ROCK抑制剂在制备预防和/或治疗放射性肺炎的药物中的用途
rock抑制剂在制备预防和/或治疗放射性肺炎的药物中的用途
技术领域
1.本发明属于生物医药技术领域,具体涉及一种rock抑制剂在制备预防和/或治疗放射性肺炎的药物中的用途。
背景技术:
2.在既往的研究中发现rho/rock通路在小鼠的肺纤维化模型中被激活,rho/rock信号通路可调控细胞增殖,与组织修复及再生功能密切相关,还可影响纤维细胞的迁移,其上下游存在有多种蛋白,最早发现的下游蛋白效应分子是rho相关蛋白激酶(rho associated kinase,简称rock),rock,其包含有两种亚型,rock1主要表达于肺、肝、肾等器官,rock2主要表达于心脏及大脑等。当受到外界刺激时,静息状态下的氨基酸结构域可发生磷酸化,介导下游发生一系列的磷酸化/脱磷酸化反应。其下游磷酸化底物包括肌球蛋白轻链(myosin light chain,mlc)、肌球蛋白轻链磷酸酶靶亚单位1(myosin phosphatase target subunit-1,mypt-1)、lim激酶(lim linase,limk)等,并通过这些底物来调控肌动蛋白的收缩力。曾有研究者分别使用单倍rock1和rock2剂量不足的小鼠,发现这部分小鼠在博来霉素的诱导下,其肺纤维化程度较野生型小鼠程度减低。
3.kd025是kadmon公司开发的口服的rock2激酶选择性抑制剂。在既往研究中kd025可通过调节rho激酶来调节纤维化相关的蛋白表达进而限制特发性肺纤维化的进展的,现在处在ⅱ阶段临床阶段。在小鼠体内实验中,用药量相对较大,且易引起小鼠的体重大幅度下降。
4.现阶段临床上用于治疗放射性肺炎的药物主要有糖皮质激素,对于放射性肺炎有一定的治疗作用。阿米福汀,氨溴索,多烯磷脂酰胆碱、己酮可可碱、aceis、异黄酮、姜黄素水杨酰单酯等在研究中均被报道具有一定的抑制放射性肺炎发展的作用,但作用较为局限,尚未在临床上推广。
技术实现要素:
5.本发明旨在至少解决现有技术中存在的技术问题之一。本发明目的在于提供rock抑制剂在制备预防和/或治疗放射性肺炎的药物中的用途。
6.本发明解决上述技术问题的技术方案为:提供了一种rock抑制剂在制备预防和/或治疗放射性肺炎的药物中的用途。
7.进一步地,所述药物抑制rock1和rock2蛋白的表达量。
8.更进一步地,所述药物减少炎性因子的表达以及炎性细胞的浸润。
9.进一步地,所述的药物抑制放射性肺炎发病阶段的炎性因子和炎症细胞聚集。
10.进一步地,所述放射性肺炎是由x射线诱导所致。
11.进一步地,所述的药物抑制放射性肺炎发病阶段的促炎因子为tnf-α、il-1β或il-10。
12.优选地,所述促炎因子为il-10。
13.进一步地,所述的药物抑制放射性肺炎发病阶段的炎性因子激活或持续激活rho/rock通路。
14.进一步地,所述rock抑制剂为非选择性rock抑制剂。
15.进一步地,所述rock抑制剂具有激酶抑制活性。
16.优选地,所述激酶为rho激酶。
17.进一步地,所述rock抑制剂对rock2和rock1均有抑制作用。
18.优选地,所述rock抑制剂对rock2有很好的抑制活性,对rock1也有一定的抑制作用。
19.进一步地,所述的rock抑制剂为wxwh0265或其盐。
20.进一步地,所述的wxwh0265是来自国际公布号:wo 2019/201297 a1中所示的化合物或其药学上可接受的盐或异构体。
21.进一步地,所述wxwh0265为苯并吡唑类化合物或其药物组合物中的至少一种。
22.其中,所述的药物是以rock抑制剂为活性成分,加入药学上接受的辅料或辅助性成分,制备而成的制剂。
23.进一步地,所述制剂为口服制剂或注射制剂。
24.进一步地,所述的口服制剂包括固体制剂、液体制剂或悬浮液制剂。
25.本发明的有益效果为:
26.通过建立体内外模型,本发明证实了rock抑制剂能够对放射性肺炎发挥显著的治疗作用,且在既往的研究中未被报道应用于放射性肺炎模型中。而且,化合物wxwh0265是一种非选择性rock抑制剂,对rock2有很好的抑制活性,对rock1也有一定的抑制作用。本发明的应用将有助于降低临床上放射治疗肺炎所带来的毒副作用,提高肺炎患者的生存质量和晚期肺炎患者的疗效,为临床上放射性肺炎的综合治疗提供了一种新的思路和策略。
附图说明
27.图1为小鼠造模后肺湿重变化:7天时小鼠肺湿重变化情况及12周时小鼠肺湿重变化情况;
28.图2为在小鼠肺组织的he,masson切片染色中的变化:
29.图3为针对小鼠肺部切片进行szapiel 7天时评分;
30.图4为针对小鼠肺部切片进行szapiel 12周时评分;
31.图5为小鼠肺部切片7天时小鼠肺部rock1表达情况及12周时小鼠肺部rock1表达情况;
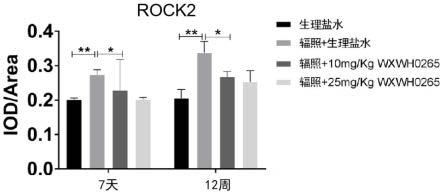
32.图6为小鼠肺部切片7天时小鼠肺部rock2表达情况及12周时小鼠肺部rock2表达情况。
具体实施方式
33.在既往的研究中证实,在放射性肺炎发病阶段,大量促炎因子如tnf-α、il-1β、il-6等大量释放,在其他肺部炎症模型中,这些炎症因子均可激活rho/rock通路启动炎症反应,rho/rock通路也可激活nf-κb促进炎症反应。这一反应可以促使nf-κb从胞质进入到胞
核中促进tnf-α、il-1β、il-6等的合成和释放。这些炎性因子可以持续激活rho/rock通路,不断的持续刺激会导致更多的炎性因子和炎症细胞的聚集。
34.而本发明通过实验证实,本发明所述的新型化合物wxwh0265通过抑制rock1和rock2蛋白的表达量,从而进一步减少炎性因子的表达以及炎性细胞的浸润,最终达到减轻肺部炎症的效果。
35.因此,本发明的创新点在于本发明中所采用的化合物为新型化合物wxwh0265,在既往的研究中未被报道应用于放射性肺炎模型中。本发明证实,造模后的小鼠肺部出现明显的炎症浸润,随造模的实验延长,小鼠的肺部组织受到持续的破坏。造模后的小鼠使用本发明所述的化合物处理后肺部炎症细胞浸润明显减少,程度明显减轻,肺部组织的破坏程度减弱,小鼠状态明显改善。
36.本实验造模过程中小鼠对x射线的耐受程度较低,部分小鼠在造模后10天左右死亡。在保证小鼠造模成功的条件下,通过调整造模的剂量改善小鼠的生存,这是本发明实验需要克服的难点。
37.下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
38.实施例
39.1.1小鼠饲养:
40.c57bl/6小鼠,8-10周龄、雄性,体重约18-22g用于模型建造,购买于北京华阜康生物科技股份有限公司或维通利华有限公司。在四川大学生物治疗国家重点实验室spf动物房饲养,5只/笼。在探索新化合物对放射治疗诱导的肺损伤治疗作用实验中,将小鼠随机分为4组:正常对照组(control)、造模组(model)和wxwh0265治疗小剂量组(low dose)(10mg/kg),wxwh0265治疗大剂量组(high dose)(25mg/kg)。每组10只观察小鼠造模前后的生存状态及基本情况,另外10只小鼠用于取材进行he染色,masson染色,免疫组化。针对小鼠采用灌胃方法,剂量为(10mg/kg,25mg/kg)每只小鼠灌胃100ml。按照小鼠体重适当调整。
41.1.2放射线诱导的肺炎模型的建立:
42.实验准备:c57bl/6小鼠,8-10周龄、雌性,体重约18-22g。1%戊巴比妥钠,无菌生理盐水,胰岛素针。
43.1、待小鼠开始适应环境后开始进行实验,将实验动物分为四组,正常对照组,造模组,给药小剂量组(10mg/kg),给药大剂量组(25mg/kg),期间观察其状态并取材进行后续实验。
44.2、术前半小时给与小鼠腹腔注射1%戊巴比妥钠(溶剂为生理盐水),50mg/kg,18g-22g小鼠每只90μl-110μl,待小鼠麻醉后,将小鼠固定,消毒。
45.3、待小鼠全麻后,将小鼠固定,用铅块遮挡其他部位,暴露胸部,使用x射线照射,距皮肤约30cm,总剂量为18gy,单次照射。
46.4、放射结束后,将小鼠放回笼中,观察其复苏情况,等待其自然苏醒。该模型共设置两个时间点,分别于第7天及第12周,将造模的当天记为第一天,2个不同时间点处死实验小鼠,取肺组织标本供实验用。具体实验结果如图1所示。
47.图1为小鼠造模后肺湿重变化,7天时小鼠肺湿重变化情况及12周时小鼠肺湿重变化情况;造模后小鼠的肺部重量增加,随着造模时间的延长,肺部重量逐渐增加,在造模7天时,各组之间肺重量及湿重无明显统计学差异,低剂量与高剂量治疗小鼠的肺湿重无明显差异,低剂量组的肺湿重略低于高剂量组,对比造模组略微减轻,但均无统计学差异(p》0.05)。
48.造模12周时,造模组肺湿重与正常对照组出现统计学差异(p《0.05),高剂量组与低剂量组之间肺湿重无明显差异,无统计学差异(p》0.05),但两组治疗组分别与造模组存在统计学差异(p《0.05)。
49.1.3组织包埋技术及切片:
50.1、取新鲜小鼠组织浸泡于4%多聚甲醛溶液中固定,48小时后将其置于包埋盒中,在流动的自来水下冲洗过夜。2、置于75%酒精中30分钟。3、置于85%酒精中30分钟4、置于95%酒精中两次,共一个小时。5、置于100%酒精中三次,共一个小时。6、取出后放置于二甲苯中两次,共一个小时。7、石蜡浸泡,两次共一个小时,浸泡结束后将包埋盒置于新蜡中进行包埋。8、包埋结束,将冷却蜡块置于冰上,完全冷却后于切片机上开始切片,先使用旧刀片对蜡块表面进行修整,然后使用新刀片对蜡块进行切片,厚度约为3-5μm。随后进行漂片,漂片时温度控制在42摄氏度,待组织展开后,选用载玻片进行摊片,将摊片温度控制在65摄氏度,待切片上的石蜡被烤干后,将切片取出进行下一步操作。
51.切片水化:1、将切片放置在切片架上于65摄氏度左右进行烘片2小时,待切片上的石蜡融化烤干后取出。2、将切片放置于二甲苯中两次,共一个小时。3、将切片转移至100%酒精中,两次,每次两分钟。4、将切片转移至95%酒精中,一次,每次两分钟。5、将切片转移至85%酒精中,一次,每次两分钟。6、将切片转移至75%酒精中,一次,每次两分钟。7、待上述步骤结束后,将切片转移至蒸馏水中漂洗,两分钟。
52.he染色:
53.1、完成水化后的切片,mayer氏苏木素染色一分钟。2、自来水中漂洗,两次,每次三分钟。3、置于75%盐酸酒精中,2分钟左右。4、自来水漂洗,一分钟。5、依红复染,一分钟左右。6、自来水漂洗,一分钟。7、85%酒精,两分钟左右。8、95%酒精,两分钟左右。9、100%酒精,两分钟左右。10、待上述步骤结束后置于二甲苯中,5-10分钟。11、中性树胶进行封片。
54.masson染色:
55.1、首先将水化完成后的切片,置于masson复合中性染色液5分钟;2、0.2%醋酸水溶液中漂洗两分钟左右;3、8%膦钨酸浸泡10分钟左右;4、0.2%醋酸水溶液中漂洗两分钟左右;5、0.2%苯胺蓝液5分钟;6、0.2%醋酸水溶液中漂洗两分钟左右,两次;7、85%酒精,两分钟左右;8、95%酒精,两分钟左右;9、100%酒精,两分钟左右;10、待上述步骤结束后置于二甲苯中,5-10分钟;11、中性树胶进行封片。
56.图2为在小鼠肺组织的he,masson切片染色中的变化:
57.1.正常对照组:肺组织正常,肺泡结构完整并且形态正常,肺泡壁纤细清晰可见无肺泡间隔增宽,未见明显的炎性细胞浸润。
58.2.射线造模组:造模7天时,肺组织结构被破坏,部分肺泡结构不完整,肺泡壁扭曲,肺泡腔内可见少量炎性渗出物,部分肺泡融合,可见肺泡间隔增宽,大量炎性细胞浸润。造模12周时,肺组织结构不完整,肺泡融合,肺泡间隔增宽,肺泡腔内大量炎性渗出物,可见
炎性细胞浸润。
59.3.治疗组:本研究中设置两个治疗组,低剂量组和高剂量组。造模7天时,两组的肺组织结构出现破坏,肺泡结构被破坏,低剂量组组织破坏较明显,高剂量组可见肺部较为完整,两组均无明显的肺泡间隔增宽,可见炎性细胞浸润,高剂量组的炎性细胞浸润区域少于低剂量组。
60.造模12周,较同时间点下造模组纤维化程度低,低剂量组的肺泡结构出现融合,肺泡间隔增宽,肺泡腔可见炎性渗出物。高剂量组可见炎性细胞浸润。
61.在masson染色中,1、正常对照组:各个时间点内,肺泡组织结构完整,其肺泡间隔可见少量蓝色纤维沉积,支气管管壁及血管也可见少量胶原纤维。2、放射线造模组:造模7天时,肺泡间隔蓝色纤维沉积明显增多,肺泡结构严重破坏。造模12周时,肺泡间隔蓝色纤维沉积明显,支气管壁周围及血管周围蓝色纤维增多,结构大量破坏。3、治疗组:造模7天时,肺泡间隔蓝色纤维增多较造模组明显减少,高剂量治疗组蓝色纤维沉积减少较造模组明显。造模12周时,两组蓝色纤维沉积无明显差异,对比造模组明显减少。
62.以上结果表明:在小鼠受到辐照后发生较为严重的放射性肺炎,使用本发明的新型化合物wxwh0265治疗后,炎症程度明显减轻,由此推测新型化合物具有良好的抵抗放射性肺炎的效果。
63.1.4szapiel评分:
64.按szapiel等的方法确定肺泡炎和纤维化的程度并各分为4级,进行病理半定量分析。szapiel方法参考szapiel sv,elson na,fulmer jd,hunninghake gw,crystal rg.bleomycin-induced interstitial pulmonary disease in the nude,athymic mouse.am rev respir dis 1979;120(4):893-899.
65.表1szapiel肺组织学评分标准
[0066][0067]
图3,图4分别针对小鼠肺部切片进行szapiel评分,图3为7天时评分,图4为12周时评分。造模后小鼠的肺部评分增加,随着造模时间的延长,肺部炎症逐渐加重,在造模7天时,造模组评分与正常对照组出现统计学差异(p《0.05),低剂量与高剂量治疗小鼠的评分无明显差异,低剂量组的评分略高于高剂量组,对比造模组略微减轻,但均无统计学差异(p》0.05)。造模12周时,高剂量组与低剂量组之间评分无明显差异(p》0.05),但高剂量组与造模组存在统计学差异(p《0.05)。
[0068]
以上结果表明:使用szapiel评分可以评估小鼠受到辐照后发生较为严重的放射性肺炎,使用本发明rock抑制剂治疗后,小鼠的肺部评分下降,炎症程度明显减轻,由此推测新型化合物具有良好的抵抗放射性肺炎的效果。
[0069]
1.5免疫组化技术:
[0070]
1、完成水化后的切片,3%的过氧化氢溶液室温避光处理15分钟。2、蒸馏水漂洗3分钟,两次。3、edta组织抗原修复液配制:a液:枸橼酸二钠-2h2o 29.41g+1000ml蒸馏水;b:枸橼酸21g+1000ml蒸馏水;工作液的配置:a液82ml与b液18ml混合后加入900ml蒸馏水。4、抗原修复方法:将切片置于工作液中,淹没切片,盖上锅盖,在高压锅内煮沸,待上汽后10分钟自然冷却。注意事项:1、不能让组织干透;2、抗原修复后均需用pbs缓冲液。5、pbs漂洗5分钟,三次。6、从切片架上取出切片,擦净切片背面水分及组织周围水分,但要保持组织湿润,滴加正常山羊血清进行封闭,约15-25分钟。7、弃去血清,擦干周围液体,保持组织湿润。按照不同抗体的说明书进行抗体稀释,使组织被稀释后的抗体充分覆盖,将切片置于湿盒中,置于四摄氏度冰箱中,孵育过夜。8、pbs漂洗5分钟,三次。9、针对一抗的种属滴加生物素化二抗,室温孵育25分钟。10、pbs漂洗5分钟,三次。11、滴加三抗(sab复合物)室温孵育15-25分钟。12、pbs漂洗5分钟,三次。13、按说明书配置dab显色液,显微镜下显色观察,适当显色后终止。14、pbs漂洗15、苏木素复染3秒钟,自来水漂洗。16、酒精梯度脱水:1、85%酒精,2分钟;2、90%酒精,2分钟;3、95%酒精,2分钟;4、100%酒精,2分钟。5、二甲苯透明,二次,20分钟。
[0071]
图5在7天,12周时正常对照组与辐照造模组相比均存在显著性差异,在辐照造模组中rock1的表达量上调(p《0.05)。在7天时,两治疗组内的蛋白对比辐照组略有下调,但是组间差异不具有统计学差异(p》0.05)。高剂量治疗组与低剂量治疗组及造模组分别存在统计学差异(p《0.05)。12周时,高剂量治疗组,低剂量治疗组分别与造模组存在显著性差异(p《0.05),但两治疗组间不存在统计学差异。
[0072]
图6造模组中rock2蛋白的含量显著上升,在7天,12周时与正常小鼠肺内的rock2含量相比均存在明显差异(p《0.05)。在7天时,高剂量治疗组内的蛋白对比辐照造模组略有下调,但是组间差异不具有统计学差异,且低剂量治疗组与造模组之间不具有统计学差异(p》0.05)。12周时,高剂量治疗组与造模组之间具有统计学差异,两治疗组间不存在统计学差异。
[0073]
以上结果表明,wxwh0265可显著减少肺部rock1,rock2的含量,进而减轻肺部的炎症细胞浸润,进一步达到减轻肺部炎症的效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1