大黄酸在制备治疗病理性心肌肥厚药物中的应用
1.本发明涉及医药技术领域,涉及大黄酸的新医药用途,特别是涉及大黄酸或者大黄酸药用盐作为唯一活性成分用于制备治疗病理性心肌肥厚药物的应用。
背景技术:
2.大黄酸(rhein)主要分布于蓼科植物掌叶大黄,它是一种有机化合物,分子式为c
15
h8o6。为咖啡色针晶,升华后为黄色针晶,其结构式如下
[0003][0004]
近年陆续有研究结果显示,大黄酸主要的药理活性包括:
[0005]
1)抗肿瘤作用:大黄酸对黑色素瘤、乳腺肿瘤、神经胶质瘤等肿瘤生长有抑制作用,主要通过抑制肿瘤葡萄糖(2
‑
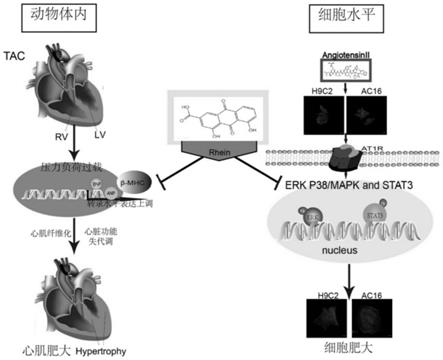
脱氧葡萄糖,3
‑
甲基葡萄糖苷)的摄入,抑制了葡萄糖的磷酸化,从而造成肿瘤细胞线粒体功能障碍,而且通过干扰肿瘤细胞dna功能抑制肿瘤增殖,并促进凋亡。
[0006]
2)抗炎作用:大黄酸能抑制大鼠巨噬细胞il
‑
2转录水平的表达,下调白三烯c4、b4、ltc4、ltb4的表达,并且可以提高巨噬细胞中camp的表达,抑制花生四烯酸代谢,影响炎症细胞因子代谢。大黄酸还可降低胰腺炎中乳酸脱氢酶,淀粉酶和nag的产生,对受损的胰腺组织保护和修复具有潜在的药用价值,在对抗细胞炎症和细胞因子分泌中具有重要意义。
[0007]
3)抗纤维化:大黄酸可以糖尿病肾病外周组织胶原和纤维基质(ecm)的分泌,减轻糖尿病肾病的肾脏损害并抑制肾脏的肥大,通过抑制tgf
‑
β1诱导的nrk
‑
49f细胞的增殖,抑制pkc信号通路的功能,下调a
‑
sma的表达,从而对抗器官纤维化。
[0008]
心肌肥厚(cardiac hypertrophy)是大多数心脏肌细胞的肥厚、心肌细胞外基质的沉积、基因表达异常及多种基因之间的相互作用等,从而导致心肌结构、表型、功能的变化,表现为心肌质量、心室容量及心室形状的改变。初期为代偿性心脏扩大或肥厚,随后由于炎症、过高的压力或容量负荷增加了心室壁的机械负荷,激活了一系列神经内分泌信号,神经内分泌细胞因子系统的长期、慢性激活促进心室重塑,加重心肌损伤和心功能恶化,后者又激活神经内分泌因子系统,形成一种恶性循环病的最终归宿,同时心肌细胞胚胎基因重新激活,编码心室细胞重塑,心肌结构异常,心功能下降,从而走向肥厚的失代偿阶段,最终发展为慢性心力衰竭。
[0009]
目前对于心肌肥厚的治疗,主要包括:1)β受体阻滞剂(β
‑
receptor blocker):普萘洛尔(propranolol),美托洛尔(metoprolol),阿替洛尔(atenolol)2)acri和arb:依那普利(enalapril),卡托普利(captopril),缬沙坦(valsartan),替米沙坦(telmisartan);3)
钙离子阻滞剂(ccb):硝苯地平(nifedipine),氨氯地平(amlodipine);4)利尿剂(diuretics):呋塞米(furosemide),氢氯噻嗪(hydrochlorothiazide);5)其他治疗:中药治疗,手术治疗以及介入治疗等,但效果有限,仍需进一步发现新的治疗措施,寻找更具靶向性的新的中药制剂及中西药物联用策略。
技术实现要素:
[0010]
本发明的目的是提供大黄酸或者大黄酸药用盐作为唯一活性成分用于制备治疗病理性心肌肥厚药物的应用。
[0011]
为实现上述目的,本发明提供了如下方案:具体而言,本发明涉及大黄酸(rhein),分子式为c
15
h8o6。经试验证实,大黄酸可治疗主动脉缩窄术(tac)诱导的小鼠心肌肥厚以及治疗angii诱导的大鼠心室肌(h9c2)细胞和人源心肌细胞(ac16)肥厚和炎症。
[0012]
其作用机理参见图1,大黄酸在体能有效抑制主动脉缩窄术(tac)诱导的心肌肥厚,体外能明显有效治疗(angiotensin ii)诱导的心肌细胞肥大,并能显著减轻心脏纤维化,抑制心脏功能失代偿,抑制stat3/p38 mapk下游关键转录因子并减少anp、bnp、β
‑
mhc的表达。从图1可以看到,大黄酸能够治疗心肌肥厚,具有心脏保护的作用。
[0013]
本发明提供的具体方案包括:大黄酸在制备治疗病理性心肌肥厚药物中的应用。
[0014]
进一步的,所述大黄酸在体外的有效浓度为≤120μm优选为120μm,在体内的有效浓度为≤200mg/kg,优选为200mg/kg。
[0015]
进一步的,所述心肌肥厚指tac诱导的心肌肥厚。
[0016]
进一步的,所述心肌肥厚指血管紧张素ii诱导的心肌细胞h9c2和ac16的肥大。
[0017]
进一步的,所述治疗病理性心肌肥厚药物含有大黄酸和/或大黄酸药用盐。
[0018]
进一步的,所述治疗病理性心肌肥厚药物为分散剂、胶囊剂、丸剂、栓剂、片剂、口服液、颗粒剂、酊剂或注射液中任意一种。
[0019]
进一步的,所述治疗病理性心肌肥厚药物含有一种或多种药学上可接受的载体或辅料。
[0020]
进一步的,所述的辅料为缓释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂或润滑剂中的至少一种。
[0021]
以上目的通过如下实验加以验证:
[0022]
1、动物实验:本发明以c57/bl6小鼠为研究对象,利用主动脉缩窄术(tac)建立心肌肥厚模型,总历时28天,在建模第1天开始用药物治疗。大黄酸的使用剂量为50mg/kg、150mg/kg和200mg/kg,以灌胃的方式给药,每天一次,连续治疗28天。另外,利用替米沙坦(telmisartan,telmi)作为大黄酸的阳性对照。于第28天结束实验,超声检测心功能和心脏解剖指数,结果显示,大黄酸能保护心脏功能,恢复由主动脉缩窄术诱导引起的射血分数缩短分数下降,减轻室间隔厚度,抑制心肌肥厚发生;处死小鼠检测相关指标。首先检测心肌肥厚的重要指标:心身比(hw/bw)、心胫骨长比(hw/tl)发现大黄酸可减弱tac诱导的心肌肥厚程度,(参见图1
‑
5)。进一步病理学检测发现,大黄酸可减弱tac手术诱发的心肌细胞分泌anp、bnp、col3a1、col1a1,抑制心肌细胞肥大,心肌组织排列紊乱和基质纤维化的程度(参见图6
‑
10)。接着,本发明人发现具体作用机制与stat3/p
‑
38mapk信号通路相关,并且大黄酸可靶向p
‑
erk入核,减弱anp,bnp,β
‑
mhc的表达(参见图11
‑
12)。
[0023]
2、体外细胞学实验:以大鼠心肌细胞h9c2和人心肌细胞ac16为研究对象,利用大黄酸预处理24小时,再加入angii诱导h9c2细胞产生炎症和肥厚,24小时后收样,检测心肌细胞大小、肥厚指标、stat3/p
‑
38mapk信号通路和炎症因子的表达变化。另外,检测不同浓度大黄酸对h9c2和ac16细胞活性的影响。结果发现,大黄酸可抑制angii诱导的心肌细胞炎症和肥大,且对h9c2和ac16细胞的增殖仅有较小影响(参见图13
‑
18)。
[0024]
本发明通过体外及体内实验证实大黄酸对正常细胞和小鼠没有明显毒副作用,在体能有效抑制主动脉缩窄术(tac)诱导的心肌肥厚,体外能明显有效治疗(angiotensin ii)诱导的心肌细胞肥厚,并能显著减轻心脏纤维化,抑制mapk下游关键转录因子。大黄酸能够治疗心肌肥厚,具有心脏保护的作用,安全有效,优于传统的治疗药物,从而扩宽了其应用范围,也为治疗病理性心肌肥厚以及心衰提供了新途径。
[0025]
本发明的有益技术效果包括:
[0026]
(1)大黄酸可有效治疗tac和angii诱导的小鼠心肌肥厚,具体机制与stat3/p
‑
38mapk信号通路相关。
[0027]
(2)大黄酸对h9c2和ac16细胞低毒性,且能减弱angii诱导的心肌细胞炎症、纤维化和肥厚,抑制促炎因子的表达。
[0028]
(3)大黄酸具备治疗心肌肥厚的作用,安全有效,优于传统的治疗药物,从而扩宽了其应用范围,也为治疗心肌肥厚提供了新途径。
附图说明
[0029]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0030]
为例方便表述,实施例中采用缩写代表各实验组,其中,假手术组缩写为sham、模型组缩写为tac、大黄酸低浓度组缩写为tac+rhein(50mg/kg)、大黄酸中浓度组缩写为tac+rhein(150mg/kg)、大黄酸高浓度组缩写为tac+rhein(200mg/kg),替米沙坦阳性对照组缩写为tac+tel(10mg/kg)。
[0031]
图1为本发明的原理示意图。
[0032]
图2为心脏超声和解剖学常数显示图,其中,假手术组、tac诱导小鼠心肌肥厚组及大黄酸梯度(50、150、200mg/kg)治疗组和替米沙坦阳性对照组各指标变化,ivsd:心脏舒张期室间隔厚度,lvidd:左心室舒张期内部直径,lvpwd:左心室舒张期后壁厚度、ivss:收缩期室间隔厚度,lvids:左心室收缩的内部直径,lvpws:左心室收缩后壁厚度、lvmass/bw:左心室质量/体重,ef:射血分数,fs:缩短分数(n=6,
*
p<0.05,
***
p<0.001,
****
p<0.0001,
#
p<0.05,
###
p<0.001,
####
p<0.0001)。
[0033]
图3为假手术组,tac诱导心肌肥厚组,大黄酸剂量梯度组和阳性对照组心室横轴超声(28天)结果图。
[0034]
图4为假手术组,tac诱导心肌肥厚组,大黄酸剂量梯度组和阳性对照组28天后心脏大小比较图。
[0035]
图5为假手术组,tac诱导心肌肥厚组,大黄酸剂量梯度组和阳性对照组28天后心
脏体重之比图(n=6,
*
p<0.05,
***
p<0.001,
****
p<0.0001,
#
p<0.05,
###
p<0.001,
####
p<0.0001)。
[0036]
图6为假手术组,tac诱导心肌肥厚组,大黄酸剂量梯度组和阳性对照组28天后心脏胫骨长之比图(n=6,
*
p<0.05,
***
p<0.001,
****
p<0.0001,
#
p<0.05,
###
p<0.001,
####
p<0.0001)。
[0037]
图7为he检测大黄酸对心肌肥厚心肌细胞大小的影响图,包括假手术组sham、模型组tac、大黄酸低浓度组tac+rhein(50mg/kg)、大黄酸中浓度组tac+rhein(150mg/kg)、大黄酸高浓度组tac+rhein(200mg/kg)和替米沙坦阳性对照组tac+tel(10mg/kg))。
[0038]
图8为wga检测大黄酸对心肌肥厚心肌细胞大小的影响图,包括假手术组sham、模型组tac、大黄酸低浓度组tac+rhein(50mg/kg)、大黄酸中浓度组tac+rhein(150mg/kg)、大黄酸高浓度组tac+rhein(200mg/kg)和替米沙坦阳性对照组tac+tel(10mg/kg))。
[0039]
图9(a)为masson检测大黄酸对心肌肥厚纤维化程度的治疗效果图,包括假手术组sham、模型组tac、大黄酸低浓度组tac+rhein(50mg/kg)、大黄酸中浓度组tac+rhein(150mg/kg)、大黄酸高浓度组tac+rhein(200mg/kg)和替米沙坦阳性对照组tac+tel(10mg/kg)。
[0040]
图9(b)为心肌细胞平均表面积统计结果图。
[0041]
图9(c)为纤维化面积统计结果图,根据wga和masson染色结果,对大黄酸抑制心肌细胞肥大和纤维化的组织学评分统计结果(n=6,
*
p<0.05,
***
p<0.001,
****
p<0.0001,
#
p<0.05,
###
p<0.001,
####
p<0.0001)。
[0042]
图10为wb检测大黄酸可抑制心肌肥厚anp、bnp、β
‑
mhc、col1a1、col3a1蛋白的表达图,包括:假手术组sham、模型组tac、大黄酸低浓度组tac+rhein(50mg/kg)、大黄酸中浓度组tac+rhein(150mg/kg)、大黄酸高浓度组tac+rhein(200mg/kg)和替米沙坦阳性对照组tac+tel(10mg/kg)。
[0043]
图11(a)为检测大黄酸治疗对小鼠心肌组织anp的影响图;
[0044]
图11(b)为检测大黄酸治疗对小鼠心肌组织bnp的影响图;
[0045]
图11(c)为检测大黄酸治疗对小鼠心肌组织β
‑
mhc的影响图;
[0046]
图11(d)为检测大黄酸治疗对小鼠心肌组织col1a1的影响图;
[0047]
图11(e)为检测大黄酸治疗对小鼠心肌组织col3a1的影响图;
[0048]
图11(f)为检测大黄酸治疗对小鼠心肌组织炎症因子il
‑
1βmrna水平的影响图;
[0049]
其中,对照组(sham,n=6)、模型组(tac,n=6)、大黄酸低浓度组tac+rhein(50mg/kg,n=6)、大黄酸中浓度组tac+rhein(150mg/kg,n=6)、大黄酸高浓度组tac+rhein(200mg/kg,n=6)和替米沙坦阳性对照组tac+tel(10mg/kg,n=6)。
[0050]
图12为大黄酸对炎症信号通路stat3/p
‑
38mapk的关键蛋白p
‑
stat3和p
‑
erk等蛋白表达的调控图。
[0051]
图13(a)为p
‑
jnk/jnk的灰度比较;
[0052]
图13(b)为p
‑
erk/erk的灰度比较;
[0053]
图13(c)为p
‑
stat3/stat3的灰度比较;
[0054]
图13(a)
‑
13(c)通过灰度分析检测stat3/p
‑
38mapk通路关键蛋白的差异,包括对照组(sham,n=3)、模型组(tac,n=3)、大黄酸低浓度组tac+rhein(50mg/kg,n=3)、大黄酸
中浓度组tac+rhein(150mg/kg,n=3)、大黄酸高浓度组tac+rhein(200mg/kg,n=3)和替米沙坦阳性对照组tac+tel(10mg/kg,n=3)。
[0055]
图14(a)为大黄酸对angii诱导的h9c2细胞产生肥厚标志anp、bnp、β
‑
mhc、col1a1的影响图;
[0056]
图14(b)为大黄酸对angii诱导的ac16细胞产生肥厚标志anp、bnp、β
‑
mhc、col1a1的影响图;
[0057]
图14(a)
‑
图14(b)中各代号的含义分别如下:col1a为胶原带白1a,anp为心房钠尿肽、bnp为脑钠尿肽、β
‑
mhc为重链肌球蛋白。
[0058]
图15(a)为大黄酸对angii诱导的h9c2细胞关键的通路蛋白p
‑
erk和p
‑
stat3等蛋白表达水平的调控图;
[0059]
图15(b)为大黄酸对angii诱导的ac16细胞关键的通路蛋白p
‑
erk和p
‑
stat3等蛋白表达水平的调控图;
[0060]
图15(a)
‑
图15(b)中各代号的含义分别如下:p
‑
erk/erk表示erk的磷酸化程度,p
‑
stat3/stat3表示stat的磷酸化程度,p
‑
p38/p38表示p38的磷酸化程度,p
‑
jnk/jnk表示jnk的磷酸化程度。
[0061]
图16(a)为stat3的磷酸化程度图;
[0062]
图16(b)为p38的磷酸化程度图;
[0063]
图16(c)为jnk的磷酸化程度图;
[0064]
图16(d)为erk的磷酸化程度图;
[0065]
图16(a)
‑
图16(d)通过灰度分析检测大黄酸对angii诱导的h9c2细胞关键的通路蛋白p
‑
erk和p
‑
stat3等蛋白关键蛋白的差异。
[0066]
图17(a)为mtt检测不同浓度(0、1μm、10μm、50μm、125μm、250μm、500μm、1000μm)的大黄酸对ac16细胞的增殖活性的影响图;
[0067]
图17(b)为mtt检测不同浓度(0、1μm、10μm、50μm、125μm、250μm、500μm、1000μm)的大黄酸对h9c2细胞的增殖活性的影响图;
[0068]
图17(a)
‑
图17(b)通过mtt检测不同浓度(0、1μm、10μm、50μm、125μm、250μm、500μm、1000μm)的大黄酸对h9c2和ac16细胞的增殖活性的影响。
[0069]
图18(a)为细胞免疫荧光结果,通过a
‑
actin染细胞骨架,p
‑
erk特异性抗体进行标记,dapi染核来检测大黄酸对angii诱导的h9c2细胞肥厚的影响;
[0070]
图18(b)为核内p
‑
erk的荧光强度图;
[0071]
图18(c)为h9c2染色的细胞表面积比示意图;
[0072]
图18(a)
‑
图18(c)通过免疫荧光(a
‑
actin染细胞骨架,p
‑
erk特异性抗体进行标记,dapi染核)检测大黄酸对angii诱导的h9c2细胞肥厚的影响,并用image proplus分析免疫荧光心肌细胞大小和p
‑
erk入核程度。
[0073]
图19(a)为核质分离实验检测大黄酸对p
‑
erk在细胞核和细胞质分布的影响图;
[0074]
图19(b)为细胞核内p
‑
erk/erk,表示大黄酸对细胞核内erk磷酸化程度的影响图;
[0075]
图19(c)为细胞质内p
‑
erk/erk,表示大黄酸对细胞质内erk磷酸化程度的影响图;
[0076]
图19(a)
‑
图19(c)通过核质分离实验检测大黄酸对p
‑
erk入核的影响,并用灰度分析检测p
‑
erk在细胞质和细胞核中的富集程度。
[0077]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0078]
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图和具体实施方式对本发明作进一步详细的说明。
[0079]
实施例1动物实验
[0080]
1、主要实验材料:实验动物,c57/bl6小鼠(6
‑
8周,雄性,体重18
‑
20g),购自上海斯莱克实验动物有限公司,spf级,饲养于厦门大学实验动物中心。血管紧张素ii及替米沙坦购自美国sigma公司。实验所需试剂及试剂盒和手术器械购于cell signaling公司和南京建成生物工程研究所等。
[0081]
2、实验方法:
[0082]
(1)小鼠心肌肥厚模型建立36只小鼠随机分配为6组(n=6):假手术组、tac模型组、低剂量rhein组(rhein,50mg/kg/d)、中剂量rhein组(rhein,150mg/kg/d)、高剂量rhein组(rhein,200mg/kg/d)和阳性对照组tel组(10mg/kg/d)。方法简述如下,rhein以相应浓度溶于生理盐水,灌胃方式给药,每天灌胃共28天,第28天处死小鼠,且处死前一天检测心脏超声结果。
[0083]
(2)心肌肥厚病情评估:处死小鼠后,解剖取出心脏,记录心脏重量及外观变化;取两心耳上边缘连线于心室肌平行线切下左心室组织,4%多聚甲醛固定,脱水包埋切片后,进行he染色、wga染色和masson染色,观察心脏病理学变化、肥大和纤维化程度。
[0084]
(3)心肌组织匀浆处理后qrt
‑
pcr及wb检测取0.05g组织样本,加入ripa裂解液300μl后匀浆机研磨,提取蛋白样本检测anp、bnp、β
‑
mhc、col1a1、col3a1、p
‑
erk、p
‑
p38、p
‑
jnk和p
‑
stat3。取0.02g组织样本,加入trizol rna裂解液1ml,提取mrna样本,检测anp、bnp、β
‑
mhc、col1a1、col3a1、炎症因子il
‑
1β等。
[0085]
(4)用graphpad prism 8.01进行unpairedt
‑
test以及one way anova检验。*p<0.05,表示具有显著统计学意;**p<0.01,***p<0.001,****p<0.0001,
##
p<0.01,
###
p<0.001,
####
p<0.0001)。
[0086]
表示具有高度显著意义。
[0087]
3、实验结果:
[0088]
(1)大黄酸对tac诱导的小鼠心肌肥厚的肥厚程度和纤维化指标的影响,包括:心身比、心胫骨长比、超声心功能等。如图4所示,tac诱导的心肌肥厚模型成功,而且大黄酸可明显减轻心肌肥厚导致的心功能下降、心肌组织排列紊乱等不良结果,且高浓度组治疗效果优于低浓度组,与阳性对照组替米沙坦的作用效果相当。另外,大黄酸可明显增强由tac诱导的小鼠心肌肥厚的心脏功能,射血分数(ef)和缩短分数(fs)都有明显改善(如图2所示)。同时,大黄酸的治疗效果还体现在心身比、心胫骨长比中,如图5
‑
图6所示,大黄酸治疗可抑制tac导致心肌质量增加,与以上结果一致,高浓度组的疗效明显优于低浓度组(n=6,
*
p<0.05,
***
p<0.001,
****
p<0.0001,
#
p<0.05,
###
p<0.001,
####
p<0.0001)。
[0089]
(2)大黄酸对心肌肥厚病理指标的影响:镜下可见,模型组的心肌细胞形态不规则,排列紊乱,心肌细胞明显肥大,细胞内基质增多,细胞外大量纤维和胶原沉积,结构异常
(如图7、图8、图9(a)
‑
图9(c)所示)。根据心肌细胞结构的改变程度、肥大程度、细胞外基质纤维化程度,大黄酸治疗的组织分析可以看出;高浓度组优于低浓度组(n=3,*p<0.05,**p<0.01,***p<0.001,
#
p<0.05,
###
p<0.001,
####
p<0.0001)。
[0090]
(3)大黄酸可以下调心肌肥厚指标蛋白如anp、bnp、β
‑
mhc、col1a1、col3a1,参见图10,且对炎症通路stat3/p
‑
38mapk的关键蛋白p
‑
erk和p
‑
stat3等蛋白表达的调控。
[0091]
大黄酸可以下调心肌肥厚标志物如anp、bnp、β
‑
mhc、col1a1、col3a1的rna水平,以及炎症因子il
‑
1β的mrna水平,参见图11(a)
‑
图11(f)。
[0092]
参见图12、图13(a)
‑
图13(c),wb检测结果证明,与模型组相比,大黄酸干预后可抑制p
‑
erk和p
‑
stat3等因子的表达(*p<0.05,***p<0.001,
#
p<0.05,
###
p<0.001)。
[0093]
实施例2体外细胞实验
[0094]
1、主要实验材料:h9c2和ac16细胞,购自上海细胞库,高糖dmem培养基购于上海元培生物科技股份有限公司,其他试剂购自上海翊圣生物科技有限公司和美国sigma公司。
[0095]
2、实验方法
[0096]
(1)细胞活性检测:将h9c2和ac16细胞,以0.5x104个/孔,种植于96孔板,待细胞贴壁后,开始加药处理,大黄酸浓度梯度为0、1μm、10μm、50μm、125μm、250μm、500μm、1000μm,24小时后,每孔加mtt溶液(5mg/ml用pbs配)20μl。继续孵育4小时,终止培养,小心吸弃孔内培养上清液,对于悬浮细胞需要离心后再吸弃孔内培养上清液。每孔加150μl dmso,振荡10分钟,使结晶物充分融解。选择490nm波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果。
[0097]
(2)细胞总rna提取及real time pcr检测:将h9c2大鼠心肌细胞,以3x105个/孔,接种于6孔板,待细胞贴壁后,加rhein(30μm、60μm、120μm)预处理24小时,24小时后加入angii(0.8μm)处理24小时后,收样,利用翊圣rna快速提取试剂盒,提取对照组,angii组,加药组总rna,反转后,real time pcr检测肥大因子anp、bnp、β
‑
mhc。
[0098]
3、实验结果:
[0099]
(1)大黄酸干预对angii诱导h9c2和ac16细胞的肥大有明显抑制作用,心肌肥大标志分子anp、bnp、β
‑
mhc和纤维化因子col1a1有明显下降。如图14(a)
‑
图14(b)所示。
[0100]
(2)大黄酸干预对angii诱导的h9c2和ac16细胞心肌肥厚模型的stat3/p
‑
38mapk信号通路的影响。如图15(a)
‑
15(b)所示,在h9c2细胞中,与动物模型一致,大黄酸可以通过降低p
‑
erk和p
‑
stat3等蛋白表达的调控,从而抑制stat3/p
‑
38mapk信号通路起到保护心肌肥大的作用。
[0101]
(3)大黄酸干预对angii诱导的心肌肥厚模型的stat3/p
‑
38mapk信号通路的影响,灰度分析表明大黄酸对stat,jnk,p38,erk的磷酸化有明显抑制作用,呈现剂量依赖性,如图16(a)
‑
图16(d)所示。
[0102]
(4)大黄酸干预对h9c2和ac16细胞增殖活性的调控。如图17(a)
‑
图17(b)所示,以h9c2和ac16细胞为研究对象,以不同浓度(0、1μm、10μm、50μm、125μm、250μm、500μm、1000μm)的大黄酸处理24小时后,mtt检测发现大黄酸0、30μm、60μm、120μm在处理对细胞的增殖活性仅有轻微的影响。
[0103]
从图18(a)
‑
图18(c)可以看出,rhein可以抑制h9c2细胞肥大,并且可以减少p
‑
erk的核内富集程度。
[0104]
从图19(a)
‑
图19(c)可以看出,rhein可以同时减少细胞核和细胞质内erk的磷酸化程度。
[0105]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1