miR-574-3p抑制剂的应用的制作方法
mir
‑
574
‑
3p抑制剂的应用
技术领域
1.本发明涉及mirna领域,尤其是涉及一种mir
‑
574
‑
3p抑制剂的应用。
背景技术:
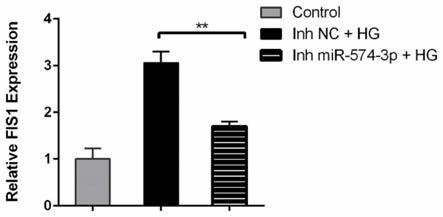
2.糖尿病是我国严重的慢性疾病,血管并发症是其致死致残的因素。通常而言,糖尿病引起的高血糖会促进血管内皮细胞活性氧(ros)的释放,破坏敏感的细胞成分,导致细胞过早死亡,并减少一氧化氮(no)的可用性,从而最终引起血管内皮功能障碍。高糖引起的ros有多种来源,其中线粒体呼吸活动产生的ros对内皮功能障碍是关键因素。因此,抑制线粒体来源的ros对于保护血管内皮层正常功能至关重要。
3.线粒体动力学,包括线粒体融合和分裂,是线粒体稳态的重要调控机制,与细胞ros密切相关,其失衡已被证实会促进糖尿病血管内皮功能障碍。线粒体融合主要涉及mfn
‑
1、mfn
‑
2和opa
‑
1蛋白,而线粒体分裂相关蛋白主要包括drp1、fis1和mff。线粒体融合能够维持遗传物质,而线粒体分裂则能去除受损的线粒体。线粒体融合和分裂是两个对立而又统一的调控过程,但过度的线粒体分裂会导致电子传递链受损,线粒体碎片化,引发细胞内线粒体ros增加。
4.mirna是一类含有20
‑
25个核苷酸的非编码单链rna分子,可通过转录后水平抑制或干扰mrna来调节基因的表达。mirna通过对基因表达的调节作用参与到许多细胞生物学功能与人类疾病的发生发展。一系列的研究表明mirna在调控线粒体动力学方面发挥重要的作用。
5.mirna通过转录后水平调节基因的表达,参与细胞的生物学过程以及疾病的发生发展。目前,已有关于mirna调节线粒体动力学的报道,如wang等报道了mir
‑
484可以抑制线粒体分裂蛋白fis1的翻译,并抑制细胞中fis1介导的分裂和凋亡,lee等发现mir
‑
200a
‑
3p是一种通过靶向线粒体分裂因子mff的新的线粒体动力学调节因子,通过mir
‑
200a
‑
3p可以下调mff的表达,正向调节线粒体的延伸,joshi等发现mfn1是mir
‑
140的直接靶标,guan等报道了mfn2受mir
‑
106a的调节,而zhang等发现mir
‑
21
‑
5p/203a
‑
3p能够通过下调drp1而促进内皮细胞的衰老。这些研究揭示了不同mirna对细胞线粒体动力学相关基因(fis1、mfn1和mff等)表达的影响。
6.但是目前尚未有与糖尿病治疗相关的mirna抑制剂的相关技术方案和报道。
技术实现要素:
7.基于此,有必要提供一种可用于糖尿病治疗的mir
‑
574
‑
3p抑制剂。
8.一种mir
‑
574
‑
3p抑制剂,在制备糖尿病治疗药物或治疗设备领域的应用。
9.结合实施例部分的数据,在高糖状态下,qpcr检测提示huvec中mir
‑
574
‑
3p的表达显著性地高于对照组,并且在高糖状态下加入mir
‑
574
‑
3p抑制剂后,huvec的fis1基因表达显著性降低,从而说明mir
‑
574
‑
3p抑制剂可以用于糖尿病治疗。
附图说明
10.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
11.其中:
12.图1为实施例1中高糖与正常状态下huvec中mir
‑
574
‑
3p的表达对比图。
13.图2为实施例2中抑制mir
‑
574
‑
3p后huvec的细胞线粒体形态相关基因表达变化图。
14.图3为实施例3中抑制mir
‑
574
‑
3p后huvec细胞的荧光对比照片。
15.图4为实施例3中抑制mir
‑
574
‑
3p后huvec细胞线粒体ros水平变化图。
具体实施方式
16.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
17.本发明公开了一实施方式的mir
‑
574
‑
3p抑制剂,在制备糖尿病治疗药物或治疗设备领域的应用。
18.本发明通过对已知公共数据库转录组学数据进行查阅,运用生物信息学分析方法筛选表达具有显著差异的mirna,并通过生物学平台预测mirna的靶基因。
19.目前国际上最大两个的公共数据库为:1)美国nih的ncbi/geo和2)欧洲的arrayexpress。
20.这两个数据库分别收集几乎世界上所有的公开发表文章以及部分未发文章的rnas(mrna,mirna,lncrna等)表达数据。
21.糖尿病内皮细胞功能障碍以及糖尿病和正常的样本对比全部mirna表达数据在geo中的序列号码是gse74296、gse21321、gse74296和gse74296。
22.具体筛选到的mirna为mir
‑
574
‑
3p。
23.通过生物信息学平台mirecords来预测mir
‑
574
‑
3p的靶基因和mirtarbase的数据库来检验是否mirna的靶基因,对这mir
‑
574
‑
3p的靶基因和靶基因显著富集的生物学功能gene ontology(go)生物学过程和kegg代谢pathway,结果显示mir
‑
574
‑
3p调控或影响的基因与线粒体动力学密切相关。
24.具体来说,mir
‑
574
‑
3p能够同时靶向线粒体动力学分裂和融合两个方向的基因(fis1和mfn1),这表明mir
‑
574
‑
3p可能调节分裂和融合双向过程。mir
‑
574
‑
3p可能参与调控与高糖环境内皮层功能障碍有关的生物学过程。
25.结合实施例1的数据,在高糖状态下,qpcr检测提示huvec中mir
‑
574
‑
3p的表达显著性地高于对照组。
26.结合实施例2的数据,在高糖状态下加入mir
‑
574
‑
3p抑制剂后,huvec的fis1基因表达显著性降低。
27.综上所述,可以说明mir
‑
574
‑
3p抑制剂可以用于糖尿病治疗。
28.具体来说,mir
‑
574
‑
3p抑制剂为与mir
‑
574
‑
3p基因互补的mirna。
29.优选的,mir
‑
574
‑
3p抑制剂的序列如seq id no:1所示。
30.结合实施例3的数据,在高糖状态下,mitosox染色后显示huvec细胞线粒体来源的ros显著性增高,提示细胞氧化应激增强,在加入mir
‑
574
‑
3p抑制剂后,huvec的ros水平显著性降低,说明mir
‑
574
‑
3p抑制剂用于改善内皮细胞的氧化应激状态和功能障碍。
31.以下为具体实施例。
32.其中,人脐静脉内皮细胞(huvec)采购自北纳生物(bncc),编号:347734。
33.实施例1
34.高糖与正常状态下人脐静脉内皮细胞(huvec)中mir
‑
574
‑
3p的表达
35.1.细胞培养:解冻人脐静脉内皮细胞(huvec),分别用高糖dmem培养基(30mm葡萄糖、dmem基础培养基、10%胎牛血清)和低糖dmem培养基(5.5mm葡萄糖、dmem基础培养基、10%胎牛血清)培养细胞,48小时后,用trypsin edta(0.05%)消化3分钟后,用含10%胎牛血清的完全培养基中和回收至离心管,1000转3分钟后,进行rna提取。
36.2.rna提取和逆转录:在无核糖核酸酶条件下,根据标准trizol实验方案(life technologies),用trizol试剂消化离心沉淀的huvec细胞团块。之后使用rneasy试剂盒(qiagen,74104)提取各组huvec的总rna。通过光密度(od)(分光光度计nd
‑
100,nanodrop technologies)以及凝胶电泳(1%(w/v)琼脂糖)评估提取的rna的质量。能用于进一步分析的合格的rna应符合以下od值标准:od260/280比率>1.8和od260/230比率<2.0。通过去除基因组dna进一步纯化分离的rna,并使用带有基因组dna去除剂的primescript
tm
rt试剂盒(实时定量)(takara,japan)进行逆转录。
37.3.qpcr:根据标准方案使用steponeplustm实时pcr系统(appliedbiosystems,foster city,ca,usa)和premixex
‑
taqtm ii试剂盒(takara,japan)进行pct扩增,扩增条件如下:95℃下30秒,然后95℃下15秒40次循环,进行变性,并在60℃(34秒)的温度下进行延伸,在72℃(30秒)下采集数据。每个rna样本和内部对照(β
‑
actin)进行三次pcr反应,得到图1。
38.其中,靶基因的相对表达水平通过2
‑
δδct方法标准化为内源性参照物β
‑
actin的相对表达水平。
39.其中,mir
‑
574
‑
3p的正向引物序列如seq id no:2所示,mir
‑
574
‑
3p的反向引物序列如seq id no:3所示,β
‑
actin的正向引物序列如seq id no:4所示,β
‑
actin的反向引物序列如seq id no:5所示。
40.由图1可以看出,在高糖(hg)状态下(30mm葡萄糖),qpcr检测提示huvec中mir
‑
574
‑
3p的表达显著性地高于对照组(control,5.5mm葡萄糖)(p<0.01),验证了此前生物信息学分析的预测。
41.实施例2
42.抑制mir
‑
574
‑
3p后huvec的细胞线粒体形态相关基因表达变化
43.1.细胞培养:解冻人脐静脉内皮细胞(huvec),分别用如下配方培养细胞48小时:(1)对照组:低糖dmem培养基(5.5mm葡萄糖、dmem基础培养基、10%胎牛血清);(2)高糖组:高糖dmem培养基(30mm葡萄糖、dmem基础培养基、10%胎牛血清)和mir抑制剂阴性对照;(3)
实验组:高糖dmem培养基(30mm葡萄糖、dmem基础培养基、10%胎牛血清)和mir
‑
574
‑
3p抑制剂。根据操作手册,用lipofectamine3000分别和mirna抑制剂和阴性对照混合后加入各自组别的细胞,转染huvec细胞48小时后,弃上清液,用trypsin
‑
edta(0.05%)消化3分钟,之后用含10%胎牛血清的完全培养基中和回收至离心管,1000转3分钟后,进行rna提取。
44.其中,mir
‑
574
‑
3p抑制剂的序列如seq id no:1所示,阴性对照的序列如seq id no:6所示。
45.2.rna提取和逆转录:在无核糖核酸酶条件下,根据标准trizol实验方案(life technologies),用trizol试剂消化离心沉淀的huvec细胞团块。之后使用rneasy试剂盒(qiagen,74104)提取各组huvec的总rna。通过光密度(od)(分光光度计nd
‑
100,nanodrop technologies)以及凝胶电泳(1%(w/v)琼脂糖)评估提取的rna的质量。能用于进一步分析的合格的rna应符合以下od值标准:od260/280比率>1.8和od260/230比率<2.0。通过去除基因组dna进一步纯化分离的rna,并使用带有基因组dna去除剂的primescript
tm
rt试剂盒(完美实时)(takara,japan)进行逆转录。
46.3.qpcr:根据标准方案使用steponeplustm实时pcr系统(appliedbiosystems,foster city,ca,usa)和premix ex
‑
taqtm ii试剂盒(takara,japan)进行pct扩增,扩增条件如下:95℃下30秒,然后95℃下15秒40次循环,进行变性,并在60℃(34秒)的温度下进行延伸,在72℃(30秒)下采集数据。每个rna样本和内部对照(β
‑
actin)进行三次pcr反应,得到图2。
47.其中,靶基因的相对表达水平通过2
‑
δδct方法标准化为内源性参照物β
‑
actin的相对表达水平。
48.其中,fis1的正向引物的序列如seq id no:7所示,fis1的反向引物序列如seq id no:8所示,β
‑
actin的正向引物序列如seq id no:4所示,β
‑
actin的反向引物序列如seq id no:5所示。
49.由图2可以看出,在高糖(inh nc+hg)状态下(30mm葡萄糖),qpcr检测提示huvec细胞线粒体分裂蛋白fis1的基因表达显著性增高,在加入mir
‑
574
‑
3p抑制剂后(inh mir
‑
574
‑
3p),huvec的fis1基因表达显著性降低(p<0.01)。
50.实施例3
51.抑制mir
‑
574
‑
3p后huvec细胞线粒体ros水平变化
52.1.细胞爬片和培养:在24孔板内预先放入玻片,解冻人脐静脉内皮细胞(huvec),将细胞铺于24孔板内的玻片上,分别用如下配方培养细胞48小时:(1)对照组:低糖dmem培养基(5.5mm葡萄糖、dmem基础培养基、10%胎牛血清);(2)高糖组:高糖dmem培养基(30mm葡萄糖、dmem基础培养基、10%胎牛血清)和mir抑制剂阴性对照;(3)实验组:高糖dmem培养基(30mm葡萄糖、dmem基础培养基、10%胎牛血清)和mir
‑
574
‑
3p抑制剂。根据操作手册,用lipofectamine3000分别和mirna抑制剂和阴性对照混合后加入各自组别的细胞,转染huvec细胞48小时后,弃上清液,进行染色。
53.其中,mir
‑
574
‑
3p抑制剂的序列如seq id no:1所示,阴性对照的序列如seq id no:6所示。
54.2.mitosox细胞染色:线粒体ros的生成情况用mitosox red探针(5mm,4000x,cat no.:m36008,thermofisher)进行染色进行测定,取mitosox red12.5ul,用pbs溶液配置成
50ml混合液体,使其终浓度为1.25μm。在种上细胞之前,至少提前4小时在24孔板的盖玻片上包被层粘连蛋白。细胞高低糖处理后,丢弃完全培养基,用pbs清洗细胞。接下来,将huvec与mitosox red溶液在37℃下避光孵育15分钟。培养结束后,丢弃溶液,并在37℃下用完整培养基再孵育20分钟。用温pbs轻轻洗涤细胞两次,每次持续5分钟,然后用4%多聚甲醛(4%pfa,cat no.:199431lt,usb)孵育10分钟。固定后,在pbs中轻轻清洗细胞,然后封片以进行显微镜观察,得到图3,并且由图3得到图4。
55.其中,为了评估ros的信号强度,在线粒体内验证了ros,以对照组为基准,并通过高塘组和实验组与其的倍数变化计算其相对荧光强度。同样,取每组30个细胞计算平均强度值。
56.由图3和图4可以看出,在高糖(inh nc+hg)状态下(30mm葡萄糖),mitosox染色后显示huvec细胞线粒体来源的ros显著性增高,提示细胞氧化应激增强,在加入mir
‑
574
‑
3p抑制剂后(inh mir
‑
574
‑
3p),huvec的ros水平显著性降低(p<0.05),提示抑制mir
‑
574
‑
3p的表达有助于改善内皮细胞的氧化应激状态和功能障碍。
57.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对申请专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1