一种抗长航疲劳的中药组合物的制作方法
1.本发明涉及一种中药组合物,具体涉及一种抗疲劳的中药组合物,属于医药领域。
背景技术:
2.长航疲劳是水域长期航行过程中因长期单一或过度的工作、紧张的心理和特殊环境等引起的作业效率明显降低的一种生理心理现象,多表现为精神倦怠,注意力不集中,反应迟钝,健忘,情绪低落,效率降低等。研究显示,长航疲劳发生率高达85.6%,是导致长航人员工作能力和健康状况下降的主要原因。因此,开发出安全有效的抗疲劳药物对于保障长航人员的健康有着重大的意义。抗疲劳的化学药物大多会产生中枢抑制作用等副作用,结合中药的优势,尤其是中药药食两用药物,在保证发挥药物作用的同时能够将药物副作用降低到最低,开发出安全有效的中药缓解长航疲劳具有重要的意义。
3.有关疲劳发生的假说有很多,其中脑内的兴奋性神经递质与工作能力和效率的维持有关,其中作为最主要的兴奋性神经递质da主导的奖励效应机制与大脑工作的驱动有关,当过度工作时会使其活性降低引起动机减弱,进而产生认知功能、注意力、应变能力下降等疲劳的表现。
4.上个世纪九十年代,研究者就证明脑中da的含量和活性与疲劳的关系密切,当da的合成与代谢处于平衡状态能够延缓疲劳的发生,当进行力竭运动后脑内da含量常呈现明显的降低。当机体处于疲劳状态时,脑内处于相对缺血缺氧的状态,drd1通过调节直接通路,抑制兴奋性神经递质的水平,使其处于合适浓度水平;drd2通过调节间接通路,刺激椎体外系实现对运动水平的调节,进而保护机体不受到损害。
5.因此,开发一种针对da调节通路缓解长航疲劳症状的药食两用药物,对于治疗疲劳成为本领域技术人员亟需解决的问题。
技术实现要素:
6.针对现有技术存在的问题,本发明的目的在于提供一种抗疲劳的中药组合物及其应用。
7.作为本发明的一个方面,本发明提供一种抗疲劳的中药组合物,所述中药组合物由如下原料药制成:黄芪、枳壳、山楂、铁皮石斛、五味子、当归。
8.优选的,所述中药组合物由如下原料药制成:黄芪8-28重量份、枳壳8-28重量份、山楂5-22重量份、铁皮石斛4-18重量份、五味子3-15重量份、当归2-12重量份;
9.进一步优选的,所述中药组合物由如下原料药制成:黄芪10-22重量份、枳壳10-22重量份、山楂6-15重量份、铁皮石斛5-12重量份、五味子4-10重量份、当归3-8重量份;
10.或,所述中药组合物由如下原料药制成:黄芪12-18重量份、枳壳12-18重量份、山楂8-12重量份、铁皮石斛6-10重量份、五味子5-9重量份、当归4-6重量份;
11.最优选的,所述中药组合物由如下原料药制成:黄芪15重量份、枳壳15重量份、山楂10重量份、铁皮石斛8重量份、五味子7重量份、当归5重量份;
12.或,黄芪13重量份、枳壳17重量份、山楂9重量份、铁皮石斛9重量份、五味子6重量份、当归6重量份;
13.或,黄芪17重量份、枳壳13重量份、山楂11重量份、铁皮石斛7重量份、五味子8重量份、当归4重量份。
14.本发明所述中药组合物可以是各原料药粉碎后混合而成的组合物,也可以是各原料药混合或单独提取后得到的提取物,或者是提取物进一步精制纯化得到的有效部位,还可以是提取物/有效部位加入药学上可接受的辅料制成的常规剂型。
15.其中,所述提取方法包括煎煮提取、回流提取、浸渍提取、超声提取、渗漉提取、微波提取等;所述纯化方法包括水提醇沉、碱溶酸沉以及各种柱色谱纯化方法,如大孔树脂柱、硅胶柱、凝胶柱、反相柱等;所述常规剂型包括但不限于注射剂、胶囊剂、片剂、颗粒剂、凝胶剂、缓释剂、口服液、滴丸剂或纳米制剂;所述药学可接受的辅料包括:填充剂、崩解剂、润滑剂、助悬剂、粘合剂、甜味剂、矫味剂、防腐剂、基质等。填充剂包括:淀粉、预胶化淀粉、乳糖、甘露醇、甲壳素、微晶纤维素、蔗糖等;崩解剂包括:淀粉、预胶化淀粉、微晶纤维素、羧甲基淀粉钠、交联聚乙烯吡咯烷酮、低取代羟丙纤维素、交联羧甲基纤维素钠等;润滑剂包括:硬脂酸镁、十二烷基硫酸钠、滑石粉、二氧化硅等;助悬剂包括:聚乙烯吡咯烷酮、微晶纤维素、蔗糖、琼脂、羟丙基甲基纤维素等;粘合剂包括,淀粉浆、聚乙烯吡咯烷酮、羟丙基甲基纤维素等。
16.作为本发明的另一个方面,本发明中药组合物还可以由所述原料药的提取物作为原料,因此,本发明进一步提供一种抗疲劳的中药组合物,所述中药组合物由如下原料制成:
17.黄芪提取物8-28重量份、枳壳提取物8-28重量份、山楂提取物5-22重量份、铁皮石斛提取物4-18重量份、五味子提取物3-15重量份、当归提取物2-12重量份;
18.优选的,所述中药组合物由如下原料制成:
19.黄芪提取物10-22重量份、枳壳提取物10-22重量份、山楂提取物6-15重量份、铁皮石斛提取物5-12重量份、五味子提取物4-10重量份、当归提取物3-8重量份;
20.进一步优选的,所述中药组合物由如下原料制成:
21.黄芪提取物12-18重量份、枳壳提取物12-18重量份、山楂提取物8-12重量份、铁皮石斛提取物6-10重量份、五味子提取物5-9重量份、当归提取物4-6重量份;
22.最优选的,所述中药组合物由如下原料制成:黄芪提取物15重量份、枳壳提取物15重量份、山楂提取物10重量份、铁皮石斛提取物8重量份、五味子提取物7重量份、当归提取物5重量份。
23.上述提取物可以是各原料药的水提物,或有机溶剂提取物,或水提物/有机溶剂提取物经过进一步精制纯化工艺得到的精制物。
24.所述有机溶剂选自甲醇、20~95%乙醇溶液、丙酮中的一种或几种;
25.制备上述提取物所用的提取方法包括回流提取、浸渍提取、超声提取或渗漉提取中的任意一种方式,或者不同提取方法的组合。
26.本发明所涉及的原料药黄芪、枳壳、山楂、铁皮石斛、五味子、当归均符合《中国药典》(2020版)的记载。其中,山楂优选生山楂。
27.作为本发明的另一个方面,本发明还提供所述中药组合物在制备抗长航疲劳的药
物中的应用。
28.本发明的技术效果:
29.本发明组方中,黄芪味甘,性微温,归肺、脾经,有益气固表、利尿脱毒等作用,主要缓解气虚乏力等症状,同时还有提高身体免疫力的作用,为方中君药。枳壳性微寒,味苦、辛、酸,具有理气宽胸、行滞消胀的功效;石斛,味甘,微寒,强阴益精,厚肠胃,补内绝不足,二药相合,共为臣药,既能与黄芪共同发挥抗疲劳作用,又能起到疏肝理气的效果。当归味甘,温,归心、肝、肺经,有润肠通便,活血化瘀之功;山楂味甘酸,性平,入脾经,功能健脾消食,散结气,行滞血;五味子味酸,性温,诸药相合,共奏疏肝健脾,理气扶正,缓解疲劳之效。
30.本发明组方是发明人在前期研究成果上对组方的进一步优化,相对于前期组方,本发明中药组合物在保证临床功效的同时,其安全性提高。在急性毒性实验中,给予成人日用113.5倍剂量的本发明中药组合物和对照药物,对照组小鼠谷丙转氨酶、谷草转氨酶和尿素氮含量均值较本发明中药组合物高,且对照组还出现一只小鼠死亡的情况,死亡小鼠谷丙转氨酶、谷草转氨酶、尿素氮指标较正常组小鼠明显提高。以上结果说明对照药物对肝肾功能的副作用要大于本发明中药组合物。因此,从用药安全的角度,本发明中药组合物更适于长期服用,毒副作用低,安全有效。
具体实施方式
31.实施例1
32.组方:黄芪15g、枳壳15g、山楂10g、铁皮石斛8g、五味子7g、当归5g;
33.制备方法:按比例取各原料药,加水煎煮两次,第一次40min,第二次30min,过滤,取水煎液,浓缩,制得提取物浸膏;
34.将提取物浸膏按常规片剂制剂工艺制备成片剂。
35.实施例2
36.组方:黄芪13g、枳壳17g、山楂9g、铁皮石斛9g、五味子6g、当归6g;
37.制备方法:按比例取各原料药,加50%乙醇回流提取两次,第一次40min。第二次20min,滤过,合并提取液,浓缩,制得提取物浸膏;
38.将提取物浸膏按常规颗粒剂制剂工艺制备成颗粒剂。
39.实施例3
40.组方:黄芪17g、枳壳13g、山楂11g、铁皮石斛7g、五味子8g、当归4g;
41.制备方法:按比例取各原料药,加水煎煮提取两次,第一次40min。第二次20min,滤过,合并煎液,浓缩,制得提取物浸膏;
42.将提取物浸膏按常规胶囊剂制剂工艺制备成胶囊剂。
43.实施例4
44.组方:黄芪11g、枳壳20g、山楂7g、铁皮石斛11g、五味子5g、当归8g;
45.制备方法:按比例取各原料药,加60%乙醇回流提取两次,第一次40min。第二次20min,滤过,合并提取液,浓缩,制得提取物浸膏;
46.将提取物浸膏按按常规蜜丸制剂工艺制备成蜜丸。
47.实施例5
48.组方:黄芪21g、枳壳11g、山楂14g、铁皮石斛6g、五味子9g、当归4g;
49.制备方法:按比例取各原料药,加水煎煮提取两次,第一次40min。第二次20min,滤过,合并煎液,浓缩,制得提取物浸膏;
50.将提取物浸膏按常规散剂制剂工艺制备成散剂。
51.实施例6
52.组方:黄芪9g、枳壳25g、山楂6g、铁皮石斛16g、五味子4g、当归10g;
53.制备方法:按比例取各原料药,加60%乙醇超声提取两次,第一次40min。第二次20min,滤过,合并提取液,浓缩,制得提取物浸膏;
54.将提取物浸膏按常规滴丸制剂工艺制备成滴丸剂。
55.实施例7
56.组方:黄芪26g、枳壳9g、山楂20g、铁皮石斛5g、五味子14g、当归3g;
57.制备方法:按比例取各原料药,加水回流提取两次,第一次40min。第二次20min,滤过,合并提取液,将提取液按常规口服液制剂工艺制备成口服液。
58.实施例8
59.组方:黄芪提取物15g、枳壳提取物15g、山楂提取物10g、铁皮石斛提取物8g、五味子提取物7g、当归提取物5g。
60.实施例9
61.组方:黄芪提取物13g、枳壳提取物17g、山楂提取物9g、铁皮石斛提取物9g、五味子提取物6g、当归提取物6g。
62.实施例10
63.组方:黄芪提取物17g、枳壳提取物13g、山楂提取物11g、铁皮石斛提取物7g、五味子提取物8g、当归提取物4g。
64.实施例11
65.组方:黄芪提取物11g、枳壳提取物20g、山楂提取物7g、铁皮石斛提取物11g、五味子提取物5g、当归提取物8g。
66.实施例12
67.组方:黄芪提取物21g、枳壳提取物11g、山楂提取物14g、铁皮石斛提取物6g、五味子提取物9g、当归提取物4g。
68.实施例13
69.组方:黄芪提取物9g、枳壳提取物25g、山楂提取物6g、铁皮石斛提取物16g、五味子提取物4g、当归提取物10g。
70.实施例14
71.组方:黄芪提取物26g、枳壳提取物9g、山楂提取物20g、铁皮石斛提取物5g、五味子提取物14g、当归提取物3g。
72.以上实施例8-14所述提取物分别各原料药的水提取物。各提取物按配方量组合后按常规制剂工艺制备成片剂、胶囊剂、散剂、颗粒剂、蜜丸剂、滴丸剂、口服液等常规口服剂型。
73.实施例15 急性毒性试验
74.1实验材料
75.1.1动物与分组
76.选用健康4周龄昆明种小鼠40只,雄性,spf级,体重(20
±
2)g,订购于斯贝福(北京)实验动物科技有限公司,实验动物许可证号为(scxk(京)2016-0002)。动物在温度(23
±
1)℃,相对湿度为50%的动物房中进行饲养。适应性饲养5天后,使用随机数字表随机分为正常组、实验组、对照组、西药组,每组10只。
77.1.2实验药品
78.实验药物:
79.组方:黄芪15g、枳壳15g、山楂10g、铁皮石斛8g、五味子7g、当归5g;
80.制备方法:按比例取各原料药,加水煎煮两次,第一次40min,第二次30min,过滤,取水煎液,浓缩,制得提取物浸膏;
81.对照药物:枳实15g、黄芪15g、当归5g、山楂10g、柴胡10g、栀子5g;按照与实验药物相同的方法制备成提取物浸膏。
82.阳性对照药:辅酶q10(生产公司:卫材(中国)药业有限公司制造,批准文号:国药准字h10930021),其由北京中医药大学第一临床医学院东直门医院药剂科提供。
83.将实验药物浓缩至最大浓度(相当于生药2g/ml,以灌胃针刚好能按压出药液时计算),对照药物制备方法与实验药物相同,各组小鼠给药前禁食不禁水12小时,然后采用最大给药量法,24小时内以最大给药体积给予实验组实验药物4ml/100g、对照组对照药物4ml/100g,灌胃3次。正常组给予相同体积的蒸馏水,连续灌胃20天。西药组给予1ml/100g的辅酶q10灌胃。
84.1.3实验仪器设备
85.煎锅
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
oubei
86.普通冰箱
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
晶宏bcd-256wdgh
87.电子天平
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
德国赛多利斯bsa224s
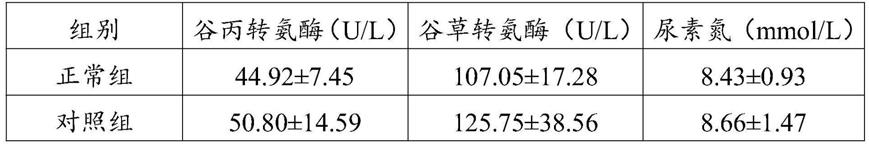
88.2实验指标
89.2.1观察小鼠毒性反应
90.2.2记录小鼠体质量情况
91.2.3检测各组小鼠谷丙转氨酶、谷草转氨酶、尿素氮含量。
92.3.实验结果
93.3.1小鼠毒性反应评估
94.实验和对照组使用量为成人日用113.5倍剂量的实验药物和对照药物进行灌胃,正常组使用相同体积的生理盐水。从用药后到实验结束,实验组小鼠均未见精神萎靡、中毒症状、死亡等不良反应的出现。在各重要系统进行评估中,神经系统方面未见明显嗜睡、焦躁不安、易激惹及昏迷等现象,未见明显刻板运动、强迫运动、肌肉松弛及麻痹,瞳孔未见明显放大及缩小;呼吸系统方面未见明显咳嗽、口鼻内未见异常分泌物;心血管系统方面周身未见明显静脉曲张、心前区触诊未见明显心率加快或变慢、未见明显出血征象;消化系统方面未见呕吐,未见明显腹部胀气、腹壁紧张及异常收缩,未见明显大便偏稀,肛门周围未见明显发红及溃疡;泌尿生殖系统未见明显会阴部、阴唇及乳房肿胀;周身皮肤未见充血、紫绀、苍白、皮疹及毛发松散;眼部未见异常流泪,眼睑下垂、眼球突出及震颤;耳部及鼻部未见溃疡及缺损。对照组小鼠出现死亡1例,死亡小鼠谷丙转氨酶、谷草转氨酶、尿素氮等反应肝肾功能的指标较正常组小鼠明显提高。其余小鼠未见明显异常,且在各个系统的评估中
无明显异常。
95.3.2小鼠体质量变化
96.结果见表1。
97.各组小鼠最初体重与最后体重均未见统计学差异(p>0.05)
98.表1 小鼠最初及最后体重表(n,)
99.组别最初体质量(g)最后体质量(g)正常组19.40
±
0.7036.70
±
3.56对照组19.50
±
0.7137.70
±
2.83实验组19.10
±
0.5737.60
±
1.90西药组19.80
±
1.3238.0
±
1.83
100.3.3小鼠血清谷丙转氨酶、谷草转氨酶、尿素氮含量
101.结果见表2。
102.各组小鼠间谷丙转氨酶、谷草转氨酶、尿素氮含量进行两两对比,各组间差异无统计学意义(p》0.05),但对照组小鼠谷丙转氨酶、谷草转氨酶和尿素氮含量均值较实验组和正常组小鼠高。
103.表2 小鼠血清谷丙转氨酶、谷草转氨酶、尿素氮含量对比(n,)
[0104][0105][0106]
从以上急性毒性试验结果可以看出,在相同剂量下,对照组小鼠谷丙转氨酶、谷草转氨酶和尿素氮含量均值较实验组高,且对照组还出现一只小鼠死亡的情况,死亡小鼠谷丙转氨酶、谷草转氨酶、尿素氮指标较正常组小鼠明显提高。谷丙转氨酶、谷草转氨酶和尿素氮是反映肝肾功能的指标。以上结果说明对照药物对肝肾功能的副作用要大于实验药物,因此,从用药安全的角度,实验药物更适于长期服用,毒副作用低,安全有效。
[0107]
实施例16 药效试验
[0108]
1实验材料
[0109]
1.1动物与分组
[0110]
选用健康成年雄性sd大鼠60只,体重(210
±
10)g,spf级,提前3天购入并进行适应性饲养。实验动物购自斯贝福(北京)实验动物科技有限公司;许可证号:scxk(京)2016-0002。在温度(23
±
1)℃、相对湿度为50%的动物房中饲养。按随机数字表法随机分为4组,分别为正常组、长航疲劳模型组、实验组、西药组,每组15只。
[0111]
1.2实验药品
[0112]
(1)实验药物1:实施例1制备药物浸膏,以上生药均来源于北京同仁堂药业有限公司。
[0113]
(2)西药:辅酶q10(生产公司:卫材(中国)药业有限公司制造,批准文号:国药准字h10930021),其由北京中医药大学第一临床医学院东直门医院药剂科提供。
[0114]
1.3实验仪器设备
[0115][0116]
2实验方法
[0117]
2.1模型复制
[0118]
适应性饲养:购进动物先进行3天适应性饲养,在中医诊断动物研究实验室进行。40w日光灯照射(8:00-20:00),室内温度控制在22.0℃-24.0℃,保持安静,大鼠5只/笼。常规鼠类饲料喂养。
[0119]
造模方法:每天将大鼠置于水面晃动站台仪中站立2小时,将造浪器设置为85转/min,晚上8点至早上6点将大鼠放入水环境小平台睡眠剥夺箱中(modified multiple platform method,mmpm),共计10小时,每天总计造模12小时,造模期间将水瓶与食物放在模型上方的空隙中,保证大鼠可以正常饮食饮水,连续造模21天。
[0120]
2.2给药方案
[0121]
造模第15天开始给予大鼠相应的中药和西药的灌服,按人体用药量换算成大鼠等效剂量作为大鼠用药量,灌胃容积为1ml/100g。余组则灌服等体积的蒸馏水。
[0122]
2.3检测指标和方法
[0123]
(1)取材
[0124]
造模结束,用10%水合氯醛以0.3ml/100g进行腹腔麻醉,铡头,放置于冰上,取出纹状体,迅速移至液氮中冷冻保存,待脑组织表面颜色变白,放置-80℃冰箱保存,备用。
[0125]
(2)实验步骤
[0126]ⅰ基因水平检测
[0127]
1.1样本总rna的提取
[0128]
将取材所得到的纹状体自-80℃超低温冰箱取出,依据hipure total rna mini kit试剂盒使用说明书进行实验操作,具体过程如下:
[0129]
①
预处理:buffer rw2加入4倍体积无水乙醇;使用无水乙醇及depc处理水配置70%乙醇;在buffer rl中加入少量消泡剂。
[0130]
②
每个组织样本加入buffer rl 750ul。
[0131]
③
在冰上使用超声破碎仪对组织样本进行破碎,10000r/min,离心5min。
[0132]
④
将gdna filter mini column放入2ml收集管中,将上步所得上清液转移至该柱中。
[0133]
⑤
10000r/min离心2min,丢弃gdna filter mini column柱。
[0134]
⑥
将所得滤液加入750ul depc处理水配置的70%乙醇,吹打5次得到混合液。
[0135]
⑦
将hipure rna mini column放入2ml收集管中。
[0136]
⑧
加入750ul上步所得混合液10000r/min离心1min,丢弃离心所得废液。
[0137]
⑨
再次加入剩余的750ul上步所得混合液10000r/min离心1min,丢弃离心所得废液。
[0138]
⑩
加入500ul buffer rw2,10000r/min离心1min,丢弃离心所得废液。
[0139]
加入500ul buffer rw1,10000r/min离心1min,丢弃离心所得废液。
[0140]
加入500ul buffer rw1,10000r/min离心1min,丢弃离心所得废液。
[0141]
空柱离心2min,将hipurernaminicolumn柱子转移至1.5ml离心管。
[0142]
加入50ul rnase freewater静置2min。
[0143]
10000r/min离心1min,获取总rna。
[0144]
获取rna后使用紫外分光光度计检测样本浓度,读取a260/280、a260/230数值。
[0145]
1.2 rna反转录
[0146]
(1)根据提取rna的浓度,计算2ug rna的体积及配置20ul反应体系所需depc处理水的量,模板rna及depc处理水添加量。
[0147]
使用thermo逆转录试剂盒,配制反转录反应体系,各试剂添加量见(表3),所有样品及试剂添加完毕,将八连排短暂离心。
[0148]
表3 20ul逆转录体系
[0149]
名称添加量rt1ulribolocktm rna酶抑制剂1ul5
×
reaction buffer4uldntp2uloligo(dt)181ulrandom hexamer primer1ulrna溶液2ugdepc处理水将总反应体系补充至20ul
[0150]
设定反转录程序为:42℃保持60min,70℃保持5min,冷却至-12℃后将所得cdna置于-80℃冰箱保存。
[0151]
1.3实时荧光定量pcr扩增
[0152]
(1)根据本实验的设计,委托上海生物工程有限责任公司进行引物合成及验证工作,引物序列如下表所示,实验所使用引物的序列见(表4)。
[0153]
表4 引物序列
[0154][0155]
将cdna、引物、sybr green realtime pcr master mix、depc处理水配置成20ul反应体系见(表5),每孔设3个副孔。
[0156]
表5 rt-pcr 20ul反应体系
[0157]
名称添加量(ul)cdna3sybr green realtime pcr master mix10引物正向0.5引物反向0.5depc水6
[0158]
(3)使用real-time pcr instrument进行扩增,程序设定见(表6);结束后获取每孔ct值,若各副孔间见未明显差异,则取3个副孔的平均值为该样本的ct值,采用2-△△
ct法计算目标基因与内参基因β-actin的比值。
[0159]
表6 pcr扩增程序设定
[0160][0161][0162]
1.4数据处理
[0163]
数据采用spss 17.0软件进行统计学处理。各项指标中,计量变量采用均数
±
标准差描述,正态分布的资料采用单因素方差分析,两两比较进行lsd-t检验。偏态分布
的资料采用秩和检验进行组间比较。检验水准取α=0.05,p《0.05为有显著性差异,p《0.01为有极显著性差异,具有统计学意义。
[0164]ⅱ蛋白水平检测
[0165]
将ripa(radio immunoprecipitation assay)裂解液和蛋白酶抑制剂苯甲基磺酰氟(phenylmethanesulfonyl fluoride,pmsf)以1000:1的比例混匀混匀,将纹状体及下丘脑组织中加入300ul混合液,使用超声破碎仪对组织在冰上进行破碎,将破碎后混合液置于冰上继续裂解30min,然后使用低温高速离心机14000rpm离心10min,吸取每份组织样本上清液使用bca法进行蛋白浓度测定后置于冰箱保存,避免反复冻融。
[0166]
2.1总蛋白浓度测定
[0167]
使用bca(bicinchonininc acid)法检测总蛋白浓度,测定过程主要包括如下几个步骤:
[0168]
①
配制工作液:50体积bca试剂加1体积cu2+试剂(50:1)配制成bca工作液,充分混匀,室温保存备用。
[0169]
②
标准品的稀释:取10μl bsa标准品用pbs稀释至100μl,使最终浓度为0.5mg/ml。将标准品按0,2,4,6,8,12,16,20μl加到96孔板的蛋白标准品孔中,pbs补足至20μl。
[0170]
③
样本的稀释:将代表性的样品作2、4、8、16稀释,将原液与稀释液加20μl到96孔板的样品孔中。
[0171]
④
各孔加入200μl bca工作液,37℃干燥箱中放置30分钟。用酶标仪测定a562nm od值,根据标准曲线计算出蛋白浓度,确定合适的稀释倍数。
[0172]
⑤
将所有样品进行相应的稀释后,重复上述步骤检测各样本的蛋白浓度。
[0173]
2.2电泳胶制备
[0174]
根据预实验结果以及本次实验一抗分子量大小,配制成10%分离胶。将烧杯中分别加入去离子水4.86ml、分离胶缓冲液3ml、30%丙烯酰胺溶液4ml、10%ap100ul、temed8ul,将烧杯中混合溶液迅速而充分的混匀。然后使用1000ul微量移液器,将溶液加入到制胶架上玻璃板中,直到加到制胶架绿色小门上2-3mm为止,然后轻柔的加入去离子水,保证水流冲击在长板上,缓缓的流到胶上,直到加满玻璃板以隔绝空气,出现气泡时用细枪头吸出。室温静置30min。然后准备配制5%浓缩胶,将玻璃板中的去离子水倒掉,往烧杯中依次加入去离子水2.87ml、浓缩胶缓冲液1.25ml、30%丙烯酰胺0.83ml,将滤纸剪成1cmx4cm的条状,伸入制胶架的玻璃板中,将多余的水分吸干,然后将10%ap50ul、temed5ul放入烧杯中,迅速混匀,使用1000ul微量移液器将混合好的浓缩胶混合液加入制胶架玻璃板中,加满后快速将梳子垂直插入玻璃板上,最后往玻璃板中补充适量浓缩胶,室温静置30min。
[0175]
2.3制备上样缓冲液
[0176]
根据bca法测量的蛋白浓度,加入pbs将所有样本蛋白浓度调整至同一水平,按照蛋白溶液体积:上样缓冲液=4:1的比例加入上样缓冲液,密封后煮沸迅速冷却。
[0177]
2.4电泳
[0178]
将电泳装置内槽加满1
×
电泳缓冲液,确保不漏液后将剩余电泳液加入外槽。轻轻双手垂直向上拔出电泳胶梳子,两边加入4ul marker,剩余每孔加入6ul样本。通电加压至80v进行电泳直至蓝色上样缓冲液至底部,关闭电源。
[0179]
2.5转膜
[0180]
转膜前提前2h将配置好的1
×
电转缓冲液放入冰箱中预冷,转膜前半小时取出电转液将转膜过程中使用的海绵垫、滤纸进行浸泡。开始转膜前将pvdf膜裁剪至合适大小,使用甲醇浸泡1min进行活化。打开转膜用夹板,分别铺上海绵垫、滤纸,黑色面铺上电泳所获得胶块,透明面铺上经甲醇活化后的pvdf膜,逐层使用玻璃棒压紧。将转膜夹黑色面对应电转盒黑色面放入,电泳盒外放入碎冰,予以80v电压转膜90min。
[0181]
2.6封闭
[0182]
将转膜后的pvdf膜使用1xtbst清洗2次,每次5min,洗完后浸没在5%脱脂奶粉中封闭,常温下置于摇床1h。
[0183]
2.7孵育一抗
[0184]
将封闭结束的pvdf膜用1xtbst清洗5次,每次5min,并放在摇床上轻轻摇晃。用抗体稀释液稀释一抗,稀释倍数分别为:drd1=1:3000,drd2r1:500,drd5=1:2000,gapdh=1:10000。将pvdf膜浸入一抗稀释液,室温90min,并放在摇床上轻轻摇晃。
[0185]
2.8孵育二抗
[0186]
一抗孵育结束后,将pvdf膜清洗5次,每次5min,并放在摇床上轻轻摇晃。用5%脱脂奶粉稀释二抗,浸没pvdf膜,室温1h,并放在摇床上轻轻摇晃。
[0187]
2.9ecl显色
[0188]
二抗孵育后,将pvdf膜清洗5次,每次5min,并放在摇床上轻轻摇晃。按照说明书配显色液(a液:b液=1:1),避光保存。铺保鲜膜,将pvdf膜置于保鲜膜上,正面向上,显色液平铺滴在上面,平均每条200ul,摇晃去气泡保证pvdf膜被显色液液完全覆盖。预试时用梯度曝光,找到最佳曝光时间后进行照片拍摄。
[0189]
2.10数据处理
[0190]
数据采用spss17.0软件进行统计学处理。各项指标中,计量变量采用均数
±
标准差描述,正态分布的资料采用单因素方差分析,两两比较进行lsd-t检验。偏态分布的资料采用秩和检验进行组间比较。检验水准取α=0.05,p《0.05为有显著性差异,p《0.01为有极显著性差异,具有统计学意义。
[0191]
3实验结果
[0192]
3.1大鼠纹状体drd1、drd2mrna基因表达结果
[0193]
结果见表7。
[0194]
表7 大鼠纹状体drd1、drd2mrna基因表达结果
[0195][0196]
[0197]
与正常组相比,*p<0.05**p<0.01,与模型组相比
#
<0.05
[0198]
实时荧光定量pcr实验结果显示,大鼠纹状体drd1、drd2各组数据间有统计学差异,2个指标的长航疲劳模型组基因表达均低于正常组,实验组基因表达高于模型组,且优于阳性对照药物。
[0199]
3.2大鼠纹状体drd1、drd2蛋白的表达结果
[0200]
结果见表8。
[0201]
westernblot实验结果显示,大鼠纹状体drd1、drd2各组数据间有统计学差异,2个指标的长航疲劳模型组蛋白表达低于正常组,实验组蛋白表达高于模型组。
[0202]
表8 大鼠纹状体drd1、drd2蛋白的表达结果
[0203]
组别drd1drd2正常组1.05
±
0.11.17
±
0.08模型组0.48
±
0.17**0.61
±
0.11**实验组0.94
±
0.15
##1±
0.1
##
西药组1.01
±
0.14
##
1.14
±
0.1
##
[0204]
与正常组相比,**p<0.01,与模型组相比
##
p<0.01
[0205]
当机体处于疲劳状态时,脑内处于相对缺血缺氧的状态,drd1通过调节直接通路,抑制兴奋性神经递质的水平,使其处于合适浓度水平;drd2通过调节间接通路,刺激椎体外系实现对运动水平的调节,进而保护机体不受到损害。本发明中药组合物能显著提高长航模型大鼠drd1、drd2的基因和蛋白表达,表明其可以针对da调节通路缓解长航疲劳症状。
[0206]
实施例17 临床观察
[0207]
1实验药物:本发明实施例1制备的片剂,一次一片,一日两次;
[0208]
2患者统计:实验者为长期海上航行人员,共计160人次,其中严重疲劳者8人,长航时出现严重倦怠乏力,注意力无法集中等症状;中度疲劳者34人,长航时出现四肢疲倦感;轻度疲劳者118人,其在长航时出现轻微倦怠乏力。
[0209]
3治疗结果
[0210]
结果见表9。
[0211]
表9 本发明中药组合物缓解长航疲劳临床观察结果
[0212]
人员严重疲劳者中度疲劳者轻度疲劳者 834118症状解除521110症状减轻3108无效030
[0213]
上述结果表明,症状解除者共计136例,占85%;症状减轻者共计21例,占13.125%;无效者共3例,占1.875%。总有效率为98.125%。说明本发明中药组合物能够显著缓解长航疲劳。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1