特拉唑嗪作为制备降低血管硬度药物的用途的制作方法
1.本发明属于医药技术领域,涉及特拉唑嗪的新制药用途,具体地指一种特拉唑嗪作为制备降低血管硬度药物的用途。
背景技术:
2.特拉唑嗪(terazosin)通常以其盐酸盐的形式应用于医院临床治疗中,已上市的特拉唑嗪片剂或胶囊剂规格主要有1mg、2mg和5mg等等。盐酸特拉唑嗪可用于治疗良性前列腺增生症,也可用于治疗高血压症。其可单独使用,也可与其它抗高血压药物如利尿剂或α1
‑
肾上腺素能受体阻滞剂合用(wilde mi,fitton a,sorkin em(1993)terazosin.a review of its pharmacodynamic and pharmacokinetic properties,and therapeutic potential in benign prostatic hyperplasia.drugs&aging 3:258
‑
277;achari r,hosmane b,bonacci e,o'dea r(2000)the relationship between terazosin dose and blood pressure response in hypertensive patients.journal of clinical pharmacology 40:1166
‑
1172;zusman rm(2000)the role of alpha1
‑
blockers in combination therapy for hypertension.international journal of clinical practice54:36
‑
40)。针对现有的临床适应症,特拉唑嗪用于成人患者治疗的日剂量大多在1~10mg的范围。特拉唑嗪用于治疗良性前列腺增生(bph)时,用药后良性前列腺增生症状减轻和尿流速改善与膀胱颈和前列腺中的α1
‑
肾上腺素能受体阻断所引起的平滑肌松弛有关。由于在膀胱体中有相对少的α1
‑
肾上腺素能受体,因而特拉唑嗪能够减轻膀胱出口的阻塞而不影响膀胱的收缩(wilt tj,howe rw,rutks ir,macdonald r(2002)terazosin for benign prostatic hyperplasia.the cochrane database of systematic reviews cd003851)。此外,特拉唑嗪通过减少总外周血管阻力而使血压降低。特拉唑嗪的血管舒张、血压降低作用似乎主要是由α1
‑
肾上腺素能受体阻断所引起的。特拉唑嗪的化学名为(4
‑
(4
‑
氨基
‑
6,7
‑
二甲氧基喹唑啉
‑2‑
基)哌嗪
‑1‑
基)(四氢呋喃
‑2‑
基)甲酮,化学分子式为c
19
h
25
n5o4,化学结构式为以下式i:
[0003][0004]
越来越多的证据表明,年龄是患者心脑血管疾病发生、发展的主要危险因素之一,而血管退行性变化在其中发挥了主导作用。血管退行性变化指的是血管随着年龄的增长,在其他因素共同作用下发生的功能和结构衰老、退化的生理病理过程。在临床上血管退行
性变化主要表现为血管硬度的增加,而血管硬度的增加则表现为脉搏波传导速度的增加。特别需要指出的是:血管硬度的增加与动脉粥样硬化在形成机制上存在明显不同,它更广泛地导致了血管壁的结构重塑。患者在没有动脉粥样硬化的情况下,血管硬度的增加主要体现在血管内中膜厚度(imt)显著增加,并且还存在内皮细胞的损伤和功能障碍、血管对一氧化氮(no)依赖性的舒张作用明显减弱。这种结构重塑和功能障碍相互影响,最终促使血管硬度增加(张宇聪、张存泰;重视血管衰老的评估和防治;中华老年医学杂志2020,39(8):857
‑
858)。详细的动脉粥样硬化以及血管硬度增加的区别参见下面的表1(中华医学会老年医学分会心血管学组;血管衰老临床评估与干预中国专家共识(2018);中华老年医学杂志2018,37(11):1177
‑
1184)。
[0005]
表1
[0006][0007]
当患者的主动脉、颈动脉等大动脉因发生退行性变化而僵硬度增加时,其外围的肌肉动脉却没有出现明显的变化,此时脉搏波的能量更多地向微循环中进行传递,从而破坏微循环结构,影响患者终末组织、细胞的灌注,这种现象会导致具有高流量、低阻力血管床的器官受到损害,如心肌、肾脏、大脑、胎盘和睾丸(chirinos ja,segers p,hughes t,townsend r.large
‑
artery stiffness in health and disease:jacc state
‑
of
‑
the
‑
art review.j am coll cardiol.2019;74(9):1237
‑
1263.,nowak kl,rossman mj,chonchol m,seals dr.strategies for achieving healthy vascular aging.hypertension.2018;71(3):389
‑
402),导致收缩期高血压、左心肥厚、心衰、脉搏波相关肾病、认知障碍、认知能力下降、偶发性痴呆、先兆子痫、胎儿宫内生长迟缓、睾丸衰老等(张宇聪、张存泰;重视血管衰老的评估和防治;中华老年医学杂志2020,39(8):857
‑
858)。而患者动脉粥样硬化与血管退行性僵硬明显不同的是前者主要在局部引起相应器官的病变,如冠心病等。
[0008]
目前,临床上尚未出现可以在早期直接治疗或延缓血管硬度增加的药物,血管硬度升高的人群往往是在长期血管退行性病变出现相关靶器官损害或者症状之后再进行相应的对症治疗,而此时相关靶器官的损害往往不可逆转。为了解决上述难题,医学科研人员一直在努力寻求能够在相关疾病出现之前干预患者血管硬度的药物,以延缓或减轻患者病变症状、提高患者生活质量,但目前尚未取得满意的进展。因此,本领域仍然期待能为临床上提供具有直接降低血管硬度的药物。
技术实现要素:
[0009]
本发明的目的就是要克服现有技术存在的不足,提供一种特拉唑嗪作为制备降低血管硬度药物的用途,为临床实践开拓可以在早期干预血管退行性变化的药物。
[0010]
为实现上述目的,本发明公开了一种特拉唑嗪在新制备药物中的应用,即特拉唑嗪或其药用盐或其溶剂合物作为制备降低血管硬度药物的用途。
[0011]
作为优选方案,所述药用盐为特拉唑嗪的盐酸盐、磷酸盐、苯磺酸盐、甲磺酸盐、硫酸盐、硝酸盐中的一种或一种以上的任意组合,通常选用特拉唑嗪的盐酸盐。
[0012]
作为优选方案,所述溶剂合物为特拉唑嗪或其药用盐的水合物。
[0013]
进一步地,所述水合物通常选用一水合物或二水合物。
[0014]
更进一步地,所述溶剂合物为盐酸特拉唑嗪二水合物。
[0015]
在本发明的具体实验研究中,如未另外特别说明,都是选用盐酸特拉唑嗪二水合物进行试验的。
[0016]
作为优选方案,所述特拉唑嗪按其活性成分0.1~1mg的日剂量经消化道给药,每日一次或多次服用。
[0017]
进一步地,所述特拉唑嗪按其活性成分0.25~0.75mg的日剂量经消化道给药,每日一次或二到三次服用。
[0018]
更进一步地,所述特拉唑嗪按其活性成分0.50~0.75mg的日剂量经消化道给药,每日一次或两次服用;每日一次时按固定时间服用,每日两次时分早晚服用。
[0019]
再进一步地,所述特拉唑嗪按其活性成分0.50mg的日剂量经消化道给药,每日一次在睡前服用。
[0020]
在本发明的具体临床研究中,如未另外特别说明,特拉唑嗪都是按其活性成分的日剂量(例如0.25mg、0.5mg、0.75mg和1mg)进行临床观察的。特拉唑嗪用于人体的有效剂量可根据多种因素例如人的体重、年龄、病症状态等进行调节,本发明中成人给药的日剂量是0.1~1mg,该范围内的剂量与本发明具体实验研究中所使用剂量是相当的,但大幅度低于特拉唑嗪在目前临床上的常规使用剂量。并且,特拉唑嗪可以用各种途径给药,例如口服、注射、经皮等等。作为早期干预血管硬度的药物,口服给药是最佳的,并且与其现有的给药途径相同。在确定了给药途径的情况下,药物的剂型选择是容易的。
[0021]
作为验证方案之一,所述降低血管硬度药物的效果评判是在临床上通过测量脉搏波传导速度来评估血管的硬化程度。
[0022]
作为验证方案之二,所述降低血管硬度药物的效果评判是在动物模型上通过测量脉搏波传导速度来评估血管的硬化程度。
[0023]
作为验证方案之三,所述降低血管硬度药物的效果评判是在实验中通过检测β
‑
半乳糖苷酶活性来评估血管组织的衰老程度。
[0024]
本发明的有益效果在于:通过对目前临床上的常用药物特拉唑嗪进行细胞实验、动物试验和临床研究,发现小剂量的特拉唑嗪能够卓有成效地降低血管硬度,这为早期治疗或预防血管硬化相关疾病提供了重要的技术支持。本发明的实验和临床研究结果也证明,在降低血管脉搏波传导速度方面,使用0.1~1mg剂量范围内的特拉唑嗪均有良好的降速效果。更为突出的是,使用0.50~0.75mg特拉唑嗪的降速效果优于使用0.25mg和1mg特拉唑嗪的降速效果。最佳地,使用0.50mg特拉唑嗪的降速效果不仅与使用0.75mg特拉唑嗪的
降速效果相当,而且与目前常规的2~5mg特拉唑嗪服用量相比,能够大幅降低用药剂量、节省用药成本、减轻患者医疗负担。同时,由于在人体中使用的特拉唑嗪剂量极低,基本上杜绝了与特拉唑嗪相关的不良副作用发生。
附图说明
[0025]
图1为0.25~1mg特拉唑嗪在临床研究中降低观察对象脉搏波传导速度的折线图;
[0026]
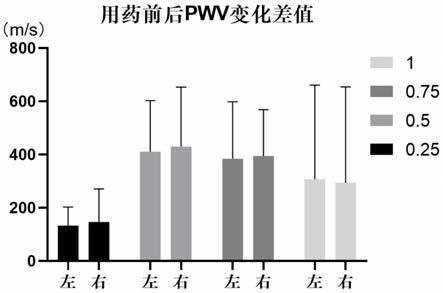
图2为0.25~1mg特拉唑嗪在临床研究中降低观察对象脉搏波传导速度差异的柱状图;
[0027]
图3为特拉唑嗪在动物模型中降低实验动物脉搏波传导速度的柱状图;
[0028]
图4为特拉唑嗪降低实验动物血管组织β
‑
半乳糖苷酶活性效果的柱状图;
[0029]
图5为特拉唑嗪改善实验动物血管组织弹性纤维状态后的染色示意图;
具体实施方式
[0030]
以下结合附图、实施例和实验例对本发明作进一步的详细描述。当然,本发明的保护范围并不限于下述实施例。本领域专业技术人员能够理解,在不背离本发明精神的前提下,可以对本发明进行各种变化和修饰。本发明对实验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但本发明仍然在此作尽可能详细的描述。以下实施例是进一步说明本发明,而不是限制本发明。任何依据本发明构思所作出的仅仅为形式上的而非实质性的等效变换都应视为本发明技术方案的范畴。
[0031]
在下述实验中,如未另外特别说明,所使用的特拉唑嗪都是其盐酸盐二水合物。众所周知的是,不同形式的盐和/或其溶剂合物通常仅影响药物的理化性质例如溶解性等,而不会影响药物的生物学活性,因此可以预期特拉唑嗪游离碱及其其它形式的盐例如硫酸盐、磷酸盐等,它们在下述实验中的生物学性质将呈现与盐酸特拉唑嗪二水合物等当的结果。
[0032]
实施例1
[0033]
盐酸特拉唑嗪片剂或胶囊剂0.50mg(以其活性成分计量),口服经消化道给药,每日一次在睡前服用,疗程12~52周,用于降低血管硬度,预防和治疗血管退行性变化导致的血管硬度增加。治疗末期根据体检数据确定后续治疗方案。
[0034]
实施例2
[0035]
盐酸特拉唑嗪片剂或胶囊剂0.75mg(以其活性成分计量),口服经消化道给药,每日一次在睡前服用,疗程12~52周,用于降低血管硬度,预防和治疗血管退行性变化导致的血管硬度增加。治疗末期根据体检数据确定后续治疗方案。
[0036]
实施例3
[0037]
盐酸特拉唑嗪片剂或胶囊剂1mg(以其活性成分计量),口服经消化道给药,每日一次在睡前服用,疗程12~52周,用于降低血管硬度,治疗血管退行性变化导致的血管硬度增加。治疗末期根据体检数据确定后续治疗方案。
[0038]
实施例4
[0039]
盐酸特拉唑嗪片剂或胶囊剂0.25mg(以其活性成分计量),口服经消化道给药,每
日一次在睡前服用,疗程12~52周,用于预防血管退行性变化导致的血管硬度增加。
[0040]
为了证实本发明所述特拉唑嗪应用于降低血管硬度药物方面的优异疗效,下面进一步介绍其在各项药理学基础研究中所取得的结果:
[0041]
实验例1
[0042]
特拉唑嗪在临床上降低血管硬度的效果
[0043]
在临床上收集每天服用特拉唑嗪0.25mg、0.5mg、0.75mg、1mg的人群,分左、右两侧测量服用前和服用过程中脉搏波传导速度,记录检测结果。如图1所示:与服用前比较,服用特拉唑嗪后脉搏波传导速度显著下降(采用配对t检验进行统计学分析,差异具有统计学显著性,p<0.01);图1中相连的两点分别为同一个人服用特拉唑嗪前后,身体左、右两侧测量脉搏波传导速度(pwv)的结果,纵坐标为pwv。而在自然衰老的过程中,人体血管脉搏波传导速度是逐年增长的。如图2所示:在降低血管脉搏波传导速度的效果方面,使用0.5mg和0.75mg特拉唑嗪的效果优于使用0.25mg和1mg特拉唑嗪的效果,说明特拉唑嗪在远低于2~5mg常规剂量的情况下仍具有极好的降低血管硬度作用。而本实验研究中所有观察对象均未出现与特拉唑嗪相关的副作用,例如体虚无力、心悸、恶心、体位性低血压等。
[0044]
实验例2
[0045]
特拉唑嗪在小鼠血管早衰模型中降低血管硬度的效果
[0046]
apoe
‑
/
‑
小鼠饲喂高脂饮食,建立动脉硬化模型,用以模拟血管早衰。高脂饮食饲喂8周后,对小鼠进行动脉脉搏波传导速度测量,并对本实验结果进行统计学分析。每组实验使用10只小鼠,实验重复三次。统计方法为单因素anova分析,统计结果如图3所示:与正常饮食(ctrl)小鼠比较,高脂喂养(hfd)后小鼠动脉脉搏波传导速度(pwv)有明显增加(图中纵坐标为pwv);而高脂喂养并给予口服0.05mg/kg小剂量特拉唑嗪(hfd+lowtz)的小鼠动脉脉搏波传导速度明显降低;同样,高脂喂养并给予口服0.5mg/kg大剂量特拉唑嗪(hfd+hightz)的小鼠动脉脉搏波传导速度也明显降低;高脂喂养+特拉唑嗪处理小鼠与单纯高脂喂养小鼠在血管硬度方面存在显著差异(p<0.05,图中以***表示)。
[0047]
实验例3
[0048]
特拉唑嗪在小鼠血管早衰模型中干预血管组织的效果
[0049]
取实验例2中血管早衰模型小鼠胸主动脉
‑
腹主动脉段,进行β
‑
半乳糖苷酶(β
‑
gal)染色和evg染色,并对本实验结果进行统计学分析。每组实验使用6只小鼠,实验重复三次。统计方法为单因素anova分析,统计结果参见图4和图5。如图4所示:与正常饮食(ctrl)小鼠比较,高脂喂养(hfd)后小鼠血管半乳糖苷酶染色呈明显阳性;而高脂喂养并给予口服0.05mg/kg小剂量特拉唑嗪(hfd+lowtz)的小鼠血管半乳糖苷酶染色阳性率明显降低;同样,高脂喂养并给予口服0.5mg/kg大剂量特拉唑嗪(hfd+hightz)的小鼠血管半乳糖苷酶染色阳性率也明显降低;高脂喂养+特拉唑嗪处理小鼠血管与单纯高脂喂养小鼠血管在半乳糖苷酶染色阳性率方面存在显著差异(p<0.05,图中以***表示)。如图5所示:染色呈黑色的部分代表小鼠血管中的胶原纤维。与正常饮食(ctrl)小鼠相比,高脂喂养(hfd)后小鼠的evg染色呈现出弹性纤维排列紊乱、断裂无序、走行僵直的变化;而高脂喂养+小剂量特拉唑嗪(hfd+lowtz)处理的小鼠可有效缓解胶原纤维变劣;同样,高脂喂养+大剂量特拉唑嗪(hfd+hightz)处理的小鼠也可有效缓解胶原纤维变劣。
[0050]
综上所述,借助于本发明的技术方案,能够确定特拉唑嗪或其类似物在降低血管
硬度药物方面的新用途,这种新用途不仅为医学科研人员在临床治疗中提供了新的选择方案,而且与目前临床上使用的2~5mg常规剂量特拉唑嗪相比,能够大幅降低用药剂量,节省用药成本,减轻患者医疗负担,同时能够将特拉唑嗪的不良副作用限制在极低的水平。
[0051]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修饰、等同替换、改进等等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1