一种基于动物组织的低温脱脂方法及其应用与流程
1.本发明属于脱脂技术领域,涉及一种基于动物组织的低温脱脂方法及其应用。
背景技术:
2.脂肪酶(lipase)即三酰基甘油酰基水解酶,是一种重要的工业酶,能够催化天然油脂分解成脂肪酸、甘油和甘油单酯或甘油二酯,并能在不同反应体系条件下催化转酯、酯化、醇解等多种反应。脂肪酶广泛存在于动植物及微生物中,微生物脂肪酶比动植物脂肪酶的作用ph值更广、作用温度范围更大、底物更专一,且微生物脂肪酶一般都是分泌性的胞外酶,目前部分研究较多的微生物脂肪酶已获得高纯度的产品,因此微生物脂肪酶更适合进行工业化生产。
3.低温微生物是指在较低温度的环境下具有生长适应能力的微生物,其广泛分布于寒冷地区中,如高山、冰川、深海、南北极、冻土等。低温微生物可以在低温条件下合成具有高催化效率的低温酶类,通过这些酶将环境中的生物大分子降解为小分子,保证自身营养所需和进行正常的生命活动。产低温脂肪酶的低温微生物大部分属于气单胞菌属、假单胞菌属、青霉属、念球菌数等。
4.低温脂肪酶(cold-temperature lipase)是一类能在较低温度下催化油脂分解的脂肪酶,其最适温度通常比同功能的中高温脂肪酶低30℃左右,中高温脂肪酶最适温度一般为50-60℃,而低温脂肪酶在0-30℃中就可以拥有较高的酶活性。低温脂肪酶的基本性质如作用温度、最适ph值、等电点及分子量都因酶的不同而不同,例如有的低温脂肪酶最适ph值为6-9,有些低温脂肪酶最适温度为30-40℃,有些则为10-15℃。
5.目前,在组织工程领域,以动物组织为原料的细胞外基质材料的制备是一个主要发展方向。细胞外基质是由许多大分子物质如胶原纤维、糖蛋白、弹性蛋白、生长因子等成分构成的三维结构,为各种细胞的生存及活动提供适宜的场所及微环境,调控组织器官功能。所以细胞外基质作为理想的组织修复材料,已经广泛用于临床。在细胞外基质的制备工艺中,脱脂是主要的技术难点之一,由于脂肪具有一定的免疫原性,因此需要将动物组织材料中的脂肪去除干净,以降低生物材料的免疫原性。目前的动物组织脱脂方法有许多,基本都是通过去污剂、有机溶剂、酸碱溶液等试剂进行脱脂过程。但是上述脱脂方法极不稳定,这些试剂的使用一方面导致了细胞外基质材料中的活性成分破坏,组织材料脱脂不彻底,另一方面,有害溶剂的残留会导致生物材料具有细胞毒性,从而影响生物膜材料的修复效果。而且大部分有机溶剂易挥发、有特殊气味、易燃、毒性较大,在使用中有一定安全隐患。
6.cn109603195a公开了一种动物组织的脱脂方法及其应用,包括如下步骤:(1)预处理:将动物组织洗净、消毒,切割成片状、块状或者捣碎成粉;(2)脱水:动物组织经乙醇溶液脱水处理;(3)萃取:将动物组织装入密闭萃取釜内进行超临界二氧化碳脱脂;(4)分离:脂肪及脂溶性杂质随着二氧化碳流体进入分离釜,脂肪及脂溶性杂质与二氧化碳分离,二氧化碳参与下一次萃取循环,脂肪及脂溶性杂质在分离釜中被去除,经过至少二次萃取循环即得。该发明的动物组织脱脂方法采用了超临界二氧化碳萃取处理后,动物组织的脱脂率
在99%以上,能彻底去除动物组织中的脂肪和脂溶性杂质;另一方面,经超临界二氧化碳处理后,动物组织潜在的动物病毒去除率达到99%以上。但该发明的脱脂温度较高,可能会破坏细胞外基质材料中的活性成分。
7.因此,在本领域中,期望开发一种避免生物材料三维结构被破坏、脱脂效率高、毒性小、安全无污染的脱脂方法,以提高细胞外基质制备的效率,并进一步保证细胞外基质的再生及修复活性。
技术实现要素:
8.针对现有技术的不足,本发明的目的在于提供一种基于动物组织的低温脱脂方法及其应用,以解决采用传统的表面活性剂或有机溶剂脱脂方法,污染大、脱脂效率不高、破坏生物材料结构等缺陷,实现低温、无溶剂和表面活性剂的动物组织清洁、高效脱脂。本发明提供的低温脱脂方法通过低温脂肪酶和酸碱试剂配合使用,大大提高了生物材料制备过程中动物组织的脱脂效率,且避免了生物材料三维结构被破坏,毒性小、安全无污染。
9.为达此目的,本发明采用以下技术方案:
10.第一方面,本发明提供一种基于动物组织的低温脱脂方法,所述低温脱脂方法包括以下步骤:
11.(1)取离体的动物组织,预处理,而后使用碱性试剂处理;
12.(2)使用低温脂肪酶溶液处理步骤(1)得到的产物;
13.(3)使用酸性试剂或脂肪酸分散剂溶液处理步骤(2)得到的产物,后处理,即得到脱脂后的动物组织。
14.脱脂后的动物组织可冷冻保存或进行后续处理。
15.目前大多数脂肪酶是中高温酶,酶的活性温度一般都在50-60℃,在低温时酶活力低,因此中高温脂肪酶较难应用于一些热稳定性较差的产品中。而低温脂肪酶在热稳定性较差的产品中具有良好的应用前景,与中高温脂肪酶相比,低温脂肪酶有利于保护产物的特性、降低生产能源消耗,ph适应性宽,对长链甘油酯具有更高的催化活性等优点,从低温环境中筛选的微生物能够分离出低温脂肪酶,可以运用于低温脱脂技术中。
16.在动物源性的生物支架材料制备过程中,脱脂是一个较难解决的问题,如果使用中高温脱脂方法,会破坏生物支架材料的胶原纤维和骨架结构,导致生物支架材料力学强度低,组织再生的诱导效果差。因此,利用低温脂肪酶和酸碱试剂配合使用的方法,能够在较低温度下有效脱脂,同时保护生物材料的胶原纤维结构。
17.本发明将低温脂肪酶和酸碱试剂配合使用来进行细胞外基质材料制备中的脱脂步骤,其中,低温脂肪酶能够在较低温度下进行高效脱脂,在低温条件下,既保证了动物组织材料的三维结构完整性,也提高了脱脂效率,使得脱脂更加彻底,降低生物材料的免疫原性。同时,在使用低温脂肪酶溶液处理前,使用碱性试剂进行配合使用,碱溶液浸泡后,动物组织材料的胶原纤维孔隙更加疏松,使得低温脂肪酶溶液能够更好的进入组织材料内部,作用后脱脂效果更佳,在使用低温脂肪酶溶液处理后,使用酸性试剂或脂肪酸分散剂溶液进行处理,可以将已经脱除的脂肪洗脱下来,以达到低温、高效、彻底脱脂的目的。
18.本发明技术的核心是使用低温脂肪酶催化油脂分解,一些低温脂肪酶在碱性条件下能够达到较高酶活性,碱性试剂处理后的生物材料孔隙疏松,在一定碱性环境下,加入低
温脂肪酶溶液,其可以迅速进入生物材料内部结构,水解脂肪,使脂肪酸原位形成可溶性皂,进入水相。进一步通过酸性试剂或脂肪酸分散剂进行分散,通过水即可将动物脂肪洗脱下来,从而达到低温、高效、彻底脱脂的目的。
19.本发明所述低温脱脂方法中的低温指的4~15℃。低温脱脂方法指的是此方法的各步骤均在4~15℃的较低温度下进行,在此温度下进行脱脂,不会破坏生物材料内部的三维结构和胶原蛋白纤维等结构,并能达到高效脱脂的目的,为生物材料制备中的脱脂过程提供良好的方法。
20.优选地,所述动物组织包括动物的食道、胃、肠道、尿道或膀胱中的任意一种。
21.优选地,所述碱性试剂包括碳酸钠溶液、碳酸钾溶液、氢氧化钠溶液或氢氧化钾溶液中的任意一种或至少两种的组合。
22.优选地,所述碱性试剂的浓度为0.1~5mol/l,例如0.1mol/l、0.2mol/l、0.3mol/l、0.5mol/l、0.8mol/l、1mol/l、1.5mol/l、2mol/l、2.5mol/l、3mol/l、3.5mol/l、4mol/l、4.5mol/l或5mol/l等。
23.若碱性试剂的浓度低于0.1mol/l,对于生物材料的处理程度不够,若碱性试剂的浓度高于5mol/l,高浓度的碱溶液会对生物材料的内部胶原纤维等结构造成严重破坏,力学性能降低。
24.优选地,所述低温脂肪酶溶液中的低温脂肪酶包括lipase zc1脂肪酶、lipase b5脂肪酶、jxj-7脂肪酶、jxj-54脂肪酶、fs119脂肪酶或lp28脂肪酶中的任意一种。其中,lipase zc1脂肪酶和lipase b5脂肪酶是中性低温脂肪酶,其最适ph值为7;jxj-7脂肪酶、jxj-54脂肪酶、fs119脂肪酶和lp28脂肪酶是碱性低温脂肪酶,其最适ph值为8~14,例如8、9、10、11、12、13或14等。
25.作为本发明的优选技术方案,低温脂肪酶ph适应性宽,对长链甘油酯具有较高的催化活性,能够有效去脂。
26.优选地,所述低温脂肪酶溶液的浓度为10~500u/ml,例如10u/ml、20u/ml、30u/ml、50u/ml、80u/ml、100u/ml、150u/ml、200u/ml、250u/ml、300u/ml、350u/ml、400u/ml、450u/ml、480u/ml或500u/ml等。
27.若低温脂肪酶溶液的浓度低于10u/ml,浓度太低导致酶活较低,不利于脂肪分解,若低温脂肪酶溶液的浓度高于500u/ml,会对生物材料的其他成分如生长因子等产生影响,从而影响生物材料的再生修复效果。
28.需要说明的是u表示酶活性单位,10u/ml表示每ml液体的酶活为10u;1976年对酶活性单位定义为:在特定的条件下,1min能转化1μmol底物的酶量,即1iu=1μmol/min。目前国内外大多数临床实验室常省略国际二字,即将iu简写为u。
29.优选地,所述酸性试剂包括磷酸溶液、醋酸溶液或盐酸溶液中的任意一种。
30.优选地,所述酸性试剂中溶质的质量百分含量为0.1%~5%,例如0.1%、0.2%、0.3%、0.5%、0.8%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%或5%等。
31.若酸性试剂中溶质的质量百分含量低于0.1%,对于已分解的脂肪洗脱不彻底,若酸性试剂中溶质的质量百分含量高于5%,浓度较高的酸性试剂会破坏胶原纤维、弹性纤维等结构,影响生物材料力学性能。
32.优选地,所述脂肪酸分散剂溶液包括三聚磷酸钠溶液、三聚磷酸钾溶液、六偏磷酸
钠溶液、六偏磷酸钾溶液、磷酸钠溶液、磷酸钾溶液、焦磷酸钠溶液、焦磷酸钾溶液、硅酸钠溶液、硅酸钾溶液、偏硅酸钠溶液或偏硅酸钾溶液中的任意一种或至少两种的组合。
33.优选地,所述脂肪酸分散剂溶液中溶质的质量百分含量为0.1%~5%,例如0.1%、0.2%、0.3%、0.5%、0.8%、1%、1.5%、2%、2.5%、3%、3.5%、4%、4.5%或5%等。
34.优选地,步骤(1)所述预处理包括去除表面杂质和脂肪块,并清洗干净。
35.优选地,所述清洗包括用纯化水清洗。
36.优选地,步骤(1)所述处理包括浸泡。
37.优选地,步骤(1)所述处理的温度为4~15℃,例如4℃、5℃、6℃、7℃、8℃、9℃、10℃、11℃、12℃、13℃、14℃或15℃等。
38.优选地,步骤(1)所述处理的时间为0.5~5h,例如0.5h、0.8h、1h、1.5h、2h、2.5h、3h、3.5h、4h、4.5h或5h等。
39.优选地,步骤(1)所述使用碱性试剂处理之后还包括如下步骤:将动物组织清洗至中性。
40.优选地,步骤(2)所述处理包括浸泡。
41.优选地,步骤(2)所述处理的ph值为7~14,例如7、8、8.5、9、9.5、10、10.5、11、11.5、12、12.5、13、13.5或14等,在浸泡时使用酸碱试剂将浸泡液的ph值调为7~14。
42.优选地,步骤(2)所述处理的温度为4~15℃,例如4℃、5℃、6℃、7℃、8℃、9℃、10℃、11℃、12℃、13℃、14℃或15℃等。
43.优选地,步骤(2)所述处理的时间为4~12h,例如4h、5h、6h、7h、8h、9h、10h、11h或12h等。
44.优选地,步骤(2)所述处理之后还包括如下步骤:将动物组织清洗至中性。
45.优选地,步骤(3)所述处理包括浸泡。
46.优选地,步骤(3)所述处理的温度为4~15℃,例如4℃、5℃、6℃、7℃、8℃、9℃、10℃、11℃、12℃、13℃、14℃或15℃等。
47.优选地,步骤(3)所述处理的时间为1~8h,例如1h、2h、3h、4h、5h、6h、7h或8h等。
48.步骤(3)所述后处理包括使用纯化水清洗干净。
49.作为本发明的优选技术方案,所述低温脱脂方法包括以下步骤:
50.(1)取离体的动物组织,去除表面杂质和脂肪块,并清洗干净,而后使用碱性试剂处理,然后将动物组织清洗至中性;
51.(2)将低温脂肪酶溶液的ph值调至7~14,而后使用该溶液处理步骤(1)得到的产物,然后将动物组织清洗至中性;
52.(3)使用酸性试剂或脂肪酸分散剂溶液处理步骤(2)得到的产物,而后使用纯化水清洗干净,即得到脱脂后的动物组织。
53.第二方面,本发明提供一种第一方面所述的低温脱脂方法在生物材料制备、脱细胞基质制备或动物源性材料脱脂等组织工程领域中的应用。
54.与现有技术相比,本发明至少具有以下有益效果:
55.本发明的低温脱脂过程分段进行,先使用碱性试剂作用,使得动物组织材料疏松,然后使用低温脂肪酶作用于动物组织材料,低温脂肪酶可在其最适ph值的条件下迅速进入组织内部孔隙,将脂肪彻底水解,进一步通过酸性试剂或脂肪酸分散剂溶液将已分解的脂
肪洗脱,从而高效脱脂(脱脂后生物材料的脂肪含量:0.096%-0.295%)。此外,本发明的低温脱脂方法可以避免生物材料三维结构被破坏、毒性小、安全无污染。
具体实施方式
56.下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
57.实施例1
58.在本实施例中提供一种基于动物组织的低温脱脂方法,所述低温脱脂方法包括以下步骤:
59.(1)取离体的动物组织,去除表面杂质和脂肪块,并用纯化水清洗干净,而后在10℃下使用碱性试剂浸泡3h,然后将动物组织清洗至中性;
60.(2)将低温脂肪酶溶液的ph值调至8,将步骤(1)得到的产物在10℃下使用该低温脂肪酶溶液浸泡8h,然后将动物组织清洗至中性;
61.(3)在10℃下使用酸性试剂浸泡步骤(2)得到的产物,浸泡的时间为5h,而后使用纯化水清洗干净,即得到脱脂后的动物组织。
62.其中,动物组织为羊食道组织;碱性试剂为浓度为3mol/l的氢氧化钠溶液;低温脂肪酶溶液中的低温脂肪酶为jxj-7脂肪酶,低温脂肪酶溶液的浓度为300u/ml;酸性试剂为盐酸溶液,酸性试剂中溶质的质量百分含量为3%。
63.实施例2
64.在本实施例中提供一种基于动物组织的低温脱脂方法,所述低温脱脂方法包括以下步骤:
65.(1)取离体的动物组织,去除表面杂质和脂肪块,并用纯化水清洗干净,而后在4℃下使用碱性试剂浸泡5h,然后将动物组织清洗至中性;
66.(2)将低温脂肪酶溶液的ph值调至7,将步骤(1)得到的产物在4℃下使用该低温脂肪酶溶液浸泡12h,然后将动物组织清洗至中性;
67.(3)在4℃下使用酸性试剂浸泡步骤(2)得到的产物,浸泡的时间为8h,而后使用纯化水清洗干净,即得到脱脂后的动物组织。
68.其中,动物组织为猪的胃;碱性试剂为浓度为1mol/l的碳酸钠溶液;低温脂肪酶溶液中的低温脂肪酶为lipase zc1脂肪酶,低温脂肪酶溶液的浓度为10u/ml;酸性试剂为醋酸溶液,酸性试剂中溶质的质量百分含量为0.1%。
69.实施例3
70.在本实施例中提供一种基于动物组织的低温脱脂方法,所述低温脱脂方法包括以下步骤:
71.(1)取离体的动物组织,去除表面杂质和脂肪块,并用纯化水清洗干净,而后在15℃下使用碱性试剂浸泡0.5h,然后将动物组织清洗至中性;
72.(2)将低温脂肪酶溶液的ph值调至10,将步骤(1)得到的产物在15℃下使用该低温脂肪酶溶液浸泡4h,然后将动物组织清洗至中性;
73.(3)在15℃下使用脂肪酸分散剂溶液浸泡步骤(2)得到的产物,浸泡的时间为1h,而后使用纯化水清洗干净,即得到脱脂后的动物组织。
74.其中,动物组织为牛的肠道;碱性试剂为浓度为5mol/l的碳酸钠溶液;低温脂肪酶溶液中的低温脂肪酶为jxj-54脂肪酶,低温脂肪酶溶液的浓度为500u/ml;脂肪酸分散剂溶液为三聚磷酸钠溶液,脂肪酸分散剂溶液中溶质的质量百分含量为3%。
75.实施例4
76.在本实施例中提供一种基于动物组织的低温脱脂方法,所述低温脱脂方法包括以下步骤:
77.(1)取离体的动物组织,去除表面杂质和脂肪块,并用纯化水清洗干净,而后在8℃下使用碱性试剂浸泡4h,然后将动物组织清洗至中性;
78.(2)将低温脂肪酶溶液的ph值调至12,将步骤(1)得到的产物在12℃下使用该低温脂肪酶溶液浸泡6h,然后将动物组织清洗至中性;
79.(3)在6℃下使用脂肪酸分散剂溶液浸泡步骤(2)得到的产物,浸泡的时间为7h,而后使用纯化水清洗干净,即得到脱脂后的动物组织。
80.其中,动物组织为猪的食道;碱性试剂为浓度为1mol/l的氢氧化钾溶液;低温脂肪酶溶液中的低温脂肪酶为fs119脂肪酶,低温脂肪酶溶液的浓度为100u/ml;脂肪酸分散剂溶液为六偏磷酸钠溶液,脂肪酸分散剂溶液中溶质的质量百分含量为0.1%。
81.实施例5
82.在本实施例中提供一种基于动物组织的低温脱脂方法,所述低温脱脂方法包括以下步骤:
83.(1)取离体的动物组织,去除表面杂质和脂肪块,并用纯化水清洗干净,而后在12℃下使用碱性试剂浸泡2h,然后将动物组织清洗至中性;
84.(2)将低温脂肪酶溶液的ph值调至7,将步骤(1)得到的产物在8℃下使用该低温脂肪酶溶液浸泡10h,然后将动物组织清洗至中性;
85.(3)在8℃下使用脂肪酸分散剂溶液浸泡步骤(2)得到的产物,浸泡的时间为6h,而后使用纯化水清洗干净,即得到脱脂后的动物组织。
86.其中,动物组织为羊的胃;碱性试剂为浓度为2mol/l的氢氧化钾溶液;低温脂肪酶溶液中的低温脂肪酶为lipase b5,低温脂肪酶溶液的浓度为400u/ml;脂肪酸分散剂溶液为硅酸钾溶液,脂肪酸分散剂溶液中溶质的质量百分含量为5%。
87.实施例6
88.本实施例与实施例1不同之处仅在于,步骤(1)中所用碱性试剂的浓度为0.05mol/l,其他条件均与实施例1相同。
89.实施例7
90.本实施例与实施例1不同之处仅在于,步骤(1)中所用碱性试剂的浓度为6mol/l,其他条件均与实施例1相同。
91.实施例8
92.本实施例与实施例1不同之处仅在于,步骤(2)中所用低温脂肪酶溶液的浓度为5u/ml,其他条件均与实施例1相同。
93.实施例9
94.本实施例与实施例1不同之处仅在于,步骤(3)中所用酸性试剂中溶质的质量百分含量为5%,其他条件均与实施例1相同。
95.实施例10
96.本实施例与实施例4不同之处仅在于,步骤(3)中所用脂肪酸分散剂溶液中溶质的质量百分含量为0.05%,其他条件均与实施例4相同。
97.对比例1
98.本对比例与实施例1不同之处仅在于,步骤(1)中不包括使用碱性试剂浸泡处理的步骤,其他条件均与实施例1相同。
99.对比例2
100.本对比例与实施例1不同之处仅在于,不包括步骤(2),其他条件均与实施例1相同。
101.对比例3
102.本对比例与实施例1不同之处仅在于,步骤(3)中不包括使用酸性试剂浸泡处理的步骤,其他条件均与实施例1相同。
103.对实施例1-10以及对比例1-3得到的脱脂后的动物组织进行性能测试,测试方法如下:
104.(1)脱脂效果检测:采用gb 5009.6-2006《食品安全国家标准食品中脂肪的测定》中的酸水解法进行脂肪含量检测;
105.(2)拉伸强度:按照gb/t 1040.3-2006中2型试样规定的方法进行拉伸强度检测;
106.(3)标准胶原含量:按照yy/t 1511-2017中《附录b羟脯氨酸的测定方法》进行检测。
107.性能测试结果如表1所示。
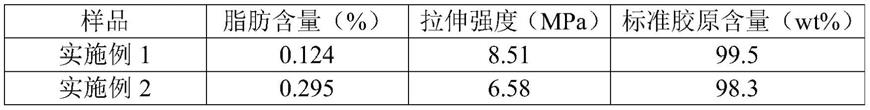
108.表1
[0109][0110][0111]
由表1的测试数据可以看出,由本发明实施例1-5提供的方法制备得到的脱脂后生物材料的脂肪含量在0.300%以下(0.096%-0.295%),拉伸强度在5mpa以上(5.98mpa-8.51mpa),标准胶原含量在97wt%以上(97.8wt%-99.5wt%)。
[0112]
与实施例1相比,由实施例6提供的方法制备得到的脱脂后生物材料的脂肪含量上
升;由实施例7提供的方法制备得到的脱脂后生物材料的拉伸强度下降。
[0113]
与实施例1相比,实施例8提供的方法制备得到的脱脂后生物材料的脂肪含量明显上升;
[0114]
与实施例1相比,实施例9提供的方法制备得到的脱脂后生物材料的脂肪含量差别不大,拉伸强度下降;
[0115]
与实施例4相比,实施例10提供的方法制备得到的脱脂后生物材料的脂肪含量上升;
[0116]
与实施例1相比,由对比例1-3提供的方法制备得到的脱脂后生物材料的脂肪含量均明显上升。
[0117]
由上表中数据可说明通过本发明提供的方法进行生物材料制备中的脱脂过程,一方面能够有效的降低生物组织中的脂肪含量,从而降低生物材料的免疫原性,另一方面使用本发明所提供的处理步骤和处理方法进行脱脂,材料的胶原含量不受影响,拉伸强度高,说明用此方法制备不会破坏生物材料中的胶原蛋白,使得生物材料的性能不受影响。因此本发明所提供的脱脂方法能够用于不用动物不同组织的生物材料制备过程中,在有效、彻底的去除脂肪的同时,能够保证生物材料的三维结构完整,可以有效用于引导组织细胞生长。
[0118]
申请人声明,本发明通过上述实施例来说明本发明的基于动物组织的低温脱脂方法及其应用,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1