一种注射用艾司奥美拉唑钠冻干制剂及其制备方法与流程
1.本发明涉及一种注射用艾司奥美拉唑钠冻干制剂,相应的,还涉及一种注射用艾司奥美拉唑钠冻干制剂的制备方法,属于药物制剂技术领域。
背景技术:
2.艾司奥美拉唑钠,化学名(s)-5-甲氧基-2-[[(4-甲氧基-3,5-二甲基-2-吡啶基)甲基]亚磺酰基-1h-苯并咪唑]钠,是一种胃部疾病的有效药物,但艾司奥美拉唑钠性质不稳定,在长期储存过程中易出现质量问题,对光、热、氧气、水都很敏感,尤其是在酸性条件下结构易改变。
[0003]
目前,常用的稳定方式包括金属离子络合剂和微胶囊式的外层包裹聚合物来实现,然而上述方案均有缺陷。
[0004]
如cn103006585a公开了一种包含依地酸二钠和氢氧化钠的艾司奥美拉唑钠的冻干制剂,主要是通过金属离子络合剂依地酸二钠来减小艾司奥美拉唑钠的变质问题。
[0005]
cn102285970a公开了一种艾司奥美拉唑半水合物冻干制剂,包含山梨醇、依地酸二钠、氢氧化钠。
[0006]
依地酸二钠是常用的金属离子络合剂,能够在碱性条件下与大多数金属离子络合,从而保持制剂的稳定,但是依地酸二钠不仅能与金属离子络合,也能与人体中的钙离子络合,进入人体后可能导致钙流失,体内血钙下降等临床问题。
[0007]
cn111870583a提供了一种稳定的注射用艾司奥美拉唑钠冻干制剂及其制备方法。其发明的注射用艾司奥美拉唑钠冻干制剂包含艾司奥美拉唑钠、羟乙基淀粉、l-天门冬氨酸、柠檬酸钠、明胶、聚乳酸-羟基乙酸和注射用水。艾司奥美拉唑钠注射用冻干制剂包封率高,载药量合适,药物可长时间维持有效的血药浓度,稳定性高,能够有效控制杂质的含量,并且对胃溃疡有良好的治疗效果,并能有效修复溃疡面积。
[0008]
上述技术方案存在的缺陷在于:
[0009]
(1)配方复杂,为了提升艾司奥美拉唑钠冻干制剂的稳定性,如添加了明胶、聚乳酸一羟基乙酸等;
[0010]
(2)工艺复杂,包括配液,乳化,包裹聚合物形成微球;
[0011]
(3)成本较高,且由于其技术方案中的聚合物包裹,药效也因此受到影响。
[0012]
鉴于上述的技术缺陷,需要对现有的艾司奥美拉唑钠冻干制剂的生产工艺进行改进,发明一种配方和工艺更加简单且成本相对较低的艾司奥美拉唑钠冻干制剂生产工艺。
技术实现要素:
[0013]
为解决上述技术问题,本发明提供了一种注射用艾司奥美拉唑钠冻干制剂,是由以下组份所组成的:艾司奥美拉唑钠、羟乙基淀粉、葡甲胺、氢氧化钠和注射用水;该艾司奥美拉唑钠冻干制剂兼具优越的稳定性和良好的药效。
[0014]
其中,艾司奥美拉唑钠:羟乙基淀粉:葡甲胺的重量比为2~5:4~10:0.2~0.5。
[0015]
优选的,艾司奥美拉唑钠:羟乙基淀粉:葡甲胺的重量比为3:7:0.3。
[0016]
其中,助溶剂为葡甲胺,赋形剂为羟乙基淀粉。
[0017]
进一步的,本发明还涉及一种注射用艾司奥美拉唑钠冻干制剂的制备方法,采用低温配液方式,提高了艾司奥美拉唑钠的稳定性,且不添加活性炭,工艺简单易行,且无需外加聚合物包裹,同时解决了不溶性微粒的问题;制备方法包括如下步骤:
[0018]
(1)配液:向配液罐中注注射用水,降温,加入羟乙基淀粉,葡甲胺,搅拌溶解,加入艾司奥美拉唑钠,搅拌使艾司奥美拉唑钠溶解,用氢氧化钠调节ph,加水定容至全量;
[0019]
(2)过滤除菌,灌装、半加塞;
[0020]
(3)反复升降温预冻和干燥;
[0021]
(4)真空压塞,轧盖,得到注射用艾司奥美拉唑钠冻干粉。
[0022]
优选的,(1)中,降温至0~-25℃。本发明中,与现有技术最大的区别以及创新在于,本发明中的配液是在低温条件下进行的,注射用艾司奥美拉唑钠储存条件为粉末状态室温保存,在溶液状态下高温对艾司奥美拉唑钠有关物质有影响,低温配液可以提高艾司奥美拉唑钠溶液的稳定性;
[0023]
优选的,(1)中,氢氧化钠调节ph为10.5~11.0。
[0024]
优选的,(3)中,预冻采用反复升降温预冻的方式;本发明人经过大量的实验,结果表明,采用对比例1中的快速降温的冷冻方式,快速降温形成冰晶较小,不利于升华,会影响产品的稳定性,导致产品有浊光,不溶性微粒不符合规定,且有关物质会增加。
[0025]
其中,预冻的具体步骤为:
[0026]
s1:以1~1.5℃/min的降温速率降至-46~-44℃,保温1~2h;
[0027]
s2:以1.5~2.5℃/min的升温速率升至-26~-24℃,保温1~2h;
[0028]
s3:以1~1.5℃/min的降温速率降至-41~-39℃,保温1.5~2.5h。
[0029]
优选的,(3)中,干燥包括升华干燥和解析干燥;
[0030]
其中,升华干燥步骤为:开启真空装置,保持真空度10~32pa,0.8~1.2h内匀速升至-1~1℃,保温10~20h;
[0031]
解析干燥步骤为:1.8~2.2h内匀速升至38~42℃,干燥4~6h;
[0032]
优选的,(3)中,干燥包括升华干燥和解析干燥这两个过程,本发明中先进行升华干燥,再进行解析干燥;
[0033]
其中,升华干燥步骤为:开启真空装置,保持真空度10~32pa,1h内匀速升至0℃,保温10-20h。
[0034]
解析干燥步骤为:2h内匀速升至40℃,干燥4-6h。
[0035]
作为一种优选的干燥方式,(3)中,干燥包括升华干燥和解析干燥;升华干燥步骤为:开启真空装置,保持真空度10~32pa,1h内匀速升至0℃,保温10~20h;
[0036]
解析干燥步骤为:2h内匀速升至40℃,干燥4~6h。
[0037]
本发明在制备过程和冻干过程中采用全程充氮,艾司奥美拉唑钠对氧敏感,易氧化,制备过程中对料液进行充氮可以降低溶液中的溶解氧,冻干过程中全程充氮气,将药物和氧接触的机会降到最低,从而提高了稳定性。
[0038]
本发明制备工艺中通过对原辅包、生产设备等的控制来控制热原,而不采用活性炭吸附,避免了引入新的杂质和活性炭残留的风险。
[0039]
通过以上的分析和阐述,本发明最大的特点是,首先,在原料配方上进行了简化,并未采用外源性的稳定剂,一方面减少了稳定剂投入的成本,另一方面也简化了配方;但是本发明中通过工艺的改进来弥补了未加入稳定剂所导致的稳定性下降这一缺陷。在减掉原料配方的同时,却依然能保持产品具有优异的稳定性能,这是采用现有的方法所并不能达到的,本发明的配方结合特定的工艺,却能达到上述的效果。因此,本发明的工艺是具有显著的进步性的。
[0040]
其次,本发明对工艺进行了改进,主要是体现在预冻步骤当中,本发明中通过升降温反复预冻处理,提高了产品的稳定性。
[0041]
本发明的有益效果概括如下:
[0042]
(1)配方组成更简单:本发明仅用艾司奥美拉唑钠、葡甲胺、羟乙基淀粉和ph调节剂配合本发明的特殊工艺即实现了艾司奥美拉唑钠优越的稳定性,其中助溶剂为葡甲胺,赋形剂为羟乙基淀粉;并未引入比如明胶等辅料。
[0043]
(2)制备工艺简捷:采用低温配液和预冻干燥氮气保护的工艺,提高了艾司奥美拉唑钠在生产过程中的稳定性,且不添加活性炭,工艺简单易行,且无需外加聚合物包裹,同时解决了不溶性微粒的问题;
[0044]
(3)本发明采用反复升降温预冻的方式,操作简单,效果优越,使药液中的艾司奥美拉唑钠与羟乙基淀粉、葡甲胺形成良好的共晶化合物,且反复处理后,制品表面外壳由致密变为疏松,改善通气性,更利于水分升华;
[0045]
(4)本发明的冻干粉成型良好,具有很好的复溶性能,并且在临床使用时与输液配伍稳定性优,不会出现可见异物和不溶性微粒;其在稳定性考察期间,产品各项指标亦均符合标准规定,大大提高了临床使用的安全性,保证了患者用药的安全性。
具体实施方式
[0046]
为了使本领域技术人员更了解本发明,本发明人将通过具体的实施案例对本发明进行更进一步的说明,但是并不以此来限制本发明。具体的实施案例如下:
[0047]
实施例1
[0048]
实施例1中的各原料配比如下表:
[0049]
成分用量作用艾司奥美拉唑钠20g活性成分羟乙基淀粉40g赋形剂葡甲胺2g助溶剂氢氧化钠调节ph为10.5ph调节剂注射用水加至3000ml溶剂
[0050]
制备方法:
[0051]
(1)配液:向配液罐中注入2000ml注射用水,全程充氮,降温至-25℃,加入40g羟乙基淀粉、2g葡甲胺搅拌溶解,再加入20g艾司奥美拉唑钠,搅拌使艾司奥美拉唑钠溶解,用氢氧化钠调节ph为10.5,加水至3000ml,搅拌20分钟,滤液经0.22μm滤膜过滤除菌;
[0052]
(2)灌装、半加塞;
[0053]
(3)冻干:全程氮气保护,预冻采用反复升降温预冻的方式,具体步骤如下:以1℃/
min的降温速率降至-45℃,保温1h,再以1.5℃/min的升温速率升至-25℃保温1h,再以1℃/min的降温速率降温至-40℃,保温2h;升华干燥:开启真空装置,保持真空度为10pa,1h内匀速升温至0℃,在此温度保持20h;
[0054]
解析干燥:2h内匀速升温至40℃,干燥6h;
[0055]
(4)真空压塞,轧盖,得到注射用艾司奥美拉唑钠冻干粉。
[0056]
实施例2
[0057]
实施例2中的各原料配比如下表:
[0058]
成分用量作用艾司奥美拉唑钠30g活性成分甘露醇50g赋形剂葡甲胺5.0g助溶剂氢氧化钠调节ph为11.0ph调节剂注射用水加至3000ml溶剂
[0059]
制备方法:
[0060]
(1)配液:向配液罐中注入2000ml注射用水,全程充氮,降温至-5℃,加入50g甘露醇、5.0g葡甲胺搅拌溶解,再加入30g艾司奥美拉唑钠,搅拌使艾司奥美拉唑钠溶解,用氢氧化钠调节ph为11.0,加水至3000ml,搅拌20分钟,药液经0.22μm滤膜过滤除菌;
[0061]
(2)灌装、半加塞;
[0062]
(3)冻干:全程氮气保护,预冻采用反复升降温预冻的方式,具体的步骤如下:以1.5℃/min降温速率降至-45℃,保温2h,再以2.5℃/min升温速率升至-25℃保温2h,再以1.5℃/min的降温速率降温至-40℃,保温2h;
[0063]
升华干燥:开启真空装置,保持真空度为20pa,1h内匀速升温至0℃,在此温度保持15h;
[0064]
解析干燥:2h内匀速升温至40℃,干燥4h;
[0065]
(4)真空压塞,轧盖,得到注射用艾司奥美拉唑钠冻干粉。
[0066]
实施例3
[0067]
实施例3中的各原料配比如下表:
[0068]
成分用量作用艾司奥美拉唑钠30g活性成分羟乙基淀粉70g赋形剂葡甲胺3g助溶剂氢氧化钠调节ph为10.0ph调节剂注射用水加至3000ml溶剂
[0069]
制备方法:
[0070]
(1)配液:向配液罐中注入2000ml注射用水,全程充氮,降温至-15℃,加入70g羟乙基淀粉、3g葡甲胺搅拌溶解,再加入30g艾司奥美拉唑钠,搅拌使艾司奥美拉唑钠溶解,用氢氧化钠调节ph为10.0,加水至3000ml,搅拌20分钟,药液经0.22μm滤膜过滤除菌;
[0071]
(2)灌装、半加塞;
[0072]
(3)冻干:全程氮气保护,预冻采用反复升降温预冻的方式,以1.2℃/min的降温速
率降至-45℃,保温1.5h,再以2℃/min的升温速率升至-25℃保温1.5h,再以1.2℃/min的降温速率降温至-40℃,保温2h;
[0073]
升华干燥:开启真空装置,保持真空度为15pa,1h内匀速升温至0℃,在此温度保持17h;
[0074]
解析干燥:2h内匀速升温至40℃,在此温度下干燥5h;
[0075]
(4)真空压塞,轧盖,得到注射用艾司奥美拉唑钠冻干粉。
[0076]
对比例1
[0077]
对比例1与实施例3相比,其原料的种类与用量与实施例3完全相同,仅调整了冻干的方式,具体的配方及工艺如下:
[0078]
处方:
[0079]
成分用量作用艾司奥美拉唑钠30g活性成分羟乙基淀粉70g赋形剂葡甲胺3.0g助溶剂氢氧化钠调节ph为10.0ph调节剂注射用水加至3000ml溶剂
[0080]
制备方法:
[0081]
(1)配液:向配液罐中注入2000ml注射用水,全程充氮,降温至-15℃,加入70g羟乙基淀粉、3.0g葡甲胺搅拌溶解,加入30g艾司奥美拉唑钠,搅拌使艾司奥美拉唑钠溶解,用氢氧化钠调节ph为10.0,加水至3000ml,药液经0.22μm滤膜过滤除菌;
[0082]
(2)灌装、半加塞;
[0083]
(3)冻干:全程氮气保护,将已灌装好的玻璃瓶放入已降温至0℃的冻干箱内,迅速降温至-40℃,保温冷冻3h,然后抽真空,在3h内升温至0℃,维持0℃的时间为10-15h,在3h升温至40℃,维持30℃的时间为3-6h;
[0084]
(4)真空压塞,轧盖,得到注射用艾司奥美拉唑钠冻干粉。
[0085]
对比例2
[0086]
对比例2与实施例3中的原料种类及用量完全相同,具体的配方及工艺如下:
[0087]
处方:
[0088]
成分用量作用艾司奥美拉唑钠30g活性成分羟乙基淀粉70g赋形剂葡甲胺3.0g助溶剂氢氧化钠调节ph为10.0ph调节剂注射用水加至3000ml溶剂
[0089]
制备方法:
[0090]
(1)配液:向配液罐中注入2000ml注射用水,降温至15℃,加入70g羟乙基淀粉、3.0g葡甲胺搅拌溶解再加入30g艾司奥美拉唑钠,搅拌使艾司奥美拉唑钠溶解,用氢氧化钠调节ph为10.0,加水至3000ml,搅拌20分钟,药液经0.22μm滤膜过滤除菌;
[0091]
(2)灌装、半加塞;
[0092]
(3)冻干:预冻采用反复升降温预冻的方式,其具体的步骤是,先以1.2℃/min的降温速率降温至-45℃,保温1.5h,再以2℃/min的升温速率升至-25℃保温1.5h,再以1.2℃/min的降温速率降温至-40℃,保温2h;
[0093]
升华干燥,:开启真空装置,保持真空度为15pa,1h内匀速升温至0℃,在此温度保持17h;
[0094]
解析干燥:2h内匀速升温至40℃,干燥4h;
[0095]
(4)真空压塞,轧盖,得到注射用艾司奥美拉唑钠冻干粉。
[0096]
对比例3
[0097]
对比例3中,具体的配方及工艺如下:
[0098]
处方:
[0099]
成分用量作用艾司奥美拉唑钠30g活性成分羟乙基淀粉70g赋形剂葡甲胺3.0g助溶剂氢氧化钠调节ph为11.0ph调节剂注射用水加至3000ml溶剂
[0100]
制备方法:
[0101]
(1)配液:向配液罐中注入2000ml注射用水,全程充氮,配液温度40℃,加入70g羟乙基淀粉,加入3.0g葡甲胺搅拌溶解,加入30g艾司奥美拉唑钠,搅拌使艾司奥美拉唑钠溶解,用氢氧化钠调节ph为11.0,加水至3000ml,搅拌20分钟,药液经0.22μm滤膜过滤除菌;
[0102]
(2)灌装、半加塞;
[0103]
(3)冻干:全程充氮,预冻采用反复升降温预冻的方式,以1.5℃/min的降温速率降至-45℃,保温2h,再以2.5℃/min的升温速率升至-25℃保温2h,再以1.5℃/min的降温速率降温至-40℃,保温2h;
[0104]
升华干燥:开启真空装置,保持真空度为20pa,1h内匀速升温至0℃,在此温度保持15h;
[0105]
解析干燥:2h内匀速升温至40℃,干燥4h;
[0106]
(4)真空压塞,轧盖,得到注射用艾司奥美拉唑钠冻干粉。
[0107]
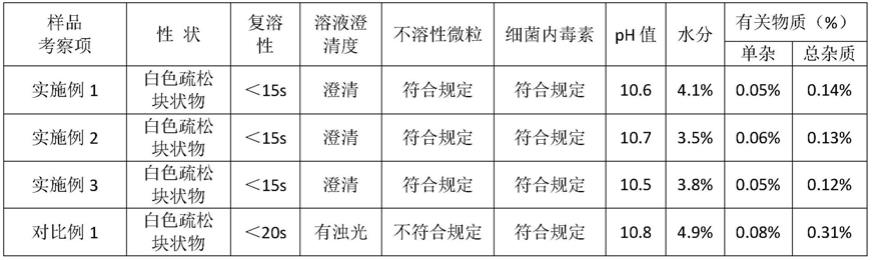
本发明实施例1~3和对比例1~3中制备的注射用艾司奥美拉唑钠全检结果见下表:
[0108]
表1.各实施例和对比例的全检结果表
[0109]
[0110][0111]
注:“符合规定”即指符合中国药典规定:标示装量为100ml以下的静脉用注射液、静脉注射用无菌粉末、注射用浓溶液及供注射用无菌原料药除另有规定外,每个供试品容器(份)中含10μm及10μm以上的微粒数不得过3000粒,含25μm及25μm以上的微粒数不得过300粒,下列均同。
[0112]
性状、溶液澄清度通过肉眼观察;复溶性采用将注射用水加入到冻干制剂中,振荡观察复溶时间和溶解后的溶液状态;ph值是将注射用水加入到冻干制剂中,溶解,用ph计测定;水分采用卡尔费休测定法所得;有关物质是采用高效液相色谱测定所获得的数据,具体的检测条件如下:流动相a:乙腈:磷酸盐缓冲液(ph7.6):水=20:10:70;流动相b:乙腈:磷酸盐缓冲液(ph7.6):水=80:10:10;检测波长280nm;柱温:25℃;样品室温度:6℃;流速:0.9ml/min;进样量:20μl,色谱柱:c18,100
×
4.6mm,3μm。
[0113]
以下所涉及到的上述指标的检测,其检测方法均同。
[0114]
配伍溶液的稳定性:
[0115]
参照注射用艾司奥美拉唑钠冻干粉说明书中的临床使用浓度,将本品溶解于0.9%氯化钠注射液中,考察配伍溶液放置30分钟后的稳定性。
[0116]
表2.各实施例和对比例的配伍溶液稳定性结果
[0117]
样品考察项目溶液澄清度不溶性微粒可见异物ph值实施例1澄清符合规定符合规定10.2实施例2澄清符合规定符合规定10.7实施例3澄清符合规定符合规定10.5对比例1有浊光不符合规定不符合规定10.0对比例2有浊光符合规定符合规定10.2对比例3有浊光符合规定符合规定10.0
[0118]
配伍稳定性结果表明:实施例1~3和对比例1与0.9%氯化钠注射液配伍后溶液澄清,不溶性微粒、可见异物符合规定,ph值降低不明显;对比例1、2、3与0.9%氯化钠注射液配伍后溶液有浊光,不符合规定,ph值降低明显;可见实施例1~3的配伍稳定性优于对比例1、2、3。
[0119]
实施例4
[0120]
长期稳定性考察结果:
[0121]
将本发明实施例1~3和对比例1和3制备的注射用艾司奥美拉唑钠放长期稳定性做进一步考察(25℃
±
2℃,rh 60%
±
10%,放置12个月),结果见下表3:
[0122]
表3.各实施例和对比例的长期稳定性
[0123][0124][0125]
以上结果表明:
[0126]
从稳定性数据可以看出,实施例1~3采用低温配液及全程充氮的工艺进行制备样品,注射用艾司奥美拉唑钠外观性状良好,复溶较快,溶液澄清,不溶性微粒、可见异物、细菌内毒素均符合规定,ph降低不明显,杂质无显著变化;
[0127]
在制备方法方面,由于艾司奥美拉唑钠水溶性差,若直接降温或降温过快在预冻过程中容易析出结晶,复溶后产生可见异物或不溶性微粒,本发明采用反复升降温预冻的方式,目的是为了使药液中的艾司奥美拉唑钠与羟乙基淀粉、葡甲胺形成良好的共晶化合物,且反复处理后,制品表面外壳由致密变为疏松,改善通气性,更利于水分升华。
[0128]
本发明在制备过程和冻干过程中充氮,将药物和氧接触的机会降到最低,从而提高了稳定性。
[0129]
本发明制备工艺中通过对原辅包、生产设备等的控制来控制热原,而不采用活性炭吸附,避免了引入新的杂质和活性炭残留的风险。
[0130]
经过放置12个月,实施例1~3制备的注射用艾司奥美拉唑钠外观性状良好,复溶较快,溶液澄清,不溶性微粒、可见异物、细菌内毒素均符合规定,ph降低不明显,杂质变化小;按对比例1制备的注射用艾司奥美拉唑钠复溶速率一般,溶液有浊光,不溶性微粒、可见异物不符合规定,ph降低明显,因其水分含量较高,杂质增加明显;按对比例2和3制备的注射用艾司奥美拉唑钠复溶速率较慢,溶液有浊光,ph降低明显,杂质增加明显。可见实施例1~3的长期12个月的稳定性优于对比例1~3。
[0131]
与实施例3相比,对比例1中工艺采用快速降温预冻,形成的冰晶体小,粒子细腻,比表面积大,升华干燥需要时间长,制备的产品溶液有浊光,不溶性微粒、可见异物不符合规定;对比例2中工艺采用反复预冻,形成的冰晶体大,升华干燥阶段快,但是因为没有充氮,制备的产品稳定性不好,有关物质在长期放置过程中有增加趋势;对比例3中工艺采用反复预冻,全程充氮,配液温度为40℃,艾司奥美拉唑钠在该配液温度条件下不稳定,易出现颜色变黄等现象,制备的产品有浊光,不溶性微粒不合格,稳定性不好,有关物质在长期放置过程中有增加趋势。
[0132]
本发明实施例1~3,相对于现有专利技术,在减少原辅料种类的情况下,既能保证产品稳定的性能,又改进了工艺,通过控制工艺参数来达到提高冻干效率,提高产品稳定性,保证产品质量的目的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1