一种加载SN-38的多靶向药物载体及其应用
一种加载sn
‑
38的多靶向药物载体及其应用
技术领域
1.本发明涉及靶向生物药物技术领域,具体涉及一种加载sn
‑
38的多靶向药物载体,该载体的制备方法与应用。
背景技术:
2.喜树碱衍生物sn
‑
38(7
‑
乙基
‑
10
‑
羟基喜树碱)是伊立替康(irinotecan,cpt
‑
11)的活性代谢产物,能抑制dna拓扑异构酶(topoisomerase),抑制dna合成,并造成频繁的dna单链断裂,具有广谱的细胞毒性。与伊立替康相比,sn38对多种癌细胞的功效高约100
‑
1000倍,并且对包括结直肠癌,肺癌,肝癌、宫颈癌和卵巢癌在内的多种肿瘤具有抑制作用。由于其水溶性差、严重的毒性和低稳定性而临床上应用受到阻碍。
3.无唾液酸糖蛋白受体(asialoglycoprotein receptor,asgpr)也称肝凝集素,是一种主要表达在肝窦状隙和基底外侧细胞表面的受体,其能够专一性识别、结合并介导内吞末端具有半乳糖或乙酰氨基半乳糖残基的去唾液酸糖蛋白类物质。
4.组织蛋白酶是溶酶体水解酶家族。根据其活性部位的氨基酸,可分为三组:半胱氨酸(b、c、h、f、k、l、o、s、v、w、x/z)、天冬氨酸(d、e)和丝氨酸(g)组织蛋白酶。溶酶体依赖于这些蛋白水解酶和其他酶来进行细胞内降解,然后再回收细胞成分。除了在溶酶体中的定位外,还可以从细胞和功能中释放组织蛋白酶,从而降解细胞外基质的成分。组织蛋白酶b(cathepsin b,cb)为溶酶体中半胱氨酸蛋白酶之一,在一些肿瘤细胞中转录水平和蛋白水平上都有高表达,如肝癌、结肠癌、乳腺癌、前列腺癌、胃癌等。组织蛋白酶b与肿瘤生长、侵袭、转移、血管形成等过程中起重要作用,并在肿瘤弱酸性的环境中表现出最佳的酶促活性。因此,广泛用于药物靶向,在不同类型的前药、纳米载体、生物材料或探针中发挥其活性。组织蛋白酶b水解底物是蛋白质或多肽:例如leu
‑
leu,arg
‑
arg,ala
‑
leu,phe
‑
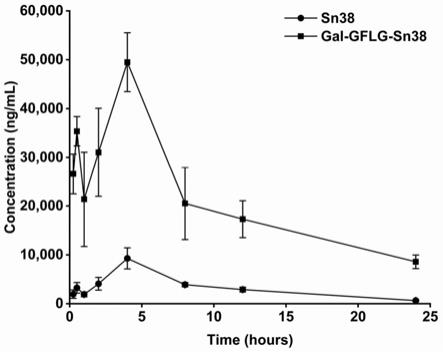
arg,phe
‑
lys,gly
‑
phe
‑
leu
‑
gly,ala
‑
leu
‑
ala
‑
leu等。
5.大多数文献报道是在sn
‑
38前药的c
‑
10和c
‑
20的位置进行化学结构修饰,可以改善其溶解性。例如选择可降解的水溶性高分子聚乙二醇(peg)来修饰内酯环上c
‑
20的羟基。sn
‑
38前药可分为亲水性、亲脂性和两亲性前药(中国药房,2016年第27卷第28期,4005
‑
4009)。
6.鉴于此,特提出本发明。
技术实现要素:
7.为了解决sn
‑
38在临床应用中存在的问题,本发明的第一目的是提供一种加载sn
‑
38的多靶向药物载体,其以无唾液酸糖蛋白受体和组织蛋白酶b进行响应。
8.本发明的第二目的是提供上述药物载体在制备治疗癌症药物中的应用。
9.为实现上述目的,本发明的技术方案如下:
10.本发明涉及一种加载sn
‑
38的多靶向药物载体,其由包括无唾液酸糖蛋白受体的配体、组织蛋白酶b酶解底物、喜树碱衍生物及亲水性乙氧基链通过共价键连接组成的化合
物。
11.进一步地,所述化合物具有如式(i)所示的结构:
[0012][0013]
进一步地,所述r’为喜树碱或喜树碱衍生物,其具有抗肿瘤活性作用。所述喜树碱衍生物选自拓扑替康及其盐酸盐、伊立替康及其盐酸盐、belotecan盐酸盐、7
‑
叔丁基二甲基硅基喜树碱、sn
‑
38中的一种。
[0014]
进一步地,所述r”为无唾液酸糖蛋白受体的配体,选自半乳糖、乙酰氨基半乳糖及乙酰氨基葡萄糖中的一种。上述配体具有水溶性,能够将该药物载体输送到无唾液酸糖蛋白受体特异性或高度表达的细胞内。
[0015]
进一步地,所述组织蛋白酶b酶解底物即为片段表示的基团,选自leu
‑
leu,arg
‑
arg,ala
‑
leu,phe
‑
arg,phe
‑
lys,gly
‑
phe
‑
leu
‑
gly,ala
‑
leu
‑
ala
‑
leu中的一种,具体实验方法中选的是gly
‑
phe
‑
leu
‑
gly(gflg),其具有组织蛋白酶b的高度靶向性和酶促活性。
[0016]
进一步地,所述r
”’
为α
‑
氨基酸支链上的基团,m为α
‑
氨基酸的数目,为2
‑
8的整数。作用为利用肿瘤细胞内高度表达的组织蛋白酶b酶解作用释放喜树碱及其衍生物,发挥其抗肿瘤活性。r
”’
选自含有2
‑
10个碳原子的烷基、含有6
‑
10个碳原子的苯基等,优选为甲基、苄基、异丁基。
[0017]
进一步地,所述n为乙氧基数目,为0
‑
50的整数,优选为3
‑
12的整数。乙氧基链具有亲水性,能增强药物载体的水溶性及生物相容性。
[0018]
进一步地,所述x为对氨基苯甲醇与喜树碱之间的连接基团,为o或基团。作用为通过共价键将组织蛋白酶b酶解底物与喜树碱及其衍生物进行连接。
[0019]
进一步地,式(i)所示的化合物选自gal
‑
gflg
‑
sn38、galnac
‑
gflg
‑
sn38和glcnac
‑
gflg
‑
sn38中的至少一种。
[0020][0021]
本发明还涉及所述加载sn
‑
38的多靶向药物载体的制备方法,包括以n
‑
(9
‑
芴甲氧羰基)甘氨酸(fmoc
‑
gly
‑
oh)和2
‑
氯三苯甲基氯树脂等为原料,制备得到gal
‑
gflg
‑
sn38、galnac
‑
sn38和glcnac
‑
sn38。所述载体可采用本领域公知的多肽固相合成(behrendt r,white p,offer j.advances in fmoc solid
‑
phase peptide synthesis.j pept sci.2016jan;22(1):4
‑
27.)等方法制备得到。
[0022]
本发明还涉及所述加载sn
‑
38的多靶向药物载体在制备治疗癌症药物中的应用。
[0023]
进一步地,所述癌症包括人肝癌细胞系、人肺癌细胞系和人子宫颈瘤细胞系。
[0024]
本发明的有益效果:
[0025]
本发明提供了一种加载sn
‑
38的多靶向药物载体,其为包括无唾液酸糖蛋白受体的配体、组织蛋白酶b酶解底物、喜树碱衍生物及亲水性乙氧基链通过共价键连接组成的化合物。所得药物载体对特异性或高表达的无唾液酸糖蛋白受体细胞的选择性好,肿瘤细胞溶酶体内高度表达的组织蛋白酶b的响应性好,以及负载的sn38对多种肿瘤细胞的杀伤力强,并具有良好的水溶性。
附图说明
[0026]
图1为不同药物载体分别处理hepg2、siha及16hbe细胞后得到的共聚焦显微镜荧光成像图。其中,
[0027]
图1a为hepg2细胞与(a)1μmsn38和(b)1μm gal
‑
gflg
‑
sn38孵育96h或使用(c)3μm gal预处理1h或(d)20μm ca
‑
07
‑
me预处理24h后与1μm gal
‑
gflg
‑
sn38孵育96h得到的荧光成像图;
[0028]
图1b为huh7细胞与(e)1μm sn38和(f)1μm gal
‑
gflg
‑
sn38孵育96h或使用(g)3μm gal预处理1h或(h)20μmca
‑
07
‑
me预处理24h后与1μm gal
‑
gflg
‑
sn38孵育96h得到的荧光成
像图。
[0029]
图1c为siha细胞与16hbe细胞分别用1μm sn38和1μm gal
‑
gflg
‑
sn38孵育96h得到的荧光成像图。上述荧光成像图通过hoechst33342(1μg/ml)对细胞核进行染色后,用荧光显微镜观察(mean
±
sd,n=4)得到。
[0030]
图2为不同药物载体处理huh7细胞后得到的共聚焦显微镜荧光成像图(mean
±
sd,n=4)。其中,图2a为gal
‑
gflg
‑
sn38处理huh7细胞后得到的荧光成像图;图2b为galnac
‑
gflg
‑
sn38处理huh7细胞后得到的荧光成像图;图2c为glcnac
‑
gflg
‑
sn38处理huh7细胞后得到的荧光成像图;图2d为sn38处理huh7细胞后得到的荧光成像图。
[0031]
图3为icr小鼠静脉注射sn38和gal
‑
gflg
‑
sn38后的血浆浓度与时间曲线图(mean
±
sd,n=5)。
[0032]
图4为icr小鼠静脉注射sn38和gal
‑
gflg
‑
sn38后的各组织浓度分布图(mean
±
sd,n=5)。其中,图4a为sn38浓度分布图;图4b为gal
‑
gflg
‑
sn38浓度分布图。
具体实施方式
[0033]
为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
[0034]
实施例制备的加载sn
‑
38的多靶向药物载体包括以下三种类型:gal
‑
gflg
‑
sn38、galnac
‑
gflg
‑
sn38和glcnac
‑
gflg
‑
sn38。
[0035]
实施例1gal
‑
gflg
‑
sn38的合成
[0036]
(1)alkyne
‑
gflg
‑
oh的合成
[0037]
1)在反应容器中称取1000mg的2
‑
氯三苯甲基氯树脂(2
‑
chlorotrityl chloride resin),加入5ml干燥的二氯甲烷(ch2cl2)使树脂溶胀10min,真空吸去溶剂后树脂用ch2cl2和n,n
‑
二甲基甲酰胺(dmf)各洗涤三次。2)n
‑
(9
‑
芴甲氧羰基)甘氨酸(fmoc
‑
gly
‑
oh)溶解在5ml dmf加到反应管中,再加入n,n
‑
二异丙基乙胺(diea)震荡反应12h。洗涤后加入5ml dmf、200μl meoh、400μl diea,震荡反应15min,重复一次。3)反应结束后洗涤干净,加入5ml dmf溶液(含25%哌啶和1%1,5
‑
二氮杂二环[5.4.0](dbu)),振荡反应15min,抽滤后用dmf洗涤三次,重复一次。4)称取n
‑
芴甲氧羰基
‑
[15n]亮氨酸(fmoc
‑
leu
‑
oh)、1
‑
羟基苯并三唑(hobt)和n,n'
‑
二异丙基碳二酰亚胺(dic)溶解在5ml dmf加到反应管中,震荡反应4h。反应结束后重复步骤(3)再继续加入下一个氨基酸。5)依次加入fmoc
‑
l
‑
苯丙氨酸(fmoc
‑
phe
‑
oh)、fmoc
‑
甘氨酸(fmoc
‑
gly
‑
oh),如同步骤4)。6)将炔基
‑
聚乙二醇
‑
羧酸(alkyne
‑
linker
‑
cooh)、hobt、dic溶解在5ml dmf加到反应管中,震荡反应4h,抽滤溶剂后树脂用dmf和ch2cl2各洗涤六次,加入5mlch2cl2与三氟乙酸(tfa)的混合试剂(ch2cl2:tfa=95:5)震荡反应2h,抽滤收集滤液,旋干浓缩。7)浓缩液用少量乙酸乙酯(etoac)溶解,用50ml蒸馏水洗涤,用50ml etoac萃取三次,饱和nacl溶液洗涤有机层,无水na2so4干燥,过滤,浓缩,得到淡黄色胶状产物。分子式及分子量为c
30
h
44
n4o
10+
[m+na]
+
643.3,经maldi
‑
tof
‑
ms分析发现643.8峰。
[0038]
(2)alkyne
‑
gflg
‑
paboh的合成
[0039]
将alkyne
‑
gflg
‑
cooh(454.2mg,0.73mmol)用10ml dmf溶解,在冰浴条件下加入苯
并三氮唑
‑
n,n,n',n'
‑
四甲基脲六氟磷酸酯(hbtu)(277.6mg,0.73mmol)和n,n
‑
二异丙基乙胺(diea)(0.31ml,1.76mmol)并搅拌活化10min,再加入对氨基苯甲醇(paboh)(108.2mg,0.88mmol)继续搅拌4h。反应结束后加入50ml蒸馏水,用50ml etoac萃取三次,饱和nacl溶液洗涤有机层,无水na2so4干燥,过滤、浓缩、柱层析(展开剂:ch2cl2/meoh=9/1,rf=0.52),得到淡黄色固体产物245.2mg,产率为38.4%。1h nmr(500mhz,dmso
‑
d6)δ9.76(s,1h),8.20
‑
8.09(m,3h),7.79(t,j=5.4hz,1h),7.56(d,j=8.2hz,2h),7.32
‑
7.19(m,7h),7.17(t,j=6.4hz,1h),5.08(t,j=5.7hz,1h),4.56(dd,j=8.3,4.0hz,1h),4.43(d,j=5.7hz,2h),4.30(d,j=7.4hz,1h),4.17
‑
4.09(m,2h),3.87(dd,j=12.4,7.2hz,4h),3.77(dd,j=16.5,5.8hz,1h),3.65(dd,j=16.5,5.7hz,1h),3.61
‑
3.46(m,11h),3.40(t,j=2.3hz,1h),3.04(dd,j=13.8,4.3hz,1h),2.79(dd,j=13.8,9.4hz,1h),1.65
‑
1.58(m,1h),1.52(t,j=7.2hz,2h),0.90(d,j=6.5hz,3h),0.85(d,j=6.5hz,3h);
13
c nmr(125mhz,dmso
‑
d6)δ172.24,171.07,169.56,168.53,167.33,137.63,137.40,129.19,128.01,126.94,126.23,118.80,80.31,77.06,70.24,69.83,69.73,69.50,69.47,68.49,62.58,57.47,53.78,51.38,42.64,41.45,40.61,37.37,24.08,22.99,21.64;分子式及分子量为c
37
h
51
n5o
10+
[m+na]
+
748.4,经maldi
‑
tof
‑
ms分析,发现748.3峰。
[0040]
(3)alkyne
‑
gflg
‑
sn38的合成
[0041]
将alkyne
‑
gflg
‑
paboh(245.4mg,0.34mmol)溶解在10ml无水ch2cl2中,在冰浴中加入三溴化磷(pbr3)(30.8μl,0.17mmol)搅拌反应1h。加入5%nahco3溶液调节反应溶液ph为碱性,加入50ml蒸馏水,用50ml ch2cl2萃取三次,饱和nacl溶液洗涤有机层,无水na2so4干燥、过滤、浓缩,得到256.4mg白色固体产物alkyne
‑
gflg
‑
pab
‑
br,产率为95.6%。在10ml无水dmf中加入sn38(153.0mg,0.39mmol)、cs2co3(74.1mg,0.23mmol)和18
‑
冠醚
‑
6(120.3mg,0.46mmol)搅拌反应2h,加入白色固体alkyne
‑
gflg
‑
pab
‑
br(256.4mg,0.33mmol)避光下继续搅拌反应48h。在溶液中加入50ml蒸馏水,用50ml etoac萃取三次,饱和nacl溶液洗涤有机层,无水na2so4干燥、过滤、浓缩、柱层析(展开剂:ch2cl2/meoh=9/1,rf=0.56),得到黄色固体产物155.76mg,产率为42.9%。经反相
‑
高效液相色谱(rp
‑
hplc)分析alkyne
‑
gflg
‑
sn38的保留时间为30.4min。1h nmr(500mhz,dmso
‑
d6)δ9.89(s,1h),8.18(d,j=8.2hz,2h),8.09(dd,j=12.5,8.7hz,2h),7.80(d,j=5.6hz,1h),7.66(s,1h),7.59
‑
7.55(m,2h),7.49(s,1h),7.27
‑
7.22(m,5h),7.16(s,1h),6.49(s,1h),5.40(s,1h),5.29(s,2h),4.56(d,j=3.9hz,1h),4.30(d,j=7.5hz,1h),4.12(d,j=2.2hz,2h),3.89(s,3h),3.77(d,j=10.7hz,1h),3.64(d,j=10.8hz,1h),3.56
‑
3.51(m,10h),3.41(t,j=2.3hz,1h),3.32(s,8h),3.17(s,2h),3.04(d,j=9.6hz,1h),2.78(d,j=4.3hz,1h),1.88(dd,j=12.9,5.5hz,2h),1.61(d,j=6.4hz,1h),1.52(s,2h),1.25(d,j=3.3hz,3h),0.88(dd,j=12.7,5.5hz,9h);
13
c nmr(125mhz,dmso
‑
d6)δ172.19,171.94,170,74,169.23,168.20,167.25,156.87,156.51,149.73,149.32,145.97,144.12,143.54,138.32,137.29,131.12,130.95,128.86,128.42,128.06,127.67,127.47,125.89,122.33,118.70,117.92,103.43,95.67,79.98,76.74,72.06,69.90,69.49,69.39,69.16,69.13,68.15,64.91,57.13,53.44,51.04,48.25,42.33,41.12,40.28,37.04,29.90,28.65,23.75,22.66,21.31,13.10,7.41;分子式及分子量为c
59
h
69
n7nao
14+
[m+na]
+
1123.1,经maldi
‑
tof
‑
ms分析发现1122.9峰。
[0042]
(4)gal
‑
gflg
‑
sn38的合成
[0043]
将半乳糖
‑
叠氮(gal
‑
n3)(4.3mg,0.017mmol)和alkyne
‑
gflg
‑
sn38(15.9mg,0.015mmol)溶解在500μl二甲基亚砜(dmso)中,在125μl蒸馏水中加入抗坏血酸钠(2.86mg,0.015mmol)和cuso4(3.61mg,0.015mmol)震荡至变姜黄色,将水溶液移到dmso溶液中避光搅拌反应12h。溶液过滤后通过制备型高效液相色谱仪纯化,冷冻干燥得到淡黄色固体产物。经rp
‑
hplc分析gal
‑
gflg
‑
sn38的保留时间为26.2min。分子式及分子量为c
67
h
84
n
10
o
20+
[m+na]
+
1371.6,经maldi
‑
tof
‑
ms分析发现1371.4峰。
[0044]
实施例2galnac
‑
gflg
‑
sn38的合成
[0045]
步骤(1)至(3)同实施例1。
[0046]
(4)将乙酰半乳糖
‑
叠氮(galnac
‑
n3)(5.1mg,0.018mmol)和alkyne
‑
gflg
‑
sn38(16.0mg,0.015mmol)溶解在500μl dmso中,在125μl蒸馏水中加入抗坏血酸钠(2.86mg,0.015mmol)和cuso4(3.61mg,0.015mmol)震荡至变姜黄色,将水溶液移到dmso溶液中避光搅拌反应12h。溶液过滤后通过制备型高效液相色谱仪纯化,冷冻干燥得到淡黄色固体产物。经rp
‑
hplc分析galnac
‑
gflg
‑
sn38的保留时间为26.3min。分子式及分子量为c
69
h
87
n
11
o
20+
[m+na]
+
1412.6,经maldi
‑
tof
‑
ms分析发现1412.6峰。
[0047]
实施例3glcnac
‑
gflg
‑
sn38的合成
[0048]
步骤(1)至(3)同实施例1。
[0049]
(4)将glcnac
‑
n3(5.1mg,0.018mmol)和alkyne
‑
gflg
‑
sn38(16.0mg,0.015mmol)溶解在500μl dmso中,在125μl蒸馏水中加入抗坏血酸钠(2.86mg,0.015mmol)和cuso4(3.61mg,0.015mmol)震荡至变姜黄色,将水溶液移到dmso溶液中避光搅拌反应12h。溶液过滤后通过制备型高效液相色谱仪纯化,冷冻干燥得到淡黄色固体产物。经rp
‑
hplc分析glcnac
‑
gflg
‑
sn38的保留时间为26.3min。分子式及分子量为c
69
h
87
n
11
o
20+
[m+na]
+
1412.6,经maldi
‑
tof
‑
ms分析发现1412.6峰。
[0050]
上述合成过程及各化合物结构式如下所示:
[0051][0052]
实验例
[0053]
一、细胞荧光成像实验
[0054]
本实验应用hepg2、hun7、siha、16hbe 4种细胞,将高压消毒好的盖玻片放于6孔板,细胞计数,按照每孔3
×
104的细胞数量接种6孔板。部分细胞设置三个实验组,分别为gal
‑
gflg
‑
sn38组、gal+gal
‑
gflg
‑
sn38组和gal
‑
gflg
‑
sn38+ca
‑
074
‑
me组。实验方法如下:
[0055]
(1)gal
‑
gflg
‑
sn38组:经24h待细胞贴壁之后,向gal
‑
gflg
‑
sn38组加入gal
‑
gflg
‑
sn38使其终浓度为1μm,置37℃培养箱培养96h后,2ml pbs溶液冲洗2遍,4%多聚甲醛每孔2ml,固定细胞15min,去掉多聚甲醛,加入0.4%tritionx
‑
100每孔2ml通透细胞,室温孵育15min,2ml pbs溶液摇洗2次,每次10min,每孔中加入2ml 1μg/ml hoechst 33342,室温孵育15min,超净台内2ml pbs溶液冲洗2次,每孔留2ml pbs溶液室外操作,指甲油封片,荧光拍照。
[0056]
(2)gal+gal
‑
gflg
‑
sn38组:经24h待细胞贴壁之后,向gal+gal
‑
gflg
‑
sn38组加入gal使其终浓度为3mm,置37℃培养箱培养1h后,不用冲洗,直接加入gal
‑
gflg
‑
sn38使其终浓度为1μm。置37℃培养箱培养96h后,2ml pbs溶液冲洗2遍,4%多聚甲醛每孔2ml固定细胞15min,去掉多聚甲醛,加入0.4%tritionx
‑
100每孔2ml通透细胞,室温孵育15min,2ml pbs溶液摇洗2次,每次10min,每孔中加入2ml 1μg/ml hoechst 33342,室温孵育15min,超净台内2ml pbs溶液冲洗2次,每孔留2ml pbs溶液室外操作,指甲油封片,荧光拍照。
[0057]
(3)gal
‑
gflg
‑
sn38+ca
‑
074
‑
me组:经24h待细胞贴壁之后,向gal
‑
gflg
‑
sn38+ca
‑
074
‑
me组加入ca
‑
074
‑
me使其终浓度为20μm,置37℃培养箱培养24h后,2ml pbs溶液冲洗2遍,4%多聚甲醛每孔2ml固定细胞15min,去掉多聚甲醛,加入0.4%tritionx
‑
100每孔2ml通透细胞,室温孵育15min,2ml pbs溶液摇洗2次,每次10min,每孔中加入2ml 1μg/ml hoechst 33342,室温孵育15min,超净台内2ml pbs溶液冲洗2次,每孔留2ml pbs溶液室外操作,指甲油封片,荧光拍照。
[0058]
通过荧光成像分析gal
‑
gflg
‑
sn38进入到细胞之后的药物定位。将hepg2、hun7、siha和16hbe细胞用1μm gal
‑
gflg
‑
sn38处理96h,用hoechst 33342染色细胞核,然后用共聚焦显微镜进行分析。另外两组也采用相同方法进行分析。
[0059]
如图1(a)、(b)和(c)所示,经过sn38和gal
‑
gflg
‑
sn38处理的hepg2和huh7细胞的细胞核中可见较强的绿色荧光,说明细胞中半乳糖与asgpr特异性结合进入到细胞内,经过溶酶体中组织蛋白酶b酶解四肽gflg,使释放的sn38扩散到细胞核并定位于细胞核内。并且,因为sn38毒性作用,huh7细胞核出现核裂解,核形态不完整等特征。然而,gal+gal
‑
gflg
‑
sn38组的hepg2和huh7细胞荧光强度明显减弱,是因为提前加入gal对细胞表面的去唾液酸糖蛋白封闭作用,使得gal
‑
gflg
‑
sn38可结合的受体数量变少。另一方面,gal
‑
gflg
‑
sn38+ca
‑
074
‑
me组的细胞核出现微弱的荧光强度,是因为抑制剂ca
‑
074
‑
me对组织蛋白酶b的抑制作用,使得sn38始终与gflg相连接,不能进入细胞核,大部分堆积在细胞质中。此外,由于缺乏asgpr,经过gal
‑
gflg
‑
sn38处理过的siha细胞和16hbe正常细胞显示微弱的荧光。综上所述,gal
‑
gflg
‑
sn38释放sn38在hepg2或huh7细胞核内积累的过程中,asgpr和组织蛋白酶b是必须存在的。
[0060]
二、细胞毒性实验
[0061]
本实验应用sk
‑
hep1、huh7、hep3b、hepg2、hepg2 2.15、hela、siha、pc9、a549、16hbe 10种细胞,按照每孔1
×
103个细胞接种96孔板。经24h待细胞贴壁之后,更换新的培养基,设置药物载体(前述gal
‑
gflg
‑
sn38,galnac
‑
gflg
‑
sn38和glcnac
‑
gflgsn38中的一种)及游离sn
‑
38的浓度梯度为0μm、0.2μm、0.5μm、1μm、2μm、5μm、10μm、20μm,置37℃培养箱内培养96h。更换新的培养基,每孔加入10μl 5mg/ml的甲瓒(mtt)置37℃培养箱内培养4h,吸掉废液,每孔加入200μl dmso,置摇床摇晃10min,直至mtt完全溶解,置于酶联免疫检测仪上检测492nm处各孔吸光度值。
[0062]
采用mtt法测定gal
‑
gflg
‑
sn38,galnac
‑
gflg
‑
sn38和glcnac
‑
gflg
‑
sn38的抗肿瘤活性,探讨三种药物载体对细胞的杀伤作用。mtt细胞毒性结果如图2所示,从图2(a)、(b)和(c)的结果可以看出,这三种给药系统对肝癌和肺癌细胞系均表现出较强的细胞毒性。此外,除了肝癌和肺癌细胞系,glcnac
‑
gflg
‑
sn38对宫颈癌hela和siha细胞也有良好的细胞毒性。申请人发现所有的药物载体对大多数癌细胞都具有显著的抗肿瘤活性,ic
50
为0.2
‑
2μm。然而,当三种药物载体的浓度为20μm时,作为正常细胞的16hbe由于asgpr和组织蛋白酶b的表达量少,其细胞存活率在50%以上。
[0063]
在相同条件下,申请人还检测了游离sn38对癌细胞和正常细胞的抗肿瘤活性。从图2d可知,游离sn38对癌细胞和正常细胞均表现出强烈的细胞毒性,ic
50
为0.1
‑
0.2μm。从结果可以证明gal
‑
gflg
‑
sn38、galnac
‑
gflg
‑
sn38和glcnac
‑
gflg
‑
sn38与游离sn38相比,能够选择性靶向于癌细胞,减少对正常细胞的伤害。
[0064]
三、体内药代动力学研究
[0065]
将80只健康雄性icr小鼠(20
±
2g)随机分为两组(每组40只),每组再分成8个小组(每组5只)。以sn38为参照,检测gal
‑
gflg
‑
sn38的药代动力学。将sn38(10.0mg/kg)和gal
‑
gflg
‑
sn38(34.4mg/kg,相当于10.0mg/kg sn38)通过尾静脉注射作为单剂量静脉给药。在不同时间点(0.25h、0.5h、1h、2h、4h、8h、12h和24h)从静脉丛收集血样(100μl),立即与10μl 1%肝素钠混合,防止凝血。将血样离心,收集血浆部分,并置于
‑
20℃下保存,备用。所有血浆样品预处理方法如下:在100μl血浆中加入10μl is(cpt)、50μl甲酸和200μl乙腈,并涡旋混合5min,12500rpm离心10min,取上清液用高效液相色谱分析。
[0066]
icr小鼠血浆中sn38和gal
‑
gflg
‑
sn38浓度与时间的关系见图3,采用非室模型求得主要药代动力学参数见表1。与sn38相比,gal
‑
gflg
‑
sn38在血浆中的浓度更高。gal
‑
gflg
‑
sn38曲线下面积auc
(0
‑
∞)
值是sn38的6.3倍,同时半衰期(t
1/2
)明显延长,表明gal
‑
gflg
‑
sn38可显著增强药物吸收,延长体内循环时间。此外,gal
‑
gflg
‑
sn38的表观分布容积(v)明显小于sn38,说明给药后血浆中循环的活性药物浓度更高。gal
‑
gflg
‑
sn38的清除率(cl)较sn38降低1.9倍,进一步说明其结构稳定,能够延长血液循环时间,提高血药浓度,通过滞留效应和受体介导的内吞作用,使药物到达靶点。
[0067]
表1 icr小鼠静脉注射sn38和gal
‑
gflg
‑
sn38后的主要药代动力学参数
[0068][0069]
四、体内组织分布研究
[0070]
将80只健康雄性icr小鼠(20
±
2g)随机分为两组(每组40只),每组再分成8个小组(每组5只)。分别静脉注射sn38(10.0mg/kg)和gal
‑
gflg
‑
sn38(34.4mg/kg,相当于10.0mg/kg sn38),在注射后的不同时间点(0.25h、0.5h、1h、2h、4h、8h、12h和24h)处死小鼠。取心、肝、脾、肺、肾等器官,检测各组织中sn38和gal
‑
gflg
‑
sn38的含量。称取各组织0.1g,分别按1:4的比例加入生理盐水于匀浆器中,研磨并转移到离心管,置于
‑
20℃下保存,备用。所有组织样品预处理方法如下:在100μl组织样品中加入10μl is(cpt)、50μl甲酸和200μl乙腈,并涡旋混合5min,12500rpm离心10min,取上清液用高效液相色谱分析。
[0071]
sn38和gal
‑
gflg
‑
sn38在主要器官中的浓度
‑
时间变化见图4。如图4a和b所示,sn38主要分布于心脏和肺,而gal
‑
gflg
‑
sn38主要分布于肺。sn38在心脏、肝脏、脾脏、肺和肾脏的分布分别在注射药物0.25h、0.5h、8h、1h和0.25h达到峰值,而gal
‑
gflg
‑
sn38在心脏、肝脏、脾脏、肺和肾脏的分布分别在注射药物1h、0.25h、1h、0.25h和0.5h达到峰值,随后器官中的总体药物浓度随着时间而下降。与sn38相比,gal
‑
gflg
‑
sn38表现出更好的肝亲和力,且在各脏器中的药物浓度始终高于sn38,显示出更高的稳定性和载药量。
[0072]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1