一种抑制SARS-CoV-2的纳米捕集剂
一种抑制sars
‑
cov
‑
2的纳米捕集剂
技术领域
1.本发明涉及功能材料领域,尤其涉及一种抑制sars
‑
cov
‑
2的纳米捕集剂。
背景技术:
2.严重急性呼吸系统综合征冠状病毒2(sars
‑
cov
‑
2)引起了2019冠状病毒病(covid
‑
19),sars
‑
cov
‑
2病毒表面具有刺突(s)糖蛋白通过与受体细胞表面的人血管紧张素转换酶ii(hace2)结合,进入细胞并感染。 s蛋白不断地发生突变,其与hace2受体的亲和力增加,增强了感染性和传播能力。其中d614g突变株是目前sars
‑
cov
‑
2病毒的主体,d614g突变株在病毒感染过程中与hace2受体结合效率明显提高。具有大量突变基因的新型sars
‑
cov
‑
2变异株b.1.1.7,其s蛋白与hace2受体的亲和力提高了1000倍,比之前发现的sars
‑
cov
‑
2的传播能力高出70%。
3.疫苗受到广泛关注。目前,全球处于研发阶段的sars
‑
cov
‑
2疫苗有160多种,其中4种疫苗已经获得临床批准,包括 mrna疫苗(bnt162和mrna
‑
1273)、病毒载体疫苗(chadox1
‑
2)和灭活病毒疫苗(bbibp
‑
corv),它们为抗击covid
‑
19带来曙光。
4.目前的疫苗主要通过产生s蛋白表面的中和抗体来保护宿主免受感染。然而,s蛋白的突变可能会降低这些疫苗的有效性。例如,接种了moderna (mrna
‑
1273)或pfizer
‑
biontech(bnt162b2)疫苗志愿者的血清对南非突变株(b.1.351)的中和活性明显降低。另外,现有疫苗运输和存储条件苛刻,因此,仍需一种能保持纳米囊泡对假病毒的中和效率且便于运输和保存的疫苗。
技术实现要素:
5.为解决上述技术问题,本发明针对含hace2的纳米囊泡提供了合适的冻干保护剂和黏膜黏附辅料,为抑制sars
‑
cov
‑
2的可吸入型纳米捕集剂提供了更安全有效的存储方法,相对于传统保护剂可显著提升纳米囊泡对假病毒的中和效率。
6.本发明的一种抑制sars
‑
cov
‑
2的纳米捕集剂,包括含hace2的纳米囊泡,还包括冻干保护剂和黏膜黏附辅料中的一种或两种;
7.含hace2的纳米囊泡由以下步骤制备得到:
8.(1)用编码hace2的慢病毒、编码hace2的质粒或携带hace2遗传信息的阳离子脂质体转染细胞,构筑稳定表达hace2的细胞此处细胞指 293t细胞、vero细胞、l929细胞、hela细胞、dc2.4细胞、raw细胞等;
9.(2)提取步骤(1)所得细胞的细胞膜,以细胞膜为原料制备含hace2 的纳米囊泡(ncs)。
10.sars
‑
cov
‑
2病毒通过hace2受体感染宿主,本发明的含hace2的纳米囊泡与宿主细胞竞争结合sars
‑
cov
‑
2病毒来保护宿主细胞免受感染,而不是产生s蛋白表面的中和抗体,因此不受s蛋白突变的影响,对不同的病毒突变株均有效,从而提高纳米囊泡对假病毒的中和效率,实现高效治疗的目的。现有疫苗运输和存储条件苛刻,且现有疫苗生产力有限,不
能在短期满足大量接种要求。本发明针对此纳米捕集剂引入冻干保护剂和黏膜黏附辅料,冻干保护剂显著提高了纳米捕获剂储存过程中的稳定性和运输的便利性,保存较长时间后复溶,纳米囊泡的中和效价仍保持90%以上,从而大大增加了其临床应用的可行性;黏膜黏附辅料可以显著延长纳米捕获剂在肺中的滞留,增强病毒抑制作用。
11.进一步地,冻干保护剂为蔗糖,或蔗糖和乳糖,或蔗糖和海藻糖,或海藻糖和甘露醇。
12.进一步地,黏膜黏附辅料包括透明质酸或聚乙烯醇。
13.进一步地,本发明的纳米捕集剂在制备过程中,先将冻干保护剂与含 hace2的纳米囊泡混合,将得到的混合溶液冷冻干燥,最后向冻干后的粉末中加入黏膜黏附辅料,得到纳米捕集剂。
14.进一步地,在步骤(1)中,用嘌呤霉素筛选稳定表达hace2的293t 细胞。
15.进一步地,在步骤(2)中,通过微型脂质体挤出器制备含hace2的纳米囊泡。
16.进一步地,含hace2的纳米囊泡的粒径为100
‑
400nm。
17.进一步地,纳米捕集剂的剂型为粉末剂型或气溶胶剂型。超纯水复溶的冻干粉可通过喷鼻瓶制备可吸入的气溶胶剂型。
18.进一步地,含hace2的纳米囊泡和冻干保护剂的质量比为0.2
‑
5:1,其中,hace2跨膜蛋白和冻干保护剂的质量浓度比为1:25
‑
100。
19.进一步地,含hace2的纳米囊泡和黏膜黏附辅料的质量比为0.2
‑
5:1
‑
5。
20.本发明的还要求保护上述纳米捕集剂在制备保护肺组织免受 sars
‑
cov
‑
2病毒感染的药物中的应用。通过吸入纳米捕集剂/冻干保护剂/ 黏膜黏附辅料气溶胶,可以无创、高效地保护肺组织免受sars
‑
cov
‑
2假病毒的感染。
21.借由上述方案,本发明至少具有以下优点:
22.本发明的纳米捕集剂安全性高,易于存储与运输,成本低廉,能够快速量产,以便及时、有效的应对频繁出现的突变毒株,具有良好的临床转化前景。
23.上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细附图说明如后。
附图说明
24.为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明。
25.图1为实施例1制备的hace2
‑
293t细胞与阴性对照293t细胞的蛋白印迹结果图(1a)和ncs的透射电子显微图(1b);
26.图2为hace2
‑
293t细胞提取的纳米囊泡与阴性对照293t细胞提取的纳米囊泡对假病毒的中和曲线图;
27.图3为不同黏膜黏附辅料与ncs混合后ncs的滞留时间和滞留部位对比图;
28.图4为ncs包含不同冻干保护剂的粉末剂型复溶后的粒径和电位图;
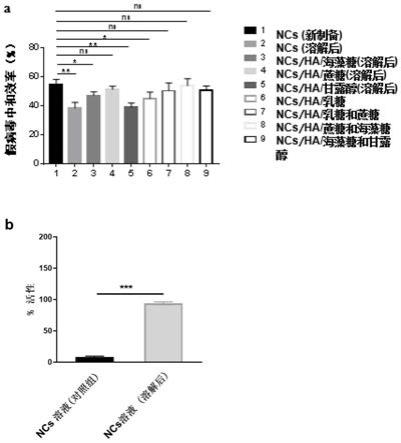
29.图5为不同冻干保护剂与ncs混合溶液对假病毒的中和效果图;
30.图6为小鼠肺组织hace2的表达情况图;
31.图7为小鼠肺组织的luci表达情况图;
32.图8为ncs/ha/蔗糖在体内的生物安全性结果图;
33.图9为实施例2制备的ncs的透射电镜图;
34.图10为加入ha后冻干得到的纳米囊泡冻干粉复溶时的结果。
具体实施方式
35.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
36.实施例1
37.表面含有hace2纳米囊泡(ncs)的制备
38.首先,利用编码跨膜蛋白hace2的慢病毒转染人胚胎肾上皮细胞293t 细胞,与2μg/ml嘌呤霉素共孵育构筑稳定表达hace2的293t(hace2
‑
293t) 细胞。其次,用胰蛋白酶消化收集hace2
‑
293t细胞,并用含有0.25m蔗糖,1mm edta,10mm hepes(ph 7.4)和蛋白酶抑制剂的均质培养基重悬。在冰浴下用功率为200w的超声仪破坏细胞。然后,将悬浮液以3000rpm 离心10min以去除细胞核和细胞质。所得的细胞膜用冷的均质培养基洗涤两次。之后,以14800rpm离心30min收集细胞膜。最后,使用微型脂质体挤出器将所得悬浊液依次挤出400nm、200nm聚碳酸酯多孔膜各10次。结果见图1。
39.图1a为hace2
‑
293t细胞与阴性对照293t细胞的蛋白印迹结果图(以β
‑
actin蛋白为内参,确保蛋白上样量一致),该图表明hace2
‑
293t细胞表面表达大量的hace2,具有中和新冠病毒的潜力;图1b为实施例1制备的纳米囊泡的透射电子显微图,从图中可见成功制备表面含有hace2,粒径200nm左右的ncs。
40.实施例2
41.首先,利用编码跨膜蛋白hace2的慢病毒转染hela细胞,与2μg/ml 嘌呤霉素共孵育构筑稳定表达hace2的hela(hace2
‑
hela)细胞。其次,用胰蛋白酶消化收集hace2
‑
hela细胞,并用含有0.25m蔗糖,1mm edta, 10mm hepes(ph 7.4)和蛋白酶抑制剂的均质培养基重悬。在冰浴下用功率为200w的超声仪破坏细胞。然后,将悬浮液以3000rpm离心10min以去除细胞核和细胞质。所得的细胞膜用冷的均质培养基洗涤两次。之后,以 14800rpm离心30min收集细胞膜。最后,使用微型脂质体挤出器将所得悬浊液依次挤出400nm、200nm聚碳酸酯多孔膜各10次,得到含hace2的纳米囊泡,图9为本实施例制备的纳米囊泡的透射电镜图。
42.发明人又尝试了其他细胞通过慢病毒转染表达hace2,然后通过相似的方法制备得到表面含有不同hace2的纳米囊泡。慢病毒转染不同细胞的效率不同,优选实施例1中293t细胞,其转染效率更高。但,本发明中的纳米囊泡可来自于不同细胞,以相应的得到特异性的纳米囊泡。
43.实施例3
44.含hace2纳米囊泡(ncs)的体外病毒中和能力
45.所使用的基于水泡性口炎病毒(vsv)的假病毒,包含sars
‑
cov
‑
2病毒s蛋白并携带荧光素酶(luci)报告基因。通过观察hace2
‑
293t细胞的感染情况评估ncs对假病毒的中和能力。首先,将hace2
‑
293t细胞以104个细胞/孔的密度接种于96孔板中,培养16h。其次,将不同浓度的ncs(50μl) 与等体积的假病毒(500tcid
50
)在37℃下孵育1h,然后将混合溶液转移到单层hace2
‑
293t中感染48小时。最后,统计细胞裂解液中荧光素酶的荧光强度,计算中
和效率。中和效率(%)=[1
–
[(样品的荧光强度值
–
背景荧光强度值的平均值)/(仅对照病毒荧光强度值的平均值
–
背景荧光强度值的平均值)]]
×
100%。tcid
50指
半数组织培养感染剂量。结果见图2。
[0046]
图2是hace2
‑
293t细胞提取的纳米囊泡ncs与阴性对照293t细胞提取的纳米囊泡nvs对假病毒的中和曲线,横轴为半抑制浓度ic
50
值(单位为μg/ml),纵轴为中和效率。可见与nvs对比,ncs表现出强大的假病毒中和能力,其半抑制浓度ic
50
值为9.8μg/ml。
[0047]
实施例4
[0048]
黏膜黏附辅料增强ncs的肺部滞留
[0049]
首先,选取三种黏膜黏附辅料聚乙烯醇(pva)、聚乙烯醇吡咯烷酮(pvp)、透明质酸(ha)、环糊精(cd)、壳聚糖(cs)和聚赖氨酸(pll)(1mg/ml) 分别与菁染料cy5.5标记的ncs(2mg/ml)混合。然后,将小鼠气麻,使用可雾化的气溶胶装置吸入50ul以上混合溶液,打开小鼠口腔,将雾化针头伸置小鼠支气管口处,喷出包含ncs和辅料的气溶胶。最后,在吸入给药后的不同时间点观察并统计主要器官的荧光强度。结果见图3。
[0050]
图3a是小鼠吸入不同辅料与ncs的混合物,肺组织在6和24h的荧光强度统计图。其中吸入ncs/ha的小鼠肺组织在不同时间点均显示最强的荧光强度值,其肺部治疗效果最好,吸入ncs/pva、ncs/cs和ncs/pll的小鼠肺部治疗效果也显著优于吸入ncs/pvp和ncs/cd;图3b是小鼠吸入不同辅料与ncs的混合物后不同时间点ncs在各主要器官的生物分布,从图中可知ha、pva、cs和pll可显著延长ncs在主要器官中的滞留时间;图3c进一步显示小鼠吸入不同辅料与ncs的混合物后,不同时间点ncs 在肺、肝、脾、肾、心等器官中的生物分布,荧光强度统计图表明,相对于其他器官,肺组织在不同时间点均具有最强的荧光信号,进一步表明ha、 pva、cs和pll均延长了ncs肺部滞留时间,提高了生物利用度;图3d 为给药完成后的小鼠存活率,图中显示,阳离子的cs、pll的毒性很大,虽然具有较好的治疗效果,但是不适于实际应用,综上ha治疗效果好且安全,pva次之。
[0051]
实施例5
[0052]
ncs粉末剂型的制备
[0053]
选取冻干保护剂蔗糖、海藻糖、甘露醇、乳糖及其混合物来制备ncs 粉末剂型。首先,制备ncs(2mg/ml)和冻干保护剂(2.5mg/ml)的混合溶液。其次,将混合溶液(1ml)置于液氮中10min快速冻干并使用冻干机冷冻干燥24h。冻干后的粉末中加入ha粉末(2.5mg),于4℃保存。使用时用分子生物级超纯水溶解,并安装配套的喷鼻头,喷出含ncs的气溶胶。相关结果见图4。
[0054]
图4a为纳米囊泡与不同冻干保护剂冻干复溶后的粒径和电位图。其中,从粒径来看,对照组和甘露醇组的ncs溶于水后尺寸增大,出现明显的聚集,乳糖组的ncs溶于水后尺寸变小,其他组的尺寸无明显变化,说明采用这些冻干保护剂冻干复溶后的囊泡均一性较好;从电位来看,其他组ncs 的大小和zeta电位基本保持不变;图4b为冻干粉使用的样品示意图。用水溶解含ncs的冻干粉,安装喷鼻头随即喷出气溶胶。该冻干粉剂型有利于长期存储和运输。
[0055]
在实验中发现,如果加入ha之后进行冻干,冻干产物不能很好的复溶,出现肉眼可见的颗粒团聚,如图10所示,因此只能在冻干得到纳米囊泡的冻干粉后混合ha固体粉末,并在使用时溶解,才能达到理想的喷雾制剂效果。这与常规的冻干粉制剂制备思路不同,实际
生产中,冻干粉制剂在最后步骤进行冻干和封装,能更有利于控制冻干粉中的含水量等参数指标,而这种思路不适用于本发明,为了更好的得到冻干粉制剂,必须在纳米囊泡与冻干保护剂混合冻干后,再与干燥的辅料混合,以得到可用的制剂。
[0056]
实施例6
[0057]
ncs粉末剂型的体外中和能力
[0058]
首先,将实施例4中制备的冻干粉用生物级超纯水溶解,按照实施例2 中的方法将不同浓度的稀释液与假病毒进行中和,计算中和效率。然后,将新鲜制备的ncs溶液与优化的ncs/ha/蔗糖冻干粉置于4℃冰箱保存1个月后复溶,同样条件下进行假病毒中和实验。相关结果见图5。
[0059]
图5a为不同冻干保护剂与ncs混合溶液对假病毒的中和效果图。假病毒中和效率作为最重要的指标,假病毒中和效率越高,视为冻干保护效果越好,从图中可知,ncs/ha/蔗糖组、ncs/ha/乳糖和蔗糖、ncs/ha/蔗糖和海藻糖、ncs/ha/海藻糖和甘露醇组与新制备的纳米囊泡效率无明显差异,均保持较高的水平;图5b为ncs溶液与优化的ncs/ha/蔗糖冻干粉4℃保存一个月后对假病毒的中和效果图。复溶后的ncs的效价保留了大约90%。该结果表明ncs/ha/蔗糖冻干粉较好的保留了ncs的病毒中和能力。
[0060]
综合图4和图5的结果,ncs/ha/蔗糖组、ncs/ha/乳糖和蔗糖、ncs/ha/ 蔗糖和海藻糖、ncs/ha/海藻糖和甘露醇这四种组合可大大提升对纳米囊泡的保护作用。
[0061]
实施例7
[0062]
hace2小鼠模型的建立
[0063]
麻醉雄性的免疫缺陷的nsg小鼠,通过支气管给予编码hace2的复制缺陷型腺病毒(adv
‑
hace2)(1x1010 pfu,50μl)使小鼠肺组织表达hace2,建立表达hace2的小鼠模型。5天后,将小鼠肺组织取出,部分用于制备单细胞悬浮液进行hace2流式抗体染色,另一部分制备细胞裂解液通过蛋白质印迹法检测hace2的表达。结果见图6。
[0064]
图6为小鼠肺组织hace2的表达情况,其中,adv
‑
empty表示不携带遗传信息的复制缺陷型腺病毒。图6a的流式结果图与图6b的蛋白印迹结果图均说明编码hace2的adv成功诱导了小鼠肺组织中hace2的表达。以上结果表明hace2小鼠模型成功建立。
[0065]
实施例8
[0066]
可吸入ncs在体内抑制病毒感染的能力
[0067]
利用hace2小鼠模型评估实施例4中优化的ncs/ha/蔗糖在体内抑制病毒感染的能力。将表达hace2的小鼠分为三组,分别吸入50μl磷酸盐缓冲液(pbs)、ncs/蔗糖和ncs/ha/蔗糖,并于4h和8h后吸入两次编码luci的含有sars
‑
cov
‑
2病毒s蛋白外壳的假病毒。小鼠肺组织的luci 表达情况见图7。
[0068]
图7a流式细胞结果中,pbs对照组、ncs/蔗糖和ncs/ha/蔗糖组的luci 阳性细胞百分比分别为6.5%,2.1%和0%;图7b蛋白质印迹分析中pbs 组的luci表达量最高。以上结果说明吸入含hace2的ncs和ha通过延长肺部滞留,在表达hace2的小鼠模型中表现出有效的假病毒抑制作用。
[0069]
实施例9
[0070]
可吸入ncs体内的生物安全性
[0071]
吸入较高剂量的ncs/ha/蔗糖(ncs膜蛋白质量为200μg),在第1 天和7天收集小鼠
血清和全血样品进行血清生物化学和全血分析。通过 elisa试剂盒确定小鼠血清中炎性细胞因子(肿瘤坏死因子α,白介素6,白介素12)的浓度。ncs/ha/蔗糖在体内的生物安全性结果见图8。
[0072]
图8a表明所有的血液标志物与pbs治疗组均无显著差异;图8b血清炎性细胞因子的浓度均处于基线水平。所有这些结果表明,ncs/ha/蔗糖复合物具有优异的生物相容性。
[0073]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1