一种用于慢传输型便秘的药物组合物及制备方法和应用
1.本发明涉及医药发明领域,具体涉及一种用于慢传输型便秘的药物组合物及制备方法和应用。
背景技术:
2.慢传输型便秘是指非器质性的便秘,由于大肠功能紊乱,传导失常而导致排便周期延长和排便困难,属于慢性、原发性、功能性、结肠性和传输缓慢性便秘。
3.慢传输型便秘引起原因:主要由于工作压力较大,大部分人饮食生活没规律,长期不良的生活习惯,比如居无规律、饮食过于精细、减肥、节食、缺少锻炼导致肠道受刺激不足,排便动作缺乏,粪便在肠腔内滞留时间过久,肠蠕动缓慢,需要两天,甚至是三天的时间,才能够把食物残渣运送到直肠,然后,患者才会有排便的意识。有报道称慢传输型病例可以占到便秘患者的16%到40%左右而引发的便秘。长期慢传输型便秘易导致痔疮、直肠脱垂、结肠炎、肠梗阻、结肠癌等病的发生。
4.慢传输型便秘是指由已知原因或未知原因,造成的以炎性改变及功能紊乱为主的便秘。临床表现以腹痛、腹泻、肠鸣、下坠、大便带粘液或脓血,也有便秘或干稀交替出现,病程缠绵、反复发作为特点。由于消化功能紊乱、营养来源不足,患者可出现消瘦、贫血、乏力甚至衰弱。严重者常并发肠道大出血、肠穿孔。慢性结肠炎、肠易激综合征的病程较长,因此,治疗起来比较困难,无特效药物,西医对此病主要运用抗生素进行消炎止痛,抗感染治疗,副作用大;目前,虽然治疗慢传输型便秘的中药较多,但均存在治疗效果欠佳的问题。
5.申请号cn201310348797.x,发明名称为一种治疗便秘的中药及其制备方法与应用,公开了一种治疗便秘的中药及其制备方法与应用,由以下质量份数的原料药制成:附子25
‑
35份;肉桂5
‑
15份;淫羊藿15
‑
25份;厚朴10
‑
20份;薤白15
‑
25份;葛根25
‑
35份;茯苓15
‑
25份;肉桂经提取挥发油,经β
‑
环糊精包合得包合物,其他中药使用乙醇回流,制备成制剂,具有治疗便秘的作用,特别是针对脾肾阳虚型便秘。
6.申请号cn201510853695.2,发明名称为一种治疗慢性便秘的药物及其制备方法,本发明公开了一种治疗慢性便秘的药物及其制备方法,包括玄参、麦冬、升麻、枳实、熟附子、炒莱菔子、肉苁蓉、生白术、当归、木香、沉香、火麻仁、柏子仁、何首乌、乌药、鱼腥草、生黄芪、厚朴、酒大黄、肉桂、玉竹、大腹皮、金银花、连翘、威灵仙、猪牙皂等多味中草药。按配方药物干燥后,打粉机;以药粉的重量按1∶1.2
‑
1.5的比例加入炼蜜,制成丸剂。本发明药物具有益气养血,清热除燥,润肠通便之功效,本发明用于治疗慢性便秘尤其是老年慢性便秘疗效显著,且用药安全,无副作用。
7.申请号cn200710116230.4,发明名称为一种治疗便秘的纯中药制剂,本发明公开了一种治疗便秘的纯中药制剂,依据中国中医中药的精华,经过多年的尝试、论证,精选二十多种中草药,对于便秘的主要临床症状:大便次数多、大便干燥、成羊粪蛋症状都有良好的治疗效果,本中药制剂选用以下中药:火麻仁、糯米、杜仲、桑椹、白石英、大黄、附子、川乌、白升麻、玉竹、厚朴、琥珀、番泄叶、芒硝、玄参、兰花参、木香、乌药、肉桂、芦荟叶、柴胡、
冬瓜、天雄、干地黄、白花蛇叶、生何首乌,本中药制剂制备非常方便,而且治疗费用低,因而,具有较好的社会效益和经济价值。
8.以上专利存在的技术问题:1)药味较多,制备方法复杂,成本高,不利于工业化生产;2)服用后,粪便数量及含水量均无明显变化,未从根本上解决病因;3)服用后,对结肠内血清及结肠5-ht水平的影响不大;4)治疗时间长,效果不佳。
9.为了解决以上问题,发明团队根据附子、肉桂的性质,结合便秘产生的因素及动力学的因素,研究出了一种用于慢传输型便秘的药物组合物,从根本上解决结肠的病因,且该药物对stc大鼠粪便数量及含水量的影响、对stc大鼠碳末推进率的影响、对stc大鼠血清及结肠5-ht水平的影响方面均有积极的作用,有利于便秘的治疗。
技术实现要素:
10.本发明的目的是提供一种用于慢传输型便秘的药物组合物。
11.本发明的另一目的是提供一种用于制备慢传输型便秘药物的制备方法。
12.本发明的另一目的是提供一种药物组合物在制备治疗慢传输型便秘药物药物方面的应用。
13.本发明提供一种用于慢传输型便秘的药物组合物,其特征在于,该药物组合物由附子、肉桂组成。
14.本发明所述原料优选由以下重量份的药物组成:附子1
‑
2份、肉桂0.5
‑
1份。
15.优选的,本发明所述原料由以下重量份的药物组成:附子2份、肉桂1份。
16.本发明所述药物组合物的制备方法为:
17.1)分别取附子、肉桂,加清水浸泡20
‑
40分钟;
18.2)取浸泡后的附子,加12
‑
16倍的水煎煮50
‑
90分钟后,加入浸泡后的肉桂,再煎煮20
‑
50分钟,过滤,滤液备用;
19.3)取过滤残渣,加8
‑
12倍的水,再煎煮20
‑
40分钟,过滤,滤液备用;
20.4)合并滤液,95
‑
105℃浓缩至每毫升药液含原生药为1g的药液,再加入药学上可接受的辅料制成药学上可接受的制剂。
21.优选的,
22.本发明所述药物组合物的制备方法为:
23.1)分别取附子、肉桂,加清水浸泡25
‑
35分钟;
24.2)取浸泡后的附子,加13
‑
15倍的水煎煮55
‑
80分钟后,加入浸泡后的肉桂,再煎煮30分钟,过滤,滤液备用;
25.3)取过滤残渣,加9
‑
11倍的水,再煎煮25
‑
30分钟,过滤,滤液备用;
26.4)合并滤液,96
‑
103℃浓缩至每毫升药液含原生药为1g的药液,再加入药学上可接受的辅料制成药学上可接受的制剂。
27.进一步优选的,
28.1)分别取附子、肉桂,加清水浸泡30分钟;
29.2)取浸泡后的附子,加14倍的水煎煮60分钟后,加入浸泡后的肉桂,再煎煮30分钟,过滤,滤液备用;
30.3)取过滤残渣,加10倍的水,再煎煮25分钟,过滤,滤液备用;
31.4)合并滤液,100℃浓缩至每毫升药液含原生药为1g的药液,再加入药学上可接受的辅料制成药学上可接受的制剂。
32.本发明所述辅料为淀粉、滑石粉、炼蜜、单糖浆、氢氧化钠、氢氧化钠、苯甲酸钠、蔗糖中的一种或几种。
33.本发明所述制剂为固体制剂或液体制剂;所述固体制剂为颗粒剂、胶囊剂、片剂、丸剂;所述液体制剂为口服液、汤剂。
34.本发明所述药物组合物在制备治疗慢传输型便秘药物方面的应用。
35.本发明所述的重量份可以是本领域的常规单位,可以是g、kg等。
36.有益效果
37.1、本发明药物组合物制备方法简单,成本低,利于工业化生产。
38.2、本发明通过造模药物制备,分别对大鼠进食情况、大鼠皮毛光泽、活动范围、进食量及大鼠体质量的变化;大鼠粪便观察;活性炭推进试验;结肠残留粪便数;血清等进行了检测,并通过统计学分析,证明本发明药物对结肠的病症的有效性。
39.3、通过对stc大鼠大鼠粪便数量及含水量的影响的实验,结果显示正常组造模前后粪便数量及含水量均无明显变化,与造模前的比较,附子配肉桂1组、附子配肉桂2组、附子组、肉桂组、莫沙必利组、模型组较造模期粪便数量及含水量均明显降低(p<0.05);与造模期比较,附子配肉桂1组、附子配肉桂2组、附子组、肉桂组、莫沙必利组大鼠粪便数量及含水量均明显升高(p<0.05),模型组治疗后无明显变化,无统计学意义。与正常组治疗期比较,模型组大鼠粪便数量及含水量均明显降低,有统计学意义(p<0.05);与模型组治疗期比较,附子配肉桂1组、附子配肉桂2组、附子组、肉桂组、莫沙必利组大鼠粪便数量及含水量均明显升高。
40.4、通过对stc大鼠碳末推进率的影响的实验,结果显示与正常组比较,模型组大鼠碳末推进率降低(p<0.05);与模型组比较,附子配伍肉桂低中、高剂量组、莫沙必利组大鼠碳末推进率升高。
41.5、通过对stc大鼠血清及结肠5-ht水平的影响的实验,结果显示与空白对照组比较,模型组血清5-ht含量明显升高(p>0.05);给药后,与模型组比较,附子肉桂2组血清5-ht含量明显降低(p<0.05),其余各给药组血清5-ht含量均无明显改变。与空白对照组比较,模型组结肠组织5-ht含量明显升高(p<0.05);给药后,与模型组比较,各给药组结肠组织5-ht含量均无明显改变,但附子肉桂1组给药组有降低结肠组织5-ht的趋势。
具体实施方式
42.以下实施例用于说明本发明,但不用来限制本发明的范围。
43.实施例1
44.组方:附子1000g、肉桂500g。
45.实施例2
46.组方:附子2000g、肉桂1000g。
47.实施例1
‑
2的组方分别按以下任一种制备方法制备。
48.实施例3
49.1)分别取附子、肉桂,加清水浸泡30分钟;
50.2)取浸泡后的附子,加14倍的水煎煮60分钟后,加入浸泡后的肉桂,再煎煮30分钟,过滤,滤液备用;
51.3)取过滤残渣,加10倍的水,再煎煮30分钟,过滤,滤液备用;
52.4)合并滤液,100℃浓缩至每毫升药液含原生药为1g的药液,加苯甲酸钠2g及蔗糖15g,灌封,灭菌,即得汤剂。
53.实施例4
54.1)分别取附子、肉桂,加清水浸泡20分钟;
55.2)取浸泡后的附子,加12倍的水煎煮50分钟后,加入浸泡后的肉桂,再煎煮20分钟,过滤,滤液备用;
56.3)取过滤残渣,加8倍的水,再煎煮25分钟,过滤,滤液备用;
57.4)合并滤液,95℃浓缩至每毫升药液含原生药为1g的药液,加苯甲酸钠2g及蔗糖15g,灌封,灭菌,即得汤剂。
58.实施例5
59.1)分别取附子、肉桂,加清水浸泡40分钟;
60.2)取浸泡后的附子,加16倍的水煎煮90分钟后,加入浸泡后的肉桂,再煎煮50分钟,过滤,滤液备用;
61.3)取过滤残渣,加12倍的水,再煎煮40分钟,过滤,滤液备用;
62.4)合并滤液,105℃浓缩至每毫升药液含原生药为1g的药液,加苯甲酸钠2g及蔗糖15g,灌封,灭菌,即得汤剂。
63.实施例6
64.1)分别取附子、肉桂,加清水浸泡30分钟;
65.2)取浸泡后的附子,加14倍的水煎煮60分钟后,加入浸泡后的肉桂,再煎煮30分钟,过滤,滤液备用;
66.3)取过滤残渣,加10倍的水,再煎煮30分钟,过滤,滤液备用;
67.4)合并滤液,98℃浓缩至每毫升药液含原生药为1g的药液,再加入淀粉500g,混合均匀,20目筛制粒,80℃干燥1h,整粒,即得颗粒剂。
68.实施例7
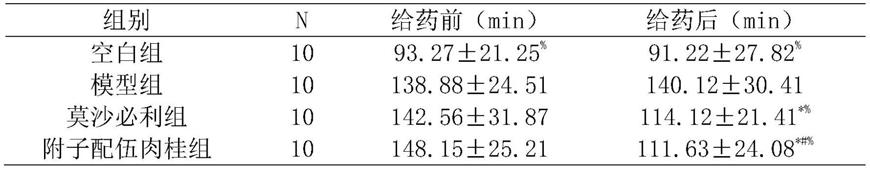
69.1)分别取附子、肉桂,加清水浸泡30分钟;
70.2)取浸泡后的附子,加14倍的水煎煮60分钟后,加入浸泡后的肉桂,再煎煮30分钟,过滤,滤液备用;
71.3)取过滤残渣,加10倍的水,再煎煮30分钟,过滤,滤液备用;
72.4)合并滤液,96℃浓缩至每毫升药液含原生药为1g的药液,加入淀粉500g和5%淀粉浆,制粒,干燥,制片,得片剂。
73.实施例8
74.1)分别取附子、肉桂,加清水浸泡30分钟;
75.2)取浸泡后的附子,加14倍的水煎煮60分钟后,加入浸泡后的肉桂,再煎煮30分钟,过滤,滤液备用;
76.3)取过滤残渣,加10倍的水,再煎煮30分钟,过滤,滤液备用;
77.4)合并滤液,100℃浓缩至每毫升药液含原生药为1g的药液,加入淀粉300g和
0.5%滑石粉,混合均匀,烘干,粉碎,装入胶囊壳中,得胶囊剂。
78.实施例9
79.1)分别取附子、肉桂,加清水浸泡30分钟;
80.2)取浸泡后的附子,加14倍的水煎煮60分钟后,加入浸泡后的肉桂,再煎煮30分钟,过滤,滤液备用;
81.3)取过滤残渣,加10倍的水,再煎煮30分钟,过滤,滤液备用;
82.4)合并滤液,99℃浓缩至每毫升药液含原生药为1g的药液,加入淀粉500g,烘干制成粉末,再每100g粉末加炼蜜100g制成丸剂。
83.实施例10
84.1)分别取附子、肉桂,加清水浸泡30分钟;
85.2)取浸泡后的附子,加14倍的水煎煮60分钟后,加入浸泡后的肉桂,再煎煮30分钟,过滤,滤液备用;
86.3)取过滤残渣,加10倍的水,再煎煮30分钟,过滤,滤液备用;
87.4)合并滤液,96℃浓缩至每毫升药液含原生药为1g的药液,加单糖浆100ml、0.3%苯甲酸钠,以10%氢氧化钠溶液调节ph值至7.2,搅匀,静置,滤过,灌封,灭菌,即得口服液。
88.为了进一步验证本发明的有效性,发明进行了一系列的验证试验,具体如下:
89.1.制备方法的确认
90.1.1组合物比例的来源
91.根据叶强等对附子配伍肉桂对附子总生物碱与酯型生物碱的影响研究发现,附子配肉桂以1:0.5比例的功效调控最为全面,不仅可以增加总生物碱,并且最大程度降低酯型生物碱,较好保留了附子有效成分含量。故选择附子:肉桂为1:0.5的比例。
92.1.2制备方法
93.分别取附子、肉桂,加清水浸泡30分钟;取浸泡后的附子,加14倍的水煎煮60分钟后,加入浸泡后的肉桂,再煎煮30分钟,过滤,残渣加10倍的水,再煎煮25分钟,过滤,合并滤液,100℃浓缩为1:1(即每毫升药液含原生药1g)药液,4℃保存备用。
94.2.实验方法
95.2.1实验动物
96.选用体重200
±
20g的spf级雄性sd大鼠60只,由成都里来生物科技公司提供。
97.2.2药物制备
98.2.2.1造模药物制备
99.复方地芬诺酯混悬液:复方地芬诺酯片用生理盐水稀释成0.1g
·
l
‑
1的混悬液,现用现配。
100.活性炭:杭州木材总厂。
101.电热恒温鼓风干燥机:上海博泰设备有限公司。
102.电子天平:苏州赛恩斯仪器公司。
103.2.2.2供试药物制备
104.枸橼酸莫沙必利混悬液:枸橼酸莫沙必利片用蒸馏水稀释成0.2g
·
l
‑
1混悬液,现用现配。
105.选择四川江油产地附子,广西产地肉桂,按“1.2”项下的制备方法制备药液。
106.2.2.3分组及建立模型
107.60只大鼠适应性喂养1周后,随机分为空白组、附子配肉桂、附子组、肉桂组、莫沙必利组、模型组。共6组,n=10只/组。除空白组外,其余各组按照每天10mg
·
kg-1复方地芬诺酯混悬液进行灌胃,连续灌胃21d,制备stc模型,造模期间每天记录各组大鼠一般情况、体质量、粪便粒数及粪便干湿质量。
108.2.2.4给药方法
109.空白组及模型组给予10ml/(kg
·
d)
‑
10.9%氯化钠溶液灌胃,每日1次,连续20d;附子配肉桂组、附子组、肉桂组分别给予确定剂量的相应中药水煎浓缩液灌胃,每日1次,连续20d。枸橼酸莫沙必利组给予10ml/(kg
·
d)
‑
1枸橼酸莫沙必利混悬液灌胃,每日1次,连续20d。
110.2.2.5指标检测
111.(1)一般情况:每天观察大鼠进食情况,大鼠皮毛光泽、活动范围、进食量及大鼠体质量的变化。
112.(2)大鼠粪便观察:各组大鼠造模前、造模后及治疗结束后分别观察大鼠粪便,并对每组大鼠粪便粒数做一记录,同时观察大便性状,测定其含水率。用电热恒温培养箱90℃烘干粪便,分别记录烘干前后大鼠粪便重量,计算粪便含水率。
113.粪便含水率=(湿粪质量-干粪质量)/湿粪质量
×
100%
114.(3)活性炭推进试验:活性炭末混悬液的制备:称取食用藕粉15g,加100ml水煮沸至溶液透明,再称取活性炭末5g,加入上述溶液搅拌均匀并煮沸,制成质量浓度5%的活性炭混悬液,低温冷藏备用。方法:各组大鼠在治疗结束后,均禁食不禁水24h,用制备的活性炭混悬液10ml
·
kg-1灌胃,灌胃后放入笼内活动,30min后立即采用颈椎脱臼方法处死大鼠。大鼠处死后立即剪开腹壁,游离并摘除从幽门到直肠末端的全部肠道,在无张力状态下置于测量台上,测量活性炭在肠道内的推进长度,以及肠道全长,计算活性炭推进率。
115.活性炭推进率=炭末向前推进长度/肠道全长
×
100%
116.结肠残留粪便数:计数每只大鼠结肠内残留粪便数。
117.(5)血清:股动脉血静置30min,3000rpm离心10min,取血清100ul,
‑
20℃冰箱保存待测5
‑
ht;剖取结肠组织,4℃生理盐水冲洗干净,称取0.5g,用生理盐水制成10%匀浆,3000rpm离心10min,取上清100ul,
‑
20℃冰箱保存,用于5
‑
ht的检测;
118.(6)统计学分析
119.计量资料以均数
±
标准差表示,应用spss17.0统计分析软件对数据进行分析处理,组间采用单因素方差分析(one
‑
wayanova)进行比较,以p﹤0.05为差异有统计学意义。
120.3.实验结果
121.3.1对stc大鼠大鼠粪便数量及含水量的影响
122.正常组造模前后粪便数量及含水量均无明显变化,与造模前比较,附子配肉桂组、附子组、肉桂组、莫沙必利组、模型组较造模期粪便数量及含水量均明显降低(p<0.05);与造模期比较,附子配肉桂组、附子组、肉桂组、莫沙必利组大鼠粪便数量及含水量均明显升高(p<0.05),模型组治疗后无明显变化,无统计学意义。与正常组治疗期比较,模型组大鼠粪便数量及含水量均明显降低,有统计学意义(p<0.05);与模型组治疗期比较,附子配肉
桂组、附子组、肉桂组、莫沙必利组大鼠粪便数量及含水量均明显升高,见表1、表2、表3。
123.表1治疗前后各组大鼠首粒黑便排出时间比较
[0124][0125][0126]
表2附子肉桂药物组合水煎液对stc大鼠不同时间段排便数量的影响
[0127][0128]
注:与同组前一时间点比较1)p<0.05;与正常组比较2)p<0.05;与模型组比较p<0.05。
[0129]
表3附子肉桂药物组合水煎液对stc大鼠不同时间段粪便含水率变化的影响
[0130][0131]
注:与同组前一时间点比较1)p<0.05;与正常组比较2)p<0.05;与模型组比较3)p<0.05。
[0132]
3.2对stc大鼠碳末推进率的影响
[0133]
与空白组动物相比,模型组动物炭末推进率减少,有极其显著差异(p<0.01);与模型组动物相比,治疗组大鼠炭末推进率增加,有极其显著差异(p<0.01),见表4。
[0134]
表4附子肉桂药物组合水煎液对stc大鼠碳末推进率的影响
[0135][0136]
注:模型组与空白组相比,**p<0.01;其余组与模型组相比,##p<0.01。
[0137]
3.3对stc大鼠血清及结肠5-ht水平的影响
[0138]
与空白组相比,模型组大鼠血清中5
‑
ht浓度明显降低差异,差异极显著(p<0.01)。与模型组相比,附子配肉桂组、莫沙必利组大鼠血清中5
‑
ht浓度明显升高,差异极显著(p<0.01);附子组大鼠血清中5
‑
ht浓度升高,差异显著(p<0.05);其余各组大鼠血清中5
‑
ht浓度差异不显著,不具备统计学意义。与空白组相比,模型组大鼠结肠匀浆中5
‑
ht浓度明显降低差异,差异极显著(p<0.01)。与模型组相比,附子配肉桂组、附子组、莫沙必利组大鼠结肠匀浆中5
‑
ht浓度明显升高,差异极显著(p<0.01);其余各组大鼠结肠匀浆中5
‑
ht浓度差异不显著,不具备统计学意义。结果见表5。
[0139]
表5附子肉桂药物组合水煎液对stc大鼠血清及结肠5-ht水平的影响
[0140]
组别n(只)血清5
‑
ht水平/ng/ml结肠5
‑
ht水平/ng/ml正常109.059
±
1.5693.492
±
0.310模型105.374
±
1.545**1.738
±
0.505**附子肉桂组108.090
±
1.319##3.273
±
0.363##附子组107.380
±
0.840#2.816
±
0.389##肉桂组106.644
±
1.0992.089
±
0.291莫沙必利组108.255
±
0.939##3.178
±
0.215##
[0141]
注:模型组与空白组相比,*p<0.05,**p<0.01;其余组与模型组相比,#p<0.05,##p<0.01;
[0142]
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作出一些修改或改进,这对本领域技术人员而言是显而易见的,因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1