单环单萜类化合物在制备抗老年痴呆药物中的应用
reviews,2012,112(10):5193-239.
8.[2]dong s,duan y,hu y,et al.advances in the pathogenesis of alzheimer's disease:a re-evaluation of amyloid cascade hypothesis[j].translational neurodegeneration,2012,1(1):18.
[0009]
[3]bartus r t,dean r l,beer b,et al.the cholinergic hypothesis of geriatric memory dysfunction[j].science,1982,217(4558):408-14.
[0010]
[4]hardy j a,higgins g a.alzheimer's disease:the amyloid cascade hypothesis[j].science,1992,256(5054):184-5.
[0011]
[5]nortley r,korte n,izquierdo p,et al.amyloid beta oligomers constrict human capillaries in alzheimer'sdisease via signaling to pericytes[j].science,2019,365(6450):250.
[0012]
[6]zhou r,yang g,guo x,et al.recognition of the amyloid precursor protein by human gamma-secretase[j].science,2019,363(6428):708.
[0013]
[7]zott b,simon m m,hong w,et al.a vicious cycle of beta amyloid-dependent neuronal hyperactivation[j].science,2019,365(6453):559-65.
[0014]
[8]eikelenboom p,veerhuis r.the importance of inflammatory mechanisms for the development of alzheimer’s disease[j].experimental gerontology,1999,34(3):453-61.
[0015]
[9]scorziello a,borzacchiello d,sisalli m j,et al.mitochondrial homeostasis and signaling in parkinson’s disease[j].frontiers in aging neuroscience,2020,12:100.
[0016]
[10]panes j d,godoy p a,silva-grecchi t,et al.changes in pgc-1a/sirt1 signaling impact on mitochondrial homeostasis in amyloid-beta peptide toxicity model[j].frontiers in pharmacology,2020,11:709.
[0017]
[11]vaillant-beuchot l,mary a,pardossi-piquard r,et al.accumulation of amyloid precursor protein c-terminal fragments triggers mitochondrial structure,function,and mitophagy defects in alzheimer’s disease models and human brains[j].acta neuropathologica,2021,141:39-65.
[0018]
[12]zhang y,song w.islet amyloid polypeptide:another key molecule in alzheimer’s pathogenesis?[j].progress in neurobiology,2017,153:100-120.
[0019]
[13]国家药典委员会.中华人民共和国药典2020版一部[s].北京:化学工业出版社,2020:165.
[0020]
[14]王淑英,刘玲.芍药苷对aβ25-35诱导pc12细胞损伤的作用[j].中国中药杂志,2012,37(16):2448-2451.
[0021]
[15]邢敏,毛敬洁,陈文列,等.芍药苷干预阿尔茨海默病作用机制研究进展[j].中草药,2019,50(4):1022-1026.
[0022]
[16]李世朋,张培哲,张露露,等.芍药苷对阿尔茨海默病模型大鼠学习记忆能力的影响[j].时珍国医国药,2012,23(12):3035-3036.
技术实现要素:
[0023]
本发明的目的是克服现有技术的不足,提供单环单萜类化合物在制备抗老年痴呆药物中的应用。
[0024]
本发明的第二个目的是提供上述单环单萜类化合物的药用盐在制备抗老年痴呆药物中的应用。
[0025]
本发明的第三个目的是提供包含上述单环单萜类化合物的组合物在制备抗老年痴呆药物中的应用。
[0026]
本发明的第四个目的是提供包含上述单环单萜类化合物的药用盐的组合物在制备抗老年痴呆药物中的应用。
[0027]
本发明的技术方案概述如下:
[0028]
单环单萜类化合物在制备抗老年痴呆药物中的应用,其特征是所述单环单萜类化合物如式i所示:
[0029][0030]
其中:
[0031]
3-4位为单键或双键;
[0032]
5-6位为单键或双键;
[0033]
r1为h或oh;
[0034]
r2为h或oh;
[0035]
r3为h;
[0036]
r4为h;
[0037]
或r3和r4为一个o;
[0038]
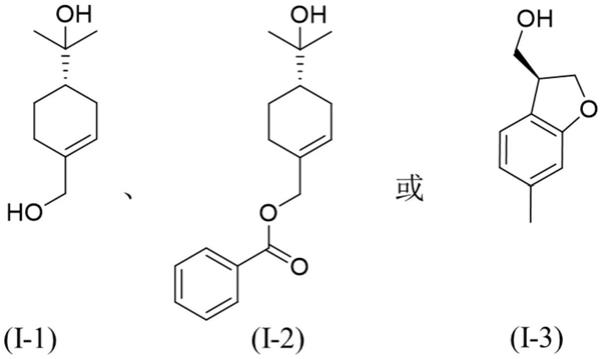
r5为h、oh或苯甲酰氧基。
[0039]
单环单萜类化合物优选为:
[0040][0041]
上述单环单萜类化合物的药用盐在制备抗老年痴呆药物中的应用。
[0042]
包含上述单环单萜类化合物的组合物在制备抗老年痴呆药物中的应用,所述组合物中包含药用载体或赋形剂。
[0043]
包含上述单环单萜类化合物的药用盐的组合物在制备抗老年痴呆药物中的应用,所述组合物中包含药用载体或赋形剂。
[0044]
本发明的优点:
[0045]
通过体外实验,证实了来自中药赤芍paeonia lactiflora pall提取物的单环单萜类化合物具有bace1和app-ctfs抑制的作用;进而,单环单萜类化合物的药用盐,包含单环单萜类化合物的组合物和包含单环单萜类化合物的药用盐的组合物也具有bace1和app-ctfs抑制的作用。
附图说明:
[0046]
图1为本发明的各化合物对n2a/app695细胞毒评价结果。(化合物i-1,i-2,i-3分别对应图中的9,11和1)
[0047]
图2为本发明的各化合物抑制bace1和app-ctfs的western blot结果。(化合物i-1,i-2,i-3分别对应图中的9,11和1)
具体实施方式
[0048]
下面结合实施例对本发明作进一步的详细描述,但本发明的实施方式不限于此。
[0049]
各实施例中公开的50%乙醇是体积浓度为50%的乙醇水溶液的简写,95%乙醇是体积浓度为95%的乙醇水溶液的简写,以此类推。
[0050]
实施例1
[0051]
赤芍提取物的制备,包括如下步骤:
[0052]
中药赤芍paeonia lactiflora pall饮片50kg,加入100l蒸馏水浸泡24h,超声1h提取,提取3次,每次加入的蒸馏水100l,合并提取液,减压浓缩至100l,为赤芍水提取液。
[0053]
实施例2
[0054]
单环单萜类化合物的制备,包括如下步骤:
[0055]
将实施例1中获得的赤芍水提取液直接用hpd100型大孔树脂柱层析分离,用水、50%乙醇、95%乙醇依次洗脱,洗脱液浓缩,得到3个部分浓缩液。
[0056]
95%乙醇的浓缩液进一步浓缩至无乙醇,用等体积乙酸乙酯萃取5次,得乙酸乙酯萃取部分(简称cs-5,580g)和水相部分(270g)。乙酸乙酯萃取部分进行硅胶柱色谱分离,开始用石油醚-丙酮体系洗脱(体积比50:1,30:1,20:1,10:1,8:1),后用氯仿-甲醇体系洗脱(体积比20:1,10:1,8:1,5:1,2:1,1:1,甲醇),流分经tlc检测合并,最后得21个组分。
[0057]
组分8(石油醚-丙酮30:1洗脱)部分经反相flash柱色谱分离,80%-100%甲醇水溶液梯度洗脱得到9个组分(8-1-8-9)。8-3部分经正相硅胶柱色谱(石油醚-乙酸乙酯体系洗脱),得到7个组分(8-3-1―8-3-7)。8-3-1正相硅胶柱色谱(石油醚-乙酸乙酯体系洗脱),得到5个组分(8-3-1-1―8-3-1-5)其中8-3-1-4经反相hplc半制备色谱(流动相为乙腈-水46:54),得到化合物i-2。
[0058]
组分11经sephadex lh-20柱色谱分离,石油醚-二氯-甲醇体系洗脱(4:3:1),得到4个组分(11-1―11-4)。11-3组分经反相flash柱色谱分离,15%-100%甲醇水梯度洗脱,得到5个组分(11-3-1―11-3-5)。11-3-2进一步经正相硅胶柱分离,二氯-甲醇体系洗脱(100:1,70:1,30:1,0:1),得到3个组分(11-3-2-1―11-3-2-3)。11-3-2-3经反相hplc半制备色谱(流动相为乙腈-水=24:76)分离得化合物i-1。
[0059]
赤芍水提取液直接用hpd100型大孔吸附树脂柱层析分离得到的50%乙醇部位(cs-4,315.7g)经sephadex lh-20柱色谱分离,50%甲醇、甲醇分别洗脱,得到组分cs-4-1―cs-4-8。cs-4-4经反相中压柱色谱分离,20%―100%甲醇洗脱,得到组分a1和a2,组分a2(8.3g)经正相硅胶柱分离(二氯-甲醇50:1―10:1),得到组分b1―b9。b2经正相硅胶柱分离(石油醚-乙酸乙酯10:1),得到组分c1―c7。c4经反相hplc半制备色谱(流动相为meoh-h2o=48:52)分离得化合物i-3。
[0060]
化合物的理化性质和波谱数据:
[0061]
化合物i-1:(4s)-p-薄荷-1-烯-7,8-二醇[(4s)-p-menth-1-ene-7,8-diol]:黄色油状物;[α]
20d
-48.7(c 0.17,meoh);eims m/z 171[m+h]
+
;1h nmr(cd3od,400mhz)δ:5.67(1h,bs,h-2),3.91(2h,s,h
2-7),1.16(3h,s,h
3-9),1.15(3h,s,h
3-10);
13
c nmr(cd3od,150mhz)δ:138.6(c-1),123.2(c-2),26.3(c-3),46.5(c-4),24.9(c-5),27.3(c-6),67.2(c-7),73.1(c-8),27.7(c-9),27.7(c-10)。以上数据与文献报道的(-)-1-p-menthene-7,8-diol数据一致。
[0062]
化合物i-2:(s)-8-羟基-松油-1-烯7-苯甲酸酯[(s)-8-hydroxy-p-menth-1-en-7-yl benzoate]:无色油状液体;esims m/z 275[m+h]
+
;1h nmr(cd3od,500mhz)δ:5.79(1h,s,h-2),4.65(1h,s,h-7),1.10(3h,s,h
3-9),1.11(3h,d,h
3-10),7.95(2h,dd,h-2
′
,6
′
),7.42(2h,t,h-3
′
,5
′
),7.55(1h,t,h-2
′
,6
′
)。
13
c nmr(cd3od,125mhz)δ:134.5(c-1),127.4(c-2),28.1(c-3),46.5(c-4),25.1(c-5),27.5(c-6),70.2(c-7),73.4(c-8),28.4(c-9),26.6(c-10),131.9(c-1
′
),130.8(c-2
′
),129.9(c-3
′
),134.5(c-4
′
),129.9(c-5
′
),130.8(c-6
′
),168.2(c-7
′
)。以上数据与文献报道的(s)-8-hydroxy-p-menth-1-en-7-yl benzoate数据一致。
[0063]
化合物i-3:(3s)-5-甲基-2,3-二氢-1-苯并呋喃-3-基甲醇{[(3s)-5-methyl-2,3-dihydro-1-benzofuran-3-yl]methanol}:白色粉末;[α]
20d
+40.9(c 0.04,meoh);esims m/z 187[m+na]
+
;1h nmr(cd3od,400mhz)δ:4.57(1h,dd,j=8.9,8.4hz,h-2a),4.41(1h,dd,j=8.9,5.1hz,h-2b),3.52(1h,m,h-3),6.56(1h,d,j=1.8hz,h-4),6.66(1h,dd,j=7.5,
1.8hz,h-5),7.09(1h,d,j=7.5hz,h-7),3.73(1h,dd,j=10.4,5.1hz,h-10a),3.56(1h,dd,j=10.4,7.2hz,h-10b),2.27(3h,s,h
3-7);
13
c nmr(cd3od,150mhz)δ:75.9(c-2),46.3(c-3),126.5(c-4),140.2(c-5),125.8(c-6),122.5(c-7),162.4(c-8),111.4(c-9),66.1(c-10),22.0(c-11)。以上数据与文献报道的(3s)-5-甲基-2,3-二氢-1-苯并呋喃-3-基甲醇{[(3s)-5-methyl-2,3-dihydro-1-benzofuran-3-yl]methanol}数据一致。
[0064]
通过理化常数和现代波谱学手段(ms、nmr、ord),并结合文献相关数据,鉴定了化合物i-3的结构,如下所示:
[0065][0066]
实施例3
[0067]
化合物i-1、i-2、i-3抑制bace1和app-ctfs的实验,步骤如下:
[0068]
化合物对n2a/app695细胞毒评价:收集对数生长期细胞,消化处理后,制成细胞悬液,将细胞浓度调整为3
×
105个/ml,按照3
×
104个/孔的细胞量接种于96孔板中,每孔100μl,边缘孔用无菌pbs填充,然后放于37℃含5%co2培养箱中培养24h后,空白对照组加入100μl 0.2%二甲基亚砜(dmso)溶液,实验组分别加入不同的化合物药液,药液终浓度为20μm,同时设置不加细胞的阴性对照组,置于37℃细胞培养箱中孵育10h后,吸去培养基,各孔加入75μl含0.5%mtt的培养基,置于培养箱中继续孵育4h后,加入dmso溶液150μl,低速震荡10min后,用多功能酶标仪测492nm处每孔的吸光值(od值)。按照公式:细胞活力(100%)=(实验组吸光值-空白对照组吸光值)/(阴性对照组吸光值-空白对照组吸光值),计算相应的细胞活力。
[0069]
结果如图1所示,在20μm浓度作用下3个化合物并无明显的抑制细胞增殖的作用,因此该浓度可用于后续的蛋白免疫印迹法实验(western blot)。
[0070]
western blot检测蛋白表达采用western blot实验,检测各化合物对bace1和app-ctfs蛋白的影响,将生长状态良好的n2a/app695细胞接种于24孔板中,并加入药物干预10h后进行蛋白提取。简要步骤如下:各组处理的细胞用裂解液冰上裂解30min,低温下12000
×
g离心15min后,吸取上清液进行蛋白浓度测定后,用裂解液稀释成1mg/ml的样本液,随后加入等体积的上样溴酚蓝缓冲液,熟沸5min,冷却后取样品10μg以10%sds-聚丙烯酰胺凝胶电泳分离,将分离的蛋白转移到pvdf膜上,室温下用5%脱脂奶粉封闭30min后,分别加入用封闭液稀释的一抗(1:60稀释),4℃孵育过夜,加入辣根过氧化物酶标记的二抗,再用tbst洗涤3次后显影及图片扫描。
[0071]
结果如图2所示20μm作用浓度下,化合物i-1,i-2,i-3干预n2a/app696细胞10h后,
bace1、app-ctfs蛋白的表达水平较对照组明显减少。化合物i-1,i-2,i-3分别对应图2中的9,11和1)。
[0072]
本发明的化合物,按照常规技术手段,与药学上可接受的载体、和/或赋形剂,制成适用于口服或注射等应用形式制剂(即组合物),例如,按常规技术,加入药物可接受的载体和/或赋形剂制成片剂、胶囊剂、粉剂、糖浆剂、针剂等。
[0073]
本发明的化合物的药用盐具有bace1和app-ctfs抑制的药理活性。
[0074]
含有本发明化合物的组合物或其药用盐具有bace1和app-ctfs抑制的药理活性。
[0075]
以上实施例的说明只是用于帮助理解本发明的方法及其中心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1