喹啉衍生物与PD-1单抗的药物组合的制作方法
喹啉衍生物与pd-1单抗的药物组合
技术领域
1.本技术属于医药技术领域,涉及可用于抗肿瘤的联合治疗。具体的,本技术涉及基于喹啉衍生物与pd-1单抗的药物组合及其在预防或治疗子宫内膜癌中的用途。
背景技术:
2.酪氨酸激酶是一组催化蛋白质酪氨酸残基磷酸化的酶,在细胞内的信号转导中起着重要的作用,它参与正常细胞的调节、信号传递和发育,也与肿瘤细胞的增殖、分化、迁移和凋亡密切相关。许多受体酪氨酸激酶都与肿瘤的形成相关,根据其细胞外区域结构的不同可分为表皮生长因子受体(egfr)、血小板衍生生长因子受体(pdgfr)、血管内皮生长因子受体(vegfr)、成纤维细胞生长因子受体(fgfr)等。
3.安罗替尼(anlotinib)是一种喹啉衍生物类酪氨酸激酶抑制剂,其作为多靶点酪氨酸激酶抑制剂(tki)在影响肿瘤血管生成和增殖信号传导方面发挥作用,主要靶点包括:受体酪氨酸激酶血管内皮生长因子受体(vegfr)1至3,表皮生长因子受体(egfr),成纤维细胞生长因子受体(fgfr)1至4,血小板衍生生长因子受体(pdgfr)α和β,以及干细胞因子受体(scfr)7、8和9。一项2期试验显示,安罗替尼可改善无进展生存期,并具有总体生存的潜在益处(han b,et al.br j cancer.2018;118(5):654-661)。一项多中心、双盲、3期随机临床试验显示,在中国患者中,安罗替尼导致延长的总生存期和无进展生存期,这一发现表明,安罗替尼耐受性良好,是晚期nsclc患者潜在的三线或进一步治疗用药(han b,et al.jama oncol.2018nov;4(11):1569-1575)。
4.文献wo2008112407在实施例24中公开了一种喹啉衍生物类的酪氨酸激酶抑制剂1-[[[4-(4-氟-2-甲基-1h-吲哚-5-基)氧基-6-甲氧基喹啉-7-基]氧基]甲基]环丙胺及其制备方法,它的结构式如式i所示:
[0005][0006]
pd-1(programmed death-1,pd-1)是一种由活化的t淋巴细胞和b淋巴细胞表达的关键免疫检查点受体并介导免疫抑制,其配体至少包括pd-l1和pd-l2。pd-l1(programmed death-ligand 1)又称为cd274或b7-h1,是由cd274基因编码的40kda的1型跨膜蛋白,是pd-1的一个配体。pd-l1和pd-1两者都属于免疫球蛋白超家族并且都由两个细胞外ig结构域,即n末端v结构域和c末端恒定结构域组成。pd-l1与程序性死亡受体-1(pd-1)和b7-1(cd80)
的结合界面是在igv样结构域上(lin等(2008)pnas 105:3011-3016)。pd-l1含有保守的短的细胞内尾区(约30个氨基酸),pd-1含有两个基于细胞质酪氨酸的信号基序,即基于免疫受体酪氨酸的抑制基序(itim)和基于免疫受体酪氨酸的转换基序(itsm)。在t细胞刺激之后,pd-1将酪氨酸磷酸酶shp-2募集到其胞质尾区内的itsm基序,导致参与cd3+t细胞信号传导级联的效应分子(诸如cd3ζ、pkcθ和zap70)的去磷酸化(freeman等(2000)j exp med 192:1027-34;latchman等(2001)nat immunol 2:261-8;carter等(2002)eur j immunol32:634-43)。pd-l1不仅在淋巴和非淋巴组织中的白细胞和非造血细胞上广泛分布,而且还在各种癌细胞中广泛分布,在多种肿瘤细胞表面高表达,而且肿瘤的恶性程度以及不良预后与pd-l1的表达水平密切相关。有临床数据表明pd-l1的高肿瘤表达与增加的肿瘤侵袭性和较差的预后相关联。pd-1/pd-l1复合物的形成传输抑制信号并负调节t细胞免疫应答;它抑制tcr介导的t细胞活化、细胞因子产生和t细胞增殖(fife等(2011)nature immunology 10:1185-1193);诱导同源抗原特异性t细胞之中的衰竭或无反应性(hofmeyer等(2011)journal of biomedicine and biotechnology 2011:1-9);促进th1细胞分化成foxp3+调节性t细胞(armanath等(2011)science transmed 3:1-13;francisco等(2009)j.exp.med.206:3015-3029);并诱导效应t细胞的凋亡。pd-l1基因的破坏导致上调的t细胞应答和自身反应性t细胞的产生(latchman等(2004)pnas 101:10691-10696)。pd-1或pd-l1的抗体阻断导致增加的抗肿瘤免疫性(iwai等(2002)pnas 99:12293-12297)。
[0007]
中国专利文献cn106977602a公开了一种pd-1单克隆抗体14c12h1l1,该单克隆抗体能够十分有效地阻断pd1与pdl1的结合,显示出较好的抗肿瘤活性。
[0008]
前人在肿瘤免疫治疗过程中遇到的最大挑战是由于肿瘤免疫耐受和逃逸所导致的疗效不佳。因此,通过基于小分子抗肿瘤化合物与抗pd-1/pd-l1抗体的联合使用以打破机体已经建立的对肿瘤细胞的免疫耐受,具有重要的理论意义和应用价值。
技术实现要素:
[0009]
本发明的目的至少在于提供一种药物组合用于治疗或预防子宫内膜癌的用途,其包含酪氨酸激酶抑制剂以及人类pd-1抗体或其抗原结合片段,所述人类pd-1抗体包含轻链和重链,其中所述轻链包含轻链互补决定区lcdr1、lcdr2和lcdr3,所述轻链互补决定区分别由seq id no:1、seq id no:2和seq id no:3所示的氨基酸序列组成,且其中所述重链包含重链互补决定区hcdr1、hcdr2和hcdr3,所述重链互补决定区分别由seq id no:4、seq id no:5和seq id no:6所示的氨基酸序列组成。
[0010]
在一些方案中,所述酪氨酸激酶抑制剂是上述的式i的化合物或其药学上可接受的盐,在一些具体的实施方式中,所述酪氨酸激酶抑制剂是式i的化合物的盐酸盐,即盐酸安罗替尼。
[0011]
在一些方案中,所述人类pd-1抗体包含氨基酸序列如seq id no:7所示的轻链可变区和如seq id no:8所示的重链可变区。在一些方案中,所述人类pd-1抗体包含与seq id no:7所示的氨基酸序列有至少80%(例如至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%)同源性的轻链可变区和与seq id no:8所示的氨基酸序列有至少80%(例如至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%)同源性的
重链可变区。
[0012]
在一些方案中,所述人类pd-1抗体是14c12h1l1。
[0013]
在一些方案中,所述式i化合物可以以药学上可接受的盐或其药学上可接受的制剂形式存在,优选其盐酸盐形式,例如二盐酸盐形式。
[0014]
在一些具体实施方案中,所述式i化合物为1-[[[4-(4-氟-2-甲基-1h-吲哚-5-基)氧基-6-甲氧基喹啉-7-基]氧基]甲基]环丙胺的盐酸盐,即盐酸安罗替尼。
[0015]
在一些方案中,所述药物组合包含:式i的化合物或其盐酸盐(例如二盐酸盐);以及14c12h1l1单抗或其抗原结合片段。
[0016]
本发明还提供一种用于治疗患有子宫内膜癌的主体的方法,其包括向所述主体施用治疗有效量的酪氨酸激酶抑制剂以及治疗有效量的人类pd-1抗体或其抗原结合片段,所述人类pd-1抗体包含轻链和重链,其中所述轻链包含轻链互补决定区lcdr1、lcdr2和lcdr3,所述轻链互补决定区分别由seq id no:1、seq id no:2和seq id no:3所示的氨基酸序列组成,且其中所述重链包含重链互补决定区hcdr1、hcdr2和hcdr3,所述重链互补决定区分别由seq id no:4、seq id no:5和seq id no:6所示的氨基酸序列组成。在一些实施方案中,所述酪氨酸激酶抑制剂是式i的化合物或其盐酸盐。在一些方案中,所述人类pd-1抗体包含氨基酸序列如seq id no:7所示的轻链可变区和如seq id no:8所示的重链可变区。在一些方案中,所述人类pd-1抗体是14c12h1l1。
[0017]
本发明也提供一种用于治疗或预防患有子宫内膜癌的主体的联合疗法,所述方法包括给所述主体单独施用治疗有效量的酪氨酸激酶抑制剂以及单独施用治疗有效量的人类pd-1抗体,所述人类pd-1抗体包含轻链和重链,其中所述轻链包含轻链互补决定区lcdr1、lcdr2和lcdr3,所述轻链互补决定区分别由seq id no:1、seq id no:2和seq id no:3所示的氨基酸序列组成,且其中所述重链包含重链互补决定区hcdr1、hcdr2和hcdr3,所述重链互补决定区分别由seq id no:4、seq id no:5和seq id no:6所示的氨基酸序列组成。
[0018]
本发明也提供了一种治疗或预防患有癌症或肿瘤的主体的方法,所述癌症或肿瘤是子宫内膜癌,所述方法包括:(i)测量所述主体的样品中的pd-1水平和/或pd-l1水平,其中所述主体是pd-1和/或pd-l1阳性的,和(ii)给所述主体施用治疗有效量的本发明所述的喹啉衍生物与pd-1抗体的药物组合。
[0019]
在本发明的一些方案中,所述子宫内膜癌为晚期的,或复发性的,或转移性的,或不可切除的。在本发明的一些方案中,所述子宫内膜癌为晚期复发性的,或晚期转移性的,或晚期不可切除的。
[0020]
在本发明的一些方案中,所述子宫内膜癌为一型子宫内膜癌,又称雌激素依赖型子宫内膜癌,或二型子宫内膜癌,又称为非雌激素依赖型子宫内膜癌。
[0021]
在本发明的一些方案中,所述子宫内膜癌是单纯内膜样癌,例如是鳞状分化的,绒毛腺型的,或者分泌型的单纯内膜样癌。在本发明的另一些方案中,所述子宫内膜癌是粘液癌。在本发明的一些方案中,所述子宫内膜癌是浆液性癌,例如是浆液性浆液性子宫内膜上皮癌或浆液性乳头状癌。在本发明的又一些方案中,所述子宫内膜癌是透明细胞癌。在本发明的再一些方案中,所述子宫内膜癌是未分化癌。在本发明的再一些方案中,所述子宫内膜癌是混合细胞腺癌。在本发明的一些方案中,所述主体患有神经内分泌肿瘤,例如是低级别
神经内分泌肿瘤或搞基吧神经内分泌肿瘤。
[0022]
在一些方案中,所述主体先前已接受手术、化疗和/或放射治疗。在一些具体实施方式中,所述主体经手术、化疗和/或放射治疗后获完全缓解后再次出现疾病进展。在一些具体实施方式中,所述主体经手术、化疗和/或放射治疗后未能完全缓解或未能部分缓解。
[0023]
在一些方案中,主体先前未接受过系统化疗。在一些方案中,主体先前已接受手术治疗、放射治疗、诱导化疗和/或辅助化疗,或者主体接受同期的化疗。在一些具体实施方式中,主体先前未接受过系统化疗,但是接受过手术治疗、放射治疗、诱导化疗和/或辅助化疗或者将接受同期的化疗。在一些具体实施方式中,主体经手术治疗、放射治疗、诱导化疗、同期的化疗和/或辅助化疗后,获完全缓解后再次出现疾病进展。在一些具体实施方式中,主体经手术治疗、放射治疗、诱导化疗、同期的化疗和/或辅助化疗后,未能完全缓解或未能部分缓解。在一些具体实施方式中,主体经手术治疗、放射治疗、诱导化疗、同期的化疗和/或辅助化疗后癌症发生转移。
[0024]
在一些方案中,所述主体先前接受手术治疗后出现疾病进展。其中,所述手术可以是全子宫、双附件切除加腹膜后淋巴结切除术,或淋巴结切除。
[0025]
在一些方案中,所述主体出现盆腔内器官转移,例如是阴道,膀胱,直肠,宫旁转移。在本技术的另一些方案中,所述主体出现肝脏转移或其他远处转移。
[0026]
在一些方案中,所述主体是前接受手术治疗后出现疾病进展的复发或晚期的浆液性乳头状腺癌(upsc),透明细胞癌,癌肉瘤,或恶性苗勒管混合瘤(mmmt)患者。其中,所述手术是早期分期手术或晚期减瘤术。在一些具体实例中,所述内膜样癌和浆乳癌、透明细胞癌患者选自没有被施用过甲地孕酮,醋酸甲羟孕酮,他莫昔芬,托瑞米芬,来曲唑,阿那曲唑的主体。
[0027]
在一些方案中,主体是先前接受手术治疗和术后辅助治疗的患者,后出现疾病进展。其中,所述手术可以是全子宫、双附件切除加腹膜后淋巴结切除术,或淋巴结切除。在一些具体实施方式中,所述术后辅助治疗是放射治疗或者化疗联合放射治疗,其中,所述放射治疗可以是单纯盆腔外照射或者联合放疗。
[0028]
在一些方案中,主体是先前接受化疗,生物药治疗或多药联合方案的子宫内膜癌患者。例如,是先前接受接受化疗或多药联合方案的的复发或转移的患者。其中,化疗或生物药治疗所选的药物包括顺铂,卡铂,多柔比星,阿霉素或脂质体阿霉素,紫杉醇,贝伐单抗,多烯紫杉醇,环磷酰胺,多药联合方案包括卡铂+紫杉醇,顺铂+多柔比星,顺铂+多柔比星+紫杉醇,卡铂+多烯紫杉醇,异环磷酰胺+紫杉醇(癌肉瘤),或者顺铂+环磷酰胺(癌肉瘤)等。
[0029]
在一些方案中,主体是先前接受激素治疗的er和/或pr阴性的g1或g2内膜样癌患者,所述激素治疗药物选自甲地孕酮,醋酸甲羟孕酮,他莫昔芬,托瑞米芬,来曲唑,阿那曲唑。
[0030]
在一些方案中,主体患有复发和转移子宫内膜癌。在一些具体的方案中,所述主体是复发部位先期进行过放疗的患者。在另一些具体的方案中,所述主体是复发部位先期进行过放疗和化疗的患者。在又一些具体的方案中,所述主体是发生远处转移的患者。在所述远处转移的患者中,孤立病灶可以是已经过或未经过外照射、消融治疗、化疗和/或激素治疗,广泛转移的er或pr阳性患者可以是已经过或未经过激素治疗、化疗或姑息治疗,广泛转
移的er或pr阴性患者已经过或未经过化疗和/或姑息治疗。
[0031]
在一些方案中,所述子宫内膜癌还可以是msi-h或dmmr阳性的。为此本发明还提供一种治疗患有子宫内膜癌的主体的方法,所述方法包括:(i)测量所述主体的样品中的msi-h或dmmr水平,其中所述主体是msi-h或dmmr阳性的,和(ii)给所述主体施用治疗有效量的本发明所述的喹啉衍生物与pd-1抗体的药物组合。在一些具体实施方式中,所述msi-h或dmmr状态可以是自发的或药理学诱导的。在另一些具体实施方式中,所述msi-h或dmmr子宫内膜癌为晚期的,或复发性的,或转移性的,或不可切除的。在患者中,错配修复缺失(dmmr)可导致高度微卫星不稳定型超突变(msi-h),其涉及的基因改变往往包括mlh1,msh2,msh6,pms2,pten,kras,rpl22等的突变或缺失。在一些具体的方案中,所述主体所患的子宫内膜癌是msi-h或dmmr阳性的,并且:自主体获得的肿瘤样品已经确定构成约1%或更多(例如约1%,约2%,约3%,或约4%或更多)的细胞中具有可检测的pd-l1的表达水平。在一些具体实施方案中,自该主体者获得的肿瘤样品已经确定构成约1%至约65%或更多(例如约1%至约5%,约5%至约10%,约10%至约20%,约20%至约30%,约30%至约40%,约40%至约50%,或约50%至约65%)的细胞中具有可检测的pd-l1的表达水平。
[0032]
在一些方案中,所述子宫内膜癌还可以是pole超突变阳性的。
[0033]
在一些方案中,所述药物组合是固定组合。在一些方案中,所述固定组合呈固体药物组合物形式或液体药物组合物形式。
[0034]
在本技术的一些方案中,所述药物组合是非固定组合。在一些方案中,所述非固定组合中的人类pd-1抗体和式i化合物各自呈药物组合物形式。
[0035]
本技术的目的还至少在于提供一种药物包,其在独立的容器中分别包含单包装的药物组合物,其中,在一个容器中包含含有式i的化合物或其药学上可接受的盐的药物组合物,并在第二个容器中包含含有人类pd-1抗体的药物组合物。
[0036]
在本技术的一些实施方案中,所述药物组合物包含有其量为6~168mg的式i化合物。在部分方案中,所述药物组合物包含有其量选自6mg、8mg、10mg、12mg、15mg、20mg、30mg、50mg、56mg、70mg、84mg、112mg、140mg、168mg或上述任意值形成的范围的式i化合物。在部分方案中,所述药物组合物包含有其量为8mg-12mg的式i化合物。在部分方案中,所述药物组合物包含有其量为8mg或10mg的式i化合物。在部分方案中,所述药物组合物包含有其量为12mg的式i化合物。
[0037]
在一些方案中,所述人类pd-1抗体以能够有效治疗所述癌症的一个或多个统一剂量施用。在一些具体实施方式中,所述统一剂量在大约10mg至大约1000mg人类pd-1抗体的范围内。在一些具体实施方式中,所述统一剂量选自大约100mg、大约150mg、大约200mg、大约250mg、大约300mg、大约350mg、大约400mg、大约450mg、大约500mg、大约600mg、大约700mg、大约800mg、大约900mg、或大约1000mg人类pd-1抗体。在一些具体实施方式中,所述统一剂量选自大约200mg人类pd-1抗体。
[0038]
在一些方案中,人类pd-1抗体的施用治疗以2周(14天)或3周(21天)为一个周期,优选在每个周期第一天(d1)静脉给予人类pd-1抗体。即,所述抗pd-1抗体以每两周一次(q2w)或者每三周一次(q3w)的频率施用。
[0039]
本技术的目的还在于提供单位制剂,其中,所述单位制剂包含:化合物成分,6~12mg的式i化合物或其盐酸盐;以及抗体成分,50-350mg的人类pd-1抗体或其抗原结合片
段;其中,化合物成分和抗体成分分别单独包装。
[0040]
在一些方案中,所述单位制剂包含:化合物成分,8mg、10mg或12mg的式i化合物或其盐酸盐;以及抗体成分,100mg或200mg的人类pd-1抗体或其抗原结合片段;其中,化合物成分和抗体成分分别单独包装。
[0041]
本技术的目的还在于提供一种用于预防或治疗癌症或肿瘤的方法,其中,向有需要的受试者给予一份或多份上述的单位制剂。优选地,所述单位制剂中的化合物成分和抗体成分各自分开施用。优选地,所述癌症或肿瘤为子宫内膜癌。
[0042]
在本技术的一些方案中,安罗替尼联合14c12h1l1施用,每21天为一个治疗周期,按以下方式给药:第1-第14天施用安罗替尼12mg、10mg/次或8mg/次,第1天施用14c12h1l1200mg。
[0043]
在本技术的一些方案中,安罗替尼联合14c12h1l1施用,其中盐酸安罗替尼胶囊给药方式为每日1次,每次8mg、10mg或12mg。连续口服2周停1周,即3周(21天)为一治疗周期,14c12h1l1注射液给药方式为每3周给药1次,200mg/次,静脉输注给药,输注时间为60
±
10min。
[0044]
安罗替尼
[0045]
如本技术所用,所述安罗替尼(即,式i的化合物)的化学名为1-[[[4-(4-氟-2-甲基-1h-吲哚-5-基)氧基-6-甲氧基喹啉-7-基]氧基]甲基]环丙胺,其具有如下的结构式:
[0046][0047]
如本技术所用,所述安罗替尼包括其非盐形式(例如,自由酸或自由碱),也包括其药学上可接受的盐,所述非盐形式或盐都纳入本技术的保护范围内。例如,所述安罗替尼的药学上可接受的盐可以是盐酸盐或二盐酸盐。本技术中涉及的安罗替尼或其盐的剂量,除非另有说明,均基于安罗替尼游离碱计算。
[0048]
14c12h1l1
[0049]
如本技术所用,14c12h1l1或称14c12h1l1单抗,是抗pd-1单克隆抗体,其序列和结构可以参见文献(cn106977602a)。在所述14c12h1l1单克隆抗体中,lcdr1包含序列qdinty(seq id no:1),lcdr2包含序列ran(seq id no:2),lcdr3包含序列lqydefplt(seq id no:3),hcdr1包含序列gfafssyd(seq id no:4),hcdr2包含序列isgggryt(seq id no:5),hcdr3包含序列anrygeawfay(seq id no:6)。
[0050]
其轻链可变区的氨基酸序列为:
[0051]
diqmtqspssmsasvgdrvtftcrasqdintylswfqqkpgkspktliyranrlvsgvpsrfsgsgsgqdytltisslqpedmatyyclqydefpltfgagtklelk(seq id no:7)。
[0052]
其重链可变区的氨基酸序列为:
[0053]
evqlvesggglvqpggslrlscaasgfafssydmswvrqapgkgldwvatisgggrytyypdsvkgrf
tisrdnsknnlylqmnslraedtalyycanrygeawfaywgqgtlvtvss(seq id no:8)。
[0054]
定义
[0055]
除非另有说明,本技术中所用的下列术语具有下列含义。一个特定的术语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照本领域普通的含义去理解。当本技术中出现商品名时,意在指代其对应的商品、组合物或其活性成分。
[0056]
如本文所用,术语“抗体”是指具有至少一个抗原结合结构域的抗原结合蛋白。本技术的抗体和其片段可以是整个抗体或其任何片段。因此,本技术的抗体和其片段包括单克隆抗体或其片段和抗体变体或其片段,以及免疫缀合物。抗体片段的实例包括fab片段、fab'片段、f(ab)'片段、fv片段、分离的cdr区、单链fv分子(scfv)和本领域已知的其它抗体片段。抗体和其片段还可以包括重组多肽、融合蛋白和双特异性抗体。本文公开的抗pd-l1抗体和其片段可以是igg1、igg2、igg3或igg4同种型。
[0057]
术语“同种型”是指由重链恒定区基因编码的抗体种类。在一个实施方案中,本文公开的抗pd-1/pd-l1抗体和其片段是igg1或igg4同种型。本技术的抗pd-1/pd-l1抗体和其片段可以衍生自任何物种,其包括但不限于小鼠、大鼠、兔、灵长类动物、美洲驼和人。pd-1/pd-l1抗体和其片段可以是嵌合抗体、人源化抗体或完整的人抗体。
[0058]
术语“人源化抗体”是指其中抗原结合位点来源于非人物种且可变区框架来源于人免疫球蛋白序列的抗体。人源化抗体在框架区中可包含置换,使得该框架可能不是所表达的人免疫球蛋白或种系基因序列的精确拷贝。
[0059]“分离的抗体”表示这样的抗体:其基本上不含有具有不同抗原特异性的其它抗体(例如,分离的特异性地结合pd-1/pd-l1的抗体基本上不含有特异性地结合除pd-1/pd-l1以外的抗原的抗体)。但是,分离的特异性地结合pd-1/pd-l1的抗体可以具有与其它抗原(诸如来自不同物种的pd-1/pd-l1分子)的交叉反应性。此外,分离的抗体可以基本上不含有其它细胞材料和/或化学物质。
[0060]
抗体的“抗原结合部分”(也称为“抗原结合片段”)表示抗体的一个或多个片段,其保留特异性地结合被完整抗体结合的抗原的能力。
[0061]
如本文所用,术语“衍生的”当用于指相对于参考抗体或其它结合蛋白的分子或多肽时,意指能够与参考抗体或其它结合蛋白特异性地结合相同表位的分子或多肽。
[0062]
如本文所用,术语“ec50”是指有效浓度,抗体的50%最大应答。如本文所用,术语“ic50”是指抑制浓度,抗体的50%最大应答。ec50和ic50两者均可以通过elisa或facs分析或本领域已知的任何其它方法进行测量。
[0063]
术语“治疗”一般是指获得需要的药理和/或生理效应的操作。该效应根据完全或部分地预防疾病或其症状,可以是预防性的;和/或根据部分或完全稳定或治愈疾病和/或由于疾病产生的副作用,可以是治疗性的。本文使用的“治疗”涵盖了对患者疾病的任何治疗,包括:(a)预防易感染疾病或症状但还没诊断出患病的患者所发生的疾病或症状;(b)抑制疾病的症状,即阻止其发展;或(c)缓解疾病的症状,即,导致疾病或症状退化。
[0064]
如本文所用,术语“全身治疗”是指药物物质通过血流传送,到达并影响全身细胞的治疗。
[0065]
如本文所用,术语“系统化疗”是指不包括作为多模式治疗的一个环节针对局部晚期疾病进行的化疗的全身化疗,其中,针对局部晚期疾病进行的化疗包括诱导化疗、放疗同
期的化疗以及辅助化疗。
[0066]
如本文所用,术语“受试者”表示哺乳动物,诸如啮齿动物、猫科动物、犬科动物和灵长类动物。优选地,根据本技术的受试者是人。
[0067]“施用”表示使用本领域技术人员已知的多种方法和递送系统中的任一种,向主体物理引入包含治疗剂的组合物。免疫检查点抑制剂(例如,抗pd-1抗体或抗pd-l1抗体)的施用途径包括静脉内、肌肉内、皮下、腹膜内、脊柱或其它胃肠外施用途径,例如通过注射或输注。本文中使用的短语“胃肠外施用”是指,通常通过注射进行的除了肠内和局部施用以外的施用模式,且包括但不限于,静脉内、肌肉内、动脉内、鞘内、淋巴管内、病灶内、囊内、眶内、心内、真皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注、以及体内电穿孔。在某些实施方案中,所述免疫检查点抑制剂(例如,抗pd-1抗体或抗pd-l1抗体)通过非胃肠外途径施用,在某些实施方案中,口服施用。其它非胃肠外途径包括局部、表皮或粘膜施用途径,例如,鼻内地、阴道地、直肠地、舌下地或局部地。还可以执行施用,例如,一次、多次,和/或在一个或多个延长的时间段中。
[0068]
本文中使用的“不良事件”(ae)是与医学治疗的应用有关的任何不利的和通常非故意的或不希望的迹象(包括异常的实验室发现)、征状或疾病。例如,不利事件可以与响应于治疗的免疫系统的激活或免疫系统细胞(例如,t细胞)的扩增相关。医学治疗可以具有一种或多种相关的ae,并且每种ae可以具有相同或不同的严重性水平。对能够“改变不利事件”的方法的提及是指降低与不同治疗方案的应用相关的一种或多种ae的发生率和/或严重性的治疗方案。
[0069]
本文中使用的“给药间隔”是指在施用给主体的本文公开的制剂的多个剂量之间逝去的时间的量。因而可以将给药间隔指示为范围。
[0070]
本文中使用的术语“给药频率”表示在给定时间中本文公开的制剂的施用剂量的频率。可以将给药频率指示为每个给定时间的给药次数,例如,每周1次或2周1次。
[0071]
术语“统一剂量(flat dose)”的应用是指,不考虑患者的重量或体表面积(bsa)施用给患者的剂量。因此将统一剂量规定为药剂(例如,抗pd-1抗体)的绝对量,而不是规定为mg/kg剂量。例如,60kg人和100kg人将接受相同剂量的抗体(例如,240mg抗pd-1抗体)。
[0072]
关于本技术的组合物的术语“固定剂量”的应用是指,单一组合物中的两种或更多种不同抗体彼此以特定(固定)比率存在于所述组合物中。在某些实施方案中,所述固定剂量是基于所述抗体的重量(例如,mg)。在某些实施方案中,所述固定剂量是基于所述抗体的浓度(例如,mg/ml)。在某些实施方案中,所述mg第一抗体:mg第二抗体的比率是至少约1:1、约1:2、约1:3、约1:4、约1:5、约1:6、约1:7、约1:8、约1:9、约1:10、约1:15、约1:20、约1:30、约1:40、约1:50、约1:60、约1:70、约1:80、约1:90、约1:100、约1:120、约1:140、约1:160、约1:180、约1:200、约200:1、约180:1、约160:1、约140:1、约120:1、约100:1、约90:1、约80:1、约70:1、约60:1、约50:1、约40:1、约30:1、约20:1、约15:1、约10:1、约9:1、约8:1、约7:1、约6:1、约5:1、约4:1、约3:1或约2:1。例如,第一抗体和第二抗体的3:1比率可以是指,瓶中可以含有约240mg第一抗体和80mg第二抗体,或约3mg/ml的第一抗体和1mg/ml的第二抗体。
[0073]
本文提及的术语“基于重量的剂量”是指基于患者的重量计算出的、施用给患者的剂量。例如,当具有60kg体重的患者需要3mg/kg的抗pd-1抗体和1mg/kg的抗ctla-4抗体时,人们可以从抗pd-1抗体和抗ctla-4抗体的3:1比率固定剂量制剂中一次性抽取适当量的抗
pd-1抗体(即,180mg)和抗ctla-4抗体(即,60mg)。
[0074]
术语“免疫疗法”表示通过一定方法治疗患有疾病或处于感染或遭受疾病复发的风险的主体,所述方法包括诱导、增强、抑制或以其它方式改变免疫应答。主体的“治疗”或“疗法”表示在主体上执行的任何类型的干预或过程,或给主体施用活性剂,目的在于逆转、减轻、改善、抑制、减慢或阻止征状、并发症或病症的发作、进展、发展、严重程度或复发,或与疾病相关的生化指标。
[0075]
本文中使用的“pd1/pd-l1阳性的”可以与“至少约1%的pd-1/pd-l1表达”互换使用。在一个实施方案中,通过本领域已知的任意方法可以使用pd-1/pd-l1表达。在另一个实施方案中,通过自动化的ihc测量pd-1/pd-l1表达。在某些实施方案中,“pd-1/pd-l1阳性的”是指存在至少100个在细胞表面上表达pd-1/pd-l1的细胞。
[0076]“程序性死亡受体-1(pd-1)”表示属于cd28家族的免疫抑制性受体。pd-1主要在体内先前活化的t细胞上表达,并且结合两种配体pd-l1和pd-l2。本文使用的术语“pd-1”包括人pd-1(hpd-1)、hpd-1的变体、同种体和物种同系物,以及与hpd-1具有至少一个共同表位的类似物。
[0077]“程序性死亡配体-1(pd-l1)”是针对pd-1的两种细胞表面糖蛋白配体(另一种是pd-l2)之一,其在结合pd-1后下调t细胞活化和细胞因子分泌。
[0078]“主体”包括任何人或非人动物。术语“非人动物”包括但不限于脊椎动物诸如非人灵长类动物、绵羊、狗,和啮齿类动物诸如小鼠、大鼠和豚鼠。在某些实施方案中,所述主体是人。术语“主体”、“受试者”和“患者”在本文中的某些语境下可互换地使用。
[0079]
药物或治疗剂的“治疗有效量”或“治疗上有效的剂量”是当单独使用或与另一种治疗剂联合使用时保护主体免于疾病发作或促进疾病消退的药物的任何量,所述疾病消退通过疾病征状的严重程度的降低、无疾病征状阶段的频率和持续时间的增加、或由疾病折磨引起的损伤或失能的预防来证明。使用熟练的从业人员已知的多种方法可以评价治疗剂的促进疾病消退的能力,诸如在临床试验期间在人主体中,在预测对于人类的效力的动物模型系统中,或通过在体外测定法中测定所述药剂的活性。
[0080]
本文中使用的“亚治疗剂量”是指,当单独施用用于治疗过度增殖性疾病(例如,癌症)时低于治疗性化合物的常用或典型剂量的治疗性化合物(例如,抗体)的剂量。
[0081]
作为例子,“抗癌药”促进主体中的癌症消退或阻止进一步的肿瘤生长。在某些实施方案中,治疗有效量的药物促进癌症消退至消除癌症的点。“促进癌症消退”是指单独地或与抗肿瘤剂联合施用有效量的药物,导致肿瘤生长或大小的减小、肿瘤的坏死、至少一种疾病征状的严重程度的降低、无疾病征状阶段的频率和持续时间的增加、或由疾病折磨引起的损伤或失能的预防。此外,关于治疗的术语“有效的”和“有效性”包括药理学有效性和生理学安全性。药理学有效性表示药物在患者中促进癌症消退的能力。生理学安全性表示由药物施用引起的在细胞、器官和/或生物体水平的毒性水平或其它不利的生理效应(不良作用)。
[0082]
作为用于治疗肿瘤的例子,相对于未治疗的主体,或者,在某些实施方案中,相对于用护理标准疗法治疗的患者,治疗有效量的抗癌药可以将细胞生长或肿瘤生长抑制至少约10%、至少约20%、至少约40%、至少约60%或至少约80%。在本技术的其它实施方案中,可以观察到肿瘤消退并持续至少约20天、至少约40天或至少约60天的时间段。尽管存在治
疗有效性的这些最终测量,免疫治疗药物的评价还必须考虑“免疫相关的”应答模式。
[0083]“免疫相关的”应答模式表示在用免疫治疗剂治疗的癌症患者中经常观察到的临床应答模式,所述免疫治疗剂通过诱导癌症特异性免疫应答或通过改变天然免疫过程而产生抗肿瘤作用。该应答模式的特征在于在肿瘤负荷的初始增加或新病变出现之后的有益的治疗效果,其在传统化学治疗剂的评价中将被分类为疾病进展并且将与药物失效同义。因此,免疫治疗剂的适当评价可以需要长期监测这些药剂对靶疾病的影响。
[0084]
药物的治疗有效量包括“预防有效量”,其为当单独地或与抗肿瘤剂联合施用给处于发生癌症的风险的主体(例如,具有恶化前病症的主体)或具有癌症复发的风险的主体时,抑制癌症的发生或复发的任何药物量。在某些实施方案中,预防有效量完全阻止癌症的发生或复发。“抑制”癌症的发生或复发是指减少癌症的发生或复发的可能性,或完全阻止癌症的发生或复发。
[0085]“复发性”癌症是在对初始治疗(例如手术)产生应答后,在初始部位或远处部位再生的癌症。“局部复发性”癌症是在治疗后,在与先前治疗的癌症相同的位置出现的癌症。
[0086]“晚期子宫内膜癌”是指处于局部转移(例如是figo iii期)及远处转移(例如是figo iv期)的子宫内膜癌。
[0087]“不能切除的”癌症是无法通过手术去除的。
[0088]“转移性”癌症是指从身体的一部分(例如肺部)扩散到身体的另一部分的癌症。
[0089]
备选方案(例如,“或”)的应用应当被理解为是指备选方案中的任一个、两个或它们的任意组合。本文中使用的不定冠词“一个”或“一种”应当理解为表示任何列举或枚举的组分中的“一个或多个/一种或多种”。
[0090]
术语“约”、“大约”或“基本上包含”表示在本领域普通技术人员确定的特定值或组成的可接受误差范围内的值或组成,其将部分地取决于如何测量或测定值或组成,即,测量系统的限制。例如,“约”、“大约”或“基本上包含”可以是指按本领域中的实践,在1个或超过1个标准差内。可替换地,“约”或“基本上包含”可以是指与由其修饰的参数或数值相差至多10%或20%(即,
±
10%或
±
20%)的范围。例如,约3mg可以包括2.7mg至3.3mg之间(对于10%)或2.4mg至3.6mg(对于20%)之间的任何数字。此外,特别是关于生物学系统或过程,该术语可以是指直到一个数量级或直到数值的至多5倍。当在本技术和权利要求中提供特定值或组成时,除非另有说明,否则“约”或“基本上包含”的含义应当假定在该特定值或组成的可接受误差范围内。
[0091]
本文中使用的术语“约每周一次”、“约每两周一次”或任意其它类似的给药间隔术语是指近似值。“约每周一次”可以包括每7天
±
1天,即,每6天至每8天。“约每两周一次”可以包括每14天
±
3天,即,每11天至每17天。类似的近似值适用于,例如,约每3周一次,约每4周一次,约每5周一次,约每6周一次,和约每12周一次。在某些实施方案中,约每6周一次或约每12周一次的给药间隔是指可以在第一周的任意天施用第一剂,然后可以分别在第六周或第十二周的任意天施用第二剂。在其它实施方案中,约每6周一次或约每12周一次的给药间隔是指在第一周的特定天(例如,星期一)施用第一剂,并然后分别在第六周或第十二周的相同天(即,星期一)施用第二剂。类似的原则适用于包括、但不限于“约每2周1次”,“约每月1次”等
……
的短语。
[0092]
如本文中所述的,任何浓度范围、百分比范围、比率范围或整数范围应当理解为包
括在列举的范围内的任意整数的值,且当适当时,包括其分数(诸如整数的十分之一和百分之一),除非另外指出。
[0093]
除特别声明外,本技术中的“约”或“大约”是指在所给定的具体数值范围
±
5%范围内波动,优选在
±
2%范围内波动,更优选在
±
1%范围内波动。例如ph值为约5.5表示ph为5.5
±
5%,优选ph为5.5
±
2%,更优选ph为5.5
±
1%。
[0094]
术语“药学上可接受的”是针对那些化合物、材料、组合物和/或剂型而言,它们在可靠的医学判断的范围之内,适用于与人类和动物的组织接触使用,而没有过多的毒性、刺激性、过敏性反应或其它问题或并发症,与合理的利益/风险比相称。
[0095]
术语“药学上可接受的盐”包括碱根离子与自由酸形成的盐或酸根离子与自由碱形成的盐,例如包括盐酸盐、氢溴酸盐、硝酸盐、硫酸盐、磷酸盐、甲酸盐、乙酸盐、三氟乙酸盐、富马酸盐、草酸盐、马来酸盐、柠檬酸盐、琥珀酸盐、甲磺酸盐、苯磺酸盐或对甲基苯磺酸盐,优选盐酸盐、氢溴酸盐、硫酸盐、甲酸盐、乙酸盐、三氟乙酸盐、富马酸盐、马来酸盐、甲磺酸盐、对甲基苯磺酸盐、钠盐、钾盐、铵盐、氨基酸盐等。本技术中,当形成药学上可接受的盐时,所述自由酸与碱根离子的摩尔量之比为约1:0.5~1:5,优选1:0.5、1:1、1:2、1:3、1:4、1:5、1:6、1:7或1:8。本技术中,当形成药学上可接受的盐时,所述自由碱与酸根离子的摩尔量之比为约1:0.5~1:5,优选1:0.5、1:1、1:2、1:3、1:4、1:5、1:6、1:7或1:8。
[0096]
术语“固定组合”指活性组分(例如抗pd-1抗体或式i化合物)以固定总剂量或剂量比例,或以单一实体、药物组合物或制剂的形式同时给予受试者。
[0097]
术语“非固定组合”指两种以上活性组分作为独立的实体(例如药物组合物、制剂)同时、并行或依序且无具体时间限制地给予受试者,其中所述给予受试者的活性成份达到治疗有效量水平。非固定组合可列举的例子是鸡尾酒疗法,例如给予3种或以上之活性组分。在非固定组合中,所述各个活性组分可以作为完全独立的药物组合物进行包装、销售或给药。所述“非固定组合”也包括“固定组合”之间、或“固定组合”与任一或多种活性组分的独立实体的联合使用。
[0098]
如本文所用,“联用”或“联合使用”意指两种或更多种活性物质可以在混合物中一起、作为单一制剂同时地或作为单一制剂以任何顺序依次地施用于受试者。
[0099]
术语“药物组合物”是指一种或多种本技术的活性成分(例如抗pd-1抗体或式i化合物)或其药物组合与药学上可接受的辅料组成的混合物。药物组合物的目的是有利于对受试者给予本技术的化合物或其药物组合。
[0100]
术语“协同效应”指两种或多种成份(例如抗pd-1抗体或式i化合物)所产生的效果(例如抑制结肠癌生长、或缓解结肠癌症状)大于成份单独给药的效果的简单加成。
[0101]
本技术还包括以下内容:
[0102]
1.一种药物组合在制备治疗或预防子宫内膜癌药物中的用途,所述药物组合包含:
[0103]
a)人类pd-1抗体,所述人类pd-1抗体包含轻链和重链,其中所述轻链包含轻链互补决定区lcdr1、lcdr2和lcdr3,所述轻链互补决定区分别由seq id no:1、seq id no:2和seq id no:3所示的氨基酸序列组成,且其中所述重链包含重链互补决定区hcdr1、hcdr2和hcdr3,所述重链互补决定区分别由seq id no:4、seq id no:5和seq id no:6所示的氨基酸序列组成,以及
[0104]
b)酪氨酸激酶抑制剂,其中所述酪氨酸激酶抑制剂是式i的化合物或其药学上可接受的盐,
[0105][0106]
2.根据项1所述的用途,其中式i的化合物的药学上可接受的盐为1-[[[4-(4-氟-2-甲基-1h-吲哚-5-基)氧基-6-甲氧基喹啉-7-基]氧基]甲基]环丙胺的盐酸盐,优选为二盐酸盐。
[0107]
3.根据项1-2任一项所述的用途,其中所述人类pd-1抗体包含氨基酸序列如seq id no:7所示的轻链可变区和如seq id no:8所示的重链可变区。
[0108]
4.根据项1-3任一项所述的用途,其中所述人类pd-1抗体是14c12h1l1。
[0109]
5.根据项1-4任一项所述的用途,所述药物组合是非固定组合。
[0110]
6.根据项1-5任一项所述的用途,所述非固定组合中的人类pd-1抗体和式i化合物或其药学上可接受的盐各自呈药物组合物形式。
[0111]
7.根据项1-6任一项所述的用途,所述子宫内膜癌为一型子宫内膜癌或二型子宫内膜癌。
[0112]
8.根据项1-7任一项所述的用途,所述子宫内膜癌为晚期的,或复发性的,或转移性的,或不可切除的。
[0113]
9.根据项1-8任一项所述的用途,所述子宫内膜癌为晚期复发性的,或晚期转移性的,或晚期不可切除的。
[0114]
10.根据项1-9任一项所述的用途,患所述子宫内膜癌的主体为不适合接受根治性治疗方法,或所述主体先前未接受系统性治疗或已接受过系统性治疗,或所述主体先前已接受手术、化疗和/或放射治疗。
[0115]
11.根据项1-10任一项所述的用途,所述子宫内膜癌是msi-h或dmmr阳性的。
[0116]
12.根据项1-11任一项所述的用途,所述药物组合中式i化合物盐酸盐的统一施用剂量在大约8mg/次、10mg/次或12mg/次,优选12mg/次,14c12h1l1每次的统一施用剂量在大约100mg、大约150mg、大约200mg、大约250mg、大约300mg、大约350mg、大约400mg、大约450mg、大约500mg、大约600mg、大约700mg、大约800mg、大约900mg、或大约1000mg,优选200mg。
[0117]
13.根据项1-12任一项所述的用途,所述药物组合中式i化合物盐酸盐给药方式为每日1次,每次8mg、10mg或12mg,连续口服2周停1周,14c12h1l1注射液给药方式为每3周给药1次,100mg/次、150mg/次或200mg/次。
[0118]
施用方式
[0119]
下述内容并非限制本技术药物组合的施用方式。
[0120]
本技术的药物组合中的组分可以各自分开配制、或者其中的部分或全部共同配制。在一个实施方案中,本技术的药物组合可以配制成适合于单次或多次施用的药物组合物。
[0121]
本技术的药物组合中的组分可以各自单独施用、或者其中的部分或全部共同施用。本技术的药物组合中的组分可以基本上不同时施用,或者其中的部分或全部基本上同时施用。
[0122]
本技术的药物组合中的组分可以各自独立地、或者其中的部分或全部共同以适合的各种途径施用,包括但不限于,口服或肠胃外(通过静脉内、肌内、局部或皮下途径)。在一些实施方案中,本技术的药物组合的组分可以各自独立地、或者其中的部分或全部共同口服施用或注射施用,例如静脉注射或腹腔注射。
[0123]
本技术的药物组合中的组分可以各自独立地、或者其中的部分或全部共同是适合的剂型,包括但不限于,片剂、含片、丸剂、胶囊剂(例如硬胶囊、软胶囊、肠溶胶囊、微囊剂)、酏剂、颗粒剂、糖浆剂、注射剂(肌肉内、静脉内、腹腔内)、颗粒剂、乳剂、悬浮液、溶液、分散剂和用于口服或非口服给药的缓释制剂的剂型。
[0124]
本技术的药物组合中的组分可以各自独立地、或者其中的部分或全部共同含有药学上可接受的载体和/或赋形剂。
[0125]
本技术的药物组合还可以包含另外的治疗剂。在一个实施方式中,所述另外的治疗剂可以是本领域已知的癌症治疗剂。
具体实施方式
[0126]
下面结合具体实施例对本技术进行进一步的描述,然而,本技术中这些实施例仅用于阐明而不限制本技术的范围。同样,本技术不限于本文描述的任何具体优选的实施方案。本领域技术人员应该理解,对本技术技术特征所作的等同替换、或相应的改进仍属于本技术的保护范围之内。除特别说明的以外,以下实施例采用的试剂均为市售产品,溶液的配制可以采用本领域常规技术。
[0127]
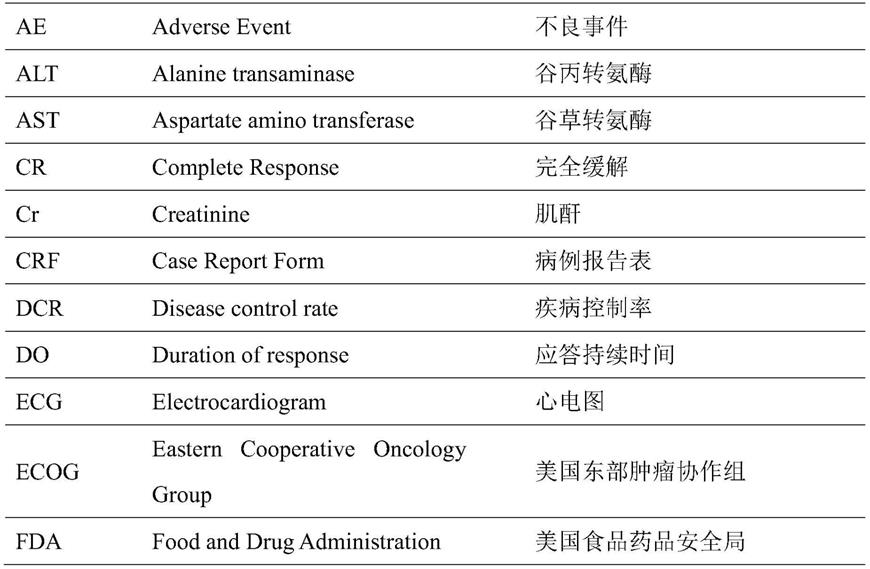
表1缩略语表
[0128]
[0129][0130]“14c12h1l1注射液”是指含14c12h1l1单克隆抗体的注射用医用配制品,其通常以静脉输注途径给予患者。在具体实施例中,“14c12h1l1注射液,200mg/次”的表述可以按照本领域通常方式的理解为每次给予患者含有200mg 14c12h1l1单克隆抗体的液态注射用医用配制品。
[0131]
实施例一 盐酸安罗替尼联合14c12h1l1治疗复发性或晚期子宫内膜癌临床研究方案
[0132]
本实施例披露了盐酸安罗替尼联合14c12h1l1治疗复发性或晚期子宫内膜癌临床研究方案。主要研究目的是研究者根据recist1.1及irrecist评估复发性或晚期子宫内膜癌的orr。
[0133]
关键入选标准:年龄大于18岁,女性;经组织学证实的子宫内膜癌;复发性或晚期子宫内膜癌至少接受过一线含铂方案系统化疗;根据recist 1.1标准有客观可测量的病
灶,至少1个靶病灶。
[0134]
关键排除标准:
[0135]
(1)病理学有癌肉瘤的成分(包括恶性混合苗勒氏瘤,内膜平滑肌肉瘤以子宫内膜间质肉瘤);
[0136]
(2)首次给药前4周接受过其他抗肿瘤药物的治疗;
[0137]
(3)在28天内接受过大手术或预计在研究期间需要大手术;
[0138]
(4)在给药前21天接受过放疗(对骨转移姑息性的放疗为2周内)。
[0139]
(5)既往接受过抗pd1抗体治疗;
[0140]
(6)患者尚有因既往治疗引起的无法缓解的大于1度的不良反应(脱发除外,神经毒性大于2度);
[0141]
(7)正在使用免疫抑制剂、或全身激素治疗以达到免疫抑制的目的(剂量》10mg/天泼尼松或其他等效激素制剂),并在入组前2周仍然使用。
[0142]
(8)既往5年内患有其他恶性肿瘤(经充分治疗各种原位恶性肿瘤除外,如乳腺癌,膀胱癌,宫颈原位癌,皮肤基底细胞癌或鳞状细胞癌)。
[0143]
给药剂量:
[0144]
盐酸安罗替尼胶囊:
[0145]
每日1次(建议在14c12h1l1注射液开始输注
±
60min内空腹服用),每次8mg(最终剂量由安全导入期确定,暂定12mg)。连续口服2周停1周,即3周(21天)为一治疗周期。用药期间如出现漏服,确认距下次用药时间短于12小时,则不再补服。
[0146]
14c12h1l1注射液:
[0147]
每3周给药1次,200mg/次,静脉输注给药。输注时间为60
±
10min。
[0148]
用药周期:
[0149]
每21天为一个治疗周期,用药期间不能进行其它抗肿瘤治疗;疾病控制(cr+pr+sd)且不良反应可以耐受的患者,持续用药,直到疾病进展或不能耐受。
[0150]
每2个周期评估一次疗效,16周期后每4个周期评估一次疗效。疾病控制(cr+pr+sd)且不良反应可以耐受的患者,可持续用药,至失去临床获益、毒性不可耐受、疗效评价为pd、研究者认为不适合继续用药时研究结束。
[0151]
终止治疗标准:
[0152]
(1)受试者撤回知情同意;
[0153]
(2)经影像学检查显示病情进展;
[0154]
(3)因pd-1有影像学假进展的情况,除了临床快速,显著的进展外,首次出现疾病进展,需要在4-6周后进行确认。
[0155]
(4)14c12h1l1累计用药达到2年;
[0156]
(5)影像学检查认为cr的受试者用药满6个周期可考虑停药;
[0157]
(6)无法耐受毒性;
[0158]
(7)依从性不佳。
[0159]
结果,在复发性或晚期子宫内膜癌临床研究中,可预期盐酸安罗替尼联合14c12h1l1表现出一定的治疗潜能。
[0160]
实施例二 疾病进展与疗效评估
[0161]
14c12h1l1注射液的同类药物在临床用药期间,受试者存在假性进展,本次研究的疗效评估标准依据recist 1.1(实体瘤的疗效评价标准)。同时使用irecist标准(肿瘤免疫治疗相关评价标准)对疗效进行确认。即按recist 1.1标准判定为疾病进展(pd)的受试者,按irecist标准进一步确认,从而决定是否进一步用药观察。
[0162]
从第一周期第一天开始,每2个周期评估一次疗效,16周期后每4个周期评估一次疗效,直至受试者发生肿瘤影像学证实的疾病进展,该评估不会因为受试者延迟或中断治疗而改变评估频率。如果受试者因为非疾病进展原因终止研究治疗,仍需要持续接受上述频率肿瘤影像学评估直到受试者开始新的抗肿瘤治疗、或影像学证据的疾病进展、或受试者主动退出、或受试者死亡,以先出现者为准。
[0163]
肿瘤的影像学评价方式可采用ct或mri,但在整个研究期间评价方法、机器和技术参数应保持一致;如果无禁忌症,应使用造影剂。如果在首次给药前14天内已进行肿瘤评价,且在同一家医院使用同样的方法,可作为基线肿瘤评价。基线肿瘤评价应包括胸部、腹部和盆腔的ct或mri。筛选期需行颅脑平扫+增强/增强mri检查。所有可疑的病灶部位都应该行影像学检查。对于有骨转移的患者,应使用骨扫描对病灶进行随访。对于骨转移的患者,如果没有临床症状加重,不需每次肿瘤评估进行复查,如有临床症状加重,应及时复查。对于在计划中的下次评价开始前怀疑出现疾病进展的病例,应进行一次计划外的肿瘤评估。试验期间只做有病灶部位的影像学检查,期间有可疑部位,可以加查对应部位影像。
[0164]
实施例三.生物样本的采集
[0165]
3.1血清抗14c12h1l1抗体(ada)检测
[0166]
免疫原性监测的时间点以14c12h1l1注射液给药时间为准;14c12h1l1延迟给药时,免疫原性采血相应延迟。若检测出受试者的ada呈阳性时,则加测中和抗体。
[0167]
在第1、2、4、8周期及此后每6个周期给药前(-60min)采集。同时在第1周期和第8周期输注结束后30min(
±
5min)和末次给药后30天(
±
7天)、90天(
±
7天)采集。需要每次采血5ml静脉血,置于含促凝分离胶的采血管中,室温放置30min,自然凝固后,3000g离心10min,平均分装到4个冻存管中(检测管3份,备份管1份,每个检测管不少于0.5ml),取血清标记后置-40至-80℃冰箱保存供检测免疫原性和14c12h1l1血药浓度。
[0168]
在试验期间出现与免疫相关的非预期不良事件,在不良事件确认后需及时额外增加1次采血,用来检测免疫原性和14c12h1l1血药浓度,但距最近一次采集血样的时间不足24h,可以不采集。
[0169]
注意:根据ada结果,后续若有需要会加测中和抗体。
[0170]
3.2生物标志物测定
[0171]
参加本研究需要提供肿瘤组织标本进行生物标志物研究,包括pd-1/pd-l1表达、错配修复/微卫星不稳定(mmr/msi)检测等。
[0172]
生物标志物检测的样本,优先选择入组前1个月内新鲜活检组织样本。取新鲜组织样本时,经皮穿刺1针及以上。如果无法获取新鲜活检组织样本,可收集使用存档组织样本,取未经染色病理组织切片(防脱)10张,厚度为4-6μm,新鲜切取制备的白片,若不能及时(一个月内)送出,需进行封蜡处理。
[0173]
实施例四.有效性与安全性评价
[0174]
4.1.主要疗效指标的分析
[0175]
4.1.1.客观缓解率(objective response rate,orr):
[0176]
计算各组客观缓解例数(pr+cr)占各组总病例数的比率及95%ci。orr的95%ci基于f分布的精确二项方法计算。
[0177]
4.1.2.次要疗效指标的分析
[0178]
4.1.2.1.无进展生存期(pfs)
[0179]
采用kaplan-meier法估计中位pfs,并绘制生存曲线图。
[0180]
4.1.2.2.总生存期(os)
[0181]
采用kaplan-meier法估计中位os,并绘制生存曲线图。
[0182]
4.1.2.3.缓解持续时间(duration of response,dor)
[0183]
采用kaplan-meier法估计中位pfs及其95%ci,并绘制生存曲线图。
[0184]
4.1.2.4.疾病控制率(dcr):
[0185]
计算疾病控制例数(cr+pr+sd)占总病例数的比率及95%ci。dcr的95%ci基于f分布的精确二项方法计算。
[0186]
4.2.安全性评价
[0187]
4.2.1.药物暴露量与依从性情况
[0188]
对药物暴露量采用均数、标准差、最大值、最小值、中位数描述。
[0189]
总结受试者暴露于研究药物治疗的情况,病人完成周期数的情况、治疗期间剂量调整情况、治疗期间累计调整剂量次数的情况等。
[0190]
对治疗期内研究药物治疗时间,研究药物服用总剂量及日平均剂量和研究药物剂量依从性进行统计描述。
[0191]
研究药物剂量依从性将基于ecrf记录的每天实际服用的研究药物总剂量和方案规定研究药总剂量进行计算。
[0192]
各研究药物治疗时间、研究药物服用总剂量及日平均剂量和研究药物剂量依从性的比较采用单因素方差分析,依从性分类的比较采用卡方检验或fisher精确概率法。
[0193]
4.2.2.不良事件
[0194]
汇总不良事件、首次用药前的不良事件、治疗期间不良事件、治疗期间非预期不良事件、治疗期间重要不良事件、治疗期间特别关注的不良事件、治疗期间3级及以上不良事件、治疗期间严重不良事件、治疗期间与研究药物相关的不良事件、治疗期间与研究药物相关的saes、治疗期间导致剂量调整、治疗永久停止、试验终止、患者死亡的不良事件的例次、例数和发生率,按照soc、pt分类汇总。
[0195]
按照pt分类汇总治疗期间发生率≥5%的不良事件、药物相关不良事件。
[0196]
按照pt分类汇总治疗期间ctc ae分级为3级或4级的药物相关不良事件。
[0197]
按照pt分类汇总治疗期间发生率≥10%的不良事件、药物相关不良事件。
[0198]
特别关注的不良事件中位首次发生时间。
[0199]
4.2.3.生命体征
[0200]
采用均数
±
标准差、最大值、最小值、中位数描述治疗前后的测量值和变化值。
[0201]
4.2.4.实验室检查指标
[0202]
表2检查项目表
[0203][0204][0205]
血常规、血生化、甲状腺功能、凝血功能、淀粉酶、脂肪酶采用均数
±
标准差、最大值、最小值、中位数描述治疗前后的测量值和变化值,组内比较采用配对t检验。采用交叉分类表描述治疗前后正常、异常的变化情况。
[0206]
尿常规:采用交叉分类表描述治疗前后正常、异常的变化情况。
[0207]
便常规:采用交叉分类表描述治疗前后正常、异常的变化情况。
[0208]
描述异常变化的受试者中的“异常、并有临床意义”的比例,其中异常有无临床意义由研究者判断。
[0209]
4.2.5.心电图
[0210]
心电图:根据研究者判断的正常、异常,描述治疗前后正常、异常的变化情况。
[0211]
心率、pr间期、qrs间期、qt间期和qtc采用均数
±
标准差、最大值、最小值、中位数
描述用药前后的测量值和变化值。心电图总体评估结果采用交叉分类表描述用药前后正常、异常的变化情况。描述异常变化的受试者中的“异常有临床意义”的比例,其中异常有无临床意义由研究者判断。列表呈现给药后异常清单。
[0212]
4.2.6.体格检查
[0213]
描述治疗前后正常、异常的变化情况。
[0214]
根据本技术所公开的内容,虽然根据优选实施方案对本技术的组合物和方法进行了描述,但对本领域技术人员而言,在不背离本技术的概念、精神和范围的情况下,可对在此所述的组合物和/或方法以及所述方法的步骤或步骤的顺序进行改变。
[0215]
本文所引用的所有文献的公开内容通过引用结合于此,引用程度为,它们提供示例性的、程序上和其他的细节补充本文所述内容。
[0216]
研究者基于recist1.1或者irrecist首次评估影像学进展后,如果受试者临床疾病稳定,可和患者沟通,获得患者知情同意后继续当前治疗,4-6周后再行影像学评估确认,如果再次确认进展,可停止治疗。14c12h1l1最长治疗时间为24个月。研究过程中受试者应持续接受治疗,直至发生客观疾病进展、不可耐受的毒性、受试者撤销知情同意、失访或死亡、研究者或申办方决定让受试者退出试验。
[0217]
盐酸安罗替尼:12mg/片,qd,口服,d1-d14,q3w。
[0218]
直至疾病进展或出现不可耐受的不良反应。用药期间如出现漏服,确认距下次用药时间短于12小时,则不再补服。
[0219]
自用药时起,第2治疗周期(
±
7天)和第4周(
±
7天)分别接受1次肿瘤影像学评价,接下来每3个治疗周期(
±
7天)进行一次肿瘤影像学评价到第10个周期(即第7以及第10周期);10个治疗周期以后按每4个治疗周期(
±
7天)进行一次肿瘤影像学评价。
[0220]
本研究采用simon二阶段设计估算样本量。alpha值取0.05(单侧),beta值取0.2,检验效能为0.8。
[0221]
临床结果显示,本发明所述的药物组合在治疗或预防子宫内膜癌上有显著效果。
[0222]
根据本技术所公开的内容,虽然根据优选实施方案对本技术的组合物和方法进行了描述,但对本领域技术人员而言,在不背离本技术的概念、精神和范围的情况下,可对在此所述的组合物和/或方法以及所述方法的步骤或步骤的顺序进行改变。
[0223]
本文所引用的所有文献的公开内容通过引用结合于此,引用程度为,它们提供示例性的、程序上和其他的细节补充本文所述内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1