一种小分子化合物在制备治疗新型冠状病毒所致疾病的药物中的应用的制作方法
1.本发明涉及医药技术领域,具体涉及3,3,3’,3’,9,9
’‑
六甲基-4,4’,9,9
’‑
四氢-3-氢,3
’‑
氢-1,1
’‑
双吡咯[3,4-b]吲哚在制备预防和/或治疗新型冠状病毒所致疾病的药物中的应用。
背景技术:
[0002]
新型冠状病毒(sars-cov-2)是新型冠状病毒肺炎(covid-19)的病原体。sars-cov-2与sars-cov病毒均属于冠状病毒科(coronaviridae),冠状病毒β属。sars-cov-2是一种正链单股rna冠状病毒。其rna序列长度约30kb。covid-19病毒粒子外膜由4种结构蛋白组成,包括n蛋白(nucleocapsid,核衣壳蛋白)、s蛋白(spikeprotein)、e蛋白(envelope protein)和m蛋白(membrane protein)。其中的s蛋白决定了病毒的宿主范围和特异性。到目前为止,尚且没有任何特效药物能够治愈新型冠状病毒肺炎。因此,要完全战胜新冠病毒,相应的抗新冠病毒药物的研发也是至关重要的。
[0003]
3,3,3’,3’,9,9
’‑
六甲基-4,4’,9,9
’‑
四氢-3-氢,3
’‑
氢-1,1
’‑
双吡咯[3,4-b]吲哚是新近合成的化合物,其结构式如下式(i)所示,
[0004][0005]
目前尚无3,3,3’,3’,9,9
’‑
六甲基-4,4’,9,9
’‑
四氢-3-氢,3
’‑
氢-1,1
’‑
双吡咯[3,4-b]吲哚用于制备预防或治疗新型冠状病毒感染的药物的报道。
技术实现要素:
[0006]
为克服现有技术中存在的不足,本发明的目的是提供3,3,3’,3’,9,9
’‑
六甲基-4,4’,9,9
’‑
四氢-3-氢,3
’‑
氢-1,1
’‑
双吡咯[3,4-b]吲哚在制备预防和/或治疗新型冠状病毒sars-cov-2所致疾病的药物中的应用。
[0007]
具体而言,为解决本发明的技术问题,采用如下技术方案:
[0008]
第一方面,本发明提供式(i)化合物3,3,3’,3’,9,9
’‑
六甲基-4,4’,9,9
’‑
四氢-3-氢,3
’‑
氢-1,1
’‑
双吡咯[3,4-b]吲哚在如下x1)-x5)中任一种的应用:
[0009][0010]
x1)制备预防和/或治疗新型冠状病毒sars-cov-2所致疾病的产品;
[0011]
x2)制备预防和/或治疗新型冠状病毒sars-cov-2感染的产品;
[0012]
x3)制备新型冠状病毒sars-cov-2抑制剂;
[0013]
x4)制备抑制新型冠状病毒sars-cov-2增殖的产品;
[0014]
x5)制备抑制新型冠状病毒sars-cov-2产生细胞病变效应的产品。
[0015]
优选地,上述应用中,式(i)化合物可以作为唯一活性成分,或者可以与一种、两种或更多种其他抗病毒药物一起作为活性成分。
[0016]
优选地,其他抗病毒药物选自更昔洛韦、阿昔洛韦、金刚烷胺、金刚乙胺、奥司他韦、阿巴卡韦、醋孟南、阿昔洛韦钠、阿德福韦、阿洛夫定、阿韦舒托、盐酸三环癸胺、阿拉诺丁、阿立酮、阿替韦啶甲磺酸酯、阿夫立定、西多福韦、西潘茶碱、恩曲他滨、盐酸阿糖胞苷、甲磺酸地拉韦啶、地昔洛韦、去羟肌苷、二噁沙利、依度尿苷、乙米韦林、依曲西他平、恩韦拉登、恩韦肟、贺普丁、泛昔洛韦、盐酸氯苯氢异喹、非西他滨、非阿尿苷、磷利酯、膦甲酸钠、膦乙酸钠、甘西洛维钠、碘苷、茚地那韦、乙氧丁酮醛、拉米夫定、洛布卡韦、洛德腺苷、洛匹那韦、盐酸美莫汀、甲红硫脲、那非那韦、奈韦拉平、喷昔洛韦、吡罗达韦、利巴韦林、甲磺酸沙奎那韦、利托那韦、盐酸索金刚胺、索立夫定、匍枝青霉菌素、司他夫定、替诺福韦、盐酸梯络龙、曲氟尿苷、盐酸伐昔洛韦、阿糖腺苷、磷酸阿糖腺苷、阿糖腺苷磷酸钠、替拉那韦、韦罗肟、扎西他滨、齐多夫定、净韦肟。
[0017]
优选地,上述应用中,新型冠状病毒sars-cov-2所致疾病为sars-cov-2引起的感染性疾病或其并发症;进一步优选地,感染性疾病为呼吸道感染疾病。
[0018]
优选地,所述产品为药物。
[0019]
第二方面,本发明提供一种包含式(i)化合物的药物组合物在如下x1)-x5)中任一种应用:
[0020]
x1)制备预防和/或治疗新型冠状病毒sars-cov-2所致疾病的产品;
[0021]
x2)制备预防和/或治疗新型冠状病毒sars-cov-2感染的产品;
[0022]
x3)制备新型冠状病毒sars-cov-2抑制剂;
[0023]
x4)制备抑制新型冠状病毒sars-cov-2增殖的产品;
[0024]
x5)制备抑制新型冠状病毒sars-cov-2产生细胞病变效应的产品。
[0025]
本发明还提供预防和/或治疗新型冠状病毒sars-cov-2相关疾病的方法,包括给予患者预防或治疗有效量的包含式(i)化合物的药物组合物。
[0026]
根据本发明的实施方案,所述新型冠状病毒sars-cov-2相关疾病可以包括新型冠状病毒sars-cov-2所致疾病、新型冠状病毒sars-cov-2感染、新型冠状病毒sars-cov-2增殖或新型冠状病毒sars-cov-2产生的细胞病变效应。
[0027]
优选地,所述药物组合物还包含药学上可接受的载体和/或赋型剂。
[0028]
优选地,所述载体包括但不限于水溶性载体材料(如聚乙二醇、聚乙烯吡咯烷酮、有机酸等)、难溶性载体材料(如乙基纤维素、胆固醇硬脂酸酯等)、肠溶性载体材料(如醋酸纤维素酞酸酯和羧甲乙纤维素等)。其中优选的是水溶性载体材料。
[0029]
优选地,所述赋形剂的某些实例包括乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、淀粉、阿拉伯胶、磷酸钙、藻酸盐、黄蓍胶、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆和甲基纤维素。
[0030]
优选地,所述药物组合物中还可以添加常规的助溶剂、缓冲剂、ph调节剂等。
[0031]
优选地,所述药物组合物中添加着色剂、防腐剂、香料、矫味剂、甜味剂或其它材料。
[0032]
优选地,所述药物组合物的剂型,包括但不限于片剂、胶囊、滴丸、气雾剂、丸剂、粉剂、溶液剂、混悬剂、乳剂、颗粒剂、脂质体、透皮剂、口含片、栓剂、冻干粉针剂等。上述各种剂型的药物均可以按照药学领域的常规方法制备。使用上述剂型可以经注射给药,包括皮下注射、静脉注射、肌肉注射和腔内注射等;腔道给药,如经直肠和阴道;呼吸道给药,如经鼻腔,粘膜给药。
[0033]
可按单位剂型配制组合物,每一剂量含约5~1000mg,更通常约100~500mg活性成分。术语“单位剂型”是指物理上分离的适宜作为用于人患者和其它哺乳动物的单一剂量单位,各单位含有与适宜的药物赋形剂混合的经计算可产生所需疗效的预定量的活性物质。
[0034]
活性化合物的有效剂量的范围可很大,通常按药用有效量给药。但是,可以理解实际给予的化合物的量通常由医师根据相关情况决定,它们包括所治疗的病症、所选择的给药途径、所给予的实际化合物;患者个体的年龄、重量和反应;患者症状的严重程度等。
[0035]
对于制备固体组合物例如片剂,将主要的活性成分与药物赋形剂混合,形成含本发明化合物的均匀混合物的固体预制剂组合物。当称这些预制剂组合物为均匀时,是指活性成分通常均匀地分布在整个组合物中,致使该组合物可容易地划分为同等有效的单位剂型例如片剂、丸剂和胶囊剂。然后将该固体预制剂划分为上述类型的含例如约0.1~1000mg本发明活性成分的单位剂型。
[0036]
可将本发明片剂或丸剂包衣或复合,得到提供长效作用优点的剂型。例如,片剂或丸剂含内剂量和外剂量组分,后者是前者的被膜形式。可通过肠溶层将两种组分隔离,肠溶层用于在胃中阻止崩解,以使内组分完整通过十二指肠或延迟释放。多种物质可用于此类肠溶层或包衣剂,此类物质包括多种高分子酸和高分子酸与此类物质如虫胶、鲸蜡醇和醋酸纤维素的混合物。
[0037]
其中可掺入本发明化合物和组合物,用于口服或注射给药的液体形式包括水溶液、适当矫味的糖浆剂、水或油混悬液;和用食用油例如棉子油、芝麻油、椰子油或花生油矫味的乳剂;以及酏剂和类似的药用溶媒。
[0038]
用于吸入或吹入的组合物包括溶于药学上可接受的水或有机溶剂或其混合物的溶液剂和混悬液、散剂。液体或固体组合物可含有如上所述适宜的药学上可接受的赋形剂。
在某些实施方案中,通过口服或鼻呼吸途径给予组合物,实现局部或全身作用。可通过使用呈惰性的气体,使组合物成雾化。可直接由雾化装置吸入雾化溶液,或雾化装置可与面罩帷或间歇正压呼吸机连接。可通过口服或由按适当方式递送制剂的装置通过鼻给予溶液、混悬液或粉末组合物。
[0039]
给予患者的化合物或组合物的量不固定,取决于给予的药物、给药的目的例如预防或治疗;患者的状态、给药的方式等。在治疗应用时,可给予已患疾病的患者足够治愈或至少部分抑制疾病及其并发症症状的量的组合物。有效剂量应取决于所治疗的疾病状态和主治临床医师的判断,该判断取决于例如疾病的严重程度、患者的年龄、体重和一般状况等因素。
[0040]
给予患者的组合物可以是上述药用组合物形式。可通过常规灭菌技术或可过滤灭菌,将这些组合物灭菌。可将水溶液包装原样使用,或冻干,给药前,将冻干制剂与无菌水性载体混合。化合物制剂的ph通常为3~11,更优选5~9,最优选7~8。可以理解,使用某些前述赋形剂、载体或稳定剂会导致形成药物盐。
[0041]
本发明化合物的治疗剂量可根据例如以下而定:治疗的具体用途、给予化合物的方式、患者的健康和状态,以及签处方医师的判断。本发明化合物在药用组合物中的比例或浓度可不固定,取决于多种因素,它们包括剂量、化学特性(例如疏水性)和给药途径。例如可通过含约0.1~10%w/v该化合物的生理缓冲水溶液提供本发明化合物,用于肠胃外给药。某些典型剂量范围为约1μg/kg~约1g/kg体重/日。在某些实施方案中,剂量范围为约0.01mg/kg~约100mg/kg体重/日。剂量很可能取决于此类变量,如疾病或病症的种类和发展程度、具体患者的一般健康状态、所选择的化合物的相对生物学效力、赋形剂制剂及其给药途径。可通过由体外或动物模型试验系统导出的剂量-反应曲线外推,得到有效剂量。
[0042]
本发明的有益效果:
[0043]
本发明首次发现式(i)化合物(3,3,3’,3’,9,9
’‑
六甲基-4,4’,9,9
’‑
四氢-3-氢,3
’‑
氢-1,1
’‑
双吡咯[3,4-b]吲哚)可抑制新型冠状病毒sars-cov-2增殖及感染宿主细胞,可用作治疗新型冠状病毒感染方面的疾病。
[0044]
式(i)化合物是小分子化合物,其对caco-2细胞的cc
50
为15.62μm,能够剂量依赖的抑制新型冠状病毒sars-cov-2复制,其ic
50
(半数抑制浓度)为0.185μm,选择指数(si)约为84。说明式(i)化合物是低毒高效的抗新型冠状病毒sars-cov-2的药物。
附图说明
[0045]
图1为一种式(i)化合物细胞毒性检测示意图。
[0046]
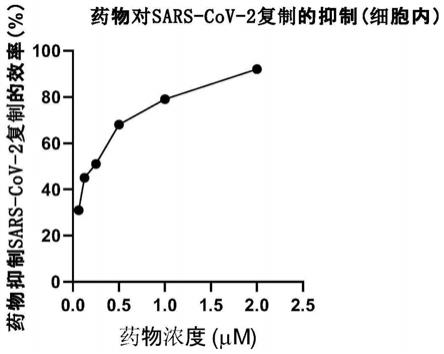
图2为一种式(i)化合物处理新型冠状病毒sars-cov-2感染细胞中病毒复制效率图。
[0047]
图3为一种式(i)化合物处理新型冠状病毒sars-cov-2感染细胞培养液上清中病毒复制效率图。
具体实施方式
[0048]
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。
凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
[0049]
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。
[0050]
定义与说明:
[0051]
本文所用的术语“包含”、“具有”、“包括”或“含有”是指包括在内的或开放式的,并不排除额外的、未引述的元件或方法步骤。
[0052]
本文所用的“或”的定义仅为替代物以及“和/或”,但除非明确表示仅为替代物或替代物之间相互排斥外,权利要求中的术语“或”是指“和/或”。
[0053]
除非另外定义或由背景清楚指示,否则在本公开中的全部技术与科学术语具有如本公开所属领域的普通技术人员通常理解的相同含义。
[0054]
目前,抗新型冠状病毒sars-cov-2药物体外筛选的细胞培养模型是最常用的筛选模型,其优点在于:可提供大量遗传性状相同的细胞为研究对象,操作方便,可消除其它外界因素的影响,并可以检测药物的有效浓度和治疗指数,为后期机理研究提供更多基础。本发明采用细胞培养筛选法检测式(i)所示化合物对新型冠状病毒sars-cov-2感染caco-2细胞的影响,基于对上清和细胞内病毒核酸拷贝数的检测定量分析式(i)化合物抗新型冠状病毒sars-cov-2活性。
[0055]
实施例1:式(i)化合物的制备方法
[0056]
将2-甲基-1(1-甲基-1h-吲哚-3)-2-丙氨(购于国药集团)202mg(1.0mmol)溶解在二氯甲烷中(30ml),在0℃时加入乙二醛水溶液(90μl,0.60equiv.)。再加入干燥的分子筛后搅拌,在酸(如三氟乙酸)作用下,10℃反应过夜。次日使用tlc分析后,原料消失后,过滤去掉分子筛,并用大极性溶剂,如甲醇与二氯甲烷的混合溶剂(1:5),洗涤分子筛,合并反应物,减压蒸馏去掉溶剂,剩余物质使用硅胶(200-300目)分离得到目标产物,产率71%左右,反应式如下:
[0057][0058]
化合物表征如下:
[0059]1h nmr(600mhz,cdcl3)δ7.61(d,j=8.0hz,2h),7.30(dd,j=11.0,4.0hz,2h),7.27(d,j=6.5hz,2h),7.15(dd,j=10.9,3.9hz,2h),3.62(s,6h),3.00(s,4h),1.44(s,3h
×
4).
[0060]
13
c nmr(151mhz,cdcl3)δ155.44,138.90,128.54,125.43,124.43,119.89,117.52,110.16,56.40,32.23,32.12,31.81,31.68,28.19.
[0061]
hrms-esi m/z calcd for c
28h30
n4[m+h]
+
423.2549,found 423.2540.
[0062]
以上制备方法参考了发明名称:一种含氮多环类芳香化合物及其制备方法和应用(申请号:202110721322.5)的专利申请。
[0063]
实施例2:式(i)化合物(3,3,3’,3’,9,9
’‑
六甲基-4,4’,9,9
’‑
四氢-3-氢,3
’‑
氢-1,1
’‑
双吡咯[3,4-b]吲哚)抗新型冠状病毒活性的评价
[0064]
1.实验材料
[0065]
1.1细胞、病毒和药物
[0066]
caco-2细胞购自atcc(货号:htb-037)。
[0067]
sars-cov-2活病毒(编号ivcas 6.7512),由中国科学院武汉病毒研究所国家病毒保藏中心提供。
[0068]
式(i)化合物购自翰香生物科技公司(biochempartner)。
[0069]
1.2试剂
[0070]
dmem培养基和fbs购自gibco公司;cck8细胞活性检测试剂盒购自thermofisher公司;sybr混合液(itaq
tm universalgreen supermix)购自bio-rad公司。
[0071]
1.3实验仪器
[0072]
定量rcp仪(bio-rad cfx96 touch
tm real-time pcr detection system)购自bio-rad公司。多标记微孔板读取仪购自perkinelmer公司。1.0r型冷冻离心机和细胞培养箱购自thermofisher公司。
[0073]
2.实验方法与结果
[0074]
2.1细胞培养
[0075]
37℃,5%co2加湿培养箱中培养。使用含有10%fbs、100u/ml的青霉素和链霉素的dmem培养基。细胞至90%汇合度后传代,传代比例1/3
–
1/4。
[0076]
2.2病毒培养
[0077]
200μl/管分装并置-70℃冻存备用。
[0078]
2.3式(i)化合物的细胞毒性检测
[0079]
caco-2细胞按8
×
103细胞/孔(100μl)接种于96孔细胞培养板中,细胞贴壁后备用;用细胞维持液(dmem+2%血清)将药物以8000.0μm为最高浓度按照2倍梯度稀释共计6个梯度(20μm,10μm,5μm,2.5μm,1.25μm,0.625μm)进行处理,每梯度3个复孔。培养48h后弃掉培养上清,于每孔中加入10μl含有cck8试剂,置细胞培养箱中继续培养1h,1h后用酶标仪测定在450nm处的吸光度,计算细胞存活率。
[0080]
结果显示(图1)式(i)化合物对caco-2细胞的cc
50
为15.62微摩尔/升。在小于2.5μm范围内对caco-2细胞完全没有细胞毒性,说明式(i)化合物有比较安全的适用范围,即式(i)化合物的给药剂量按照细胞实验用量为0.0~2.0μm。
[0081]
2.4基于荧光定量pcr检测式(i)化合物抑制sars-cov-2复制的效率(以下实验均在bsl-3实验室中进行)
[0082]
2.4.1.将caco-2细胞按1.0
×
104细胞/孔接种于48孔细胞培养板中,37℃细胞培养箱中培养14~18h后,待细胞长成单层后备用。将孔板中培养基弃去,pbs清洗两遍后,加入0.5moi病毒液和各浓度梯度药物共500μl于37℃细胞培养箱中培养。药物以2.0μm为起始浓度,连续2倍梯度稀释6个梯度,每梯度设置3个复孔。培养48h后取各实验孔上清和细胞提取rna,逆转录为cdna,然后进行荧光定量pcr检测。实验设置空白对照组、阳性对照组(瑞德西韦)、阴性对照组(病毒感染后无药物处理)和实验药物组。
[0083]
2.4.2.48h后收样,分别用trizol ls收取细胞上清与细胞,病毒灭活后带出生物
安全三级(bsl-3)实验室,用于rna提取。
[0084]
2.4.3按天漠科技公司tr205-50试剂盒说明提取上清和细胞中的rna。
[0085]
2.4.4得到的rna按庄盟zr102反转录试剂盒说明逆转录为cdna。
[0086]
2.4.5通过基因组定量pcr方法(qpcr)检测基因组复制水平。定量rcr引物针对sars-cov-2的s2基因序列,定量rcr引物如下:
[0087]
5'-gctggtgctgcagcttatta-3';
[0088]
5'-agggtcaagtgcacagtcta-3'。
[0089]
选择管家基因gadph作为校正的内参对照基因,针对gadph的定量rcr引物如下:
[0090]
5'-gctccctctttctttgcagcaat-3';
[0091]
5'-taccatgagtccttccacgatac-3'。
[0092]
2.4.6定量的ct值通过内参基因(gapdh)进行校对,然后计算抑制率。计算公式:病毒复制抑制率=(1-药物组/阴性对照组)
×
100%。结果通过graphpad prism 8软件计算出平均值、标准差及ic
50
。
[0093]
2.4.7利用步骤(2.4.6)中的计算结果绘制式(i)化合物抑制sars-cov-2的复制的结果图。结果如图2和图3所示。
[0094]
图2结果显示:在caco-2细胞中,式(i)化合物能剂量依赖地抑制sars-cov-2的复制水平,其对sars-cov-2复制的ic
50
(半数抑制浓度)为0.185微摩尔/升。
[0095]
图3结果显示:在caco-2细胞培养液上清中,式(i)化合物能剂量依赖地抑制sars-cov-2的复制水平,其对sars-cov-2复制的ic
50
(半数抑制浓度)为0.171微摩尔/升。
[0096]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1