阿帕替尼在制备治疗多发性硬化症药物的用途
1.本发明属于医药领域,具体而言,本发明涉及阿帕替尼在制备治疗多发性硬化症药物的用途。
背景技术:
2.多发性硬化症(multiple sclerosis,ms)是一种中枢神经系统(central nervous system,cns)的不可治愈性和渐进性的炎症性疾病,其神经病理学特征包括炎症性脱髓鞘、慢性轴突损伤以及神经退行性变
1.。全球有两百万人受到该疾病的影响,典型的临床症状包括但不限于视神经炎引起的单眼视野、横断性脊髓炎引起的肢体无力或感觉丧失、脑干障碍所致复视以及小脑病变导致共济失调
2.。
3.因与ms具有相似的神经病理学特征,实验性自身免疫性脑脊髓膜炎(experimental autoimmune encephalomyelitis,eae)是用来研究ms最为普遍的动物模型,能够帮助定义ms发展进程中所发生的免疫反应
[3,4]
。eae诱导完成后8-10天,小鼠便会开始出现尾部无力、走路不稳、四肢瘫痪等症状,根据这些症状可以给小鼠做出疾病评分,从而评估小鼠发病的严重程度。eae模型小鼠发病过程中,自身反应性t细胞在外周被活化诱导,随后迁移至中枢神经系统识别由局部抗原提呈细胞所提呈的抗原,攻击表达此类抗原的组织,从而造成神经组织的损伤
[5]
。研究表明,eae是由th1和th17细胞所介导
[6]
,这两种细胞均能够引起疾病的发生。
[0004]
阿帕替尼(apatinib)是新一代高选择性血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,vegfr2)酪氨酸激酶抑制剂,这会在细胞水平阻断vegfr2下游的信号转导
[7]
。第三期临床试验表明,其已被证实是患有晚期胃癌患者的安全有效的治疗药物。
[0005]
th1与th17是cd4+辅助性t细胞的两个细胞亚群,前者主要分泌ifn-γ,后者主要分泌il-17a,通过流式细胞术、酶联免疫吸附试验、实时荧光定量pcr检测这些细胞因子分泌的量,就可定义th1和th17的细胞比例。
[0006]
目前,尚未有阿帕替尼在制备治疗多发性硬化症药物的用途的报道。
技术实现要素:
[0007]
本发明的目的是克服现有技术的不足,提供阿帕替尼在制备治疗多发性硬化症药物的用途。
[0008]
本发明的技术方案概述如下:
[0009]
阿帕替尼在制备治疗多发性硬化症药物的用途。
[0010]
有益效果
[0011]
1.相比于对照组,aptinib选定给药浓度对小鼠无毒性作用;
[0012]
2.根据eae模型发病的临床评分规则,相比于对照组,apatinib治疗组eae模型小鼠的发病程度明显降低;
pbs;将研磨液收集于15ml离心管进行离心,离心条件为4℃、1600rpm、5min,离心结束后弃去上清,用10ml 1x pbs重悬细胞沉淀,随后可进行细胞计数,根据计数结果取1x10^6个细胞进行流式细胞术染色。
[0055]
实施例4
[0056]
中枢神经系统单个核细胞悬液制备(脑和脊髓):
[0057]
首先,用10x pbs将percoll原液配制为90%percoll溶液,即percoll工作溶液;对小鼠进行解剖,取小鼠脑和脊髓,将两者置于同一玻璃研磨器,往玻璃研磨器中加入3ml 1x pbs,然后对脑和脊髓进行研磨;将研磨液收集至15ml离心管,用1x pbs补至7ml,然后加入3ml percoll工作液,此时液体体积为10ml,为溶液a;用1x pbs将percoll工作溶液配制成70%浓度的percoll工作溶液,为溶液b。取3ml溶液b加到一个15ml离心管,随后用电动移液枪将全部溶液a缓慢地沿壁加入到3ml溶液b上层,移液过程中保持上下分层;移液完成后16℃、630g、30min进行离心,并且离心机启动和制动调制为0;离心结束后,缓慢取出离心管以保持分层状态,所需单个核细胞在中间白膜层。
[0058]
实施例5
[0059]
流式细胞术:
[0060]
实施例2、3、4小鼠各组织的单细胞悬液制备完成后,
[0061]
用添加了10%胎牛血清(foetal bovine serum,fbs)和1%青霉素/链霉素混合液的rpmi1640完全培养基在96孔平底板进行细胞铺板,每个孔加入细胞刺激剂(cell activation cocktail,cac),细胞刺激剂与培养基的体积比为1:1000,刺激4小时,刺激结束后将细胞收集到流式管中,1x106个细胞/管;
[0062]
细胞收集后,于4℃、1600rpm、5min离心,弃去上清,
[0063]
每个流式管加入100μl的nir死活染料稀释液进行细胞染色以排除死细胞,在4℃避光15min进行染色;(nir死活染料稀释液的配制:按体积比为1000:1的比例,将1x pbs与nir死活染料混合制成)
[0064]
染色结束后每个管加入1ml 1x pbs,在4℃、1600rpm、5min离心,弃去上清;
[0065]
每个流式管加入50μl第一种抗体稀释液。
[0066]
第一种抗体稀释液是按体积比为200:1的比例,将1x pbs与流式抗体(cd45::fitc和cd4::pe-cy7等体积)混合,得到第一种抗体稀释液;
[0067]
按固定/破膜试剂盒说明书对细胞进行固定和破膜;破膜结束后,每个流式管加入50μl第二种抗体稀释液;所述第二种抗体稀释液是按体积比200:1的比例,将1x pbs与流式抗体(ifn-γ::apc和il-17a::pe等体积)混合,得到第二种抗体稀释液,
[0068]
每个流式管加入50μl第二种抗体稀释液。4℃避光30min,染色结束后每个管加入1ml 1xpbs,在4℃、1600rpm、5min离心。离心结束后弃去上清,用200μl 1x pbs重悬细胞,上机检测,流式数据用flowjo软件进行分析。
[0069]
实施例6
[0070]
评估药物毒性
[0071]
选取6只周龄为6周的c57bl/6雌鼠进行造模。
[0072]
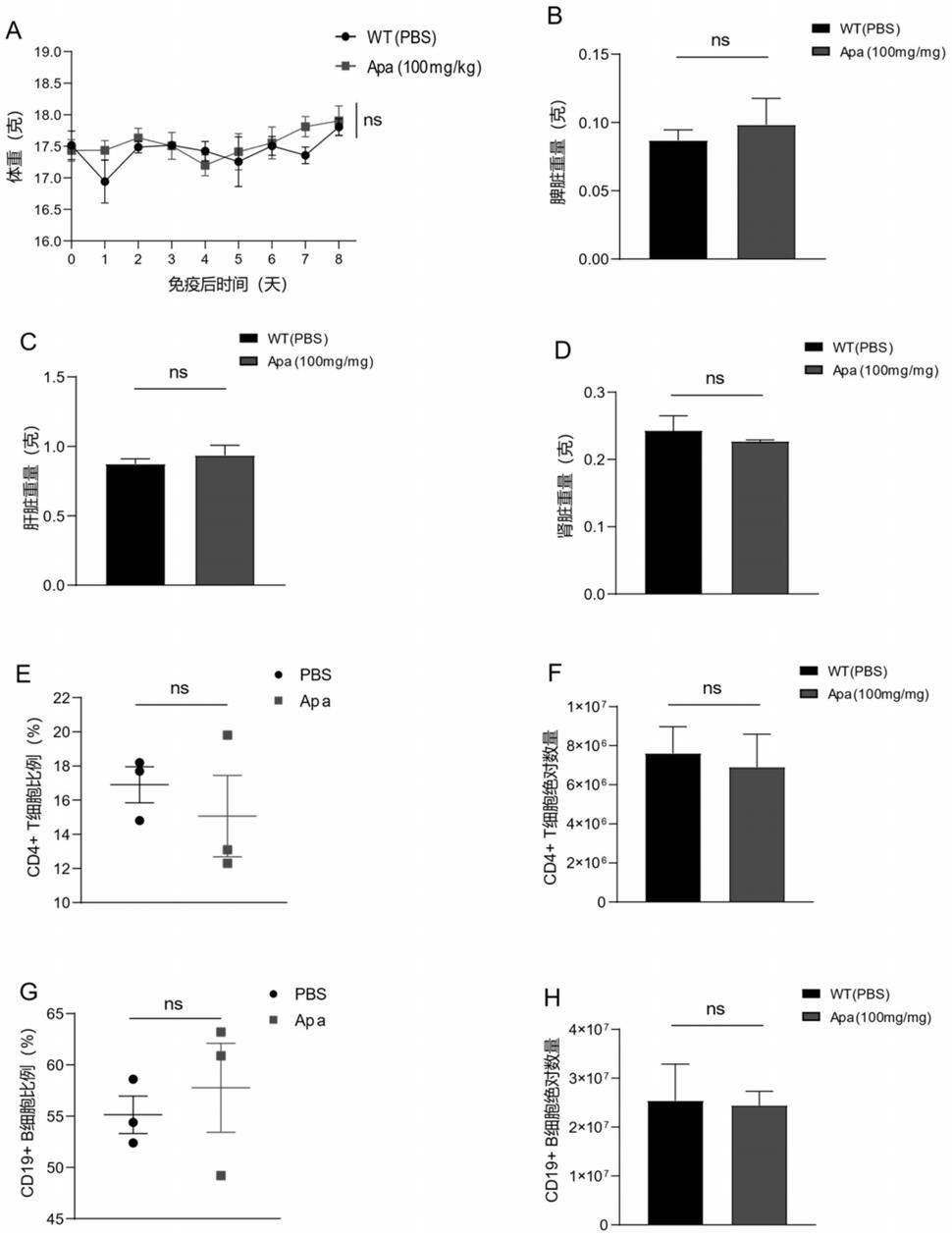
造模成功后,随机分为对照组和给药组,每组3只小鼠;给药组按100mg/kg/只剂量进行灌胃给药200μl,对照组灌胃给予200μl的1x pbs,过程持续7天并且每天记录小鼠体重
(图1a)。而后于第8天取两组小鼠脾脏、肝脏、肾脏进行体外称重并记录(图1b、图1c、图1d),并且通过流式细胞术检测两组小鼠各自脾脏中的cd4+t cells比例和绝对数(图1e、图1f)、cd19+b cell比例和绝对数(图1g、图1h)。(n=3只/组,mean
±
sem)
[0073]
实施例7
[0074]
评估药物治疗效果
[0075]
选取12只周龄为6周的c57bl/6雌鼠进行造模。
[0076]
造模成功后,随机分为对照组和给药组,每组6只小鼠;给药组按100mg/kg/只剂量进行灌胃给药200μl,对照组灌胃给予200μl的1x pbs,过程持续27天并且每天评估小鼠临床评分以及记录体重(图2a、图2e);得到小鼠评分图后,计算两组评分曲线的曲线下面积以及评分峰值均数,进行统计学差异比较(图2b、图2c);将两组小鼠按发病严重程度分级(评分《1分,无疾病;评分1-2分,轻微疾病;评分≥2.5分,严重疾病),进行绘图(图2d)。(n=6只/组,mean
±
sem)
[0077]
实施例8
[0078]
评估药物治疗效果
[0079]
选取20只周龄为6周的c57bl/6雌鼠进行造模。
[0080]
造模成功后,随机分为对照组和给药组,每组10只小鼠;给药组按100mg/kg/只剂量进行灌胃给药200μl,对照组灌胃给予200μl的1x pbs。当小鼠处于即将发病的状态时,即造模后第7天,从两组各取出5只小鼠,通过解剖获取小鼠的脾脏和引流淋巴结,而后制备单细胞悬液,将细胞体外刺激后,进行流式细胞术染色从而检测两组小鼠脾脏和引流淋巴结的th1、th17细胞比例(图3)。当剩余小鼠处于发病高峰期的状态时,即造模后第18天,将两组剩余小鼠全部解剖获取小鼠的脾脏、引流淋巴结以及中枢神经系统,而后制备单细胞悬液,将细胞体外刺激后,进行流式细胞术染色从而检测两组小鼠脾脏、引流淋巴结以及中枢神经系统的th1、th17细胞比例(图4)(n=10只/组,mean
±
sem)
[0081]
相比于对照组,aptinib选定给药浓度对小鼠无毒性作用,如图1;
[0082]
根据eae模型发病的临床评分规则,相比于对照组,apatinib治疗组eae模型小鼠的发病程度明显降低,如图2;
[0083]
apatinib缓解eae模型小鼠的发病是通过降低小鼠体内th1细胞的比例,如图3、4。
[0084]
参考文献
[0085]
[1]e-m frohman,racke m-k,raine c-s.multiple sclerosis
‑‑
the plaque and its pathogenesis[j].n engl j med,2006,354(9):942-955.
[0086]
[2]d-s reich,lucchinetti c-f,calabresi p-a.multiple sclerosis[j].n engl j med,2018,378(2):169-180.
[0087]
[3]sheng li,wu yuqing,yang dongxue,et al.gasdermin d in peripheral myeloid cells drives neuroinflammation in experimental autoimmune encephalomyelitis[j].journal of experimental medicine,2019,216(11):2562-2581.
[0088]
[4]r-m ransohoff.animal models of multiple sclerosis:the good,the bad and the bottom line[j].nat neurosci,2012,15(8):1074-1077.
[0089]
[5]cris-s constantinescu,farooqi nasr,o'brien kate,et al.experimental autoimmune encephalomyelitis(eae)as a model for multiple sclerosis(ms)[j]
.british journal of pharmacology,2011,164(4):1079-1106.
[0090]
[6]ian-l mcwilliams,rajbhandari rajani,nozell susan,et al.stat4 controls gm-csf production by both th1 and th17 cells during eae[j].journal of neuroinflammation,2015,12(1):128.
[0091]
[7]d-j hicklin,ellis l-m.role of the vascular endothelial growth factor pathway in tumor growth and angiogenesis[j].j clin oncol,2005,23(5):1011-1027.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1