蓝靛果花青素提取物在制备改善多囊卵巢综合征的药物和/或保健品中的应用
1.本发明涉及多囊卵巢综合征治疗技术领域,具体涉及一种蓝靛果花青素提取物在制备改善多囊卵巢综合征的药物和/或保健品中的应用。
背景技术:
2.多囊卵巢综合征(pcos)是妇科内分泌最常见的生殖系统疾病,以闭经、不孕、孕后易流产、过度肥胖、多毛等男性化体征为主症,目前影响着全球约 5%-10%的育龄期女性月经、生育,同时也与子代健康密切相关。近年来研究发现pcos患者的代谢异常,主要表现为糖耐量和血脂代谢异常、胰岛素抵抗等临床表现。pcos是一种遗传性疾病,但也有一些其他因素可能导致患病;尽管对其发病机制的研究不断深入,但其发病机制仍不明确,因此,探讨pcos 的发病机制,寻求防治pcos的有效措施一直是妇产科工作者关注的问题。
3.pcos被认为是一种慢性炎症,炎症因子可诱发活性氧自由基(ros)产生过多造成氧化损伤。pcos患者卵泡发育表现为阻滞现象,多停留在小卵泡发育阶段。生理水平的ros有助于卵巢功能维持和卵子发生和卵泡形成,但是过量的ros对女性卵巢功能产生不利的影响。卵巢氧化应激不仅影响着卵泡的发育、卵子的生长和成熟、卵泡的闭锁和排卵等,还会显著降低卵子质量和胚胎的发育潜能。当卵子的氧化应激产物超过机体抗氧化能力,就会引起细胞膜脂质磷酸化的发生并造成细胞dna的损伤,进而影响细胞的分裂、细胞内物质代谢以及线粒体功能,导致卵子质量下降。因此,改善卵巢氧化应激的发生,可能对卵巢功能和卵子质量以及胚胎发育有着积极作用。
4.花青素又称花色素,是一类水溶性天然色素,已知的花青素有20余种,食物中主要存在6种,分别为:天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、牵牛花色素和锦葵色素。花青素极不稳定,自然状态下常以糖苷的形式与葡萄糖、半乳糖、阿拉伯糖等糖类结合形成花色苷。花色苷是一种在植物中普遍存在的多酚类物质,属于黄酮类化合物,是鲜花、水果、蔬菜中重要的着色物质。含花色苷的植物如蓝莓、黑加仑、蓝靛果、桑椹、黑果腺肋花楸、黑果枸杞、紫甘薯、黑米、紫甘蓝等。花色苷一般易溶于水、甲醇、乙醇等有机溶剂中,不溶于乙醚、氯仿等有机溶剂。花色苷的颜色会随ph变化,ph值从强酸—》中性—》强碱,花色苷颜色变化为红色—》紫色—》蓝色。花色苷在可见光的最大吸收波长在500~550nm范围内。花色苷和维生素c一样,有强抗氧化作用,是清除自由基的重要物质,自由基是人体新陈代谢产生的有害物质,会引发癌症、心脑血管疾病、各种炎症和导致人衰老。花色苷是一种天然色素,安全无毒,而且具有一定的营养和药理作用,在食品、化妆品、保健品和药品领域有着巨大的应用潜力。
5.目前,关于花青素的研究较多,然而,关于花青素对pcos患者卵泡发育的影响以及抗氧化作用的研究未见报道。
技术实现要素:
6.本发明的目的在于提供一种蓝靛果花青素提取物在制备改善多囊卵巢综合征的药物和/或保健品中的应用,该蓝靛果花青素提取物能够有效改善多囊卵巢综合征,具体地能够改善卵泡发育阻滞以及提高卵巢储备能力和抗氧化功能。
7.为了实现本发明的上述目的,特采用以下技术方案:
8.本发明第一方面提供一种蓝靛果花青素提取物在制备改善多囊卵巢综合征的药物和/或保健品中的应用。
9.优选地,所述蓝靛果花青素提取物中花青素含量不低于25%。
10.更优选地,所述蓝靛果花青素主要存在的花色苷形式为矢车菊素-3-o-葡萄糖苷、矢车菊素-3-o-芸香糖苷、芍药素-3-o-芸香糖苷和矢车菊素-3,5-双葡萄糖苷,其中,矢车菊素-3-o-葡萄糖苷占比最高,可达90%。
11.优选地,所述蓝靛果花青素提取物通过如下方法得到:
12.(a)采用dl-苹果酸和柠檬酸调节乙醇水溶液ph值至3~4,得到提取液;
13.(b)采用提取液对蓝靛果果渣进行提取、纯化,得到所述蓝靛果花青素提取物。
14.优选地,所述提取包括:
15.将蓝靛果果渣置于提取液中并搅拌一段时间,过滤,收集滤液和滤渣,滤渣重复上述过程2~3次,合并滤液,得到所述提取液。
16.优选地,所述蓝靛果果渣与提取液的质量体积比为1∶(3~5);所述搅拌时间不低于2h。
17.优选地,所述纯化包括:
18.将提取液浓缩、稀释后,过dm21和聚酰胺树脂柱,再采用含有dl-苹果酸和柠檬酸的水溶液进行洗柱,再将洗脱液进行浓缩、喷粉干燥;
19.优选地,所述dl-苹果酸的浓度为0.01%,柠檬酸的浓度为0.01%。
20.本发明第二方面提供一种用于改善多囊卵巢综合征的药物,所述药物包含蓝靛果花青素提取物。
21.本发明第三方面提供一种用于改善多囊卵巢综合征的保健品,所述保健品包含蓝靛果花青素提取物。
22.与现有技术相比,本发明的有益效果至少包括:
23.本发明蓝靛果花青素提取物在改善pcos小鼠卵泡发育阻滞方面有显著的作用、具有提高卵巢储备功能以及提高卵巢抗氧化的能力,为广大pcos患者带来福音,将改善pcos患者的心理和生理治疗压力,改善广大不孕患者的生殖健康,提高育龄女青年的生育潜能。
附图说明
24.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍。在所有附图中,类似的元件或部分一般由类似的附图标记标识。附图中,各元件或部分并不一定按照实际的比例绘制。
25.图1为本发明实验例2中pcos模型建立和验证结果;
26.图2为本发明实验例2中各组小鼠卵巢组织的显微镜下观察结果;
27.图3为本发明实验例2中各组小鼠amh表达情况;
甲醇溶液(m/v)定容至刻度,摇匀,得待测试液b;溶液应澄清透明。若混浊,则用滤纸过滤,开始的滤液约10ml弃去,之后的滤液用作检测。
51.b.测定方法
52.2%盐酸-甲醇溶液(m/v)作空白,用uv-1700进行紫外可见光谱分析;
53.经紫外可见光谱分析,得到蓝靛果花青素含量为25%、蓝莓花青素含量为 18%、黑加仑花青素含量为25%。
54.对上述实施例1以及对比例1~2提取得到的花青素提取物中花色苷的种类以及含量进行测定,方法如下:
55.样品经超声溶解后,采用高效液相色谱法(hplc)测定。
56.1)仪器、用具:分析天平、超声波清洗仪、高效液相色谱仪(附紫外检测器)、0.45μm微孔滤膜。
57.2)试剂、溶液:甲醇(色谱纯)、乙腈(色谱纯)、无水甲酸(色谱纯)、盐酸、磷酸、甲醇、2%盐酸-甲醇溶液(v/v)、10%磷酸水溶液(v/v)、纯水。
58.3)标准品溶液:花色苷标准品bilberry dry extract crs(用于测定15种花色苷组分含量,购自欧洲药品质量管理局edqm);称取标准品约125mg,置于25ml容量瓶中,加入2%盐酸-甲醇溶液并稀释至刻度,摇匀。准确移取2ml 的上述溶液于10ml的容量瓶中,用10%磷酸水溶液定容。配成的标准品溶液中矢车菊素-3-葡萄糖苷的浓度约为0.035mg/ml。
59.4)样品溶液:称取供试品约125mg溶解于25ml 2%盐酸甲醇溶液中,移取2ml的上述溶液于100ml的容量瓶中,用10%磷酸水溶液定容。用0.45μ m微孔滤膜过滤即得供试液,取10μl上样。
60.5)色谱条件
61.色谱柱:zorbax extend-c18,4.6
×
250mm,5μm或同类型色谱柱;流动相:a相:甲酸-水溶液(8.5:91.5,v/v)、b相:乙腈-甲醇-甲酸-水溶液 (22.5:22.5:8.5:41.5,v/v/v/v);检测波长:535nm;流速:1.0ml/min。
62.6)小浆果提取物中各花色苷含量的计算:
[0063][0064]
式中:
[0065]
wi——供试品中花色苷的质量分数,%;
[0066]ai
——供试品溶液中花色苷的峰面积;
[0067]astda
——标准品溶液中矢车菊素-3-葡萄糖苷的峰面积;
[0068]cstda
——标准品溶液中矢车菊素-3-葡萄糖苷的浓度,单位为毫克每毫升 (mg/ml);
[0069]
m——供试品的称样量,单位为毫克(mg);
[0070]
v——供试品的定容体积,单位为毫升(ml);
[0071]
p——标准品溶液中矢车菊素-3-葡萄糖苷的纯度,%;
[0072]
mwi——供试品溶液中各花色苷的分子量;
[0073]
mw
stda
——矢车菊素-3-葡萄糖苷的分子量。
[0074]
结果如下:
[0075]
蓝靛果花青素主要有三种类型:分别是矢车菊素、天竺葵素、芍药素,其主要存在的花色苷形式包括矢车菊素-3-o-葡萄糖苷、矢车菊素-3-o-芸香糖苷、芍药素-3-o-芸香糖苷、矢车菊素-3,5-双葡萄糖苷,其中矢车菊素-3-o-葡萄糖苷占比最高,占比约90%。蓝莓花青素提取物所含花色苷种类较多,有15种,其中主要以矢车菊素、飞燕草素、矮牵牛素、芍药山和锦葵素衍生花色苷为主;其中飞燕草素衍生物、矮牵牛素衍生物和锦葵素衍生物占比最高,大概分别为 35%、28%、25%。黑加仑花青素主要两种存在形式,分别是矢车菊素和飞燕草素,其花色苷主要以下4种:矢车菊素-3-o-葡萄糖苷、矢车菊素-3-o-芸香糖苷、飞燕草素-3-o-葡萄糖苷、飞燕草素-3-o-芸香糖苷,各花色苷含量差不多,占比为92%。
[0076]
实验例2
[0077]
实施例1以及对比例1~2提取得到的花青素提取物对pcos影响的研究:
[0078]
(1)pcos小鼠模型的建立和模型验证
[0079]
25日龄c57bl/6雌性小鼠,连续注射dhea(6mg/100g,0.2ml
·
d-1
芝麻油溶解)同时60%高脂饲料连续喂养20天;对照组正常喂养;实验结束后分别取各组小鼠血液以及双侧卵巢,一侧固定做病理检测,另一侧进行后续检测;验证方式如下:
[0080]
1)阴道涂片:自开始给药的第11天采集阴道脱落细胞涂片,连续10d,每天下午5:00~6:00收集小鼠阴道脱落细胞,涂片观察。(正常组和模型组随机选3只)。
[0081]
2)多囊卵巢病理:he染色,方法如下:
[0082]
a.制作切片
[0083]
固定:4%甲醛溶液中固定3-5d;
[0084]
修块:从固定液中取出组织,修整为适当的形状及厚度;
[0085]
脱水:组织块经过80%、90%、95%、100%乙醇ⅰ、100%乙醇ⅱ、100%乙醇ⅲ进行脱水处理;
[0086]
透明:二甲苯ⅰ30min、二甲苯ⅱ30min;
[0087]
浸蜡:石蜡ⅰ1h、石蜡ⅱ5h;
[0088]
包埋:按照取材面向下的原则,用石蜡包埋起组织,待蜡块冷却凝固后置于-20℃冷藏;
[0089]
切片:切片厚度5μm;
[0090]
烤片:切片放入65℃恒温箱中6-12h;
[0091]
保存:装盒,常温保存。
[0092]
b.he染色
[0093]
脱蜡复水:二甲苯ⅰ15min、二甲苯ⅱ15min、无水乙醇ⅰ5min、无水乙醇ⅱ5min、95%乙醇5min、80%乙醇5min、自来水浸洗1min;
[0094]
染色:将切片浸入苏木精染液中常温染色5min,自来水洗1min;将切片浸入1%盐酸酒精溶液数秒,自来水至组织返蓝;将切片浸入伊红染液中染色 3-5min,自来水洗去玻片上的浮色即可;
[0095]
脱水、透明、封固:80%乙醇0.5min、95%乙醇ⅰ0.5min、95%乙醇ⅱ0.5min、无水乙醇ⅰ0.5min、无水乙醇ⅱ0.5min、二甲苯ⅰ透明3min、二甲苯ⅱ透明 3min、取出后用中性树胶封固;染色情况,细胞核呈蓝色或紫蓝色,细胞浆呈粉红色,红细胞呈较鲜艳的红色;
[0096]
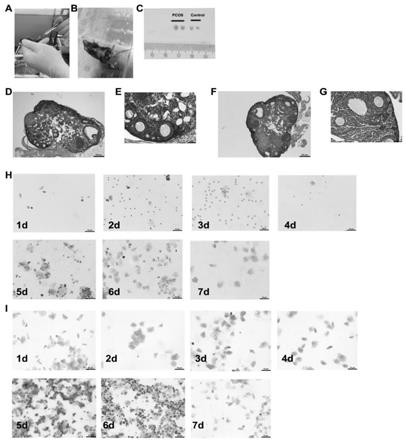
上述pcos模型建立和验证结果如图1所示;图1中,a为小鼠腹腔药物注射图片;b为
小鼠卵巢取材图片;c为对照组小鼠卵巢和pcos组小鼠卵巢大小对比,图片可见pcos小鼠卵巢直径显著大于对照组小鼠卵巢直径;d 和e为pcos小鼠卵巢he染色情况,e是d红框放大图片。f和g为对照组小鼠卵巢he染色情况,g是f红框放大图片。d和f比较可见,pcos小鼠卵巢相对对照组小鼠卵巢内可见大量的小卵泡。h为对照小鼠给药最后7天阴道涂片。i为pcos小鼠给药最后7天阴道涂片;
[0097]
由图1可知,通过dhea注射和高脂饲料喂养的方法,成功建立了pcos 小鼠模型。he染色观察可知,对照组卵巢皮质和髓质结构清晰可见,构造完整,可见正常发育、结构整齐、大小不一的各级卵泡,卵母细胞胞浆丰富,颗粒细胞分层数目较多且排列整齐,可见黄体(图1,f/g)。模型组卵泡数量明显增多,且大部分发育不良,颗粒细胞排列紊乱、疏松,可见大量闭锁卵泡(图 1,d/e)。
[0098]
(2)pcos小鼠分组和喂养
[0099]
成年pcos小鼠随机分成7组,每组10只,分别为pcos对照组、蓝莓花青素低剂量组、蓝莓花青素高剂量组、蓝靛果花青素低剂量组、蓝靛果花青素高剂量组、黑加仑花青素低剂量组、黑加仑花青素高剂量组。另10只性成熟 balb/c雌鼠作为正常对照组。
[0100]
76只25日龄小鼠(其中6只做模型验证),连续注射dhea(6mg/100g) 同时60%高脂饲料连续喂养20天;之后随机分为7组,1组作为对照组(10 只),另外6组分别是各浆果花青素提取物喂养的低剂量组(10只/组,150mg /kg/d)和高剂量组(10只/组,300mg/kg/d),按0.1ml
·
10g-1的灌胃体积给药,同时分笼连续给药30天,自由饮水、自由摄食(基础饲料),温度22~24℃,相对湿度55%~65%。
[0101]
实验结束后分别取各组小鼠血液以及双侧卵巢,一侧固定做病理检测,另一侧冷冻卵巢组织,备用。每组小鼠采血,分别检测amh、sod、mda含量。
[0102]
(3)pcos小鼠处理和指标测定
[0103]
末次灌胃后,各组小鼠禁食不禁水,24h后称各组小鼠的体质量,眼眶取血,小鼠断颈法处死,迅速取出卵巢组织经固定、脱水等制作为石蜡切片,显微镜下观察卵泡发育级别,观察结果如图2所示;血浆于4℃低温离心后分离血清。按试剂盒说明书分别测定血清中amh、sod和mda的含量。
[0104]
①
、amh的测定:
[0105]
a.实验材料:mis、amh elisa试剂盒(江莱生物,货号:jl20476)。
[0106]
b.实验仪器:全波长酶标仪(spectramax plus 384型,美国md)、低速自动平衡离心机(tdz4-ws型,湖南湘仪)。
[0107]
c.检测方法:
[0108]
a.试剂盒在室温下平衡60min,配置所需试剂;
[0109]
b.设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50μl;
[0110]
c.样本孔中加入待测样本50μl,空白孔加样本稀释液50μl;
[0111]
d.除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(hrp)标记的检测抗体100μl,用封板膜封板,37℃恒温温育60min;
[0112]
e.弃去液体,在吸水纸上拍干,每孔加满洗涤液,静置1min,弃去洗涤液,拍干,重复5次。每孔加入底物a、b各50μl,37℃避光孵育15min;
[0113]
f.每孔加入终止液50μl,15min内在450nm波长处测定各孔的od值。
[0114]
②
、总超氧化物歧化酶(t-sod)含量的测定:
[0115]
a.实验材料:总超氧化物歧化酶(t-sod)测定试剂盒(南京建成,货号 a001-1-2)
[0116]
b.实验仪器:全波长酶标仪(spectramax plus 384型,美国md)、低速自动平衡离心机(tdz4-ws型,湖南湘仪)。
[0117]
c.检测方法:
[0118]
a.准备好所有所需试剂;
[0119]
b.操作表如下:
[0120][0121]
混匀,室温放置10min,于波长550nm处,1cm光径比色杯,蒸馏水调零,测各管od值。
[0122]
计算公式:总sod活力(u/ml)=(对照组od值-测定od值)/对照od 值/50%*反应体系的稀释倍数*样本测试前的稀释倍数。
[0123]
③
、丙二醛(mda)含量检测:
[0124]
a.实验材料:丙二醛(mda)测定试剂盒(南京建成,货号a003-1-1)。
[0125]
b.实验仪器:全波长酶标仪(spectramax plus 384型,美国md)、低速自动平衡离心机(tdz4-ws型,湖南湘仪)。
[0126]
c.检测方法:
[0127]
a.准备好所有所需试剂;
[0128]
b.操作表如下:
[0129][0130][0131]
离心管盖上盖,用针在盖上扎一小孔,旋涡混匀器混匀,95℃水浴40分钟,取出后流水冷却,然后3500转/分,离心10分钟。取上清200pl,532nm处, 1cm光径,蒸馏水调零,测各管吸光度值。
[0132]
计算公式:血清中mda含量=(测定od值-对照od值)/(标准od值
‑ꢀ
空白od值)*标准品浓度(10nmol/ml)*样本测试前稀释倍数。
[0133]
结果:
[0134]
各组小鼠卵巢组织的显微镜下观察结果如图2所示;各组小鼠amh表达情况如图3所示;各组小鼠sod表达情况如图4所示;各组小鼠mda表达情况如图5所示;图3中,a vs b,c,d,p《0.01;b vs c,p《0.05;c vs d,p《0.01;图4 中a,b,c,d vs e,p《0.01;c vs e,p《0.01;b vs d,p《0.01;b vs c,p《0.05;d vs e, p《0.05;图5中b,c,d,e,f vs a,p《0.01;b vs d,p《0.01;c vs e,p《0.01;b vs c, p《0.05;d vs e,p《0.05。
[0135]
由图2可知:模型组卵泡数量明显增多,且大部分发育不良,颗粒细胞排列紊乱、疏松,可见闭锁卵泡。蓝靛果、蓝莓和黑加仑花青素提取物喂养低剂量组闭锁卵泡较模型组减少,颗粒细胞排列较为整齐,高剂量组闭锁卵泡数量最少,大部分为正常卵泡发育,颗粒细胞排列较整齐。
[0136]
由图3可知:
[0137]
通过标准品绘制标准曲线(图3,a),测定并计算对照组、pcos组、各低剂量花青素喂养组和各高剂量花青素喂养组的amh表达水平。结果显示, pcos组同对照组相比,amh的表达水平升高(图3b,p《0.01);花青素喂养组和pcos组相比amh的水平显著降低(图3b,p《0.01);同时,高剂量花青素同低剂量花青素相比,amh的水平也是显著下调(图3b,p《0.05)。另外,蓝靛果各组amh表达水平同黑加仑和蓝莓各组比较其下调水平更高。结果表明,各种类花青素提取物喂养后可正调节pcos小鼠的卵巢储备功能、并且蓝靛果花青素的作用最显著。
[0138]
由图4可知:
[0139]
pcos组sod表达水平显著低于对照组(p《0.01)、低剂量花青素组和高剂量花青素组同pcos组相比sod的表达水平显著升高(p《0.01,图4)。蓝靛果高剂量组sod表达水平同对照组没有差异,同时,蓝靛果各组sod表达水平比蓝莓、黑加仑各组sod表达水平更高(图4)。结果表明花青素提取物喂养后可以显著提高pcos小鼠体内的抗氧化能力,并且蓝靛果花青素的作用最显著,并具有显著性差异。
[0140]
由图5可知:
[0141]
pcos组同对照组相比,mda的表达水平显著升高(p《0.01,图5);花青素组同pcos组相比,mda的表达水平显著降低(p《0.01,图5),同时,高剂量花青素组的mda表达水平亦显著低于低剂量花青素组(p《0.05,图5)。另外,蓝靛果低剂量组和高剂量组mda表达水平均低于黑加仑组和蓝莓组对应各组mda的表达水。结果表明,花青素提取物喂养后可以降低小鼠体内过氧化水平、减少细胞的损伤,并且蓝靛果花青素的作用最显著,并具有显著性差异。
[0142]
综上,各组花青素提取物喂养可以显著降低pcos小鼠卵巢组织过氧化水平、提高卵巢组织的抗氧化能力,改善pcos小鼠卵泡发育水平、提高卵巢储备能力。蓝靛果花青素提取物同蓝莓和黑加仑花青素提取物相比,其使用功效更好,并且存在剂量依赖性。蓝靛果花青素主要存在形式是矢车菊素-3-o-葡萄糖苷,可以确定其发挥了重大作用,为进一步研究奠定基础。
[0143]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,其均应涵盖在本发明的权利要求和说明书的范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1