一种基于人工合成寡核苷酸有效抑制HIV-1病毒组装的方法
本发明涉及生物医药领域,具体涉及一种可在活细胞中有效干扰hiv-1病毒组装的方法。
背景技术:
1、i型人类免疫缺陷病毒(hiv-1)的组装和释放过程是其生命周期的重要阶段,该过程主要由gag蛋白质介导,gag以病毒rna分子作为骨架,在细胞膜上发生聚合,组装形成病毒颗粒后从宿主细胞的细胞膜释放。迄今为止,有大量研究结果证明gag-rna相互作用对于病毒组装具有关键作用,细胞膜上组装中的gag分子能够与多种rna发生相互作用,包括病毒rna和细胞内源的rna(selective and nonselective packaging of cellular rnas inretrovirus particles.(j virol.2007;81(12):6623-6631.))等。体外水溶液实验显示,在一定的rna长度范围内,与gag互作的rna越长,gag组装的程度越强(self-assembly invitro of purified ca-nc proteins from rous sarcoma virus and humanimmunodeficiency virus type 1(j virol.1995;69(10):6487-6497.))。
2、2014年,chen等提出了利用天然小rna阻断病毒颗粒组装的概念。研究发现,细胞普遍存在的微小rna(mirna)分子能够结合gag蛋白,扰乱gag在病毒rna上的多聚化过程,造成病毒颗粒组装失败。这些组装失败的gag蛋白将被宿主细胞以内吞的途径运输到细胞质中,在溶酶体内进行降解(microrna binding to the hiv-1 gag protein inhibits gagassembly and virus production(proc natl acad sci u s a.2014 jul 1;111(26):e2676–e2683.))。2017年,qu等进一步揭示了自噬在mirna-gag相互作用抑制病毒组装过程中的作用(inhibition of retroviral gag assembly by non-silencing mirnaspromotes autophagic viral degradation(protein cell.2018;9(7):640–651.))。
3、尽管具备上述优点,mirna在用于抑制病毒组装时仍存在一些问题。例如,需要对细胞进行过表达mirna的实验,但难以控制mirna的表达量;所选mirna局限于生物内源的分子种类,因此序列、结构、碱基构成、分子大小和化学修饰类型有限。
4、rna分子碱基互补的特性可以帮助核酸链自组装形成复杂的纳米结构,作为一种天然的生物材料具有可修饰性高、热稳定性好、生物安全性高等优势。研究者已证实可基于碱基的互补特性设计多个核酸链,使其在水溶液中自组装形成大小可控的rna纳米颗粒,并证实某些rna颗粒可在细胞中甚至活体内具有生物学功能。目前,使用特殊rna序列或结构作为自组装材料已经成为一个快速发展的研究领域(advancement of the emergingfield of rna nanotechnology(acs nano.2017;11(2):1142-1164.))。
技术实现思路
1、针对上述用mirna抑制病毒组装的不足之处,本发明设计了一系列人工合成的rna寡核苷酸,发现gag蛋白在细胞膜上对茎环结构的rna寡核苷酸具有结合倾向性,且该结合可以干扰病毒组装。将此概念引入设计可自组装的rna原件,得到空间结构更加复杂、具有多个茎环结构的rna自组装纳米材料,进一步提升人工合成的rna寡核苷酸对hiv-1病毒组装的抑制效果。
2、具体的,本发明首先提供了一种可有效结合hiv-1结构蛋白gag分子的人工合成茎环结构寡核苷酸,这种寡核苷酸可通过自组装(controllable self-assembly of rnatetrahedrons with precise shape and size for cancer targeting(adv mater.2016;28(34):7501-7.))的方法建立空间结构更加复杂的rna自组装纳米材料。
3、可自组装成具有多个茎环结构的rna自组装纳米材料的rna寡核苷酸可以是具有如下特征的寡核苷酸链:
4、1、具有茎环结构,在茎环结构的5’或3’端具有延长的单链,该延长的单链长度优选为16~20nt;
5、2、茎环结构中的环结构由15~25个碱基组成,茎结构的长度至少为4个碱基对;可以通过unafold等软件验证设计的rna寡核苷酸是否具有茎环结构;
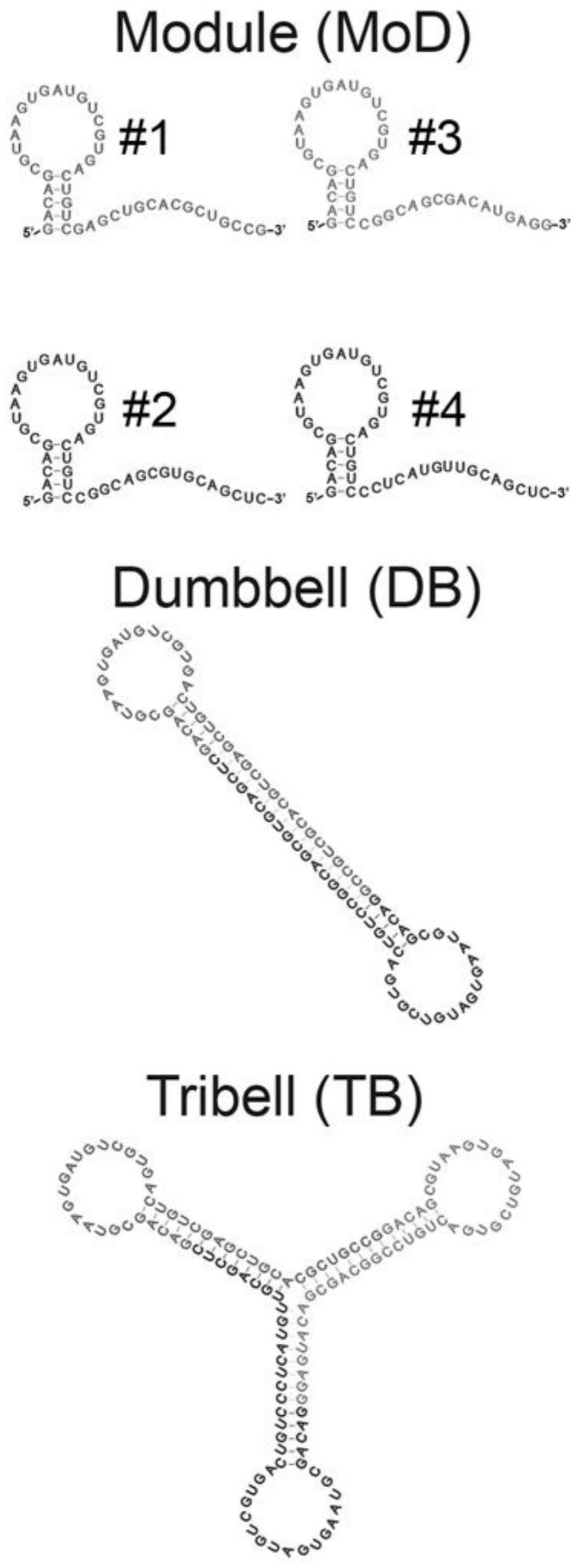
6、3、不同rna寡核苷酸之间通过位于茎环结构5’或3’端的单链进行互补,自组装形成空间结构更加复杂的rna自组装纳米材料;可以通过自由设计单链的序列,以碱基互补配对的原理,实现两种、三种甚至更多rna寡核苷酸之间的组装(参见图2);
7、4、rna寡核苷酸序列为无义寡核苷酸序列,即应当与人类基因组、病毒基因组没有同源性。
8、基于上述rna寡核苷酸,本发明提供了一种抑制hiv-1病毒组装的方法,包括以下步骤:
9、1)设计能够自组装成具有多个茎环结构的rna自组装纳米材料的至少两种rna寡核苷酸,然后人工合成所述rna寡核苷酸;
10、2)将步骤1)合成的多种rna寡核苷酸在1×tris缓冲液(100mm nacl,50mm tris,ph 8.0)中等摩尔浓度混合后,进行高温解链-缓慢降温退火,通过各个rna寡核苷酸单体中位于茎环结构5’或3’端的单链进行互补,从而实现自组装;然后对产物进行纯化,得到具有多个茎环结构的rna自组装纳米材料;
11、3)用所述rna自组装纳米材料转染感染了hiv-1病毒的细胞,干扰细胞内hiv-1病毒的组装。
12、步骤1)所设计的rna寡核苷酸应为与人类基因组、病毒基因组没有同源性的无义寡核苷酸序列;具有茎环结构,并在茎环结构的5’或3’端具有延长的单链;在步骤2)中,各个rna寡核苷酸单体通过位于茎环结构5’或3’端延长的单链进行互补来实现自组装,例如:两个rna寡核苷酸单体自组装形成哑铃形结构的rna自组装纳米材料,三个rna寡核苷酸单体自组装形成“y”形结构的rna自组装纳米材料。
13、优选地,步骤1)设计的rna寡核苷酸的茎环结构中,环结构由15~25nt组成,茎结构的长度至少为4个碱基对,所述延长的单链长度为16~20nt。
14、进一步地,为在细胞环境中抵抗核酸酶的降解,所述rna寡核苷酸是所有碱基皆为2’-o-甲基化修饰的寡核苷酸。也可以使用其他具有抗核酸酶降解能力的化学修饰,例如硫代磷酸(phosphorothioate,ps)修饰、锁核酸(locked nucleic acid,lna)修饰、吗啉基(morpholino)修饰等。
15、在本发明的实施例中,设计了如序列表中的seq id no:1至seq id no:4所示的四种rna寡核苷酸,其中,将seq id no:1和2所示的rna寡核苷酸等量混合后自组装,可形成哑铃形结构的rna自组装纳米材料;将seq id no:1、3和4所示的rna寡核苷酸等量混合后自组装,可形成“y”形结构的rna自组装纳米材料,如图2所示。
16、优选地,在步骤2)中使用3000nmwl纤维素过滤柱对自组装产物进行纯化。
17、优选地,在步骤3)采用电转染的方法使所述rna自组装纳米材料转染细胞。
18、在本发明的实施例中,通过下述实验验证了本发明技术方案的可行性和有效性:
19、1)培养细胞,转染病毒基因载体pnl43δpolδenv-gag,在细胞中表达病毒rna与gag蛋白质;
20、2)电转染rna寡核苷酸或其自组装纳米材料,进行gag-rna寡核苷酸免疫共沉淀,测定二者的相互作用情况,即用特异性抗体提取细胞膜上的gag蛋白质,检测免疫沉淀物中rna寡核苷酸的富集程度,分析不同寡核苷酸与细胞膜上gag分子结合的能力;
21、3)电转染rna寡核苷酸或其自组装纳米材料,进行病毒颗粒释放效率分析,即通过western blot方法测定hiv-1病毒受到rna寡核苷酸或其自组装纳米材料干扰后的释放效率,证实本方法的有效性。
22、本发明的有益效果:
23、本发明通过自组装的方法构建了具有复杂空间结构的rna自组装纳米材料,进一步提高了人工合成的rna寡核苷酸抑制病毒组装的能力。利用人工合成小分子rna易操作、可控性高的特性,有效抑制hiv-1病毒的释放,拓展了rna寡核苷酸在生物医学领域的应用。这是首次实现使用人工合成的rna寡核苷酸以及自组装纳米材料抑制hiv-1病毒的组装,为疾病治疗提供了新的思路。
- 还没有人留言评论。精彩留言会获得点赞!