一种地氯雷他定制剂及其制备方法与流程
1.本发明属于药物制剂技术领域,具体涉及一种地氯雷他定制剂及其制备方法。
背景技术:
2.地氯雷他定为非镇静性的长效三环类抗组胺药,为氯雷他定的活性代谢物,可通过选择性地拮抗外周h1受体,药理作用和氯雷他定比较相似,但效果会更强,起效时间也比较快,能够缓解季节性过敏性鼻炎或慢性特发性荨麻疹的相关症状。但由于地氯雷他定众所周知的不稳定性和低水溶性,其在制剂方面遇到很大困难。
3.中国专利cn1268377a公开了一种地氯雷他定干混悬剂及其制备方法,其将地氯雷他定原料进行包衣然后与其他辅料进行混合制备干混悬剂,从而改善地氯雷他定的稳定性,但这种干混悬剂工艺较复杂,生产困难。
4.美国专利us2002/123504中公开了几种解决地氯雷他定制剂不稳定性的方法包括:
①
使用无水地或无吸湿性的氯雷他定原料;
②
增加地氯雷他定的粒径;
③
对地氯雷他定原料包衣用进行保护隔绝;
④
避免使用酸性辅料和乳糖等辅料避免发生maillard反应。
5.目前,地氯雷他定难溶于水的问题、稳定性难以控制的问题一直未得到很好的解决。为了克服现有技术缺陷,我们解决了溶解性差的问题、开发了稳定性高的地氯雷他定制剂。
技术实现要素:
6.为克服现有技术的不足,本发明提供了一种稳定性高的地氯雷他定制剂,通过将地氯雷他定与大环化合物结合,解决了地氯雷他定水溶性低的问题,提高了制剂的稳定性,制备工艺简单易控,且动物实验表明对于过敏性鼻炎的治疗效果显著提升。
7.具体而言,本发明的技术方案如下:
8.本发明的第一个目的在于提供了一种地氯雷他定制剂,包括地氯雷他定、载体材料、药学上可接受的辅料。
9.所述地氯雷他定作为药物客体分子,载体材料作为主体分子,通过分子间作用力结合形成超分子化合物,所述分子间作用力包括但不限于配位键、氢键、π-π堆积作用、静电作用和疏水作用等。
10.进一步的,所述氯雷他定和载体材料的用量以摩尔比计算为1-5:1。
11.进一步的,所述载体材料为具有空穴或孔道的大环化合物,包括但不限于dna、冠醚、环糊精、杯芳烃、杯吡咯、杯咔唑、瓜环葫芦脲、柱芳烃等。
12.具体的,所述大环化合物为葫芦脲,所述葫芦脲包括葫芦[5]脲、葫芦[6]脲、葫芦[7]脲、葫芦[8]脲、葫芦[10]脲、葫芦[14]脲,优选为葫芦[7]脲。
[0013]
进一步的,所述氯雷他定和载体材料以摩尔比1:1或/和2:1的形式结合形成超分子化合物,如图1举例的,地氯雷他定中的氨基与葫芦[7]脲内部的氧原子通过氢键的形式结合形成超分子化合物,葫芦[7]脲能够以1:1或/和2:1的摩尔比通过n-h
···
o氢键搭载
地氯雷他定。
[0014]
进一步的,所述超分子化合物中还包含水分子和/或溶剂分子,水分子和/或溶剂分子以氢键、π-π堆积作用、静电作用、疏水作用等方式存在于超分子化合物中。
[0015]
进一步的,所述超分子化合物可与药学上可接受的辅料制备成制剂,所述制剂包括但不限于片剂、胶囊剂、颗粒剂、丸剂、混悬剂、软膏剂、乳剂、气雾剂;所述辅料包括但不限于填充剂、崩解剂、润滑剂、粘合剂、稳定剂、矫味剂。
[0016]
本发明的第二个目的在于提供一种制备上述地氯雷他定制剂的方法,包括以下步骤:
[0017]
(1)地氯雷他定超分子化合物的制备:将地氯雷他定和载体材料分别溶于溶剂中,混合,减压旋蒸1-3h,得到乳状物,真空干燥,即得;
[0018]
(2)步骤(1)所得地氯雷他定超分子化合物,加入药学上可接受的辅料,按照常规方法制备成制剂。
[0019]
进一步的,所述步骤(1)为:将地氯雷他定溶于甲醇、乙醇、丙二醇、水中的一种溶剂中,超声使其溶解,得到溶液a;将载体材料溶于水中,超声溶解,得到溶液b;溶液a与溶液b缓慢混合并置于水浴锅中加热减压旋蒸,加热温度由25℃至40℃逐步增加,1-3h后得到乳状物,真空减压干燥,即得。
[0020]
具体的,所述溶剂优选为乙醇,加热温度由25℃至40℃逐步增加根据馏出液的流速逐步调整,每次升高3-5℃,直至40℃。
[0021]
与现有技术相比,本发明的有益效果在于:
[0022]
(1)本发明通过将地氯雷他定与大环化合物,尤其是与葫芦[7]脲结合,形成超分子化合物,解决了地氯雷他定水溶性差的问题,降低了有关物质含量,提高了地氯雷他定的稳定性。
[0023]
(2)本发明地氯雷他定超分子化合物制备方法简单,产率高;通过优选地氯雷他定和载药材料的种类、配比,优化制备方法,提高了地氯雷他定的载药量,降低临床应用剂量,更易于满足临床需要。
[0024]
(3)通过大鼠实验证明,本发明可以明显缓解由过敏性鼻炎引起的鼻痒、鼻涕和喷嚏等症状;降低模型大鼠血清il-2、il-4、ig e、ecp含量水平,治疗过敏性鼻炎的效果优于市售制剂。
附图说明
[0025]
图1:地氯雷他定-葫芦[7]脲超分子化合物结构示意图:(a)摩尔比1:1;(b)摩尔比2:1。
具体实施方式
[0026]
为了使本发明的目的、技术方案更加清楚明白,以下结合实施例,对本发明做进一步的说明,但是本发明的保护范围并不限于这些实施例,实施例仅用于解释本发明。本领域技术人员应该理解的是,凡是不背离本发明构思的改变或等同替代均包括在本发明的保护范围之内。
[0027]
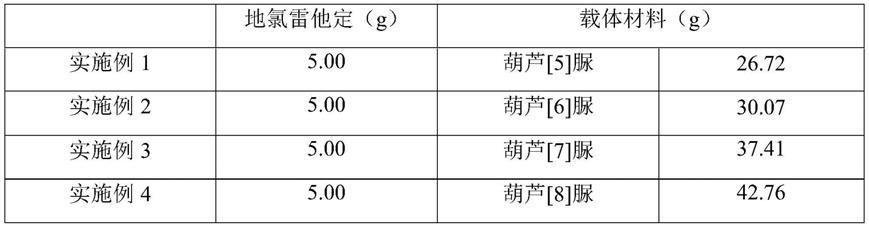
实施例1-4地氯雷他定超分子化合物
[0028][0029]
制备方法:
[0030]
地氯雷他定与葫芦脲的摩尔比为2:1。
[0031]
将地氯雷他定溶于100ml乙醇中,超声使其溶解,得到溶液a;葫芦脲溶于200ml水中,超声溶解,得到溶液b;溶液a与溶液b缓慢混合并置于水浴锅中25℃加热减压旋蒸,观察馏出液的流速,流速降低或不再馏出时,升高水浴温度逐步增加直至40℃,每次升高3-5℃,1-3h后得到乳状物,真空减压干燥,即得。
[0032]
实施例5-9地氯雷他定超分子化合物
[0033][0034][0035]
制备方法:
[0036]
实施例5:地氯雷他定与葫芦脲的摩尔比为1:1。
[0037]
实施例6:地氯雷他定与葫芦脲的摩尔比为2:1。
[0038]
实施例7:地氯雷他定与葫芦脲的摩尔比为3:1。
[0039]
实施例8:地氯雷他定与葫芦脲的摩尔比为4:1。
[0040]
实施例9:地氯雷他定与葫芦脲的摩尔比为5:1。
[0041]
将地氯雷他定溶于100ml乙醇中,超声使其溶解,得到溶液a;葫芦[7]脲溶于100-500ml水中(根据葫芦[7]脲的用量调整),超声溶解,得到溶液b;溶液a与溶液b缓慢混合并置于水浴锅中25℃加热减压旋蒸,观察馏出液的流速,流速降低或不再馏出时,升高水浴温度逐步增加直至40℃,每次升高3-5℃,1-3h后得到乳状物,真空减压干燥,即得。
[0042]
实施例10-13地氯雷他定超分子化合物
[0043]
[0044]
制备方法:
[0045]
实施例10-11:地氯雷他定与葫芦脲的摩尔比为1:1。
[0046]
实施例12-13:地氯雷他定与葫芦脲的摩尔比为2:1。
[0047]
将地氯雷他定溶于10-200ml乙醇中(根据地氯雷他定的用量调整),超声使其溶解,得到溶液a;葫芦[7]脲溶于10-1000ml水中(根据葫芦[7]脲的用量调整),超声溶解,得到溶液b;溶液a与溶液b缓慢混合并置于水浴锅中25℃加热减压旋蒸,观察馏出液的流速,流速降低或不再馏出时,升高水浴温度逐步增加直至40℃,每次升高3-5℃,1-3h后得到乳状物,真空减压干燥,即得。
[0048]
实施例14-16地氯雷他定超分子化合物
[0049][0050]
实施例14制备方法:
[0051]
将地氯雷他定溶于50ml甲醇中,超声使其溶解,得到溶液a;葫芦[7]脲溶于200ml水中,超声溶解,得到溶液b;溶液a与溶液b缓慢混合并置于水浴锅中25℃加热减压旋蒸,观察馏出液的流速,流速降低或不再馏出时,升高水浴温度逐步增加直至40℃,每次升高3-5℃,1-3h后得到乳状物,真空减压干燥,即得。
[0052]
实施例15制备方法:
[0053]
将地氯雷他定溶于50ml丙二醇中,超声使其溶解,得到溶液a;葫芦[7]脲溶于200ml水中,超声溶解,得到溶液b;溶液a与溶液b缓慢混合并置于水浴锅中25℃加热减压旋蒸,观察馏出液的流速,流速降低或不再馏出时,升高水浴温度逐步增加直至40℃,每次升高3-5℃,1-3h后得到乳状物,真空减压干燥,即得。
[0054]
实施例16制备方法:
[0055]
将地氯雷他定溶于100ml水中,超声使其溶解,得到溶液a;葫芦[7]脲溶于200ml水中,超声溶解,得到溶液b;溶液a与溶液b缓慢混合并置于水浴锅中25℃加热减压旋蒸,观察馏出液的流速,流速降低或不再馏出时,升高水浴温度逐步增加直至40℃,每次升高3-5℃,1-3h后得到乳状物,真空减压干燥,即得。
[0056]
实施例17地氯雷他定片(400片)
[0057][0058]
制备方法:
[0059]
将地氯雷他定溶于100ml乙醇中,超声使其溶解,得到溶液a;葫芦脲溶于200ml水中,超声溶解,得到溶液b;溶液a与溶液b缓慢混合并置于水浴锅中25℃加热减压旋蒸,观察馏出液的流速,流速降低或不再馏出时,升高水浴温度逐步增加直至40℃,每次升高3-5℃,1-3h后得到乳状物,真空减压干燥,得到地氯雷他定-葫芦[7]脲超分子化合物粉末;取上述粉末10g,粉碎过筛,加入微晶纤维素75g(填充剂)、海藻酸钠5g(粘合剂),过筛,干法制粒压片法制成片剂。
[0060]
实施例18地氯雷他定颗粒剂(400份)
[0061][0062][0063]
制备方法:
[0064]
将地氯雷他定溶于100ml乙醇中,超声使其溶解,得到溶液a;葫芦脲溶于200ml水中,超声溶解,得到溶液b;溶液a与溶液b缓慢混合并置于水浴锅中25℃加热减压旋蒸,观察馏出液的流速,流速降低或不再馏出时,升高水浴温度逐步增加直至40℃,每次升高3-5℃,1-3h后得到乳状物,真空减压干燥,得到地氯雷他定-葫芦[7]脲超分子化合物粉末;取上述粉末10g,粉碎过筛,加入甘露醇70g(填充剂)、聚维酮5g(粘合剂),干淀粉5g(崩解剂),过筛,制粒,干燥,整粒,即得。
[0065]
实施例19地氯雷他定胶囊(400粒)
[0066][0067]
制备方法:
[0068]
将地氯雷他定溶于100ml乙醇中,超声使其溶解,得到溶液a;葫芦脲溶于200ml水中,超声溶解,得到溶液b;溶液a与溶液b缓慢混合并置于水浴锅中25℃加热减压旋蒸,观察馏出液的流速,流速降低或不再馏出时,升高水浴温度逐步增加直至40℃,每次升高3-5℃,1-3h后得到乳状物,真空减压干燥,得到地氯雷他定-葫芦[7]脲超分子化合物粉末;取上述粉末10g,粉碎过筛,加入糊精70g(填充剂)、甲基纤维素5g(粘合剂)、低取代羟丙纤维素3g(崩解剂)、微粉硅胶2g(助流剂),过筛,填充入空心胶囊,即得。
[0069]
对比实施例1地氯雷他定超分子化合物
[0070][0071]
制备方法:
[0072]
地氯雷他定与β-环糊精的摩尔比为2:1。
[0073]
将地氯雷他定溶于100ml乙醇中,超声使其溶解,得到溶液a;β-环糊精溶于200ml水中,超声溶解,得到溶液b;溶液a与溶液b缓慢混合并置于水浴锅中25℃加热减压旋蒸,观察馏出液的流速,流速降低或不再馏出时,升高水浴温度逐步增加直至40℃,每次升高3-5℃,1-3h后得到乳状物,真空减压干燥,即得。
[0074]
对比实施例2地氯雷他定超分子化合物
[0075][0076]
制备方法:
[0077]
地氯雷他定与葫芦[7]脲的摩尔比为1:2。
[0078]
将地氯雷他定溶于100ml乙醇中,超声使其溶解,得到溶液a;葫芦脲溶于200ml水中,超声溶解,得到溶液b;溶液a与溶液b缓慢混合并置于水浴锅中25℃加热减压旋蒸,观察
馏出液的流速,流速降低或不再馏出时,升高水浴温度逐步增加直至40℃,每次升高3-5℃,1-3h后得到乳状物,真空减压干燥,即得。
[0079]
对比实施例3地氯雷他定超分子化合物
[0080][0081]
制备方法:
[0082]
将地氯雷他定溶于100ml乙醇中,超声使其溶解,得到溶液a;葫芦脲溶于200ml乙醇中,超声溶解,得到溶液b;溶液a与溶液b缓慢混合并置于水浴锅中25℃加热减压旋蒸,观察馏出液的流速,流速降低或不再馏出时,升高水浴温度逐步增加直至40℃,每次升高3-5℃,1-3h后得到乳状物,真空减压干燥,即得。
[0083]
对比实施例4:市售地氯雷他定片(恩**)
[0084]
验证实施例
[0085]
一、质量评价
[0086]
1.产率
[0087]
表1实施例与对比实施例地氯雷他定超分子化合物合成产率
[0088]
[0089][0090]
由表1的产率可知,实施例1-4在对载体材料进行筛选时,实施例2利用葫芦[7]脲作为主体分子,产率最高,达到95.64%;实施例5-9在对地氯雷他定和葫芦[7]脲的摩尔比进行筛选实验是,发现实施例5、6、7,加入地氯雷他定和葫芦[7]脲量的摩尔比为1-3:1时,产率较高;另外,地氯雷他定和葫芦[7]脲的加入量和溶剂也对产率有较大影响。对比实施例的产率较低。
[0091]
2.载药量
[0092]
表2实施例与对比实施例地氯雷他定超分子化合物的载药量
[0093]
[0094][0095]
由表2的载药量可知,载体材料、地氯雷他定和载体材料的摩尔比、地氯雷他定和葫芦[7]脲的加入量、溶剂也载药量有较大影响。对比实施例的载药量低于本发明实施例的载药量。
[0096]
3.有关物质含量
[0097]
表3实施例与对比实施例有关物质含量
[0098]
[0099]
[0100][0101]
由表2有关物质含量可知,本发明实施例所制备的地氯雷他定超分子或地氯雷他定制剂稳定性高,有关物质含量明显低于对比实施例和市售制剂。
[0102]
二、药理学实验
[0103]
发明人开展相关药效学试验研究以证明本发明地氯雷他定制剂治疗过敏性鼻炎的功效。需要说明的是,下述药效学试验所选取的药品为本发明具有代表性的配方、剂型及其制备方法所得的药品;本发明所包含的其它配方、剂型及制备方法所得药品,发明人同样进行了药效学实验,实验结果显示其他配方、剂型及制备方法所得药品具有相同或类似的效果,但由于篇幅限制,在此不一一列举。
[0104]
发明人要说明的是,以下实验研究均是在急性毒性试验、长期毒性试验证明药物安全性基础之上开展,实验研究中的给药剂量均在安全剂量范围之内。
[0105]
1材料
[0106]
1.1实验药物与试剂
[0107]
1.1.1药物
[0108]
本发明实施例17所得片剂,实施例18所得颗粒剂,实施例19所得胶囊剂;
[0109]
对比实施例4:市售地氯雷他定片(恩**)
[0110]
卵白蛋白(ova);
[0111]
氢氧化铝凝胶。
[0112]
1.1.2用药剂量
[0113]
实施例17:0.225mg/kg(低剂量)、0.45mg/kg(中剂量)、0.9mg/kg(高剂量);
[0114]
实施例18:0.45mg/kg;
[0115]
实施例19:0.45mg/kg;
[0116]
对比实施例4:0.45mg/kg。
[0117]
1.2实验动物:
[0118]
sd大鼠,spf级,180-220g,110只(雌雄各半),实验动物许可证号:syxk(鲁)20180008,由鲁南制药集团股份有限公司提供,实验前在标准条件下适应性喂养1周。
[0119]
2.方法
[0120]
2.1造模方式
[0121]
造模:取90只大鼠(雌雄各半)建立卵白蛋白(ova)致敏模型:第1天腹腔注射含10μgova及1mg氢氧化铝凝胶的无菌生理盐水0.5ml进行基础致敏,第5天腹腔注射含l0μgova的无菌生理盐水0.5ml强化致敏,第6天开始每日1次用50μl的2mg/ml ova滴鼻,连续14天激发
大鼠,观察其喷嚏、挠鼻的次数和流涕,最终共有87只大鼠均造模成功(其中雌鼠41只,雄鼠46只)。
[0122]
空白:取10只大鼠(雌雄各半),用无菌生理盐水按照上述同样过程进行假致敏和假激发。
[0123]
2.2实验动物分组
[0124]
将造模成功的sd大鼠随机分为模型组、对比实施例4组、实施例17(高、中、低)三个剂量组、实施例18组、实施例19组,每组10只,雌雄各半。
[0125]
空白组:10只sd大鼠,雌雄各半。
[0126]
2.3给药
[0127]
各给药组大鼠灌胃给予1.12相应的药物,空白组及模型组灌胃给予等量的生理盐水,每天给药1次,持续给药7d。
[0128]
3观察指标
[0129]
3.1大鼠状态评分
[0130]
采取记分法记录鼻分泌物量、喷嚏次数及鼻痒程度。观察大鼠喷嚏、流涕及搔鼻动作,各项指标采取叠加量化记分,总分超过5分为造模成功。评分方法见表4。
[0131]
表4过敏性鼻炎症状评分标准
[0132][0133]
3.2血清样品中il-2、il-4的检测
[0134]
用1ml一次性注射器取鼠尾静脉血0.1-0.2ml,将所采静脉血置于1ml离心管中,室温下静置30min。4℃下,将血液离心10min(3000r/min),分取血清于1ml离心管中,采用elis法对血清样品中il-2、il-4的含量进行测定。用底物tmb显色,tmb在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的il-2、il-4呈正相关。用酶标仪在450nm波长下测定吸光度,计算样品浓度。
[0135]
3.3细胞免疫因子的检测
[0136]
用1ml一次性注射器取鼠尾静脉血0.1-0.2ml,将所采静脉血置于1ml离心管中,室温下静置30min。4℃下,将血液离心10min(3000r/min),分取血清于1ml离心管中,分别检测血清中总免疫球蛋白e(t-ige)、嗜酸粒细胞阳离子蛋白(ecp)含量。
[0137]
4.统计学处理
[0138]
采用spss22.0软件对所得数据进行统计分析,计量资料用表示,多组间比较采用单因素方差分析,两组间采用独立样本t检验方式分析。以p《0.05为差异有统计学意义。
[0139]
5.结果及结论
[0140]
5.1大鼠行为状态
[0141]
各组大鼠鼻痒、鼻涕和喷嚏的过敏反应行为评分比较(见表5)结果表明,给药0天时,模型组、实施例17(高、中、低)三个剂量组、实施例18组、实施例19组与空白组比较,差异
有统计学意义(p<0.01),造模成功。
[0142]
表5大鼠过敏性鼻炎症状的评分
[0143][0144]
注:与空白组对比,*p<0.01;
[0145]
与模型组对比,
%
p<0.01;
[0146]
与对比实施例4相比,
#
p<0.01。
[0147]
给药7d时,观察大鼠行为,给予评分,表5可知,模型组大鼠假给药7天后,会出现一定情况的自愈,实施例17(高、中、低剂量组)、实施例18组、实施例19组、对比实施例4组与模型组相比,p<0.01,说明实施例17(高、中、低剂量组)、实施例18组、实施例19组、对比实施例4组对于大鼠鼻炎具有很好的治疗效果,能够明显缓解大鼠过敏性鼻炎的打喷嚏、流鼻涕等症状,并且实施例17(高、中、低剂量组)、实施例18组、实施例19组与对比实施例4组p<0.01,说明实施例17(高、中、低剂量组)、实施例18组、实施例19组的治疗效果优于对比实施例4组。
[0148]
5.2血清样品中il-2、il-4的含量表达
[0149]
表6大鼠血清il-2含量表达
[0150][0151]
注:与空白组对比,*p<0.01;
[0152]
与模型组对比,
%
p<0.01;
[0153]
与对比实施例4相比,
#
p<0.01。
[0154]
表6可知,与模型组相比,实施例17(高、中、低剂量组)、实施例18组、实施例19组、对比实施例4组
%
p<0.01,说明可以降低大鼠血清il-2含量的表达,且与对比实施例4组相比,本发明实施例17-19降低大鼠血清中il-2含量的作用更明显。
[0155]
表7大鼠血清il-4含量表达
[0156][0157][0158]
注:与空白组对比,*p<0.01;
[0159]
与模型组对比,
%
p<0.01;
[0160]
与对比实施例4相比,
#
p<0.01,
@
p<0.05。
[0161]
表7可知,与对比实施例4组相比,本发明实施例17-19降低大鼠血清中il-4含量的作用更明显。
[0162]
5.3大鼠血清样品中ig e、ecp含量水平
[0163]
表8大鼠血清ig e、ecp含量表达
[0164][0165]
注:与空白组对比,*p<0.01;
[0166]
与模型组对比,
%
p<0.01;
[0167]
与对比实施例4相比,
#
p<0.01。
[0168]
表8可知,模型组、实施例17(高、中、低剂量组)、实施例18组、实施例19组、对比实
施例4组与空白组相比,p<0.01;实施例17(高、中、低剂量组)、实施例18组、实施例19组、对比实施例4组与模型组相比,p<0.01;实施例17(高、中、低剂量组)、实施例18组、实施例19组与对比实施例4组,p<0.01。
[0169]
综上所述,本发明实施例17(高、中、低剂量组)、实施例18组、实施例19组对于大鼠过敏性鼻炎的治疗效果优于对比实施例4市售地氯雷他定片,实施例17片剂的低剂量组的效果也同样优于对比实施例4,说明本发明将地氯雷他定与大环化合物结合成超分子化合物作为制备制剂的中间体,能够提升地氯雷他定对于过敏性鼻炎的治疗效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1