一种Molnupiravir掩味颗粒及其制备方法与流程
一种molnupiravir掩味颗粒及其制备方法
技术领域
1.本发明涉及药物的制剂及其制备方法,具体涉及一种molnupiravir掩味颗粒及其制备方法。
背景技术:
2.molnupiravir是一种口服生物活性的核糖核苷类似物β-d-n4-hydroxycytidine(nhc;eidd-1931)的前药,可抑制多种rna病毒的复制,包括新型冠状病毒(sars-cov-2)。molnupiravir具有广谱的抗病毒活性,可对抗sars-cov-2、mers-cov、sars-cov和covid-19的病原体,其化学式为c
13h19
n3o7,化学名称为尿苷5
′‑
甲基丙酸酯-4-肟,分子量为329.31,分子结构如下:
[0003][0004]
新冠疫情肆虐,目前研究人员正加紧对molnupiravir的研究,面临的难题不少,首先就是molnupiravir原料药不稳定,如何有效的解决制备过程中原料药易降解的问题。其次,molnupiravir味苦,新冠肺炎患者中有一部分是儿童,如何提高用药的方便性和患者服药的依从性也是需要解决的一个问题。
技术实现要素:
[0005]
发明目的:本发明的目的是提供一种molnupiravir掩味颗粒,该颗粒能够有效掩盖药物本身的苦味,且能达到无水口服的技术效果,打破了常规颗粒剂需要用水顺服的缺点,提高患者特别是儿童用药的依从性。本发明的另一个目的是提供molnupiravir掩味颗粒的制备方法,该制备工艺可以有效解决molnupiravir在生产中易分解、稳定性差的问题,进而提高制剂产品的质量和稳定性。
[0006]
技术方案:本发明提供一种molnupiravir掩味颗粒,包含活性颗粒、隔离层和掩味层,掩味层包裹在活性颗粒外,隔离层包裹在掩味层外;其中活性颗粒包含molnupiravir、ph调节剂、易挥发的黏合剂溶液。
[0007]
其中molnupiravir占活性颗粒的重量百分比为40%-75%。
[0008]
所述ph调节剂为选自琥珀酸、枸橼酸、富马酸、柠檬酸,占活性颗粒的重量百分比
为2.0%-6.0%。
[0009]
所述易挥发的黏合剂溶液采用羧甲基纤维素钠的90%以上的乙醇溶液,优选95%乙醇溶液,占活性颗粒的重量百分比为2.0%-5.0%。
[0010]
molnupiravir掩味颗粒的活性颗粒还包含润湿剂、填充剂、矫味剂、润滑剂中的两种及以上。
[0011]
所述的润湿剂选自乙醇、水,其中乙醇优选95%;所述的填充剂为麦芽糊精;所述的矫味剂为香草香精;所述的润滑剂选自滑石粉、微粉硅胶、硬脂酸镁。
[0012]
molnupiravir掩味颗粒的掩味层是由尤特奇e型号系列和抗粘剂组成,与活性颗粒的重量百分比为2.0%-10.0%。所述的尤特奇e型号系列选自尤特奇e100、尤特奇epo、尤特奇l30d-55,所述的抗粘剂选自乙酰柠檬酸三丁酯、乙酰柠檬酸二乙酯、柠檬酸二乙酯、柠檬酸三乙酯、油酸、癸二酸二丁酯、甘油、丙二醇、吐温80、聚乙二醇、滑石粉、单硬脂酸甘油酯、硬脂酸镁、二氧化钛、碳酸钙、氧化镁。
[0013]
molnupiravir掩味颗粒的隔离层由羟丙甲纤维素和增塑剂组成,与活性颗粒的重量百分比为2.0%-10.0%。所述的羟丙甲纤维素选自粘度级别介于3mpa.s至50mpa.s的一种或几种,增塑剂选自蓖麻油、邻苯二甲酸二乙酯、聚乙二醇、吐温80、柠檬酸三乙酯、丙二醇。
[0014]
本发明还提供一种molnupiravir掩味颗粒的制备方法,包括以下步骤:
[0015]
(1)前处理:molnupiravir原料药粉碎;
[0016]
(2)制备黏合剂溶液:将羧甲基纤维素钠溶于95%乙醇溶液中作为黏合剂溶液;
[0017]
(3)软材的制备:先将处方量的molnupiravir、ph调节剂和其他辅料混合均匀,再加入步骤(2)制得的黏合剂溶液,黏合剂溶液以雾化的形式加入,继续混合均匀制成软材;
[0018]
(4)颗粒的制备:移动式整粒机进行制备湿颗粒;
[0019]
(5)颗粒的干燥:流化床中进行颗粒的干燥;
[0020]
(6)流化床包衣:依次包制掩味层和隔离层。
[0021]
在一些实施方案中步骤(5)中颗粒干燥控制物料温度为30-50℃,控制颗粒水分为1%-3%。
[0022]
有益效果:与现有技术相比,本发明具有如下优点:(1)本发明颗粒的制软材步骤中采用ph调节剂和低水分、易挥发的黏合剂溶液,最大限度的控制软材含水量,保证molnupiravir不被水解,同时该颗粒采用低温干燥,亦能30min内快速干燥,使温度和水分对molnupiravir的影响时间最短,进一步保证了molnupiravir的稳定性,解决molnupiravir在生产中稳定性差、易分解产生杂质的问题;(2)我们对颗粒进行了双层包衣,使得其在口中不会融化,有效改善药物口感,掩盖了其本身的苦味,能够实现免水口服的效果,打破常规颗粒剂用药需要用水进行顺服,增强药物稳定性提高用药方便性和患者服药的依从性,增加了患者的适应人群,有助于提高患者特别是儿童用药的依从性。
附图说明
[0023]
图1为实施例1的溶出曲线图。
具体实施方式
[0024]
该掩味颗粒的配方适用于各规格:如0.4g、0.8g、2.4g等产品。
[0025]
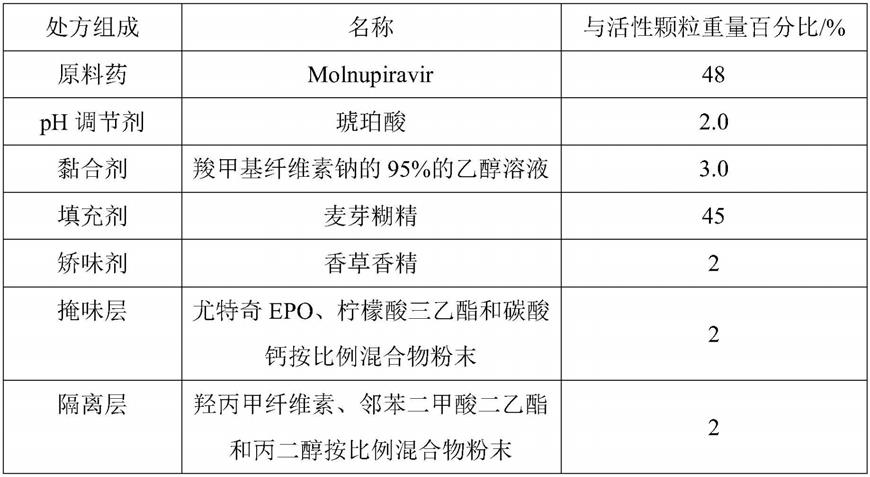
实施例1
[0026]
molnupiravir颗粒处方组成如下:
[0027][0028]
molnupiravir颗粒的工艺包括以下步骤:
[0029]
(1)前处理:molnupiravir气流粉碎;
[0030]
(2)制备黏合剂:将羧甲基纤维素钠溶于95%的乙醇溶液中作为黏合剂;
[0031]
(3)软材的制备:将处方量的molnupiravir、ph调节剂和其他辅料组合物置于高剪切湿法制粒机中混合均匀,物料在混合状态下加入黏合剂溶液,黏合剂溶液以雾化的形式加入,继续混合均匀,制成软材;
[0032]
(4)颗粒的制备:采用移动式整粒机进行制备湿颗粒,筛网为40目;
[0033]
(5)颗粒的干燥:采用流化床进行颗粒的干燥,控制物料温度为30-50℃,控制颗粒水分为1%-3%,用30目筛网整粒;
[0034]
(6)流化床包衣:
[0035]
a包制掩味层:将掩味层物料溶于95%的乙醇溶液中,采用流化床对干燥后颗粒进行掩味层包衣。
[0036]
b包制隔离层:将隔离层物料溶于95%的乙醇溶液中,采用流化床对掩味层包衣后颗粒进行隔离层包衣。
[0037]
c包衣工艺参数:
[0038]
工艺参数隔离层包衣掩味层包衣雾化气压1.2bar1.2bar物料温度40℃40℃供液速率9.5g/min9.7g/min风门20-24%15-20%
[0039]
(7)装袋:铝塑复合膜灌装
[0040]
实施例2-7
[0041]
实施例2-7采用实施例1的配方和制备方法,分别设计不同ph调节剂的用量、不同黏合剂溶液的用量和包衣增重的用量。
[0042][0043]
实施例8
[0044]
考察molnupiravir掩味颗粒口感及无水吞服的效果、溶出度、含量均匀度、颗粒粒度、溶化性质量指标和有关含量,其检测结果如下:
[0045]
1.对实施例1中molnupiravir颗粒口感及无水吞服的效果
[0046]
取样方法:成人男女各半吞服,一共20人
[0047]
检测方式:颗粒口服,无水吞服
[0048]
检测结果
[0049][0050][0051]
结论:molnupiravir颗粒无水吞服口感良好,无吞咽困难现象。
[0052]
2.对实施例1中molnupiravir颗粒溶出度研究
[0053]
取样方法:以在水、ph1.2盐酸缓冲液、ph4.5醋酸缓冲液、ph6.8磷酸缓冲液为释放介质,
[0054]
溶出测定方法:浆法,转速100r/min,温度为(37.0
±
0.5)℃,分别于5min、10min、15min、30min、45min取样。
[0055]
检测方法:按中国药典高效液相色谱法进行检验,限度为标示量的80%
[0056]
检测结果:(相当于标示量的百分含量):
[0057][0058]
具体如图1所述,结果表明,molnupiravir颗粒溶出度在ph1.2-ph6.8范围内快速
释放。
[0059]
3.实施例1-7的molnupiravir颗粒含量均匀度检测
[0060]
取样方法:按国家药典规定的取样方法,分别对上述7个实施例的颗粒进行取样,每个实施例取5个样品
[0061]
检测方法:按中国药典高效液相色谱法进行检验
[0062]
检测结果(相当于标示量的百分含量):
[0063][0064][0065]
上述实验结果表明,按实施例1工艺过程进行操作,经对其颗粒中molnupiravir颗粒含量进行检测并对数据进行分析,rsd最小,说明其数值的精密度高,molnupiravir颗粒含量均匀度最好。
[0066]
4.实施例1-7的molnupiravir颗粒粒度检测
[0067]
取样方法:按国家药典规定的取样方法,分别对上述7个实施例总混后的颗粒进行取样,每个实施例取5个样品
[0068]
检测方法:按中国药典颗粒剂项下的粒度检查方法进行检查。
[0069]
检测结果:
[0070][0071]
上述实验结果表明,按实施例1工艺过程进行操作,经对其颗粒中molnupiravir颗粒颗粒进行检测并对数据进行分析,rsd最小,说明其数值的精密度高,粒度均匀。
[0072]
5.实施例1-7的molnupiravir颗粒溶化性检测
[0073]
取样方法:按国家药典规定的取样方法,分别对上述7个实施例总混后的颗粒进行取样,每个实施例取5个样品,每个样品取样10g进行溶化性检查
[0074]
检测方法:按中国药典颗粒剂项下的溶化性检查检查方法进行检查。
[0075]
检测结果:
[0076]
实施例样品1样品2样品3样品4样品51合格合格合格合格合格2合格合格合格合格合格3合格合格合格合格合格4合格合格合格合格合格5合格合格合格合格合格6合格合格合格合格合格7合格合格合格合格合格
[0077]
上述实验结果表明,按实施例1工艺过程进行操作,经对颗粒进行溶化性检测,全部合格,说明工艺参数的设定是合理的。
[0078]
6.稳定性研究
[0079]
(1)molnupiravir原料药稳定性研究
[0080]
取molnupiravir进行破坏性实验考察,在不同破坏因素中,检测其高分子杂质含量。
[0081]
破坏因素杂质百分比(%)未破坏0.02高温(85℃)30天1.77高湿(92.5%,25℃)30天1.220.1m弱酸破坏30天0.040.1m弱碱破坏30天1.110.1m强酸破坏10h1.570.01m强碱破坏1h11.42
[0082]
研究molnupiravir在酸和碱中稳定性时发现molnupiravir在高温、高湿、强酸和强碱及弱碱条件下与未破坏条件下比较,杂质有明显增长并增长量较大,故molnupiravir不稳定,在弱酸条件与未破坏条件进行比较,杂质未有明显增长,故molnupiravir在弱酸中稳定,在其他条件下不稳定。
[0083]
(2)实施例1-7molnupiravir颗粒稳定性加速考察
[0084]
加速放样:对实施例1-7的样品放置加速条件温度30℃/湿度65%rh,放置时间6个月;
[0085]
取样方法:按国家药典规定的取样方法,分别对上述7个实施例的颗粒进行取样,每个实施例取1个样品进行有关含量检测;
[0086]
检测方法:按中国药典高效液相色谱法进行检验
[0087]
检测结果(相当于标示量的百分含量):
[0088][0089]
不同ph调节剂的用量的样品(实施例1、实施例2和实施例3),由上表可以看出,当没有ph调节剂时,处方中杂质有明显增加,说明稳定性较差而处方中增加ph调节剂时,可以发现处方较稳定。当实施例1和实施例2相比时,ph调节剂的用量对处方中杂质含量无较大影响,稳定性良好,故ph调节剂的用量优选2.0%-6.0%。
[0090]
不同黏合剂溶液的用量生产的样品(实施例1、实施例4和实施例5),由上表可以看出,黏合剂溶液对处方中杂质含量无较大影响,稳定性良好,故黏合剂溶液的用量2.0%-5.0%。
[0091]
不同包衣增重生产的样品(实施例1、实施例6和实施例7),由上表可以看出,包衣增重不同,则对杂质含量和溶化度无较大影响,稳定性良好,故包衣增重范围为2%-10%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1