胶束、核酸传递系统及鼻黏膜给药系统
1.本发明属于生物医药领域,具体涉及胶束、核酸传递系统及鼻黏膜给药系统。
背景技术:
2.由于鼻腔和颅腔在解剖学上具有独特的生理联系,因此鼻黏膜给药被认为是一种潜在的非侵入性的给药途径。相比于其他类型的给药方式,鼻黏膜给药的优势主要体现在:(1)能避免胃肠道降解和肝脏首过效应;(2)药物可以绕过血脑屏障直接聚集在大脑,增加药物的生物利用度;(3)减少药物的全身暴露,从而减少不必要的全身副作用。
3.rna干扰是通过向细胞中导入与内源性mrna编码区同源的双链rna,使目标mrna发生降解从而导致基因沉默的技术。小干扰rna(sirna)是长度为20~25个碱基对的非编码rna,能对与之互补的mrna序列进行酶切,从而使相应的蛋白无法表达,达到基因功能沉默的目的。数年来,各个国家的科研工作者潜心研究sirna技术,截止现在为止,sirna已经被用于治疗多种疾病,是一种极具潜力的治疗方式。
4.有效地将sirna经鼻黏膜递送到大脑并发挥治疗作用是治疗中枢神经系统疾病的关键。由于鼻腔的特殊解剖生理结构,sirna技术用经鼻黏膜给药还存在许多困难,主要表现在以下方面:(1)鼻黏膜表面有众多纤毛在向后摆动,将鼻黏膜表面的物质快速清除。药物给药后,清除半衰期大概是一刻钟;(2)鼻黏膜细胞间存在紧密连接,阻碍大分子药物进入;(3)鼻腔内存在许多酶,可能影响sirna的稳定性。为解决这些问题,一些纳米级的递送载体被开发出来,以进一步增强经鼻到脑的药物递送。目前常用的sirna递送载体可以大致分为病毒来源的和非病毒来源的载体,后者根据载体的组成不同分为以下三大类:脂质体、聚合物、和蛋白多肽类。其中,蛋白多肽类载体与其他载体相比具有更高的生物相容性,并且可以保护sirna不被降解,促进内体逃逸,还可以在表面进一步修饰用于针对特定的细胞类型,具有潜在的应用前景。虽然目前sirna的递送载体的研究用于静脉给药、皮下给药、瘤内给药等给药方式上已经取得了一定的效果,但是在鼻黏膜给药领域的研究还较少。因此有必要开发能用于鼻黏膜给药高效递送sirna到中枢神经系统的载体,来达到治疗中枢神经系统疾病的作用。同时,为了获得更好的治疗效果,该载体还应该具有高效的帮助sirna进入细胞的效果。增强细胞转染效率的传统方式通常有电穿孔、超声处理等方法。
5.粘多糖是含氮的不均一多糖,是构成细胞间结缔组织的主要成分。由于其较高的生物相容性和较低的细胞毒性,已被各种药物递送系统的制备。粘多糖可作为载体的修饰或组成材料之一存在,可能使修饰过后的载体具有肿瘤靶向性或其他功能特性。
技术实现要素:
6.本发明要解决的技术问题是制备一种可用于鼻黏膜给药的载体,用于传递治疗性sirna到中枢神经系统并发挥治疗作用。本发明解决上述技术问题的技术方案是提供了胶束。
7.该胶束为粘多糖包裹疏水化修饰的多肽所形成的核壳结构胶束;所述多肽的氨基
酸序列为vqwrirvavirk(seq id no.1),所述的疏水化修饰为在所述多肽的氮末端偶联疏水片段。
8.其中,上述胶束中所述的粘多糖是由糖醛酸和氨基己糖组成。
9.其中,上述的糖醛酸为d-葡萄糖醛酸、d-甘露糖醛酸、d-半乳糖醛酸、l-艾杜糖醛酸或l-古罗糖醛酸中的至少一种。
10.其中,上述的氨基己糖为n-乙酰甘露糖胺、n-乙酰葡萄糖胺或n-乙酰-d-半乳糖胺中的至少一种。
11.其中,上述胶束中所述的粘多糖的平均分子量为8000~80000道尔顿。
12.其中,上述胶束中所述粘多糖与疏水化修饰多肽的质量比例为粘多糖:疏水化多肽=0.6~1.2:1。
13.其中,上述胶束中所述粘多糖为硫酸皮肤素,硫酸类肝素、硫酸角质素、硫酸软骨素或透明质酸中的至少一种。
14.进一步的,上述的胶束可由以下方法制成:
15.a、称取粘多糖溶于溶剂中制成溶液;称取疏水化修饰多肽溶于溶剂中制成溶液;
16.b、将步骤a制备的两种溶液混合均匀,静置至形成胶束。
17.其中,上述的溶剂为水、磷酸盐缓冲溶液或生理盐水中的至少一种。
18.其中,上述的静置条件为:温度在0~60摄氏度。进一步的,上述静置的温度条件可为4摄氏度、25摄氏度、37摄氏度或55摄氏度中的任一种。25摄氏度左右为最佳。
19.其中,上述的疏水化修饰多肽vqwrirvavirk的碳端酰胺化修饰为vqwrirvavirk-nh2。
20.其中,上述疏水化修饰多肽中所述的疏水片段为甾醇类化合物或饱和直链脂肪酸或peg衍生物。
21.其中,上述疏水化修饰多肽中所述的甾醇类化合物为胆固醇类化合物或胆酸类化合物。优选的,上述的甾醇类化合物为胆固醇、丁二酰化胆固醇、胆酸或去氧胆酸中的至少一种。
22.其中,上述疏水化修饰多肽中所述饱和直链脂肪酸为c
6-c
20
中的至少一种。优选的,所述饱和直链脂肪酸为c8~c18中的至少一种。进一步优选的,所述直链脂肪酸为硬脂酸(c18)、软脂酸(c16)、月桂酸(c12)或正辛酸(c8)中的至少一种。
23.其中,上述疏水化修饰多肽中所述peg衍生物为1,2-二油酰-sn-甘油-3-磷酰乙醇胺-聚乙二醇、二硬脂酰基磷脂酰乙醇胺-聚乙二醇或二棕榈酰磷酯酰乙醇胺-聚乙二醇中的至少一种。
24.其中,上述疏水化修饰多肽中所述的多肽的氮端与疏水片段偶联的方式为通过疏水片段上的-co-oh与多肽上的-nh2酰胺化反应生成。
25.进一步的,上述疏水化修饰多肽的多肽结构为:
[0026][0027]
其中,所述的r为甾醇类化合物或饱和直链脂肪酸或peg衍生物。
[0028]
进一步的,上述的多肽结构中的r为:
[0029][0029]
中的至少一种。
[0030]
本发明还提供了上述的胶束在制备核酸传递系统中的作用。
[0031]
本发明也还提供了上述的胶束在制备中枢系统药物递送系统中的作用。特别适用于递送带负电的药物。比如核酸、带负电的多肽或蛋白质等。
[0032]
本发明还提供了一种核酸传递系统,其是由上述的胶束装载核酸制成。其中,上述核酸传递系统中所述的核酸为dna或rna中的至少一种。其中,上述核酸传递系统中所述的rna为信使rna、sirna、sgrna或microrna中的至少一种。
[0033]
其中,上述核酸传递系统是由胶束成分和核酸按质量比1~15:1作为主要原料制备而成。优选的,胶束和核酸的质量比为9~11:1。进一步优选的,由粘多糖、疏水化修饰多肽与核酸按质量比4~5:5~6:1作为主要原料制备而成。
[0034]
其中,上述核酸传递系统是由核壳结构的胶束装载核酸构成,所述核酸被装载于由粘多糖包裹在疏水化修饰的多肽外形成的核壳结构胶束中。
[0035]
其中,上述核酸传递系统是由疏水化修饰多肽与核酸在溶液中共孵育4~15min,随后再与粘多糖在培养基中继续孵育4~15min而得。
[0036]
其中,上述核酸传递系统中所述的孵育可以在水、pbs缓冲液、生理盐水或液体培养基中的至少一种中进行。进一步的,所述的液体培养基为rpmi 1640、dmem双无培养基或opti-mem培养基中的至少一种。
[0037]
其中,上述核酸传递系统中所述的核酸的长度为20~30nt。
[0038]
其中,上述核酸传递系统中所述的核酸为无修饰的sirna;或是正义链的5'端修饰了荧光基团的sirna。所述的修饰的荧光基团可以是fam、cy3或cy5中的至少一种。
[0039]
本发明也提供了上述的胶束或上述的核酸传递系统在制备鼻黏膜给药系统中的作用。
[0040]
其中,上述的鼻黏膜给药系统的,给药方式为鼻喷雾、滴鼻、雾化吸入中的至少一种。
[0041]
其中,上述的鼻黏膜给药系统的为滴鼻剂、气雾剂、喷雾剂、粉雾剂或雾化器用制剂。
[0042]
本发明的有益效果在于:本发明使用粘多糖包裹在疏水化修饰的vqwrirvavirk多肽外面形成了具有核壳结构的胶束,该胶束可以高效地将核酸递送到细胞中,并且具有较低的细胞毒性。本发明通过实验证明,使用本发明胶束递送特异性靶向血管生长因子vegf或polo样激酶plk1的治疗性sirna,可以在mrna和蛋白层面上有效抑制vegf或plk1的表达,从而降低huvec细胞的血管生成能力或诱导胶质瘤细胞凋亡。同时,本发明胶束具有一定的粘附性,鼻黏膜给药后可以增强在鼻腔中的滞留能力,避免sirna经纤毛运动分布至肺中。同时,该胶束可通过三叉神经途径将sirna快速传递到中枢神经系统。鼻黏膜给药以后的sirna主要分布在大脑中,在其他脏器中没有检测到;而静脉注射后,sirna在肝、脾、肺、肾中均有分布,表明该经鼻给药系统可以降低sirna的全身性分布,从而减少系统性毒副作用。在本发明实施例中,使用装载靶向vegf或plk1的sirna经小鼠鼻黏膜给药,均显示出显著的抗肿瘤效果,说明本发明技术方案能够通过高效鼻脑递送sirna、协助sirna进入细胞等方式综合促进最终体内抗肿瘤效果。同时,本发明技术方案制备方便、成本低廉、低度安全,且制备周期短,可以在给药前进行制备,无需长期保存,具有很好的临床应用前景,用于治疗胶质瘤甚至其他中枢神经系统疾病。
附图说明
[0043]
图1.dp7-c/sirna复合物的制备、表征。a.凝胶阻滞电泳测定dp7-c与sirna的最佳质量配比。b.dp7-c与sirna不同质量配比的粒径分布情况。c.dp7-c与sirna不同质量配比的电位。d.单独dp7-c的粒径分布。e.单独dp7-c的电位。f.dp7-c的透射电镜表征。g.dp7-c/sirna复合物的粒径分布。h.dp7-c/sirna复合物的电位。i.dp7-c/sirna的透射电镜表征。
[0044]
图2.透明质酸包裹的dp7-c/sirna胶束的制备、表征。a.透明质酸包裹的dp7-c/sirna胶束的粒径分布。b.透明质酸包裹的dp7-c/sirna胶束的电位。c.透明质酸包裹的dp7-c/sirna胶束的透射电镜表征。
[0045]
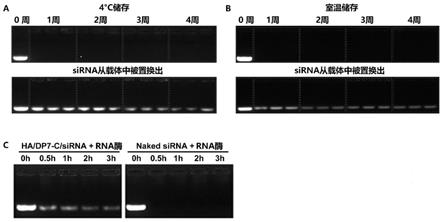
图3.透明质酸包裹的dp7-c/sirna胶束作为sirna载体的稳定性研究。a.透明质酸包裹的dp7-c/sirna胶束4度放置稳定性。b.透明质酸包裹的dp7-c/sirna胶束室温放置稳定性。c.透明质酸包裹的dp7-c/sirna胶束抗rna酶降解能力。
[0046]
图4.透明质酸包裹的dp7-c/sirna胶束作为sirna载体方面的研究。a~b.透明质酸包裹的dp7-c/sirna胶束转染sirna到gl261细胞的效率。a.流式结果图。b.转染效率和荧光强度统计分析。c.透明质酸包裹的dp7-c/sirna胶束被gl261细胞摄取的相关机制。(*p《0.05,**p《0.05,***p《0.001)。
[0047]
图5.透明质酸包裹的dp7-c/sirna胶束的细胞毒性检测。
[0048]
图6.透明质酸包裹的dp7-c/sirna胶束递送vegf sirna体外治疗效果研究。a-b.透明质酸包裹的dp7-c/sirna胶束递送vegf sirna到gl261细胞的基因和蛋白沉默效率。a.mrna水平的沉默效率。b.蛋白水平的沉默效率(vegf及下游相关蛋白)。c~d.透明质酸包裹的dp7-c/sirna胶束递送vegf sirna到huvec细胞的抗血管生成实验。c.血管生成统计计数。d.血管生成情况拍照。(*p《0.05,**p《0.05,***p《0.001)。
[0049]
图7.透明质酸包裹的dp7-c胶束递送plk1 sirna的体外mrna沉默效果。a~b.透明
质酸包裹的dp7-c/sirna胶束递送plk1sirna到gl261细胞的基因和蛋白沉默效率。a.mrna水平的沉默效率。b.蛋白水平的沉默效率(vegf及下游相关蛋白)。c~f.透明质酸包裹的dp7-c/sirna胶束递送plk1 sirna诱导细胞凋亡研究。c.细胞核形态学研究。d.细胞核形态学统计分析。e.gl261细胞凋亡率统计分析。f.gl261细胞凋亡率流式检测结果。(*p《0.05,**p《0.05,***p《0.001)。
[0050]
图8.透明质酸包裹的dp7-c胶束鼻黏膜给药递送sirna进入大脑的功能验证和途径研究。a~b.透明质酸包裹的dp7-c胶束鼻黏膜给药递送sirna进入大脑的功能验证。a.活体成像图。b.活体成像统计分析。c.透明质酸包裹的dp7-c胶束递送sirna鼻黏膜给药后鼻腔黏附能力验证。d.透明质酸包裹的dp7-c胶束递送sirna鼻黏膜给药后进入大脑的途径研究(三叉神经途径验证,三叉神经活体成像)。e.透明质酸包裹的dp7-c胶束递送sirna鼻黏膜给药和静脉给药后在组织中的分布比较。(*p《0.05,**p《0.05,***p《0.001)。
[0051]
图9.透明质酸包裹的dp7-c胶束的体内外肿瘤靶向性验证。a.透明质酸体外竞争性抑制实验。b~d.透明质酸包裹的dp7-c胶束鼻黏膜给药递送sirna体内靶向性验证。b.活体成像。c.冰冻切片。d.冰冻切片统计分析。(*p《0.05,**p《0.05,***p《0.001)。
[0052]
图10.透明质酸包裹的dp7-c胶束鼻黏膜给药递送sirna治疗小鼠原位胶质瘤的效果验证。a.治疗期间小鼠体重变化。b.生存期统计(*p《0.05,**p《0.05,***p《0.001)。
[0053]
图11.透明质酸包裹的dp7-c胶束鼻黏膜给药递送sirna治疗小鼠原位胶质瘤的效果验证。a.肿瘤面积统计(he染色)。b~c.荷瘤脑组织切片免疫组织化学分析。b.肿瘤血管计数。c.ki67阳性细胞统计。(*p《0.05,***p《0.001)。
具体实施方式
[0054]
以下通过具体实施方式的介绍对本发明进行具体的说明。
[0055]
在本发明的前期研究中,获得了一种具有优秀抗菌作用的多肽,其序列为vqwrirvavirk(seq id no.1),将其命名为dp7。在进一步的研究中,发现对dp7多肽进行疏水化修饰后成为具有自组装成胶束能力的两亲化合物,一方面能降低dp7多肽的细胞毒性,保持抗菌活性;另一方面作为组装成纳米粒子后能作为一些药物的传输载体。
[0056]
发明人创造性地考虑使用粘多糖对该疏水化修饰的dp7多肽自组装形成的胶束进行修饰,然后再考察其修饰获得的复合物载体是否具有在鼻黏膜给药后将核酸分子、尤其是sirna传输到中枢神经系统的功能。在实验中出人意料地发现,使用粘多糖修饰得到的核壳结构胶束不仅明显提高了疏水化修饰的dp7多肽将sirna转染到gl261胶质瘤细胞中的效率,同时保持了较低毒性的特点。并且由于粘多糖的粘附特性,粘多糖修饰得到的核壳结构胶束在鼻黏膜给药以后在鼻腔中的黏附能力增加,增强了sirna被最终传输到中枢神经系统的效率,避免了sirna因鼻纤毛运动分布在肺中,体现出鼻脑输送治疗性核酸分子、尤其是sirna的巨大潜力。在此基础上,获得了本发明的各项技术方案。
[0057]
而本发明中用于制备粘多糖包裹的多肽胶束的疏水化修饰多肽是在vqwrirvavirk多肽的氮端连接疏水片段进行的修饰。而vqwrirvavirk多肽的碳端可酰胺化修饰为vqwrirvavirk-nh2。
[0058]
用于vqwrirvavirk多肽疏水化修饰的疏水片段可以为甾醇类化合物、饱和直链脂肪酸或peg衍生物。所述的甾醇类化合物为胆固醇类化合物或胆酸类化合物。比如可在胆固
醇、丁二酰化胆固醇、胆酸或去氧胆酸中选择。所述饱和直链脂肪酸为c6~c20中的至少一种。优选的,所述饱和直链脂肪酸为c8~c18中的至少一种。比如,可以在硬脂酸(c18)、软脂酸(c16)、月桂酸(c12)或正辛酸(c8)中选择。所述peg衍生物可选自1,2-二油酰-sn-甘油-3-磷酰乙醇胺-聚乙二醇(dspe-peg)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dope-peg)或二棕榈酰磷酯酰乙醇胺-聚乙二醇(dppe-peg)。
[0059]
一般来说,所述疏水化修饰多肽的氮端与疏水片段(疏水化合物)偶联的方式为通过疏水片段(疏水化合物)上的-co-oh与抗菌肽上的-nh2酰胺化反应而偶联。
[0060]
疏水化修饰多肽的结构可以表示为:
[0061][0062]
其中,所述的r为甾醇类化合物或饱和直链脂肪酸或peg衍生物。
[0063]
在一些实例中,上述结构式中的r为:
[0064]064]
中的至少一种。
[0065]
而经过考察,粘多糖包裹疏水化修饰多肽所组成的核壳结构胶束,粘多糖与疏水化修饰多肽的质量比例一般可在以下范围内选取为较优:粘多糖:疏水化多肽=0.6~1.2:1.0。
[0066]
在本发明的一个实施例中,以胆固醇作为疏水化片段修饰上述阳离子多肽,即上式中的r为:此胆固醇化修饰vqwrirvavirk-nh2得到的多肽在本发明中命名为dp7-c,其制备可参考cn107446019a。
[0067]
本发明进一步的提供了制备上述粘多糖包裹疏水化修饰多肽所组成的核壳结构胶束的参考方法:
[0068]
a.称取粘多糖溶于溶液中,所述溶剂可以为超纯水、磷酸盐缓冲溶液、生理盐水中的至少一种;
[0069]
b.称取疏水化修饰多肽溶于溶剂中,所述溶剂可以为超纯水、磷酸盐缓冲液、生理盐水中的至少一种;
[0070]
c.将步骤a和b中的溶液混合均匀,静置等待形成胶束,静置条件0-60摄氏度。一般可选4、25、37、55摄氏度中的任意一种;25摄氏度为较佳。
[0071]
本发明提供的上述胶束具有装载核酸并传递至细胞中的作用,因此可以装载上核酸形成核酸传递系统。这些目标细胞可以是各种动植物包括人的细胞。可以是在体或者处于离体培养状态中的细胞。
[0072]
该核酸传递系统可用于传递dna或rna中的至少一种核酸。而长度在20~30nt之间的核酸均能获得好的传递效率。
[0073]
此核酸传递系统可广泛地应用于传递各种功能性的rna分子,如信使rna、sirna、sgrna或microrna中的至少一种。尤其是可以高效地传送用于在细胞内沉默靶mrna的sirna,这些sirna一般为带有5’磷酸基团和3’羟基结构的sirna。
[0074]
更为重要的是,这个传递系统可以非常简单地制备获得。一种典型的简便制备方案就是将上述疏水化修饰多肽与核酸在培养基中共孵育4~15min,随后再与粘多糖在培养基中继续孵育4~15min而得,所述培养基为rpmi 1640、dmem双无培养基或optim培养基中的至少一种。在体系中,共孵育4~15min的时间一般已经足够将足够量的核酸负载到此脂质体上而得到该核酸传递系统。此核酸传递系统可由胶束成分(粘多糖和疏水化修饰多肽的总质量)和核酸按质量比1~15︰1制得。优选的,由胶束成分与核酸按质量比9~11:1制得。进一步优选的,由粘多糖、疏水化修饰多肽与核酸按质量比4~5:5~6:1作为主要原料制备而成。
[0075]
虽然在之前的研究中已经发现单独的dp7-c多肽能够在水中自组装形成胶束,可装载一些小分子药物、多肽乃至短的核酸分子。但是,能否用粘多糖包裹dp7-c胶束,以及得到的粘多糖/dp7-c胶束的具体特性和功能还是未知的。
[0076]
首先,本发明发现用粘多糖包裹dp7-c后得到得核壳结构胶束仍然保持了较高的将核酸递送到细胞中的能力和较低的细胞毒性。
[0077]
使用粘多糖包裹dp7-c形成的核壳结构胶束转染gl261细胞时,发现该粘多糖具有特异性靶向gl261细胞表面cd44受体的功能,并提高sirna被gl261细胞摄取的效率。进一步研究了该粘多糖包裹其他类似多肽转染gl261细胞的效率,发现该粘多糖包裹后可以通过与cd44结合,普遍提高转染效率。而与粘多糖包裹的tat-c、r9-c相比,粘多糖包裹的dp7-c转染效率最佳,细胞毒性也更低。深入研究还发现粘多糖/dp7-c胶束主要是通过巨胞饮途径和网格蛋白途径被gl261细胞内化的。
[0078]
而在更进一步的实验中,本发明发现粘多糖包裹后增加了该核酸递送系统的黏附性,使其能够黏附在鼻腔中,避免了鼻黏膜给药后随着纤毛运动分布在肺里。在鼻黏膜给药以后,该粘多糖包裹的dp7-c胶束可以快速通过三叉神经通路进入大脑,并且与静脉注射相比,该系统通过鼻黏膜给药以后在其他重要脏器中(心肝脾肺肾)没有出现药物分布,因此不会导致全身毒性。此外,粘多糖包裹的dp7-c胶束比单独的dp7-c胶束鼻黏膜给药以后,在脑部胶质瘤的聚集能力更强,这与细胞实验发现粘多糖可以与gl261细胞上cd44受体结合一致。
[0079]
由此,基本可以确定粘多糖包裹的dp7-c胶束特别适合于作为传递载体经鼻黏膜给药向中枢神经系统传递核酸分子,尤其是sirna。这正好可以解决其他如静脉注射、口服给药等方式给药后需要穿过血脑屏障才能发挥治疗作用的问题,从而提高药物的生物利用
度。
[0080]
基于此,本发明提供了上述的核酸传递系统在制备鼻黏膜给药系统中的用途。该鼻黏膜传递系统所装载的核酸是sirna,这里的sirna可以是能够靶向任意肿瘤相关靶点的sirna。在本研究中使用的是能够特异性降解vegf mrna或plk1 mrna的sirna序列,并希望其进入肿瘤细胞中能够降解肿瘤中的vegf或plk1 mrna,进而抑制vegf或plk1的蛋白而成,以减少肿瘤中新生血管的生成或起到诱导肿瘤细胞凋亡的作用。
[0081]
在本发明的实施例中,在体外筛选了能够特异性降解vegf或plk1 mrna的sirna序列,并验证了体外的治疗效果。使用粘多糖包裹的dp7-c胶束递送vegf sirna到gl261细胞中,或递送plk1 sirna到gl261细胞中,能够抑制vegf mrna或plk1 mrna的表达,影响vegf和plk1蛋白及其下游相关蛋白的合成。体外治疗效果被进一步研究,使用粘多糖包裹的dp7-c胶束递送vegf sirna到huvec细胞中,并观察vegf基因沉默后huvec细胞在体外的血管生成能力,发现huvec的血管生成能力下降。使用粘多糖包裹的dp7-c胶束递送plk1 sirna到gl261细胞中,发现在处理48h后,gl261细胞开始出现显著的凋亡。
[0082]
在小鼠原位胶质瘤模型中,使用粘多糖包裹的dp7-c胶束经鼻黏膜给药递送vegf或plk1 sirna进行治疗,表现出了显著的抗肿瘤效果,能明显延缓荷瘤小鼠的体重下降速度并延长生存期。
[0083]
本领域技术人员可以理解的是,本发明胶束递送活性成分,尤其是功能性核酸分子时,可以制备成药品使用。本发明胶束可以和药学上可接受的辅助性成分,或者可能于一种或多种其他的活性成分配合使用。这些药学上可接受的辅助性成分可为保护剂、赋型剂、免疫佐剂、分散剂、表面活性剂或细胞培养基中的至少一种。
[0084]
所述药品的剂型可根据具体情况选取,一般为滴鼻剂或喷雾剂,都是本领域的经鼻腔给药的常用制剂类型。
[0085]
其中喷雾剂是指含药溶液、乳状液或混悬液置于特制的装置,使用时借助适当的雾化系统将内容物呈雾状释出,用于患者吸入的制剂。喷雾剂一般由药物、辅料、容器、雾化装置等组成。本发明胶束可以制备为溶液型喷雾剂、乳剂型喷雾剂或混悬型的经鼻给药的喷雾剂。喷雾剂一般由药物、溶剂、助溶剂、表面活性剂组成,有时根据药物理化性质的不同加入稳定剂。
[0086]
本领域技术人员能够在需要将上述的胶束进行粘膜给药,尤其是进行鼻腔的粘膜给药时,可以上述的装载有活性成分的粘多糖与疏水化修饰的dp7多肽形成的胶束作为原料药,制备成各种合适的制剂类型。
[0087]
以下通过对实施例对本发明进行更进一步的详细描述。
[0088]
实施例中主要使用的实验材料和设备如下:
[0089]
1、实验用细胞株及实验动物
[0090]
293t、huvec细胞系和小鼠胶质母细胞瘤细胞系gl261均购自美国模式菌种收藏所(american type culture collection,atcc)。用含10%胎牛血清(fetal bovine serum,fbs,gibico公司)的dmem(gibico公司)培养基进行细胞培养。实验所用6-8周龄的c57bl/6j雌性小鼠购自北京华阜康生物技术股份有限公司,饲养于spf级环境中。
[0091]
2、主要试剂材料及试剂盒
[0092]
实验用细胞培养基:dmem培养基和胎牛血清(fetal bovine serum,fbs)均购自于
美国gibco公司。
[0093]
透明质酸购自华熙生物科技股份有限公司,平均分子量35000道尔顿(粘均分子量),ph值为6.0~8.0,透明质酸钠含量大于等于95%。
[0094]
dp7-c:疏水修饰的dp7-c多肽由上海科肽生物技术有限公司合成。
[0095]
tat-c:tat多肽的序列为rkrrqrrrprq(seq id no.2),通过胆固醇的-cooh与tat多肽的氮端偶联得到疏水化修饰的tat-c多肽(由上海科肽生物技术有限公司合成)。
[0096]
r9-c:r9多肽的序列为rrrrrrrrr(seq id no.3),通过胆固醇的-cooh与r9多肽的氮端偶联得到疏水化修饰的tat-c多肽(由上海科肽生物技术有限公司合成)。
[0097]
实验使用的所有sirna均由上海吉玛制药技术有限公司合成:
[0098]
vegf的sirna:sence 5'-3':cgaugaagcccuggagugctt(seq id no.4);
[0099]
anti-sense 5'-3':gcacuccagggcuucaucgtt(seq id no.5)。
[0100]
plk1的sirna:sence 5'-3':gcucccaucccaauuccuutt(seq id no.6);
[0101]
anti-sense 5'-3':aaggaauugggaugggagctt(seq id no.7)。
[0102]
scramble sirna:sence5'-3':uucuccgaacgugucacgutt(seq id no.8);
[0103]
anti-sense 5'-3':acgugacacguucggagaatt(seq id no.9)。
[0104]
pei25k试剂购自sigma-aldrich公司。
[0105]
早、晚期胞内体抗体:anti-eea1、anti-cd107a均购自美国invitrogen。
[0106]
巨胞饮途径抑制剂、窖蛋白途径抑制剂和网格蛋白途径抑制剂均购自美国sellect chemicals公司。
[0107]
western blot抗体:anti-p53 antibody、anti-erk1/2antibody、anti-p-erk1/2antibody、anti-akt antibody、anti-p-akt antibody、anti-caspase3 antibody均购自美国cell signaling technology(cst);anti-gapdh antibody,anti-vegf,anti-plk1均购自abcam。
[0108]
pe annexin v/7-aad细胞凋亡检测试剂盒购自美国bd。
[0109]
rt-qpcr试剂盒购自南京诺唯赞生物科技股份有限公司。
[0110]
real-time pcr引物购自北京擎科生物科技有限公司。
[0111]
4、主要仪器设备
[0112]
凝胶成像系统,fluor-stm multiimager,bio-rad;实时定量pcr仪,bio-rad cfx96;核酸电泳装置,power/pac1000,bio-rad;ph计,phs-3c酸度计;流式细胞仪,bd facs calibur;共聚焦显微镜,fv1000,olympus;超低温冰箱,mltra low,sanyo;rna浓度检测仪,nanodrop 2000,thermo;高压灭菌锅,sx300/500/700系列tomy;活体成像仪,cliper;纯水仪,easypure uf 07421,millipore;酶标仪,multiskan mk3,thermo scientific;透射电镜,jem-2100plus,joel;粒度仪,malvern zetasizer nano-zs zen 3600;荧光显微镜,dp80,olympus;组织石蜡包埋仪,eg1150h,leica。
[0113]
实施例一、dp7-c/sirna复合物的制备、表征
[0114]
本实施例中,我们采用了静电吸附法制备dp7-c/sirna复合物。
[0115]
1.dp7-c/sirna复合物的制备、表征。
[0116]
称取10mg dp7-c粉末溶解于milliq水中,作为母液保存于4℃冰箱中。将配置好的dp7-c母液稀释至1mg/ml作为使用浓度。按照scramble sirna:dp7-c=1:5的质量比例轻轻
混匀,室温孵育15min即得dp7-c/sirna复合物胶束。随后用凝胶阻滞电泳检测了scramble sirna与不同质量配比得dp7-c的结合情况,sirna与dp7-c质量比分别为1:0、2:1、1:1、2:1、3:1、4:1、5:1、6:1、8:1、10:1。
[0117]
实验结果表明:凝胶阻滞电泳结果显示,sirna与dp7-c在质量比1:5的时候不存在游离的sirna条带,sirna条带均与dp7-c结合,说明sirna与dp7-c的最佳比例为1:5(图1a)。使用粒度电位仪检测发现,sirna与dp7-c在质量比1:5的时候粒径较小,带正电荷(图1b~c)。单独的dp7-c的粒径为40.60
±
1.50nm,zeta电位为53.85
±
1.20mv(图1d~e)。透射电镜观测表明,dp7-c粒径均一,直径与粒径电位仪测得的大小相当,约为40nm(图1f)。dp7-c/sirna复合物的粒径为78.82
±
1.40nm,zeta电位为46.08
±
2.10mv(图1g~h)。透射电镜观测表明,制备的dp7-c/sirna复合物胶束粒径均一,分散性良好,直径与粒径电位仪测得的大小相当,约为75nm(图1i)。
[0118]
实施例二、透明质酸包裹的dp7-c/sirna胶束的制备、表征
[0119]
1.透明质酸包裹的dp7-c/sirna胶束的制备、表征
[0120]
称取10mg透明质酸(ha,平均分子量35000道尔顿)粉末溶解于milliq水中,作为母液保存于4℃冰箱中。取配置好的ha母液稀释至1mg/ml作为使用浓度。按照ha与dp7-c的质量配比为1:4,1:2,1:1,1:0.5,1:0.25的比例,将ha加入实施例一制备的dp7-c/sirna在水溶液中,轻轻混匀,室温静置10min即得ha/dp7-c/sirna胶束。
[0121]
实验结果表明:使用粒度电位仪检测发现,当ha与dp7-c的质量配比为1:1的时候,ha/dp7-c/sirna胶束的粒径为105.70
±
2.12nm,zeta电位为-24.60
±
0.37mv(图2a~b)(检测样品的sirna含量为40μg),粒径符合用于鼻黏膜给药需求,为最优配比。透射电镜观测表明,ha/dp7-c/sirna粒径均一,成核壳结构,直径与粒度电位仪测得的大小相当,约为105nm(图2c)。
[0122]
实施例三、透明质酸包裹的dp7-c/sirna胶束作为sirna载体的稳定性研究
[0123]
1.透明质酸包裹的dp7-c/sirna胶束长期放置稳定性
[0124]
分别于第1、2、3、4周时,将1.0μg sirna与5.0μg dp7-c轻轻混匀,室温孵育15min,然后加入5.0μg ha轻轻混匀,继续室温孵育10min。所得ha/dp7-c/sirna胶束置于4℃或室温进行保存。于第四周时,在上述溶液中加入sds,室温处理20min,使包裹于胶束中的sirna变为游离状态以便检测。以1μg sirna作为对照组,1%琼脂糖凝胶电泳检测结果。
[0125]
结果显示,ha/dp7-c/sirna在4度或室温下放置1~4周,均能通过凝胶阻滞电泳检测到sirna的条带,说明ha/dp7-c/sirna长期放置具有较好的稳定性(图3a-b)。
[0126]
2.透明质酸包裹的dp7-c/sirna胶束抗rna酶降解能力
[0127]
将1.0μg sirna与5.0μg dp7-c轻轻混匀,室温孵育15min,然后加入5.0μg ha轻轻混匀,继续室温孵育10min。设置相同质量的游离sirna作为对照组,并向前一步所得的ha/dp7-c/sirna胶束和对照组中分别加入0.5μl rna酶(1mg/ml)均匀混合,于37℃水浴下处理0、0.5、1、2、3h。结束处理后,加入sds室温孵育20min。使用1%琼脂糖凝胶电泳进行检测。
[0128]
实验结果显示,裸露的sirna组在rna酶处理后0.5h时已经被完全降解,而ha/dp7-c/sirna组在处理3h后,仍然有sirna释放,说明ha/dp7-c/sirna具有一定的抗rna酶降解的作用(图3c)。
[0129]
实施例四、透明质酸包裹的dp7-c/sirna胶束作为sirna递送载体方面的研究
[0130]
1.透明质酸包裹的dp7-c/sirna胶束转染sirna到小鼠胶质母细胞瘤gl261细胞的效率
[0131]
(1)将0.25μg cy3-sirna和1.25μg dp7-c、1.25μg tat-c、1.25μg r9-c和0.25μg pei25k在dmem培养基中共孵育15min。
[0132]
(2)将0.25μg cy3-sirna和1.25μgdp7-c、1.25μg tat-c和1.25μg r9-c在dmem培养基中共孵育15min后,加入1.25μg ha继续共孵育10min。
[0133]
(3)将步骤(1)(2)所得分别转染到铺有8
×
104个gl261细胞的24孔板中,6h后将dmem培养基替换为dmem+10%fbs+1%ps培养基,转染24h。使用荧光显微镜观察cy3-sirna的红色荧光情况并拍照。用胰酶消化细胞,并使用流式细胞仪检测cy3阳性细胞的比例以确定转染效率,以及分析平均荧光强度。
[0134]
实验结果显示,未包裹的dp7-c将sirna转染到gl261细胞的效率为87.29
±
3.15%,ha/dp7-c将sirna转染到gl261的效率为92.74
±
0.25%。对照组tat-c将sirna转染到gl261中的效率为32.54
±
2.43%,ha/tat-c将sirna转染到gl261细胞的效率为48.86
±
5.31%;r9-c将sirna转染到gl261中的效率为48.80
±
4.01%,ha/r9-c将sirna转染到gl261中的效率为55.97
±
2.20%;pei25k将sirna转染到gl261细胞的效率为66.50
±
3.21%。结果说明了dp7-c本身与其他类似的多肽对比,具有较高的转染效率。而ha包裹可以提高dp7-c、tat-c、rp9-c递送sirna到gl261细胞中的效率(图4a-b)。
[0135]
2.透明质酸包裹的dp7-c/sirna胶束被gl261细胞摄取的相关机制研究
[0136]
细胞内吞是通过细胞质膜变形运动将细胞外物质转运入细胞内的过程。主要分为巨胞饮、网格蛋白途径以及窖蛋白途径。为确定ha/dp7-c/sirna胶束进入gl261细胞与哪一条摄取途经相关,用各个摄取途径的抑制剂处理gl261,再测试抑制该途径后gl261对ha/dp7-c/sirna胶束的摄取效率,从而确定ha/dp7-c/sirna进入gl261与哪条内吞途径相关。分别使用了网格蛋白介导的内吞途径的抑制剂chlorpromazine、巨胞饮途径抑制剂amiloride、窖蛋白介导的内吞途径抑制剂genistein进行研究。
[0137]
具体实验方法为将gl261细胞铺于24孔板,每孔8
×
104细胞,分别加入1μm的chlorpromazine、20μm的amiloride和30μm的genisterin,处理2h。接着加入ha(1.25μg)与dp7-c(1.25μg)与cy3-sirna(0.25μg)孵育后的复合物胶束,于37℃培养24h。收取细胞,使用流式细胞术检测cy3阳性细胞的比例。
[0138]
从结果可见:ha/dp7-c/sirna胶束转染gl261细胞的效率为87.53
±
0.98%,经过巨胞饮途径抑制剂处理后,摄取效率降低至73.64
±
0.38%,并且显著低于未用抑制剂处理组(p《0.01)。而经过网格蛋白抑制剂处理后摄取效率降低至68.84
±
0.24%,并且显著低于未用抑制剂处理组(p《0.01)。而经过窖蛋白抑制剂处理后摄取效率为87.89
±
3.39%,未见明显变化(p》0.05)。说明dp7-c修饰的dotap脂质体/mrna复合物主要是以巨胞饮和网格蛋白两个途径被gl261内化的(图4c)。
[0139]
3.透明质酸包裹的dp7-c/sirna胶束的细胞毒性检测
[0140]
用不同浓度的空载ha/dp7-c、ha/tat-c、ha/r9-c和pei25k处理细胞24h,比较不同浓度的细胞毒性。具体方法为将293t细胞或gl261细胞铺于96孔板上,每孔1
×
104个细胞。培养24h后,用不同浓度的ha/dp7-c、ha/tat-c、ha/r9-c和pei25k处理细胞24h,然后在每个孔中加入10μl的cck8,在37℃下培养1h,吸弃培养基,最后使用酶标仪(multiskan mk3,
thermo scientific)读取450nm处的吸光度值。
[0141]
结果发现随着ha/tat-c、ha/r9-c和pei25k浓度的增加,细胞活力显著降低。在293t细胞中,100μg/ml的pei25k处理组仅有17.63
±
4.49%的细胞存活,100μg/ml的ha/tat-c处理组仅有21.51
±
1.32%的细胞存活,100μg/ml的ha/r9-c处理组仅有21.94
±
4.89%的细胞存活,说明这三个转染试剂细胞毒性较大。而ha/dp7-c处理组的细胞活力随浓度升高降低缓慢,100μg/ml的ha/dp7-c处理组仍有84.23
±
5.43%的细胞存活,说明ha/dp7-c的细胞毒性低于ha/tat-c、ha/r9-c和pei25k(图5a)。同样,在gl261细胞中,100μg/ml的pei25k处理组仅有14.87
±
1.87%的细胞存活,100μg/ml的ha/tat-c处理组仅有22.85
±
4.93%的细胞存活,100μg/ml的ha/r9-c处理组仅有16.87
±
4.78%的细胞存活,说明这三个转染试剂细胞毒性较大。而ha/dp7-c处理组的细胞活力随浓度升高降低缓慢,100μg/ml的ha/dp7-c处理组仍有87.56
±
4.56%的细胞存活,说明ha/dp7-c的细胞毒性低于ha/tat-c、ha/r9-c和pei25k(图5b)。
[0142]
实施例五、透明质酸包裹的dp7-c胶束递送vegf sirna体外治疗效果研究
[0143]
在本部分的实验中,主要验证ha/dp7-c递送特异性靶向vegf的治疗性sirna在体外的治疗效果。进行了q-pcr和western-blot实验,分别检测使用ha/dp7-c递送vegf sirna到gl261细胞后mrna和蛋白水平(vegf及下游相关蛋白)的抑制效果。检测沉默了vegf基因后,huvec细胞的的血管生成能力,来评价ha/dp7-c递送vegf sirna的治疗效果。
[0144]
1.透明质酸包裹的dp7-c胶束递送vegf sirna的体外mrna沉默效果
[0145]
(1)实验处理组:将2.0μg vegf sirna和10.0μg dp7-c在dmem培养基中共孵育15min后,加入10.0μg ha继续孵育10min。
[0146]
(2)材料组:将2.0μg scramblesirna和10.0μg dp7-c在dmem培养基中共孵育15min后,加入10.0μg ha继续孵育10min。将10.0μg dp7-c和10.0μg ha在dmem培养基中共孵育10min。以上两组为材料组。
[0147]
(3)对照组:以未处理的gl261细胞作为阴性对照组。
[0148]
将上述(1)(2)(3)转染到铺有2.5
×
105个gl261细胞的6孔板中,6h后将dmem培养基替换成dmem+10%fbs+1%ps培养基,转染48h。弃去培养基,用pbs洗一次,然后使用rna提取试剂盒提取细胞总rna。使用nanodrop测量rna的浓度并做好标记,于-80℃冰箱保存,用于后续逆转录和荧光定量pcr实验。取新鲜提取的细胞总rna,使用逆转录试剂盒进行提取,随后用根据q-pcr试剂盒的说明书混合各反应物。q-pcr反应程序为:95℃,30秒,38个循环(95℃,5s;60℃,20s)。vegf q-pcr引物序列(seq id no.10):forward:gtccgattgagaccctggtg;reverse(seq id no.11):accgggatttcttgc gcttt。
[0149]
通过比较各组目的基因和内参基因的ct值,以计算基因沉默效率。
[0150]
实验结果显示ha/dp7-c/sivegf处理后,gl261细胞中vegf mrna的水平为20.00
±
0.90%,显著低于未处理组(p《0.01);ha/dp7-c组处理后,gl261细胞中vegf mrna的水平为117.00
±
3.30%,未见明显变化(p》0.05);ha/dp7-c/siscramble组处理后,gl261细胞中vegf mrna的水平为118.00
±
1.90%,未见明显变化(p》0.05)。说明ha/dp7-c递送vegf sirna到gl261细胞中,能在mrna水平上有效沉默vegf基因的表达(图6a)。
[0151]
2.透明质酸包裹的dp7-c胶束递送vegf sirna的体外蛋白沉默效果
[0152]
(1)实验处理组:将2.0μg vegf sirna和10.0μg dp7-c在dmem培养基中共孵育
15min后,加入10.0μg ha继续孵育10min。
[0153]
(2)材料组:将2.0μgscramblesirna和10.0μg dp7-c在dmem培养基中共孵育15min后,加入10.0μg ha继续孵育10min。将10.0μg dp7-c和10.0μg ha在dmem培养基中共孵育10min。以上两组为材料组。
[0154]
(3)对照组:以未处理的gl261细胞作为阴性对照组。
[0155]
将上述(1)(2)(3)转染到铺有2.5
×
105个gl261细胞的6孔板中,6h后将dmem培养基替换成dmem+10%fbs+1%ps培养基,转染48h。弃去培养基,用预冷的pbs洗涤2次。每个孔加入100μl ripa裂解液并将细胞置于冰上,待细胞充分裂解以后吸取细胞裂解液于1.5ml ep管中,于4℃离心机,12000rpm离心10分钟,收集上清液得到蛋白样品。使用bca蛋白定量试剂盒进行蛋白浓度检测,在562nm处用酶标仪检测od值,并计算蛋白浓度。将所有待测样品的浓度调整至相同。每个样品加入1/5体积的6
×
蛋白loading buffer,于沸水中煮5~10分钟,使蛋白变性,于-20℃进行短期保存。取煮沸变性的蛋白样品用于sds-page电泳。
[0156]
实验结果显示ha/dp7-c/sivegf处理后,gl261细胞中vegf的蛋白表达水平下调;而对照组ha/dp7-c、ha/dp7-c/siscramble处理后,gl261细胞中vegf的蛋白表达水平未见明显变化。进一步实验结果显示,ha/dp7-c/sivegf处理后,gl261细胞中的p-akt和p-erk1/2蛋白(vegf的下游蛋白)表达水平均下调;而对照组ha/dp7-c、ha/dp7-c/siscramble处理后,gl261细胞中的p-akt和p-erk1/2蛋白表达水平未见明显变化。说明ha/dp7-c/sivegf处理后,能够抑制gl261细胞中的vegf蛋白合成,从而进一步抑制下游的p-akt和p-erk1/2蛋白合成(图6b)。
[0157]
3.透明质酸包裹的dp7-c胶束递送vegf sirna的抗血管生成实验
[0158]
1)实验处理组:将2.0μg vegf sirna和10.0μg dp7-c在dmem培养基中共孵育15min后,加入10.0μg ha继续孵育10min,即为ha/dp7-c/siveg组。
[0159]
2)材料组:将2.0μg scramble sirna和10.0μg dp7-c在dmem培养基中共孵育15min后,加入10.0μg ha继续孵育10min,为ha/dp7-c/siscramble组。将10.0μg dp7-c和10.0μg ha在dmem培养基中共孵育10min,为ha/dp7-c组。以上两组为材料组。
[0160]
3)对照组:以未处理的huvec细胞作为阴性对照组。
[0161]
将上述1)2)3)转染到铺有2.5
×
105个huvec细胞的6孔板中,6h后将ecm培养基替换成ecm+10%fbs+1%ps培养基,转染48h。转染结束后,将6孔板中的细胞用胰酶消化下来,按照每孔提前将基质胶按照1
×
104的细胞量,将细胞接种于提前铺了基质胶的96孔板中(基质胶按照100μl每孔铺板),于37℃孵箱中继续孵育6~8小时。使用显微镜对96孔板中的huvec细胞血管生成情况进行拍照,使用imagej统计血管生成情况。
[0162]
实验结果显示,未处理组中,huvec在每个视野的血管生成数约为50;ha/dp7-c处理后,huvec在每个视野的血管生成数约为49,未见明显变化(p》0.05);ha/dp7-c/siscramble处理后,huvec在每个视野的血管生成数约为43,未见明显变化(p》0.05);ha/dp7-c/sivegf处理后,huvec在每个视野的血管生成数约为26,显著低于未处理组(p《0.001)。说明ha/dp7-c/sivegf处理后,huvec细胞的体外血管生成能力受到显著抑制(图6c~d)。
[0163]
实施例六、透明质酸包裹的dp7-c胶束递送plk1sirna体外治疗效果研究
[0164]
在本部分的实验中,主要验证ha/dp7-c递送特异性靶向plk1的治疗性sirna在体
外的治疗效果。进行了q-pcr和western-blot实验,分别检测使用ha/dp7-c递送plk1 sirna到gl261细胞后mrna和蛋白水平(plk1及下游相关蛋白)的抑制效果。检测沉默了plk1基因后gl261细胞的凋亡情况,来评价ha/dp7-c递送plk1 sirna的治疗效果。
[0165]
1.透明质酸包裹的dp7-c胶束递送plk1sirna的体外mrna沉默效果
[0166]
1)实验处理组:将2.0μg plk1 sirna和10.0μg dp7-c在dmem培养基中共孵育15min后,加入10.0μg ha继续孵育10min,为ha/dp7-c/siplk1组。
[0167]
2)材料组:将2.0μg scramble sirna和10.0μg dp7-c在dmem培养基中共孵育15min后,加入10.0μg ha继续孵育10min,为ha/dp7-c/siscramble组。将10.0μg dp7-c和10.0μg ha在dmem培养基中共孵育10min,为ha/dp7-c组。以上两组为材料组。
[0168]
3)对照组:以未处理的gl261细胞作为阴性对照组。
[0169]
将上述1)2)3)转染到铺有2.5
×
105个gl261细胞的6孔板中,6h后将dmem培养基替换成dmem+10%fbs+1%ps培养基,转染48h。弃去培养基,用pbs洗一次,然后使用rna提取试剂盒提取细胞总rna。使用nanodrop测量rna的浓度并做好标记,于-80℃冰箱保存,用于后续逆转录和荧光定量pcr实验。取新鲜提取的细胞总rna,使用逆转录试剂盒进行提取,随后用根据q-pcr试剂盒的说明书混合各反应物。q-pcr反应程序为:95℃,30秒,38个循环(95℃,5s;60℃,20s)。plk1 q-pcr引物序列:forward(seq id no.12):aacgaggatctggaggtg;reverse(seq id no.13):gcaaggtatacat gatgcac。通过比较各组目的基因和内参基因的ct值,以计算基因沉默效率。
[0170]
实验结果显示ha/dp7-c/siplk1处理后,gl261细胞中plk1mrna的水平为5.00
±
0.10%,显著低于未处理组(p《0.001);ha/dp7-c组处理后,gl261细胞中plk1mrna的水平为60.00
±
0.20%,未见明显变化(p》0.05);ha/dp7-c/siscramble组处理后,gl261细胞中plk1mrna的水平为71.00
±
1.00%,未见明显变化(p》0.05)。说明ha/dp7-c递送plk1sirna到gl261细胞中,能在mrna水平上有效沉默plk1基因的表达(图7a)。
[0171]
2.透明质酸包裹的dp7-c胶束递送plk1sirna的体外蛋白沉默效果
[0172]
1)实验处理组:将2.0μg plk1 sirna和10.0μg dp7-c在dmem培养基中共孵育15min后,加入10.0μg ha继续孵育10min。
[0173]
2)材料组:将2.0μg scramble sirna和10.0μg dp7-c在dmem培养基中共孵育15min后,加入10.0μg ha继续孵育10min。将10.0μg dp7-c和10.0μg ha在dmem培养基中共孵育10min。以上两组为材料组。
[0174]
3)对照组:以未处理的gl261细胞作为阴性对照组。
[0175]
将上述1)2)3)转染到铺有2.5
×
105个gl261细胞的6孔板中,6h后将dmem培养基替换成dmem+10%fbs+1%ps培养基,转染48h。弃去培养基,用预冷的pbs洗涤2次。每个孔加入100μl ripa裂解液并将细胞置于冰上,待细胞充分裂解以后吸取细胞裂解液于1.5ml ep管中,于4℃离心机,12000rpm离心10分钟,收集上清液得到蛋白样品。使用bca蛋白定量试剂盒进行蛋白浓度检测,在562nm处用酶标仪检测od值,并计算蛋白浓度。将所有待测样品的浓度调整至相同。每个样品加入1/5体积的6
×
蛋白loading buffer,于沸水中煮5~10分钟,使蛋白变性,于-20℃进行短期保存。取煮沸变性的蛋白样品用于sds-page电泳。
[0176]
实验结果显示ha/dp7-c/siplk1处理后,gl261细胞中plk1的蛋白表达水平下调;而对照组ha/dp7-c、ha/dp7-c/siscramble处理后,gl261细胞中plk1的蛋白表达水平未见
明显变化。进一步实验结果显示,ha/dp7-c/siplk1处理后,gl261细胞中的p53和cleaved-caspase3蛋白(plk1的下游蛋白)表达水平均上调;而对照组ha/dp7-c、ha/dp7-c/siscramble处理后,gl261细胞中的p53和cleaved-caspase3蛋白表达水平未见明显变化。说明ha/dp7-c/siplk1处理后,能够抑制gl261细胞中的plk1蛋白合成,从而增加下游的凋亡相关蛋白p53和cleaved-caspase3的合成(图7b)。
[0177]
3.透明质酸包裹的dp7-c胶束递送plk1sirna诱导细胞凋亡研究细胞核形态学研究
[0178]
1)实验处理组:将0.25μg plk1 sirna和1.25μg dp7-c在dmem培养基中共孵育15min后,加入1.25μg ha继续孵育10min。
[0179]
2)对照组:以未处理的gl261细胞作为阴性对照组。
[0180]
将上述1)2)转染到铺有6
×
104个gl261细胞的24孔板中的细胞爬片上,6h后将dmem培养基替换成dmem+10%fbs+1%ps培养基,转染48h。将细胞爬片取出,置于载玻片上,用1
×
pbs清洗2次,然后滴加在细胞爬片上滴加dapi。染色10min,用1
×
pbs冲2次,然后使用抗荧光淬灭封片剂进行封片。将制备好的样品放在荧光显微镜下查看,分别统计正常的、哑铃型的、碎片状的细胞核数量。
[0181]
实验结果显示,未处理组的gl261细胞中,每个视野中的正常形态细胞核约为280个,哑铃型细胞核约为8个,碎片状细胞核约为12个;而ha/dp7-c/siplk1处理后的gl261细胞中,每个视野中的正常形态细胞核约为118个,哑铃型细胞核约为45个,碎片状细胞核约为137个,非正常形态的细胞核显著多于未处理组。说明ha/dp7-c/siplk1处理后,能够诱导gl261细胞发生凋亡(图7c~d)。
[0182]
4.透明质酸包裹的dp7-c胶束递送plk1sirna诱导细胞凋亡流式检测
[0183]
1)实验处理组:将0.25μg plk1 sirna和1.25μg dp7-c在dmem培养基中共孵育15min后,加入1.25μg ha继续孵育10min。
[0184]
2)材料组:将0.25μg scramble sirna和1.25μg dp7-c在dmem培养基中共孵育15min后,加入1.25μg ha继续孵育10min。将1.25μg dp7-c和1.25μg ha在dmem培养基中共孵育10min。以上两组为材料组。
[0185]
3)对照组:以未处理的huvec细胞作为阴性对照组。
[0186]
将上述1)2)3)转染到铺有6
×
104个gl261细胞的24孔板中,6h后将dmem培养基替换成dmem+10%fbs+1%ps培养基,转染48h。转染结束后,将6孔板中的细胞用胰酶消化下来,使用pe annexin v/7-aad凋亡检测试剂盒于25℃避光染色15min。使用流式细胞仪检测pe/7-aad双阳性细胞的比例以确定细胞凋亡率。
[0187]
实验结果显示,未处理组中,gl261细胞的凋亡率为1.64
±
0.22%;使用ha/dp7-c处理后,gl261细胞的凋亡率为3.37
±
0.46%,未见明显变化(p》0.05);使用ha/dp7-c/siscramble处理后,gl261细胞的凋亡率为6.33
±
0.59%,未见明显变化(p》0.05);使用ha/dp7-c/siplk1处理后,gl261细胞的凋亡率为18.02
±
0.25%,显著高于未处理组(p《0.001)。说明ha/dp7-c/siplk1处理后,能够诱导gl261细胞发生凋亡(图7e~f)。
[0188]
实施例六、透明质酸包裹的dp7-c胶束鼻黏膜给药递送sirna进入大脑的功能验证和途径探究
[0189]
1.透明质酸包裹的dp7-c胶束鼻黏膜给药递送sirna进入大脑的功能验证
[0190]
1)ha/dp7-c/cy5-sirna组:将10.0μg cy5-sirna和50.0μg dp7-c在室温共孵育15min后,加入50.0μg ha继续孵育10min。
[0191]
2)dp7-c/cy5-sirna组:50.0μg dp7-c和50.0μg ha在室温共孵育10min。
[0192]
将1)2)分别以滴鼻的方式均匀滴入小鼠的两个鼻腔,空白对照组给药等量的生理盐水。在经鼻给药2h后,断颈处死小鼠,并取出小鼠的脑组织在520nm激光发光下进行离体成像检测。
[0193]
实验结果显示从滴鼻给药2h后的相对荧光强度来看,对照组的相对荧光强度为1.42
±
0.54;dp7-c/cy5-sirna组的相对荧光强度为12.38
±
2.59,显著高于未处理组(p《0.0001);ha/dp7-c/cy5-sirna组的相对荧光强度为16.40
±
2.60,显著高于未处理组(p《0.0001),且显著高于dp7-c/cy5-sirna组(p《0.05)。说明dp7-c和ha/dp7-c均有经鼻黏膜给药递送sirna进入大脑的功能,ha包裹以后得到的ha/dp7-c能够增强经鼻黏膜给药递送sirna进入大脑的能力(图8a~b)。
[0194]
2.透明质酸包裹的dp7-c胶束递送sirna鼻黏膜给药后鼻腔黏附能力验证
[0195]
将生理盐水,cy5-sirna(10.0μg),dp7-c(50.0μg)/cy5-sirna(10.0μg),ha(50.0μg)/dp7-c(50.0μg)/cy5-sirna(10.0μg)分别以滴鼻的方式均匀滴入小鼠的两个鼻腔。在经鼻给药2h后,断颈处死小鼠,并取出小鼠的鼻腔和肺组织在520nm激光发光下进行离体成像检测。
[0196]
实验结果显示从滴鼻给药2h后的相对荧光强度来看,cy5-sirna组、dp7-c/cy5-sirna组的鼻腔荧光信号均呈现从前呼吸道往后呼吸道移动的趋势,而ha/dp7-c/cy5-sirna组的鼻腔荧光信号停留在前呼吸道。相对应的,cy5-sirna组的肺组织检测到荧光信号,而dp7-c/cy5-sirna组、ha/dp7-c/cy5-sirna组的肺组织未检测到荧光信号。说明与cy5-sirna比,dp7-c/cy5-sirna和ha/dp7-c/cy5-sirna均具有更强的鼻腔黏附能力,其中ha/dp7-c/cy5-sirna的鼻腔黏附性最强,适用于作为鼻黏膜给药载体(图8c)。
[0197]
3.透明质酸包裹的dp7-c胶束递送sirna鼻黏膜给药后进入大脑途径的研究
[0198]
将ha(50.0μg)/dp7-c(50.0μg)/cy5-sirna(10.0μg)以滴鼻的方式均匀滴入小鼠的两个鼻腔,并以等量生理盐水作为对照组。在经鼻给药0.5、1、2h后,断颈处死小鼠,并取出小鼠的一对三叉神经组织在520nm激光发光下进行离体成像检测。
[0199]
实验结果显示,给药30min后两侧三叉神经均出现了荧光信号,1h时达到最强,并在2h时荧光信号无法被检测到,可能与活体成像灵敏度过低有关,并不能证明2h的时候三叉神经中无ha/dp7-c/cy5-sirna(图8d)。三叉神经离体成像的结果与脑组织成像结果一致,说明ha/dp7-c/cy5-sirna在鼻黏膜给药以后主要通过三叉神经途径进入大脑(图8b)。
[0200]
4.透明质酸包裹的dp7-c胶束递送sirna鼻黏膜给药和静脉给药后在组织中的分布比较
[0201]
将ha(50.0μg)/dp7-c(50.0μg)/cy5-sirna(10.0μg)以鼻黏膜或静脉的方式分别给药,并以等量生理盐水作为对照组。在给药2h后,断颈处死小鼠,并取出小鼠的心、肝、脾、肺、肾和脑组织在520nm激光发光下进行离体成像检测。
[0202]
实验结果显示,静脉注射ha/dp7-c/cy5-sirna后,ha/dp7-c/cy5-sirna在肝、脾、肺和肾中均有分布,其中主要分布在肺部。鼻黏膜给药ha/dp7-c/cy5-sirna后,ha/dp7-c/cy5-sirna主要分布在脑组织。说明鼻黏膜给药能够避免药物的全身分布,从而减少全身性
sirna(10μg)胶束经鼻黏膜给药,2h后,处死小鼠,取脑组织进行活体成像,随后将脑组织制备为冰冻切片用于共聚焦观察和cy5-sirna荧光统计。
[0214]
实验结果显示,鼻黏膜给药2h时,ha/dp7-c/cy5-sirna组肿瘤部位的荧光显著高于dp7-c/cy5-sirna组。通过对冰冻切片的cy5-sirna阳性细胞统计,发现dp7-c/cy5-sirna组每个视野的cy5 sirna阳性细胞率约为19%,ha/dp7-c/cy5-sirna组每个视野的cy5sirna阳性细胞率约为57%,显著高于dp7-c/cy5-sirna组(p《0.001)(图9a-c)。说明透明质酸包裹可以提高sirna在肿瘤部位的聚集。
[0215]
实施例八、透明质酸包裹的dp7-c胶束鼻黏膜给药递送sirna治疗小鼠原位胶质瘤的效果验证
[0216]
(1)本发明在gl261小鼠原位胶质瘤模型中验证了抗肿瘤效果
[0217]
gl261小鼠原位胶质瘤模型被用于评估使用ha/dp7-c递送具有治疗作用的vegf或plk1 sirna鼻黏膜给药后是否能发挥抗肿瘤效果。
[0218]
选用18~20g左右,6~8周龄的雌性c57bl/6j小鼠构建原位脑胶质瘤模型。将gl261细胞用新鲜胰酶消化下来,并用不含血清和抗生素的培养基洗涤两遍,重悬时调整细胞悬液浓度为1
×
105个/μl。鼠以1%戊巴比妥钠腹腔注射麻醉,麻醉生效后,将小鼠固定于小鼠脑立体定位仪上,剪去头顶部的毛发。用酒精棉进行常规消毒后,剪开一长约1.0cm的垂直切口,暴露前囟,取其后方1.2mm,右侧距中线1.9mm处钻孔。调整移动架的位置,使针尖位于骨孔处,缓慢垂直进针3mm,按照1
×
105个/只的接种量,10μl/只缓慢注入细胞悬液,每分钟推注2.5μl,注射时间持续4分钟。推注完毕后,稳针5min防止细胞悬液被带出,然后缓慢将针拔出。封闭骨孔,缝合头皮。实验分组为saline对照组、ha/dp7-c/siscramble组、ha/dp7-c/sivegf组、ha/dp7-c/siplk1组,按照ha︰dp7-c︰sirna=5:5:1的最佳配比制备成胶束。每组10只老鼠。从接种第五天开始,每天给药1次,共给药7次。接种前(第0天)对小鼠进行称重及记录,并于开始给药后每隔两天的体重记录下来,并用于体重变化曲线的绘制。每日进行存活率统计,以此计算生存期。
[0219]
实验结果显示,两个给药组(ha/dp7-c/sivegf和ha/dp7-c/siplk1)的小鼠体重下降速度明显慢于saline和ha/dp7-c/siscramble组,差异具有非常显著性意义(图10a)。说明在经过ha/dp7-c/sivegf或ha/dp7-c/siplk1治疗后,能够延缓小鼠的病情进展,减慢小鼠体重下降速度。ha/dp7-c/sivegf组小鼠的平均存活时间为17天,ha/dp7-c/siplk1组小鼠的平均存活时间为18天,而生理盐水组小鼠的平均存活时间为13天,ha/dp7-c/siscramble组小鼠的平均存活时间为14天。结果表明,与两个对照组相比,两个治疗组的小鼠平均存活时间均有非常显著的延长(图10b,p《0.0001)。
[0220]
(2)组织切片he染色和免疫组化分析
[0221]
选用18~20g左右,6~8周龄的雌性c57bl/6j小鼠构建原位脑胶质瘤模型。将gl261细胞用新鲜胰酶消化下来,并用不含血清和抗生素的培养基洗涤两遍,重悬时调整细胞悬液浓度为1
×
105个/μl。鼠以1%戊巴比妥钠腹腔注射麻醉,麻醉生效后,将小鼠固定于小鼠脑立体定位仪上,剪去头顶部的毛发。用酒精棉进行常规消毒后,剪开一长约1.0cm的垂直切口,暴露前囟,取其后方1.2mm,右侧距中线1.9mm处钻孔。调整移动架的位置,使针尖位于骨孔处,缓慢垂直进针3mm,按照1
×
105个/只的接种量,10μl/只缓慢注入细胞悬液,每分钟推注2.5μl,注射时间持续4分钟。推注完毕后,稳针5min防止细胞悬液被带出,然后缓
慢将针拔出。封闭骨孔,缝合头皮。实验分组为saline对照组、ha/dp7-c/siscramble组、ha/dp7-c/sivegf组、ha/dp7-c/siplk1组,按照ha:dp7-c:sirna=5:5:1的最佳配比制备成胶束。每组3只老鼠。从接种第五天开始,每天给药1次。第十一天时观察到saline组的小鼠出现临终征兆,处死所有小鼠并取出脑组织进行he染色用于分析肿瘤面积。进行cd31、ki67免疫组化染色,用于分析肿瘤中新生血管的数量和肿瘤细胞的增殖能力。
[0222]
实验结果显示,从荷瘤组织的he染色来计算相对肿瘤面积,以saline组的平均相对肿瘤面积为对照组,约为0.97
±
0.11,ha/dp7-c/siscramble组平均相对肿瘤面积为0.84
±
0.19,ha/dp7-c/sivegf组平均相对肿瘤面积为0.60
±
0.10,ha/dp7-c/siplk1组平均相对肿瘤体积为0.61
±
0.10。其中ha/dp7-c/sivegf组和ha/dp7-c/siplk1组的平均肿瘤面积与saline组相比具有显著差异(p《0.05),相比于递送乱序sirna的ha/dp7-c/siscramble组也具有显著差异(p《0.05)(图11a)。
[0223]
免疫组织化学结果显示,saline组的每个视野的平均血管计数约为56.67
±
0.58,ha/dp7-c/siscramble组的每个视野的平均血管计数约为54.33
±
5.03,ha/dp7-c/sivegf组的每个视野的平均血管计数约为27.33
±
1.15,ha/dp7-c/siplk1组的每个视野的平均血管计数约为31.00
±
2.65。其中,ha/dp7-c/sivegf组和ha/dp7-c/siplk1与对照组saline相比均具有非常显著性差异(p《0.001);相比于递送乱序sirna的ha/dp7-c/siscramble组也具有非常显著性差异(p《0.001)(图11b)。
[0224]
saline组的每个视野的ki67阳性细胞百分率约为33.22
±
2.41,ha/dp7-c/siscramble组的每个视野的ki67阳性细胞百分率约为33.89
±
3.10,ha/dp7-c/sivegf组的每个视野的ki67阳性细胞百分率约为25.83
±
2.99,ha/dp7-c/siplk1组的ki67阳性细胞百分率约为17.14
±
3.98。其中,ha/dp7-c/sivegf组与对照组saline和ha/dp7-c/siscramble相比均具有显著差异(p《0.05);ha/dp7-c/siplk1组与对照组saline和ha/dp7-c/siscramble相比均具有非常显著性差异(p《0.001)(图11c)。
[0225]
前期的研究中我们发现胆固醇修饰的阳离子多肽dp7-c具有载体的功效,可用于向细胞内递送核酸或多肽类药物。本发明实施例中在具有载体功效的dp7-c外层包裹了具有生物黏附性和能与肿瘤表面cd44受体特异性结合的双重功效的透明质酸,用于鼻黏膜给药递送sirna到中枢神经系统。透明质酸包裹后提高了dp7-c作为载体的细胞递送能力,并且仍然具有较低的毒性,成功经鼻黏膜给药将sirna递送到大脑,治疗小鼠原为胶质瘤。
[0226]
本发明上述实例中我们分别比较了透明质酸包裹dp7-c或其他类似的多肽,发现ha/dp7-c与ha/tat-c、ha/r9-c相比,具有更高效的细胞转染效率和更低的细胞毒性。验证了ha/dp7-c递送靶向vegf或plk1 mrna的特异性sirna在细胞层面的治疗效果。证明了ha包裹以后的ha/dp7-c比单独的dp7-c具有更高的鼻腔黏附性和递送sirna到大脑及肿瘤组织的能力。最后通过建立小鼠原位胶质瘤模型分别验证了ha/dp7-c递送vegf sirna和plk1 sirna的抗肿瘤效果,发现ha/dp7-c递送vegf sirna和plk1 sirna均能延缓荷瘤小鼠的体重下降速度、延长荷瘤小鼠的生存期,具有显著的抗肿瘤效果。总的来说,本发明将透明质酸包裹在dp7-c外面制备出一个核壳结构的胶束,能够增强鼻黏膜给药后递送sirna到大脑的能力,用于治疗中枢神经系统疾病。
[0227]
因此,本发明为本领域提供了一种能够用于鼻黏膜给药递送核酸到中枢神经系统,并有效治疗恶性胶质瘤的递送载体。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1