抗原蛋白冻干小球及其制备方法与流程
1.本发明涉及生物技术领域,尤其涉及一种抗原蛋白冻干小球及其制备方法。
背景技术:
2.抗原,是指能够刺激机体产生免疫应答或特异性免疫应答,并能与免疫应答产物抗体和致敏淋巴细胞在体内外结合,发生免疫效应或特异性反应的物质。
3.目前国内市场中抗原蛋白冻干产品以粉末状为主,制备成小球的较少。冻干成粉末状的抗原蛋白存在以下缺陷:(1)易黏连管壁,复溶时会出现复溶不完全,导致结果测试不准确;(2)多个抗原蛋白混合冻干成粉末状,冻干粉内,每个抗原蛋白的量差异较大,不便于试剂的检测。
4.公开号为cn111110638a的中国专利公开了一种偶联有蛋白的微球冻干制剂及其制备方法、保存方式,微球冻干制剂包括冻干保护剂和偶联有蛋白的微球;该专利产品采用偶联有抗体或者抗原的微球与冻干保护剂混合后冻干获得,其中,所述偶联有蛋白的微球中的蛋白为抗体或者抗原,例如将n端含有c-myc标签的sox2抗原蛋白(genscript公司)与luminex公司荧光编码的magplex磁性微球进行偶联,其制备工艺包括:(1)微球的活化,取出微球,涡旋震荡及超声20s,使微球充分混匀重悬后吸取适量体积微球混悬液于离心管中置于磁力分离器上30s-60s,移除上清加入500μl激活缓冲液(o.1m nah2p04,ph 6.2),涡旋震荡及超声重悬微球后置于磁力分离器上分离微球,重复次步骤1-2次,向清洗后的微球中加入480μl激活缓冲液,涡旋震荡及超声混匀后一次加入10μl nhs及10μl edc,在旋转混合仪上300rpm室温避光孵育20-30min;(2)sox2蛋白偶联至微球,将激活后的微球置于磁力分离器上分离60s,移除上清重复此步骤2次,取500μl稀释好的sox2融合蛋白(用偶联缓冲液稀释至10μg/ml)加入活化的微球中,涡旋震荡及超声后置于旋转混合仪上300rpm避光室温孵育2h,置于磁力分离器上60s移除上清;(3)微球的清洗,向离心管中加入500μl的洗涤液(10mm pbs,0.05%吐温-20),涡旋震荡及超声重悬上述偶联微球,置于磁力分离器上60s移除上清;(4)微球的封闭,向清洗后的微球中加入500μl的封闭缓冲液(10mm pbs,5%驴血清,0.03%prolin300)涡旋震荡及超声,在旋转混合仪上300rpm室温避光孵育30min,置于磁力分离器上60s移除上清,加入500μl的洗涤液清洗后磁力分离器上移除洗涤液后即得。偶联有抗体或者抗原的微球冻干制剂的形态是粉末形式存在的,冻干后的样品易黏连在冻干品的容器内壁上,不能进行固态的转移。
5.因此,有必要提供一种新型的抗原蛋白冻干小球及其制备方法以解决现有技术中存在的上述问题。
技术实现要素:
6.本发明的目的在于提供一种抗原蛋白冻干小球及其制备方法,以克服粉末制剂黏连管壁、复溶不完全、多抗原混合不均匀的缺陷。
7.为实现上述目的,本发明的所述抗原蛋白冻干小球,包括冻干保护溶液和抗原蛋
白溶液,所述抗原蛋白冻干小球由所述冻干保护溶液与所述抗原蛋白溶液混合后冻干获得,且所述冻干保护溶液与所述抗原蛋白溶液的体积比例为5:1-9:1。
8.本发明的所述抗原蛋白冻干小球的有益效果在于:通过所述抗原蛋白冻干小球由所述冻干保护溶液与所述抗原蛋白溶液混合后冻干获得,两种组分均为溶液,更容易混合均匀,并且工艺上比偶联有抗体或者抗原的微球更简便;通过所述冻干保护溶液与所述抗原蛋白溶液的体积比例为5:1-9:1,确保所述冻干保护溶液能充分与抗原蛋白溶液混合,从而使得在冻干后所述冻干保护溶液能充分包覆保护抗原蛋白,得到形状为球体状结构的所述抗原蛋白冻干小球,使得抗原蛋白冻干小球可与受试样本直接混合使用,避免了液态因取样偏差而导致的检测结果偏差,而且抗原蛋白冻干小球呈小球形态,与管壁不粘连,可实现固态的转移,尤其是多个不同抗原蛋白的混合使用时,可根据实际需求快速进行组合使用,同时小球形态实现了由液态到固态的转变,更利于运输与保存。
9.优选的,所述抗原蛋白冻干小球的直径为2.5-3.0mm。其有益效果在于:小球不会与容器内壁黏连,可实现固态的转移,避免了粉末制剂黏连管壁、复溶不完全、多抗原混合不均匀的问题;球状可与受试样本直接混合使用,避免了液态因取样偏差,导致的检测结果的偏差;制备工艺是较偶联抗体或抗原的微球更为简便。
10.优选的,所述冻干保护溶液为混合溶液,包括醇类、氨基酸、高分子化合物、生物活性蛋白、表面活性剂、糖类、盐类物质和缓冲体系。其有益效果在于:有利于保障抗原蛋白的稳定性的同时,在滴液过程利于形成一完整的珠状液滴,从而利于制备成冻干小球,且该组分的冻干保护溶液适用于不同的抗原蛋白,通用性好。
11.优选的,所述冻干保护溶液包括:
[0012][0013]
优选的,所述冻干保护溶液的ph值为7.2-7.4。其有益效果在于:有效保证了抗原蛋白的稳定性。
[0014]
优选的,本发明还提供了一种抗原蛋白冻干小球的制备方法,包括以下步骤:
[0015]
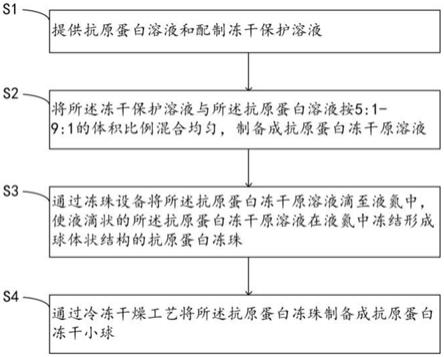
s1:提供抗原蛋白溶液和配制冻干保护溶液;
[0016]
s2:将所述冻干保护溶液与所述抗原蛋白溶液按5:1-9:1的体积比例混合均匀,制备成抗原蛋白冻干原溶液;
[0017]
s3:通过冻珠设备将所述抗原蛋白冻干原溶液滴至液氮中,使液滴状的所述抗原蛋白冻干原溶液在液氮中冻结形成球体状结构的抗原蛋白冻珠;
[0018]
s4:通过冷冻干燥工艺将所述抗原蛋白冻珠制备成抗原蛋白冻干小球。
[0019]
本发明的所述抗原蛋白冻干小球的制备方法的有益效果在于:通过s1:提供抗原蛋白溶液和配制冻干保护溶液,s2:将所述冻干保护溶液与所述抗原蛋白溶液按5:1-9:1的体积比例混合均匀,制备成抗原蛋白冻干原溶液,两种组分均为溶液,更容易混合均匀且确保所述冻干保护溶液能充分与抗原蛋白溶液混合,从而使得在冻干后所述冻干保护溶液能充分包覆保护抗原蛋白;通过s3:通过冻珠设备将所述抗原蛋白冻干原溶液滴至液氮中,利于使液滴状的所述抗原蛋白冻干原溶液的形成,从而在液氮中冻结形成球体状结构的抗原蛋白冻珠,即利用微量精密的液珠滴液设备,将配制好的抗原蛋白冻干原溶液滴出一个小液珠滴入液氮中,使得液滴在液氮的作用下能迅速冻结形成小球状抗原蛋白冻珠,制备简单,形成冻珠速度快,有利于提升抗原蛋白的稳定性;通过s4:通过冷冻干燥工艺将所述抗原蛋白冻珠制备成抗原蛋白冻干小球,使抗原蛋白冻干小球的形状为球体状结构,即转移至已设定好参数的冷冻干燥机中进行冷冻干燥,冻结的小球在冷冻干燥机中脱水并保持球形状态,从而形成了抗原蛋白冻干小球,使得确保了制得球状的抗原蛋白冻干小球,提升了稳定性和保存寿命;该制备工艺简单方便,制备得到的抗原蛋白冻干小球可与受试样本直接混合使用,避免了液态因取样偏差,导致的检测结果的偏差,而且抗原蛋白冻干小球呈小球形态,与管壁不粘连,可实现转移,尤其是多个不同抗原蛋白的混合使用时,可根据实际需求快速进行组合使用,便于检测,解决了粉末状的抗原蛋白一样存在黏连管壁,复溶时会出现复溶不完全的问题,同时小球形态实现了由液态到固态的转变,更利于运输与保存。
[0020]
优选的,所述步骤s4中通过冷冻干燥工艺将所述抗原蛋白冻珠制备成抗原蛋白冻干小球的步骤具体包括:
[0021]
s40:开启冷冻干燥机,并对所述冷冻干燥机预冷至预冷温度后将所述抗原蛋白冻珠置于所述冷冻干燥机中;
[0022]
s41:设置所述冷冻干燥机中的搁板的温度以进行第一阶段干燥;
[0023]
s42:调节所述搁板的温度以进行第二阶段干燥;
[0024]
s43:调节所述搁板的温度以进行第三阶段干燥。其有益效果在于:分阶段干燥,有利于保障抗原蛋白的稳定性。
[0025]
优选的,所述步骤s1中配制冻干保护溶液的步骤包括:按预设配方配置所述冻干保护溶液,并采用0.01mol/l的盐酸溶液或0.01mol/l氢氧化钠溶液调节所述冻干保护溶液的ph值至7.2-7.4。其有益效果在于:有利于保障抗原蛋白的稳定性,适用于作为不同的抗原蛋白的冻干保护溶液,通用性好。
[0026]
优选的,所述步骤s3中所述冻珠设备的参数设置为:前进速度40-60mm/s,后撤速度250-320mm/s,滴液体积为9-15μl。其有益效果在于:有利于液滴在液氮的作用下能迅速冻结形成小球状抗原蛋白冻珠,有利于保障抗原蛋白的稳定性。
[0027]
优选的,所述步骤s3中所述冻珠设备的滴液针设置在含液氮的金属杯上方,所述
滴液针的外径为1.1-1.3mm,所述滴液针的出液口与所述金属杯中的液氮平面距离为5-15cm,所述滴液针的出液间隔时长为10-20秒。其有益效果在于:有利于液滴在液氮的作用下能迅速冻结形成小球状抗原蛋白冻珠,有利于保障抗原蛋白的稳定性。
[0028]
优选的,所述步骤s40中的所述预冷温度为小于-20℃。其有益效果在于:避免破坏抗原蛋白的性能,有利于保障抗原蛋白的稳定性。
[0029]
优选的,所述步骤s41中设置所述冷冻干燥机中的搁板的温度以进行第一阶段干燥的步骤具体包括:
[0030]
s411:将所述搁板的温度设置为-45℃,并保持该温度4h;
[0031]
s412:将所述搁板的温度设置为-35℃,并对所述冷冻干燥机抽真空后保持该温度8-12h。其有益效果在于:避免破坏抗原蛋白的性能,有利于保障抗原蛋白的稳定性。
[0032]
优选的,所述步骤s42中调节所述搁板的温度以进行第二阶段干燥的步骤具体包括:
[0033]
s421:将所述搁板的温度设置为-30℃,并保持该温度8-12h;
[0034]
s422:将所述搁板的温度设置为-25℃,并保持该温度8-12h;
[0035]
s423:将所述搁板的温度设置为-20℃,并保持该温度1-2h;
[0036]
s424:将所述搁板的温度设置为-10℃,并保持该温度1-2h;
[0037]
s425:将所述搁板的温度设置为0℃,并保持该温度1-8h。其有益效果在于:避免破坏抗原蛋白的性能,有利于保障抗原蛋白的稳定性。
[0038]
优选的,所述步骤s43中调节所述搁板的温度以进行第三阶段干燥的步骤具体包括:
[0039]
s431:将所述搁板的温度设置为10℃,并保持该温度1-2h;
[0040]
s432:将所述搁板的温度设置为25℃,并保持该温度2-8h。其有益效果在于:避免破坏抗原蛋白的性能,有利于保障抗原蛋白的稳定性。
[0041]
优选的,所述步骤s412中对所述冷冻干燥机抽真空形成的真空度小于20pa。其有益效果在于:避免破坏抗原蛋白的性能,有利于保障抗原蛋白的稳定性。
附图说明
[0042]
图1为本发明实施例的抗原蛋白冻干小球的制备方法的流程示意图;
[0043]
图2为本发明实施例中冻珠设备的结构示意图;
[0044]
图3为采用本发明实施例的抗原蛋白冻干小球的制备方法制备的自制冻干小球与bd试剂小球分别与试剂盒中的检测试剂对人的离体全血样品进行检测得到的对比结果的示意图。
具体实施方式
[0045]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。除非另外定义,此处使用的技术术语或者科学术语应当为本发明所属领域内具有一般技能的人士所理解的通常意义。本文中
使用的“包括”等类似的词语意指出现该词前面的元件或者物件涵盖出现在该词后面列举的元件或者物件及其等同,而不排除其他元件或者物件。
[0046]
为克服现有技术中存在的问题,本发明实施例提供了抗原蛋白冻干小球及其制备方法,使得抗原蛋白冻干小球可与受试样本直接混合使用,避免了液态因取样偏差,导致的检测结果的偏差,而且抗原蛋白冻干小球呈小球形态,与管壁不粘连,可实现转移,尤其是多个不同抗原蛋白的混合使用时,可根据实际需求快速进行组合使用,便于检测,解决了粉末状的抗原蛋白黏连管壁,复溶时会出现复溶不完全的问题,同时小球形态实现了由液态到固态的转变,更利于运输与保存。
[0047]
本发明的所述受试样本为人的离体全血样品。
[0048]
本发明一些实施例中,所述抗原蛋白冻干小球包括冻干保护溶液和抗原蛋白溶液,所述抗原蛋白冻干小球由所述冻干保护溶液与所述抗原蛋白溶液混合后冻干获得,且所述冻干保护溶液与所述抗原蛋白溶液的体积比例为5:1-9:1,制得的所述抗原蛋白冻干小球的形状为球体状结构。使得抗原蛋白冻干小球可与受试样本直接混合使用,避免了液态因取样偏差,导致的检测结果的偏差,而且抗原蛋白冻干小球呈小球形态,与管壁不粘连,可实现转移,尤其是多个不同抗原蛋白的混合使用时,可根据实际需求快速进行组合使用,便于检测,解决了粉末状的抗原蛋白黏连管壁,复溶时会出现复溶不完全的问题,同时小球形态实现了由液态到固态的转变,更利于运输与保存。
[0049]
本发明一些实施例中,所述抗原蛋白冻干小球的直径为2.5-3.0mm。
[0050]
本发明一些实施例中,所述冻干保护溶液为混合溶液,包括醇类、氨基酸、高分子化合物、生物活性蛋白、表面活性剂、糖类、盐类物质和缓冲体系,有利于保障抗原蛋白的稳定性,且该组分的冻干保护溶液适用于不同的抗原蛋白,通用性好。
[0051]
本发明一些实施例中,所述抗原蛋白溶液采用本领域的常规配置,抗原是指能够刺激机体产生特异性或免疫应答,并能与免疫应答产物抗体和致敏淋巴细胞在体内外结合,发生免疫效应或特异性反应的物质。
[0052]
本发明一些具体实施例中,所述抗原蛋白溶液为常见的细胞因子il-2、il-6、il-10、tnf-α等。
[0053]
本发明所用试剂和原料均市售可得。
[0054]
本发明一些实施例中,所述冻干保护溶液的ph值为7.2-7.4,有效保证了抗原蛋白的稳定性。
[0055]
图1为本发明实施例的抗原蛋白冻干小球的制备方法的流程示意图。
[0056]
本发明一些实施例中,参考图1,所述抗原蛋白冻干小球的制备方法,包括以下步骤:
[0057]
s1:提供抗原蛋白溶液和配制冻干保护溶液;
[0058]
s2:将所述冻干保护溶液与所述抗原蛋白溶液按5:1-9:1的体积比例混合均匀,制备成抗原蛋白冻干原溶液;
[0059]
s3:通过冻珠设备将所述抗原蛋白冻干原溶液滴至液氮中,使液滴状的所述抗原蛋白冻干原溶液在液氮中冻结形成球体状结构的抗原蛋白冻珠;
[0060]
s4:通过冷冻干燥工艺将所述抗原蛋白冻珠制备成抗原蛋白冻干小球,使抗原蛋白冻干小球的形状为球体状结构。
[0061]
本发明一些实施例中,所述步骤s4执行之后还包括步骤:干燥后取出,装入西林瓶中,加盖密封。
[0062]
本发明一些实施例中,所述步骤s1中配制冻干保护溶液的步骤包括:按预设配方配置所述冻干保护溶液,并采用0.01mol/l的盐酸溶液或0.01mol/l氢氧化钠溶液调节所述冻干保护溶液的ph值至7.2-7.4,以利于保证抗原蛋白的稳定性,且适用于作为不同的抗原蛋白的冻干保护溶液,通用性好。
[0063]
本发明一些实施例中,所述预设配方,即所述冻干保护溶液包括:
[0064][0065]
具体的,所述甘露醇和所述甘氨酸是冻干蛋白制剂常用的填充剂,具有无毒的特点。甘露醇作为良好的赋形剂,无吸湿性,冻干快,冻干过程可防止有效组分随水蒸气一起升华,并使有效组分成形;所述甘氨酸能提高冷冻制品的塌陷温度,稳定蛋白质,也是一种良好的赋形剂
[0066]
所述聚乙二醇起低温保护剂和脱水保护剂的作用,同时免疫反应中可起到加速反应,提高试剂灵敏度的作用;
[0067]
所述牛血清白蛋白起到蛋白保护的作用,在脱水干燥过程中起填充剂的作用,同时在免疫试剂中可以起到控制本底,消除假阳的作用;
[0068]
所述吐温20用于在冻干过程降低冰水界面张力所引起的冻结和脱水变形,复水过程中对活性组分起到润湿剂和重褶皱剂的作用,同时降低免疫反应过程中非特异性反应;
[0069]
所述海藻糖或蔗糖在冻结过程起到低温保护的作用,干燥脱水过程中起到脱水保护剂的作用;
[0070]
所述胎牛血清用于提供结合蛋白,能识别维生素、脂类、金属和其他激素等,能结合或调变它们所结合的物质活力,以及起酸碱度缓冲液作用;
[0071]
所述氯化钠用于防止试剂在冻干过程及贮藏过程中保持一定的离子强度,利于复溶后抗原蛋白的稳定性;
[0072]
所述磷酸盐缓冲液的作用是保持溶液ph值的稳定。
[0073]
实施例1-5冻干保护溶液的制备:按表1的组分和含量称取所述甘露醇、所述甘氨酸、所述聚乙二醇、所述吐温20、所述海藻糖、所述氯化钠和所述磷酸盐缓冲液,加入800ml的纯化水中并搅拌溶解,量取所述牛血清白蛋白和所述胎牛血清加入溶液中并混和均匀,使用纯化水,将配制的溶液体积定容至1l,最后,使用0.22μm的滤膜对溶液进行过滤。表1中"/"是指不含有该组分。
[0074]
表1冻干保护溶液的组分和含量
[0075]
实施例1实施例2实施例3实施例4实施例5甘露醇(g/l)1020304050甘氨酸(g/l)15101520聚乙二醇(g/l)10255075100牛血清白蛋白(g/l)10255075100吐温20(ml/l)0.51.52.753.55海藻糖(g/l)10/15/30蔗糖(g/l)/10/30/胎牛血清(ml/l)51527.53550氯化钠(g/l)51012.51520磷酸盐缓冲液(mol/l)0.010.0250.050.0750.1ph7.4
±
0.057.4
±
0.057.4
±
0.057.4
±
0.057.4
±
0.05
[0076]
效果实施例1-5:将按实施例1-5配制好的所述冻干保护剂分别与所述抗原蛋白溶液按照5:1的体积比例混匀后冻干获得5组含有不同配方的冻干保护剂的所述抗原蛋白冻干小球。其中,在效果实施例1-5中的所述抗原蛋白溶液的制备方法为:将抗原蛋白,用蛋白稀释液(0.01mol/l磷酸盐缓冲液,ph为7.2
±
0.2,含1%牛血清白蛋白)配制成浓度为4-10μg/ml的抗原蛋白溶液。然后在37℃高温条件下,通过加速稳定性试验考察分析这5组含有不同冻干保护剂的所述抗原蛋白冻干小球的加速稳定性。
[0077]
具体的,加速稳定性试验方法为:将效果实施例1-5中刚冻干的自制的所述抗原蛋白冻干小球各取3个进行检测,并记录检测结果,即冻干小球测试值(ng/球)。然后将效果实施例1-5中刚冻干的自制的所述抗原蛋白冻干小球各取至少12个放入37℃恒温箱中。然后在第3天、第5天、第7天、第9天分别从37℃恒温箱中将效果实施例1-5的所述抗原蛋白冻干小球各取3个进行检测,并记录检测结果。具体检测结果见表2。表2所用试剂和原料均市售可得。
[0078]
其中,表2中cv指该实施例当次实验结果的变异系数,均值指该实施例当次实验结果的检测均值,p点比值指该实施例当次实验的检测均值与37℃高温加速第0天的检测均值的比值。
[0079]
表2效果实施例1-5的抗原蛋白冻干小球的冻干保存效果
[0080][0081]
参考表2,可知,效果实施例1-5的所述抗原蛋白冻干小球在37℃高温保存的第3、5、7、9天,p点比值有下降趋势,但效果实施例1-5的所述抗原蛋白冻干小球在第9天的p点比值均大于92%。说明在37℃加速稳定考察下保存第9天,样品稳定性仍然保持在92%以上的活性,且按实施例1-5的不同配方的所述冻干保护剂制备得到的所述抗原蛋白冻干小球的稳定性差异不大。
[0082]
本发明一些实施例中,所述步骤s3中所述冻珠设备的参数设置为:前进速度40-60mm/s,后撤速度250-320mm/s,滴液体积为9-15μl,有利于液滴在液氮的作用下能迅速冻结形成小球状抗原蛋白冻珠,有利于提升抗原蛋白的稳定性。
[0083]
本发明一些实施例中,所述步骤s3中所述冻珠设备的滴液针设置在含液氮的金属杯上方,所述滴液针的外径为1.1-1.3mm,所述滴液针的出液口与所述金属杯中的液氮平面距离为5-15cm,所述滴液针的出液间隔时长为10-20秒,有利于液滴在液氮的作用下能迅速冻结形成小球状抗原蛋白冻珠,有利于提升抗原蛋白的稳定性。
[0084]
图2为本发明实施例中冻珠设备的结构示意图。
[0085]
本发明一些具体实施例中,所述冻珠设备包括两个冻干工位、机械手、控制面板和控制按钮。参考图2,所述两个冻干工位分别为第一冻干工位1和第二冻干工位2,可以根据需求选择开关。所述机械手3固定于横向导向柱4,所述机械手3和所述横向导向柱4活动连接且垂直设置,所述机械手3可在所述横向导向柱4上沿x轴方向移动,以及沿z轴方向移动,
所述机械手3的底部设置有注液针6。所述x轴方向为沿所述横向导向柱4的长度方向,所述z轴方向与所述x轴方向垂直。所述控制按钮包括急停按钮7、复位按钮8、启动按钮9、电源开关10和电源指示灯11。所述控制面板5设有多个功能模块。
[0086]
具体的,所述功能模块包括:
[0087]
目标循环次数模块,用于设置注液的循环次数,对所述第一冻干工位和所述第二冻干工位分别完成一次注液为一个循环,如果要多次注液就可以设置多次循环;
[0088]
当前循环次数模块,用于显示当前完成的循环次数;
[0089]
循环延时模块,用于设置多次循环的相邻循环之间的延时时长;
[0090]
自动启动模块,所述启动按钮9按下直至变至绿色,表示所述冻珠设备已进入自动状态,按下所述控制面板5中的所述自动启动模块,所述冻珠设备中的所述注液针就会在所述机械手的带动下自动走位进行注液;
[0091]
自动停止模块,在自动运行中有需要暂停的时候,或者有突发情况按下急停按钮7可以让所述冻珠设备停下来,处理完成后复位自动停止模块或松掉急停按钮7再按自动启动模块即可再次启动;
[0092]
x轴画面模块,用于进入x轴位置参数设置画面;
[0093]
z轴画面模块,用于进入z轴位置参数设置画面;
[0094]
注液画面模块,用于进入注液泵画面参数设置画面;
[0095]
报警画面模块,用于进入报警记录画面,实时报警时通过滚动条在控制面板5的触摸屏中显示,可以按下面板复位按钮进行复位,如果复位不了需要重启电源。
[0096]
所述x轴画面模块包括:
[0097]
第一当前位置单元,用于设置所述机械手3在x轴方向的横向导向柱4当前所在的位置;
[0098]
第一点动速度单元,用于设置所述机械手3在横向导向柱4上左右移动的移动速度;
[0099]
第一自动速度单位,用于设置所述机械手3在横向导向柱4上走位和自动生产时的速度;
[0100]
第一等待位单位,用于设置完成动作后所述机械手3所处的位置,方便下次注液的最佳等待位置;
[0101]
第一注液位单元,用于设置所述机械手3在所述第一冻干工位1注液的位置;
[0102]
第二注液位单元,用于设置所述机械手3在所述第二冻干工位2注液的位置。
[0103]
通过手动移动机械手,寻找合适的注液位置,根据当前位置的显示的数值,在控制面板的相应模块和单元输入适应的参数即可。
[0104]
所述z轴画面模块包括:
[0105]
第二当前位置单元,用于设置所述机械手3在z轴方向的当前所在的位置;
[0106]
第二点动速度单元,用于设置所述机械手3在z轴方向上下移动的移动速度;
[0107]
第二自动速度单位,用于设置所述机械手3在z轴方向走位和自动生产时的速度;
[0108]
第二等待位单元,用于设置所述机械手3在x轴方向移动使注液针6不会碰到冻干工位的高度;
[0109]
第三注液位单元,用于设置注液针6伸入所述第一冻干工位1和所述第二冻干工位
2的高度,根据产品工艺设定。
[0110]
所述注液画面模块包括:
[0111]
注液量设置单元,用于根据实际需求输入所需的注液量,比如,需要注15ul,就输入15,按下注液启动,会注液一次,注出来的量进行称重,少了或者多了可以通过液量补偿进行修改;
[0112]
前进速度设置单元,用于设置注液泵在注液时的前进速度;
[0113]
后退速度设置单元,用于设置注液泵在注液时的后退速度;
[0114]
回抽距离设置单元,是指在有挂液的情况下设置注液针回抽的距离,开启回抽功能时才会启用,回抽距离根据实际情况设定;
[0115]
待机延时设置单元,是指在设备不生产的情况下,按下待机模式,泵会根据设定的时间进行运转,待机模式注液阀门是关闭的,不会把液体注到平台上面;
[0116]
注液次数设置单元,用于设置计量泵的运行注液次数,可设置具体的圈数;
[0117]
当前次数显示单元,显示计量泵当前运行的注液次数,只做参考,不可设置;
[0118]
注液启动单元,是指在当前画面下,调试好参数,按下注液启动,注液泵启动一次。
[0119]
本发明一些实施例中,所述步骤s4中通过冷冻干燥工艺将所述抗原蛋白冻珠制备成抗原蛋白冻干小球的步骤具体包括:
[0120]
s40:开启冷冻干燥机,并对所述冷冻干燥机预冷至预冷温度后将所述抗原蛋白冻珠置于所述冷冻干燥机中;
[0121]
s41:设置所述冷冻干燥机中的搁板的温度以进行第一阶段干燥;
[0122]
s42:调节所述搁板的温度以进行第二阶段干燥;
[0123]
s43:调节所述搁板的温度以进行第三阶段干燥。分阶段干燥,有利于提升抗原蛋白的稳定性。
[0124]
本发明一些实施例中,优选的,所述步骤s40中的所述预冷温度为小于-20℃。避免破坏抗原蛋白的性能,有利于提升抗原蛋白的稳定性。
[0125]
本发明一些实施例中,所述步骤s41中设置所述冷冻干燥机中的搁板的温度以进行第一阶段干燥的步骤具体包括:
[0126]
s411:将所述搁板的温度设置为-45℃,并保持该温度4h;
[0127]
s412:将所述搁板的温度设置为-35℃,并对所述冷冻干燥机抽真空后保持该温度8-12h。避免破坏抗原蛋白的性能,有利于提升抗原蛋白的稳定性。
[0128]
本发明一些可能实施例中,所述步骤s412中对所述冷冻干燥机抽真空形成的真空度小于20pa,避免破坏抗原蛋白的性能,有利于提升抗原蛋白的稳定性。
[0129]
本发明一些实施例中,所述步骤s42中调节所述搁板的温度以进行第二阶段干燥的步骤具体包括:
[0130]
s421:将所述搁板的温度设置为-30℃,并保持该温度8-12h;
[0131]
s422:将所述搁板的温度设置为-25℃,并保持该温度8-12h;
[0132]
s423:将所述搁板的温度设置为-20℃,并保持该温度1-2h;
[0133]
s424:将所述搁板的温度设置为-10℃,并保持该温度1-2h;
[0134]
s425:将所述搁板的温度设置为0℃,并保持该温度1-8h。避免破坏抗原蛋白的性能,有利于提升抗原蛋白的稳定性。
[0135]
本发明一些实施例中,所述步骤s43中调节所述搁板的温度以进行第三阶段干燥的步骤具体包括:
[0136]
s431:将所述搁板的温度设置为10℃,并保持该温度1-2h;
[0137]
s432:将所述搁板的温度设置为25℃,并保持该温度2-8h。避免破坏抗原蛋白的性能,有利于提升抗原蛋白的稳定性。
[0138]
实施例6-10为抗原蛋白冻干小球的制备,其中,将按表1中实施例1所示的冻干保护溶液的组分和含量配置的所述冻干保护溶液与所述效果实施例中的所述抗原蛋白溶液按表3所示的体积比例混合均匀后冻干获得所述抗原蛋白冻干小球。
[0139]
表3冻干保护溶液与抗原蛋白溶液的体积比例
[0140][0141][0142]
将实施例6-10制备得到的所述抗原蛋白冻干小球在37℃高温条件下,通过加速稳定性试验考察分析这5组抗原蛋白冻干小球的加速稳定性。具体实验结果见表4。对实施例6-10制得的所述抗原蛋白冻干小球进行的所述加速稳定性试验方法与对效果实施例1-5制得的所述抗原蛋白冻干小球进行的加速稳定性试验方法相同,在此不再赘述。
[0143]
表4实施例6-10的抗原蛋白冻干小球的冻干保存效果
[0144]
[0145]
参考表4,可知,实施例6-10制备得到的所述抗原蛋白冻干小球在37℃高温保存的第3、5、7、9天,p点比值有下降趋势,但实施例6-10的所述抗原蛋白冻干小球在第9天的p点比值均大于91%。说明在37℃加速稳定考察下保存第9天,样品稳定性仍然保持在91%以上的活性,且实施例6-10中所述冻干保护溶液与所述抗原蛋白溶液的体积比不同,制得的所述抗原蛋白冻干小球的稳定性差异不大。
[0146]
图3为采用本发明实施例的抗原蛋白冻干小球的制备方法制备的自制冻干小球与bd试剂小球分别与试剂盒中的检测试剂对人的离体全血样品进行检测得到的对比结果的示意图。
[0147]
将所述效果实施例1的制备的所述抗原蛋白冻干小球和对比例进行对照实验。其中,以美国bd公司的试剂盒中的原有标准品细胞因子类的抗原蛋白冻干小球作为对比例,所述试剂盒为human th1/th2 cytok ine kitⅱ,货号为551809。
[0148]
其中,美国bd公司(becton,dickinson and company),中文译文为碧迪医疗器械有限公司,是世界上最大的生产和销售医疗设备,医疗系统和试剂的医疗技术公司之一。
[0149]
对比例:将bd公司的试剂盒中的原有标准品与所述试剂盒中的检测试剂对人的离体全血样品进行检测,测试120个样本并记录检测结果。实验例:将本发明中的所述效果实施例1的所述抗原蛋白冻干小球替换bd公司的试剂盒中的原有标准品,而与所述试剂盒中的检测试剂对人的离体全血样品进行检测,测试120个样本并记录检测结果。具体的检测方法为本领域的常规手段,在此不做赘述。
[0150]
将对比例的检测结果和实验例的检测结果制备校准曲线,其对比结果如图3所示。参考图3,从图3可知,本发明的所述效果实施例1中的“自制冻干小球”与bd公司的试剂盒中的原有标准品“bd试剂小球”的斜率接近于“1”,且相关系数r达到0.9991,t检验结果表明两者试剂检测结果一致,即表明本发明实施例的所述冻干小球的检测性能与对照品的检测性能一致。
[0151]
本发明还提供了一种抗原蛋白冻干小球的应用,所述抗原蛋白冻干小球应用于定量检测试剂盒的校准品、定量检测试剂盒的质控品、定量试剂盒的校准曲线制备和试剂的质量控制中的任意一种。
[0152]
虽然在上文中详细说明了本发明的实施方式,但是对于本领域的技术人员来说显而易见的是,能够对这些实施方式进行各种修改和变化。但是,应理解,这种修改和变化都属于权利要求书中所述的本发明的范围和精神之内。而且,在此说明的本发明可有其它的实施方式,并且可通过多种方式实施或实现。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1