用于血细胞分离的系统的制作方法
1.本发明涉及根据权利要求1的前序部分的用于血细胞分离的系统,并且涉及在这样的系统中使用的滴注器。
背景技术:
2.这种类型的系统包括用于全血分离的分离室,该分离室包括血液入口端口以及血浆出口端口和血液细胞成分出口端口。该系统还包括:血液泵,该血液泵用于将全血泵送到血液入口端口中;以及血浆泵或细胞泵,该血浆泵或细胞泵用于将血浆和/或靶细胞泵送出分离室。此外,该系统包括具有第一端部和第二端部的红细胞管,其中,红细胞管的第一端部连接至血液细胞成分出口端口以允许红细胞离开分离室。另外,该系统包括滴注器,该滴注器包括储存部和入口,其中,红细胞管的第二端部连接至该入口。
3.这种类型的系统通常可以在血液分离术领域中使用,其中,从供血者/患者抽取血液。血液也可以被称为全血,通过这样的系统被分离成该血液的主要成分,即,被分离成血浆和红细胞,并且其余部分被重新输注到供血者/患者体内。根据应用,异常的致病成分可以在治疗性血浆置换过程中与血浆一起被移除;或者异常的红细胞可以在红细胞置换过程中被移除并且被健康的细胞置换。
4.分离室通常包括在离心机单元中,该离心机单元构造成按密度和尺寸使血液成分分离。血液离心的最终产物是:处于分离室外部的沉降红细胞;处于中间的血沉棕黄层,该血沉棕黄层包含mnc(mnc:单核的细胞)即淋巴细胞和单核细胞、干细胞以及血小板;以及处于分离室内部的血浆。
5.已知的血细胞分离系统的示例是在ep 3 509 663 a1中描述的细胞分离器。
6.在分离阶段中,全血在分离室中被分离成红细胞层、富含血小板的血浆即prp、以及单核的细胞层即mnc层,其中,mnc层积聚在分离室中,而红细胞层和prp返回至患者/供血者。
7.分离阶段之后是所谓的溢出阶段,其中,mnc层以容积受控的方式被泵送出分离室,或者更确切地,经过容积感测装置,比如可以控制采集夹的光学传感器。当检测到细胞时,使溢出阶段停止,并且开始所谓的血沉棕黄层阶段,其中,将返回至患者的路径关闭,并且将通向采集容器的路径打开以采集mnc。
8.然而,在溢出阶段期间,其中,mnc层被泵送出分离室,分离室内的负压将流体拉回以使负压均衡,这导致(i)首先将红细胞层拉到分离室中,以及(ii)其次将全血拉到分离室中。
9.不幸的是,负压将溶液拉回到分离室中使得难以准确采集特别是较小容积的更紧凑的靶细胞部分。
技术实现要素:
10.因此,本发明的目的是提供一种用于血细胞分离的系统,该系统允许容易且准确地采集靶细胞,并且该系统还能够准确地采集较小容积的更高浓度的靶细胞。
11.该目的借助于包括权利要求1的特征的系统来实现。
12.因此,红细胞管的第二端部延伸到储存部的容积中以在从血浆出口端口泵送期间、比如例如在泵送mnc层期间进行压力均衡。
13.本文中描述的用于血细胞分离的系统可以在以上提及的自动化细胞分离器中使用。
14.因此,在示例中,系统还可以包括:前面板,该前面板具有用户界面、若干个泵、自动夹;以及检测器装置,检测器装置包括用于监测流体流的光学传感器、用于附接生理盐水袋和抗凝剂袋的静脉注射杆、灌注袋、以及用于靶细胞和血浆的采集容器等。分离室可以被包括在离心机隔室中,该离心机隔室包括具有下述机构的转子:该机构用以安装用于保持分离室的室保持器。分离室和容器可以通过包括若干个管的管系统连接至彼此。在系统中利用的泵可以是蠕动泵并且在系统的上述部分之间输送血液、血液部分和溶液。该系统可以由处理器装置控制。
15.如本发明所建议的,红细胞管的第二端部延伸到储存部的容积中以在从血浆出口端口泵送期间进行压力均衡。
16.在本文中,术语“滴注器”可以用于指下述装置:该装置允许保留诸如空气的气体使得该气体不流向下游。在本系统中,滴注器确保返回至供血者/患者的红细胞和/或血浆不含空气。
17.术语“储存部”可以用于指下述结构:该结构比如为具有规则或不规则形状的用以保持流体的容器。与红细胞管布置成使该红细胞管的第二端部位于储存部的容积上方的现有技术相比,红细胞管的第二端部延伸到储存部的容积中。因此,根据储存部内部的流体液位,红细胞管的第二端部可以完全浸没在储存部内部的流体中,即,位于流体液位下方。
18.有利地,红细胞管的第二端部延伸到储存部的容积中的这种布置结构允许增加用于红细胞部分的储存部容积,这又导致避免使用全血进行压力均衡。因此,与现有技术系统的溢出相比,靶细胞层将作为更紧凑的层溢出,并且由此允许在更小的容积内采集相同的靶细胞,其中,在现有技术系统中,红细胞管的第二端部未延伸到滴注器的储存部的容积中。另外,通过借助于红细胞管的第二端部延伸到储存部的容积中以在泵送mnc层期间进行压力均衡来增加用于红细胞部分的储存部容积,现有系统可以容易地得到改进,因为分离室或滴注器的当前的功能性设计都不需要被修改。
19.在示例中,红细胞管的第二端部至少延伸到储存部的容积的20%中。
20.在此,位于红细胞管的第二端部处的开口至少延伸到储存部的容积的20%中。因此,当储存部利用流体填充超过80%时,位于红细胞管的第二端部处的开口将浸没在流体中,这意味着开口将位于流体液位下方。
21.在其他示例中,红细胞管的第二端部至少延伸到储存部的容积的50%和80%中。
22.在示例中,红细胞管的第二端部延伸至储存部的底表面。
23.底表面可以沿重力方向与储存部的入口相反地定位。因此,在这个示例中,位于红细胞管的第二端部处的开口可能基本上尽可能地延伸到储存部中,使得即使在较低的流体
液位的情况下,位于第二端部处的开口仍然浸没到储存部内部的流体中。
24.在示例中,红细胞管的第二端部延伸至储存部的底表面中的出口开口。
25.术语“出口开口”可以用于指位于储存部的底表面中的开口,储存部内部的流体可以通过该开口返回至患者/供血者。
26.在示例中,该系统包括盖,该盖构造成安置在储存部上以覆盖储存部,其中,在盖中布置有入口,并且其中,红细胞管的第二端部延伸穿过盖。
27.盖可以覆盖储存部以防止灰尘或其他污染物进入该储存部。入口可以是基本上呈圆形的开口,该圆形的开口的直径略大于红细胞管的外径,使得红细胞管可以穿过该开口延伸到储存部中并且可以保持就位。
28.在示例中,滴注器包括第二入口,该第二入口构造成连接至血浆管,该血浆管将流体从血浆出口端口运送到储存部中。
29.除了来自红细胞管的流体通过该入口进入之外,来自血浆管的流体也可以通过第二入口进入储存部。
30.根据系统的操作模式,可以在溢出阶段将来自血浆管的流体重新引入到患者/供血者体内。
31.在示例中,分离室包括另一血液细胞成分出口端口。
32.有利地,不同样式的分离室可以与本文中描述的系统一起使用。
33.该目的还通过一种用于血细胞分离的系统的滴注器来实现,该滴注器特别地用于如本文中描述的系统,该滴注器包括:储存部和入口,其中,入口能够连接至红细胞管的第二端部,并且其中,红细胞管的第二端部延伸到储存部的容积中以在通过该系统泵送期间进行压力均衡。
34.以上针对系统描述的优点和有利实施方式同样地适用于滴注器,使得应当参考上文。
附图说明
35.本发明的基本思想随后将参照附图中所示的实施方式进行更详细地描述。在附图中:
36.图1示出了在现有技术中常用的用于血细胞分离的系统的示意图;
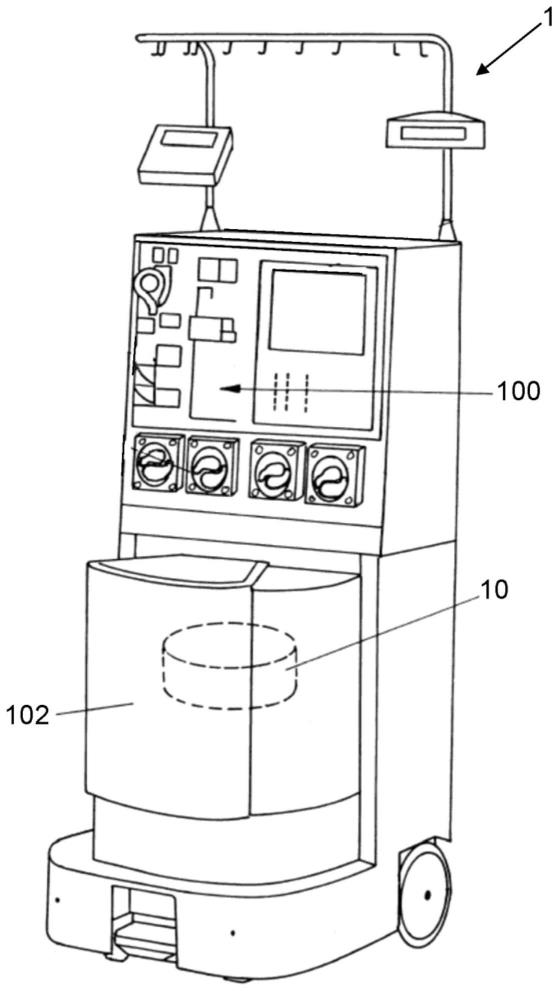
37.图2a、图2b示出了在现有技术中常用的分离室的示意图;
38.图3a、图3b示出了根据本发明的实施方式的用于血细胞分离的系统的示意图;
39.图4a、图4b示出了在现有技术中常用的滴注器的示意图;以及
40.图5a、图5b示出了根据本发明的实施方式的滴注器的示意图。
具体实施方式
41.图1示出了用于血细胞分离的示例性系统1的示意图。系统1借助于附接至壳体的轮来移动。所示出的系统1包括前面板100,前面板100具有自动夹、泵和用户界面。所示出的系统1还包括分离室10所在的离心机隔室102。
42.图2a示出了示例性的分离室10的示意图。图2a中所示的分离室10可以是先前在图1中所示的分离室10。分离室10可以基本上呈筒形并且可以与离心机单元(图2a中未示出)
结合使用来使分离室10中的血液旋转以将分离室10中的血液分离成该血液的成分。分离室10包括血液入口端口12,来自供血者/患者的全血可以通过该血液入口端口12泵入到分离室10中。图2a还示出了沿轨道方向,与分离室10的扩口部段上的血液入口端口12相对地,设置有血浆出口端口14和血液细胞成分出口端口16。在分离过程期间,全血被分离成可在血浆出口端口14处得到的血浆和可在血液细胞成分出口端口16处得到的红细胞。在血浆与红细胞之间存在有所谓的血沉棕黄层,该血沉棕黄层包括具有靶细胞的单核细胞层,即,mnc层。
43.图2b示出了另一示例性的分离室10的示意图。除了血液入口端口12、血浆出口端口14和血液细胞成分出口端口16之外,所示的分离室10还包括另一血液细胞成分出口端口18。
44.图3a示出了根据实施方式的用于血细胞分离的系统1。如图所示,系统1包括分离室10,该分离室10可以是如图2a中所示的分离室10。分离室10包括血液入口端口12、血浆出口端口14和血液细胞成分出口端口16,用于从全血中分离靶细胞。该系统还包括:血液泵20,该血液泵20用于将全血泵入到血液入口端口12中;以及血浆泵22,该血浆泵22用于将流体、即包括靶细胞的血浆和单核细胞层、即mnc层从血浆出口端口14泵送出分离室10。
45.在图3a中,红细胞管30连接至血液细胞成分出口端口16以允许红细胞离开分离室10。如图3a中所示,红细胞管30包括第一端部32和第二端部34,其中,红细胞管30的第一端部32连接至血液细胞成分出口端口16,而第二端部34与系统1的滴注器40接触。如图示意性所示,红细胞管30的第二端部34延伸到储存部42的容积中以在泵送mnc层期间进行压力均衡,这将参照图5a和图5b更详细地描述。
46.如上所述,参照图2a和图2b,全血在分离阶段期间被分离成该全血的成分。实质上,红细胞和血浆部分在分离室10中被分离。在这个所谓的分离步骤期间,形成了包括红细胞的外层和包括血浆的内层。包括具有靶细胞的单核细胞层、即mnc层的血沉棕黄层在分离室10中作为另一层积聚在红细胞与血浆部分之间。
47.一旦分离阶段完成,溢出阶段开始,其中,血浆被血浆泵22泵送到滴注器40的储存部42中,如图3a中的箭头所示。一旦在血浆中检测到靶细胞,例如借助于位于靠近血浆泵22的管部段中的光学传感器(未示出)在血浆中检测到靶细胞,采集夹(未示出)可以使如图3a中所示的从血浆出口端口14流向滴注器40的流体流转向成从血浆出口端口14流向靶细胞被采集的采集容器(未示出)的流体流。
48.进入到分离室10中的血液的流量和从该分离室10离开的血浆的流量在溢出阶段期间导致分离室10内的负压。
49.红细胞管30的第二端部34延伸到滴注器40的储存部42的容积中的布置结构允许增加用于红细胞部分的储存部容积,这又导致避免使用全血进行压力均衡。因此,与现有技术系统的溢出相比,靶细胞层可以作为更紧凑的层溢出,以允许采集具有较小体积的更紧凑的细胞部分,其中,在现有技术系统中,红细胞的第二端部未延伸到滴注器的储存部的容积中。
50.图3b示出了用于血细胞分离的系统1的至少一部分的另一实施方式。在图3b中所示的实施方式中,使用了图2b的分离室10。
51.图4a和图4b示出了在现有技术中常用的滴注器40的示意图。
52.图4a示出了空的滴注器40,即在储存部42中没有流体,而图4b示出了填充有流体的滴注器40。从图4a和图4b可以观察到,红细胞管30的第二端部34布置在储存部42上方,并且因此不延伸到储存部42的容积中以在从血浆出口端口泵送期间、比如在泵送mnc层期间进行压力均衡。
53.储存部42被具有入口46的盖44覆盖,红细胞管30的第二端部34附接至该入口46。盖44包括第二入口48以容纳血浆管的端部,使得来自血浆管的流体也可以插入到储存部42中。另外,图4a和图4b示出了位于储存部42的底表面中的出口开口50。
54.图5a和图5b示出了根据实施方式的滴注器40的示意图。正如之前已经关于图4a和图4b所示的,图5a中所示的滴注器40是空的,而图5b示出了填充有流体的滴注器40。
55.图5a和图5b中所示的滴注器40与图4a和图4b中所示的滴注器的区别在于,红细胞管30的第二端部34延伸到储存部42的容积中以在泵送期间进行压力均衡。在所示的实施方式中,红细胞管30的第二端部34延伸到储存部的容积的大约80%中。在其他实施方式中,红细胞管的第二端部也可以较小程度地延伸到储存部42的容积中,例如仅延伸到储存部42的容积的20%或50%中。在替代性实施方式中,红细胞管的第二端部还可以延伸至储存部的底表面和/或延伸至位于储存部的底表面中的出口开口。
56.附图标记列表
[0057]1ꢀꢀꢀ
用于血细胞分离的系统
[0058]
10
ꢀꢀ
分离室
[0059]
12
ꢀꢀ
血液入口端口
[0060]
14
ꢀꢀ
血浆出口端口
[0061]
16
ꢀꢀ
血液细胞成分出口端口
[0062]
18
ꢀꢀ
另一血液细胞成分出口端口
[0063]
20
ꢀꢀ
血液泵
[0064]
22
ꢀꢀ
血浆泵
[0065]
30
ꢀꢀ
红细胞管
[0066]
32
ꢀꢀ
红细胞管的第一端部
[0067]
34
ꢀꢀ
红细胞管的第二端部
[0068]
40
ꢀꢀ
滴注器
[0069]
42
ꢀꢀ
储存部
[0070]
44
ꢀꢀ
盖
[0071]
46
ꢀꢀ
入口
[0072]
48
ꢀꢀ
第二入口
[0073]
50
ꢀꢀ
出口开口
[0074]
100 前面板
[0075]
102 离心机隔室
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1