一种治疗糖尿病和/或高血脂症的联合用药物
山椒素任意一种或多种,优选羟基-α-山椒素。
14.进一步地,所述糖尿病是2型糖尿病。
15.更进一步地,所述高血脂症为高胆固醇血症,混合型高脂血症和/或低高密度脂蛋白血症。
16.本发明的花椒酰胺类物质和二甲双胍联合用药物可以明显降低血糖水平,血脂水平,在治疗治疗糖尿病,及糖尿病导致的血脂异常方面效果显著,为临床提供了一种新的选择。
17.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
18.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
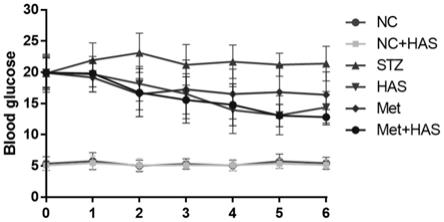
19.图1小鼠空腹血糖曲线(nc:正常对照,nc+has:正常对照+羟基-α-山椒素,stz,链脲佐菌素stz诱导的模型组,has:羟基-α-山椒素给药组,met:二甲双胍给药组,met+has:二甲双胍+羟基-α-山椒素联用组)
20.图2葡萄糖耐量的实验结果(nc:正常对照,nc+has:正常对照+羟基-α-山椒素,stz,链脲佐菌素stz诱导的模型组,has:羟基-α-山椒素给药组,met:二甲双胍给药组,met+has:二甲双胍+羟基-α-山椒素联用组)
21.图3小鼠胰岛素耐量实验结果(nc:正常对照,nc+has:正常对照+羟基-α-山椒素,stz,链脲佐菌素stz诱导的模型组,has:羟基-α-山椒素给药组,met:二甲双胍给药组,met+has:二甲双胍+羟基-α-山椒素联用组。nc:正常对照,nc+has:正常对照+羟基-α-山椒素,stz,链脲佐菌素(stz)诱导的模型组,has:羟基-α-山椒素给药组,met:二甲双胍给药组,met+has:二甲双胍+羟基-α-山椒素联用组)
22.图4生化指标的检测结果(nc:正常对照,nc+has:正常对照+羟基-α-山椒素,stz,链脲佐菌素(stz)诱导的模型组,has:羟基-α-山椒素给药组,met:二甲双胍给药组,met+has:二甲双胍+羟基-α-山椒素联用组)
23.图5肝脏组织切片油红o染色分析。
具体实施方式
24.实验例1花椒酰胺类物质和二甲双胍联合用药研究
25.1、试验方法
26.将80只体重为20
±
2g的8周龄健康c57bl/6健康雄性小鼠饲养在通风良好,室温23℃,相对湿度45%-65%,12h/12h明暗交换的环境中,在实验期间,小鼠被允许自由获取食物和水,基础饲料适应性饲喂一周后,随机选择20只小鼠作为正常组和正常has组继续喂食普通饲料,剩余小鼠作为高脂饮食组(n=40),采用高脂饲料喂养。4周后,小鼠经过12h禁食过夜,不禁水。第二天根据大鼠空腹体重,给予高脂饮食组大鼠腹腔注射55mg/kg的链脲佐菌素(stz)柠檬酸缓冲液,正常组和正常has组小鼠注射同体积的柠檬酸缓冲液,连续注射
5d。三天后,对高脂饮食组小鼠进行尾尖采血(前一晚禁食),罗氏血糖仪检测这些大鼠的空腹血糖,将空腹血糖≥11.1mmol/l的小鼠作为造模成功的动物模型。将造模成功的大鼠随机分为模型组,has组,has+二甲双胍组,二甲双胍组。精密称取has,用cmc-na(0.5%)溶液制成浓度5mg/ml的has混悬溶液。正常组和模型组小鼠灌胃相同体积的cmc-na(0.5%)溶液,阳性药组灌胃0.25g/kg二甲双胍,正常has组和has组灌胃5mg/ml的has混悬溶液,联合给药组灌胃0.25g/kg二甲双胍和5mg/mlhas。每天进行灌胃给药,连续给药6周,喂养饲料情况如给前所述,并记录小鼠饮水量、摄食量、体重变化等。
27.2、指标监测
28.2.1空腹血糖检测
29.在灌胃开始,后续每七天测一次空腹血糖,既禁食不禁水12h,使用血糖仪剪尾采血测定空腹血糖值。
30.2.2、口服葡萄糖耐量实验(ogtt)
31.实验结束前,对小鼠禁食不禁水12h,各组小鼠灌胃2g/(kg
·
bw)葡萄糖溶液,进行口服葡萄糖耐量实验(ogtt)。分别在灌胃后0、30、60、120min时取尾血测量血糖值。
32.2.3、胰岛素耐量试验(itt)
33.实验结束前,对小鼠禁食不禁水12h,各组小鼠腹腔注射0.75unitis/kg胰岛素,进行胰岛素耐量试验(itt),分别在注射后0、30、60、120min时取尾血测量血糖值。
34.2.4、组织取材
35.实验结束,使用戊巴比妥麻醉小鼠,摘眼球取血,装于ep管中。4℃静置4h,4℃下4000r离心10min,收集上层血清,放入-80冰箱中冷藏待后期检测。小鼠脱颈处死后,在冰上迅速取出肝脏组织,用生理盐水冲洗污血后,称重。将组织切成大小合适的小块,部分置于4%多聚甲醛组织固定液中,使组织充分固定,用于后续组织病理学分析和免疫组化分析。剩余组织用锡纸包裹,放入液氮中冻存,随后转移至-80℃冰箱储存,供后续生化指标检测、免疫荧光等实验使用。
36.2.5、生化指标的测定
37.使用迈瑞生化仪检测小鼠血清中丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、甘油三酯(tg)、总胆固醇(tc)、低密度脂蛋白胆固醇(ldl-c)、高密度脂蛋白胆固醇(hdl-c)等指标水平。
38.2.6、肝脏组织切片油红o染色分析
39.取-80℃保存的肝脏进行冰冻切片,并使用油红o进行染色,光学显微镜下观察肝脏组织中脂滴的含量和分布情况。
40.3、实验结果
41.3.1空腹血糖变化
42.每周纪录一次小鼠血糖值,小鼠的血糖水平随着给药时间的变化曲线结果如图1所示。正常组和正常has组小鼠的血糖处于正常水平,而高脂饲料喂养联合stz造模后,小鼠的空腹血糖水平远远超过11.1mmol/l,并维持在标准之前,表明二型糖尿病造模成功。模型建立后进行随机分组,各组二型糖尿病模型小鼠的空腹血糖水平相似,无明显差异,且均高于正常组小鼠的空腹血糖水平。当药物处理时,模型组小鼠空腹血糖水平没有出现下降,较稳定的表现为空腹高血糖。但是治疗组的空腹血糖水平总体上呈现下降趋势,其中联合给
药组的下降趋势最明显,其次是has组,最后是二甲双胍。
43.3.2口服葡萄糖耐量实验(ogtt)
44.葡萄糖耐量的实验结果如图2所示。结果表明,给予葡萄糖后各组小鼠的血糖值都是先升高后降低,呈现葡萄糖吸收代谢的过程。正常组和正常has组小鼠在糖负荷后血糖逐渐恢复正常水平,表明其糖耐量正常。而模型组和其他给药组在糖负荷后血糖值变化较大,表现出糖耐量异常。此外,在30min时,模型组小鼠血糖升高最明显,在30min之后,各小组血糖逐渐降低,但模型组小鼠血糖降低缓慢。表明造模引起了小鼠的葡萄糖耐量受损,而给药后,小鼠葡萄糖耐量得到明显改善。
45.3.3胰岛素耐量试验(itt)
46.小鼠胰岛素耐量实验结果如图3所示,注射胰岛素后,模型组小鼠的血糖降低要比给药组缓慢,表明模型组小鼠产生了明显的胰岛素抵抗。而给药组小鼠胰岛素抵抗情况有所减轻,其中联合给药组的改善效果最好。
47.3.4各项生化指标的检测结果
48.如图4生化指标分析结果显示,与正常组相比,模型组小鼠体内血清中alt、ast、tc、tg、ldl-c水平浓度显著高于正常组和正常has组,给药后这些指标水平有所改善。从alt和ast来看,has组的改善效果最好,其次是联合给药,但均比阳性药二甲双胍的改善效果好。从ldl-c、tg、tc来看,has以及has+二甲双胍组的这些指标均明显低于阳性药二甲双胍,且联合给药效果更好,表明has联用二甲双胍能显著改善stz诱导的二型糖尿病小鼠的血脂异常,并且比单用阳性药二甲双胍的效果好。
49.3.5肝脏组织切片油红o染色分析
50.肝脏油红o染色结果如图5所示,stz联合高脂饲料喂养后,小鼠肝脏出现大量脂质堆积,而给药后脂质堆积的情况明显改善。与has组和has+二甲双胍组相比,二甲双胍组小鼠肝脏中脂滴任然较多,表明has联用二甲双胍能显著改善stz诱导的二型糖尿病小鼠肝脏中的脂质堆积,并且比单用阳性药二甲双胍的效果好。
51.综上,本发明羟基-α-山椒素和二甲双胍联合用药物的动物试验显示:花椒酰胺类物质联合二甲双胍可以显著降低血糖水平,血脂水平,相较两种药物中任一种药物单用,效果具有明显的提高,在治疗治疗糖尿病,及糖尿病导致的血脂异常方面具有协同增效的作用,为临床糖尿病及并发症的治疗提供了一种新的选择。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1