一种治疗子宫内膜损伤干细胞活性因子制剂的制备方法与流程
1.本发明属于生物制药技术领域,具体涉及一种治疗子宫内膜损伤干细胞活性因子制剂的制备方法。
背景技术:
2.子宫内膜损伤是一个广泛的概念,包括各种子宫内膜疾病,如薄型子宫内膜、宫腔粘连。在正常月经周期,子宫内膜可实现周期性的完全再生,子宫内膜分为功能层和基底层两个部分,功能层在每个周期中通过生长转化、剥脱和再生修复等一系列过程不断循环再生。但是随着人工流产、宫腔镜手术等宫腔手术操作的逐渐增多,以及子宫内膜感染、药物等多种因素的作用,子宫内膜损伤变得越来越常见。子宫内膜基底层发生损伤后,增生的炎性细胞如单核细胞、中性粒细胞、淋巴细胞引起炎性反应,分泌各种炎性介质,导致子宫内膜细胞再生障碍。这些感染造成的子宫内膜损伤可造成增殖生长子宫内膜的子宫内膜基质细胞丢失,从而引起子宫内膜变薄,导致不孕。
3.目前对治疗薄型子宫的治疗方法分为药物治疗,物理治疗和宫腔镜手术治疗。其中药物治疗常见有大剂量口服或阴道用雌激素,皮下注射生长激素,口服阿司匹林或西地那非改善子宫内膜血供。长期服用性激素等药物不仅会影响患者的内分泌,还易产生抗药性,且药物治疗只对少数患者有效。常见物理治疗有内膜搔刮术,通过刮匙搔刮子宫内膜造成轻微的内膜损伤,刺激内膜生长,及神经肌肉电刺激疗法等。当内膜纤维化严重,患者迫切希望治疗内膜损伤造成的不孕,恢复正常月经,宫腔镜手术是目前的首选治疗方法。物理治疗与宫腔镜治疗不仅低效且有可能对子宫内膜产生二次伤害。现有药物制剂对子宫内膜的治疗效果不佳,亟需一种安全、高效地治疗用制剂。
技术实现要素:
4.本发明的目的在于提供一种治疗子宫内膜损伤干细胞活性因子制剂的制备方法,以解决背景技术中的问题。
5.本发明的目的可以通过以下技术方案实现:一种治疗子宫内膜损伤干细胞活性因子制剂的制备方法,包括如下步骤:
6.步骤一、采集原料:
7.将采集的新鲜脐带放置于装有100-200ml采集液的培养皿中,备用;在生产结束胎盘脱落后,将含有抗凝剂的采血袋针头插入脐静脉中,一边采集一边晃动血袋,以充分混合血液和抗凝剂,低温保存,备用;
8.步骤二、脐带组织块接种:
9.用手术剪截取5-10cm的脐带段,将脐带段转移至灭菌后的培养皿中,加入质量分数为75%的乙醇溶液,将脐带在乙醇溶液中浸泡并翻转,消毒45-60s,去除消毒后的脐带段上的动脉和静脉,用缓冲液a清洗至无血块;沥干水分后将处理好的脐带段放入烧瓶中并剪碎,获得直径为1-3mm的组织块;将组织块接种到带有dmem培养基的培养皿中,使各组织块
之间的距离<1cm,接种完成后将装有组织块的培养皿倒置于二氧化碳培养箱中处理1-3h;通过二氧化碳刺激细胞,促进细胞生长分裂;
10.步骤三、脐带间充质干细胞原代培养:
11.向接种有二氧化碳处理后的组织块的培养皿中加入培养皿容积1/5量的msc培养液,置于恒温培养箱内进行原代培养;控制恒温培养箱内的温度为37℃、二氧化碳浓度为5%;培养过程中观察到细胞明显的贴壁后,间隔3天更换一次msc培养液,共培养21-27天;
12.步骤四、脐带间充质干细胞传代培养:
13.收集培养好的原代细胞,去除培养皿内的上清后用2-3ml缓冲液a清洗并去除废液,加入1-2ml的消化液在培养箱中消化培养5-10min;消化培养后,向培养皿中加入1-2ml终止液,用移液枪吹打培养皿使附着的细胞完全脱落,得到细胞悬液,将细胞悬液转移至50ml的离心管中,在1000-1500r/min的条件下离心5-10min,去除上清后加入1ml的msc培养液重悬细胞,再加入2-10ml的dmem培养基混合均匀,计数后接种进培养瓶中并放置于二氧化碳培养箱中培养,控制每个培养瓶中的细胞数为1.3-1.6
×
106个;
14.待培养瓶中的细胞生长至培养瓶的甁壁面积的80-90%时进行传代培养,传代培养的具体步骤如下:
15.首先取原有的dmem培养基,在生物安全柜中使用dpbs缓冲液或生理盐水进行清洗1-2次;去除废液并加入适量的消化液消化3-5min,直到细胞脱离培养瓶;加入终止液终止消化,吸取细胞悬液转移至50ml离心管中,在1000-1500r/min的条件下离心5-10min,弃上清,用移液枪吹打均匀后用细胞计数板的选取1.3-1.6
×
106个细胞加入msc培养液,在二氧化碳浓度为5%、37℃饱和湿度的条件下进行传代;待细胞传代至第3代后用消化液消化并收集细胞,进行无菌检测,内毒素检测,流失表型、细胞计数及活力检测,收集培养过程中产生的所有培养上清,冷藏备用;
16.步骤五、脐带血干细胞原代分离:
17.将脐带血采用密度梯度法分离后与等量生理盐水混合得到血液稀释液,将血液稀释液与分离液按照2-3:1的体积比混合,在离心力为600-1000g的条件下离心15-25min,离心后自上而下分为血浆层、白膜层和红细胞层,吸取白膜层并且用生理盐水重悬获得第一次重悬液;将第一次重悬液在离心力为300-800g的条件下离心5min,离心完成后用msc培养液重悬获得第二次重悬液,将第二次重悬液接种至培养瓶中,接种量为培养瓶容积的1/5;
18.步骤六、脐带血干细胞换液、传代培养:
19.培养瓶中脐带血干细胞原代培养48h后换液,待培养瓶中的细胞生长至培养瓶的甁壁面积的80-90%时进行传代培养,细胞传代至第3代后加入消化液,消化并收集细胞,依次进行无菌检测、内毒素检测、流失表型、细胞计数及活力检测;收集培养过程中产生的所有培养上清液,无菌冷藏备用;
20.步骤七、制备活性因子浓缩液:
21.分别将脐带间充质干细胞和脐带血干细胞培养过程中收集的培养上清液转移至不同的离心管中,两次浓缩后,分别得到脐带间充质干细胞活性因子浓缩液和脐带血干细胞活性因子浓缩液,在-20℃条件下保存,备用;
22.两次浓缩的具体步骤如下:
23.在500-1500r/min的条件下离心5-10min分别收集离心后的细胞上清液,将上清液
在1.0bar的压力下用30kd的超滤膜包进行超滤透析,取透析液;将透析液通过3kd超滤膜,收集含有大量细胞因子的浓缩液,完成第一次浓缩;第一次浓缩后进行第二次浓缩,第二次浓缩的步骤和第一次浓缩的步骤相同;
24.步骤八:制备双重干细胞活性因子组合制剂:
25.将脐带间充质干细胞活性因子浓缩液与脐带血干细胞活性因子浓缩液按照1-3ml:1-3ml的用量比混合,制得双重干细胞活性因子组合浓缩液,将双重干细胞活性因子组合浓缩液用无菌注射器吸注射到无菌生理盐水中,制成治疗子宫内膜损伤干细胞活性因子制剂;双重干细胞活性因子组合浓缩液和无菌生理盐水的用量比为1-3ml:100ml;
26.进一步地,pbs缓冲液包括nacl、kcl、na2hpo4、kh2po4和蒸馏水;nacl、kcl、na2hpo4、kh2po4和蒸馏水的用量比为4g:0.1g:0.72g:0.12g:400ml;
27.进一步地,dpbs缓冲液包括nacl、kcl、na2hpo4、kh2po
4、
cacl、mgcl和蒸馏水;nacl、kcl、na2hpo4、kh2po
4、
cacl、mgcl和蒸馏水的用量别为8g:0.2g:1.15g:0.2g:0.1g:0.1g:1l;
28.进一步地,缓冲液a通过如下步骤制备:将pbs缓冲液用质量分数为10%的盐酸调节ph至7.2,加入双抗得到缓冲液a并且使双抗的含量为1%;
29.进一步地,采集液通过如下步骤制备:将dmso、胎牛血清、pbs缓冲液按照10ml:20ml:70ml的用量比混合,然后用质量分数为10%的盐酸调节ph至7.2-7.5,加入双抗得到混合液并且使双抗的含量为混合液的2%;双抗为青霉素-链霉素混合液,其中青霉素的含量为10000u/ml,链霉素的含量为10mg/ml;抗凝剂为质量分数为1%肝素钠溶液或质量分数为3.8%的枸橼酸钠溶液;
30.进一步地,dmem培养基为购买于赛默飞世尔科技(中国)有限公司的dmem/f12dmem培养基;msc培养液为dmem培养基、胎牛血清、双抗和抗b混合制得,其中胎牛血清占比为10-20%,双抗含量为100-300μl/ml,抗b含量为100-300μl/ml,抗b为两性霉素b;消化液为购买于赛默飞世尔科技(中国)有限公司的edta/胰蛋白酶溶液;终止液为胎牛血清和pbs缓冲液按1ml:9ml的用量比混制得;分离液为购买于西格玛奥德里奇(上海)贸易有限公司的淋巴细胞分离液。
31.本发明的有益效果:
32.本发明的制备方法中,培养的脐带间充质干细胞和脐带血干细胞出细胞率高、细胞形态好,状态稳定,培养操作比较简单且细胞数量巨大、来源充足;双重干细胞活性因子组合制剂的安全性能高,使用均是无毒无污染的试剂与材料,免疫原性低,无毒副作用,使用更安心;双重干细胞活性因子组合制剂相对于单一干细胞活性因子,双重干细胞协同作用所含活性因子种类更多,干细胞活性因子中主要含有成纤维细胞生长因子、表皮生长因子、角质细胞生长因子、血管内皮生长因子、转化生长因子β等。干细胞活性因子组合制剂可以刺激子宫内膜,促进子宫内膜生长,针对性更强,对子宫内膜损伤治疗效果显著。
附图说明
33.下面结合附图对本发明作进一步的说明。
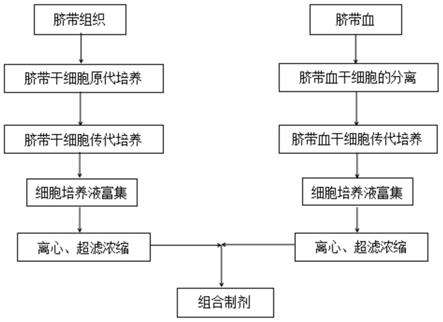
34.图1是本发明一种治疗子宫内膜损伤干细胞活性因子制剂的制备方法的流程图。
具体实施方式
35.下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
36.实施例1
37.制备脐带间充质干细胞活性因子浓缩液,包括如下步骤:
38.将采集的新鲜脐带放置于装有100ml采集液的培养皿中,备用;
39.用手术剪截取5cm的脐带段,将脐带段转移至灭菌后的培养皿中,加入质量分数为75%的乙醇溶液,将脐带在乙醇溶液中浸泡并翻转,消毒45s,去除消毒后的脐带段上的动脉和静脉,用缓冲液a清洗至无血块;沥干水分后将处理好的脐带段放入烧瓶中并剪碎,获得直径为1mm的组织块;将组织块接种到带有dmem培养基的培养皿中,使各组织块之间的距离<1cm,接种完成后将装有组织块的培养皿倒置于二氧化碳培养箱中处理1h;通过二氧化碳刺激细胞,促进细胞生长分裂;
40.向接种有二氧化碳处理后的组织块的培养皿中加入培养皿容积1/5量的msc培养液,置于恒温培养箱内进行原代培养;控制恒温培养箱内的温度为37℃、二氧化碳浓度为5%;培养过程中观察到细胞明显的贴壁后,间隔3天更换一次msc培养液,共培养21天;
41.收集培养好的原代细胞,去除培养皿内的上清后用缓冲液a清洗并去除废液,加入1ml的消化液在培养箱中消化培养5min;消化培养后,向培养皿中加入1ml终止液,用移液枪吹打培养皿使附着的细胞完全脱落,得到细胞悬液,将细胞悬液转移至50ml的离心管中,在1000r/min的条件下离心5min,去除上清后加入1ml的msc培养液重悬细胞,再加入2ml的dmem培养基混合均匀,计数后接种进培养瓶中并放置于二氧化碳培养箱中培养,控制每个培养瓶中的细胞数为1.3
×
106个;
42.首先取原有的dmem培养基,在生物安全柜中使用dpbs缓冲液或是生理盐水进行清洗1次;去除废液并加入适量的消化液消化3min,直到细胞脱离培养瓶;加入终止液终止消化,吸取细胞悬液转移至50ml离心管中,在1000r/min的条件下离心5min,弃上清,用移液枪吹打均匀后用细胞计数板的选取1.3
×
106个细胞加入msc培养液,在二氧化碳浓度为5%、37℃饱和湿度的条件下进行传代;待细胞传代至第3代后用消化液消化并收集细胞,进行无菌检测,内毒素检测,流失表型、细胞计数及活力检测,收集培养过程中产生的所有培养上清,冷藏备用;
43.将脐带间充质干细胞培养过程中收集的培养上清液转移至离心管中,在500r/min的条件下离心5min分别收集离心后的细胞上清液,将上清液在1.0bar的压力下用30kd的超滤膜包进行超滤透析,取透析液;将透析液通过3kd超滤膜,收集含有大量细胞因子的浓缩液,完成第一次浓缩;第一次浓缩后按相同步骤进行第二次浓缩,得到脐带间充质干细胞活性因子浓缩液,在-20℃条件下保存,备用。
44.实施例2
45.制备脐带间充质干细胞活性因子浓缩液,包括如下步骤:
46.将采集的新鲜脐带放置于装有200ml采集液的培养皿中,备用;
47.用手术剪截取10cm的脐带段,将脐带段转移至灭菌后的培养皿中,加入质量分数
为75%的乙醇溶液,将脐带在乙醇溶液中浸泡并翻转,消毒60s,去除消毒后的脐带段上的动脉和静脉,用缓冲液a清洗至无血块;沥干水分后将处理好的脐带段放入烧瓶中并剪碎,获得直径为3mm的组织块;将组织块接种到带有dmem培养基的培养皿中,使各组织块之间的距离<1cm,接种完成后将装有组织块的培养皿倒置于二氧化碳培养箱中处理3h;通过二氧化碳刺激细胞,促进细胞生长分裂;
48.向接种有二氧化碳处理后的组织块的培养皿中加入培养皿容积1/5量的msc培养液,置于恒温培养箱内进行原代培养;控制恒温培养箱内的温度为37℃、二氧化碳浓度为5%;培养过程中观察到细胞明显的贴壁后,间隔3天更换一次msc培养液,共培养27天;
49.收集培养好的原代细胞,去除培养皿内的上清后用缓冲液a清洗并去除废液,加入2ml的消化液在培养箱中消化培养10min;消化培养后,向培养皿中加入2ml终止液,用移液枪吹打培养皿使附着的细胞完全脱落,得到细胞悬液,将细胞悬液转移至50ml的离心管中,在1500r/min的条件下离心10min,去除上清后加入1ml的msc培养液重悬细胞,再加入10ml的dmem培养基混合均匀,计数后接种进培养瓶中并放置于二氧化碳培养箱中培养,控制每个培养瓶中的细胞数为1.6
×
106个;
50.首先取原有的dmem培养基,在生物安全柜中使用dpbs缓冲液或是生理盐水进行清洗2次;去除废液并加入适量的消化液消化5min,直到细胞脱离培养瓶;加入终止液终止消化,吸取细胞悬液转移至50ml离心管中,在1500r/min的条件下离心10min,弃上清,用移液枪吹打均匀后用细胞计数板的选取1.6
×
106个细胞加入msc培养液,在二氧化碳浓度为5%、37℃饱和湿度的条件下进行传代;待细胞传代至第3代后用消化液消化并收集细胞,进行无菌检测,内毒素检测,流失表型、细胞计数及活力检测,收集培养过程中产生的所有培养上清,冷藏备用;
51.将脐带间充质干细胞培养过程中收集的培养上清液转移至离心管中,在1500r/min的条件下离心10min分别收集离心后的细胞上清液,将上清液在1.0bar的压力下用30kd的超滤膜包进行超滤透析,取透析液;将透析液通过3kd超滤膜,收集含有大量细胞因子的浓缩液,完成第一次浓缩;第一次浓缩后按相同步骤进行第二次浓缩,得到脐带间充质干细胞活性因子浓缩液,在-20℃条件下保存,备用。
52.实施例3
53.制备脐带血干细胞活性因子浓缩液,包括如下步骤:
54.在生产结束胎盘脱落后,将含有抗凝剂的采血袋针头插入脐静脉中,一边采集一边晃动血袋,以充分混合血液和抗凝剂,低温保存,备用;
55.将脐带血采用密度梯度法分离后与等量生理盐水混合得到血液稀释液,将血液稀释液与分离液按照2:1的体积比混合,在离心力为600g的条件下离心15min,离心后自上而下分为血浆层、白膜层和红细胞层,吸取白膜层并且用生理盐水重悬获得第一次重悬液;将第一次重悬液在离心力为300g的条件下离心5min,离心完成后用msc培养液重悬获得第二次重悬液,将第二次重悬液接种至培养瓶中,接种量为培养瓶容积的1/5;
56.培养瓶中脐带血干细胞原代培养48h后换液,待培养瓶中的细胞生长至培养瓶的甁壁面积的80%时进行传代培养,细胞传代至第3代后加入消化液,消化并收集细胞,依次进行无菌检测、内毒素检测、流失表型、细胞计数及活力检测;收集培养过程中产生的所有培养上清液,无菌冷藏备用;
57.将脐带血干细胞培养过程中收集的培养上清液转移至离心管中,在500r/min的条件下离心5min分别收集离心后的细胞上清液,将上清液在1.0bar的压力下用30kd的超滤膜包进行超滤透析,取透析液;将透析液通过3kd超滤膜,收集含有大量细胞因子的浓缩液,完成第一次浓缩;第一次浓缩后按相同步骤进行第二次浓缩,得到脐带血干细胞活性因子浓缩液,在-20℃条件下保存,备用。
58.实施例4
59.制备脐带血干细胞活性因子浓缩液,包括如下步骤:
60.制备脐带血干细胞活性因子浓缩液,包括如下步骤:
61.在生产结束胎盘脱落后,将含有抗凝剂的采血袋针头插入脐静脉中,一边采集一边晃动血袋,以充分混合血液和抗凝剂,低温保存,备用;
62.将脐带血采用密度梯度法分离后与等量生理盐水混合得到血液稀释液,将血液稀释液与分离液按照3:1的体积比混合,在离心力为1000g的条件下离心25min,离心后自上而下分为血浆层、白膜层和红细胞层,吸取白膜层并且用生理盐水重悬获得第一次重悬液;将第一次重悬液在离心力为800g的条件下离心5min,离心完成后用msc培养液重悬获得第二次重悬液,将第二次重悬液接种至培养瓶中,接种量为培养瓶容积的1/5;
63.培养瓶中脐带血干细胞原代培养48h后换液,待培养瓶中的细胞生长至培养瓶的甁壁面积的90%时进行传代培养,细胞传代至第3代后加入消化液,消化并收集细胞,依次进行无菌检测、内毒素检测、流失表型、细胞计数及活力检测;收集培养过程中产生的所有培养上清液,无菌冷藏备用;
64.将脐带血干细胞培养过程中收集的培养上清液转移至离心管中,在1500r/min的条件下离心10min分别收集离心后的细胞上清液,将上清液在1.0bar的压力下用30kd的超滤膜包进行超滤透析,取透析液;将透析液通过3kd超滤膜,收集含有大量细胞因子的浓缩液,完成第一次浓缩;第一次浓缩后按相同步骤进行第二次浓缩,得到脐带血干细胞活性因子浓缩液,在-20℃条件下保存,备用。
65.实施例5
66.请参阅图1,制备治疗子宫内膜损伤干细胞活性因子制剂,包括如下步骤:
67.步骤一、采集原料:
68.将采集的新鲜脐带放置于装有150ml采集液的培养皿中,备用;在生产结束胎盘脱落后,将含有抗凝剂的采血袋针头插入脐静脉中,一边采集一边晃动血袋,以充分混合血液和抗凝剂,低温保存,备用;
69.步骤二、脐带组织块接种:
70.用手术剪截取8cm的脐带段,将脐带段转移至灭菌后的培养皿中,加入质量分数为75%的乙醇溶液,将脐带在乙醇溶液中浸泡并翻转,消毒50s,去除消毒后的脐带段上的动脉和静脉,用缓冲液a清洗至无血块;沥干水分后将处理好的脐带段放入烧瓶中并剪碎,获得直径为2mm的组织块;将组织块接种到带有dmem培养基的培养皿中,使各组织块之间的距离<1cm,接种完成后将装有组织块的培养皿倒置于二氧化碳培养箱中处理2h;
71.步骤三、脐带间充质干细胞原代培养:
72.向接种有二氧化碳处理后的组织块的培养皿中加入培养皿容积1/5量的msc培养液,置于恒温培养箱内进行原代培养;控制恒温培养箱内的温度为37℃、二氧化碳浓度为
5%;培养过程中观察到细胞明显的贴壁后,间隔3天更换一次msc培养液,共培养24天;
73.步骤四、脐带间充质干细胞传代培养:
74.收集培养好的原代细胞,去除培养皿内的上清后用2.5ml缓冲液a清洗并去除废液,加入1.5ml的消化液在培养箱中消化培养8min;消化培养后,向培养皿中加入1.5ml终止液,用移液枪吹打培养皿使附着的细胞完全脱落,得到细胞悬液,将细胞悬液转移至50ml的离心管中,在1200r/min的条件下离心8min,去除上清后加入1ml的msc培养液重悬细胞,再加入6ml的dmem培养基混合均匀,计数后接种进培养瓶中并放置于二氧化碳培养箱中培养,控制每个培养瓶中的细胞数为1.5
×
106个;
75.待培养瓶中的细胞生长至培养瓶的甁壁面积的85%时进行传代培养,传代培养的具体步骤如下:
76.首先取原有的dmem培养基,在生物安全柜中使用dpbs缓冲液或生理盐水进行清洗2次;去除废液并加入适量的消化液消化4min,直到细胞脱离培养瓶;加入终止液终止消化,吸取细胞悬液转移至50ml离心管中,在1300r/min的条件下离心8min,弃上清,用移液枪吹打均匀后用细胞计数板的选取1.5
×
106个细胞加入msc培养液,在二氧化碳浓度为5%、37℃饱和湿度的条件下进行传代;待细胞传代至第3代后用消化液消化并收集细胞,进行无菌检测,内毒素检测,流失表型、细胞计数及活力检测,收集培养过程中产生的所有培养上清,冷藏备用;
77.步骤五、脐带血干细胞原代分离:
78.将脐带血采用密度梯度法分离后与等量生理盐水混合得到血液稀释液,将血液稀释液与分离液按照2.5:1的体积比混合,在离心力为800g的条件下离心20min,离心后自上而下分为血浆层、白膜层和红细胞层,吸取白膜层并且用生理盐水重悬获得第一次重悬液;将第一次重悬液在离心力为500g的条件下离心5min,离心完成后用msc培养液重悬获得第二次重悬液,将第二次重悬液接种至培养瓶中,接种量为培养瓶容积的1/5;
79.步骤六、脐带血干细胞换液、传代培养:
80.培养瓶中脐带血干细胞原代培养48h后换液,待培养瓶中的细胞生长至培养瓶的甁壁面积的85%时进行传代培养,细胞传代至第3代后加入消化液,消化并收集细胞,依次进行无菌检测、内毒素检测、流失表型、细胞计数及活力检测;收集培养过程中产生的所有培养上清液,无菌冷藏备用;
81.步骤七、制备活性因子浓缩液:
82.分别将脐带间充质干细胞和脐带血干细胞培养过程中收集的培养上清液转移至不同的离心管中,两次浓缩后,分别得到脐带间充质干细胞活性因子浓缩液和脐带血干细胞活性因子浓缩液,在-20℃条件下保存,备用;
83.步骤八、制备双重干细胞活性因子组合制剂:
84.将脐带间充质干细胞活性因子浓缩液与脐带血干细胞活性因子浓缩液按照1ml:3ml的用量比混合,制得双重干细胞活性因子组合浓缩液,将1ml双重干细胞活性因子组合浓缩液用无菌注射器吸注射到100ml无菌生理盐水中,制成治疗子宫内膜损伤干细胞活性因子制剂。
85.实施例6
86.请参阅图1,制备治疗子宫内膜损伤干细胞活性因子制剂,包括如下步骤:
87.步骤一、采集原料:
88.将采集的新鲜脐带放置于装有150ml采集液的培养皿中,备用;在生产结束胎盘脱落后,将含有抗凝剂的采血袋针头插入脐静脉中,一边采集一边晃动血袋,以充分混合血液和抗凝剂,低温保存,备用;
89.步骤二、脐带组织块接种:
90.用手术剪截取8cm的脐带段,将脐带段转移至灭菌后的培养皿中,加入质量分数为75%的乙醇溶液,将脐带在乙醇溶液中浸泡并翻转,消毒50s,去除消毒后的脐带段上的动脉和静脉,用缓冲液a清洗至无血块;沥干水分后将处理好的脐带段放入烧瓶中并剪碎,获得直径为2mm的组织块;将组织块接种到带有dmem培养基的培养皿中,使各组织块之间的距离<1cm,接种完成后将装有组织块的培养皿倒置于二氧化碳培养箱中处理2h;
91.步骤三、脐带间充质干细胞原代培养:
92.向接种有二氧化碳处理后的组织块的培养皿中加入培养皿容积1/5量的msc培养液,置于恒温培养箱内进行原代培养;控制恒温培养箱内的温度为37℃、二氧化碳浓度为5%;培养过程中观察到细胞明显的贴壁后,间隔3天更换一次msc培养液,共培养24天;
93.步骤四、脐带间充质干细胞传代培养:
94.收集培养好的原代细胞,去除培养皿内的上清后用2.5ml缓冲液a清洗并去除废液,加入1.5ml的消化液在培养箱中消化培养8min;消化培养后,向培养皿中加入1.5ml终止液,用移液枪吹打培养皿使附着的细胞完全脱落,得到细胞悬液,将细胞悬液转移至50ml的离心管中,在1200r/min的条件下离心8min,去除上清后加入1ml的msc培养液重悬细胞,再加入6ml的dmem培养基混合均匀,计数后接种进培养瓶中并放置于二氧化碳培养箱中培养,控制每个培养瓶中的细胞数为1.5
×
106个;
95.待培养瓶中的细胞生长至培养瓶的甁壁面积的85%时进行传代培养,传代培养的具体步骤如下:
96.首先取原有的dmem培养基,在生物安全柜中使用dpbs缓冲液或生理盐水进行清洗2次;去除废液并加入适量的消化液消化4min,直到细胞脱离培养瓶;加入终止液终止消化,吸取细胞悬液转移至50ml离心管中,在1300r/min的条件下离心8min,弃上清,用移液枪吹打均匀后用细胞计数板的选取1.5
×
106个细胞加入msc培养液,在二氧化碳浓度为5%、37℃饱和湿度的条件下进行传代;待细胞传代至第3代后用消化液消化并收集细胞,进行无菌检测,内毒素检测,流失表型、细胞计数及活力检测,收集培养过程中产生的所有培养上清,冷藏备用;
97.步骤五、脐带血干细胞原代分离:
98.将脐带血采用密度梯度法分离后与等量生理盐水混合得到血液稀释液,将血液稀释液与分离液按照2.5:1的体积比混合,在离心力为800g的条件下离心20min,离心后自上而下分为血浆层、白膜层和红细胞层,吸取白膜层并且用生理盐水重悬获得第一次重悬液;将第一次重悬液在离心力为500g的条件下离心5min,离心完成后用msc培养液重悬获得第二次重悬液,将第二次重悬液接种至培养瓶中,接种量为培养瓶容积的1/5;
99.步骤六、脐带血干细胞换液、传代培养:
100.培养瓶中脐带血干细胞原代培养48h后换液,待培养瓶中的细胞生长至培养瓶的甁壁面积的85%时进行传代培养,细胞传代至第3代后加入消化液,消化并收集细胞,依次
进行无菌检测、内毒素检测、流失表型、细胞计数及活力检测;收集培养过程中产生的所有培养上清液,无菌冷藏备用;
101.步骤七、制备活性因子浓缩液:
102.分别将脐带间充质干细胞和脐带血干细胞培养过程中收集的培养上清液转移至不同的离心管中,两次浓缩后,分别得到脐带间充质干细胞活性因子浓缩液和脐带血干细胞活性因子浓缩液,在-20℃条件下保存,备用;
103.步骤八、制备双重干细胞活性因子组合制剂:
104.将脐带间充质干细胞活性因子浓缩液与脐带血干细胞活性因子浓缩液按照3ml:1ml的用量比混合,制得双重干细胞活性因子组合浓缩液,将2ml双重干细胞活性因子组合浓缩液用无菌注射器吸注射到100ml无菌生理盐水中,制成治疗子宫内膜损伤干细胞活性因子制剂。
105.实施例7:
106.请参阅图1,制备治疗子宫内膜损伤干细胞活性因子制剂,包括如下步骤:
107.步骤一、采集原料:
108.将采集的新鲜脐带放置于装有150ml采集液的培养皿中,备用;在生产结束胎盘脱落后,将含有抗凝剂的采血袋针头插入脐静脉中,一边采集一边晃动血袋,以充分混合血液和抗凝剂,低温保存,备用;
109.步骤二、脐带组织块接种:
110.用手术剪截取8cm的脐带段,将脐带段转移至灭菌后的培养皿中,加入质量分数为75%的乙醇溶液,将脐带在乙醇溶液中浸泡并翻转,消毒50s,去除消毒后的脐带段上的动脉和静脉,用缓冲液a清洗至无血块;沥干水分后将处理好的脐带段放入烧瓶中并剪碎,获得直径为2mm的组织块;将组织块接种到带有dmem培养基的培养皿中,使各组织块之间的距离<1cm,接种完成后将装有组织块的培养皿倒置于二氧化碳培养箱中处理2h;
111.步骤三、脐带间充质干细胞原代培养:
112.向接种有二氧化碳处理后的组织块的培养皿中加入培养皿容积1/5量的msc培养液,置于恒温培养箱内进行原代培养;控制恒温培养箱内的温度为37℃、二氧化碳浓度为5%;培养过程中观察到细胞明显的贴壁后,间隔3天更换一次msc培养液,共培养24天;
113.步骤四、脐带间充质干细胞传代培养:
114.收集培养好的原代细胞,去除培养皿内的上清后用2.5ml缓冲液a清洗并去除废液,加入1.5ml的消化液在培养箱中消化培养8min;消化培养后,向培养皿中加入1.5ml终止液,用移液枪吹打培养皿使附着的细胞完全脱落,得到细胞悬液,将细胞悬液转移至50ml的离心管中,在1200r/min的条件下离心8min,去除上清后加入1ml的msc培养液重悬细胞,再加入6ml的dmem培养基混合均匀,计数后接种进培养瓶中并放置于二氧化碳培养箱中培养,控制每个培养瓶中的细胞数为1.5
×
106个;
115.待培养瓶中的细胞生长至培养瓶的甁壁面积的85%时进行传代培养,传代培养的具体步骤如下:
116.首先取原有的dmem培养基,在生物安全柜中使用dpbs缓冲液或生理盐水进行清洗2次;去除废液并加入适量的消化液消化4min,直到细胞脱离培养瓶;加入终止液终止消化,吸取细胞悬液转移至50ml离心管中,在1300r/min的条件下离心8min,弃上清,用移液枪吹
打均匀后用细胞计数板的选取1.5
×
106个细胞加入msc培养液,在二氧化碳浓度为5%、37℃饱和湿度的条件下进行传代;待细胞传代至第3代后用消化液消化并收集细胞,进行无菌检测,内毒素检测,流失表型、细胞计数及活力检测,收集培养过程中产生的所有培养上清,冷藏备用;
117.步骤五、脐带血干细胞原代分离:
118.将脐带血采用密度梯度法分离后与等量生理盐水混合得到血液稀释液,将血液稀释液与分离液按照2.5:1的体积比混合,在离心力为800g的条件下离心20min,离心后自上而下分为血浆层、白膜层和红细胞层,吸取白膜层并且用生理盐水重悬获得第一次重悬液;将第一次重悬液在离心力为500g的条件下离心5min,离心完成后用msc培养液重悬获得第二次重悬液,将第二次重悬液接种至培养瓶中,接种量为培养瓶容积的1/5;
119.步骤六、脐带血干细胞换液、传代培养:
120.培养瓶中脐带血干细胞原代培养48h后换液,待培养瓶中的细胞生长至培养瓶的甁壁面积的85%时进行传代培养,细胞传代至第3代后加入消化液,消化并收集细胞,依次进行无菌检测、内毒素检测、流失表型、细胞计数及活力检测;收集培养过程中产生的所有培养上清液,无菌冷藏备用;
121.步骤七、制备活性因子浓缩液:
122.分别将脐带间充质干细胞和脐带血干细胞培养过程中收集的培养上清液转移至不同的离心管中,两次浓缩后,分别得到脐带间充质干细胞活性因子浓缩液和脐带血干细胞活性因子浓缩液,在-20℃条件下保存,备用;
123.步骤八、制备双重干细胞活性因子组合制剂:
124.将脐带间充质干细胞活性因子浓缩液与脐带血干细胞活性因子浓缩液按照2ml:2ml的用量比混合,制得双重干细胞活性因子组合浓缩液,将3ml双重干细胞活性因子组合浓缩液用无菌注射器吸注射到100ml无菌生理盐水中,制成治疗子宫内膜损伤干细胞活性因子制剂。
125.需要说明的是,在本文中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
126.尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1