特异靶向脉冲电场消融术后炎症区的仿生载药纳米粒及制备方法
1.本技术涉及细胞治疗和中性粒细胞膜仿生纳米药物领域,尤其涉及一种特异靶向脉冲电场消融术后炎症区的仿生载药纳米粒及制备方法。
背景技术:
2.近些年,随着细胞电生理学的发展,一种新型的脉冲电场消融技术应运而生。与传统消融技术(射频消融、微波消融、激光消融等)不同,脉冲电场消融通过极短但强的电脉冲作用于肿瘤细胞膜,在细胞膜上形成不可逆“纳米级”孔道,从而导致细胞稳态失衡,诱导肿瘤细胞凋亡,更重要的是,构成血管、神经和胰胆管等的骨架成分因不含脂质双分子层可得以保留。这种选择性灭活肿瘤而不损伤周围重要结构的特性,使得脉冲电场消融在肿瘤治疗中展现出独特的优势。研究表明,脉冲电场消融可激活肿瘤区域炎性因子的释放,招募中性粒细胞以阿米巴运动的方式从内皮细胞连接处溢出,到达消融部位。
3.纳米药物为肿瘤治疗提供了全新的思路,将化疗药物进行纳米化修饰在肿瘤治疗领域凸显了多方面优势,如:1)显著改善药物的溶解性、稳定性,延长半衰期;2)纳米药物对肿瘤具有靶向效应,可明显增加肿瘤内药物的富集,从而提高药物浓度;3)利用肿瘤区域的特殊微环境精确释放药物,增加药效;4)纳米药物可扭转肿瘤的耐药性;5)有效改善药物在体内分布,降低对肝、肾等器官的毒副作用。但是传统的纳米药物仍为一种外源性物质,在血液中易被非特异性蛋白质和生物分子黏附形成一种蛋白质环结构,这种结构很大程度上干扰了纳米药物与生物系统之间的相互作用,并且加快了纳米药物被免疫系统清除的速度。
4.因此,探索一种新型具有良好的生物相容性,可降低免疫原性,增加药物的靶向性的纳米材料,成为近几年纳米载体领域的研究焦点。仿生型纳米粒作为一种新型递药系统,将载药纳米粒与细胞或蛋白等重组,模拟自身结构功能或体内物质等,解决了纳米粒所引起的生物相容性、免疫反应等问题,降低毒性,将药物靶向到病灶部位,使机体对药物产生最少的药物不良反应,是一种非常有发展前景的药物递送系统。
5.近年来,基于细胞膜包覆的仿生纳米药物已成为纳米医学领域的研究热点。该类纳米材料可通过天然细胞膜包覆纳米粒,赋予其独特的生物学特性,因而具备原细胞复杂而独特的表面理化性质。通过选择不同类型细胞膜,如红细胞、白细胞或者肿瘤细胞等的细胞膜,可明显提高纳米粒的靶向性,精确递送药物至肿瘤部位,发挥良好治疗效果。其中,中性粒细胞作为人体最丰富的白细胞(50~70%),其在炎性因子刺激下,可上调膜上的相关黏附分子表达,促进其在血管内翻转、粘附、爬行并快速向炎症组织聚集,成为最早到达炎症发生部位的血液细胞。
6.将中性粒细胞膜和镶嵌在膜上的各类粘附分子整体移植到纳米粒子表面,制备成中性粒细胞膜包覆纳米粒,具有以下几方面优势:1)可跨越血管内皮层靶向到具有炎症反应的组织;2)能识别并结合肿瘤而具有较强的肿瘤靶向性;
7.3)保留了中性粒细胞膜上“自我识别”的信号分子(如cd47,cd200等),可模拟自体成份,不易被机体识别,免疫原性低;4)提高药物的稳定性,延长药物的体内半衰期。因此,中性粒细胞膜包覆的纳米药物一经出现,即在抗肿瘤治疗领域表现出极大的发展潜力,引起广泛关注。
8.然而,由于中性粒细胞膜仿生纳米材料一般要用于抗肿瘤治疗,现有的制备方法中往往需要将中性粒细胞膜进行一系列活化流程以使其具备免疫特性,制备上流程较复杂,且活化步骤耗费成本较高。因此,研究一种操作简单,成本低,制备周期短的制备中性粒细胞膜仿生载药脂质体的方法,具有十分重要的意义。
技术实现要素:
9.有鉴于此,本技术实施例的目的是提供一种操作简单、成本低、制备周期短的特异靶向脉冲电场消融术后炎症区的仿生载药纳米粒及制备方法,以克服背景技术中提到的不足和缺陷。
10.根据本技术实施例的第一方面,提供一种特异靶向脉冲电场消融术后炎症区的仿生载药纳米粒的制备方法,该方法包括:将激活的中性粒细胞通过渗透压梯度法获得中性粒细胞膜,再与载药脂质体混合,对得到的混合物通过纳米挤出器进行处理,得到中性粒细胞膜载药纳米粒。
11.优选地,通过纳米挤出器进行反复处理,可以得到粒径较均一的中性粒细胞膜载药纳米粒。
12.优选地,所述中性粒细胞为动物外周血分离得到。
13.优选地,收集从同种类动物外周血分离得到中性粒细胞,将其进行体外诱导从而上调相关粘附分子的表达。
14.优选地,所述动物是小鼠或者大鼠。
15.优选地,所述载药脂质体的制备如下:
16.(1)将dppc、ch、dspc按照摩尔比为(5-7):(1-2):(1-2)完全溶于氯仿中,混匀,用氮气流除去溶剂使其在试管壁上形成一层薄膜,后抽真空;
17.(2)称取药物溶于水中,再吸入所述试管中,在水浴超声一段时间,制成载药脂质体。
18.优选地,所述抽真空的时间为4h以上。
19.优选地,所述水浴的温度为60℃-65℃。
20.优选地,所述药物选自普通化学药物、sirna药物、mrna药物、dna药物、蛋白药物、多肽类药物、免疫增强剂、免疫抑制剂、免疫佐剂中的一种或多种的混合。
21.优选地,所述普通化学药物可以为亲水、疏水性药物或双亲性化学药物。
22.优选地,脉冲电场消融的技术包括纳米刀、纳秒刀、皮秒刀。
23.根据本技术实施例的第二方面,提供由第一方面所述的制备方法制备得到的特异靶向脉冲电场消融术后炎症区的仿生载药纳米粒,包括:载药脂质体,以及包覆于所述载药脂质体表面的中性粒细胞膜。
24.本技术的实施例提供的技术方案可以包括以下有益效果:
25.由上述实施例可知,本技术利用中性粒细胞对炎症部位具有高度的驱化能力,能
聚集在炎症部位等特性,创造性的将中性粒细胞膜包裹在载药脂质体的表面,制备成具有靶向能力的中性粒细胞膜靶向载药纳米粒。利用中性粒细胞天然募集至炎症部位的原理,靶向炎症状态的病灶并释放药物,从而治疗病灶。
26.本技术制得的仿生载药纳米粒不同于一种或者多种分子修饰的主动靶向纳米粒子,该仿生载药纳米粒在特异靶向炎症部分具有其独特的优势。
27.另外,本发明的制备方法,操作简单,成本低,制备周期短。激活的中性粒细胞膜表面相关黏附分子能高度靶向炎症部位;脂质体载药能力强,对所载药物有广泛的适应性,生物利用度高;纳米粒利用中性粒细胞膜的伪装,能够逃避自身单核巨噬细胞的吞噬,有别于传统的聚乙二醇修饰,为实现制剂的长循环提供新思路;生物相容性和安全性高:载药脂质体表面包覆的中性粒细胞膜不存在遗传物质以及细胞器等,免疫原性极低;内核为fda所认可的生物可降解材料;因此具有较高的安全性和医学转化前景。本发明制备得到的中性粒细胞膜仿生载药纳米粒,以dppc、ch、dspc作为脂质体的外壳,其内包裹治疗药物,外壳表面包裹中性粒细胞膜,使纳米粒具有主动靶向炎症部位的能力,从而提高药物对炎症部位的靶向治疗作用。
28.应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本技术。
附图说明
29.此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本技术的实施例,并与说明书一起用于解释本技术的原理。
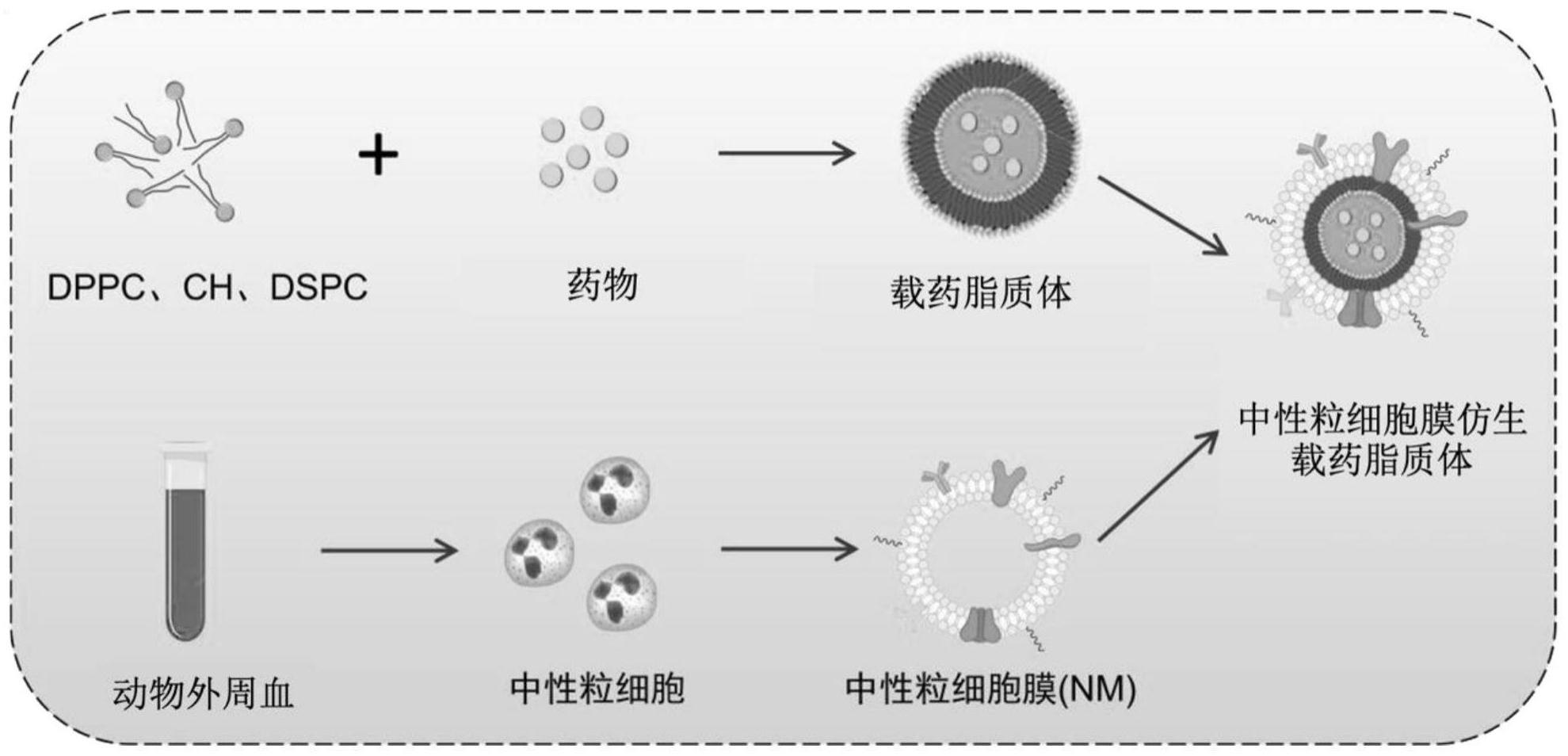
30.图1为一实施例提供的特异靶向脉冲电场消融术后炎症区的仿生载药纳米粒的制备方法流程示意图。
31.图2为一实施例提供的特异靶向脉冲电场消融术后炎症区的仿生载药纳米粒的电镜表征。
32.图3为一实施例提供的特异靶向脉冲电场消融术后炎症区的仿生载药纳米粒的粒径表征。
具体实施方式
33.这里将详细地对示例性实施例进行说明,其示例表示在附图中。下面的描述涉及附图时,除非另有表示,不同附图中的相同数字表示相同或相似的要素。以下示例性实施例中所描述的实施方式并不代表与本技术相一致的所有实施方式。相反,它们仅是与如所附权利要求书中所详述的、本技术的一些方面相一致的装置和方法的例子。
34.在本技术使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本技术。在本技术和所附权利要求书中所使用的单数形式的“一种”、“所述”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。还应当理解,本文中使用的术语“和/或”是指并包含一个或多个相关联的列出项目的任何或所有可能组合。
35.实施例1:
36.图1为一实施例提供的特异靶向脉冲电场消融术后炎症区的仿生载药纳米粒的制备方法流程示意图。本实施例提供的特异靶向脉冲电场消融术后炎症区的仿生载药纳米粒
的制备方法包括以下步骤:
37.选用小鼠或者大鼠,本实例选用小鼠,小鼠5%水合氯醛麻醉后,心脏取血于加入肝素的ep管中。取一支50ml离心管,按照试剂盒说明书小心加入小鼠外周血中性粒细胞分离液,再小心加入血液样本,500g离心25min。离心后,小心吸取下层细胞中性粒细胞层,然后加入3倍细胞体积的红细胞裂解液,轻轻吹打混匀,裂解10min,300g离心10min,弃红色上清。重复裂解步骤一次,即得中性粒细胞。向所得细胞中加入10ml pbs混匀细胞,250g离心10min,弃上清。重复清洗步骤,加入lps(一种脂多糖)激活所获得的中性粒细胞,将其进行体外诱导从而上调相关粘附分子的表达,采用渗透压梯度法获得中性粒细胞膜。
38.将dppc、ch、dspc按照摩尔比为7:1:2完全溶于氯仿中,在涡旋混合器上混匀。用氮气流除去溶剂使其在试管壁上形成一层均匀的薄膜,抽真空4h以上。称取适量的药物溶于水中,再吸入磷脂膜试管中,在65℃水浴超声一段时间,制成载药脂质体。这里的药物选自普通化学药物、sirna药物、mrna药物、dna药物、蛋白药物、多肽类药物、免疫增强剂、免疫抑制剂、免疫佐剂中的一种或多种的混合。所述普通化学药物可以为亲水、疏水性药物或双亲性化学药物。可以根据实际需求进行药物的选择。
39.将激活好的中性粒细胞膜与载药脂质体混合,通过纳米挤出器反复处理,制备得到的粒径较均一的中性粒细胞膜仿生载药纳米粒。
40.实施例2:
41.本实施例与实施例1的区别在于:将dppc、ch、dspc按照摩尔比为5:2:1完全溶于氯仿中,在60℃水浴超声一段时间。
42.实施例3:
43.将实施例1所获得的载药脂质体、中性粒细胞膜和中性粒细胞膜仿生载药纳米粒进行透射电镜检测。透射电镜结果图见图2。
44.结果显示:载药脂质体的电镜图为图2中的a,可见圆形、粒径均一的脂质体,分散系好;中性粒细胞膜的电镜图为图2中的b,可见双层细胞膜结构;中性粒细胞膜仿生载药纳米粒的电镜图为图2中的c,可见双层细胞膜内包裹圆形载药纳米粒。
45.实施例4:
46.将实施例1所获得的中性粒细胞膜仿生载药纳米粒进行粒度测定仪检测。粒度检测结果图见图3。
47.结果显示:中性粒细胞膜仿生载药纳米粒的粒径为100nm左右。
48.总的来说,本发明的制备方法,操作简单,成本低,制备周期短。制备得到的中性粒细胞膜仿生纳米材料为大小均一、外观圆整的球形结构,具有主动靶向炎症部位的能力,从而提高药物对炎症部位的靶向治疗作用。
49.本领域技术人员在考虑说明书及实践这里公开的内容后,将容易想到本技术的其它实施方案。本技术旨在涵盖本技术的任何变型、用途或者适应性变化,这些变型、用途或者适应性变化遵循本技术的一般性原理并包括本技术未公开的本技术领域中的公知常识或惯用技术手段。说明书和实施例仅被视为示例性的,本技术的真正范围和精神由权利要求指出。
50.应当理解的是,本技术并不局限于上面已经描述并在附图中示出的精确结构,并且可以在不脱离其范围进行各种修改和改变。本技术的范围仅由所附的权利要求来限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1