一种顺式乌头酸酐键阿霉素/人血清白蛋白(CAD/HSA)组合物及其制备方法和应用
一种顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)组合物及其制备方法和应用
技术领域
1.本发明属于靶向药物技术领域,具体涉及阿霉素偶联白蛋白的药物制剂及其制备方法和应用。
背景技术:
2.癌症化疗中面临的一个主要问题是化疗药物缺乏对肿瘤细胞或组织的选择性或靶向性,这样药物容易对正常的细胞和组织造成损害。阿霉素属于蒽环类抗生素,是最有效的细胞毒性药物之一,可用作多种癌症的化疗药物,但同时也会对其他正常细胞和组织,特别是心脏、神经、骨髓产生严重毒副作用,因此需要对阿霉素进行相应处理,设计一种高效的药物靶向递送体系尤为重要。
3.尽管目前已有相关专利公开了阿霉素与白蛋白偶联的组合物,但是都有多个缺点,因此需要改善组成结构和制备方法使得组合物的安全性更高以及肿瘤杀伤作用更强,同时使得工艺流程更简便高效。
技术实现要素:
4.有鉴于此,本发明制备的一种顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)组合物具有酸性敏感特性,且有一定的肿瘤靶向性,可以降低游离阿霉素所导致的心脏和肾脏毒性。
5.为实现上述目的,本发明提供如下技术方案:
6.本发明提供了一种顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)组合物,所述组合物由摩尔比为5~10:1的顺式乌头酸酐键阿霉素和人血清白蛋白制成。
7.优选的,所述组合物由摩尔比为10:1的顺式乌头酸酐键阿霉素和人血清白蛋白制成。
8.本发明还提供了一种顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)组合物的制备方法,所述组合物的制备方法为:将顺乌头酸酐阿霉素(cad)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐(edci)与n-羟基琥珀酰亚胺(nhs)溶于ph6-8的缓冲液中,进行第一次避光搅拌反应,然后将溶于ph6-8的缓冲液的人血清白蛋白(hsa)加入,进行第二次搅拌反应,最后离心取上清液,经分离纯化得顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)组合物。
9.优选的,所述分离纯化具体为将上清液用25kd透析袋透析24小时,再用sephadex 25柱分离得顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)组合物。
10.优选的,所述制备方法中第一次避光搅拌反应4小时,第二次搅拌反应24小时。
11.优选的,所述制备方法中的缓冲液为磷酸盐缓冲液。
12.优选的,所述制备方法中缓冲液的ph为7.4。
13.优选的,所述制备方法中离心步骤的转速为4000rpm,时间为5分钟。
14.本发明的另一目的是提供一种顺式乌头酸酐键阿霉素/人血清白蛋白(fa/cad/hsa)组合物在制备治疗癌症药物中的应用。
15.优选的,所述的癌症为宫颈癌、黑色素瘤、急性白血病、恶性淋巴瘤、乳腺癌、支气管肺癌、卵巢癌、软组织肉瘤、成骨肉瘤、横纹肌肉瘤、尤文肉瘤、母细胞瘤、神经母细胞瘤、膀胱癌、甲状腺癌、前列腺癌、头颈部鳞癌、睾丸癌、胃癌、肝癌。
16.优选的,所述的癌症为肝癌。
17.本发明还提供了一种顺式乌头酸酐键阿霉素/人血清白蛋白(fa/cad/hsa)组合物加入药学上可接受的辅料制备成水针剂或粉针剂。
18.本发明的有益效果:
19.(1)本发明制备的顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)组合物具有肿瘤ph敏感释药特性和一定的肿瘤靶向性,能够提高药物在肿瘤部位的蓄积,降低阿霉素治疗过程中带来的心脏和肾脏毒性,有益于提高临床使用的安全性。
20.(2)本发明的顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)组合物制备工艺简单,适用于大量生产。
21.(3)本发明的顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)组合物能够加入药学上可接受的辅料制备成水针剂或粉针剂,用于制备治疗癌症药物,所述的癌症为急性白血病、恶性淋巴瘤、乳腺癌、支气管肺癌、卵巢癌、软组织肉瘤、成骨肉瘤、横纹肌肉瘤、尤文肉瘤、母细胞瘤、神经母细胞瘤、膀胱癌、甲状腺癌、前列腺癌、头颈部鳞癌、睾丸癌、胃癌、肝癌。
附图说明
22.图1为本发明cad/hsa的紫外扫描谱图;1为cad,2为hsa,3为cad/hsa。
23.图2为本发明cad/hsa的傅立叶变换红外吸收光谱(ftir)图;a为cad,b为hsa,c为cad/hsa。
24.图3为本发明cad/hsa中的dox在不同ph条件下的体外释放图。
25.图4为本发明的cad/hsa在hepg2细胞和293t细胞中的mtt实验图。
具体实施方式
26.本发明公开了一种顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)组合物及其制备方法和应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。以下提供具体实施例以实现本发明技术,但不限于这些实施例。
27.实施例1 cad/hsa的制备工艺及表征
28.(1)顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)组合物的制备,所述顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)的摩尔比为20:10:1。
29.取7mg顺式乌头酸酐阿霉素(cad)、8mg 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐(edci)、6mg n-羟基琥珀酰亚胺(nhs)溶于3ml ph7.4的磷酸盐缓冲液中,避光搅拌4小时;
然后将66.7mg的人血清白蛋白(hsa)溶于2ml ph7.4的磷酸盐缓冲液中,将反应液加入人血清白蛋白(hsa)溶液中,室温搅拌24小时,最后4000rpm,5min离心取上清液,25kd透析袋透析24小时,用sephadex 25柱分离游离的顺式乌头酸酐键阿霉素(cad),纯化产物冷冻干燥得顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)。
30.本发明所有实施例中所使用的顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)组合物均由本方法制得。
31.(2)顺式乌头酸酐键阿霉素/人血清白蛋白(cad/hsa)组合物合成的表征实验
32.紫外扫描:将上述(1)合成的cad/hsa组合物经sephadex 25柱纯化后,称取少量cad溶于dmso中配制成20μg/ml的溶液,hsa、cad/hsa溶于水中配制成2mg/ml的溶液,使用紫外分光光度计,在波长260-600nm间依次进行扫描紫外光谱进行分析。图1中纯化后的cad/hsa的紫外扫描图具有hsa、cad在280、363、480nm处的特征峰,表明cad/hsa成功合成。
33.红外扫描:分别称取1mg的cad、hsa、cad/hsa固体与200mg溴化钾在玛瑙乳钵中充分研磨20-30秒,再放入压片机中以8000kp/cm2压制溴化钾片,将样本片放入傅立叶变换红外吸收光谱仪中,测定红外谱图。图2的傅立叶变换红外吸收光谱(ftir)结果显示,cad/hsa中hsa的特征峰由3398cm-1
位移至3309cm-1
,这与多个cad中-cooh偶联至hsa形成酰胺键有关;1656cm-1
及1539cm-1
的峰则和cad中的苯环偶联至hsa导致峰形增强有关;这些都进一步证实cad/hsa成功合成。
34.实施例2 cad/hsa中dox偶联比的测定
35.采用胰蛋白酶水解法测定dox含量:称取5mg cad/hsa加入1ml 250μg/ml的牛胰蛋白酶,置于37℃的水浴锅中反应5小时后以10000rpm/min离心,2分钟后取上清液,再用紫外分光光度计测定490nm处的吸光值,代入490nm dox紫外标准曲线计算含量。
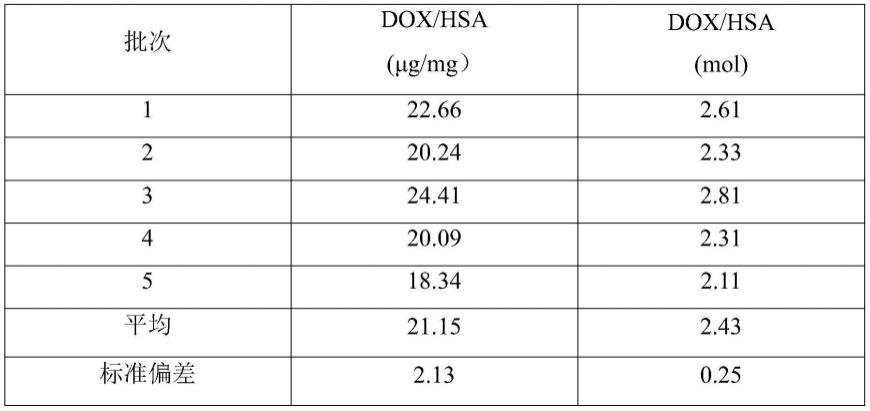
36.表1 5批cad/hsa中dox的含量
[0037][0038]
为了测定dox的偶联比,采用回归曲线测定水解后样品中的dox含量,dox的回归曲线y=0.01835x(μg/ml)+0.01558(r2=0.9992)。
[0039]
测定5批cad/hsa样品,计算得到摩尔比为dox:hsa=2~3:1(n=5)。表明hsa和dox能够在一定范围内进行偶联。
[0040]
实施例3 cad/hsa的体外酸性敏感释药实验
[0041]
分别称取5mg cad/hsa,依次用1ml ph3.5、5.0、7.4、9.0的缓冲溶液溶解并放入
25kda的透析袋中,将透析袋依次加入含相应ph的50ml体系的烧杯中,放置在37℃,70rpm/min的恒温摇床中,分别在1、2、4、8、12、24小时取每个透析袋外部缓冲液1ml,平行取三次,再补足相应的ph缓冲液至50ml,将每个时间点的样品用荧光分光光度计测定493nm的f值,代入dox荧光分光光度计标准曲线(y=138.6x+21.45,r2=0.9961),计算每个时间点dox的含量,绘制cad/hsa体外释放曲线,以研究cad/hsa对不同ph敏感响应。
[0042]
从图3看出,在酸性环境下cad/hsa释放更多的dox,在24小时后cad-hsa中dox释放量在ph3.5为72.08%,ph5.0为67.16%,ph7.4为37.55%,ph9.0为3.04%;ph5.0释放dox的量是ph7.4的1.8倍。表明cad/hsa在血液中更稳定,更容易在肿瘤弱酸性环境下释药。
[0043]
实施例4 cad/hsa对hepg2细胞和293t细胞的毒性实验
[0044]
mtt法测定细胞毒性:将hepg2(人肝癌细胞)和293t(人胚胎肾细胞)细胞系培养在含1%青霉素链霉素、10%胎牛血清的高糖dmem培养基中,并放置在37℃、5%co2的细胞培养箱中。当细胞处于对数生长期时,每个细胞系以5
×
103cells/ml的细胞密度接种在96孔板上。每个药物在6孔中进行测试。在对数期用游离dox、cad/hsa从低浓度0.3125μg/ml至高浓度20μg/ml呈两倍递增分为6组处理hepg2细胞;从低浓度0.15625μg/ml至高浓度5μg/ml呈两倍递增分为6组处理293t细胞,培养48小时后,向每个孔中添加mtt染料(20ml,5mg/ml)。再培养4小时后,加入100μl三联液,再培养12小时,在570nm处测定相对于未处理细胞的细胞存活率。
[0045]
从图4可知,在hepg2细胞中,cad/hsa与游离dox相比对hepg2细胞在高浓度时有着相似的细胞毒性,游离dox的ic
50
为3.768μg/ml,cad/hsa的ic
50
为5.222μg/ml。在293t细胞中,dox的ic
50
为0.4739μg/ml,cad/hsa的ic
50
为0.91943.526μg/ml,cad/hsa对293t细胞的细胞毒性低于游离dox。表明cad/hsa与游离dox相比具有对正常细胞较低的毒性,虽然抗肿瘤活性稍有降低,但安全性增加的程度大于肿瘤杀伤减弱程度,其作为药物的安全性增加,有益于临床应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1