一种纳米黑磷负载SDF-1的纳米药物复合体及其制备方法和应用与流程
一种纳米黑磷负载sdf-1的纳米药物复合体及其制备方法和应用
技术领域
1.本发明涉及生物技术领域,特别涉及一种纳米黑磷负载sdf-1的纳米药物复合体及其制备方法和应用。
背景技术:
2.干细胞(stem cells,scs)是原始且未完全分化的细胞,其具有分化再生成为多种组织器官的潜能。按干细胞来源可以分为外源性干细胞和内源性干细胞。目前,干细胞因其具备良好的自我更新、分化和分泌等功能已被广泛应用于组织器官损伤修复的研究中。已有大量研究揭示外源性干细胞可以通过分泌特定细胞因子或分化成特定细胞来修复受损组织,但是外源性干细胞存在一定的免疫排斥、肿瘤形成等安全风险难以进行临床应用转化,并且注射至体内的外源性干细胞无法精准靶向损伤组织和器官,其治疗效果有限。而内源性干细胞作为机体自身固有细胞而不存在上述安全问题。因此,内源性干细胞治疗有望成为组织器官损伤修复的安全有效方法。
3.近年来,随着对干细胞的研究不断深入,研究者证实干细胞的募集和归巢主要受基质细胞衍生因子-1/cxc族细胞因子受体4(stromal cell-derived factor-1/c-x-cmotif receptor 4,sdf-1/cxcr4)调节轴调控。sdf-1属于趋化因子cxc亚家族,其在骨髓、脑、心脏、肝脏等多种组织器官中广泛表达,而cxcr4是特异介导sdf-1功能的g蛋白偶联受体。在组织损伤修复过程中,sdf-1/cxcr4调节轴对干细胞的募集和重新分布起着关键作用,可通过招募干细胞并诱导其分化或调控相关细胞因子分泌的方式介导组织器官损伤修复。然而,sdf-1是一种小分子蛋白,注射到生物体后会随血液流动而分布全身,难以在靶组织和靶器官滞留并高效发挥募集干细胞的作用。因此,需要寻求有效的方法提高损伤部位sdf1的有效药物浓度和作用时长。
技术实现要素:
4.本发明为了解决上述技术问题,提供了一种纳米黑磷负载sdf-1的纳米药物复合体及其制备方法和应用。
5.第一方面,本发明提供了一种纳米黑磷负载sdf-1的纳米药物复合体的制备方法,是通过以下技术方案得以实现的。
6.一种纳米黑磷负载sdf-1的纳米药物复合体的制备方法,包括以下步骤:
7.s1.取含有纳米黑磷的分散液,离心后去上清,采用等量超纯水重悬,混匀后在冰水浴条件下超声,重复离心-等量超纯水重悬-冰水浴超声步骤2-3次,得到纳米黑磷水相分散液;
8.s2.向步骤s1得到的纳米黑磷分散液中加入sdf-1,纳米黑磷与sdf-1的质量比为(8-15):1;混匀后孵育0.5-1小时,离心去上清,采用等量超纯水重悬,再在冰水浴条件下超声,构建得到bp@sdf-1纳米药物复合体。
9.进一步的,步骤s1、s2中,离心条件为0-4℃,13000-14000rpm,15-18min。
10.进一步的,步骤s1、s2中,冰水浴超声的处理条件为30-40khz,100-120w,10-15min。
11.进一步的,纳米黑磷与sdf-1的质量比为10:1。
12.第二方面,本发明提供了一种纳米黑磷负载sdf-1的纳米药物复合体,是通过以下技术方案得以实现的。
13.一种上述制备方法制备得到的纳米黑磷负载sdf-1的纳米药物复合体。
14.第三方面,本发明提供了一种纳米黑磷负载sdf-1的纳米药物复合体的应用,是通过以下技术方案得以实现的。
15.一种上述纳米黑磷负载sdf-1的纳米药物复合体在制备修复组织损伤药物中的应用。
16.进一步的,纳米黑磷负载sdf-1的纳米药物复合体通过募集内源性干细胞来进行损伤组织的修复。
17.本技术具有以下有益效果。
18.本技术利用纳米黑磷装载sdf-1构建得到bp@sdf-1纳米药物复合体,通过局部注射的方式提高靶组织或靶器官中sdf-1的有效药物浓度并延长其局部滞留时间,从而更高效地募集内源性干细胞至损伤部位进行损伤组织的修复,从而提升治疗效果。同时,募集内源性干细胞修复受损的组织器官可以规避外源性干细胞应用带来的诸多风险,具有更高的生物安全性。
附图说明
19.图1是本发明bp和bp@sdf-1纳米药物复合体形貌结构表征图;
20.图2是本发明内源性干细胞标记效能评估图;
21.图3是本发明内源性干细胞在大鼠盆大神经节的募集效果图;
22.图4是本发明内源性干细胞在大鼠阴茎海绵体的募集效果图。
具体实施方式
23.本技术的纳米黑磷片层(bp)购自中科墨磷科技有限公司;
24.本技术的sdf-1购自peprotech公司。
25.1.构建纳米药物复合体(bp@sdf-1)
26.取bp(0.1mg/ml)1ml于ep管中,4℃高速离心(14000rpm,15min)后去上清,等量超纯水重悬,吹打混匀后冰水浴超声(40khz,100w,10min),重复高速离心-等量超纯水重悬-冰水浴超声步骤2次后,得到分散良好的bp水相分散系。随后向上述bp水相分散系中加入100μl sdf-1(100ug粉末溶于1ml超纯水),充分吹打混匀后置于37℃恒温孵育0.5小时,4℃高速离心(14000rpm,15min),去除上清中残留的sdf-1,等量超纯水重悬后冰水浴超声(40khz,100w,10min),最终构建得到bp@sdf-1纳米药物复合体。bp及bp@sdf-1相关表征结果见图1。
27.图1a为透射电子显微镜结果。如图所示,bp是超薄的纳米片层,平均横向尺寸主要在200-300nm之间;装载sdf-1后,bp形态未发生明显改变。图1b和1c为bp@sdf-1在超纯水中
的zeta电位和粒径结果。由图可知,纳米bp、sdf1、bp@sdf1在超纯水中的平均电位分别为-30.83mv、7.89mv和4.54mv;纳米bp和bp@sdf1在超纯水中的平均粒径分别198.7nm和625.8nm,纳米bp装载sdf1后粒径增大2倍以上。图1d为bp@sdf-1在超纯水中sdf-1释放程度随时间的变化关系,由图可知,sdf-1的释放量随时间的延长而增加,大约在装载后24h,纳米药物复合体中sdf-1释放量达装载总量的1/2。图1e为bp和bp@sdf-1在超纯水中bp的降解程度随时间的变化关系,由图可知,随着时间的推移,bp逐渐降解。从sdf-1装载后的第3天开始,bp@sdf-1组的bp降解量显著小于bp组的降解量,这说明sdf-1装载后可以减缓bp在超纯水中的降解。
28.2.标记内源性干细胞
29.本发明以大鼠为实验对象,将50mg 5-乙炔基-2’脱氧尿嘧啶核苷(5-ethynyl-2-deoxyuridine,edu)溶于400μl二甲基亚砜(dimethyl sulfoxide,dmso)溶液中,取适量(具体用量根据初生乳鼠体重计算,用量50mg/kg)edu溶液溶于50μl磷酸缓冲盐溶液(phosphate buffered solution,pbs)后注射至初生乳鼠腹腔中,继续饲养大鼠至8周龄。内源性干细胞标记相关实验结果见图2。
30.图2a为利用激光共聚焦显微镜采集大鼠阴茎组织冰冻切片荧光成像结果,图中灰色表示edu阳性的细胞核,即被edu标记的内源性干细胞。图2b为各个时间点大鼠阴茎海绵体组织中edu阳性细胞数量的统计结果。结合图2a和图2b可以看出,随着时间的推移,大鼠阴茎海绵体组织中的内源性干细胞数量逐渐减少,直至第7-8周时,每个高倍镜视野仍能见到约6-8个内源性干细胞。这表明通过初生乳鼠腹腔注射edu可以成功标记内源性干细胞,且有效标记时间可以长达8周及以上。
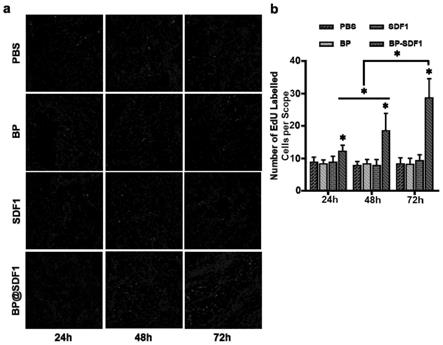
31.3.建立组织损伤动物模型
32.本发明以大鼠为实验对象,建立海绵体神经钳夹损伤模型。具体方法如下:
①
制备2%戊巴比妥溶液,以30mg/kg剂量注射至7周龄大鼠腹腔中;
②
待麻醉药生效后,将大鼠固定于动物手术固定台上,下腹部备皮,碘伏消毒2-3遍后铺无菌洞巾;
③
行下腹部正中切口,逐层切开腹壁组织至腹腔,充分暴露位于双侧前列腺侧叶的盆大神经节及海绵体神经;
④
在双侧海绵体神经远侧端距盆大神经节约5mm处钳夹海绵体神经3分钟,完成海绵体神经损伤模型的构建。
33.4.bp@sdf-1纳米药物复合体局部给药
34.取适量构建得到的bp@sdf-1纳米药物复合体(含24μg bp)重悬于100μl pbs溶液中备用。在损伤模型建立的基础上,
35.(1)将适量上述bp@sdf-1纳米药物复合体分别局部注射至大鼠双侧盆大神经节(6μl/侧)及海绵体神经受损部位(4μl/侧);
36.(2)将适量上述bp@sdf-1纳米药物复合体分别局部注射至双侧阴茎海绵体组织(25μl/侧)。
37.回纳相关脏器至腹腔后逐层缝合关闭腹腔,碘伏再次消毒伤口周围皮肤,待大鼠麻醉复苏后继续饲养。局部给药后内源性干细胞募集效果评估见附图3、附图4。
38.如图3所示,在该实验中,接受edu标记的7周龄大鼠随机分为四组(pbs组,bp组,sdf-1组和bp@sdf-1组),在海绵体神经损伤模型建立后于双侧盆大神经节及神经损伤部位分别注射pbs、bp、sdf-1、bp@sdf-1,于术后第1、2、3天收集大鼠双侧盆大神经节组织,经组
织切片、染色后激光共聚焦显微镜观察。图3a为该实验的激光共聚焦显微镜成像图。图中灰色表示edu阳性的细胞核,即被edu标记的内源性干细胞。图3b为各个时间点不同处理组的大鼠盆大神经节组织切片中edu阳性细胞数量的统计结果。结合图3a和图3b可以看出,与pbs处理组相比,在不同时间点上bp@sdf-1处理组的大鼠盆大神经节组织中edu阳性的细胞数目显著增多,而bp处理组或sdf-1处理组的对应细胞数量均未见明显变化。同时,随着时间的推移,bp@sdf-1处理组的大鼠盆大神经节组织中第3天募集的内源性干细胞数量显著多于第1天和第2天的募集数量,这表明bp@sdf-1纳米药物复合体可能通过持续释放sdf-1提高盆大神经节局部有效药物浓度并延长药物滞留时间的方式高效地募集内源性干细胞至盆大神经节。
39.如图4所示,在该实验中,接受edu标记的7周龄大鼠随机分为四组(pbs组,bp组,sdf-1组和bp@sdf-1组),在海绵体神经损伤模型建立后于双侧阴茎海绵体分别注射pbs、bp、sdf-1、bp@sdf-1,于术后第1、2、3天收集大鼠阴茎海绵体组织,经组织切片、染色后激光共聚焦显微镜观察。图4a为该实验的激光共聚焦显微镜成像图。图中灰色表示edu阳性的细胞核,即被edu标记的内源性干细胞。图4b为各个时间点不同处理组的大鼠阴茎海绵体组织切片中edu阳性细胞数量的统计结果。结合图4a和图4b可以看出,与pbs处理组相比,在不同时间点上bp@sdf-1处理组的大鼠阴茎海绵体组织中edu阳性的细胞数目显著增多,而bp处理组或sdf-1处理组的对应细胞数量均未见明显变化。同时,随着时间的推移,bp@sdf-1处理组的大鼠阴茎海绵体组织中第3天募集的内源性干细胞数量明显多于第1天和第2天的募集数量,这表明bp@sdf-1纳米药物复合体可能通过持续释放sdf-1提高阴茎海绵体局部有效药物浓度并延长药物滞留时间的方式高效地募集内源性干细胞至阴茎海绵体。
40.综上,本发明利用纳米黑磷装载sdf-1构建bp@sdf-1纳米药物复合体。在大鼠海绵体神经损伤模型中,将该纳米药物复合体局部注射至受损神经及盆大神经节处或阴茎海绵体,成功募集内源性干细胞至盆大神经节或阴茎海绵体。该研究的开展使内源性干细胞靶向、高效募集成为可能,同时为干细胞疗法在组织损伤修复治疗中提供了新的思路。
41.本具体实施方式的实施例均为本发明的较佳实施例,并非依此限制本发明的保护范围,故:凡依本发明的结构、形状、原理所做的等效变化,均应涵盖于本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1