一种栓塞物的制作方法
1.本发明涉及医疗器械技术领域,具体涉及一种栓塞物。
背景技术:
2.颅内动脉瘤是一种常见的脑血管疾病,其是由多种因素造成的颅内动脉壁结构破坏、管壁异常膨出,是引发蛛网膜下腔出血的重要原因之一。近年来,随着影像学和材料学的进步,推动了介入治疗颅内动脉瘤的迅猛发展,其中弹簧圈栓塞是一种常见治疗手段。弹簧圈栓塞动脉瘤,一方面可以减轻血流对动脉瘤瘤壁的冲击,另一方面能够诱导瘤腔内血栓形成和血栓机化,实现动脉瘤的闭塞。
3.临床研究发现,有较高比例的大型和巨大型动脉瘤是以占位效应起病。目前常见的用于介入治疗的弹簧圈多为惰性金属材质,对于占位效应的缓解或解除尚有欠缺。市面上已有的类似“生物修饰弹簧圈”概念的产品,这些产品利用可降解高分子材料对金属弹簧圈进行修饰,但所用的高分子材料的降解速率较快,通常在3-6个月内完全降解。然而,临床数据表明,在使用支架的情况下,内皮化的时间约为6个月,因此利用这些生物修饰弹簧圈产品进行动脉瘤的介入治疗时,若高分子材料在产品中的体积比例较高,则在高分子材料降解完全时,瘤腔内尚未完全机化形成纤维组织,因高分子材料的降解导致的栓塞密度下降存在动脉瘤再通的风险,但是若高分子材料在产品中的体积比例较小,瘤腔完全机化后又不能有效缓解占位效应。
技术实现要素:
4.本发明的目的在于提供一种栓塞物,其用于植入血管瘤的瘤腔以促进瘤腔内血栓机化,避免动脉瘤再通,且在瘤腔完全闭塞后有效缓解占位效应。
5.为实现上述目的,本发明提供了一种栓塞物,包括栓塞本体,所述栓塞本体为螺旋部件,且所述栓塞本体的材料是聚乳酸-羟基乙酸共聚物,且以重量百分比计,乳酸的比例为80%~85%,以使得所述栓塞本体在预定温度下的降解时间大于6个月。
6.可选地,所述聚乳酸-羟基乙酸共聚物的特性粘度为1.2dl/g~2.0dl/g,重均分子量为200000g/mol~500000g/mol。
7.可选地,所述栓塞本体由线材螺旋绕制形成,所述线材的断裂强度大于或等于200mpa,断裂伸长率大于或等于10%,热收缩率小于或等于25%。
8.可选地,所述聚乳酸-羟基乙酸共聚物的结晶度大于或等于40%。
9.可选地,聚乳酸-羟基乙酸共聚物的玻璃化转变温度为50℃~60℃。
10.可选地,所述栓塞本体为具有第一内腔的管状部件;所述栓塞物还包括显影元件,所述显影元件设置于所述第一内腔中,并与所述栓塞本体连接。
11.可选地,所述显影元件为不透射线金属制成的金属部件;或者,所述显影元件为基体中掺杂有显影物质的复合材料部件,其中,所述显影物质为碘造影剂或硫酸钡,所述基体为聚乳酸、聚己内酯聚羟基乙酸、乳酸-羟基乙酸共聚物、聚对二氧杂环己酮、聚氨酯、壳聚
糖和透明质酸中的任意一种或几种。
12.可选地,所述显影元件为具有第二内腔的管状部件,且所述显影元件的长度与所述栓塞本体的长度相匹配。
13.可选地,所述显影元件为螺旋部件,或者所述显影元件为管网状部件。
14.可选地,所述显影元件的体积与所述栓塞本体的体积之比小于或等于50%。
15.可选地,所述栓塞物还包括定型元件,所述定型元件设置于所述第二内腔中,并与所述栓塞本体连接,且用于使所述栓塞物保持为预设的形状。
16.可选地,所述栓塞本体为具有第一内腔的管状部件;所述栓塞物还包括定型元件,所述定型元件设置于所述第一内腔中并与所述栓塞本体连接,且用于使所述栓塞物保持为预设的形状。
17.可选地,所述定型元件的体积与所述栓塞本体的体积的比值小于或等于10%。
18.与现有技术相比,本发明的栓塞物具有如下优点:
19.前述的栓塞物包括栓塞本体,所述栓塞本体为螺旋部件,且所述栓塞本体的材料是聚乳酸-羟基乙酸共聚物,且以重量百分比计,乳酸的比例为80%~85%,以使得所述栓塞本体在预定温度下的降解时间大于6个月。所述预定温度是指与人体内环境温度,具体值为37℃左右,例如36.8℃~37.2℃。所述栓塞物用于植入血管瘤的瘤腔中,并促进血管瘤血栓化和机化,且该栓塞本体的降解速率较为适宜,能够配合瘤腔闭塞及瘤颈内皮化的时间,不会在瘤腔完全机化之前完成降解,有效避免血管瘤再通,且还能够缓解甚至解除占位效应。
20.所述聚乳酸-羟基乙酸共聚物的特性粘度为1.2dl/g~2.0dl/g,重均分子量为200000g/mol~500000g/mol。尤其地,所述栓塞本体由线材螺旋绕制而成,且所述线材的断裂强度大于或等于200mpa,断裂伸长率大于或等于10%,热收缩率小于或等于25%,该栓塞本体能够在所述预定温度下保持结构的稳定性,避免发生解旋,也就是说,所述栓塞物在体内可以保持为螺旋部件,并有效填塞瘤腔,促进瘤腔血栓化及机化。
附图说明
21.附图用于更好地理解本发明,不构成对本发明的不当限定。
22.图1是本发明根据一实施例所提供的栓塞物的结构示意图。
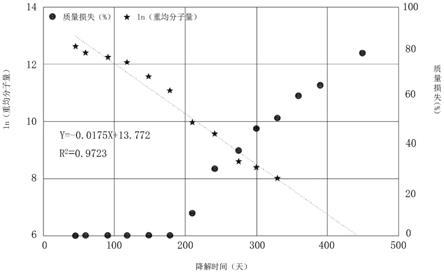
23.图2是本发明实施例所提供的栓塞物的栓塞本体在37℃条件下降解时的质量/重均分子量损失与时间的关系图。
24.图3是本发明实施例所提供的栓塞物的栓塞本体在37℃条件下降解120天时的扫描电镜图。
25.图4是本发明实施例所提供的栓塞物的栓塞本体在37℃条件下降解270天时的扫描电镜图。
26.图5是本发明实施例所提供的栓塞物的栓塞本体在50℃条件下降解14天时的扫描电镜图。
27.图6是本发明实施例所提供的栓塞物的栓塞本体在50℃条件下降解56天时的扫描电镜图。
28.图7是本发明根据一实施例所提供的栓塞物的结构示意图,图7与图1的区别在于
栓塞本体与显影元件的连接方式不同。
29.图8是本发明根据一实施例所提供的栓塞物的结构示意图,图中未示出栓塞本体与显影元件的连接方式。
30.图9是本发明根据一实施例所提供的栓塞物的结构示意图,图9中所示的显影元件的节距大于图8所示的显影元件的节距。
31.附图标记说明如下:100-栓塞物,110-栓塞本体,111-第一内腔,120-显影元件,121-第二内腔。
具体实施方式
32.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。需要说明的是,本实施例中所提供的图示仅以示意方式说明本发明的基本构想,遂图式中仅显示与本发明中有关的组件而非按照实际实施时的组件数目、形状及尺寸绘制,其实际实施时各组件的型态、数量及比例可为一种随意的改变,且其组件布局型态也可能更为复杂。
33.另外,以下说明内容的各个实施例分别具有一或多个技术特征,然此并不意味着使用本发明者必需同时实施任一实施例中的所有技术特征,或仅能分开实施不同实施例中的一部或全部技术特征。换句话说,在实施为可能的前提下,本领域技术人员可依据本发明的公开内容,并视设计规范或实作需求,选择性地实施任一实施例中部分或全部的技术特征,或者选择性地实施多个实施例中部分或全部的技术特征的组合,借此增加本发明实施时的弹性。
34.如在本说明书中所使用的,单数形式“一”、“一个”以及“该”包括复数对象,复数形式“多个”包括两个以上的对象,除非内容另外明确指出外。如在本说明书中所使用的,术语“或”通常是以包括“和/或”的含义而进行使用的,除非内容另外明确指出外,以及术语“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接。可以是机械连接,也可以是电连接。可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通或两个元件的相互作用关系。对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本发明中的具体含义。
35.在本文中,术语“近端”、“远端”是从使用该医疗器械的医生角度来看相对于彼此的元件或动作的相对方位、相对位置、方向,尽管“近端”、“远端”并非是限制性的,但是“近端”通常指该医疗设备在正常操作过程中靠近医生的一端,而“远端”通常是指首先进入患者体内的一端。
36.为使本发明的目的、优点和特征更加清楚,以下结合附图对本发明作进一步详细说明。需说明的是,附图均采用非常简化的形式且均使用非精准的比例,仅用以方便、明晰地辅助说明本发明实施例的目的。附图中相同或相似的附图标记代表相同或相似的部件。
37.图1示出了本发明一实施例所提供的栓塞物100的结构示意图,且图1所示的栓塞物100处于其线性初级形状。如图1所示,所述栓塞物100为从其近端延伸至其远端的长度较大的管状部件。所述栓塞物100的近端被设置用于与该栓塞物100的推送装置(图中未示出)
连接,以使所述栓塞物100能够被所述推送装置推送至目标位置。所述栓塞物100可以应用于血管疾病的介入治疗,所述目标位置可以是血管瘤的瘤腔,所述血管瘤例如是动脉瘤。
38.所述栓塞物100包括栓塞本体110,所述栓塞本体110是由线材螺旋绕制而成的螺旋部件。所述线材由聚乳酸-羟基乙酸共聚物制成,且以重量百分比计,聚乳酸-羟基乙酸共聚物的乳酸的比例为80%~85%,这使得所述线材在预定温度下的降解时间大于6个月。这里,所述预定温度是指患者的体腔温度,其值可以为36.8℃~37.2℃。所述降解时间是指所述线材完全降解所需要的时间。因此所述栓塞本体110的降解速率较为适宜,能够配合瘤腔闭塞及瘤颈内皮化的时间,不会在瘤腔完全机化之前完成降解,有效避免动脉瘤再通,且还能够缓解甚至解除占位效应。
39.聚乳酸-羟基乙酸共聚物可发生生物降解,降解的类型包括水解、热分解、光分解、酶分解等。当由聚乳酸-羟基乙酸共聚物制备而成的植入物植入瘤腔时,其主要发生酯键的水解反应,且该水解反应可优先在非晶区(当聚乳酸-羟基乙酸为半结晶型聚合物时)进行。酯键水解时释放出包括乳酸二聚体、乙醇酸-乳酸二聚体或其他小分子单体在内的乳酸性降解产物,反应方程为:
[0040][0041]
这些弱酸性降解产物可被机体代谢,同时这些弱酸性降解产物还可以改变局部组织生态微环境(例如改变瘤腔内的ph值),进而诱发炎症,刺激活血小板因子,并进一步激活机体的免疫细胞的免疫机制,促使瘤腔血栓化及机化。
[0042]
发明人研究发现,在乳酸比例为80%~85%的情况下,当聚乳酸-羟基乙酸共聚物的特性粘度为1.2dl/g~2.0dl/g、重均分子量为200000g/mol~500000g/mol时,聚乳酸-羟基乙酸共聚物为半结晶型聚合物,该聚乳酸-羟基乙酸共聚物的降解速度随温度发生变化,且该聚乳酸-羟基乙酸在37℃左右的条件下的降解时间较长,降解速度与血管瘤闭塞及瘤颈内皮化的时间相匹配。因此,可以利用乳酸比例为80%~85%、特性粘度为1.2dl/g~2.0dl/g、且重均分子量为200000g/mol~500000g/mol的聚乳酸-羟基乙酸共聚物来制造所述线材,进而制造所述栓塞本体110。所述栓塞本体110的降解特性具体将在后文中进行说明。实践中,用于制造所述栓塞本体110的聚乳酸-羟基乙酸共聚物的结晶度可不小于40%。
[0043]
可选地,所述线材的断裂强度大于或等于200mpa,断裂伸长率大于或等于10%,热收缩率小于或等于25%。在消除热历史之后,所述线材的玻璃化转变温度为50℃~60℃。所述线材沿一直径约为0.003”~0.010”的芯轴螺旋绕制以形成所述栓塞本体110,绕制转速为5r/s~50r/s,之后对所述栓塞本体110进行热处理以稳定其螺旋构型。所述栓塞本体110在所述预定温度(即37℃左右)下具有较为稳定的构型,不会发生解旋。另外,所述栓塞本体110的外径可以为0.008”~0.020”,其内径与所述线材的横截面积有关。可选地,所述线材的横截面可以为圆形,或圆形的一部分,其直径为0.001”~0.006”。所述线材的横截面也可以是其他形状,例如长方形、多边形等,本发明实施例对此不作限定。所述栓塞本体110的节距可以为所述线材的横截面积的直径(当所述线材的横截面积为圆形或圆形的一部分时)的1~2倍。
[0044]
接下去通过对比实验说明本发明实施例所提供的栓塞本体110的降解特性。
[0045]
实施例一:将本发明实施例制备的一栓塞本体110置于37℃的pbs缓冲液中进行降解实验,图2示出了所述栓塞本体110的质量/重均分子量损失与降解时间关系图。参考图2,在降解初期(1-200天),所述栓塞本体110的质量损失不明显,且所述栓塞本体110基本保持整体结构的完整性(如图3所示)。当降解进行到200~300天时,所述栓塞本体110的质量和重均分子量的损失基本达到50%,且所述栓塞本体110的整体完整性发生破坏(如图4所示)。从降解开始到降解进行至340天左右时,所述栓塞本体110的重均分子量的对数y与时间x的相关方程为:y=-0.0175x+13.772,相关系数r2为0.9723,降解过程基本符合一级降解规律。当降解进行到540天以上时,所述栓塞本体110的质量和重均分子量的损失均超过80%,所述栓塞本体110基本降解完全。在降解进行到200~300天时,还对所述栓塞本体110进行特性粘度的测试,测试结果显示其特性粘度损失也达到50%。同时,观察所述栓塞本体110的外观可确定其结构完整性发生破坏,并出现宏观断裂。
[0046]
实施例二:将本发明实施例制备的另一栓塞本体110置于50℃的pbs缓冲液中进行降解实验,并在降解的第14天和第56天对所述栓塞本体拍摄扫描电镜照片。如图5所示,当降解进行到第14天时,所述栓塞本体110的降解不明显,并基本保持整体完整性。如图6所示,当降解进行到第56天时,所述栓塞本体110的结构完整性发生破坏,所述栓塞本体110的特性粘度和重均分子量的损失均超过50%,且基本符合一级降解规律。在降解进行到8个月以上时,观察所述栓塞本体110的外观发现所述栓塞本体基本降解完全。
[0047]
对比例一:将一由乳酸含量约为10%的聚乳酸-羟基乙酸所制备的螺旋部件置于pbs缓冲液中,且在37℃的条件下进行降解。该螺旋部件与实施例一及实施例二所提供的栓塞本体110的区别之处仅在于原材料中的乳酸含量不同,以及,因乳酸含量不同使得该螺旋部件在消除热历史后的玻璃化转变温度为40℃~50℃。该螺旋部件在3~6个月的时间内机化完全降解。瘤腔的闭塞及瘤颈的内皮化时间通常在6个月以上,因此若将该螺旋部件植入瘤腔,其将在瘤腔完全血栓话及机化前就已经降解完成,并导致瘤腔内栓塞密度下降,进而存在血管瘤再通的可能性。另外,该螺旋部件的稳定性相对较差,需要具有更高的包装要求,以避免其在货架期(包装后的存储时间)就发生非预期的提前降解。
[0048]
对比例二:将一由乳酸含量约为50%的聚乳酸-羟基乙酸所制备的螺旋部件置于pbs缓冲液中,且在37℃的条件下进行降解。该螺旋部件与实施例一及实施例二所提供的栓塞本体110的区别之处仅在于原材料中的乳酸含量不同。另外,由于乳酸含量不同使得该对比例中的聚乳酸-羟基乙酸为非结晶型聚合物。该对比例中的螺旋部件在2-4个月内降解完成。
[0049]
因此,本发明实施例所提供的栓塞本体110在植入瘤腔后,促使瘤腔充分地血栓化及机化,并能够在机化完全后才彻底降解,避免动脉瘤再通,并缓解甚至解除占位效应。
[0050]
所述栓塞本体110具有沿其轴向贯通地延伸的第一内腔111。如图2至图6所示,所述栓塞物100还进一步包括显影元件120,所述显影元件120设置于所述第一内腔111中,并与所述栓塞本体110连接,以用于在将所述栓塞物100植入瘤腔的过程中,通过影像装置显示所述栓塞物100的位姿。这里,位姿包括位置和姿态。
[0051]
所述显影元件120可以是具有第二内腔121的管状部件,其长度优选与所述栓塞本体110的长度相匹配(即所述显影元件120与所述栓塞本体110等长,或者所述显影元件120
略短于所述栓塞本体110),以在轴向的全部长度范围内对所述栓塞物100进行显影。所述显影元件120具体可以是螺旋部件或管网状部件。
[0052]
所述显影元件120的材料可以为不透射线金属,包括但不限于铂、铱、金、银、钽和钨中的一种或其合金。由上述材料制成的金属丝在一预设直径的芯轴上螺旋绕制形成螺旋结构的所述显影元件120。或者由上述材料制成的金属丝编织形成管网状结构的所述显影元件120。或者,由上述材料制作的金属管经激光雕刻形成管网状的所述显影元件120。
[0053]
所述显影元件120的材料也可以是复合材料,所述复合材料包括基体,所述基体中掺杂有显影物质。其中,所述基体包括但不限于聚乳酸、聚己内酯聚羟基乙酸、乳酸-羟基乙酸共聚物、聚对二氧杂环己酮、聚氨酯、壳聚糖和透明质酸中的任一种或几种。所述显影物质包括碘造影剂(例如碘海醇、碘化油等)或硫酸钡。由所述复合材料制成的丝材可以编织形成所述显影元件120,或由所述复合材料制成的丝材可以在一预设直径的芯轴上螺旋绕制形成所述显影元件120。
[0054]
可选地,所述显影元件120的体积与所述栓塞本体110的体积的比值小于或等于50%。所述显影元件120的体积是指,所述显影元件120所占据的空间体积,举例来说,当所述显影元件120为管状部件时,该管状部件所占据的空间体积,其值为所述显影元件120的横截面的面积与所述显影元件120的长度的乘积。同理,所述栓塞本体110的体积是指作为所述栓塞本体110的管状部件所占据的空间体积,其值为所述栓塞本体110的横截面的面积与所述栓塞本体110的长度的乘积。由于某些材料制成的所述显影元件120不可降解,那么此类显影元件120的体积越小越好,以最大限度地缓解占位效应。另外,所述显影元件120的外径可以为0.003”~0.010”,内径可以为0.001”~0.008”。当所述显影元件120为螺旋结构时,所述显影元件120的节距可以为形成所述螺旋结构的丝材的直径的1~2倍(当所述丝材的横截面为圆形或圆形的一部分时)。
[0055]
替代性地,所述显影元件120也可以不是管状结构,而是单股或多股丝材,只要其能够显示所述栓塞物100的位姿(即位置和姿态)即可。
[0056]
所述显影元件120可采用任意合适的方式与所述栓塞本体110连接。举例来说,如图1所示,在所述栓塞物100的端部例如远端通过热熔或点胶的方式形成无创伤性的接合部130,利用所述接合部130将所述显影元件120的远端与所述栓塞本体110的远端牢固地连接在一起,即所述栓塞本体110的远端的部分结构与所述显影元件120的远端的部分结构包覆于该接合部130中。所述接合部130优选为球帽结构。类似地,可采用同样的方式使所述显影元件120的近端与所述栓塞本体110的近端连接。或者,如图7所示,所述显影元件120与所述栓塞本体110通过绑扎线140缠绕并绑扎连接,绑扎的位置可根据实际情况确定。
[0057]
再进一步地,所述栓塞物100还包括定型元件(图中未示出),所述定型元件用于使所述栓塞物100保持为预设的形状,提高所述栓塞物100的支撑性和稳定性。
[0058]
详细来说,所述栓塞物100具有预设的二级构型,所述二级构型为2d或3d的立体形态,例如波浪形、螺旋形、多面体形(例如四面体形、五面体形或六面体形)等。所述定型元件的材料可以包括形状记忆合金,例如所述定型元件完全由形状合金制造而成,其中,形状合金包括但不限于镍钛合金、镍钛诺、钴铬合金、镍钴合金,或者用于制造所述定型元件的材料的一部分为形状记忆合金,例如dft(drawn filled tube),本领域技术人员知晓,dft包括内芯和外层管,所述内芯的材料为铂、铱、金、银、钽和钨中的一种或其合金,而外层材料
则为镍钛合金、镍钛诺、钴铬合金、镍钴合金等形状记忆合金中的一种或多种。所述定型元件根据所述栓塞物100的二级构型被预先定型,即当所述栓塞物100的二级构型为波浪形时,所述定型元件被预塑为波浪形,当所述栓塞物100的二级构型为螺旋形,所述定型元件被预塑为螺旋形,当所述栓塞物100的二级构型为多面体形时,所述定型元件被预塑为多面体形。
[0059]
当所述显影元件120不具有所述第二内腔121时,所述定型元件设置于所述栓塞本体110的所述第一内腔111中,且所述定型元件的至少一端可通过所述接合部130与所述栓塞本体110连接,或者所述定型元件也可通过所述绑扎线140与所述栓塞本体110连接。当所述显影元件120具有所述第二内腔121时,所述定型元件设置于所述第二内腔121中,且所述定型元件120的至少一端通过所述接合部130与所述栓塞本体110连接。
[0060]
进一步地,所述定型元件可以是管状部件,例如螺旋部件或管网状部件,也可以是单股或多股线材。另外,所述定型元件的体积与所述栓塞本体110的体积的比值小于或等于10%。可以理解的是,所述定型元件不可降解,因此其在支撑所述栓塞本体110以使所述栓塞物100保持预设形状的前提下,应当具有尽可能小的体积,以进一步缓解占位效应。
[0061]
接下去对所述栓塞物100的制备方法进行介绍。
[0062]
当所述栓塞物100不包括所述定型元件时,所述栓塞物100的制备方法包括:步骤s1:将绕制好的所述栓塞本体110按照预设的形状定型为二级构型;以及将所述显影元件120按照预设好的形状定型为二级构型。步骤s2:采用任意合适的方法使所述显影元件120设置于所述栓塞本体110的所述第一内腔111中。步骤s3:使所述显影元件120的远端与所述栓塞本体110的远端(或近端)连接。步骤s4:调整所述显影元件120和所述栓塞本体110的位姿,以使所述显影元件120与所述栓塞本体110同轴或轴向平行地布置。步骤s5:使所述显影元件120的近端与所述栓塞本体110的近端(或远端)连接。本步骤根据实际需要采用。
[0063]
当所述栓塞物100包括所述定型元件,且所述显影元件120为具有所述第二内腔121的管状部件时,所述栓塞物100的制备方法包括:步骤s10:将所述定型元件按照预设的形状进行定型。当然,本步骤中也可以按照预设的形状对所述栓塞本体110和所述显影元件120进行定型。步骤s20:采用任意合适的方式使所述显影元件120设置于所述栓塞本体110的第一内腔111中,以及使所述定型元件设置于所述显影元件120的所述第二内腔121中。例如所述定型元件为单股丝材,可通过将所述栓塞本体110、所述显影元件120拉伸为线性初级形状(即将所述栓塞本体110及所述显影元件120拉伸为柱状构型),然后利用推送装置将所述显影元件120推入所述第一内腔111中,接着将所述定型元件拉伸为直线型,并将其穿设于所述第二内腔121中。步骤s30:使所述显影元件120的远端与所述栓塞本体110的远端连接,以及使所述定型元件的远端与所述栓塞本体110的远端(或近端)连接。步骤s40:调整所述栓塞本体110、所述显影元件120及所述定型元件的相对位姿,以使所述栓塞本体110、所述显影元件120及所述定型元件同轴或轴向平行地布置。步骤s50:使所述显影元件120的近端与所述栓塞本体110的近端连接,以及使所述定型元件的近端与所述栓塞本体110的近端(或远端)连接。本步骤根据实际需要采用。
[0064]
可以理解的,当所述显影元件120不具有所述第二内腔121时,所述步骤s20则具体为采用任意合适的方式使所述显影元件120和所述定型部件设置于所述第一内腔111中。
[0065]
本发明实施例所提供的技术方案中,所述栓塞物的栓塞本体的降解时间能够与瘤
腔闭塞及瘤颈内皮化的时间相配适,其在瘤腔完全机化之后才彻底降解,避免在机化进行过程中完全降解造成瘤腔内填塞密度下降引起血管瘤再通的问题。并且,在栓塞本体彻底降解后,可以有效缓解甚至完全消除瘤体对周围神经或组织的压迫,减缓占位效应。以及,所述栓塞本体嵌套在显影元件外侧,并完全由可降解的高分子材料制作而成,具有较为光滑的外表面,因此所述栓塞物在推送过程中具有足够的柔软度,且推送阻力较小。
[0066]
虽然本发明披露如上,但并不局限于此。本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1