一种调控肿瘤免疫抑制微环境和逆转耐药的药物递释系统
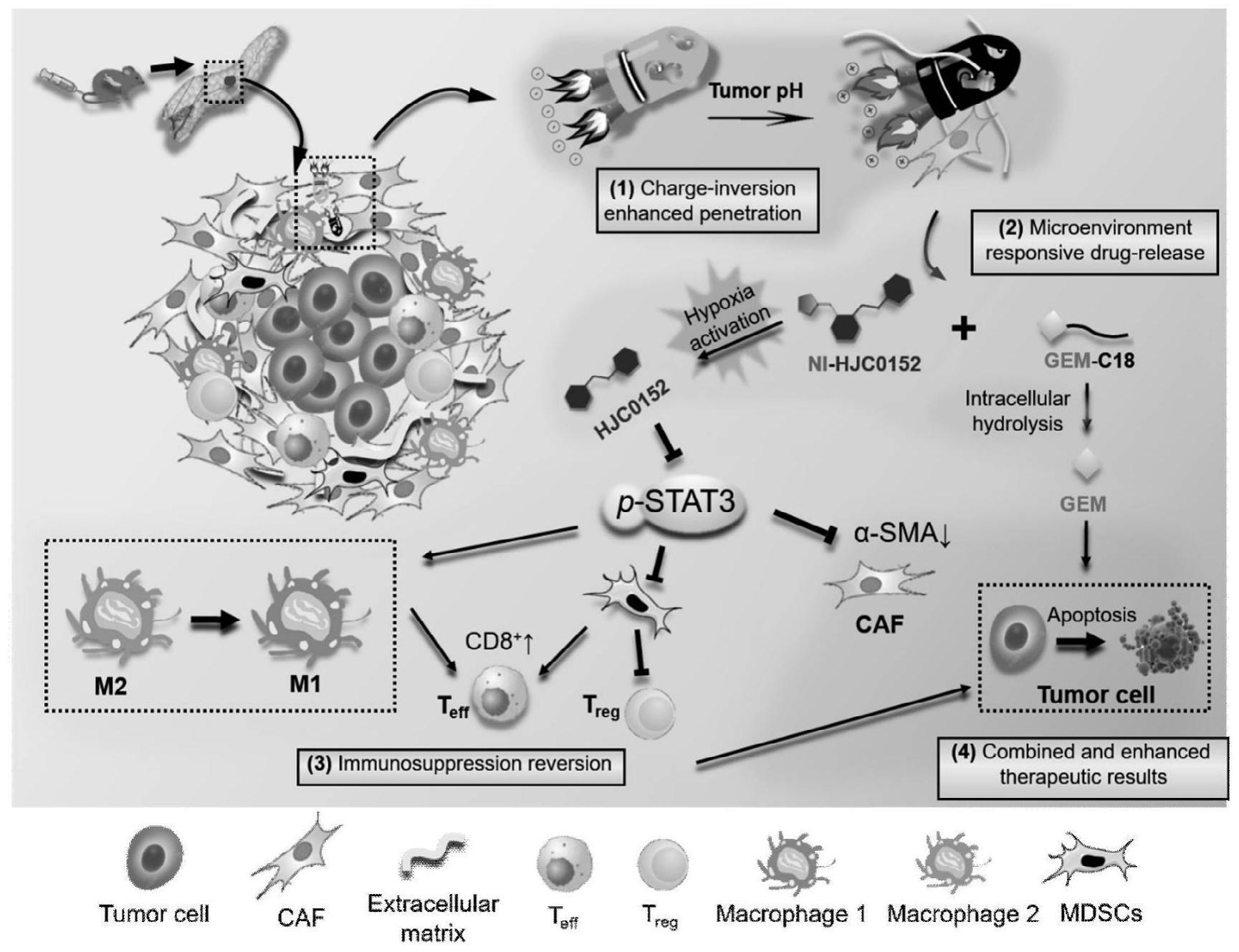
本发明属生物,涉及药物递释系统,具体涉及一种可调控肿瘤免疫抑制微环境和逆转耐药的药物递释系统;该药物递释系统由聚乙二醇-聚赖氨酸-聚苯丙氨酸(peg-plys-pphe)三嵌段聚合物为构筑基元制成,其可响应于肿瘤微酸微环境,表面电荷由负变正,可增加穿透;其负载的两种前药可进一步在肿瘤微环境下进行释药,分别可通过抑制stat3,调控肿瘤免疫微环境和逆转肿瘤耐药。本发明有望为纳米药物的临床转化领域起到启示作用。
背景技术:
1、当前,胰腺导管腺癌(pancreatic ductal adenocarcinoma,pdac)号称“癌中之王”,是一种恶性程度极高的肿瘤,在临床上仅20%比例有手术切除机会。pdac对放疗和化疗存在明显耐受,因此患者五年生存率仅为3-8%。
2、所述pdac的微环境是影响其演进的重要因素之一,并与之互相促进。pdac肿瘤微环境一个重要特点为肿瘤基质异常丰富,高密度的肿瘤基质在肿瘤周围形成了一道严密的物理屏障,瘤内血管受到压迫,由此导致高间质压、低血流灌注,为化疗药在肿瘤内部的合理有效的分布造成了极大困难。当前临床一线化疗方案(白蛋白紫杉醇联合吉西他滨)中,虽然白蛋白紫杉醇可无差别杀伤基质,促进了吉西他滨的灌注,但由此也使肿瘤的扩散和转移几率增加。在该治疗金标准方案下,治疗的患者中位生存期也通常不足一年。异常丰富的基质作为一柄双刃剑,尽管限制了化疗药物的扩散,但同样也降低了肿瘤细胞的扩散几率。因此,在保留胰腺癌外缘基质的前提下,实现药物的深层次递送,是一种较为理想的方案。
3、另外,吉西他滨在pdac治疗时还存在(1)固有耐药:丰富基质阻碍了药物渗透;水溶性的吉西他滨难以扩散进入肿瘤细胞,而pdac细胞上的负责转运药物的hent1通常缺失;(2)获得性耐药:pdac细胞内过表达cda,可能会把吉西他滨的初级活性代谢产物dfdu转运出胞外。
4、pdac的免疫抑制性微环境是其治疗的另一大难点。尽管免疫疗法已在临床上应用于癌症治疗,并取得了瞩目的进展,但这种依赖于自身免疫应答的治疗手段在pdac中尚未取得成功。一方面,高密度的肿瘤基质限制了效应t细胞的浸润,抑制了pdac抗肿瘤免疫应答。此外,肿瘤微环境中大量的免疫抑制性细胞的存在进一步限制了效应t细胞的功能,如肿瘤相关巨噬细胞(tumor-associated macrophage,tam)、调节性t细胞(regulatory tcells,tregs),这也是肿瘤免疫疗法在pdac治疗中效果并不显著的主要原因。
5、因此,在治疗pdac时,需高效穿越致密肿瘤基质将化疗药物深层递送至肿瘤细胞,解除肿瘤耐药,还需通过调控关键细胞因子、促进特异性抗肿瘤免疫应答,有效抑制pdac生长。
6、近年来,研究人员致力于开发新型药物递送系统,以增加药物的pdac肿瘤靶向性,减少非特异性分布,有效提高抗肿瘤药物的安全性和有效性。如biomaterials.2021,268,120546利用天然衍生的细胞外囊泡-外泌体作为药物递送系统,通过表面粘附蛋白和特异性配体,将装载的“货物”有效负载到pdac靶细胞,通过共递送化疗-免疫药物,使pdac肿瘤免疫抑制微环境重塑、逆转免疫抑制以达到治疗的目的。考虑到外泌体对负载的药物有一定底物选择性,更普适的、高效的,针对pdac的药物递释系统亟待发展。
技术实现思路
1、本发明的目的是构建一种可调控肿瘤免疫抑制微环境和逆转耐药的药物递释系统。
2、本发明中,所述药物递释系统由聚乙二醇-聚赖氨酸-聚苯丙氨酸(peg-plys-pphe)三嵌段聚合物为构筑基元的,该三嵌段聚合物为一种典型的两亲性聚合物,其中聚乙二醇-聚赖氨酸段为亲水性的,而聚苯丙氨酸段为疏水性;且所述三嵌段聚合物在水性溶液中可自组装成胶束结构,并可同时携带两种疏水性药物。
3、本发明中,所述赖氨酸侧链修饰有2,3-二甲基马来酸酐(dmma)基团,以实现其肿瘤微环境微酸ph微环境下响应-离去的目的;该聚合物在肿瘤微环境微酸ph微环境响应前为负电性聚合物,其对应胶束表面为负电性;该聚合物在肿瘤微环境微酸ph微环境响应-离去后,翻转为正电性聚合物,其对应胶束表面翻转为正电性。
4、本发明中,所述胶束粒径为30±12nm;所述胶束,在ph7.4的水溶液中,其表面电位为-5.8mv;该胶束,在ph6.0的水溶液中孵育4小时后,其表面电位为+1.9mv。
5、本发明中,所述聚合物材料经芘荧光探针法测得其成胶束浓度为32μg/ml,且组装的载药聚合物胶束同时携带的两种疏水性药物,分别为吉西他滨疏水性前体药物和hjc0152的乏氧响应型前体药物。
6、本发明中,所述吉西他滨的氨基部位被修饰上一条硬脂酸链(gem-c18);所述gem-c18为一种典型的疏水性吉西他滨前药;所述gem-c18可由c18烷基链介导进入肿瘤细胞,避免通过hent1途径入胞;所述gem-c18可入胞后在胞浆内水解酶作用下水解并释放出吉西他滨原型药物。
7、本发明中,所述hjc0152母药是一种stat3的抑制剂;所述hjc0152的氨基位点被占据、并修饰成为前体药物;所述hjc0152的氨基位点被修饰后其stat3的抑制作用消失;该前药的乏氧响应指的是pdac的肿瘤乏氧微环境;所述前药的乏氧响应性能是通过修饰在hjc0152氨基上的硝基咪唑(ni)基团实现的。利用对硝基苯基氯甲酸酯介导,通过碳酸酯键与hjc0152氨基相连(即ni-hjc0152)。所述乏氧前药可响应pdac的乏氧微环境,其硝基被还原成氨基,继而通过p-π共轭作用,诱发结构重排,最终使碳酸酯键断裂,释放出hjc0152母体药物;所述hjc0152的乏氧响应型前体药物,在体外模拟乏氧和常氧环境下,其药物释放比例分别为70%和11%;
8、所述前体药物可对pdac肿瘤细胞起到一定杀伤作用,且效果优于作为对照的非乏氧响应解离的ba-hjc0152结构;该前体药物对pdac肿瘤细胞的杀伤作用,在乏氧情况下优于常氧情况;该前体药物可明显抑制stat3通路,且在乏氧情况下优于常氧情况。
9、本发明中,所述药物递释系统对于gem-c18和ni-hjc0152的包封率/载药量分别为90.1%±1.3/1.23%±0.99和82.3%±1.2/4.54%±0.33for ni-hjc0152。
10、本发明中,在ph6.8的缓冲溶液中,经120小时后,ni-hjc0152的释放程度为53%,gem-c18的释放程度为3%;所述载药聚合物胶束同时携带gem-c18和ni-hjc0152,在ph7.4的缓冲溶液中,经120小时后,ni-hjc0152的释放程度为20%。
11、本发明中,所述药物递释系统没有明显系统毒性。
12、本发明中,所述药物递释系统可实现pdac肿瘤球的有效穿透;该药物递释系统可有效被pdac肿瘤细胞内吞;所述内吞是经巨胞饮和网格蛋白途径介导的。
13、本发明中,所述药物递释系统可靶向至原位pdac肿瘤部位,并实现深部穿透;该药物递释系统可对原位pdac肿瘤起到良好的杀伤效果,且优于吉西他滨原药。
14、本发明中,所述药物递释系统可下调肿瘤细胞内cda表达,同时下调α-sma,进而逆转耐药。
15、本发明中,所述药物递释系统可促进肿瘤相关巨噬细胞转型(m2→m1)。该递释系统可下调骨髓来源的抑制性细胞(mdscs),进而促进效应t细胞浸润,降低调节t细胞。
16、由上述制备方案及本发明后续实施例可知:本发明的一种可调控肿瘤免疫抑制微环境和逆转耐药的药物递释系统,具有以下优点:
17、(1)同时解决pdac的化疗耐药和免疫抑制,起到良好的协同作用,联合治疗肿瘤疗效达到1+1>2的效果;
18、(2)所述药物递释系统可保留pdac外缘基质,而通过电荷反转,增加向pdac内部渗透;
19、(3)本发明中所述吉西他滨前体药物可高效入胞,解决pdac细胞表面hent1不足的问题;
20、(4)本发明中所述hjc0152前体药物可实现乏氧刺激响应,实现肿瘤位置的智能药物递送;
21、(5)本发明中所述基于聚乙二醇-聚赖氨酸-聚苯丙氨酸胶束系统,可体内长循环和体内降解能力,无生理毒性。
22、综上,本发明提供了一种可供临床或科研选择的可调控肿瘤免疫抑制微环境和逆转耐药的药物递释系统,有望解决目前面临的肿瘤治疗低效的问题。
- 还没有人留言评论。精彩留言会获得点赞!