毛螺菌科微生物菌株、预防和/或治疗肿瘤的药物及应用的制作方法
1.本发明涉及微生物及其应用技术领域,尤其是涉及毛螺菌科微生物菌株、预防和/ 或治疗肿瘤的药物及应用。
背景技术:
2.人体肠道内有大量的共生微生物,其携带的基因信息总量是人自身基因组信息的 50~100倍,即“肠道微生物组(gutmicorbiome)”,也被称为人类的“第二基因组”。肠道微生物组是人体最大、最直接的外环境,对维持人体健康发挥着不可或缺的作用。目前,已经有关于肠道微生物组在营养障碍、代谢异常及复杂疾病(比如肥胖、糖尿病、炎性肠病及肿瘤等)方面的研究报道。
3.近年来,随着分子生物学、基因组学、生物信息分析技术、高通量测序技术及微生物培养技术的高速发展,肠道菌群对肠道和肠道外疾病的影响及作用越来越明确。肠道菌群更像是具备代谢、免疫和内分泌功能的器官,可以影响人体消化系统、循环系统和神经系统,与人类各种慢性疾病(糖尿病、高血压、心血管疾病和脑部疾病等)及肿瘤的发生密切相关。研究肠道菌群与人体健康和疾病的相互关系,不仅是重要的科学研究,更具有临床诊断、治疗、乃至转化的重要意义和价值。
4.肠道菌群失调会增加结肠直肠癌的发病率,同时一些肠道微生物的代谢产物能够直接减缓致癌作用或者抑制肿瘤发生。除肠道有关的结肠癌和直肠癌之外,肠道菌群同样还能影响到乳腺癌、肝癌等。越来越多的证据表明肠道微生物能够影响肿瘤形成、肿瘤发育以及肿瘤治疗。如何调控肠道菌群引起的免疫和炎症反应,使得既不会诱发肿瘤又可以增强抗肿瘤药物疗效,目前还在继续探讨研究中,如果能够解决这些问题,对将来肿瘤治疗领域创新和变革有重大意义。
5.michael scharl等在《cell host microbe》报道,梭菌与低肿瘤负荷相关,证明共生梭菌菌株的混合物能够通过cd8
+
t细胞产生强大的抗肿瘤作用,并通过使用多种实体瘤模型,证明特异性肠菌作为单药治疗应用于癌症治疗的可行性。梭菌混合物cc4能通过激活cd8
+
t细胞同时下调免疫抑制因子发挥抗癌效应,此外,cc4增加cd8+t细胞浸润的能力使得肿瘤处于高免疫原性状态,有利于提高crc患者对apd-1治疗的应答率。这些发现开启了肠道菌群补充作为一种独立治疗方式的新篇章。
6.短链脂肪酸(scfa)中的戊酸和丁酸能通过代谢和表观遗传重编程增强细胞毒性t 淋巴细胞(ctl)和嵌合抗原受体(car)t细胞的抗肿瘤活性。这种scfa是一种罕见的细菌代谢物,由低丰度的共生体如megasphaera massiliensis产生,可将其归类为产生戊酸盐的细菌物种。有趣的是,优势共生细菌不能产生戊酸。研究表明,用戊酸和丁酸对 ctl和car t细胞进行体外处理可增加mtor作为中央细胞代谢传感器的功能,并抑制i类组蛋白脱乙酰酶活性。这种重编程导致cd25、ifn-γ和tnf-α等效应分子的产生增加,并显著增强了同源小鼠黑色素瘤和胰腺癌模型中抗原特异性ctl和靶向ror1 的car t细胞的抗肿瘤活性。这些实验数据揭示了可用于增强细胞抗肿瘤免疫的微生物分子,同时实验结果支持将戊酸和
丁酸确定为两种在细胞癌症免疫治疗中具有治疗效用的scfa。
7.因此,进一步发现、挖掘和研究具有肿瘤预防或治疗潜力的微生物菌株具有重要的应用价值和市场前景。
8.鉴于此,特提出本发明。
技术实现要素:
9.本发明的目的在于提供毛螺菌科微生物菌株、预防或治疗肿瘤的药物及应用。本发明发现新属级别的肠道厌氧微生物菌株lachnospiraceaesp.可以抑制肿瘤的生长速度,可用于肿瘤的预防和/或治疗。
10.本发明提供的技术方案如下:
11.在一个方面,本发明提供了毛螺菌科微生物菌株在制备预防和/或治疗肿瘤的药物中的应用,所述毛螺菌科微生物菌株属于毛螺菌科(lachnospiraceae)的新属级新物种(lachnospiraceaesp.),所述毛螺菌科微生物菌株的16srdna的核苷酸序列如seqidno.1所示;所述肿瘤包括肝癌、结肠癌、直肠癌、结肠直肠癌、肺癌、乳腺癌、宫颈癌、卵巢癌、胰腺癌、胆管癌、肾癌和纤维肉瘤中的至少一种。
12.在一个实施方案中,毛螺菌科微生物菌株在制备预防和/或治疗肿瘤的药物中的应用中,所述毛螺菌微生物菌株包括毛螺菌微生物菌株mnh46686,保藏于广东省微生物菌种保藏中心,保藏名称为lachnospiraceaesp.mnh46686,菌株保藏编号为gdmccno:62002。本发明涵盖毛螺菌科微生物菌株的菌体细胞及其提取物、代谢产物(例如发酵液)在制备预防和/或治疗肿瘤的药物中的应用以及在制备抑制肿瘤生长速度(抑制肿瘤的尺寸和大学)的药物方面的作用。
13.在一个实施方案中,所述毛螺菌科微生物菌株属于毛螺菌科(lachnospiraceae)的新属级新物种(lachnospiraceaesp.),所述毛螺菌科微生物菌株的16srdna的核苷酸序列如seqidno.1所示。
14.本发明的菌株为具有抗肿瘤活性,能够显著抑制肿瘤的生长速度。
15.本发明所述毛螺菌科微生物菌株具有以下生物学特征:
16.(1)菌体特征:菌株无芽孢,无鞭毛,不运动,杆状,长度约2~5μm
×
20~50μm;菌株革兰氏阴性;
17.(2)菌落特征:接种于厌氧血平板培养基,37℃厌氧培养48h后,在厌氧血平板培养基上形成可见菌落;菌落圆形,边缘规则且光滑,直径约0.5mm,淡黄色,不透明,菌落周边无分泌物形成;
18.(3)生长特性与生理生化特性:温度生长范围30~42℃,最适生长是37℃;在ph7.0~9.0的范围内可以生长,最适生长ph为7.0;在nacl含量超过2%培养基上不生长;菌株mnh46686能在胆盐浓度为0%~0.3%范围内存活生长,在胆盐浓度大于等于0.4%时不能生长;
19.(4)其他特征:无法利用api20a基础培养基生长:对红霉素、环丙沙星、复方新诺明、氨苄西林、头孢曲松和林可霉素具有耐药性;对庆大霉素、氯霉素、四环素和青霉素等抗生素敏感;在生长过程中可以大量合成短链脂肪酸:乙酸、异丁酸、丁酸和异戊酸。
20.在另一个方面,本发明提供了一种微生物菌剂,所述微生物菌剂包含本发明前述
的毛螺菌科微生物菌株或所述毛螺菌科微生物菌株的代谢产物。
21.在另一个方面,本发明提供了一种预防和/或治疗肿瘤的药物,包含前述毛螺菌科微生物菌株或所述毛螺菌科微生物菌株的代谢产物。
22.在一个实施方案中,所述药物还包含药学上可接受的载体;优选地,所述载体选自稀释剂、分散剂、赋形剂、稳定剂、润滑剂、崩解剂中的一种或几种;所述赋形剂包括甘露醇、乳糖、淀粉、微晶纤维素等。所述崩解剂包括聚乙烯吡咯烷酮、羧甲基纤维素、羧甲基纤维素钠等。所述润滑剂包括滑石粉、硬脂酸镁等。
23.优选地,所述药物的制剂形式为液体制剂、固体制剂、胶囊制剂、缓释制剂和纳米制剂中的任一种。例如所述药物的剂型为注射剂、片剂、颗粒剂、丸剂、胶囊剂等。
24.在一个实施方案中,所述药物组合物还包括联用药物;所述联用药物包括化疗药物、光敏剂、光热剂、免疫治疗药物中的至少一种。
25.在一个实施方案中,所述化疗药物包括紫杉醇、喜树碱、5-氟尿嘧啶、顺铂、多柔比星、丝裂霉素或表柔比星中的一种或多种;
26.所述光敏剂包括硼二吡咯、二氢卟吩或孟加拉红的一种或多种;
27.所述光热剂为吲哚菁绿、新吲哚菁绿或金纳米粒棒的一种或多种。
28.在一个实施方案中,本发明的药物可以与其他抗肿瘤药物联用,例如但不限于奥沙利铂、米托蒽醌、阿霉素、表阿霉素、依托泊苷、长春瑞宾或甲氨蝶呤等。
29.在一个实施方案中,本发明的药物可以与免疫佐剂,例如cpg、il-2、氢氧化铝等一起使用。
30.在一个实施方案中,所述免疫治疗药物包括pd-1抗体、ctla-4抗体、pd-l1抗体、 pd-l1抑制剂;
31.优选地,所述pd-l1抑制剂选自度伐单抗、阿替珠单抗或阿维单抗;所述pd-1抗体或pd-l1抗体选自帕博利珠单抗或纳武利尤单抗;所述ctla-4抗体选自伊匹木单抗。
32.在一个方面,本发明还提供了一种预防和/或治疗肿瘤的方法,所述方法包括使用有效量的本发明的所述毛螺菌科微生物菌株或代谢物对有需要的患者进行治疗;或者使用含有本发明菌株或代谢物作为有效成分的菌剂或药物对有需要的患者进行治疗。优选地,所述菌株为毛螺菌微生物菌株mnh 46686,保藏于广东省微生物菌种保藏中心,保藏名称为lachnospiraceae sp.mnh 46686,菌株保藏编号为gdmcc no:62002。
33.生物保藏信息:
34.本发明的菌株mnh 46686,现已保藏于广东省微生物菌种保藏中心,保藏名称为 lachnospiraceae sp.mnh 46686,保藏编号为gdmcc no:62002;保藏时间2021年11 月4日;保藏地址:广州市先烈中路100号大院59号楼5楼,广东省科学院微生物研究所,提议的分类名称为lachnospiraceae sp.。经保藏中心鉴定,所保藏菌株存活。
35.有益效果:
36.本发明提供的毛螺菌科微生物菌株在已有的报道中并不存在,属于新属级新物种;
37.本发明的毛螺菌科微生物菌株具有完整的产丁酸通路,在生长过程中可以大量合成乙酸、异丁酸、丁酸和异戊酸;
38.本发明的毛螺菌科微生物菌株可以抑制肿瘤(如肝癌)的生长,与对照组相比,可
以显著降低肿瘤的尺寸和重量;
39.本发明的菌株及其代谢产物可用于制备缓解、预防或治疗癌症(或肿瘤)的药物组合物,具有非常广泛的应用前景。
附图说明
40.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
41.图1为本发明菌株mnh 46686在厌氧血平板培养24h的菌落形态照片;
42.图2为本发明菌株mnh 46686的显微形态照片(整体);
43.图3为本发明菌株mnh 46686的显微形态照片(局部);
44.图4为本发明菌株mnh 46686的革兰氏染色显微形态照片;
45.图5为本发明菌株mnh 46686的芽孢革兰氏染色显微形态照片;
46.图6为本发明菌株mnh 46686对不同ph的耐受性结果;
47.图7为本发明菌株mnh 46686对不同浓度nacl的耐受性结果;
48.图8为本发明菌株mnh 46686对不同胆盐的耐受性结果;
49.图9为本发明菌株mnh 46686经api 20a进行生化鉴定的结果;
50.图10为将本发明菌株与lachnospiraceae菌科相关菌株比较构建的系统发育树;
51.图11为本发明肝癌治疗的动物实验解剖后肿瘤组织大小对比图;
52.图12为mnh 46686的细胞流式脾脏细胞检测结果;
53.图13为mnh 46686的细胞流式肿瘤细胞检测结果。
具体实施方式
54.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
55.实施例1
56.1.1菌株mnh 46686的分离
57.本发明筛选到的肠道菌株lachnospiraceae sp.mnh 46686分离自广东省广州市的一位健康女性自愿者的粪便样本。
58.具体地,菌株的分离方法如下:
59.捐赠者自取新鲜粪便2~5g,放入样本收集保存管中,震荡匀质后将处理好的粪便样本置于冰盒中,并于24小时内送达实验室进行菌株分离。
60.在生物安全柜中分装生理盐水,9ml/管;准备菌株分离培养基厌氧血琼脂平板,并提前24h将其转入厌氧工作站内,标记样品信息、培养基类型、分离日期等。
61.取新鲜粪便样本置于厌氧操作站中(don whitley scientific h35)使用漩涡振荡器震荡1min,混匀,吸取1ml样本到9ml生理盐水中,混匀为10-1
稀释液,然后梯度稀释至
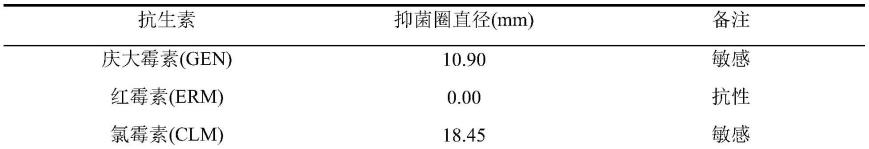
10-6
稀释液,备用。
62.取10-6
稀释液滴于分离培养基(厌氧血琼脂平板、哥伦比亚血琼脂平板和巧克力琼脂平板)中,滴加量为100μl/皿,涂布均匀,待平板表面干燥后,平板倒置,37℃培养 3~5天。
63.1.2菌株的纯化
64.观察分离培养基菌株生长状况并用灭菌牙签挑取单菌落,进行菌株纯化,纯化菌株置于37℃,厌氧培养。
65.将纯培养菌株制备成20%甘油/水-菌液,-86℃低温保存。
66.实施例2.菌株mnh 46686的形态特征和生理生化特征
67.2.1菌株mnh 46686的形态特征
68.将菌株mnh 46686接种于厌氧血平板培养基,37℃厌氧培养48h后,在厌氧血平板培养基上形成可见菌落,菌落圆形,边缘规则且光滑,直径约0.5mm,淡黄色,不透明,菌落周边无分泌物形成;菌株为革兰氏阴性;显微形态观察发现菌株无芽孢,无鞭毛,不运动,杆状,长度约2~5μm
×
20~50μm。菌株mnh 46686在厌氧血平板培养48h 的菌落形态照片见图1。菌株mnh 46686的显微形态照片见图2(整体)和图3(局部)。
69.菌株mnh 46686的革兰氏染色显微形态照片见图4,菌株mnh 46686芽孢染色显微形态照片见图5(图4与图5进行了灰度化处理,原始染色图片显示呈红色),菌株为革兰氏阴性。
70.2.2菌株mnh 46686的生理生化特征
71.菌株mnh 46686,温度生长范围30~42℃,最适生长是37℃。在ph 7.0到9.0的范围内可以生长,最适生长ph为7.0(菌株对不同ph的耐受性结果见图6);在nacl 含量超过2%培养基上不生长(菌株对不同浓度nacl的耐受性结果见图7);菌株mnh 46686能在胆盐浓度为0%~0.3%范围内存活生长,在胆盐浓度大于等于0.4%时不能生长 (菌株对不同浓度胆盐的耐受性结果见图8)。
72.2.3菌株mnh 46686经api 20a进行生化鉴定的结果
73.本研究使用的是api 20a,具体实验操作见常规的api试剂操作指引。培养条件: 37℃,厌氧。实验结果见表1和图9。
74.表1.菌株mnh 46686api 20a测试结果
75.检测项目检测结果检测项目检测结果ind阴性esc阴性ure阴性gly不产酸glu不产酸cel不产酸man不产酸mne不产酸lac不产酸mlz不产酸sac不产酸raf不产酸mal不产酸sor不产酸sal不产酸rha不产酸xyl不产酸tre不产酸ara不产酸gel阴性
76.2.4使用纸片扩散法进行菌株mnh 46686抗生素敏感性测试。
77.mnh 46686的抗生素敏感性测试结果见表2。菌株mnh 46686对红霉素、环丙沙星、复方新诺明、氨苄西林、头孢曲松和林可霉素具有耐药性;对庆大霉素、氯霉素、四环素和青霉素等抗生素敏感。
78.表2.菌株mnh 46686抗生素敏感性测试结果
[0079][0080][0081]
实施例3.菌株mnh 46686鉴定
[0082]
3.116s rrna基因扩增
[0083]
取菌株mnh 46686新鲜培养物,进行菌株基因组dna的提取。采用提取的菌株基因组dna作为模板进行16s rrna基因扩增。
[0084]
本发明16s rrna基因pcr使用的引物对为:
[0085]
27f:5
’‑
agagtttgatcmtggctcag-3’(seq id no.2)
[0086]
1492r:5
’‑
tacggytaccttgttacgactt-3’(seq id no.3)。
[0087]
pcr反应程序如下:
[0088]
预变性:94℃,4min;变性:94℃,50sec;退火:52℃,40sec;延伸:72℃,70 sec;终延伸:72℃,10min。(注:循环36次)。
[0089]
3.2 16s rrna基因测序
[0090]
pcr扩增完成后,将pcr产物进行纯化,交由金唯智公司进行16s rrna基因测序,得到16s rrna基因序列(1383bp)。
[0091]
菌株mnh 46686 16s rrna基因序列如seq id no.1所示:
[0092]
cagtcgagcgagcattttaaaggaagttttcggatggaatttgaaatgactga gcggcggacgggtgagtaacgcgtgggtaacctgcctcatacagggggataacag ttagaaatgactgctaataccgcataagcacacagtaccgcatggtacggtgtgaa aaactccggtggtatgagatggacccgcgtctgattagctggttggcggggtaac ggcccaccaaggcgacgatcagtagccgacctgagagggtgaccggccacattg ggactgagacacggcccaaactcctacgggaggcagcagtggggaatattgcaca atgggggaaaccctgatgcagcaacgccgcgtgagtgaagaagtatttcggtatg taaagctctatcagcagggaagaaagtgacggtacctgactaagaagccccggct aactacgtgccagcagccgcggtaatacgtagggggcaagcgttatccggatttac tgggtgtaaagggagcgtagacggcacagcaagtctgaagtgaaatccccgggc tcaacccgggaactgctttggaaactgttgggctggagtgct
ggagaggcaagc ggaattcctagtgtagcggtgaaatgcgtagatattaggaggaacaccagtggcg aaggcggcttgctggacagtaactgacgttgaggctcgaaagcgtggggagcaa acaggattagataccctggtagtccacgccgtaaacgatgcatactaggtgtcggg gagcaaagcttttccgtggccgcccaaacgcagtaagtatgccacctggggagta cgttcgcaagaatgaaactcaaaggaattgacggggacccgcacaagcggtgga gcatgtggtttaattcgaagcaacgcgaagaaccttaccaagtcttgacatccccc tgacgagcaagtaacgttgcttttccttcgggacaggggagacaggtggtgcatg gttgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgcaac ccttattgtcagtagccagcaggtaaagctgggcactctgatgagactgccaggg ataacctggaggaaggtggggatgacgtcaaatcatcatgccccttatgatttggg ctacacacgtgctacaatggcgtaaacaaagggaagcgaccctgcgaaggcaag caaatcccaaaaataacgtcccagttcggattgtagtctgcaactcgactacatga agctggaatcgctagtaatcgcagatcagcatgctgcggtgaatacgttcccgggt cttgtacacaccgcccgtcacaccatgggagtcggaaatgcccgaagccagtgac ccaactgca(seq id no.1)。
[0093]
3.3菌株鉴定结果
[0094]
将测序返回的菌株16s rrna基因序列提交到ncbi basic local alignment searchtool,进行菌株16s rrna基因分析,确认菌株分类信息。
[0095]
将测得的序列与genbank中的数据通过blast进行分析,比对结果显示与mnh 46686相似性最高的菌株是lachnoclostridium pacaense(93.77%)和enterocloster citroniae (93.77%),菌株mnh 46686与其它菌株16s rrna基因序列相似性均低于93.7%;较低 (《95%)的16s rrna基因序列相似性表明菌株mnh 46686可能是lachnospiraceae菌科的一个新属级新物种。
[0096]
将mnh 46686与从genbank等数据库中调取的lachnospiraceae菌科相关菌株的16s rrna基因序列进行比较,构建系统进化树。
[0097]
将mnh 46686和ncbi数据库中16s rrna基因序列相似性较高模式菌株的序列进行多序列比对,然后利用软件mega 5构建系统发育树(采用最大似然法构建系统发育树),图中发育树节点只显示bootstrap值大于50%数值,上标的“t”表示模式菌株。
[0098]
从系统进化树(图10)可以看出菌株mnh 46686与lachnospiraceae菌科其他菌属菌株未聚在一起,而是形成一个单独的分枝(bootstrap支持值为90),系统进化树分析支持将菌株mnh 46686划定为lachnospiraceae菌科的一个新属级新物种。
[0099]
实施例4.菌株mnh 46686的基因组分析
[0100]
mnh46686原始菌株的基因组通过超声波法进行序列片段化,片段化长度范围~ 350bp,然后利用标准dna建库试剂盒(neb ultratm)构建illumina测序文库。将构建好的测序文库利用novaseq(illumina)进行双端150bp测序。测序得到1.34gbp数据,其中q20占比为:97.325%。
[0101]
基因组原始测序数据使用fastp(版本:0.20.0)进行数据过滤,过滤参数:
“‑‑
poly_g_min_len 10
‑‑
poly_x_min_len 10-q 15-u 40-n 5-1 50”。过滤后的原始数据使用 spades(版本:v3.14.0)进行基因组组装,组装参数
“‑‑
isolate
‑‑
cov-cutoff 10”。基因组组装得到基因总长度3.34mbp,n50长度为174.9kbp,gc含量为51.93%。
[0102]
基因组基因使用原核分析软件基因组注释流程prokka(版本:1.14.5)进行基因组基因预测分析,参数
“‑‑
gcode 11
‑‑
evalue 1e-09”。总共预测得到3052条cds序列,其中平均 cds序列长度为977bp。
[0103]
基因组中潜在的抗生素耐药基因使用rgi流程分析(版本:4.2.2),其中抗生素耐药基因数据库为card(版本:3.0.0,https://card.mcmaster.ca/analyze/rgi)。详细对比信息参照表3所示。
[0104]
表3.耐药基因信息列表
[0105]
菌株基因抗性基因基因名称比对一致性(%)mnc-686_01541aro:3000567tet(40)99.51mnc-686_02439aro:3000375ermb98.78
[0106]
对基因组中潜在的毒力因子及相关基因的分析采用的是ncbi blastp(版本为: 2.7.1+)比对毒力因子数据库vfdb(virulence factor database,http://www.mgc.ac.cn/cgi-bin/vfs/v5/main.cgi,更新日期为2019年9月19日)。详细比对结果见表4。
[0107]
表4.mnc-686潜在毒性基因列表
[0108]
菌株基因vfdb基因基因名称比对一致性(%)mnc-686_00125vfg013286gale64.793mnc-686_00586vfg048797ugd62.408mnc-686_00593vfg001373cps4i73.407mnc-686_00595vfg001376cps4l83.793mnc-686_00597vfg001375cps4k66.584mnc-686_01781vfg000077clpp69.474mnc-686_01956vfg002162bsh64.375mnc-686_02546vfg001967glf63.26
[0109]
对基因组中潜在的次级代谢基因簇的分析采用的是antismash5(版本为:5.1.1)。详细比对结果见表5。
[0110]
表5.mnc-686潜在次级代谢基因簇列表
[0111]
基因簇范围类型从到最类似的已知基因簇相似性region 7.1sactipeptide121872142018
‑‑
[0112]
对基因组中潜在的初级代谢基因簇的分析采用的是gutsmash5(版本为:1.0.0)。详细比对结果见表6。
[0113]
表6.mnc-686潜在初级代谢基因簇列表
[0114]
基因簇范围类型类别从到最类似的已知基因簇缩写相似性region 1.1rnf_complexe-mgc4415069270rnf complex c.sporogenesrnf1region 2.1glvcine_reductasescfa159178186401glycine reductase c.sticklandiigly0.83region 2.2tpp_aa_metabolismtpp_fatty_acidsputative222268252454
ꢀꢀꢀ
reaion 4.1pyruvate2acetate-formatescfa2193944986pyruvate to acetate and formate c.acetobutylicumpfl_acetate1region 4.2putrescine2spermidinealiphatic_amine4665669981putrescine2spermidine e.rectalesprm1
region 5.1tpp_aa_metabolismputative124827149784
ꢀꢀꢀ
region 7.1others_hgd_unassignedputative169282193604
ꢀꢀꢀ
region 9.1glutamate2butyricsuccinate2propionatescfa55918101483glutamate to butyrate c.symbiosumbut1region 11.1fumarate2succinatescfa1624538368
ꢀꢀꢀ
region 14.1others_hgd_unassignedputative710929030
ꢀꢀꢀ
region 16.1acetate2butyratescfa6090587005acetate to butyrate c.sporogenesbut1
[0115]
对此菌株产丁酸能力进行评估,采用文章(vital m,howe c,tiedje m.revealingthe bacterial butyrate synthesis pathways by analyzing(meta)genomic data[j].mbio,2014,5(2):1-11)中的产丁酸通路有关基因作为参考数据库,用ncbi blastp(版本为: 2.7.1+)将此菌株的基因组序列和参考数据库进行比对,详细比对结果见表7,进而计算产丁酸通路的完整性,通过计算发现此菌株产丁酸通路的完整性为100%。
[0116]
表7.mnc-548潜在产丁酸基因列表
[0117]
菌株基因产丁酸通路名称基因名称比对一致性(%)mnh46686_02582pyruvatebcd93.75mnh46686_02578pyruvatebut84.855mnh46686_02580pyruvatecro81.783mnh46686_02584pyruvateetfa89.911mnh46686_02583pyruvateetfb85.769mnh46686_01795glutarategctb95.539mnh46686_02581pyruvatehbd92.115mnh46686_01793glutaratehgcoad_a84.733mnh46686_01794glutaratehgda93.718mnh46686_01807glutaratehgdb95.55mnh46686_02579pyruvatethl86.548
[0118]
实施例5.菌株mnh 46686的脂肪酸组分分析
[0119]
将菌株mnh 46686接种在tsa平板上,37℃厌氧培养48小时后,收集菌体,进行菌体脂肪酸提取和甲基化处理;使用美国midi公司的(microbial id,inc.,newark,del) (kroppenstedt,1985;meier et al.,1993)全自动细菌鉴定系统进行菌株mnh 46686脂肪酸组分分析。
[0120]
实验菌株mnh 46686脂肪酸组成见下表。
[0121]
从结果看,mnh 46686主要脂肪酸(》10%)是十六碳饱和脂肪酸(c16:0 34.61%)、18:1 cis 9fame(18.30%)、18:1c11/t9/t6 fame(12.74%)和十八碳饱和脂肪酸(c18:0 10.92%);其余类型脂肪酸及含量详见下表8。
[0122]
表8.菌株mnh 46686脂肪酸组分表
[0123][0124][0125]
实施例6.菌株mnh 46686的短链脂肪酸(scfa)测定
[0126]
6.1菌体制备
[0127]
将菌株mnh 46686接种在液体培养基中,37℃厌氧培养48小时,离心收集菌体,收集物置于-86℃低温保存,待用。
[0128]
6.2标准品配制
[0129]
称量乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸和己酸标准品,用乙酸乙酯配制成 0.1μg/ml、0.5μg/ml、1μg/ml、5μg/ml、10μg/ml、20μg/ml、50μg/ml和100μg/ml 八个混合标准浓度梯度。
[0130]
取600μl标准品,加入25μl终浓度为500μm的4-甲基戊酸作为内标,混匀加入进样瓶,进入gc-ms检测,进样量1μl,分流比10:1,分流进样。
[0131]
6.3代谢物提取
[0132]
将样品冰上解冻,取80mg样品于2ml玻璃离心管中,加入900μl0.5%的磷酸重悬,震荡混匀2min,14000g离心10min,取上清液800μl,加入等量的乙酸乙酯提取,震荡混匀2min,14000g离心10min,取600μl上层有机相,加入终浓度为500μm的 4-甲基戊酸作为内标,混匀加入进样瓶,进入gc-ms检测,进样量1μl,分流比10:1,分流进样。
[0133]
6.4样本检测分析
[0134]
采用agilent db-wax毛细管柱(30m
×
0.25mm id
×
0.25μm)气相色谱系统对样本进行分离。程序升温:初始温度90℃,以10℃/min升温至120℃,再以5℃/min升温至 150℃,最后以25℃/min升温至250℃,并维持2min。载气为氦气载气流速1.0ml/min。
[0135]
采用agilent 7890a/5975c气质联用仪进行质谱分析。进样口温度250℃,离子源
温度230℃,传输线温度250℃,四极杆温度150℃。电子轰击电离(ei)源,全扫及sim扫描方式,电子能量70ev。
[0136]
采用msd chemstation软件提取色谱峰面积及保留时间。绘制标曲曲线,计算样品中短链脂肪酸的含量。
[0137]
表9.菌株mnh 46686短链脂肪酸(scfa)产量结果
[0138]
scfa类型产量(μg/g)乙酸857.1941054丙酸14.63679879异丁酸1711.508723丁酸1797.854335异戊酸1415.507669戊酸0.216392053己酸0.396975456
[0139]
由检测结果可见,菌株mnh 46686在生长过程中可以大量合成乙酸、异丁酸、丁酸和异戊酸。
[0140]
实施例7.菌株mnh 46686用于肝癌治疗的动物实验
[0141]
为了验证菌株mnh 46686是否可以用于肿瘤的预防和治疗,利用小鼠同源肿瘤模型进行抑制肝癌生长实验。该研究已通过慕恩生物动物伦理委员会伦理审查。
[0142]
供试菌株:将mnh 46686菌种甘油冻存管在37℃下融化后,于厌氧工作站中接种于厌氧血平板上进行活化,将活化后的菌株接种于mm01液体培养基中,厌氧培养,获得足够数量的培养物,将培养好的菌液离心浓缩后用溶媒将菌体重悬,得到纯度和活菌数(2.04
×
10
10
cfu/ml)满足动物实验要求的受试物。
[0143]
肿瘤细胞:h22小鼠肝癌细胞,cbp69230。
[0144]
实验动物:实验用鼠为c57bl/6j小鼠,鼠龄5周,总共20只,购自广东药康生物科技有限公司。
[0145]
动物实验:正常饲养,检疫期结束后,根据体重进行随机分为2组(对照组和实验组),每组10只,分笼饲养。分组后以皮内注射h22小鼠肝癌细胞方式构建小鼠肝癌模型,细胞接种量为2
×
106/ml,0.1ml/只。
[0146]
接种完成当天(day 0)开始进行灌胃给药,对照组给予培养基,实验组给予mnh46686菌,灌胃体积为0.2ml/只/次,给药频率为1天/次。检疫期每天、给药期每天给药后进行一般观察1次,在接收动物、检疫期结束、给药期每周3次需称量动物体重;肿瘤细胞接种7天(day 7)开始,每周进行3次肿瘤测量,并记录肿瘤生长情况。本实验终点为:灌胃给药完成19次。实验终点时,将全部小鼠用颈椎脱臼法执行安乐死。
[0147]
实验结果见下表10。
[0148]
表10.实验终点小鼠总体情况统计
[0149]
[0150]
图11为实验小鼠解剖后肿瘤组织大小对比图,图中左图为实验组,右图为对照组。
[0151]
对小鼠解剖后肿瘤组织的重量进行统计,结果如下表11。
[0152]
表11.小鼠解剖后肿瘤组织重量
[0153][0154]
结果显示,对照组肿瘤快速生长,在d19肿瘤组织达到均重约2.53g,实验组在第 19天肿瘤组织均重约1.69g,生长速度明显慢于对照组。该实验证明mnh 46686可以明显降低肝癌的生长速度。表明本发明菌株可以抑制肿瘤生长,进而可用于肿瘤的预防和治疗。
[0155]
实施例8.mnh 46686的细胞流式检测结果
[0156]
实验原理:
[0157]
组织制备成单细胞悬液后,标记带有荧光分子标记的特定分子,可在流式细胞仪中检测到表达特定分子的细胞比例。免疫细胞的比例分布,一定程度上体现小鼠免疫状态。
[0158]
实验方法:
[0159]
一、肿瘤组织
[0160]
1.肿瘤单细胞悬液制备及细胞计
[0161]
取0.3g肿瘤组织,用pbs冲洗表面后剪成小块并粉碎,将粉碎的肿瘤组织置于5ml 胶原酶iv消化液体系中(1mg/ml胶原酶iv,0.1mg/ml dna酶,10%fbs)37℃消化处理30min;消化处理的组织液经70um滤膜过滤,制成小鼠肿瘤单细胞悬液,上机检测。
[0162]
2.肿瘤细胞表面t细胞/nk细胞染色
[0163]
取小鼠肿瘤单细胞悬液,分别加入染料t-alexa fluor647 anti-mousefoxp3-tumor/nk-alexa fluor647 anti-mouse foxp3-tumor及 t-live-tumor/nk-live-tumor进行肿瘤细胞表面t细胞/nk细胞染色,染色后的细胞使用pbs重悬,上机检测。
[0164]
3.肿瘤细胞胞内转录因子foxp3染色
[0165]
取小鼠肿瘤单细胞悬液,依次加入染料treg-fcblock-tumor、treg-live-tumor、 treg-surface-tumor进行染色,染色后的细胞使用pbs重悬;随后,按照检测试剂盒说明书依次使用固定液、破膜液、treg-tumor核内染色进行染色;染色后的细胞使用pbs 重悬,上
机检测。
[0166]
二、脾脏组织
[0167]
1.脾脏单细胞悬液制备及细胞计数
[0168]
取0.1g脾脏组织,用pbs冲洗表面后进行组织粉碎,将粉碎的脾脏组织悬于pbs 中,经70um滤膜过滤,制成小鼠脾脏单细胞悬液,上机检测。
[0169]
取少量上述制备的小鼠脾脏单细胞悬液,依次加入红细胞裂解液、spleen-counting、预冷pbs等,完成上机检测,准确计数小鼠脾脏单细胞数值。
[0170]
取剩余上述制备的小鼠脾脏单细胞悬液,依次加入红细胞裂解液、pbs等进行细胞处理,处理后的细胞悬液过300目滤膜后,上机检测。
[0171]
2.脾脏细胞表面t细胞/nk细胞染色
[0172]
取小鼠脾脏单细胞悬液,分别加入染料t-alexa fluor647 anti-mousefoxp3-sp/nk-alexa fluor647 anti-mouse foxp3-sp、t-live-sp/nk-live-sp、 t-sp/nk-sp进行脾脏细胞表面t细胞/nk细胞染色,染色后的细胞使用pbs重悬,上机检测。
[0173]
3.脾脏细胞胞内转录因子foxp3染色
[0174]
取小鼠脾脏单细胞悬液,依次加入染料treg-fcblock-sp、treg-live-sp、 treg-surface-sp进行染色,染色后的细胞使用pbs重悬;随后,按照检测试剂盒说明书依次使用固定液、破膜液、treg-sp核内染色进行染色;染色后的细胞使用pbs重悬,上机检测。
[0175]
实验结果:
[0176]
脾脏细胞检测结果见图12。
[0177]
流式分析数据均用cyexpert处理,graphpad prism v9统计处理。统计分析采用 one-way anova with dunnet’s multiple comparison,ns not significant*p《0.05,**p《0.01, ***p《0.001。
[0178]
相比对照组,喂食菌株mnh 46686的小鼠脾脏组织中的cd3/cd4/cd8/nk细胞比例升高,其中cd3细胞比例显著上调,其他细胞上调无显著性差异。喂食菌株mnh46686组和对照组的cd4细胞中foxp3比例无显著差异。
[0179]
肿瘤细胞检测结果见图13。
[0180]
流式分析数据均用cyexpert处理,graphpad prism v9统计处理。统计分析采用 one-way anova with dunnet’s multiple comparison,ns not significant*p《0.05,**p《0.01, ***p《0.001。
[0181]
相比对照组,喂食菌株mnh 46686的小鼠肿瘤细胞中的cd3/cd4/cd8/cd19/nk 细胞在cd45细胞中比例无显著性差异,肿瘤组织cd4细胞中foxp3比例也无显著性差异。
[0182]
综上所述,喂食菌株mnh 46686的小鼠其脾脏组织中免疫刺激细胞cd3细胞比例显著上调;推测菌株mnh 46686可通过刺激小鼠免疫系统活化发挥抗肿瘤活性作用。
[0183]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1