用于多细胞转化的经修饰MRNA的制作方法
用于多细胞转化的经修饰mrna
1.相关申请的交叉引用
2.本技术是2020年5月8日提交的美国申请序号16/869,642的接续申请,上述美国申请是2017年5月1日提交、现为美国专利第10,682,401号的美国申请序号15/583,599的部分接续申请,上述美国申请是2016年7月28日提交、现为美国专利第9,636,388号的美国申请序号15/114,943的部分接续申请,上述美国申请是2016年5月19日提交的国际专利申请第pct/us2016/033235号的美国国家阶段申请,上述国际专利申请要求2015年5月19日提交的美国临时申请序号62/163,446的权益,上述各申请的公开内容以全文引用的方式并入本文中,包括所有的图、表以及氨基酸和核酸序列。
3.本技术的序列表标为“seq-list.txt”,其创建于2020年4月12日,大小为31kb。序列表的全部内容以全文引用的方式并入本文中。
技术领域
4.本发明总体上涉及疫苗,尤其涉及通过癌细胞转染或用合成细菌信使核糖核酸(mrna)直接瘤内施用制备的癌症疫苗。
5.本发明更具体地描述了在哺乳动物细胞中有效表达所选多肽的合成rna以及该rna在体内或体外转化细胞的用途。
6.本发明提供了用于癌症治疗的有效mrna疫苗的开发和用途。虽然脱氧核糖核酸(dna)疫苗有若干缺陷(包括转染效率低和递送方法耗时),但本发明的mrna疫苗被直接施用到肿瘤细胞中并被立即翻译成引起多肿瘤抗原反应的免疫原性蛋白质。与质粒dna相比,mrna的体内半衰期较短,这使得其不太可能整合到宿主基因组中,因此被认为更安全。与dna不同,mrna疫苗不需要穿过核膜,因此通常可以产生更快和更高水平的蛋白质表达。此外,转染mrna的表达与细胞周期无关,并且由于mrna的水平不受启动子驱动,因此可以通过改变转染的mrna水平来调节蛋白质表达和疫苗剂量。与肽对比,mrna疫苗缺乏主要组织相容性复合体(mhc)单倍型限制,可以设计成通过添加mhc i运输信号或与鱼精蛋白组合进行自我调节。尽管mrna疫苗的功效可能受益于保护rna免于降解并增强细胞摄取的复合剂,但在没有其它试剂或物理转导方法的情况下,体内细胞可以用mrna转染。用作疫苗的信使rna可以使用体外转录从质粒dna中产生。
背景技术:
7.癌症的治疗基于诊断出的特定类型。一些常见的癌症包括膀胱癌、乳腺癌、结肠癌、淋巴瘤、黑色素瘤和前列腺癌。治疗方案由医生根据多种因素的评估制定,包括但不限于疾病阶段、病因和患者年龄和总体健康状况。对于许多癌症,治疗方案可以包括手术、化学疗法、放射疗法、骨髓/干细胞移植、抗癌药物或免疫疗法中的一种或组合。最常见的治疗方法包括手术、化疗、放疗和口服药物。尽管这些治疗可能有效,但通常有许多副作用。化疗尤其针对体内所有新分裂的细胞,而不仅仅是癌细胞。
8.一些免疫疗法的优点是能够靶向患病细胞,同时使未患病细胞保持完整。癌细胞
源于正常生长调节机制的崩坏;因此,身体仍然将癌细胞中的许多视为自体的。癌症免疫疗法克服了身体对这些患病自体细胞的耐受性,并使身体能够将它们区分为外来的。癌症还可以通过降低细胞上免疫激活标记(如mhc分子)的表达直接抑制人体免疫系统来逃避免疫检测。mhc是对于身体区分哪些细胞是自体细胞以及哪些细胞是外来或患病的细胞有帮助的成分之一。
9.实体癌的治疗通常包括化疗和/或手术。最近,人们对开发疫苗以刺激自体免疫防御产生了兴趣。美国专利第7,795,020号详细描述了一种淋巴瘤疫苗,用于治疗晚期淋巴瘤,其转化自体或非自体细胞分离自诊断患有淋巴瘤的受试者。分离的细胞用携带化脓性链球菌emm55基因的质粒载体转染。细菌蛋白在细胞表面表达,当将转染的细胞引入患有癌症的受试者时,会产生对淋巴瘤细胞的免疫反应。
10.迄今为止,fda仅批准了细胞癌症免疫疗法疫苗provenge用于治疗前列腺癌;然而,一些疫苗目前正在临床试验中进行测试。biovaxid是一种自体肿瘤衍生的免疫球蛋白独特型疫苗,正在进行iii期临床研究,用于治疗惰性滤泡非霍奇金淋巴瘤。
11.原则上,外源dna或rna都可以在哺乳动物体内表达蛋白质。dna和mrna表达的蛋白质是否可以产生类似的免疫活性尚不确定。传统观点认为dna因其稳定性和易用性而更适合用于疫苗生产和基因治疗。质粒dna疫苗的一个实例是merial的oncept,它是为治疗口腔犬黑色素瘤而开发的。
12.已经报道了关于mrna疫苗的工作。在一个案例中,使用脂质体递送了一种有效的mrna疫苗。在将编码流感病毒蛋白的mrna施用至小鼠体内后,这种特殊的疫苗在体内诱导细胞毒性t淋巴细胞。curevac gmh的其它研究表明,mrna疫苗在皮内递送时会引发体液和细胞免疫反应。这种疫苗以裸露的形式施用,并与鱼精蛋白复合,鱼精蛋白是一种增强mrna稳定性和改善蛋白质表达的蛋白质。此疫苗目前正在进行去势抵抗性前列腺癌的临床试验。
13.已经使用mrna对液体和实体肿瘤进行了人体试验。癌症包括急性髓性淋巴瘤、转移性黑色素瘤、前列腺癌、肾细胞癌/卵巢癌、神经母细胞瘤、脑癌、肺癌、结肠癌和肾细胞癌。目前正在进行的大多数临床试验都涉及将mrna转染到自体树突细胞中,而不是癌细胞中。此外,还没有尝试使用mrna的瘤内施用的临床试验。图3是已发表的使用mrna疫苗的临床试验表。
14.如脂质体和阳离子聚合物等递送载体似乎有望增强转染。一旦脂质体或聚合物复合物进入细胞质,mrna必须能够与递送载体分离,以实现抗原翻译;不幸的是,这些载体可能无法与mrna正确复合,且因此无法正确翻译所编码的蛋白质。可能会产生抗原,但其量不足以产生所需的效果。
15.许多免疫疗法是疾病特异性的,概念复杂,并且生产起来更加复杂和昂贵。此类疗法是否具有商业可行性还有待观察。将mrna直接施用到患者的肿瘤中具有深远的意义,mrna在该肿瘤中立即被翻译成一种免疫原性蛋白,从而引发多肿瘤抗原反应。例如,单个合成mrna可用于治疗多个物种的多种类型的癌症。mrna易于递送、具有成本效益、易于运输和储存以及易于施用。连同出色的安全性,mrna的这些属性使得治疗全球癌症患者成为可能,甚至在发展中国家也是如此。
16.引导免疫系统杀死癌细胞是所有癌症免疫疗法的基础。为了使任何类型的免疫疗
法成功,必须触发对肿瘤相关抗原的免疫反应并允许其放大。免疫反应可以涉及任何数量的免疫细胞,包括抗原呈递细胞、中性粒细胞、自然杀伤细胞、t辅助细胞、t细胞毒性细胞和b细胞等。然而,在人类癌症疫苗试验中,对单个肿瘤抗原的免疫反应的触发和激活还不足以转化为有益的临床疗效,很可能是由于免疫逃逸变异;也没有使用完整的肿瘤细胞或肿瘤细胞裂解物加上外源佐剂作为多种相关肿瘤抗原的供应者。这就是为什么必须能够在肿瘤抗原的背景下提供触发物,因为它们在患者的肿瘤细胞上表达。实现这一目标的唯一方法是向肿瘤细胞提供编码核酸,以便细胞机构可以在肿瘤抗原旁边表达触发抗原,从而使所有这些抗原都暴露于免疫系统的细胞。这种暴露会导致抗原间表位扩散,从而针对所有携带这些抗原的肿瘤细胞培养和激活适应性免疫反应,即使在没有触发抗原的情况下也是如此。
17.使用核酸作为疫苗具有多种其它优势。核酸疫苗可诱导体液和细胞免疫反应;有效剂量低;操作简单;利用快速测试;在大规模生产和分离中具有成本效益和可重复性;可以高频生产并且易于分离;比传统疫苗对温度更稳定;存放期长;易于储存和运输;并且不太可能需要冷链。
18.dna已成功用于疫苗。dna是一种双链分子,作为生物的蓝图,即遗传指令。dna适合用作疫苗,因为它相当稳定且无反应性,并且可以长期储存。然而,dna是自我复制的,很容易被紫外线辐射损坏。
19.另一方面,rna是单链的,且功能是执行dna的指令,即rna转移基因码以产生蛋白质。rna比dna更具反应性且稳定性更差,但对紫外线辐射具有抵抗力。事实证明,后一种特性使rna更适合用作疫苗。一般来说,mrna整合到宿主染色体的机会为零。mrna的递送导致感兴趣抗原的更快表达,并且需要更少的表达拷贝。mrna表达是短暂的,这似乎是一个缺点,但实际上增加了它的安全性。对于有丝分裂后和非分裂细胞中的蛋白质生产,mrna比dna更有效,因为dna需要通过核成员和质粒膜易位,而mrna只需要通过质粒膜易位。mrna不仅是翻译的模板,也是toll样受体的配体,并且对核酸酶敏感;因此,它呈现较少对于水平传播的担忧。
技术实现要素:
20.本发明基于编码免疫原性细菌蛋白质的核糖核酸信息(mrna)(seq id no:1、seq id no:13、seq id no:15和seq id no:16)的用途。可以使用多种已知技术中的任何一种将信息递送到细胞质中。一旦mrna到达细胞质,就会使用已经存在的细胞机制将其翻译成编码的蛋白质。细菌蛋白质,例如具有氨基酸序列seq id no:2或seq id no:14的m样蛋白接着将在细胞中表达,从而赋予癌细胞免疫原性。例如,m样蛋白可以来自细菌来源,a组和g组链球菌(gas和ggs),且因此被哺乳动物身体视为外来物。免疫监测细胞,例如抗原呈递细胞(apc)会被外源蛋白吸引。apc将吞噬整个癌细胞,且接着将所有外来/突变蛋白(包括m样蛋白)呈递给其它免疫细胞。
21.在细胞中产生细菌蛋白质是通过插入相应的基因码来实现的。m样蛋白的基因被称为emml。一旦emml信息被递送到含有由细胞dna的突变产生的异常蛋白质的癌细胞中,m样蛋白将在细胞中表达,吸引免疫细胞将其吞噬,并致使将先前被掩盖的突变蛋白质呈递给免疫系统。异常蛋白质可能已存在很长时间,但由于它们源自“自体”蛋白质,身体不一定
会将它们视为外来物或威胁。细菌蛋白抗原充当免疫系统的引物或触发物,以处理它之前可能无法识别为受损和有害的细胞。
22.如实例中所述地产生mrna。一旦获得,含有免疫原性信息的mrna可以被递送到需要本发明内容中描述的引发作用的自体或同种异体细胞中。mrna也可以直接在瘤内递送,或者在某些癌症(例如淋巴瘤)的情况下,也可以在结内递送。
23.一种由emml基因编码的m样蛋白先前已通过dna递送到细胞中,并已显示在细胞中表达以产生免疫学效应。由于对dna递送,包括基因整合到染色体中的可能性的担忧,通过rna递送信息是一种更安全的选择,因为它不能整合到宿主dna中。dna整合到宿主dna的这种能力在外源性dna整合可能产生不利影响的医学应用中变得尤为重要。与dna表达相反,mrna表达在细胞内最多只能持续几小时到几天。未递送到细胞中的mrna会被环境中存在的rnase快速降解,且因此不会造成水平传播的风险。当emml mrna成功转染到癌细胞中时,它可以在癌细胞中以及癌细胞表面上表达免疫原性细菌蛋白,且因此诱导免疫原性反应。
附图说明
24.图1说明了用于为m样蛋白的mrna生产而设计的重组质粒的骨架的质粒。
25.图2说明了用作要连接到图1的线性化载体中的emml基因的来源的质粒dna。
26.图3是在实体癌中进行的mrna试验的概要。
27.图4是说明mrna与dna之间的细胞生产途径差异的图。
28.图5显示了产生重组dna载体以生产编码细菌抗原的mrna。
29.图6显示了针对抗m样抗体的分离的emm55的蛋白质印迹。
30.图7显示了来自dna和rna转染的蛋白质表达的比较结果。
31.图8是使用flashgel系统合成的emm55 mrna的琼脂糖凝胶照片。
32.图9是显示在第1、2、3和4周后用emml mrna或水(对照)(c2)接种的小鼠中与emml蛋白反应的抗体的图。
33.图10是显示在用emml mrna接种前和接种后小鼠血液中存在与emml蛋白反应的抗体的蛋白质印迹。
34.图11是用于生产合成mrna的新型双链dna分子的图谱,该分子可以在哺乳动物细胞中高效翻译。此dna分子含有t7 rna聚合酶的序列(seq id no:8)、非洲爪蟾β珠蛋白基因5'非翻译区的一部分(seq id no:9)、具有用于插入emml的编码区的saci、noti、bglii、ecorv和spei的限制性内切核酸酶识别位点的多接头(seq id no:7)、非洲爪蟾β珠蛋白基因3'非翻译区的一部分(seq id no:10),然后是具有用于在体外转录之前线性化质粒的bamhi、ecori和xbai的限制性内切酶识别位点的多接头(seq id no:11)。对应于图11的dna序列是seq id no:12。
35.图12a-12b示出了emm55的相对适应性图。y轴是emm55的每个密码子的适应性指数,其中1.0非常适合人类细胞表达。
36.图12a是原始的emm55序列。
37.图12b显示了使用jcat算法优化后的emm55。
38.图13a-13c是来自用含有野生型尿苷(wt)和n1-甲基假尿苷的mrna瞬时转染hek293t和b16-f10细胞后表达的emm55的wes
tm
毛细管电泳分析的模拟蛋白质印迹。裂解物
为0.5μg/μl。erk1用作标准化对照.-,用egfp mrna转染的细胞。*,emm55freqdist转染后6小时,hek293t细胞裂解物仅与兔抗erk1一起培育。
39.图13a是emm55jcat。
40.图13b是emm55mostfreq。
41.图13c是emm55freqdist。*,emm55freqdist转染后6小时,hek293t细胞裂解物仅与兔抗erk1一起培育。
42.图14a-14b显示了来自图13所示图像的emm55的标准化表达。密码子适应性指数用于确定jcat算法中的密码子优化,其中1.0是完美优化的。
43.图14a显示了在hek293t细胞中的表达。
44.图14b显示了在b16-f10细胞中的表达。
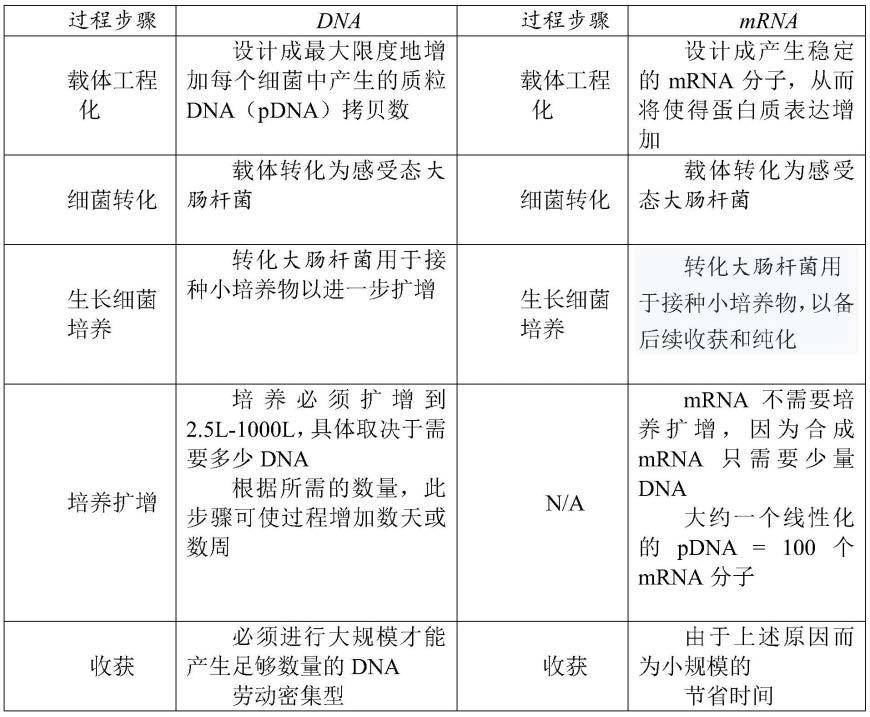
45.图15a-15b显示了hek293t细胞中emm55表达的时间过程。
46.图15a是在wes
tm
最大信号强度下进行的初始分析。
47.图15b是在降低蛋白质负载下的重复实验。通过单向方差分析和bonferroni事后检验确定的显著性。*,p《0.05;**,p《0.01,***,p《0.001,****,p《0.0001(n=3)。空心星形,emm55jcat-n1与pac/emm55之间的显著性。实心星形,emm55jcat-wt与pac/emm55之间的显著性。
具体实施方式
48.本发明提供了一种癌症疫苗,与以前使用的疫苗相比,该癌症疫苗可以高效地制备并且费用更低,该癌症疫苗通过将质粒dna直接引入细胞核来制备。使用插入细胞质中的emml编码mrna(seq id no:1、seq id no:13、seq id no:15和seq id no:16)在转染肿瘤细胞方面更有效。
49.本发明进一步提供了几种新的emml编码rna,其设计用于优化转化细胞中增加的表达。使用几种密码子优化算法实现了emm55蛋白的更稳健的表达,该算法设计用于使emm55核苷酸序列适应哺乳动物表达。
50.mrna能够将抗原性蛋白质信息递送到癌细胞中。mrna不仅是一种更安全的替代品,因为它不能整合到宿主dna中;而且表达也仅限于几小时到至多几天。mrna递送还将抗原信息进一步置于细胞蛋白质生产过程中,从而在细胞中提供更快的表达。mrna只需要被递送到细胞质中,而dna最终必须进入细胞核才能发挥作用。使用mrna有利于生产蛋白质抗原,因为mrna可以在有丝分裂后和非分裂细胞中诱导蛋白质生产。
51.尽管抗原蛋白的mrna递送是dna递送的更安全替代方案,但必须解决mrna的稳定性和免疫原性问题。许多有助于增加稳定性和免疫原性的元件被工程化到重组载体模板中。如果载体中不含合适的元件,可以添加该元件;例如,如果模板载体不包含聚(a)尾部编码序列,则在转录过程中添加该尾部。
52.为了在细胞质中增加稳定性,mrna必须同时含有5'-甲基鸟苷帽和3'-聚(a)尾部(seq id no:3)。这些元件负责吸引和附着负责将mrna翻译成蛋白质的细胞机构的成分。缺少这些成分会减少mrna在降解之前可用于蛋白质翻译的时间。因此,如实例中所述,这些元件已被并入mrna。
53.高效的免疫原性可以通过利用诸如病毒载体、纳米颗粒、阳离子聚合物、脂质和电
穿孔的增强递送等技术来增加。病毒载体已广泛用于质粒dna(pdna)的递送,但存在若干风险以及成本增加。由于较不严格的电设置,使用mrna进行电穿孔对细胞的毒性较小,并且是一种优选的mrna递送方法。dna需要更高的电荷才能使dna通过外细胞膜和核膜,而mrna只需要通过外细胞膜。
54.与pdna相比,用于疫苗的mrna的生产具有经济和生产益处。mrna是从线性化的pdna模板体外合成的,并且只需要少量的dna。另一方面,大量pdna的生产是劳动密集型的,并且需要大型发酵罐等设备来培养足够的细菌以产生疫苗生产所需的大量pdna。虽然从大型培养物中分离的pdna是纯的,但由于质粒的环状性质,最终产物以三种结构形式出现:松弛、线性和超螺旋。尽管每种形式都能够在进入细胞后产生抗原蛋白,但每种dna形式通过质膜进入细胞的能力各不相同。mrna的生产仅产生一种结构形式。此外,由于生产的合成方法,批次间的再现性很高。
55.从生产的角度来看,mrna是由dna合成的,并且具有高度的再现性。这对于用作疫苗很重要,因为不需要大规模生长,即它需要更少的时间和材料,并且污染的风险也更小。这些因素有助于降低成本。此外,mrna的合成导致更高的产率,因为它只需要一个线性化的质粒dna即可产生一百个mrna分子。mrna在体外产生,因此分离后没有大肠杆菌污染(基因组dna或内毒素)。这导致更少的纯化步骤和质量控制测试。体外转录的合成性质也确保了更好的批次间再现性和更纯的产品,因为包括选择标记在内的载体序列不是最终产品的一部分。同样与dna不同的是,mrna具有单一分子构象,而质粒dna具有三个分子构象。mrna也比质粒dna更容易转染,并且由于需要较低的电压,因此在电穿孔过程中细胞死亡较少。与dna一样,mrna也可以被冻干。从监管的角度来看,mrna更安全,因为它是不可复制的并且是暂时的。mrna也不会造成环境问题,因为它很容易降解并且不会产生抗生素抗性。
56.下面的比较说明了使用mrna代替dna将抗原性emml信息递送到癌细胞中的优势。该比较分为三个部分;上游生产、下游生产和细胞递送。大部分好处,包括降低的生产成本、缩短的制造时间、卓越的信息递送和提高的安全性都在上游生产和细胞递送中可见。每个部分都显示了dna与mrna过程之间的巨大差异,以及每个过程的相似步骤。
57.上游生产:
58.两种核酸产品的上游生产在细菌培养扩增前几乎相同。只需要少量的dna就可以生产大约100倍量的mrna。例如,体外转录实验仅从0.2μg dna中便产生了25μg mrna。这是比使用相同培养量产生的dna多25倍的mrna。培养扩增可能非常昂贵和耗时,并会导致dna污染或突变的风险增加。
59.只需要培养少量细菌培养物的好处是显著的。这种培养物中的少量dna需要进行较小的分离。这种缩小规模可以节省时间和资源并降低污染风险。最终mrna产物的生产需要从dna模板转录mrna的额外步骤。这是在体外进行的合成步骤。由于转录的合成性质,批次间的再现性良好,并且整个过程只需几个小时。培养含有dna的细菌可能需要长达数天的时间。
60.使用pdna而不是mrna的一个显著缺点是最终产品有可能被基因组dna(gdna)污染。此外,分离的pdna形成三种构型;不以相同效率转染细胞的线性、超螺旋和圆形。mrna最终产物是纯的、呈单一构象并且没有被gdna或pdna污染。
61.表1比较了用于dna和mrna生产的步骤。
62.表1
[0063][0064][0065]
下游生产(自体制备):
[0066]
dna和mrna的大部分下游生产是相同的。一个区别在于电穿孔步骤。mrna需要较低的电压,因为它只需要通过质膜且无需通过核膜,不像dna,它必须通过质膜和核膜。较低的电压是有利的,因为它使得电穿孔过程中的细胞死亡较少。mrna转染细胞增加的活力转化为足够比例的轻松表达m样蛋白的疫苗细胞。
[0067]
表2比较了肿瘤组织中dna和mrna的处理,从制备到在转染细胞中接种。
[0068]
表2
[0069][0070][0071]
细胞递送:
[0072]
下面的细胞递送流程表展示了使用mrna递送的显著优势。如表所示,递送到细胞中的mrna跳转到立即翻译为抗原性m样蛋白。转染的dna不仅必须通过额外的细胞膜,而且还必须转录成mrna以递送回细胞质,这是由mrna疫苗启动的蛋白质合成的起点。
[0073]
根据所需的效果,mrna疫苗可以与相容的免疫佐剂或阻遏物结合。如trimix(一种免疫刺激分子的混合液)的佐剂可以添加到基于mrna的疫苗中,引发针对编码免疫原的增强免疫反应。免疫阻遏物可用于对抗其它元件的免疫抑制酶,该酶可能阻碍身体产生足够的免疫反应的能力。这些免疫抑制元件可以通过使用可以在免疫过程中共同递送的沉默rna(sirna)来沉默。可以与基于mrna的癌症疫苗联合施用的另一种类型的免疫阻遏物是检查点抑制剂。这些通常由抗体组成,该抗体例如抗pd1和抗ctla4,它们与肿瘤细胞或免疫激活细胞上存在的受体结合,如果不加以阻断,则会诱导免疫抑制。这个过程被称为“踩下刹车”,并且正如它所暗示的,这种“刹车”的释放允许免疫疗法,如mrna癌症疫苗来磨练免疫系统攻击癌细胞的努力。
[0074]
上述疫苗不仅可以与检查点抑制剂疗法联合使用,还可以在施用rna疫苗之前或同时与化学疗法、放射疗法、全细胞疫苗、其它核酸疗法、自然杀伤细胞疗法或嵌合抗原受
体疗法联合使用。
[0075]
在其它情况下,在施用疫苗之前或同时,用改变肿瘤微环境的方案治疗癌症患者,该方案包括但不限于细胞因子、抗趋真菌剂(anti-fugetaxis agent)、趋化剂和节律剂量的化学品。
[0076]
表3比较了细胞中从细胞进入到翻译的dna和mrna处理。
[0077]
表3
[0078][0079]
在实例23-25中,可以使用体外转录反应产生编码emml的mrna。在此反应中可以对所得mrna进行一些修饰,以提高mrna和emml蛋白的稳定性和翻译效率,并降低mrna的免疫原性。例如,可以将修饰的核酸连接到emml mrna的5'端,例如但不限于抗反向帽类似物[arca,p1-(5'-(3'-o-甲基)-7-甲基-鸟苷)p3-(5'-(鸟苷))三磷酸)]、n1-甲基鸟苷、2'氟鸟苷、7-脱氮鸟苷、肌苷、8-氧代鸟苷、2-氨基鸟苷、lna-鸟苷和2-叠氮基鸟苷。
[0080]
在另一个实例中,长度大约为50-200个单磷酸腺苷的聚(a)尾部可以连接到emml mrna的3'端,或者5'修饰的核苷酸帽和聚(a)尾部都可以添加到emml mrna。
[0081]
emml mrna可以用核糖核苷酸类似物合成。在这个阶段可以进行化学修饰,以进一步提高翻译效率和稳定性。实例包括5-甲基-胞苷-5'-三磷酸、假尿苷-5'-三磷酸、2-硫尿苷-5'三磷酸和n1-甲基假尿苷-5'-三磷酸。
[0082]
有多种方法可以将mrna递送到细胞,从而以高水平产生emml蛋白。例如,可以将体外转录后产生的emml mrna直接注射到组织或肿瘤中。
[0083]
脂质或聚合物等复合剂可用于保护rna免于降解、增强细胞摄取并改善向细胞质中的翻译结构的递送。在一个实施例中,emml mrna与由亲脂性物质,如胆固醇和合成磷脂制备的脂质体复合。
[0084]
在一个实施例中,emml mrna与由亲脂性物质,如胆固醇和天然磷脂制备的脂质体复合。
[0085]
在一个实施例中,emml mrna与阳离子脂质,例如但不限于n-[1-(2,3-二油酰氧基)丙基]-n,n,n-三甲基甲基硫酸铵(dotap)复合。
[0086]
在一个实施例中,emml mrna与两性离子脂质,例如但不限于3-[(3-胆酰胺丙基)二甲基铵]-1-丙磺酸盐(chaps)复合。
[0087]
在一个实施例中,emml mrna与聚乙二醇化脂质,例如但不限于n-(羰基-甲氧基聚乙二醇_2000)-1,2-二硬脂酰-sn-甘油-3磷酸乙醇胺(dspe-peg)复合。
[0088]
在一个实施例中,emml mrna与阳离子、两性离子和聚乙二醇化脂质的混合物复合。
[0089]
在一个实施例中,emml mrna与鱼精蛋白复合。
[0090]
在一个实施例中,emml mrna与由特定物质(例如日本的血凝病毒)制备的脂质体复合,该物质已用于制备用于治疗黑色素瘤的mrna疫苗[26]。
[0091]
在一个实施例中,emml mrna可以与一种聚合物复合,该聚合物被合理设计成具有多种模拟病毒成分以高效转染特定细胞的物质。这些将包括但不限于膜破坏肽、核酸结合成分、保护涂层和外部靶向配体。
[0092]
在一个实施例中,可以将复合组分组合并配制成单个纳米颗粒。
[0093]
在一个实施例中,emml mrna或emml mrna复合物可以与针对免疫检查点分子的干扰rna或干扰rna复合物组合,该免疫检查点分子例如程序性细胞死亡蛋白1(pd-1)、程序性死亡配体1(pd-l1)、细胞毒性t淋巴细胞相关蛋白4(ctla-4)或具有ig和itim域的t细胞免疫受体(tigit)。一个非限制性实例是emml mrna复合物和靶向pd-1的短干扰rna(sirna)复合物。
[0094]
在一个实施例中,emml编码区可以与病毒rna复制基因结合形成能够自我复制的线性rna分子。然后可以将这种线性rna分子与亲脂性化合物和脂质一起配制,以形成能够用自我复制的mrna转染细胞的脂质体。
[0095]
在一个实施例中,emml mrna或用脂质、鱼精蛋白或在脂质体中配制的emml mrna与可生物降解的聚合物复合。一个非限制性实例是聚己内酯,它已被美国食品和药物管理局批准用作药物递送装置。可生物降解聚合物复合的优势在于,随着聚合物的降解,mrna或mrna复合物可以在长时间范围内递送。这种持续递送可以增强疫苗的有效性。
[0096]
在一个实施例中,可以将emml mrna或emml mrna复合物配制在含有增强emml mrna疫苗效力的组织或肿瘤特异性因子的可生物降解聚合物中。一个实例可以是用含有抑制血管新生或血管生成的因子的生物聚合物配制的emml mrna疫苗,从而提供协同抗肿瘤作用。
[0097]
在一个实施例中,可以将emml mrna或emml mrna复合物配制在含有降低免疫检查点分子,例如pd-1、pd-l1、ctla-4或tigit表达的因子的生物可降解聚合物中。作为非限制性实例,这可以包括现有的或新的药物试剂,例如降低pd-1表达的小分子或抗体,从而提供协同抗肿瘤作用。
[0098]
在一个实施例中,可以将emml mrna或emml mrna复合物配制在含有干扰rna或干扰rna复合物的生物可降解聚合物中,该干扰rna或干扰rna复合物用于降低免疫检查点分
子,例如pd-1、pd-l1、ctla-4或tigit的表达的因子。一个非限制性实例是emml mrna复合物和短干扰rna(sirna)复合物。
[0099]
在一个实施例中,emml mrna或emml mrna复合物可以与佐剂,例如合成双链rna聚核糖肌苷聚核糖苷酸[聚(i:c)]组合。
[0100]
psfcmvt/emml设计元件的分析
[0101]
若干设计元件可以提高emml蛋白质生产水平。
[0102]
将实例1中详述的mrna疫苗(seq id no:1-3)克隆到oxford genetics psf-cmv_t7质粒dna载体中以产生psfcmvt7/emml。尽管检测到哺乳动物细胞转染后的mrna表达,但在蛋白质印迹上仅检测到低水平的emm55蛋白。psfcmvt7/emml的回顾性分析鉴定了可以提高哺乳动物细胞翻译效率的设计元件。
[0103]
至少有两种不同类型的设计元件可以提高emml蛋白质生产水平。近端元件靠近emml编码区,且在pac/emm55的emml聚合酶链反应(pcr)扩增过程中添加。远端元件远离emml编码区,且可在增强来自mrna的蛋白质的表达中通用。
[0104]
近端元件包括将针对哺乳动物细胞表达优化的翻译起始序列引入emml编码区的n端。此序列已被确定为rymrmvatggc,其中r是a或g,y是c或t,m是a或c,且v是a、c或g(seq id no:4)。在一个实施例中,最佳翻译起始序列atagccatggc(seq id no:5)替代了emml的天然起始密码子。
[0105]
在此近端设计元件的一个实施例中,合成寡核苷酸pcr引物,使得在简并位置(seq id no:4中的r、y、m和v)处的每个核苷酸具有等摩尔浓度,并且最终的寡核苷酸合成产物包含所有可能的引物序列。在当前的实施例中,在将emml基因亚克隆到哺乳动物表达质粒dna载体中之后,通过比较诸如蛋白质印迹的分析中的emml蛋白质表达水平凭经验确定最佳翻译起始序列。
[0106]
另一个可用于修饰emml编码区c末端的近端设计元件是在天然终止密码子之后添加终止密码子。许多真核表达质粒载体含有所有三种终止密码子变体tag、taa和tga的dna序列,紧跟在所表达基因的最后一个密码子之后。由于天然emml终止密码子的dna序列是tag,因此可以包括seq id no:6作为添加的近端设计元件。
[0107]
另一个近端设计元件是添加限制性内切核酸酶识别位点,可将该识别位点添加到emml编码区的n和c末端,以促进其插入质粒克隆载体中。限制性内切酶识别位点的选择是基于目的质粒。可以使用的限制性内切核酸酶的一些实例是saci、noti、bglii、ecorv和spei。在一个优选的实施例中,saci和spei位点被添加到emml编码区的n和c末端,因为它们不在emml编码区内切割并且共享反应条件,因此它们可以同时用于制备emml编码区pcr扩增子,用于插入目标质粒中。
[0108]
将emml编码区远端的设计元件添加到质粒克隆载体中,以便可以插入emml编码区的任何变异,或与近端设计元件相适应的其它基因。可以对这些远端元件进行工程化以产生mrna表达载体,该载体能够驱动emml或任何其它哺乳动物mrna的高水平mrna和蛋白质表达。
[0109]
一个远端设计元件是噬菌体rna聚合酶启动子区域的dna序列。噬菌体rna聚合酶的实例是t7、t3和sp6。在一个实施例中,t7 rna聚合酶的启动子(seq id no:8)是以如下方式添加的若干远端元件中的第一个,即相对于t7 rna聚合酶的作用,其最终位于emml编码
区的上游。
[0110]
转录但未翻译的真核基因编码区的紧邻5'和3'的rna序列,称为非翻译区(utr),可以对体外转录的mrna的蛋白质翻译产生强烈的正面或负面影响。一般来说,支持高水平蛋白质表达的utr是非结构化的,缺乏负调控序列,并且可能含有用于进一步细化基因表达模式的微rna的结合位点。通常在哺乳动物细胞中高度表达的基因的utr,或来自具有与需要mrna疫苗表达的组织匹配的表达模式的基因的utr,均可用于优化基因产物(例如emml蛋白质)的递送。来自非洲爪蟾β珠蛋白基因的utr已被广泛用于介导多种真核细胞中的高水平翻译,包括用于哺乳动物免疫治疗的rna的设计。组织特异性utr的实例是色氨酸羟化酶(tph)同型,其驱动松果体和脑干中的差异表达。
[0111]
在一个实施例中,就rna聚合酶活性而言,非洲爪蟾β珠蛋白基因5'utr可位于emml编码区的上游。seq id no:9是非洲爪蟾β珠蛋白基因5'非翻译区的一个非限制性实例。
[0112]
在一个实施例中,就rna聚合酶活性而言,非洲爪蟾β珠蛋白基因3'utr可位于emml编码区的下游。seq id no:10是非洲爪蟾β珠蛋白基因3'非翻译区的一个非限制性实例。
[0113]
在一个实施例中,非洲爪蟾β珠蛋白基因5'和3'utr都可以位于emml编码区的侧翼。
[0114]
在一个实施例中,基于疫苗靶向的肿瘤细胞的类型选择5'和3'utr。在一组非限制性实例中,当用于治疗黑色素瘤时,在黑色素瘤细胞中高度表达的基因的5'和3'utr可用于为基于emml的疫苗提供高水平的细胞特异性表达,该基因例如酪氨酸酶(tyr)、黑素生成相关转录因子(mitf)、黑皮质素受体1(mc1r)、端粒酶(tert)、环氧合酶2(cox2)、c-x-c基序趋化因子受体4(cxcr4)和含有5个基因的杆状病毒iap重复序列(birc5)。
[0115]
在一个实施例中,可以在5'和3'utr之前、之后或之内包括不位于初级基因转录物内的赋予所需表达水平和特异性的其它遗传元件,以进一步改进疫苗表达。
[0116]
另一个远端设计元件是合成dna序列,它提供限制性内切核酸酶识别位点,该位点可用于将emml编码区插入其它侧翼远端设计元件。在一个实施例中,使用了saci、noti、bglii、ecorv和spei的限制性内切核酸酶识别位点(seq id no:7)。
[0117]
另一个远端设计元件是合成dna序列,它提供限制性内切核酸酶识别位点,以在emml编码区之后立即切割目的质粒,以产生线性质粒dna分子。线性化为rna聚合酶活性提供了有效的终止,从而增加了长度一致的mrna转录本的产生。序列的一个实例是seq id no:11,其含有bamhi、ecori和xbai的限制性内切核酸酶识别位点。在一个优选的实施例中,bamhi可用于线性化含有emml编码区的质粒,因为它不在emml编码区内切割并留下5'核苷酸突出端,这可以允许比3'核苷酸突出端更高的转录效率。
[0118]
在一个实施例中,通过使用重叠互补的合成单链寡核苷酸分子来合成含有上述远端设计元件的双链dna分子。这些分子被退火,并且剩余的间隙被dna聚合酶,如taq聚合酶填充。
[0119]
在一个实施例中,可以合成两个互补的合成单链寡核苷酸分子以包含所有所需的远端设计元件。然后将这些寡核苷酸分子退火。在上述任一实施例中,所得的平末端合成dna分子可通过添加模板非特异性腺苷插入到pcr克隆载体,如invitrogenii-topo质粒中。这是通过将平末端合成dna分子与taq聚合酶和脱氧腺苷三磷酸以大约200μm最终浓度在720℃下培育10分钟来实现的。
[0120]
在一个实施例中,含有上述远端设计元件的质粒被命名为pt7xlutr。插入到ii-topo中的合成dna分子的图谱如图11所示,并且核苷酸序列显示为seq id no:12。此序列含有上述远端设计元件,但不代表可以添加以支持所需表达水平或特异性的元件的全部或完整范围。
[0121]
pt7xlutr可用于转化大肠杆菌。用pt7xlutr转化的细菌可以在含有与pcr克隆载体相匹配的抗生素的琼脂板上进行选择,例如含有补充有50-100μg/ml卡那霉素或羧苄青霉素的luria bertani培养液的琼脂板。细菌培养物可以通过在液体抗生素选择性培养基中生长而扩增,该培养基例如补充有50-100μg/ml卡那霉素或羧苄青霉素的luria bertani培养液,以及使用本领域技术人员已知的方法制备的质粒dna。
[0122]
发现包含几个上述设计元件的rna会增加emm55的表达。序列示于seq id no:13、seq id no:15和seq id no:16中。
[0123]
实例
[0124]
提供以下实例作为本发明的说明并且决不认为是限制性的。
[0125]
实例1.犬淋巴瘤的自体mrna疫苗
[0126]
一条75磅的雄性已绝育罗得西亚脊背犬(rhodesian ridgeback),因下颌和腹股沟淋巴结肿大去兽医处就诊。对患者的一个肿大淋巴结进行了细针抽吸。经病理学家复查,它被诊断出患有低度弥漫性淋巴瘤。
[0127]
由于在免疫疗法治疗中报告的副作用最小,患者的主人选择进行免疫疗法治疗而不是化学疗法和类固醇。兽医在患者全身麻醉时切除右下颌淋巴结。组织样品连夜(overnight)运送用于实验室处理。
[0128]
在实验室收到组织样品后,执行以下操作:1)检查转送介质是否有任何细菌污染,2)测量组织尺寸,3)使用若干团剂(bolus)洗涤介质反复吸出完整的淋巴结以释放肿瘤细胞,以及4)收集并计数吸出的细胞。
[0129]
适当数量的细胞可用于用emml编码mrna进行电穿孔。使用biorad gene pulse机器,用80μg mrna转染120
×
106个细胞。一小部分转染的细胞被冷冻保存,而其余的则在培养物中放置大约24小时。24小时后,细胞被照射并等分到10
×
106个细胞疫苗剂量中,冷冻保存直至需要。
[0130]
患者共接种了8剂疫苗。每个剂量都从实验室连夜运送到兽医诊所,在预定的施用日到达。兽医使用带针头的注射器皮内施用每个剂量。8剂疫苗每7天(+/-1天)接种一次,持续4周,且接着每月一次,持续4个月。在第一剂量之前采集血样。随后的血样在第5次疫苗接种、第8次疫苗接种之前和最后一次疫苗接种8周后采集。血样被处理为外周血和血浆,并保存在实验室。它们后来用于评估抗肿瘤免疫反应。
[0131]
在整个治疗过程中,会监测患者的淋巴结大小以及其整体生活质量。通过肿瘤负荷减少和抗肿瘤免疫反应来评估整体疾病状态。通过在整个治疗过程中对每个淋巴结进行测量来评估肿瘤负荷。抗肿瘤免疫反应使用标准酶联免疫吸附分析(elisa)测量以评估抗体水平以及使用流式细胞术测量以评估细胞毒性t细胞(ctl)反应。
[0132]
在治疗过程中,患者的淋巴结大小会随着治疗过程的进行而增大且随后减小。这一观察结果可能是由于免疫细胞浸润到肿瘤部位,在这种情况下是淋巴结。elisa和流式细胞术结果显示,在接种第四次疫苗后抗体产量和ctl增加,这接着在系列疫苗完成后持续存
在。
[0133]
实例2.用于马黑色素瘤的直接mrna疫苗
[0134]
一匹15岁的安达卢西亚马(andalusian),因颈部、鬃毛和肛周区域有黑色病变去兽医处就诊。在检查细针抽吸物后,病理学家诊断出患者患有黑色素瘤。由于切除患者肛周病变的复杂性,主人选择进行免疫疗法。
[0135]
制备了三个疫苗剂量,在100μl无菌无核酸酶h2o中含有100μg mrna。三个剂量和三个无针注射装置(j-tip)被运送给兽医。选择患者的三个病灶接受治疗过程,每个时间点总共300μg mrna。像以前一样,每两周将另外三个剂量运送到兽医诊所,并使用j-tip装置将每个剂量施用于相同的三个病灶。患者每个病灶总共接受六剂疫苗。
[0136]
在疫苗系列开始之前、第5次疫苗接种之前和系列完成后两周收集血样。血样被处理为外周血和血浆并保存。它们随后用于评估抗肿瘤免疫反应。
[0137]
通过肿瘤负荷减少和抗肿瘤免疫反应来评估整体疾病状态。在施用六剂疫苗中的每一个之前,通过对病灶进行的测量来评估肿瘤负荷。抗肿瘤免疫反应使用标准elisa测量以评估抗体水平以及使用流式细胞术测量以评估ctl反应。
[0138]
正如在接受免疫疗法治疗的其它患者中所见,黑色素瘤病灶的大小最初会增大,然后随着疫苗系列的进展而减小。elisa和facs结果显示在第二次疫苗接种后抗体产量和ctl增加,这将在系列疫苗完成后持续存在。
[0139]
实例3.emml mrna产生方法概述
[0140]
方法概述:
[0141]
载体和插入物的限制性酶消化
[0142]
为了产生用于最佳mrna生产的合适的重组质粒,使用了包括双原核生物和真核生物启动子、未翻译的3'和5'区以及选择标记的质粒骨架。这种类型的载体,例如psfcmvt7具有多种特征,所述特征帮助编码抗原性m样蛋白(如emm55)的mrna的产生和稳定。使用限制酶saci和ecorv切割载体psfcmvt7和含有质粒pac/emml的插入物。质粒图谱参见图1和2。
[0143]
使用凝胶电泳分离dna片段
[0144]
用合适的酶进行限制性消化后,通过凝胶电泳分离dna片段。参考dna梯度液与两种消化反应物一起运行以评估dna条带长度,从而帮助鉴定感兴趣的条带。从凝胶中提取含有dna的条带。
[0145]
凝胶提取/dna分离
[0146]
溶解含有目标dna的凝胶切片并提取dna,以便将载体和插入物连接在一起以产生重组质粒psfcmvt7/emml。
[0147]
载体和插入物连接
[0148]
在载体和含有质粒的插入物的限制性消化过程中,产生了“粘性末端”,随后通过连接反应将其拼接在一起。“粘性末端”是指可用于与互补核苷酸形成氢键的未配对核苷酸。由于载体psfcmvt7和插入物emml是用相同的限制性内切酶切割的,因此它们包含在暴露于t4 dna连接酶时连接的互补末端。
[0149]
转染到细菌中
[0150]
在产生mrna生产质粒psfcmvt7/emml后,将其转化,即转染到能产生足够dna的感受态细菌中,该dna被分离并用于体外mrna合成。invitrogen的stbl3大肠杆菌是可用于转
染的细菌类型的一个实例。通过热休克细菌在细胞膜上打开小孔,使质粒进入细胞并最终进入细胞核,从而诱导转化。
[0151]
细菌培养物的生长和扩增
[0152]
将用质粒转染的细菌置于含有选择性抗生素的适当生长培养基上。在psfcmvt7的情况下,这是一种卡那霉素。如果用质粒正确转化细菌,它们将产生一种蛋白质,该蛋白质会阻碍卡那霉素的抗菌特性,并使卡那霉素抗性细菌在培养基上选择性地生长。
[0153]
质粒分离和纯化
[0154]
在足够数量的含有pdna的细菌生长后,细胞被裂解,从而使质粒从细胞内部释放出来。pdna通过过滤和阴离子交换柱从gdna、蛋白质和其它细胞碎片中分离出来。
[0155]
模板dna的制备:质粒dna线性化
[0156]
分离的dna含有用于mrna生产的模板dna。为了发生转录反应,质粒必须被线性化。重要的是线性化发生在感兴趣的开放阅读框基因的下游。
[0157]
mrna转录反应
[0158]
模板已制备后,信息通过体外转录反应产生。此反应模拟细胞中mrna的转录,包括5'端加帽和添加聚(a)尾部以增加稳定性。
[0159]
mrna纯化
[0160]
一旦信息被转录成mrna,残留的dna模板就会被降解,使得纯mrna产物可以用于转染至自体细胞、同种异体细胞或在瘤内转染。一旦进入细胞内,mrna将产生并在细胞表面上展示m样蛋白以进行免疫激活。
[0161]
用mrna转染癌细胞
[0162]
将mrna递送到癌细胞中的一种方式是通过电穿孔方法。这种方法利用微弱的电流,使细胞膜打开小孔,然后让mrna穿过膜并进入细胞质。
[0163]
实例4.限制酶消化
[0164]
表1显示了pdna的快速消化程序。
[0165]
表1
[0166][0167]
实例5.用凝胶电泳分离dna片段。
[0168]
表2显示了dna片段分离的程序。
[0169]
表2
[0170][0171]
实例6.凝胶提取/dna分离
[0172]
表3显示了提取和dna分离的程序。
[0173]
表3
[0174][0175][0176]
实例7.载体和插入物连接。
[0177]
表4显示了载体插入和连接的程序。
[0178]
表4
[0179][0180][0181]
实例8.将dna转化为大肠杆菌。
[0182]
表5显示了大肠杆菌的转化程序。
[0183]
表5
[0184][0185][0186]
实例9.细菌培养物的生长和扩增
[0187]
表6显示了细菌培养物的生长和扩增程序。
[0188]
表6
[0189][0190]
实例10.质粒分离纯化
[0191]
表7显示了质粒分离和纯化的程序。
[0192]
表7
[0193][0194]
[0195]
实例11.模板dna的制备。
[0196]
表8显示了模板dna的制备和质粒线性化的程序。
[0197]
表8
[0198][0199][0200]
实例12.mrna转录
[0201]
表9显示了转录mrna的程序
[0202]
表9
[0203][0204]
实例13.mrna纯化
[0205]
表10显示了纯化mrna的程序
[0206]
表10
[0207]
[0208][0209]
实例14.用mrna转染癌细胞
[0210]
下面的表11显示了用emml mrna转染哺乳动物癌细胞的程序。
[0211]
表11
[0212][0213]
实例15.dnapsfcmvt7/emml的克隆步骤。
[0214]
图5显示了产生重组dna载体以生产编码细菌抗原的mrna的程序。
[0215]
实例16.抗体与m样蛋白的直接结合。
[0216]
图6所示的蛋白质印迹证明了抗m样蛋白抗体对分离的m样蛋白,特别是emm55的特异性。
[0217]
使用含130mmβ-me的上样缓冲液,通过sds-page(10%)分离蛋白质。样品在100℃
下煮沸3分钟,且在室温下以13,000x g旋转2分钟。印迹(最左侧)在室温下在5%牛奶中用一抗(α-m样蛋白)探测1.5小时。一抗稀释度为1:500。二抗(山羊α-小鼠偶联的hrp)稀释度为1:5000。空印迹(左起第二个)显示了二抗的非特异性结合。
[0218]
使用化学发光使硝酸纤维素印迹上的蛋白质可视化(暴露:10分钟)。
[0219]
实例17.荧光显微镜图像和图表表明,与dna相比,mrna的表达增加。将rna和dna转染到哺乳动物细胞中并分析蛋白质表达的实验中的结果进行了比较。结果显示,等转染量的rna产生了五倍的表达量。(见图7)。
[0220]
实例18.合成的emml mrna,无尾部和有尾部。
[0221]
用于执行图8所示的变性琼脂糖凝胶的程序表明使用lonza flashgel系统对合成的emml mrna,特别是emm55 mrna的可视化。
[0222]
通过使用depc处理过的水将总量稀释成2.5μl体积来制备20ng样品和100ng梯度液。向每个样品中加入等体积的甲醛样品缓冲液。混合样品,且接着在65℃下培育15分钟,然后在冰上培育1分钟。将样品装入1.2%rna凝胶盒中,且接着在225伏下运行8分钟。凝胶在室温下培育10分钟,且接着使用flashgel相机进行可视化。mrna大小由rna millennium marker确定。
[0223]
实例19
[0224]
表4显示了一项实验的结果,其中将rna(emml mrna)和dna(psfcmvt17/emml)转染到哺乳动物细胞中,用α-m样蛋白染色,并使用流式细胞分析进行分析。结果显示,rna转染细胞产生与dna转染细胞相等的信号,即9%。
[0225]
表4
[0226][0227]
实例20
[0228]
关于是否存在与emml蛋白发生反应的抗体对来自接种了emml mrna(治疗)或无菌水(对照)的小鼠的血样进行了测试。如图9所示,来自对照小鼠(c2)的血样不含α-m样蛋白抗体,而治疗小鼠(t2)样品显示出轻微升高。
[0229]
实例21
[0230]
表5显示了一项实验的结果,在该实验中,小鼠被移植黑色素瘤肿瘤细胞,且随后注射emml mrna(治疗)或无菌水(对照)。注射方案在肿瘤植入后10天开始。方案由每七天施用三次治疗或对照注射组成。实验中的所有五只小鼠都活过了注射#2。此时,三只治疗小鼠中有两只的肿瘤比对照小鼠小。五只小鼠中的三只活过了注射#3,此时剩余的两只治疗小鼠的肿瘤仍小于剩余的对照小鼠肿瘤。
[0231]
表5
[0232][0233]
实例22
[0234]
图10显示了来自实验的结果,其中测试来自用emml mrna接种之前和之后的小鼠的血样中与emml蛋白反应的抗体的存在。蛋白质印迹图像表明,接种后采集的血样相比于接种前样品增加了抗体的结合。
[0235]
实例23
[0236]
使用具有高保真taq dna聚合酶的pcr扩增来自pac/emm55质粒的emml编码区。在一个实施例中,此扩增子设计成具有包括与psf-cmv_t7载体相容的限制性内切核酸酶位点的近端元件,以最小化psfcmvt7/emml的5'和3'utr内的潜在抑制元件。
[0237]
近端设计元件包括ncoi和xhoi的限制性内切核酸酶识别位点、最佳翻译起始序列(seq id no:4或5)和emml编码区下游的两个额外终止密码子(seq id no:6),相对于t7 rna聚合酶的活性。所得扩增子可以插入pcr克隆载体,例如ii-topo。所得质粒可用于转化大肠杆菌,选择在含有与pcr克隆载体相匹配的选择性抗生素的琼脂板上进行阳性转化,例如在ii-topo的情况下,含有补充有50-100μg/ml卡那霉素或羧苄青霉素的luria bertani培养液的琼脂板。
[0238]
含有所得质粒的细菌培养物可以通过在液体抗生素选择性培养基中生长进行扩增,例如在ii-topo的情况下,补充有50-100μg/ml卡那霉素或羧苄青霉素的luria bertani培养液。可以使用本领域技术人员已知的方法从这些细菌培养物中制备质粒dna。然后可以使用限制性核酸内切酶ncoi和xhoi从ii-topo质粒dna中切除侧翼为近端
设计元件的emml编码区。然后可以将侧翼为近端设计元件dna片段的emml编码区插入psf-cmv_t7载体中,该载体已用ncoi和xhoi消化。在连接、细菌转化、在含有50-100μg/ml卡那霉素的琼脂板上选择阳性转化、在补充有50-100μg/ml卡那霉素的luria bertani培养液中扩增以及使用本领域技术人员已知的方法进行质粒dna制备之后,所得质粒psf/emml可用作模板,用于在用限制性内切核酸酶xhoi线性化后进行体外mrna合成。所得的mrna和预测的氨基酸序列分别显示为seq id no:13和14。
[0239]
实例24
[0240]
高保真taq dna聚合酶用于从具有近端设计元件的pac/emm55质粒扩增emml编码区,该近端设计元件包括与pt7xlutr的多接头区域相容的限制性内切核酸酶位点。在一个实施例中,这还可以包括最佳翻译起始序列(seq id no:4或5)和两个额外的终止密码子(seq id no:6)。此实施例的完整序列示于seq id 15中。所得扩增子可插入到pcr克隆载体,粒如ii-topo中。在实例23中描述的细菌转化、选择、扩增和质粒dna制备之后,可以用限制性内切核酸酶saci和spei消化所得质粒以从ii-topo中切除具有近端设计元件的emml编码区。然后可以将具有近端设计元件的emml编码区连接到已用saci和spei消化的pt7xlutr质粒载体中,以生成pt7xlutr/emml。所得的pt7xlutr/emml质粒可用于转化大肠杆菌。
[0241]
在实例23中描述的选择、扩增和质粒dna制备之后,所得的pt7xlutr/emml质粒可用作模板,在用限制性内切核酸酶bamhi线性化后进行体外mrna合成。所得的mrna和预测的氨基酸序列分别显示为seq id no:15和14。
[0242]
实例25
[0243]
使用高保真taq dna聚合酶从具有最少5'和3'utr的pac/emm55质粒扩增emml编码区。t7 rna聚合酶启动子序列(seq id no:8)作为近端设计元件与最佳翻译起始序列(seq id no:4或5)、两个额外终止密码子(seq id no:6)和一个xhoi限制性内切酶位点一起添加。
[0244]
可以将所得的pcr产物插入到pcr克隆载体,例如ii-topo中。在实例23中描述的细菌转化、选择、扩增和质粒dna制备之后,所得质粒pt7/emml可用作模板,用于在用限制性内切核酸酶xhoi线性化后进行体外mrna合成。所得的mrna和预测的氨基酸序列分别显示为seq id no:16和14。
[0245]
在实例23-25中,可以使用体外转录反应产生编码emml的mrna。在此反应中可以对所得mrna进行一些修饰,以提高mrna和emml蛋白的稳定性和翻译效率,并降低mrna的免疫原性。例如,可以将修饰的核酸连接到emml mrna的5'端,例如但不限于抗反向帽类似物[arca,p1-(5'-(3'-o-甲基)-7-甲基-鸟苷)p3-(5'-(鸟苷))三磷酸)]、n1-甲基鸟苷、2'氟鸟苷、7-脱氮鸟苷、肌苷、8-氧代鸟苷、2-氨基鸟苷、lna-鸟苷和2-叠氮基鸟苷。
[0246]
在另一个实例中,长度大约为50-200个单磷酸腺苷的聚腺苷酸化[聚(a)]尾部可以连接到emml mrna的3'端,或者5'修饰的核苷酸帽和聚(a)尾部都可以添加到emml mrna。
[0247]
emml mrna可以用核糖核苷酸类似物合成。在这个阶段可以进行化学修饰,以进一步提高翻译效率和稳定性。实例包括5-甲基-胞苷-5'-三磷酸、假尿苷-5'-三磷酸、2-硫尿苷-5'三磷酸和n1-甲基假尿苷-5'-三磷酸。
[0248]
seq id no:4.最佳翻译起始序列的简并dna序列。r是a或g,y是c或t,m是a或c,且v是a、c或g。
[0249]
rymrmvatggc
[0250]
seq id no:5.最佳翻译起始序列的dna序列。
[0251]
atagccatggc
[0252]
seq id no:6.含有2个终止密码子的dna序列。
[0253]
taatga
[0254]
seq id no:7.saci、noti、bglii、ecorv和spei的限制性内切核酸酶识别位点的dna序列。
[0255]
gagctcgcggccgcagatctgatatcactagt
[0256]
seq id no:8.t7 rna聚合酶启动子的dna序列。
[0257]
taatacgactcactatag
[0258]
seq id no:9.非洲爪蟾β珠蛋白基因5'非翻译区的50个核糖核苷酸。
[0259]
aagcuucuuguucuuuuugcagaagcucagaauaaacgcucaacuuuggc
[0260]
seq id no:10.非洲爪蟾β珠蛋白基因3'非翻译区的74个核糖核苷酸。
[0261]
cuuuuugaugccauugccgacgcccuuggcaaggguuaccacuaaaccagccucaagaacacccgaauggaguc
[0262]
seq id no:11.bamhi、ecori和xbai的限制性内切核酸酶识别位点的dna序列。
[0263]
ggatccgaattctctaga
[0264]
seq id no:12.用于制备pt7xlutr的合成双链dna分子的dna序列。t7 rna聚合酶、saci、noti、bglii、ecorv、spei以及bamhi、ecori和xbai的限制性内切核酸酶识别位点标有下划线。
[0265]
taatacgactcactatagaagcttcttgttctttttgcagaagctcagaataaacgctcaactttggcgagctcgcggccgcagatctgatatcactagtctttttgatgccattgccgacgcccttggcaagggttaccactaaaccagcctcaagaacacccgaatggagtcggatccgaattctctaga
[0266]
seq id no:13(实例23的rna序列)。来自质粒模板的emml体外mrna合成后的合成mrna序列,相对于mrna分子从5'到3'书写。在体外转录过程中,将抗反向帽类似物(arca)添加到转录本的5'端,并将大约50-200个单磷酸腺苷(a
50-200
)添加到转录本的3'端。5'小写字母是来自psf-t7_cmv质粒载体的5'非翻译区(utr)。紧接在arca帽之后的鸟嘌呤(g)是由t7 rna聚合酶产生的+1核糖核苷酸。粗体表示添加的核糖核苷酸以形成5'ncoi限制性核酸内切酶位点(下划线)和最佳翻译起始序列。大写字母表示emml的编码顺序。在mrna序列的3'端,粗体表示两个额外终止密码子。3'xhoi限制性核酸内切酶位点标有下划线。
[0267]
[0268]
[0269][0270]
seq id no:14(实例23-25的预测蛋白质序列)。一个字母预测了实例2-4中产生的emml转录本的氨基酸序列。*表示终止密码子。
[0271]
maknttnrhyslrklktgtasvavaltvlgtglvagqtvkasqtepsqtnnrlyqerqrlqdlkskfqdlknrsegyiqqyydeeknsgsnsnwyatylkelndefeqaynelsgdgvkklaaslmeervalrdeidqikkiseelknklrakeeelknkkeerelehaayaadakkheeyvksmslvlmdkeeerhkleqsldtakaelvkkeqelqlvkgnldqkekeleneelakesaisdlteqitakkaevekltqdlaaksaeiqekeaekdrqqhmyeafmsqykekvekqeqelaklkqletinnnllgnakdmiaklsaeneqlasdkakleeqnkiseasrkglrrdldasreakkqvekdlanltaeldkvkedkqisdasrkglrrdldasreakkqvekaleeansklaaleklnkeleeskkltekekaelqakleaeakalkeqlakqaeelaklragkasdsqtpdakpgnkvvpgtgqapqagtkpnqnkapmketkrqlpstgeaanpfftaaaltvmatagvaavvkrkeeneaefcrypshwrprl*
[0272]
seq id no:15(实例24的rna序列)。来自用限制性内切核酸酶bamhi线性化的pt7xlurt质粒模板的emml体外mrna合成后的合成mrna序列,相对于mrna分子从5'到3'书写。在体外转录过程中,将抗反向帽类似物(arca)添加到转录本的5'端,并将大约50-200个单磷酸腺苷(a
50-200
)添加到转录本的3'端。紧接在arca帽之后的鸟嘌呤(g)是由t7 rna聚合酶产生的+1核糖核苷酸。5'小写字母来自非洲爪蟾β珠蛋白基因的5'非翻译区。粗体表示添加以形成最佳翻译起始序列的核糖核苷酸。emml编码区5'的saci限制性内切核酸酶位点标有下划线。大写字母表示emml的编码序列。编码区的小写字母3'是非洲爪蟾β珠蛋白基因的3'非翻译区。在mrna序列的3'端,粗体表示两个额外终止密码子。spei和bamhi限制性内切核酸酶位点标有下划线。
[0273]
[0274]
[0275][0276]
seq id no:16(实例24的rna序列)。来自质粒模板的emml体外mrna合成后的合成mrna序列,相对于mrna分子从5'到3'书写。在体外转录过程中,将抗反向帽类似物(arca)添加到转录本的5'端,并将大约50-200个单磷酸腺苷(a
50-200
)添加到转录本的3'端。紧接在arca帽之后的鸟嘌呤(g)是由t7 rna聚合酶产生的+1核糖核苷酸。粗体表示添加以形成最佳翻译起始序列的核糖核苷酸。大写字母表示emml的编码序列。在mrna序列的3'端,粗体表示两个额外终止密码子。3'xhoi位点带有下划线。
[0277]
[0278]
[0279][0280]
实例26
[0281]
密码子优化算法也用于合成emm55 mrna。测量并比较emm55表达以确定哺乳动物细胞中蛋白质合成和稳定性的相对增加。每个mrna是使用野生型尿苷(wt)体外合成的,并且n1-甲基假尿苷(n1)显示可改善蛋白质表达。
[0282]
三种不同的算法用于优化emm55的核苷酸序列,从在化脓性链球菌中的表达到在人体中的表达。使用jcat算法(grote 2005)和卡罗林斯卡研究所(karolinska institute)运行的两种专有算法(freqdist和mostfreq)进行密码子优化。由这三种算法设计的mrna由biotechnologies使用野生型(wt)尿苷和化学修饰的n1-甲基假尿苷(n1)在体外合成,这可以提高体外(svitkin 2017)和体内(pardi 2015)的mrna稳定性和蛋白质表达水平。每个mrna的最终核苷酸序列显示为seq id no:17、seq id no:18和seq id no:19。作为设计的一部分,bbsi和bspqi限制性内切核酸酶位点通过从emm55jcat和emm55mostfreq的碱基置换去除,以促进克隆到用于体外合成mrna的质粒载体中。
[0283]
mrna与biotechnologies供应的每管mrna一起接收,并作为库存项目添加,以便可以独立跟踪每管。mrna储存在-80℃下。使用rd 3-75.1进行质量控制测试以验证纯度和完整性,不同之处在于mrna由biotechnologies等分,而不是按照sop(标准操作程序)中的规定进行。
[0284]
使用rd 3-79.1(2.5μg mrna/孔)将mrna瞬时转染到附着增强的hek亚系hek293t-ae和b16-f10细胞中。使用rd 3-34.2(4μg pdna/孔)用pac/emm55转染细胞。转染后2至48小时,使用rd 3-83.1在ripa缓冲液中裂解细胞,并使用rd 3-14.2通过bca分析确定裂解物的蛋白质浓度。
[0285]
egfp mrna和pdna用作转染阳性对照和emm55表达阴性对照。最初,裂解物使用变性sds-page解析、进行蛋白质印迹、用鸡抗emm55染色并使用rd 3-74.1使用化学发光检测。与emm55大小对应的条带始终压倒过氧化物酶检测反应,导致无法量化的条带。无法鉴定鸡抗emm55或山羊抗鸡辣根过氧化物酶的合适稀释液以增加检测范围的高端。为此,使用使用鸡抗emm55的proteinsimple wes
tm
毛细管电泳系统进行emm55蛋白质检测。此系统在还原型sds-page毛细管中解析蛋白质和蛋白质/抗体复合物,以提供抗体结合定量,如蛋白质印迹数据。这些分析是使用制造商提供的方案进行的。
[0286]
wes
tm
分析测量细胞裂解物中emm55的水平,该水平标准化为erk1的水平,erk1是一种受磷酸化而不是蛋白质水平调节的丝氨酸/苏氨酸激酶,从而为细胞或组织类型内的数据标准化制作合适的蛋白质。这种方法比内部总蛋白标准化具有优势,因为它可以与emm55检测复用,提供样品加载控制并将需要执行的样品检测数量减少一半。为了建立此分析的
线性,使用1.5μg未转染hek293t-ae裂解物中的10ng至30pg remm55构建标准曲线。wes
tm
分析的抗体稀释度是1:100的鸡抗emm55和1:100的山羊抗鸡-hrp。
[0287]
wes
tm
分析组装说明指的是输入蛋白质浓度而不是质量。使用0.1、0.25和0.5μg/μl的细胞裂解物进行使用wes
tm
的实验。虽然0.5μg/μl的b16-f10细胞裂解物在wes
tm
动态范围内得到结果,但0.25和0.5μg/μl hek293t裂解物产生的表达水平超过了峰值表达时间点的检测能力。发现0.1μg/μl裂解物的浓度在整个时间过程中是最佳的,尽管在预期高水平表达时可以使用较低的浓度来提供额外的动态范围。然而,这种较低的输入浓度可能会错过低但具有生物学意义的表达水平,尤其是在早期和晚期时间点。
[0288]
通过将emm55的wes
tm
数值输出值除以erk1的输出值进行数据标准化。在数据复制实验中,对单个样本进行标准化,接着计算平均值
±
标准偏差值(n=3)。在一个时间点(0.1μg/μl emm55jcat-wt转染后12小时),异常低的erk1水平导致基于grubbs的极端学生化偏差测试的单个下降的标准化数据点。在这种情况下,平均值是根据剩余的两个复本数据点计算的。使用graphpad prism软件进行单向方差分析与bonferroni事后检验确定平均值之间的显著差异。使用tukey事后检验证实了重要发现。
[0289]
使用jcat算法为emm55的每个密码子计算密码子适应性指数(cai)。如果mrna序列针对在人类细胞中的翻译进行了完美优化,则此算法将返回1.0的分数。图12显示了使用jcat优化前后emm55的相对适应性。emm55的相对适应性图如图12a和12b所示。
[0290]
结果显示,在体外瞬时转染人he293t细胞和鼠b16-f10黑色素瘤细胞后,密码子修饰的emm55 mrna驱动emm55多肽的稳健表达。蛋白质水平与pac/emm55(dna)转染水平的比较不是定量的,因为pdna的单个拷贝会产生多个mrna拷贝,但确实表明wt和n1修饰的emm55jcat在转染后4与12小时之间的hek293细胞。emm55jcat mrna的emm55表达峰值出现在转染后大约12小时,并在48小时检测到。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1