抗BAFF受体抗体及其用途的制作方法
no:1多肽序列的重链可变区和具有seq id no:2多肽序列的轻链可变区。
13.在某些实施方案中,所述的分离的单克隆抗体或其抗原结合片段是人的或人源化的。
14.在某些实施方案中,所述的分离的单克隆抗体或其抗原结合片段与baff受体结合,并能够诱导效应物介导的肿瘤细胞裂解。
15.还提供了编码本发明的单克隆抗体或其抗原结合片段的分离核酸。
16.还提供了包含编码本发明的单克隆抗体或其抗原结合片段的分离核酸的载体。
17.还提供了包括载体的宿主细胞,所述载体包含编码本发明的单克隆抗体或其抗原结合片段的分离核酸。
18.在某些实施方案中,提供了一种药物组合物,所述的药物组合物包括本发明所述的分离的单克隆抗体或其抗原结合片段以及药学上可接受的载体。
19.还提供了治疗有需要的受试者的癌症的方法,包括对受试者施用本发明的药物组合物。在某些实施方案中,所述癌症是淋巴瘤、白血病或骨髓瘤。所述癌症可以是但不限于非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、慢性髓性白血病(cml)、多发性骨髓瘤(mm)、急性髓性白血病(aml)和其他液体肿瘤。例如,非霍奇金淋巴瘤(nhl)可以是套细胞淋巴瘤、滤泡性淋巴瘤、弥漫性大b细胞淋巴瘤、边缘区淋巴瘤或伯基特淋巴瘤。
20.还提供了产生本发明的单克隆抗体或其抗原结合片段的方法。所述方法包括在产生所述单克隆抗体或其抗原结合片段的条件下,培养包含编码所述单克隆抗体或其抗原结合片段的核酸的细胞,并从所述细胞或培养物中回收所述单克隆抗体或其抗原结合片段。
21.还提供了制备包含本发明的单克隆抗体或抗原结合片段的药物组合物的方法。所述方法包括将单克隆抗体或抗原结合片段与药学上可接受的载体结合以获得药物组合物。
22.还提供了测定受试者baff受体水平的方法。所述方法包括:(a)从受试者获得样本;(b)将本发明的分离的单克隆抗体或其抗原结合片段与样品接触;(c)确定受试者baff受体水平。例如,样本可以是组织样本或血液样本。例如,组织样本可以是癌症组织样本。
23.附图简要说明
24.结合附图阅读时,将更好地了解上述概要以及下文对本技术的优选实施方案的详细描述。然而,应该理解的是,本技术并不限于图中所示的明确实施方案。
25.图1a-1b显示了人类种系轻链ig序列(igkv4-1*01(seq id no:17);igkv3-11*01(seq id no:19))与h90-11单抗(图1a)(seq id no:2)和h90-5单抗(图1b)(seq id no:10)的轻链序列的比对。
26.图2a-2d显示了smac-hplc测定利妥昔(图2a)、c90(图2b)、h90-5(图2c)和h90-11(图2d)的停留时间(rt)的实验结果图。
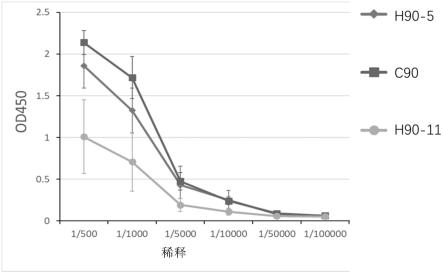
27.图3显示了通过间接的elisa法测定的h90-5、h90-11和c90单抗的免疫原性结果。
28.发明详述
29.在本说明书的背景和整个说明书中引用或描述了各种出版物、文章和专利;这些参考文献每一篇通过引用全文合并于此。本说明书中包含的文件、行为、材料、装置、物品或类似内容的讨论是为了提供本发明的背景。就所公开或要求保护的任何发明而言,这样的讨论并不承认任何或所有这些事项构成现有技术的一部分。
30.除非另有定义,本文所述的所有技术及科学术语均具有与本发明所涉领域内技术人员通常理解的相同含义。否则,本文所使用的某些术语具有本说明书中规定的含义。
31.必须注意的是,如在本文和所附权利要求中所使用的,除非上下文另有明确规定,否则单数形式“一(a)”、“一种”和“该(the)”包括复数指代。
32.除非另有说明,在一系列元素之前的术语“至少”应理解为指所述系列中的每一个元素。那些本领域的技术人员将认识到或能够仅通过常规试验确定许多本文所描述的本发明的具体实施方案的等同替代。本发明意在包含这些等同替代。
33.如本文所述,术语“包括”、“包括的”、“包含”、“含有”、“有”、“具有”、“含”或“拥有”或其任何其他变体,将被理解为隐含地包含一个指定的整数或整数组,但不排除任何其他整数或整数组,并且是非排他性或开放性的。例如,包含一系列元素的组合物、混合物、过程、方法、物品或装置,不一定只局限于这些元素,但可以包括这些组合物、混合物、过程、方法、物品或装置中没有明确列出或固有的其他元素。此外,除非有明确的相反声明,“或”指的是包含性的或,而不是排他性的或。例如,以下任意一项均满足条件a或b:a为真(或存在)并且b为假(或不存在)、a为假(或不存在)并且b为真(或存在)、a和b都为真(或存在)。
34.如本文所用,在整个说明书和权利要求中使用的术语“由...组成”或变体,例如“由
……
构成”或“由
……
所组成”,表明包含任何所述的整数或整数组,但是不能添加额外的整数或整数组到指定的方法、结构和组合中。
35.如本文所用,“受试者”是指任何动物,优选哺乳动物,最优选人。如本文所用的术语“哺乳动物”包括任何哺乳动物。哺乳动物的例子包括但不限于,牛、马、羊、猪、猫、狗、小鼠、大鼠、兔子、豚鼠、猴子、人类等,更优选人类。
36.两条或多条核酸或多肽序列(如抗baff受体抗体和编码它们的多核苷酸,baf受体多肽和编码它们的baff受体多核苷酸)的上下文中,术语“同一的”或百分比“同一性”指的是,当使用下列序列比较算法的一种或目视检查进行比较和比对以获得最大的对应关系时,两条或多条序列或子序列相同或具有指定百分比的氨基酸残基或核苷酸相同。
37.对于序列比较,通常一个序列作为参比序列,与测试序列进行比较。在使用序列比较算法时,将测试序列与参比序列输入计算机,必要时指定子序列坐标,并指定序列算法程序参数。然后,根据指定的程序参数,序列比较算法计算测试序列相对于参比序列的序列同一性百分比。
38.进一步表明两条核酸序列或多肽实质上同一的是,由第一核酸编码的多肽与由第二核酸编码的多肽发生免疫交叉反应,如下所述。因此,例如当一个多肽与另一个多肽之间的差异仅在于保守取代时,这两个多肽通常实质上是相同的。另一个表明两条核酸序列实质上是相同的是,两个分子在严格的条件下相互杂交。
39.如本文所用,术语“多核苷酸”,同义词是“核酸分子”、“核苷酸”或“核酸”,指的是任何多核糖核苷酸或多脱氧核糖核苷酸,可以是未经修饰的rna或dna,也可以是经过修饰的rna或dna。“多核苷酸”包括但不限于单链和双链dna、单链和双链区域混合而成的dna、单链和双链rna、单链和双链区域混合而成的rna、由dna和rna组成的混合分子(可以是单链,更典型的是双链、或单链或双链区域的混合)。此外,“多核苷酸”是指含有rna或dna或rna和dna的三链区域。术语多核苷酸还包括含有一个或多个修饰碱基的dna或rna,以及含有为了稳定性或其他原因而修饰的骨架的dna或rna。例如,“修饰的”碱基包括三苯甲基化
(tritylated)碱基和肌苷等不常见的碱基。可以对dna和rna进行各种各样的修饰,因此,“多核苷酸”包括自然界中常见的经化学、酶或代谢修饰的多核苷酸形式,以及病毒和细胞所特有的dna和rna的化学形式。“多核苷酸”还包括相对较短的核酸链,通常称为寡核苷酸。
40.如本文所用,术语“表达”指的是基因产物的生物合成。所述术语包括基因转录成rna的过程。所述术语还包括rna翻译成一个或多个多肽,进一步包括所有自然发生的转录后和翻译后修饰。所述表达的多肽可以在宿主细胞的细胞质内、进入细胞外环境如细胞培养的生长培养基或锚定在细胞膜上。
41.如本文所用,术语“肽”、“多肽”或“蛋白质”可以指由氨基酸组成的分子,并可以被本领域技术人员识别为蛋白质。本文使用氨基酸残基的常规单字母或三字母编码。术语“肽”、“多肽”和“蛋白质”在本文中可以互换使用,指任何长度的氨基酸聚合物。所述聚合物可以是直链的或支链的,它可以包括经修饰的氨基酸,并且可以被非氨基酸打断。所述术语还包括经过自然修饰或人工干预修饰的氨基酸聚合物,例如形成二硫键、糖基化、脂化、乙酰化、磷酸化或任何其他操作或修饰,例如偶联标记组件。该定义还包括,例如,含有一个或多个氨基酸类似物(包括例如非天然氨基酸等)的多肽,以及本领域已知的其他修饰。
42.本文所描述的肽序列是按照通常的惯例编写的,即肽的n端区域在左边,c端区域在右边。虽然氨基酸的异构体形式是已知的,但除非另有特别说明,否则所表示的是氨基酸的l型。
43.术语“分离的”可指实质上不含其来源的细胞物质、细菌物质、病毒物质或培养基(通过dna重组技术生产时),或化学前体或其他化学物质(化学合成时)的核酸或多肽。此外,分离的多肽指的是可作为分离的多肽给药给受试者的多肽。换句话说,如果多肽附着在柱上或在凝胶中,就不能简单地认为它是“分离的”。此外,“分离的核酸片段”或“分离的肽”是指不作为片段自然出现和/或通常不处于功能状态的核酸或蛋白质片段。
44.抗体
45.本技术总体上涉及分离的抗baff受体抗体、编码所述抗体的核酸和表达载体、包括所述载体的重组细胞和含有所述抗体的组合物。还提供了制备所述抗体的方法以及使用所述抗体治疗包括癌症在内的疾病的方法。本发明的抗体具有一种或多种所需的功能特性,包括但不限于与baff受体的高亲和结合、对baff受体的高特异性、增加的稳定性和降低的免疫原性。
46.本文所述的抗baff受体抗体旨在获得最优的可开发性,以进行临床试验,并作为治疗或预防有需要的受试者的癌症的药物获得批准。抗baff受体抗体的主要特点是靶向结合,与非靶向分子的交叉反应最小甚至没有。然而,一旦发现一种抗体通过与适当的靶点(如baff受体)结合而达到预期的效力,所述抗体的可开发性至关重要。通过分析所述的抗baff受体抗体的多种特性,包括但不限于抗体的表达、抗体的溶解度、抗体的共价完整性、抗体的构象和胶体稳定性、抗体的多特异性和抗体的免疫原性,可以确定抗体的可开发性。具有最优可开发性的抗baff受体抗体表现为高表达、高溶解度、高共价完整性、高构象和胶体稳定性、低多特异性和低免疫原性。例如,在jain等人的pnas 114(5):944-949(2017)中讨论了抗体的可开发性和生物物理特性。
47.在总体方面,本发明涉及分离的单克隆抗体或其抗原结合片段,这些单克隆抗体或其抗原结合片段特异性结合baff受体,并具有改进稳定性和降低潜在免疫原性方面所需
的特征。这种抗体具有更高的可制造性,并可在受试者(如人受试者)中引起较少的抗药物免疫反应。
48.如本文所用,术语“抗体”是广义的,并且包括单克隆或多克隆的人的、人源的、复合的和嵌合抗体的免疫球蛋白或抗体分子以及抗体片段。一般来说,抗体是表现出与特定抗原具有结合特异性的蛋白质或肽链。抗体的结构是众所周知的。免疫球蛋白可根据重链恒定域的氨基酸序列分为五大类(即iga、igd、ige、igg和igm)。iga和igg进一步细分为iga1、iga2、igg1、igg2、igg3和igg4同种型。因此,本发明所述的抗体可以是五大类中的任何一类或相应的亚类。优选地,本发明所述的抗体为igg1、igg2、igg3或igg4。脊椎动物的抗体轻链可以根据其恒定结构域的氨基酸序列划分为两种明显不同的类型之一,即κ和λ。因此,本发明所述的抗体可以包含κ和λ轻链恒定结构域。根据特定实施方案,本发明所述的抗体包括来自大鼠或人抗体的重链和/或轻链恒定区。除了重链和轻链恒定结构域,抗体还包含抗原结合区,该抗原结合区由轻链可变区和重链可变区组成,每个重链可变区包含三个结构域(即互补决定区1-3:cdr1、cdr2和cdr3)。轻链可变区结构域被可替代地称为lcdr1、lcdr2和lcdr3,重链可变区结构域被可替代地称为hcdr1、hcdr2和hcdr3。
49.如本文所用,术语“分离的抗体”指的是基本上不含其他不同抗原特异性的抗体的抗体(例如,特异性结合baff受体的分离的抗体或基本上不含不结合baff受体的抗体)。此外,分离的抗体基本上不含有其他细胞物质和/或化学物质。
50.如本文所用,术语“单克隆抗体”是指从基本均质的抗体中获得的抗体,即,除了可能自然发生的少量突变外,包含群体的单个抗体是同一的。本发明所述的单克隆抗体可通过杂交瘤法、噬菌体展示技术、单淋巴细胞基因克隆技术或dna重组方法制备。例如,所述单克隆抗体可以由杂交瘤产生,该杂交瘤包括从转基因非人类动物(如转基因小鼠或大鼠)获得的b细胞,其基因组包括人类重链转基因和轻链转基因。
51.如本文所用,术语“抗原结合片段”指的是抗体片段,例如,双抗体、fab、fab'、f(ab')2、fv片段、二硫键稳定的fv片段(dsfv)、(dsfv)2、双特异性dsfv(dsfv-dsfv')、二硫键稳定的双抗体(ds双抗体)、单链抗体分子(scfv)、单域抗体(sdab)、scfv二聚体(二价双抗体)、由含有一个或多个cdr的抗体的一部分形成的多特异性抗体、驼源单域抗体、纳米抗体、结构域抗体、二价结构域抗体或其他与抗原结合但不包含完整抗体结构的抗体片段。抗原结合片段能够与亲本抗体或亲本抗体片段结合的同一抗原结合。根据具体实施方案,所述抗原结合片段包括轻链可变区、轻链恒定区和重链fd段。根据其他特定实施方案,所述抗原结合片段包括fab和f(ab')。
52.如本文所用,术语“单链抗体”是指本领域中的常规单链抗体,其包括由约15~20个氨基酸组成的短肽连接的重链可变区和轻链可变区。如本文所用,术语“单域抗体”是指本领域中的常规单域抗体,其包括一个重链可变区和一个重链恒定区或仅包括一个重链可变区。
53.如本文所用,术语“人抗体”是指由人产生的抗体,或使用本领域已知的任何技术产生的与人类产生的抗体具有相应氨基酸序列的抗体。人抗体的定义包括完整或全长抗体、其片段和/或包含至少一种人重链和/或轻链多肽的抗体。
54.如本文所用,术语“人源化抗体”指的是经过修饰,增加了与人抗体的序列同源性,从而保留抗体的抗原结合特性,但其在人体的免疫原性降低的非人抗体。
55.如本文所用,术语“嵌合抗体”是指免疫球蛋白分子的氨基酸序列来源于两个或两个以上物种的抗体。轻链和重链可变区通常对应于来自一种哺乳动物(如小鼠、大鼠、兔子等)的具有所需的特异性、亲和力和性能的可变区域,而恒定区域对应于来自另一种哺乳动物(如人类)的抗体序列,以避免引起该物种的免疫反应。
56.如本文所用,术语“多特异性抗体”是指包含多个免疫球蛋白可变域序列的抗体,其中所述的多个的第一个免疫球蛋白可变域序列具有针对第一表位的结合特异性,所述的多个的第二个免疫球蛋白可变域序列具有针对第二表位的结合特异性。在一个实施方案中,第一和第二表位位于同一抗原上,例如,同一蛋白质(或多聚体蛋白质的亚基)上。在一个实施方案中,第一和第二表位重叠或基本上重叠。在一个实施方案中,第一和第二表位不重叠或基本上不重叠。在一个实施方案中,第一和第二表位位于不同抗原上,例如,不同的蛋白质(或多聚体蛋白质的不同亚基)上。在一个实施方案中,多特异性抗体包括第三、第四或第五免疫球蛋白可变结构域。在一个实施方案中,多特异性抗体是双特异性抗体分子、三特异性抗体分子或四特异性抗体分子。
57.如本文所用,术语“双特异性抗体”是指结合不超过两个表位或两个抗原的多特异性抗体。双特异性抗体的特点是具有对第一表位的结合特异性的第一免疫球蛋白可变结构域序列和具有对第二表位的结合特异性的第二免疫球蛋白可变结构域序列。在一个实施方案中,所述第一和第二表位位于同一抗原上,例如,同一蛋白质(或多聚体蛋白质亚基)上。在一个实施方案中,所述第一和第二表位重叠和基本上重叠。在一个实施方案中,所述第一和第二表位位于不同抗原上,例如,不同的蛋白质(或不同的多聚体蛋白质亚基)上。在一个实施方案中,双特异性抗体包括对第一表位具有结合特异性的的重链可变结构域序列和轻链可变结构域序列,以及对第二表位具有结合特异性的重链可变结构域序列和轻链可变结构域序列。在一个实施方案中,双特异性抗体包括对第一表位具有结合特异性的半抗体或其片段,以及对第二表位具有结合特异性的半抗体或其片段。在一个实施方案中,双特异性抗体包括对第一表位具有结合特异性的scfv或其片段,和对第二表位具有结合特异性的scfv或其片段。在一个实施方案中,所述第一表位位于baff受体上,第二表位位于pd-1、pd-l1、ctla-4、egfr、her-2、cd19、cd20、cd33、cd47、cd73、cd3和/或其他肿瘤相关的免疫抑制剂或表位抗原上。
58.如本文所用,术语“baff受体”是指b细胞激活因子(baff)受体,也称为肿瘤坏死因子受体超家族成员13c(tnfrsf 13c和blys受体3(br3),其是可识别baff的tnf受体超家族的一种膜蛋白,是b细胞成熟和存活的必不可少的因素。baff受体是tnf受体超家族的非典型代表,因为tnf受体超家族的成员通常具有多个细胞外富含半胱氨酸的结构域(crds),这些结构域可与配体结合,也可用于不依赖配体的受体单体、二聚体、三聚体或多聚体组装。与大多数tnf-r家族成员不同,baff受体只包含部分crd,用于配体结合和自组装。当未成熟的b细胞发育成过渡性b细胞时,baff受体开始表达,随后过渡性b细胞接受baff受体依赖的促生存信号,将其从细胞过早死亡中拯救出来。baff受体在b细胞成熟的各个阶段以及各种b细胞淋巴瘤中均有表达,已被确定为癌症治疗的潜在靶点,即baff受体可用于特异性靶向癌细胞的治疗分子。示例性的人类baff受体的氨基酸序列由genbank登录号np_443177(seq id no:18)表示。
59.如本文所用,“特异性结合baff受体”的抗体是指与baff受体结合的抗体,优选人
baff受体,其kd值为1
×
10-7
m或更低、优选1
×
10-8
m或更低、更优选5
×
10-9
m或更低、1
×
10-9
m或更低、5
×
10-10
m或更低或1
×
10-10
m或更低。术语“kd”指的是解离常数,由kd与ka(即kd/ka)的比值得到,并表示为摩尔浓度(m)。抗体的kd值可以根据本发明使用本领域中的方法来确定。例如,抗体的kd可以通过表面等离子共振来确定,如使用生物传感器系统,如系统,或使用生物层干涉测量技术,如octet red96系统。
60.抗体的kd值越小,抗体与靶抗原结合的亲和力越高。
61.根据一个特定的方面,本发明涉及一种分离的单克隆抗体或其抗原结合片段,所述分离的单克隆抗体或其抗原结合片段包括重链互补决定区1(hcdr1)、hcdr2、hcdr3、轻链互补决定区1(lcdr1)、lcdr2和lcdr3,其分别具有seq id nos:3、4、5、6、7和8的多肽序列;其中所述抗体或其抗原结合片段特异性结合baff受体,优选人baff受体。
62.根据另一个特定方面,本发明涉及一种分离的单克隆抗体或其抗原结合片段,所述的分离的单克隆抗体或其抗原结合片段包括具有与seq id no:1的多肽序列具有至少85%、优选90%、更优选95%或更高(如95%、96%、97%、98%或99%)同一性的多肽序列的重链可变区,或具有与seq id no:2的多肽序列具有至少85%、优选90%、更优选95%或更高(如95%、96%、97%、98%或99%)同一性的多肽序列的轻链可变区。
63.根据一个优选实施方案,本发明所述的分离的单克隆抗体或其抗原结合片段包括具有与seq id no:1至少85%、优选90%、更优选95%或更高(如95%、96%、97%、98%或99%)同一性的多肽序列的重链可变区,和与seq id no:2至少85%、优选90%、更优选95%或更高(如95%、96%、97%、98%或99%)同一性的多肽序列的轻链可变区。
64.根据另一个特定方面,本发明涉及本发明的一种分离的单克隆抗体或其抗原结合片段,所述单克隆抗体及其抗原结合片段包括具有seq id no:1多肽序列的重链可变区和具有seq id no:2多肽序列的轻链可变区。
65.在一个实施方案中,本发明涉及一种分离的单克隆抗体或其抗原结合片段,所述的分离的单克隆抗体或其抗原结合片段包括hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3,其分别具有seq id nos:3、4、5、6、7和8的多肽序列。在另一个实施方案中,所述的分离的单克隆抗体或其抗原结合片段包括具有与seq id no:1至少85%、优选90%、更优选95%或更高(如95%、96%、97%、98%或99%)同一性的多肽序列的重链可变区,和与seq id no:2至少85%、优选90%、更优选95%或更高(如95%、96%、97%、98%或99%)同一性的多肽序列的轻链可变区。优选地,所述的分离的单克隆抗体或其抗原结合片段包括具有seq id no:1多肽序列的重链可变区和具有seq id no:2多肽序列的轻链可变区。
66.根据另一特定方面,本发明涉及一种分离的单克隆抗体或其抗原结合片段,其中与对照抗体相比,所述的抗体或其抗原结合片段在受试者中具有更高的稳定性和/或更低的免疫原性。例如,对照抗体可以是另一个分离的特异性结合baff受体的单克隆抗体,优选人baff受体。例如,对照抗体可以包括重链互补决定区1(hcdr1)、hcdr2、hcdr3、轻链互补决定区1(lcdr1)、lcdr2和lcdr3,其多肽序列分别为seq id nos:11、12、13、14、15和16。
67.根据另一特定方面,本发明涉及一种分离的单克隆抗体或其抗原结合片段,其中所述抗体或其抗原结合片段是人的或人源化的。
68.在另一个总体方面,本发明涉及编码本发明的单克隆抗体或其抗原结合片段的分离核酸。本领域技术人员应理解,可以在不改变蛋白质的氨基酸序列的情况下改变蛋白质
的编码序列(例如,替换、删除、插入等)。相应地,本领域技术人员应理解,可改变编码单克隆抗体或其抗原结合片段的核酸序列,而不改变所述蛋白质的氨基酸序列。
69.在另一个总体方面,本发明涉及包含编码本发明的单克隆抗体或其抗原结合片段的分离核酸的载体。鉴于本公开,可以使用本领域技术人员已知的任何载体,如质粒、黏粒、噬菌体载体或病毒载体。在一些实施方案中,所述载体是重组表达载体,如质粒。所述载体可以包括建立表达载体常规功能的任何元件,例如启动子、核糖体结合元件、终止子、增强子、选择标记和复制起点。所述启动子可以是组成型、诱导型或抑制型启动子。本领域中已知一些能够将核酸传递到细胞的表达载体,并可在本发明中用于在细胞中产生抗体或其抗原结合片段。根据本发明的实施方案,可以使用常规克隆技术或人工基因合成来生成重组表达载体。鉴于目前的披露,这些技术对于那些本领域技术人员来说是众所周知的。
70.在另一个总体方面,本发明涉及包含编码本发明的单克隆抗体或其抗原结合片段的分离核酸的宿主细胞。根据本发明,本领域技术人员所知的任何宿主细胞可用于本发明的抗体或其抗原结合片段的重组表达。在一些实施方案中,所述宿主细胞为大肠杆菌tg1或bl21细胞(用于如scfv或fab抗体的表达)、cho-dg44细胞或cho-k1细胞或hek293细胞(用于如全长igg抗体的表达)。根据具体实施方案,通过化学转染、热休克或电穿孔等常规方法将所述的重组表达载体转化到宿主细胞中,稳定地整合到宿主细胞基因组中,从而使重组核酸得到有效表达。
71.在另一个总体方面,本发明涉及生产本发明的单克隆抗体或其抗原结合片段的方法。所述方法包括,在生产本发明的单克隆抗体或其抗原结合片段的条件下,培养包含编码本发明的单克隆抗体或其抗原结合片段的核酸的细胞,并从细胞或细胞培养物(例如上清液)中回收抗体或其抗原结合片段。可以从细胞中获得表达的抗体或其抗原结合片段,并按照本文所述的和本领域已知的常规技术进行纯化。
72.药物组合物
73.在另一个总体方面,本发明涉及一种药物组合物,所述药物组合物包括本发明的单克隆抗体或其抗原结合片段及其药学上可接受的载体。本文所用的术语“药物组合物”是指包含本发明的抗体和药学上可接受的载体的产品。本发明的抗体和由其组成的组合物也可用于本文所述治疗用途的药物的制造。
74.如本文所用,术语“载体”是指任何赋形剂、稀释剂、填充剂、盐、缓冲液、稳定剂、增溶剂、油、脂类、含脂囊泡、微球、脂质体包封剂或本领域已知的用于药剂配方的其他材料。应理解,载体、赋形剂或稀释剂的特性将取决于特定应用的给药途径。如本文所用,术语“药学上可接受的载体”是指不干扰本发明组合物的有效性或根据本发明化合物的生物活性的无毒性材料。根据具体实施方案,鉴于本公开,可以在本发明中使用任何药学上可接受的适用于抗体药物组合物的载体。
75.使用药学上可接受载体的药物活性成分的配制在本领域是已知的,如《雷明顿:科学和药学实践》(如21版(2005年)和任何后续版本)。额外的非限制性例子包括:缓冲液、稀释剂、溶剂、张力调节剂、防腐剂、稳定剂和螯合剂。一种或多种药学上可接受的载体可用于配制本发明的药物组合物。
76.在本发明的一个实施方案中,所述的药物组合物是液体制剂。液体制剂的优选例子是水溶性制剂,即含水的制剂。所述液体制剂可包括溶液、悬浮液、乳液、微乳液、凝胶等。
水溶性制剂通常包含至少50%w/w的水,或至少60%、70%、75%、80%、85%、90%或至少95%w/w的水。
77.在一个实施方案中,所述药物组合物可配制为注射装置(例如,注射器或输液泵)注射的注射剂。所述注射剂可以通过皮下注射、肌肉注射、腹腔注射、体内注射或静脉注射等方式递送。
78.在另一个实施方案中,所述药物组合物为固体制剂,如冻干或喷雾干燥组合物,其可按原样,或在使用前由医生或患者添加溶剂和/或稀释剂。固体剂型可以包括片剂(如压缩片剂和/或包膜片剂)和胶囊(如硬或软明胶胶囊)。例如,所述药物组合物还可以是小袋、糖衣、粉末、颗粒、锭剂或用于重组的粉末的形式。
79.所述剂型可以是立即释放,在这种情况下,它们可以包含水溶性或分散载体,或者它们可以是延迟释放、缓释、或修饰释放,在这种情况下,它们可以包括不溶于水的聚合物,可以调节剂型在胃肠道或皮下的溶解速度。
80.在其他实施例中,所述药物组合物可以经鼻内、口腔或舌下递送。
81.水性制剂的ph可以在ph值3至ph值10之间。在本发明的一个实施方案中,所述制剂的ph值约为7.0至约9.5。在本发明的另一个实施方案中,所述制剂的ph值约为3.0至约7.0。
82.在另一个总体方面,本发明涉及制备包含本发明的单克隆抗体或其抗原结合片段的药物组合物的方法,所述方法包括将单克隆抗体或其抗原结合片段与药学上可接受的载体结合以获得药物组合物。
83.使用方法
84.在另一个总体方面,本发明涉及一种靶向受试者癌细胞表面的baff受体的方法,所述方法包括将特异性结合baff受体的分离的单克隆抗体或其抗原结合片段或本发明的药物组合物给药给受试者。单克隆抗体或其抗原结合片段与baff受体的结合可介导互补依赖性细胞毒性(cdc)、抗体依赖性吞噬作用(adpc)和/或抗体依赖性细胞毒性(adcc)或其他导致靶癌细胞死亡的作用。例如,所述单克隆抗体或其抗原结合片段可用于招募偶联药物,和/或可与另一单克隆抗体形成双特异性抗体,以介导靶向癌细胞的死亡。
85.所述的结合baff受体的抗体及其抗原结合片段的功能活性可以通过本领域已知的方法和本文所述的方法进行表征。鉴定与baff受体结合的抗体及其抗原结合片段的方法包括但不限于亲和力和特异性分析,包括biacore、elisa和octetred分析;通过流式细胞术检测肿瘤细胞或重组表达baff受体的细胞上的baff受体与抗体的结合情况的结合试验。根据具体实施方案,用于表征结合baff受体的抗体及其抗原结合片段的方法包括以下所述的方法。
86.在另一个总体方面,本发明涉及一种治疗有需要的受试者的癌症的方法,所述方法包括将特异性结合baff受体的分离的单克隆抗体或其抗原结合片段或本发明的药物组合物给药给受试者。在某些实施方案中,所述癌症是淋巴瘤、白血病或骨髓瘤。所述癌症可以选自任何液体或实体癌症,例如,它可以选自,但不限于,肺癌、胃癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、神经胶质瘤、胶质母细胞瘤和其他实体肿瘤、和非霍奇金淋巴瘤(nhl)、急性淋巴细胞性白血病(all)、慢性淋巴细胞白血病(cll)、慢性粒细胞性白血病(cml)、多发性骨髓瘤(mm)、急性髓系白血病(aml)、以及其他液体肿瘤。例如,非霍奇金淋巴瘤(nhl)可以是套细胞淋巴瘤、
滤泡性淋巴瘤、弥漫性大b细胞淋巴瘤、边缘区淋巴瘤或伯基特淋巴瘤。
87.根据本发明实施方案,所述药物组合物包括治疗有效量的抗baff受体抗体或其抗原结合片段。如本文所用,术语“治疗有效量”指的是在受试者中引发所需生物或药物反应的活性成分或组分的量。根据声明的目的,治疗有效量可以通过经验和常规的方式确定。
88.如本文所用的关于抗baff受体或其抗原结合片段,治疗有效量是指在需要的受试者体内调节免疫反应的抗baff受体抗体或其抗原结合片段的量。
89.根据具体实施方案,治疗有效量是指足以达到下列一、二、三、四种或更多效果的治疗量:(i)减轻或改善待治疗疾病、紊乱或状况或与之相关的症状的严重程度;(ii)缩短待治疗疾病、紊乱或状况,或与之有关的症状的持续时间;(iii)预防待治疗疾病、紊乱或状况,或与之有关的症状的发展;(iv)导致待治疗疾病、紊乱或状况或与之有关的症状的消退;(v)防止待治疗疾病、紊乱或状况,或与之有关的症状的发展或发作;(vi)防止待治疗的疾病、紊乱或状况,或与之有关的症状复发;(vii)减少因患有待治疗疾病、紊乱或状况,或与该疾病、紊乱或状况有关的症状而住院的人数;(viii)缩短患有待治疗的疾病、紊乱或状况,或与该疾病、紊乱或状况有关的症状的人的住院时间;(ix)增加患有待治疗的疾病、紊乱或状况,或与该疾病、紊乱或与之相关的症状的受试者的存活时间;(xi)抑制或减轻受试者体内待治疗的疾病、紊乱或状况,或与之相关的症状;和/或(xii)加强或改善另一种治疗的预防或治疗效果。
90.所述的治疗有效量或剂量可因各种因素而异,如待治疗的疾病、紊乱或状况、给药方法、靶点、受试者的生理状态(包括,例如,年龄、体重、健康状况)、受试者是人还是动物、给药的其他药物以及治疗是预防性的还是治疗性的。对治疗剂量进行最优滴定以优化安全性和有效性。
91.根据具体实施方案,本文所述的组合物被配制为适合于向受试者给药的预期途径。例如,本文所述的组合物可以配制成适合于静脉、皮下或肌肉内给药。
92.如本文所用,术语“治疗”、“处理”和“治疗方法”都意在指与癌症相关的至少一个可测量的物理参数的改善或逆转,这在受试者中不必然能够辨别,但可以在受试者中能够辨别。术语“治疗”、“处理”和“治疗方法”也可以指引起疾病、紊乱或状况消退,防止进展,或至少减缓其进展。在具体实施方案中,“治疗”、“处理”和“治疗方法”指的是与疾病、紊乱或状况(如肿瘤或更优选的癌症)相关的一个或多个症状的缓解、发展或发作的预防,或持续时间的缩短。在具体实施方案中,“治疗”、“处理”和“治疗方法”指的是预防疾病、紊乱或状况的复发。在具体实施方案中,“治疗”、“处理”和“治疗方法”指的是患有该疾病、紊乱或状况的受试者的生存率的增加。在具体实施方案中,“治疗”、“处理”和“治疗方法”指消除受试者中的疾病、紊乱或状况。
93.根据具体实施方案,提供了用于治疗癌症的组合物。对于癌症治疗,所述组合物可以与另一种治疗方法联合使用,包括但不限于化疗、抗cd20单克隆抗体、抗cd47单克隆抗体、抗cd73单克隆抗体、抗爱帕琳肽(apelin)单克隆抗体、抗ctla-4单克隆抗体、抗pd-l1单克隆抗体、抗pd-1单克隆抗体、pd-1/pd-l1治疗、其他免疫肿瘤药物、抗血管生成剂、放射治疗、抗体-药物结合物(adc)、靶向疗法或其他抗癌药物。抗baff受体抗体可与抗pd-1、pd-l1、ctla-4、egfr、her-2、cd19、cd20、cd33、cd73、cd47、cd3和/或其他肿瘤表面抗原的伴侣单克隆抗体一起构建成双特异性抗体,用于治疗既表达baff受体又表达特异性肿瘤相关抗
原的癌症/肿瘤。
94.如本文所用,在给药给受试者两种或更多疗法的情况下,术语“联合”指的是一种以上疗法的使用。术语“联合”的使用并不限制给药给受试者的疗法的顺序。例如,给受试者进行第一次给药治疗(如本文所述的组合物)可以在第二次给药治疗之前(如5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、16小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周之前)、与此同时、或之后(如5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、16小时、24小时、48小时内、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周后)。
95.在另一个方面,本发明涉及一种测定受试者baff受体水平的方法。所述方法包括:(a)从受试者获得样本;(b)将本发明的单克隆抗体或其抗原结合片段与样本进行接触;和(c)确定受试者baff受体水平。
96.如本文所用,“样本”是指从受试者身上分离得到的生物样本,可以包括但不限于全血、血清、血浆、血细胞、内皮细胞、活检组织(如癌组织)、淋巴液、腹水、间质液、骨髓、脑脊液、唾液、粘液、痰、汗、尿液或其他分秘物、排泄物或其他体液。“血液样本”是指全血或其任何成分,包括血细胞、血清和血浆。
97.在某些实施例中,可以使用检测方法来确定受试者中的baff受体水平,这些方法选自但不限制于蛋白质印迹(western blot)检测、elisa检测和/或免疫组化(ihc)。相对蛋白水平可以通过蛋白质印迹分析和免疫组化(ihc)来确定,绝对蛋白水平可以通过elisa检测来确定。当确定baff受体的相对水平时,至少可以确定两个样本之间的baff受体水平,例如,来自同一受试者不同时间点的样本之间、来自同一受试者不同组织的样本之间、和/或来自不同受试者的样本之间。另外,当确定baff受体的绝对水平时,如通过elisa测定,样品中的baff受体的绝对水平可以通过在检测样品之前创建elisa测定的标准来确定。本领域的技术人员将理解使用哪些分析技术来利用本发明的抗体或其抗原结合片段确定受试者样本中的baff受体水平。
98.利用从受试者样本中确定baff受体水平的方法可以诊断疾病中baff受体水平异常(升高、降低或不足),并作出适当的治疗决定。例如,这种疾病可能包括癌症。此外,通过监测受试者的baff受体水平,可以根据对特定疾病和/或特定疾病进展过程中baff受体水平的了解来确定上述疾病发生的风险。
99.实施方案
100.本技术提供以下非限制性实施方案。
101.实施方案1是分离的单克隆抗体或其抗原结合片段,所述的分离的单克隆抗体或其抗原结合片段包括重链互补决定区1(hcdr1)、hcdr2、hcdr3、轻链互补决定区1(lcdr1)、lcdr2和lcdr3,其分别具有seq id nos:3、4、5、6、7和8的多肽序列,其中所述抗体或其抗原结合片段特异性结合baff受体,优选人baff受体。
102.实施方案2是实施方案1所述的分离的单克隆抗体或其抗原结合片段,所述分离的抗体或其抗原结合片段包括具有与seq id no:1至少95%、至少96%、至少97%、至少98%或至少99%同一性的多肽序列的重链可变区,和具有与seq id no:2至少95%、至少96%、至少97%、至少98%或至少99%同一性的多肽序列的轻链可变区。
103.实施方案3是实施方案1或2所述的分离的单克隆抗体或其抗原结合片段,所述的
分离的单克隆抗体或其抗原结合片段包括具有seq id no:1多肽序列的重链可变区,和具有seq id no:2多肽序列的轻链可变区。
104.实施方案4是实施方案1-3中任一所述的分离的单克隆抗体或其抗原结合片段,其中,与对照抗体相比,所述抗体或其抗原结合片段具有增加的稳定性和/或较低的免疫原性。
105.实施方案5是实施方案1-4中任一所述的分离的单克隆抗体或其抗原结合片段,其中所述抗体或其抗原结合片段是人的或人源化的。
106.实施方案6是实施方案1-5中任一所述的分离的单克隆抗体或其抗原结合片段,其中所述抗体或其抗原结合片段能够与baff受体结合,并诱导效应物介导的肿瘤细胞裂解。
107.实施方案7是编码实施方案1-6中任一所述的单克隆抗体或其抗原结合片段的分离核酸。
108.实施方案8是包含实施方案7所述的分离核酸的载体。
109.实施方案9是包含实施方案8所述的载体的宿主细胞。
110.实施方案10是一种药物组合物,所述药物组合物包括实施方案1-6中任一所述的分离单克隆抗体或其抗原结合片段及其药学上可接受的载体。
111.实施方案11是一种治疗有需要的受试者中的癌症的方法,所述方法包括将实施方案10中的药物组合物给药给受试者。
112.实施方案12是一种靶向有需要的受试者中癌症细胞表面的baff受体的方法,所述方法包括将实施方案10中所述的药物组合物给药给受试者。
113.实施方案13是一种制备实施方案1-6中任一所述的单克隆抗体或其抗原结合片段的方法,所述方法包括:在制备所述单克隆抗体或其抗原结合片段的条件下,培养包含编码所述单克隆抗体或其抗原结合片段的核酸的细胞,并从细胞或培养物中回收所述单克隆抗体或其抗原结合片段。
114.实施方案14是一种制备包含实施方案1-6中任一所述的单克隆抗体或其抗原结合片段的药物组合物的方法,所述方法包括:将所述单克隆抗体或其抗原结合片段与药学上可接受的载体结合,以获得所述的药物组合物。
115.实施方案15是一种确定受试者中baff受体水平的方法,所述方法包括:
116.a.从受试者中获得样本;
117.b.将样本与实施方案1-6中任一所述的分离的单克隆抗体或其抗原结合片段接触;和
118.c.确定受试者中baff受体水平。
119.实施方案16是实施方案15所述的方法,其中样本是组织样本。
120.实施方案17是实施方案16所述的方法,其中组织样本是癌症组织样本。
121.实施方案18是实施方案15所述的方法,其中样本是血液样本。
实施例
122.实施例1亲和力成熟的抗baff受体单克隆抗体h90-11的鉴定和表征
123.h90-11是一种抗baff受体单克隆抗体,从先前鉴定的抗baff受体单克隆抗体h90-5的亲和力成熟筛选中鉴定出来(wo2017/214170;qin等人,临床癌症研究.24(5):1114-23
(2018))。当与h90-5比较时,h90-11对baff受体受体的亲和力没有显著提高(表1),然而,观察到h90-11的几个特点,如下所示。
124.表1:抗baff受体单克隆抗体与baff受体的亲和力
125.单抗靶点kd(m)k
on
(1/ms)k
dis
(1/s)全x^2全r^2h90-53.4e-099.9e+053.4e-030.01060.9816h90-119.5e-108.6e+058.2e-040.00730.9927
126.注意到h90-11与h90-5含有相同的重链可变区(分别为seq id no:1对seq id no:9)。然而,h90-11和h90-5含有不同的轻链可变区(分别为seq id no:2对seq id no:10)。
127.接下来,研究表明,当使用ig blast时,与人类种系ig序列相比,h90-5有12个不同的氨基酸残基(图1b),而与相同的人类种系ig序列相比,h90-11只有6个不同的氨基酸残基(图1a)。鉴于h90-11单克隆抗体与人类种系序列更相似,认为h90-11单克隆抗体在人体内诱发免疫应答的可能性较小。此外,认为抗体与人类种系序列越相似,抗体就越稳定。
128.为此,评估了h90-5和h90-11抗体的稳定性和免疫原性。制备了h90-5和h90-11作为全长人类igg1,以及制备了抗体药物利妥昔单抗和h90-5人源化前的基础单克隆抗体c90作为抗体对照。用于稳定性和免疫原性研究的抗体具有以下特性,如表2所示。
129.表2:抗体特性
130.样本idec280(ml.mg-1
.cm-1
)提供浓度(mg/ml)pirituxan1.6430.288.66c901.4952.67.91h90-51.5001.98.24h90-111.6241.48.34
131.利用kohli等人所述的立式单分子层吸附色谱(smac)高效液相色谱(hplc)方法,评估h90-11、h90-5、c90和利妥昔抗体的稳定性(kohli等人,单抗7(4):752-8(2015))。在zenix色谱柱上停留时间长(例如,》20分钟)的抗体会随着时间沉淀,而在zenix色谱柱上停留时间短(例如,《10分钟)的抗体不会沉淀。停留时间在10-20分钟的抗体需要用不同的方法进一步评估。
132.简单地说,smac-hplc方法采用以下hplc和smac色谱柱:agilent 1100配备dad用于hplc,zenix sec-300,4.6x 300mm,3μm色谱柱用于smac。色谱柱流速为0.35ml/min,流动相含有150mm磷酸钠,ph为7.0。色谱柱运行20分钟。在5℃,波长为214nm和280nm下分析样本,色谱柱保存在室温下。样品缓冲液为tris-甘氨酸缓冲液(100mm tris/90mm甘氨酸,ph 7.5)。每柱装入样品3μg。
133.smac停留时间(rt)与胶体稳定性呈负相关。蛋白质在色谱柱上停留时间较长,峰值较宽,容易发生聚集或沉淀。与利妥昔相似,h90-11的聚集倾向较低(rt《10分钟),而c90和其人源化版本的h90-5的聚集倾向中等(rt》10分钟)。因此,h90-11被认为不像h90-5那样容易聚集。smac-hplc研究结果如图2a-2d和下表3所示。
134.表3 smac结果总结
[0135][0136]
利用sun等人建立的人工智能驱动的免疫原性预测与评估系统(sun等人,免疫学方法杂志,452:6-11(2018)),评估h90-11、h90-5和c90抗体的免疫原性。简单地,用balb/c小鼠评价不同抗体的抗药抗体效价。约4~6周龄雌性balb/c小鼠先用完全弗氏佐剂抗体第一次免疫,再用不完全弗氏佐剂抗体增强。第一次免疫后4周,从免疫小鼠的尾部取血,用如sun等人所述间接酶联免疫分析法(elisa)检测免疫抗体滴度,以评估h90-11和h90-5的潜在免疫原性。观察到h90-11在小鼠体内的抗药物抗体比h90-5低(图3)。因此,认为h90-11在人体内的免疫原性比h90-5低。
[0137]
本领域技术人员将理解到,在不背离宽泛的创造性概念的情况下,可以对上述实施方案进行修改。因此,应理解,本发明不限于所公开的具体实施方案,但它旨在涵盖本说明书所定义的本发明精神和范围内的修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1