抗E-选择素抗体、组合物和使用方法与流程
抗e-选择素抗体、组合物和使用方法
1.相关申请案的交叉参考
2.本技术案要求于2020年1月24日提交的美国临时专利申请案第62/965,688号、2020年10月22日提交的美国临时专利申请案第63/104,213号和2020年12月4日提交的美国临时专利申请案第63/121,467号的优先权,所述申请案中的各者的内容以全文引用的方式并入本文中。
3.序列表
4.本技术案含有序列表,其以ascii格式以电子方式提交并且以全文引用的方式并入本文中。所述ascii拷贝创建于2021年1月6日,名称是pc072498a_sequence_listing_st25.txt并且大小是1,048,576个字节。
技术领域
5.本发明涉及特异性结合e-选择素的抗体和其抗原结合片段,以及其组合物、方法和用途,包括使用本发明的抗体治疗镰状细胞疾病(scd),包括治疗和预防与scd相关的血管闭塞性危象(voc)。
背景技术:
6.镰状细胞疾病(scd)是一种严重、罕见的遗传病症,仅美国(us)就有超过100,000人受到其影响(疾病控制和预防中心(center for disease control and prevention))。所述疾病是医疗需求高度未满足的群体中发病率和死亡率很高的一种慢性病状。患有scd的个体遭受进行性器官损伤且预期寿命明显缩短,中值存活期为大约56年(加德勒(gardner)等人,血液学(blood),2016;128(10)1436-38)。
7.scd的特征在于存在异常形式的血红蛋白(hb)-镰状血红蛋白(hbs)。β-珠蛋白基因(hbb)的单个核苷酸取代产生残基6(hbs等位基因)处的一个氨基酸取代(缬氨酸取代谷氨酸)。hbs同种接合的个体具有最常见且最严重形式的镰状细胞疾病(scd-ss)。当个体具有hbs的一个拷贝和另一hbb基因的一个突变拷贝时,产生scd的变异形式。具有hbs等位基因的1个拷贝和血红蛋白c等位基因(hbc)的1个拷贝的个体患有sc疾病(scd-sc)。当个体具有hbs的1个拷贝和β-地中海型贫血等位基因的一个拷贝时,scd的严重程度视β-地中海型贫血等位基因的严重程度而定,其中hbβ
°‑
地中海型贫血缺失(scd-sβ
°‑
thal)通常比hbβ
+-地中海型贫血等位基因(scd-sβ+-thal)或另一相互作用hb变异体(scd-svariant)更严重(弗朗内特(frenett)和阿特维(atweh),临床研究杂志(j.clin.invest.),2007;117:850-858)。
8.scd的分子发病机制中的主要事件是hbs倾向于在低氧张力条件下聚合,从而使得红细胞(rbc)变得刚性且变成镰状(法布里(fabry)和纳格尔(nagel),血液学,1982;60(6)1370-77)。微毛细管静脉床中的低氧引起内皮发炎和嗜中性粒细胞的粘附,并减少嗜中性粒细胞的滚动和流速。这些细胞聚集体经由与内皮细胞相互作用而滞留于血管结构中。镰状rbc、白细胞和内皮细胞的粘着相互作用阻塞血管结构,从而引起血管闭塞(张(zhang)等
人,血液学,2016:127:801-809;奥克帕拉(okpala),2006;弗朗内蒂(frenette)和阿特维,临床研究杂志,2007;117:850-858)。氧化氮内稳定失调促使scd的血管功能障碍(阿斯兰(aslan)和弗里曼(freeman),2007)。血细胞聚集体引起血管阻塞、器官梗塞和缺血发作,其临床上表现为严重疼痛发作。贫血是由溶血和血管闭塞所致的红细胞寿命缩短引起,所述溶血和血管闭塞是由血管内皮与镰状rbc、白细胞和血小板之间的相互作用引发(利斯(rees)等人,柳叶刀(lancet)2010;376:2018-31)。
9.血管闭塞性危象(voc)是scd的最常见临床表现并且是伴随日常生活功能障碍的scd发病的主要原因(巴拉斯(ballas)和卢萨蒂(lusardi),美国血液学杂志(am.j.hematol.),2005;79:17-25;皮尔(piel)等人,新英格兰医学杂志(new engl.j.med.),2017;376:1561-1573;达巴利(darbari)等人,公共科学图书馆期刊(plos one),2013;8(11):e79923)。voc是由氧张力最低的毛细管后微静脉中镰状rbc与血管内皮之间的相互作用引发(麦宛尼(manwani)和弗朗内蒂,血液学,2013;122(24):3892-8)。这引起内皮损伤,从而触发发炎反应且使得白细胞、血小板和额外rbc募集至发炎部位(张等人,血液学,2016;127(7):801)。这些细胞聚集体引起血管阻塞(图尔汗(turhan)等人,美国国家科学院院刊(proc.natl.acad.sci.),2002;99(5):3047-51)且减缓毛细管后微静脉中的血流,其引起局部组织低氧和进一步的组织发炎。这引起rbc的更多去氧化和镰状化以及闭塞的传播,有时被称为镰状细胞和闭塞血管的二次募集(斯图尔特(stuart)和纳格尔,柳叶刀2004;364(9942):1343-60)。
10.voc可以表现于最小6个月大的患有scd的患者中,但与大龄儿童或成人相比,voc在婴幼儿中要少见得多(本杰明(benjamin)等人,美国疼痛学会(amer.pain soc.),1994;第1卷,第94页)。大约60%的患有同种接合scd的患者每年有至少1次严重voc发作,然而一部分患者有更多次发作(普拉特(platt)等人,新英格兰医学杂志(n.engl.j.med.),1991;325(1);11-6)。在此同一研究中,5.2%的具有scd基因型的患者每年有3-10次严重voc发作且较小比例(》1%)的患者每年有10次或更多次发作。
11.疼痛是初始和进行中的血管闭塞和缺血的临床表现(巴拉斯,北美血液学-肿瘤学临床研究(hematol.oncol.clin.north am.),2005;19(5):785-802),其对于具有scd-ss基因型的患者来说可能尤其严重,还已经观察到与其它基因型相比,所述患者具有较高死亡率(普拉特等人,新英格兰医学杂志,1994;330(23);1639-44)。
12.白细胞募集至血管内皮损伤区域涉及粘着分子的选择素家族:e-选择素(也称为cd62e);p-选择素(也称为cd62p);和l-选择素(也称为cd62l),其都作为发炎反应的一部分受到调节(恩斯特(ernst)和玛格拉尼(magnani),自然药物发现研究(nat.rev.drug discov.),2009;8(8):661-77;莫里吉斯(morikis)等人,血液学,2017;130(19):2101-10)。虽然结构类似,但各选择素展现不同的分布、配体结合动力学以及病理和生理功能方面的多样性。
13.粘着分子的选择素家族和其配体是通过镰状红细胞和被活化的内皮细胞中的改变所促进的scd中促发炎反应的一部分。选择素还在调节细胞-细胞粘着的初始接触、内皮上的白细胞滚动和整合素活化和细胞的转移方面起关键作用。白细胞粘着于发炎内皮和循环中的细胞聚集体是scd的标志事件。
14.碳水化合物结合蛋白的选择素家族共有类似结构,其中各自具有ca
2+
依赖性(c型)
凝集素所特有的n端碳水化合物识别域,随后是表皮生长因子(egf)样域、与互补序列调节域同源的一系列短共同重复序列、跨膜域和短胞质尾区(麦克伊夫(mcever)和朱(zhu),2010)。选择素和其配体介导血小板和白细胞从血液募集至血管内皮,从而促使慢性促发炎环境的产生。
15.scd的病理生理学是复杂且异质的。症状包括疼痛危象、慢性贫血、急性胸部综合征、中风、脾脏隔离症(splenic sequestration)、血管闭塞性急性疼痛事件或危象、肾功能障碍和容易细菌感染(阿什利(ashley)-科赫(koch)等人,美国流行病学期刊(am.j.epidemiol.),2000;151:839-845;斯坦伯格(steinberg),新英格兰医学杂志,1999;340:1021-1030;皮尔等人,新英格兰医学杂志,2017;376:1561-1573)。与scd相关的急性终末器官并发症可以包括急性胸部综合征、急性中风、恒久勃起、肝胆并发症、脾脏离症和急性肾衰竭。scd累积损害引起的慢性并发症包括缺血性坏死、肺高血压、肾并发症、眼科并发症、腿溃疡和复发性恒久勃起(瑶恩(yawn)等人,美国医学会杂志(jama)2014;312:1033-48)。
16.羟基尿素被批准用于scd的预防性疗法。机制上,羟基尿素增加胎儿血红蛋白(hbf)浓度且减少疼痛危象的数目(克拉赫(charache)等人,新英格兰医学杂志,1995;332:1317-1322)。尽管羟基尿素被视为预防voc的标准照护疗法,但羟基尿素具有约30%-35%的失败率且在急性voc期间不能有效治疗症状。endari(l-谷氨酰胺)最近被批准用于预防性scd治疗,然而,其作用机制并不明确且临床益处不太大(奎恩(quinn),血液学,2018;132:689-693)。急性voc发作的当前治疗主要是利用类鸦片镇痛剂、水化(hydration)、氧疗和输液的支持性治疗。此外,大部分患者在家治疗voc且并不寻求直接医疗干预(史密斯(smith)等人,内科学年鉴(ann.intern.med.),2008;148:94-101;卡拉汉(callaghan)等人,血液学,2017;130:973)。
17.对于scd的预防和治疗,且尤其以解决患者的复发性和致衰弱voc的基础病理生理学(例如,减少发炎和细胞聚集)仍有很大的需求。本发明提供特异性结合于e-选择素且能够中和e-选择素功能活性的新型治疗性抗体。这些抗体可以有利地在用作针对scd的预防性治疗时用于预防voc或减少voc的发生,且用于通过减少voc的持续时间(例如,减少使voc消退的时间)、强度和/或严重程度来治疗患有scd的患者的急性voc。
技术实现要素:
18.本发明提供特异性结合于e-选择素的抗体和其抗原结合片段,以及用途和相关方法。所属领域的技术人员将认识到或能够仅使用常规实验确定本文所描述的本发明具体实施例的许多等效物。所述等效物意图由以下实施例(e)涵盖。
19.e1.一种被分离的抗体或其抗原结合片段,其特异性结合于e-选择素(例如人类和/或食蟹猕猴e-选择素)。
20.e2.根据e1的抗体或其抗原结合片段,其包含选自由以下组成的群组的hcdr-1、hcdr-2和hcdr-3序列:seq id no:8、23、52、63、77、92、111、125、9、24、29、38、41、44、53、64、78、93、112、126、10、54、65、79、94、113和127。
21.e3.根据e1至e2中任一项所述的抗体或其抗原结合片段,其包含选自由以下组成的群组的lcdr-1、lcdr-2和lcdr-3序列:seq id no:2、18、47、68、82、97、106、9、24、29、38、
41、44、53、64、78、93、112、126 10、54、65、79、94、113和127。
22.e4.根据e1至e3中任一项所述的抗体或其抗原结合片段,其包含(a)-(f)中的一或多个
23.(a)lcdr-1氨基酸序列,其选自由seq id no:2、18、47、68、82、97和106的序列组成的群组;
24.(b)lcdr-2氨基酸序列,其选自由seq id no:3、19、48、69、83、98、107和120的序列组成的群组;
25.(c)lcdr-3氨基酸序列,其选自由seq id no:4、20、49、70、84、99、108和121的序列组成的群组;
26.(d)hcdr-1氨基酸序列,其选自由seq id no:8、23、52、63、77、92、111和125的序列组成的群组;
27.(e)hcdr-2氨基酸序列,其选自由seq id no:9、24、29、38、41、44、53、64、78、93、112和126的序列组成的群组;和
28.(f)hcdr-3氨基酸序列,其选自由seq id no:10、54、65、79、94、113和127的序列组成的群。
29.e5.根据e1至e4中任一项所述的抗体或其抗原结合片段,其包含以下中的一或多个:
30.包含seq id no:2的氨基酸序列的lcdr-1,
31.包含seq id no:3的氨基酸序列的lcdr-2,
32.包含seq id no:4的氨基酸序列的lcdr-3,
33.包含seq id no:8的氨基酸序列的hcdr-1,
34.包含seq id no:9的氨基酸序列的hcdr-2,和
35.包含seq id no:10的氨基酸序列的hcdr-3。
36.e6.根据e1至e5中任一项所述的抗体或其抗原结合片段,其包含至少一个选自由seq id no:11、25、30、35、39、42、45、55、60、66、75、80、90、95、104、114、118和128组成的群组的序列的所述hcdr-1、hcdr-2和hcdr-3序列。
37.e7.根据e1至e6中任一项所述的抗体或其抗原结合片段,其包含至少一个选自由seq id no:5、21、27、32、50、57、71、73、85、87、100、102、109、116和122组成的群组的序列的所述lcdr-1、lcdr-2和lcdr-3序列。
38.e8.根据e1至e7中任一项所述的抗体或其抗原结合片段,其包含至少一个选自由seq id no:7、13、22、28、34、37、40、43、51、59、62、74、76、89、91、103、110、117和124组成的群组的序列的所述hcdr-1、hcdr-2和hcdr-3序列。
39.e9.根据e1至e8中任一项所述的抗体或其抗原结合片段,其包含至少一个选自由seq id no:1、17、26、31、46、56、67、72、81、86、96、101、105、115和119组成的群组的序列的所述lcdr-1、lcdr-2和lcdr-3序列。
40.e10.根据e1至e9中任一项所述的抗体或其抗原结合片段,其包含具有seq id no:11的所述hcdr-1、hcdr-2和hcdr-3序列。
41.e11.根据e1至e10中任一项所述的抗体或其抗原结合片段,其包含具有seq id no:5的所述lcdr-1、lcdr-2和lcdr-3序列。
42.e12.根据e1至e11中任一项所述的抗体或其抗原结合片段,其包含具有seq id no:7或13的所述hcdr-1、hcdr-2和hcdr-3序列。
43.e13.根据e1至e12中任一项所述的抗体或其抗原结合片段,其包含具有seq id no:1的所述lcdr-1、lcdr-2和lcdr-3序列。
44.e14.根据e1至e13中任一项所述的抗体或其抗原结合片段,其包含:包含seq id no:2的氨基酸序列的lcdr-1、包含seq id no:3的氨基酸序列的lcdr-2、包含seq id no:4的氨基酸序列的lcdr-3、包含seq id no:8的氨基酸序列的hcdr-1、包含seq id no:9的氨基酸序列的hcdr-2和包含seq id no:10的氨基酸序列的hcdr-3。
45.e15.根据e1至e4中任一项所述的抗体或其抗原结合片段,其包含:包含seq id no:2的氨基酸序列的lcdr-1、包含seq id no:3的氨基酸序列的lcdr-2、包含seq id no:4的氨基酸序列的lcdr-3。
46.e16.根据e1至e15中任一项所述的抗体或其抗原结合片段,其包含:包含seq id no:8的氨基酸序列的hcdr-1、包含seq id no:9的氨基酸序列的hcdr-2、包含seq id no:10的氨基酸序列的hcdr-3。
47.e17.根据e1至e16中任一项所述的抗体或其抗原结合片段,其包含衍生自选自由以下组成的群组的人类生殖系vl序列的vl构架序列:igkv1-12*01、igkv1-13*02、igkv1-33*01、igkv1-39*01、igkv1-5*01、igkv3-11*01、igkv3-15*01、igkv3-20*01、igkv3d-20*02和igkv4-1*01。
48.e18.根据e1至e17中任一项所述的抗体或其抗原结合片段,其包含衍生自选自由以下组成的群组的人类生殖系vh序列的vh构架序列:ighv1-2*02、ighv1-3*01、ighv1-46*01、ighv1-69*01、ighv1-69*02、ighv1-8*01、ighv3-7*01、ighv3-13*01、ighv3-23*01、ighv3-23*04、ighv3-30*01、ighv3-30*18、ighv5-10-1*01、ighv5-10-1*04和ighv5-51*01。
49.e19.根据e1至e18中任一项所述的抗体或其抗原结合片段,其包含ighv1-39*01vl构架序列。
50.e20.根据e1至e19中任一项所述的抗体或其抗原结合片段,其包含ighv3-07*01vh构架序列。
51.e21.根据e1至e20中任一项所述的抗体或其抗原结合片段,其包含vl构架序列和vh构架序列,且其中所述vl构架序列与衍生其的所述人类生殖系序列至少72%一致。
52.e22.根据e1至e21中任一项所述的抗体或其抗原结合片段,其包含vl构架序列和vh构架序列,且其中所述vl构架序列与衍生其的所述人类生殖系序列至少72%、74%、75%、77%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%一致。
53.e23.根据e1至e22中任一项所述的抗体或其抗原结合片段,其包含vl构架序列和vh构架序列,且其中所述vh构架序列与衍生其的所述人类生殖系序列至少53%一致。
54.e24.根据e1至e23中任一项所述的抗体或其抗原结合片段,其包含vl构架序列和vh构架序列,且其中所述vh构架序列与衍生其的所述人类生殖系序列至少53%、58%、60%、63%、71%、72%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%一致。
55.e25.根据e1至e24中任一项所述的抗体或其抗原结合片段,其包含vh域,所述vh域包含与seq id no:11至少90%一致的氨基酸序列。
56.e26.根据e1至e25中任一项所述的抗体或其抗原结合片段,其包含vh域,所述vh域
no:7或seq id no:13的氨基酸序列的重链和包含seq id no:1的氨基酸序列的轻链。
75.e45.根据e1至e45中任一项所述的抗体或其抗原结合片段,其包含轻链,所述轻链包含与seq id no:17、26、31、1、46、56、67、72、81、86、96、101、105、115和119中的任一个至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%一致的氨基酸序列。
76.e46.根据e1至e45中任一项所述的抗体或其抗原结合片段,其包含由寄存于atcc处且具有atcc寄存编号pta-126529的质粒的插入物编码的所述hcdr-1、hcdr-2和hcdr-3。
77.e47.根据e1至e46中任一项所述的抗体或其抗原结合片段,其包含由寄存于atcc处且具有atcc寄存编号pta-126530的所述质粒的插入物编码的所述lcdr-1、lcdr-2和lcdr-3。
78.e48.根据e1至e47中任一项所述的抗体或其抗原结合片段,其包含由寄存于atcc处且具有atcc寄存编号pta-126529的所述质粒的插入物编码的vh域。
79.e49.根据e1至e48中任一项所述的抗体或其抗原结合片段,其包含由寄存于atcc处且具有atcc寄存编号pta-126530的所述质粒中的所述插入物编码的vl域。
80.e50.根据e1至e49中任一项所述的抗体或其抗原结合片段,其包含由寄存于atcc处且具有atcc寄存编号pta-126529的所述质粒中的所述插入物编码的hc氨基酸序列和由寄存于atcc处且具有atcc寄存编号pta-126530的所述质粒中的所述插入物编码的lc氨基酸序列。
81.e51.根据e1至e50中任一项所述的抗体或其抗原结合片段,其中所述抗体或抗原结合片段是fc融合蛋白、单功能抗体、最大抗体、双功能抗体、scfab、scfv、肽体。
82.e52.根据e1至e52中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段以约或小于选自由以下组成的群组的值的kd结合人类e-选择素:约800nm、700nm、600nm、500nm、400nm、300nm、200nm、175nm、150nm、125nm、100nm、90nm、80nm、70nm、60nm、50nm、40nm、30nm、20nm、10nm、5nm、2nm、1nm、900pm、800pm、700pm、600pm和500pm。
83.e53.根据e1至e52中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段以约或小于选自由以下组成的群组的值的kd结合食蟹猕猴e-选择素:约800nm、700nm、600nm、500nm、400nm、300nm、200nm、175nm、150nm、125nm、100nm、90nm、80nm、70nm、60nm、50nm、40nm、30nm、20nm、10nm、5nm、2nm、1nm、900pm、800pm、700pm、600pm和500pm。
84.e54.根据e1至e53中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段以约10nm至约200nm的kd结合人类e-选择素。
85.e55.根据e1至e54中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段以约68.4+/-3.18nm的kd结合人类e-选择素。
86.e56.根据e1至e55中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段以约10nm至约200nm的kd结合食蟹猕猴e-选择素。
87.e57.根据e1至e56中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段以约64.9+/-1.13nm的kd结合食蟹猕猴e-选择素。
88.e58.根据e1至e57中任一项所述的抗体或其抗原结合片段,其中抗e-选择素抗体以选自由以下组成的群组的kd结合人类e-选择素:约92.85nm、约70.3nm、约65.2nm、约61.8nm、约60.5nm、约68.0nm、约21.6nm、约324nm、约54.4nm、约628.5nm和2940nm。
89.e59.根据e1至e58中任一项所述的抗体或其抗原结合片段,其中所述抗e-选择素
抗体以选自由以下组成的群组的kd结合食蟹猕猴e-选择素:约138.5nm、约78.3nm、约76.5nm、约81.5nm、约67.8nm、约45.8nm、约243.5nm、约45.4nm、约492nm和3145nm。
90.e60.根据e1至e59中任一项所述的抗体或其抗原结合片段,其中食蟹猕猴的平均半衰期在以10mg/kg的剂量进行静脉内(iv)给予后为至少约14.4天(345小时)。
91.e61.根据e1至e60中任一项所述的抗体或其抗原结合片段,其中食蟹猕猴的所述平均半衰期在以3mg/kg的剂量进行静脉内给予后为至少约12天(287小时)。
92.e62.根据e1至e61中任一项所述的抗体或其抗原结合片段,其中食蟹猕猴的所述平均半衰期在以3mg/kg的剂量进行皮下(sc)给予后为约21.5天(518小时)。
93.e63.根据e1至e62中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段并不诱导抗药物抗体。
94.e64.根据e1至e63中任一项所述的抗体或其抗原结合片段,其中如通过t-区域抗原决定基(t-regitope;t-reg)调节的评分指示,所述抗体的预测免疫原性潜能小于约-30。
95.e65.根据e1至e64中任一项所述的抗体或其抗原结合片段,其中如通过所述t-区域抗原决定基(t-reg)调节的评分指示,所述抗体的所述预测免疫原性潜能小于约-45且存在0个非生殖系t细胞抗原决定基。
96.e66.根据e1至e65中任一项所述的抗体或其抗原结合片段,其中如通过所述t-reg调节的评分指示,所述抗体的所述预测免疫原性潜能小于选自由以下组成的群组的所述t-reg调节的评分:约-24、-26、-27、-30、-32、-33、-34、-35、-36、-37、-38、-39、-40、-41、-42、-43、-44、-45、-46、-47和-48。
97.e67.根据e1至e66中任一项所述的抗体或其抗原结合片段,其中如通过t-reg调节的评分指示,所述抗体的所述预测免疫原性潜能是约-45或-46。
98.e68.根据e1至e67中任一项所述的抗e-选择素抗体或其抗原结合片段,其中如通过例如ac-sins分析、dna结合分析和/或胰岛素结合分析所测量,所述抗体或其抗原结合片段处于多反应性低风险。
99.e69.根据e1至e68中任一项所述的抗体或其抗原结合片段,其中当在25℃下通过例如动态光散射(dls)测量时,所述抗体或抗原结合片段具有选自由以下组成的群组的粘度:约23mg/ml浓度下的约7.97+/-1.83cp、约48mg/ml浓度下的约12.38+/-5.28cp、约90mg/ml浓度下的约4.26+/-0.6cp、约102mg/ml浓度下的约5.58+/-0.99cp、约121mg/ml浓度下的约8.44+/-1.54cp、约140mg/ml浓度下的约9.78+/-2.32cp、约158mg/ml浓度下的约17.47+/-3.24cp和约188mg/ml浓度下的约37.99+/-7.03cp。
100.e70.根据e1至e69中任一项所述的抗体或其抗原结合片段,其中当在25℃下通过例如dls测量时,所述抗体或抗原结合片段在约150mg/ml至约190mg/ml的浓度下具有约15cp至40cp的粘度。
101.e71.根据e1至e70中任一项所述的抗体或其抗原结合片段,其中当在25℃下通过例如anton parr方法测量时,所述抗体或抗原结合片段在185.7mg/ml下具有33.4cp的粘度。
102.e72.根据e1至e71中任一项所述的抗体或其抗原结合片段,其中如通过例如使用例如octet生物传感器的竞争分析所测定,所述抗体或其抗原结合片段结合于人类e-选择素的三个抗原决定基中的至少一个。
103.e73.如e72的抗体或其抗原结合片段,其中所述抗原决定基中的至少2个重叠。
104.e74.根据e1至e73中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段与人类e-选择素的至少一个氨基酸残基相互作用,所述至少一个氨基酸残基选自由以下组成的群组:t7、e8、a9、m10、t11、p46、s47、y48、n82、n83、q85、e88、e92、y94、r97、n105、e107、r108、s110、k111、k112、k113和其组合。
105.e75.根据e1至e74中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段与人类e-选择素的内的至少一个氨基酸残基相互作用,所述至少一个氨基酸残基选自由以下组成的群组:t7、e8、a9、t11、p46、s47、y48、n82、n83、q85、e92、y94、n105、e107、r108、s110、k111、k112和其组合。
106.e76.根据e1至e75中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段与内埋表面积的人类e-选择素中的至少一个氨基酸残基相互作用,所述至少一个氨基酸残基选自由以下组成的群组:t7、e8、a9、t11、p46、s47、y48、n82、n83、q85、e88、e92、y94、r97、e107、r108、s110、k111、k112、k113和其组合。
107.e77.根据e1至e76中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段经由氢键与人类e-选择素的至少一个氨基酸残基相互作用,所述至少一个氨基酸残基选自由以下组成的群组:e8、s47、n82、n83、e88、e92、y94、n105、e107、r108、s110、k112和其组合。
108.e78.根据e1至e77中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段经由盐桥与人类e-选择素的选自由k111、k112和其组合组成的群组的至少一个氨基酸残基相互作用。
109.e79.根据e1至e78中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段经由水介导的氢键与人类e-选择素的选自由r97、k112和其组合组成的群组的至少一个氨基酸残基相互作用。
110.e80.根据e1至e79中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段与人类e-选择素的至少一个氨基酸残基相互作用,所述至少一个氨基酸残基还在的slex氨基酸残基内相互作用,所述至少一个氨基酸残基选自由以下组成的群组:y48、n82、n83、e92、y94、r97、n105、e107和其组合。
111.e81.根据e1至e80中任一项所述的抗体或其抗原结合片段,其中hmms的百分比和/或lmms百分比在40℃下储存于选自由以下组成的群组的溶液中4周后小于5%:20mm tris(ph 7.5)、20mm组氨酸(ph 5.8)和20mm谷氨酸(ph 4.5),且其中任选地通过asec进行分析。
112.e82.根据e1至e81中任一项所述的抗体或其抗原结合片段,其中hmms的所述百分比在4℃或25℃下储存于选自由以下组成的群组的溶液中直至6周后小于5%:20mm tris、8.5%蔗糖(ph 7.5),20mm组氨酸、8.5%蔗糖、0.005%edta(ph 5.8)和20mm谷氨酸、8.5%海藻糖(ph 4.5);其中所述抗体的浓度是约150mg/ml;且其中任选地通过asec进行所述分析。
113.e83.根据e1至e82中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段具有热稳定性,其中如通过差示扫描量热法所测量,其熔融温度(tm1)或所述抗体的ch2展开50%的温度是约65℃或更高。
114.e84.根据e1至e83中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗
原结合片段具有热稳定性,其中如通过差示扫描量热法所测量,其熔融温度(tm1)或所述抗体的所述ch2展开50%的所述温度介于65℃与72℃之间。
115.e85.根据e1至e84中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段具有热稳定性,其中如通过差示扫描量热法所测量,其熔融温度(tm1)或所述抗体的所述ch2展开50%的所述温度是约71.7℃。
116.e86.根据e1至e85中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段具有热稳定性,其中如通过差示扫描量热法所测量,其熔融温度(tm2)或所述抗体的fab展开50%的温度是约74℃或更高。
117.e87.根据e1至e86中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段具有热稳定性,其中如通过差示扫描量热法所测量,其熔融温度(tm2)或所述抗体的所述fab展开50%的所述温度介于74℃与78℃之间。
118.e88.根据e1至e87中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段具有热稳定性,其中如通过差示扫描量热法所测量,其熔融温度(tm2)或所述抗体的所述fab展开50%的所述温度是约78.2℃。
119.e89.根据e1至e88中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段具有热稳定性,其中如通过差示扫描量热法所测量,其熔融温度(tm3)或所述抗体的ch3展开50%的温度是约82℃或更高。
120.e90.根据e1至e89中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段具有热稳定性,其中如通过差示扫描量热法所测量,其熔融温度(tm3)或所述抗体的所述ch3展开50%的所述温度介于82℃与86℃之间。
121.e91.根据e1至e90中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段具有热稳定性,其中如通过差示扫描量热法所测量,其熔融温度(tm3)或所述抗体的所述ch3展开50%的所述温度是约84.3℃。
122.e92.根据e1至e91中任一项所述的抗体或其抗原结合片段,其中如例如通过facs所测量,所述抗体或其抗原结合片段对于细胞表面表达的人类e-选择素的结合亲和力(表示为ec
50
)小于或等于50nm,例如小于或等于48nm、45nm、40nm、20nm、10nm、5nm、4nm、3nm、2nm、1nm、0.75nm、0.5nm、0.25nm或0.1nm。
123.e93.根据e1至e92中任一项所述的抗体或其抗原结合片段,其中如例如通过facs所测量,所述抗体或其抗原结合片段对于细胞表面表达的人类e-选择素的结合亲和力(表示为ec
50
)是约0.66nm。
124.e94.根据e1至e93中任一项所述的抗体或其抗原结合片段,其中如例如通过facs所测量,所述抗体或其抗原结合片段对于细胞表面表达的食蟹猕猴e-选择素的结合亲和力(表示为ec
50
)小于或等于50nm,例如小于或等于48nm、45nm、40nm、20nm、10nm、5nm、4nm、3nm、2nm、1nm、0.75nm、0.5nm、0.25nm或0.1nm。
125.e95.根据e1至e94中任一项所述的抗体或其抗原结合片段,其中如例如通过facs所测量,所述抗体或其抗原结合片段对于细胞表面表达的人类p-选择素的结合亲和力(表示为ec
50
)大于或等于350nm,例如大于或等于400nm、450nm、500nm、550nm、600nm、650nm或更大。
126.e96.根据e1至e95中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗
原结合片段对于可溶性大鼠、小鼠或兔e-选择素或对于可溶性人类l-选择素或p-选择素具有弱结合或不具有结合。
127.e97.根据e1至e96中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段对于细胞表面表达的人类p-选择素具有弱结合或不具有结合。
128.e98.根据e1至e97中任一项所述的抗体或其抗原结合片段,其中如例如通过spr所测量,所述抗体或其抗原结合片段在最多405nm下展现对于大鼠、小鼠或兔e-选择素或对于可溶性人类l-选择素或p-选择素的无结合。
129.e99.根据e1至e98中任一项所述的抗体或其抗原结合片段,其中如例如通过直接结合elisa所测量,所述抗体或其抗原结合片段展现对于可溶性小鼠或大鼠e-选择素的弱-不饱和的结合,其比对于人类或大鼠e-选择素的结合低约》100倍。
130.e100.根据e1至e99中任一项所述的抗体或其抗原结合片段,其中如例如通过直接结合elisa所测量,所述抗体或其抗原结合片段在最多133.3nm下展现对于可溶性小鼠或大鼠e-选择素的弱-不饱和结合。
131.e101.根据e1至e100中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段以小于或等于2nm,例如小于或等于0.010nm、0.015nm、0.020nm、0.025nm、0.030nm、0.035nm、0.040nm、0.045nm、0.05nm、0.055nm、0.06nm、0.065nm、0.070nm、0.075nm、0.080nm、0.085nm、0.090nm、0.10nm、0.12nm、0.15nm、0.2nm、0.5nm、0.9nm、0.95nm、1.0nm、1.5nm、18nm或1.9nm的ec
50
结合于可溶性人类e-选择素。
132.e102.根据e1至e101中任一项所述的抗体或其抗原结合片段,其中如例如通过直接结合elisa所测量,所述抗体或其抗原结合片段以约0.085nm至约0.12nm的ec
50
结合于可溶性人类e-选择素。
133.e103.根据e1至e102中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段以小于或等于1nm,例如小于或等于0.010nm、0.015nm、0.020nm、0.025nm、0.030nm、0.035nm、0.040nm、0.045nm、0.05nm、0.055nm、0.06nm、0.065nm、0.070nm、0.075nm、0.080nm、0.085nm、0.090nm、0.10nm、0.12nm、0.15nm、0.2nm、0.5nm、0.9nm或0.95nm的ec
50
结合于可溶性食蟹猕猴e-选择素。
134.e104.根据e1至e103中任一项所述的抗体或其抗原结合片段,其中如例如通过直接结合elisa所测量,所述抗体或其抗原结合片段以0.071nm至0.093nm的ec
50
结合于可溶性食蟹猕猴e-选择素。
135.e105.根据e1至e104中任一项所述的抗体或其抗原结合片段,其中所述抗体或其抗原结合片段以约1nm至约3nm的ic
50
且优选以约1.2nm的ic
50
结合人类血清中的游离可溶性人类e-选择素。
136.e106.根据e1至e105中任一项所述的抗体或其抗原结合片段,其中如例如在静态条件下通过竞争elisa所测量,所述抗体或其抗原结合片段以小于或等于100nm,例如小于或等于95nm、90nm、80nm、70nm、60nm、50nm、40nm、20nm、10nm、5nm、4nm、3nm、2nm或1nm的ic
50
中和唾液酸-路易斯a配体与可溶性人类e-选择素的结合。
137.e107.根据e1至e106中任一项所述的抗体或其抗原结合片段,其中如例如在静态条件下通过竞争elisa所测量,所述抗体或其抗原结合片段以约2.87nm至约3.01nm的ic
50
中和唾液酸-路易斯a配体与可溶性人类e-选择素的结合。
138.e108.根据e1至e107中任一项所述的抗体或其抗原结合片段,其中如例如在静态条件下通过竞争elisa所测量,所述抗体或其抗原结合片段以小于或等于100nm,例如小于或等于95nm、90nm、80nm、70nm、60nm、50nm、40nm、20nm、10nm、5nm、4nm、3nm、2nm或1nm的ic
50
中和唾液酸-路易斯a配体与可溶性食蟹猕猴e-选择素的结合。
139.e109.根据e1至e108中任一项所述的抗体或其抗原结合片段,其中如例如在静态条件下通过竞争elisa所测量,所述抗体或其抗原结合片段以约2.39nm至约2.91nm的ic
50
中和唾液酸-路易斯a配体与可溶性食蟹猕猴e-选择素的结合。
140.e110.根据e1至e109中任一项所述的抗体或其抗原结合片段,其中如例如在静态条件下通过竞争elisa所测量,所述抗体或其抗原结合片段以小于或等于100nm,例如小于或等于95nm、90nm、80nm、70nm、60nm、50nm、40nm、20nm、10nm、5nm、4nm、3nm、2nm或1nm的ic
50
中和唾液酸-路易斯a配体与细胞表面表达的人类e-选择素的结合。
141.e111.根据e1至e110中任一项所述的抗体或其抗原结合片段,其中如例如在静态条件下通过竞争elisa所测量,所述抗体或其抗原结合片段以约1.88nm至约2.89nm的ic
50
中和唾液酸-路易斯a配体与细胞表面表达的人类e-选择素的结合。
142.e112.根据e1至e111中任一项所述的抗体或其抗原结合片段,其中如例如在静态条件下通过竞争elisa所测量,所述抗体或其抗原结合片段以小于或等于100nm,例如小于或等于95nm、90nm、80nm、70nm、60nm、50nm、40nm、20nm、10nm、5nm、4nm、3nm、2nm或1nm的ic
50
中和唾液酸-路易斯a配体与细胞表面表达的食蟹猕猴e-选择素的结合。
143.e113.根据e1至e112中任一项所述的抗体或其抗原结合片段,其中如例如在静态条件下通过竞争elisa所测量,所述抗体或其抗原结合片段以约1.47nm至约2.65nm的ic
50
中和唾液酸-路易斯a配体与细胞表面表达的食蟹猕猴e-选择素的结合。
144.e114.根据e1至e113中任一项所述的抗体或其抗原结合片段,其中如例如在静态条件下所测量,所述抗体或其抗原结合片段以小于或等于100nm,例如小于或等于95nm、90nm、80nm、70nm、60nm、50nm、40nm、20nm、10nm、5nm、4nm、3nm、2nm或1nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与细胞表面表达的人类e-选择素的粘着。
145.e115.根据e1至e114中任一项所述的抗体或其抗原结合片段,其中如例如在静态条件下所测量,所述抗体或其抗原结合片段以约3.36nm至约4.7nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与细胞表面表达的人类e-选择素的粘着。
146.e116.根据e1至e115的抗体或其抗原结合片段,其中如例如在静态条件下所测量,所述抗体或其抗原结合片段以约3.84nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与细胞表面表达的食蟹猕猴e-选择素的粘着。
147.e117.根据e1至e116中任一项所述的抗体或其抗原结合片段,其中如例如在生理流动条件下所测量,所述抗体或其抗原结合片段以小于或等于100nm,例如小于或等于95nm、90nm、80nm、70nm、60nm、50nm、40nm、30nm、20nm、10nm、5nm或2nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与细胞表面表达的人类e-选择素的粘着。
148.e118.根据e1至e117中任一项所述的抗体或其抗原结合片段,其中如例如在生理
流动条件下所测量,所述抗体或其抗原结合片段以约4.25nm至约4.56nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与细胞表面表达的人类e-选择素的粘着。
149.e119.根据e1至e118中任一项所述的抗体或其抗原结合片段,其中如例如在生理流动条件下所测量,所述抗体或其抗原结合片段以约4.32nm至约4.35nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与细胞表面表达的食蟹猕猴e-选择素的粘着。
150.e120.根据e1至e119中任一项所述的抗体或其抗原结合片段,其中如例如在生理流动条件下所测量,所述抗体或其抗原结合片段以小于或等于300nm,例如小于或等于290nm、280nm、270nm、260nm、250nm、150nm、100nm、90nm、100nm、90nm、80nm、70nm、60nm、50nm、40nm、20nm、20nm、5nm、2nm或1nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与可溶性人类e-选择素的粘着。
151.e121.根据e1至e120中任一项所述的抗体或其抗原结合片段,其中如例如在生理流动条件下所测量,所述抗体或其抗原结合片段以约13.28nm至约15.94nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与可溶性人类e-选择素的粘着。
152.e122.根据e1至e121中任一项所述的抗体或其抗原结合片段,其中如例如在生理流动条件下所测量,所述抗体或其抗原结合片段以约9.45nm至约16.33nm的ic
50
抑制被活化的人类嗜中性粒细胞(例如被tnf-α活化)与细胞表面表达的食蟹猕猴e-选择素的粘着。
153.e123.根据e1至e122中任一项所述的抗体或其抗原结合片段,其中如例如在生理流动条件下所测量,所述抗体或其抗原结合片段以约2.87nm至约4.65nm的ic
50
抑制被活化的人类嗜中性粒细胞(例如经tnf-α活化)与细胞表面表达的人类e-选择素的粘着。
154.e124.根据e1至e123中任一项所述的抗体或其抗原结合片段,其中如例如在生理流动条件下所测量,所述抗体或其抗原结合片段以约6.17nm至约18.66nm的ic
50
抑制来自scd患者的血细胞与可溶性人类e-选择素的粘着。
155.e125.根据e1至e124中任一项所述的抗体或其抗原结合片段,其中如例如在生理流动条件下所测量,所述抗体或其抗原结合片段以约12.4nm的ic
50
抑制来自scd患者的血细胞与可溶性人类e-选择素的粘着。
156.e126.一种被分离的核酸分子,其包含编码根据e1至e125中任一项所述的抗体或其抗原结合片段的核酸序列。
157.e127.一种被分离的核酸分子,其包含至少一个编码根据e1至e125中任一项所述的抗体或其抗原结合片段的核酸序列。
158.e128.一种被分离的核酸分子,其编码特异性结合人类e-选择素的抗体或其抗原结合片段的vl、vh或两者,其中所述核酸分子包含seq id no:136的核酸序列、seq id no:137的核酸序列或两者。
159.e129.一种被分离的核酸分子,其包含seq id no:136的核酸序列、seq id no:137的核酸序列或两者,或由所述序列组成。
160.e130.一种被分离的核酸分子,其包含如seq id no:136所示的核酸序列或由所述序列组成。
161.e131.一种被分离的核酸分子,其包含如seq id no:137所示的核酸序列或由所述序列组成。
162.e132.一种被分离的核酸分子,其编码特异性结合人类e-选择素的抗体或其抗原结合片段的所述vh,所述核酸分子包含至少一个选自由以下组成的群组的核酸序列:seq id no:136、144、146、148、150、151、152、153、155、157、159、161、163、165、167、169、171和173。
163.e133.一种被分离的核酸分子,其编码特异性结合人类e-选择素的抗体或其抗原结合片段的所述vh,所述核酸分子包含与选自由seq id no:136、144、146、148、150、151、152、153、155、157、159、161、163、165、167、169、171和173组成的群组的核酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%一致的核酸。
164.e134.一种被分离的核酸分子,其编码特异性结合人类e-选择素的抗体或其抗原结合片段的所述vl,所述核酸分子包含至少一个选自由以下组成的群组的核酸序列:seq id no:137、145、147、149、154、156、158、160、162、164、166、168、170、172和174。
165.e135.一种被分离的核酸分子,其编码特异性结合人类e-选择素的抗体或其抗原结合片段的所述vl,所述核酸分子包含与选自由seq id no:137、145、147、149、154、156、158、160、162、164、166、168、170、172和174组成的群组的核酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%一致的核酸。
166.e136.一种被分离的核酸分子,其编码特异性结合人类e-选择素的抗体或其抗原结合片段的轻链、重链或两者,其中所述核酸分子包含seq id no:206或138的核酸序列;seq id no:139的核酸序列;或两者。
167.e137.一种被分离的核酸分子,其包含seq id no:206或138的核酸序列;seq id no:139的核酸序列或两者;或由所述序列组成。
168.e138.一种被分离的核酸分子,其包含seq id no:206或138的核酸序列或由所述序列组成。
169.e139.一种被分离的核酸分子,其包含seq id no:139的核酸序列或由所述序列组成。
170.e140.一种被分离的核酸分子,其编码特异性结合人类e-选择素的抗体或其抗原结合片段,其中所述核酸分子包含寄存于atcc处且具有寄存编号pta-126529的质粒的插入物的核酸序列。
171.e141.一种被分离的核酸分子,其编码特异性结合人类e-选择素的抗体或其抗原结合片段,其中所述核酸分子包含寄存于atcc处且具有寄存编号pta-126530的质粒的插入物的核酸序列。
172.e142.一种被分离的核酸分子,其编码特异性结合人类e-选择素的抗体或其抗原结合片段,其中所述核酸包含寄存于atcc处且具有寄存编号pta-126529的质粒的插入物的核酸序列,和寄存于atcc处且具有寄存编号pta-126530的质粒的插入物的核酸序列。
173.e143.一种被分离的核酸分子,其包含寄存于atcc处且具有寄存编号pta-126529的质粒的插入物的核酸序列。
174.e144.一种被分离的核酸分子,其包含寄存于atcc处且具有寄存编号pta-126530的质粒的插入物的核酸序列。
175.e145.一种被分离的核酸分子,其包含寄存于atcc处且具有寄存编号pta-126529的质粒的插入物的核酸序列,和寄存于atcc处且具有寄存编号pta-126530的质粒的插入物的核酸序列。
176.e146.一种载体,其包含根据e126至e145中任一项所述的核酸分子。
177.e147.一种宿主细胞,其包含根据e126至e145中任一项所述的核酸分子或根据e146所述的载体。
178.e148.根据e147所述的宿主细胞,其中所述细胞是哺乳动物细胞。
179.e149.根据e147或e148所述的宿主细胞,其中所述宿主细胞是cho细胞、hek-293细胞、ns0细胞、per.c6细胞或sp2.0细胞。
180.e150.一种制造抗体或其抗原结合片段的方法,其包含在其中所述抗体或抗原结合片段由根据e147至e149中任一项所述的宿主细胞表达的条件下培养所述宿主细胞。
181.e151.根据e150的方法,其进一步包含分离所述抗体或其抗原结合片段。
182.e152.一种医药组合物,其包含根据e1至e125和e221中任一项所述的抗体或其抗原结合片段和医药学上可接受的载剂或赋形剂。
183.e153.根据e152所述的医药组合物,其中所述组合物包含1.12mg/ml l-组氨酸、2.67mg/ml l-组氨酸盐酸盐单水合物、85mg/ml蔗糖、0.05mg/ml乙二胺四乙酸二钠二水合物、0.2mg/ml聚山梨醇酯80(ph 5.8)。
184.e154.根据e152或e153所述的医药组合物,其中所述组合物包含20mm组氨酸、8.5%蔗糖和0.02%聚山梨醇酯80、0.005%edta(ph 5.8)。
185.e155.根据e152至e154中任一项所述的医药组合物,其中所述组合物包含约25mg/ml、50mg/ml、75mg/ml、100mg/ml、125mg/ml、150mg/ml抗体或其抗原结合片段。
186.e156.根据e155所述的医药组合物,其中所述组合物包含约100mg/ml抗体或其抗原结合片段。
187.e157.根据e152至e156中任一项所述的医药组合物,其中所述剂量是1ml剂量。
188.e158.根据e152至e157所述的医药组合物,其中所述组合物适用于皮下和/或静脉内给予。
189.e159.根据e152至e158中任一项所述的医药组合物,其包含含有以下的抗体或其抗原结合片段:i)seq id no:11的hcdr-1、hcdr-2和hcdr-3序列以及seq id no:5的lcdr-1、lcdr-2和lcdr-3序列;ii)包含seq id no:11的氨基酸序列的vh域和包含seq id no:5的氨基酸序列的vl域;或iii)包含seq id no:7或13的氨基酸序列的hc和包含seq id no:1的氨基酸序列的lc。
190.e160.根据e152至e159中任一项所述的医药组合物,其包含选自由以下组成的群组的额外治疗活性化合物:l-谷氨酰胺(例如endari);抗p-选择素抗体(例如立赞利珠单抗(crizanlizumab)(adakveo));调节hbs以使其维持在其r状态(即,含氧)的化合物,例如2-氨基喹啉和描述于wo 2020/109994(以引用的方式并入本文中)中的化合物;调节hbs的氧亲和力的化合物(例如沃西洛特(voxelotor)(oxbryta));通过调节2,3-二磷酸甘油酸的生成而靶向hbs聚合的化合物;通过诱发胎儿血红蛋白的表达而靶向hbs聚合的化合物(例如羟基尿素,例如droxia、hydrea);靶向功能障碍性细胞粘着、血管功能障碍和/或发炎的化合物(例如磷酸二酯酶-9抑制剂);增加血液中氧化氮的含量的化合物(例如可溶性鸟苷酸
环化酶刺激剂,例如iw-1701、瑞司瓜特(riociguat)(adempas));静脉内用免疫球蛋白(ig);靶向高血液凝固性的化合物(例如瑞司瓜特(adempas)、阿派沙班(apixaban)(eliquis)、利伐沙班(rivaroxaban)(xarelto));阻断nmda受体结合的化合物(例如美金刚胺(memantine)(namenda))和其组合。
191.e161.根据e152至e159中任一项所述的医药组合物,其包含选自由以下组成的群组的额外治疗活性化合物:预防肺炎球菌感染的青霉素预防、羟基尿素(例如droxia、hydrea)、l-谷氨酰胺(例如endari)、立赞利珠单抗(adakveo)、沃西洛特(oxbryta)、阿派沙班(eliquis)、利伐沙班(xarelto)、非类固醇消炎药、镇痛剂(通常是类鸦片镇痛剂)、iw-1701、瑞司瓜特(adempas)、替卡格雷(ticagrelor)(brilinta)、美金刚胺(namenda)和其组合。
192.e162.一种减少或抑制e-选择素活性的方法,其包含向有需要的个体给予治疗有效量的根据e1至e125、e221中任一项所述的抗体或其抗原结合片段,或根据e152至e161中任一项所述的医药组合物,且将给予之前e-选择素的活性与给予所述抗体之后的e-选择素活性的含量进行比较,由此降低e-选择素的所述活性。
193.e163.根据e162所述的方法,其中降低或抑制e-选择素活性治疗通过去除、抑制或减少e-选择素活性而得到改善、缓解、抑制或预防的疾病、病症或病状。
194.e164.根据e162至e163中任一项所述的方法,其中e-选择素的所述活性选自由以下组成的群组:
195.(a)白细胞系链至内皮细胞;
196.(b)稳定粘着于内皮细胞的活化;
197.(c)白细胞缓慢滚动直至阻滞;
198.(d)白细胞的有效跨内皮迁移;
199.(e)cd18整合素的亲和力和亲合力;
200.(f)运输白细胞至急性发炎部位;
201.(g)增加胞溶质钙;
202.(h)增加使p38 map激酶和syk激酶活化的酪氨酸磷酸化;
203.(i)自所述血液募集血小板和白细胞至血管内皮;和
204.(j)产生促发炎环境。
205.e165.一种降低有需要的个体中的游离e-选择素的含量的方法,所述方法包含向个体给予治疗有效量的根据e1至e125中任一项所述的抗体或其抗原结合片段,或根据e152至e161中任一项所述的医药组合物。
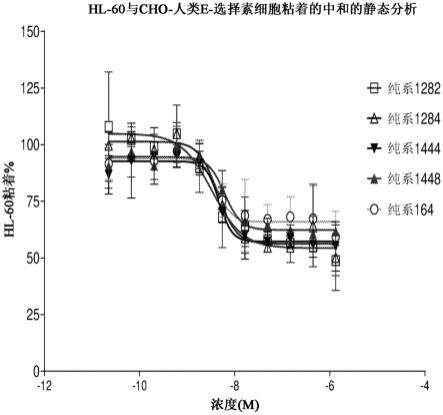
206.e166.一种治疗和/或预防与e-选择素表达和/或e-选择素结合于配体相关或由其介导的疾病、病症和/或病状的方法,其包含向有需要的个体给予治疗有效量的根据e1至e125中任一项所述的抗体或其抗原结合片段,或根据e152至e161中任一项所述的医药组合物。
207.e167.根据e166的方法,其中所述疾病、病症和/或病状选自由以下组成的群组中的至少一种:scd、血管闭塞性危象(voc)、疼痛、器官梗塞、缺血、中风、终末器官功能障碍、急性胸部和血管阻塞、皮肤病(例如牛皮癣)、发炎疾病(例如类风湿性关节炎)和糖尿病并发症。
208.e168.根据e167的方法,其中所述voc与scd相关。
209.e169.根据e166至e168中任一项所述的方法,其包含通过预防或减少voc的发生对scd进行预防性治疗。
210.e170.根据e167至e169中任一项所述的方法,其包含通过减少voc的持续时间(例如,减少使voc消退的时间)和强度对scd进行急性治疗。
211.e171.根据e166至e170中任一项所述的方法,其中所述治疗是预防性治疗。
212.e172.根据e166至e171中任一项所述的方法,其治疗、预防和/或改善scd的至少一种病征和/或症状,例如,影响以下的病征和/或症状:心胸系统(例如慢性限制性肺病、左心室舒张性疾病、肺高血压、急性胸部综合征、心律不整、猝死、血管闭塞性危象)、神经系统(例如出血性中风、静脉窦栓塞、脑的无症状脑梗塞、慢性疼痛、脑的急性缺血性中风、增生性视网膜病变、眼眶梗塞、认知障碍)、网状内皮系统(例如脾脏离症、功能性低脾功能症、贫血、溶血)、肌骨胳系统(例如缺血性坏死、皮肤溃疡)、泌尿生殖系统(例如乳头状坏死、蛋白尿、肾衰竭、血尿、夜间遗尿、恒久勃起)和肠胃系统(例如胆石症、胆管病、肝病、肠系膜血管闭塞)。
213.e173.根据e166至e172中任一项所述的方法,其中所述个体是人类。
214.e174根据e166至e173中任一项所述的方法,其中所述个体是患有scd的患者。
215.e175.根据e166至e174中任一项所述的方法,其中所述个体具有hbss、hbsc、hbs/β
°
thal、hbs/β
+
thal或hbs-变异体基因型。
216.e176.根据e166至e175中任一项所述的方法,其中所述抗体或其抗原结合片段或医药组合物是皮下给予。
217.e177.根据e166至e176中任一项所述的方法,其中所述抗体或其抗原结合片段或医药组合物是静脉内给予。
218.e178.根据e166至e177中任一项所述的方法,其中所述抗体或其抗原结合片段或医药组合物是约一周两次、一周一次、每两周一次、每三周一次、每四周一次、每五周一次、每六周一次、每七周一次、每八周一次、每九周一次、每十周一次、一个月两次、一个月一次、每两个月一次、每三个月一次、每四个月一次、每五个月一次、每六个月一次、每七个月一次、每八个月一次、每九个月一次、每十个月一次、每十一个月一次或每十二个月一次进行给予。
219.e179.根据e166至e177中任一项所述的方法,其中所述抗体或其抗原结合片段或医药组合物是一个月一次给予。
220.e180.根据e166至e179中任一项所述的方法,其中所述抗体或其抗原结合片段或医药组合物是一周一次给予。
221.e181.如e66至e180中任一项所述的方法,其中所述治疗有效量包含约1mg至约800mg的所述抗e-选择素抗体或其抗原结合片段的剂量。
222.e182.根据e181的方法,其中所述剂量是初始固定剂量。
223.e183.根据e181至e182中任一项所述的方法,其中所述剂量是约1mg至约10mg、约10mg至约20mg、约20mg至约30mg、约30mg至约40mg、约40mg至约50mg、约50mg至约60mg、约60mg至约70mg、约70mg至约80mg、约80mg至约90mg、约90mg至约100mg、约100mg至约150mg、约150mg至约200mg、约200mg至约300mg、约300mg至约400mg、约400mg至约500mg、约500mg至
约600mg、约600mg至约700mg或约700mg至约800mg的所述抗e-选择素抗体或其抗原结合片段。
224.e184.根据e181至e183中任一项所述的方法,其中所述剂量是约15mg、40mg、100mg、150mg、300mg、500mg或600mg的抗e-选择素抗体或其抗原结合片段。
225.e185.根据e181至e184中任一项所述的方法,其中所述剂量是约150mg的所述抗e-选择素抗体或其抗原结合片段。
226.e186.如e81至e185中任一项所述的方法,其包含一周一次、每2周一次、一个月一次、每两个月一次或其组合进行给予所述剂量。
227.e187.根据e162至e186中任一项所述的方法,其中所述抗体是抗体1444且所述抗原结合片段是抗体1444的片段。
228.e188.根据e162至e187中任一项所述的方法,其中所述给予是皮下或静脉内给予。
229.e189.根据e162至e188中任一项所述的方法,其包含给予包含以下的抗体或其抗原结合片段:i)seq id no:11的hcdr-1、hcdr-2和hcdr-3序列以及seq id no:5的lcdr-1、lcdr-2和lcdr-3序列;ii)包含seq id no:11的氨基酸序列的vh域和包含seq id no:5的氨基酸序列的vl域;或iii)包含seq id no:7或13的氨基酸序列的hc以及包含seq id no:1的氨基酸序列的lc。
230.e190.根据e162至e188中任一项所述的方法,其包含给予医药组合物,所述医药组合物包含含有以下的抗体或其抗原结合片段:i)seq id no:11的hcdr-1、hcdr-2和hcdr-3序列以及seq id no:5的lcdr-1、lcdr-2和lcdr-3序列;ii)包含seq id no:11的氨基酸序列的vh域和包含seq id no:5的氨基酸序列的vl域;或iii)包含seq id no:7或13的氨基酸序列的hc以及包含seq id no:1的氨基酸序列的lc。
231.e191.根据e162至e190中任一项所述的方法,其中所述个体是患有scd的患者。
232.e192.一种治疗scd的方法,其包含向有需要的个体给予治疗有效量的抗e-选择素抗体或其抗原结合片段,其包含i)seq id no:11的hcdr-1、hcdr-2和hcdr-3序列以及seq id no:5的lcdr-1、lcdr-2和lcdr-3序列;ii)包含seq id no:11的氨基酸序列的vh域和包含seq id no:5的氨基酸序列的vl域;或iii)包含seq id no:7或13的氨基酸序列的hc以及包含seq id no:1的氨基酸序列的lc;和医药学上可接受的载剂或赋形剂。
233.e193.根据e192所述的方法,其中治疗scd包括治疗scd(包括voc)的至少一种症状。
234.e194.根据e192至e193中任一项所述的方法,其中所述个体是患有scd的患者。
235.e195.根据e192至e194中任一项所述的方法,其包含皮下和/或静脉内给予所述抗体或其抗原结合片段。
236.e196.根据e192至e195中任一项所述的方法,其中所述抗体或其抗原结合片段是约一周两次、一周一次、每两周一次、每三周一次、每四周一次、每五周一次、每六周一次、每七周一次、每八周一次、每九周一次、每十周一次、一个月两次、一个月一次、每两个月一次、每三个月一次、每四个月一次、每五个月一次、每六个月一次、每七个月一次、每八个月一次、每九个月一次、每十个月一次、每十一个月一次或每十二个月一次进行给予。
237.e197.根据e192至e196中任一项所述的方法,其中所述抗体或其抗原结合片段或医药组合物是一周一次、每2周一次、每3周一次、一个月一次或其组合进行给予。
238.e198.根据e192至e197中任一项所述的方法,其中所述抗体或其抗原结合片段是以约1mg至约800mg之间的剂量进行给予。
239.e199.根据e192至e198中任一项所述的方法,其中所述抗体或其抗原结合片段或医药组合物是以选自由以下组成的群组的剂量进行给予:约15mg、约40mg、约100mg、约150mg、约300mg、约500mg和约600mg。
240.e200.根据e192至e199中任一项所述的方法,其中所述抗体或其抗原结合片段与治疗有效量的一或多种在治疗和/或预防scd的至少一种病征和/或症状方面有效的额外治疗活性化合物或治疗方法进行组合给予。
241.e201.根据e192至e200中任一项所述的方法,其中所述抗e-选择素抗体或其抗原结合片段的量以及在治疗和/或预防scd的至少一种病征和/或症状方面有效的所述治疗活性化合物或治疗方法的量是以在所述治疗和/或预防scd的至少一种病征和/或症状方面一起实现协同作用的量进行给予。
242.e202.根据e192至e201中任一项所述的方法,其中所述抗e-选择素抗体或其抗原结合片段的所述量和/或在治疗和/或预防scd的至少一种病征和/或症状方面有效的所述治疗活性化合物或治疗方法的所述量,各自以低于在不以组合形式之情况下将给予的剂量的剂量进行给予。
243.e203.根据e192至e202中任一项所述的方法,其中所述额外治疗活性化合物选自由以下组成的群组:预防肺炎球菌感染的青霉素预防、羟基尿素(例如droxia、hydrea)、l-谷氨酰胺(例如endari)、立赞利珠单抗(adakveo)、沃西洛特(oxbryta)、阿派沙班(eliquis)、利伐沙班(xarelto)、非类固醇消炎药、镇痛剂(通常是类鸦片镇痛剂)、iw-1701、瑞司瓜特(adempas)、替卡格雷(brilinta)、美金刚胺(namenda)和其组合。
244.e204.根据e192至e203中任一项所述的方法,其中所述额外治疗活性化合物选自由以下组成的群组:l-谷氨酰胺(例如endari);抗p-选择素抗体(例如立赞利珠单抗(adakveo));调节hbs以使其维持在其r状态(即,含氧)的化合物,例如2-氨基喹啉和描述于wo 2020/109994(以引用的方式并入本文中)中的化合物;调节hbs的氧亲和力的化合物(例如沃西洛特(oxbryta));通过调节2,3-二磷酸甘油酸的生成而靶向hbs聚合的化合物;通过诱发胎儿血红蛋白(hbf)的表达而靶向hbs聚合的化合物(例如羟基尿素,例如droxia、hydrea);靶向功能障碍性细胞粘着、血管功能障碍和/或发炎的化合物(例如磷酸二酯酶-9抑制剂);增加血液中氧化氮的含量的化合物(例如可溶性鸟苷酸环化酶刺激剂,例如iw-1701、瑞司瓜特(adempas));静脉内用免疫球蛋白;靶向高血液凝固性的化合物(例如瑞司瓜特(adempas)、阿派沙班(eliquis)、利伐沙班(xarelto));阻断nmda受体结合的化合物(例如美金刚胺(namenda))和其组合。
245.e205.根据e192至e204中任一项所述的方法,其中适用于治疗和/或预防scd的至少一种病征和/或症状的所述治疗活性治疗方法选自由以下组成的群组:补充氧;输血,任选地伴有铁螯合;骨髓移植;基因疗法(例如lentiglobin);通过crispr的基因编辑疗法(例如ctx001)或锌指技术和其组合。
246.e206.根据e200至e205中任一项所述的方法,其中将所述抗e-选择素抗体或其抗原结合片段和在治疗和/或预防scd的至少一种病征和或症状有效的所述治疗活性化合物或治疗方法进行共同给予。
247.e207.根据e200至e206中任一项所述的方法,其中组合疗法是根据相同给药方案(例如,两种疗法是每天进行给予)或根据不同给药方案(例如,一种疗法是每天进行给予,另一种疗法是每周进行给予)进行给予。
248.e208.根据e200至e207中任一项所述的方法,其中所述组合疗法是通过相同或不同给予途径向个体给予。
249.e209.一种根据e152至e161中任一项所述的医药组合物在制造用于治疗由e-选择素介导的疾病、病症或病状(例如scd)的药剂中的用途。
250.e210.一种根据e1至e125或e221中任一项所述的抗体或其抗原结合片段在制造用于治疗和/或预防与e-选择素表达和/或e-选择素结合于配体相关或由其介导的疾病、病症或病状的药剂中的用途。
251.e211.一种根据e152至e161中任一项所述的医药组合物在制造用于治疗和/或预防与e-选择素表达和/或e-选择素结合于配体相关或由其介导的疾病、病症或病状的药剂中的用途。
252.e212.根据e1至e125或e221中任一项所述的抗体或其抗原结合片段,或根据e152至e161的医药组合物,其适用作药剂。
253.e213.根据e1至e125或e221中任一项所述的抗体或其抗原结合片段,或根据e152至e161中任一项所述的医药组合物,其用于治疗和/或预防scd的至少一种病征和/或症状。
254.e214.根据e213所述的供使用的抗体或其抗原结合片段或医药组合物,其中scd的所述症状是voc。
255.e215.根据e213至e214中任一项所述的供使用的抗体、或其抗原结合片段或医药组合物,其中所述治疗和/或预防进一步包含额外治疗剂,诸如但不限于在治疗和/或预防scd的至少一种病征和/或症状方面有效的至少一种其它治疗活性化合物或治疗方法。
256.e216.根据e215所述的供使用的抗体或其抗原结合片段或医药组合物,其中所述额外治疗剂是作为标准照护疗法的用于预防和/或治疗scd的至少一种病征和/或症状的药剂(例如l-谷氨酰胺、羟基尿素、输血和所属领域中已知的任何其它疗法)。
257.e217.根据e215至e216所述的供使用的抗体或其抗原结合片段或医药组合物,其中所述治疗和/或预防包含i)协同治疗有效量的所述抗e-选择素抗体或其抗原结合片段,和ii)协同治疗有效量的额外治疗剂。
258.e218.根据e215或e216所述的供使用的抗体或其抗原结合片段或医药组合物,其中所述治疗和/或预防包含i)协同治疗有效量的所述抗e-选择素抗体或其抗原结合片段,和ii)协同治疗有效量的所述治疗方法。
259.e219.根据e152至e161中任一项所述的医药组合物,其中如所述组合中用于向患有scd的患者给予的各化合物的适当量是通过考虑选自由以下组成的群组的至少一个因素确定:年龄、体重、一般健康状况、给予的化合物、给予途径、scd治疗的性质和进展和其它药物的存在。
260.e220.一种根据e152至e161中任一项所述的医药组合物,其被配制成适用作用于治疗由e-选择素介导的疾病、病症或病状(例如scd)的药剂。
261.e221.一种特异性结合e-选择素的被分离的单克隆抗体,其中所述抗体是抗体0039、0164、0158、0159、0170、0180、0841、1282 1284、1444或1448。
附图说明
262.图1描绘与被截断的人类e-选择素共结晶的抗e-选择素抗体0164的fab的例示性晶体结构。e-选择素示为灰色表面(右侧的分子)。0164fab(左侧的分子)示为vl呈浅灰色且vh呈深灰色的带状物。
263.图2描绘来自对于最佳化抗e-选择素抗体0841在时间0(t0)和在40℃下储存于tris缓冲液(trist4)、组氨酸缓冲液(hist4)或谷氨酸(glu4)缓冲液中4周后的三部分质谱分析的例示性数据。
264.图3描绘在强制降解后对于抗体841(也称为0841)的例示性竞争elisa分析。在时间0(0wk)和在40℃下在tris、his或glu缓冲液中培育2周(2wk)或4周(4wk)后分析抗体841。
265.图4描绘人类化抗体0841的vh和vl区的预测非生殖系t细胞抗原决定基。通过epivax/ispri或iedb预测的涵盖未发现于人类生殖系中的t细胞抗原决定基的氨基酸残基是加下划线的。
266.图5描绘对于唾液酸路易斯a配体粘着于表达人类e-选择素的中国仓鼠卵巢(cho)细胞的例示性中和。所测试抗体包括抗e-选择素抗体164(也称为0164)、1282、1284、1444和1448以及igg同型对照物。
267.图6描绘对于唾液酸路易斯x配体粘着于表达食蟹猕猴e-选择素的cho细胞的例示性中和。所测试抗体包括抗e-选择素抗体164(也称为0164)、1282、1284、1444、1448和igg同型对照物。
268.图7描绘通过抗体1282、1284、1444、1448和164(也称为0164),对于hl-60细胞粘着于表达人类e-选择素的cho细胞的例示性中和。
269.图8描绘来自对于最佳化抗e-选择素抗体1444在时间0(顶部图)和在40℃下储存于tris、his或glu缓冲液中4周后的三部分质谱分析的例示性数据。
270.图9a-9d描绘在强制降解后对于抗体1282(图9a)、1284(图9b)、1444(图9c)和1448(图9d)的例示性竞争elisa分析。在时间1(t0)和在40℃下在tris、his或glu缓冲液中培育2周(t2)或4周t(4)后分析抗体。
271.图10a-10d描绘对于最佳化抗e-选择素抗体样本中的高浓度样本的asec分析。在时间0(0)和在4℃或25℃下储存于tris/suc、his/suc或glu/tre缓冲液中1、2、4、6和7周后分析浓度是150mg/ml的抗体。对高分子质量物种的百分比(%hmms)进行定量。图10a描绘抗体1282的结果;图10b描绘抗体1284的结果;图10c描绘抗体1444的结果;图10d描绘抗体1448的结果。
272.图11描绘最佳化抗e-选择素抗体的例示性粘度曲线。最佳化抗体1282、1284、1444和1448的粘度是使用基于dls珠粒的方法来测量。针对使用anton paar锥体和平板法的各者,提供额外单一数据点。
273.图12描绘对于最佳化抗体1444结合于人类e-选择素(rhe-选择素)、同源物p-选择素和l-选择素,以及兔、大鼠、小鼠(mue-选择素)和食蟹猕猴(rcye-选择素)的物种同源物的例示性spr分析。
274.图13描绘抗e-选择素抗体(0841、1282、1284、1444和1448)与固定化人类l-选择素和人类p-选择素的例示性结合。抗l-选择素对照抗体和抗p-选择素对照抗体分别结合人类l-选择素和人类p-选择素。
275.图14描绘在生理流动下对于scd患者细胞(供体11253和供体22358)与重组e-选择素的粘着的例示性中和。
具体实施方式
276.本发明提供抗体和其抗原结合片段,其特异性结合于e-选择素且降低或抑制e-选择素活性,包括但不限于e-选择素与包含碳水化合物结构(其中糖蛋白或糖脂上具有唾液酸路易斯(slex)决定子)的配体相互作用(例如结合)的能力。本发明还提供用于制造、制备或产生抗e-选择素抗体的方法。本发明的抗体适用于诊断、预防和/或治疗由e-选择素活性(例如结合)介导或与其相关的病症或病状,包括但不限于scd、血管闭塞性危象、疼痛、器官梗塞、缺血、中风和血管阻塞。本发明还涵盖抗体的表达和包含本发明的抗体或其抗原结合片段的组合物(诸如使用抗体的药剂)的制备和制造。
277.提供编码结合e-选择素的抗体或其抗原结合片段的多核苷酸。还提供编码抗体重链或轻链或二者的多核苷酸。提供表达抗e-选择素抗体的宿主细胞。提供使用针对e-选择素的抗体的治疗方法。所述方法包括但不限于治疗和/或预防与e-选择素表达和/或e-选择素结合于slex配体相关或由其介导的疾病的方法,包括但不限于scd、血管闭塞性危象、疼痛、器官梗塞、缺血、中风、终末器官功能障碍、急性胸部和血管阻塞。
278.不希望受任何具体理论的束缚,粘着分子的选择素家族(例如e-选择素)和其配体在调节细胞-细胞粘着的初始接触、内皮上的白细胞滚动、整合素活化和细胞的转移方面起关键作用,所有都是scd中促发炎反应的一部分,其在临床上表现为严重疼痛或血管闭塞性危象(包括例如血管阻塞、器官梗塞和缺血)的发作。因此,本发明的抗体和其抗原结合片段能够选择性拮抗e-选择素活性和血管系统中的结合,从而减少个体中的血管闭塞。在本文实例中所公开的一些实施例中,当e-选择素处于溶液中或表达于细胞(例如中国仓鼠卵巢(cho)细胞、来自患有scd的患者的嗜中性粒细胞和/或血细胞)上和其配体处于溶液中或表达于细胞(例如hl-60细胞、人类脐静脉内皮细胞(huvec)、食蟹猕猴肺微血管内皮细胞(clmec))上时,针对e-选择素的抗体和其抗原结合片段已显示抑制、中和或减少e-选择素与其配体的结合。
279.抗e-选择素抗体或其抗原结合片段(包括人类化抗体)可以单独或与第二疗法组合用于预防、治疗和/或改善scd的至少一种病征和/或症状,包括血管闭塞性危象、疼痛、器官梗塞、缺血、中风和血管阻塞。
280.本文所用的章节标题仅出于组织目的且不应解释为限制所描述的主题。
281.本文所引用的所有参考文献(包括专利申请案、专利公开案、uniprotkb寄存编号)均以引用的方式并入本文中,如同具体地且单独地指出各个别参考文献以全文引用的方式并入本文中一般。
282.本文中所描述或参考的技术和程序通常可以由所属领域的技术人员使用常规方法良好理解和共同使用,诸如描述于以下文献中的广泛使用的方法:萨姆布鲁克(sambrook)等人,分子克隆:实验室指南(molecular cloning:a laboratory manual),第3版(2001)冷泉港实验室出版社(cold spring harbor laboratory press),纽约冷泉港(cold spring harbor,n.y.),分子生物学现代方法(current protocols in molecular biology)(奥苏贝尔(f.m.ausubel)等人编,(2003));酶学方法(methods in enzymology)
系列(美国学术出版社(academic press,inc.)):pcr 2:实践方法(pcr 2:a practical approach)(麦克弗森(m.j.macpherson),哈梅斯(b.d.hames)和泰勒(g.r.taylor)编.(1995)),哈洛(harlow)和莱恩(lane)编.(1988)抗体、实验室手册和动物细胞培养(antibodies,a laboratory manual,and animal cell culture)(弗雷谢尼(r.i.freshney)编.(1987));寡核苷酸合成(oligonucleotide synthesis)(盖特(m.j.gait)编,1984);分子生物学方法(methods in molecular biology),胡马纳出版社(humana press);分子生物学:实验室笔记(cell biology:a laboratory notebook)(赛里斯(j.e.cellis)编,1998),美国学术出版社(academic press);动物细胞培养(animal cell culture)(弗雷谢尼)编,1987);细胞和组织培养概论(introduction to cell and tissue culture)(马瑟(j.p.mather)和罗伯茨(p.e.roberts),1998)普尼勒姆出版社(plenum press);细胞和组织培养实验室程序(cell and tissue culture laboratory procedures)(道尔(a.doyle),格里菲斯(j.b.griffiths)和内维尔(d.g.newell)编,1993-8)约翰威利及其子公司(j.wiley and sons);实验免疫学手册(handbook of experimental immunology)(伟尔(d.m.weir)和布莱克威尔(c.c.blackwell)编);用于哺乳动物细胞的基因转移载体(gene transfer vectors for mammalian cells)(米勒(j.m.miller)和卡洛斯(m.p.calos)编,1987);pcr:聚合酶链反应(pcr:the polymerase chain reaction),(穆利斯(mullis)等人编,1994);当前免疫学方案(current protocols in immunology)(科林根(j.e.coligan)等人编,1991);精编分子生物学方案(short protocols in molecular biology)(威利及其子公司(wiley and sons),1999);免疫生物学(immunobiology)(珍妮薇(c.a.janeway)和特弗斯(p.travers),1997);抗体(antibodies)(芬奇(p.finch),1997);抗体:实践方法(antibodies:apractical approach)(卡蒂(d.catty.)编,irl出版社(irl press),1988-1989);单克隆抗体:实践方法(monoclonal antibodies:a practical approach)(谢泼德(p.shepherd)和迪恩(c.dean)编,牛津大学出版社(oxford university press),2000);使用抗体:实验室手册(using antibodies:a laboratory manual)(哈洛(e.harlow)和莱恩(d.lane)(冷泉港实验室出版社,1999));抗体学(the antibodies)(萨内蒂(m.zanetti)和卡帕拉(j.d.capra)编,哈伍德学术出版社(harwood academic publishers),1995);以及其更新版。
283.参考以下本发明的例示性实施例的详细描述和其中所包括的实例可更易于理解本发明。
284.当本发明的方面或实施例根据马库西群组(markush group)或其它替代群组进行描述时,本发明不仅涵盖整体列出的全部群组,而且涵盖独立群组的各成员和主群组的所有可能子组,以及缺乏一或多个群组成员的主群组。本发明还设想明确排除所要求的发明中的任何群组成员中的一或多个。
285.定义
286.除非另外定义,否则本文所用的所有技术和科学术语具有与于本发明所属领域的一般技术人员通常所理解相同的含义。在有矛盾的情况下,将以本发明(包括定义)为准。
287.此外,除非情景另有需要或另外明确地指出,否则单数术语应包括复数且复数术语应包括单数。
288.尽管阐述本发明的广泛范畴的数值范围和参数是近似值,但具体实例中所示的数
值应尽可能精确地报告。然而,任何数值均固有地含有因其对应测试测量值中发现的标准差所必然引起的某些错误。此外,本文所公开的所有范围应理解为涵盖其中所包含的任何和所有子范围。举例来说,“1至10”的陈述范围应视为包括最小值1与最大值10之间(包括端值)的任何和所有子范围;即,以最小值1或更大开始(例如1至6.1)且以最大值10或更小结束(例如5.5至10)的所有子范围。
289.除非另外指示,否则如本文所使用,单数形式“一(a/an)”和“所述(the)”包括多个参考物。
290.如本文所用,术语“和/或”指代和涵盖相关所列项目中的一或多个的任何和所有可能组合,以及当以替代性“或”解释时不具有组合。
291.如本文所用,术语“约”或“大约”指代可测量的值,诸如生物活性的量、多核苷酸或多肽序列的长度、g和c核苷酸的含量、密码子适应指数、cpg二核苷酸的数目、剂量、时间、温度等,且除非另有说明,否则自上下文可见,意指涵盖在指定量的任一方向(大于或小于)上25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%或甚至0.1%的变化,或除此以外其中所述数目将超过可能值的100%。
292.如本文所用,术语“改善”意谓个体的疾病、病症或病状(例如scd)或其症状(例如血管闭塞性危象)或潜在细胞反应中的可检测或可测量的改善。可检测或可测量的改善包括由疾病、病症或病状的症状改善或恢复所引起或与其相关的并发症的发生、频率、严重程度、进展或持续时间的主观或客观降低、减少、抑制、遏制、限制或控制。
293.如本文所用的“另一”可意谓至少第二个(种)或更多个(种)。除非本文中另外定义,否则结合本发明使用的科学与技术术语应具有由所属领域的一般技术人员通常理解的含义。另外,除非上下文另外需要,否则单数术语应包括复数且复数术语应包括单数。
294.如本文所用,如果一者的存在、含量和/或形式与另一者的存在、含量和/或形式相关,那么术语“与相关”指代与另一者相关。举例来说,如果具体实体(例如,多肽、基因标签、代谢物、微生物等)的存在、含量和/或形式与(例如,在整个相关群体中)疾病、病症或病状的发生和/或对疾病、病症或病状的易感性相关,那么将所述具体实体视为与所述具体疾病、病症或病状相关。在一些实施例中,如果两个或更多个实体直接或间接相互作用,使得其彼此具有和/或保持物理接近性,那么其彼此物理上“相关”。在一些实施例中,彼此物理上相关的两个或更多个实体彼此共价连接;在一些实施例中,彼此物理上相关的两个或更多个实体彼此不共价连接,但以非共价形式相关,例如借助于氢键、凡得瓦尔力相互作用(van der waals interaction)、疏水相互作用、磁性和其组合。
295.如本文所用,术语“编码序列”指代编码具体蛋白或“编码核酸”的序列,其表示当置于适当的调节序列的控制下(可操作地连接于适当的调节序列)时,所述核酸序列被转录(在dna的情况下)和翻译(在mrna的情况下)成活体外或活体内多肽。编码序列的边界通过5'(胺基)端的起始密码子和3'(羧基)端的翻译终止密码子来确定。编码序列可以包括但不限于来自原核或真核mrna的cdna、来自原核或真核dna的基因组dna序列,以及甚至合成dna序列。
296.在整个本说明书和权利要求书中,词语“包含(comprise)”或诸如“包含(comprises/comprising)”的变化形式和词语“具有/包括”应理解为意味着包括所陈述整
数或整数群但不排除任何其它整数或整数群。除非另外为情形所需,否则单数术语应包括复数且复数术语应包括单数。在术语“例如(e.g./for example)”之后的任何实例并不意谓是穷尽性或限制性的。应理解,在本文中任何地方的实施例皆用语言“包含”描述,或也提供用术语“由组成”和/或“基本上由组成”所描述的类似实施例。
297.如本文所用,术语“保守性取代”指代由生物学上、化学上或结构上类似的残基替代一种氨基酸。生物学上类似意谓取代基并不破坏生物活性。结构上类似意谓氨基酸的侧链具有类似长度(诸如丙氨酸、甘氨酸和丝氨酸)或具有类似尺寸。化学相似性意谓残基具有相同电荷或均为亲水性或疏水性的。具体实例包括一种疏水性残基(诸如异亮氨酸、缬氨酸、亮氨酸或甲硫氨酸)取代另一种,或一种极性残基取代另一种,诸如精氨酸取代赖氨酸、谷氨酸取代天冬氨酸或谷氨酰胺取代天冬酰胺、丝氨酸取代苏氨酸等。保守性取代的具体实例包括一种疏水性残基(诸如异亮氨酸、缬氨酸、亮氨酸或甲硫氨酸)取代另一种,一种极性残基取代另一种,诸如精氨酸取代赖氨酸、谷氨酸取代天冬氨酸或谷氨酰胺取代天冬酰胺等。保守性氨基酸取代通常包括例如以下基团内的取代:甘氨酸、丙氨酸、缬氨酸、异亮氨酸、亮氨酸;天冬氨酸、谷氨酸;天冬酰胺、谷氨酰胺;丝氨酸、苏氨酸;赖氨酸、精氨酸;和苯丙氨酸、酪氨酸。“保守性取代”还包括使用被取代的氨基酸而非未被取代的母体氨基酸。
298.如本文所用,术语“表达控制序列”意谓引导核酸转录的核酸序列。表达控制序列可以是启动子,诸如组成型或可诱导型启动子;或强化子。表达控制序列可操作地连接于待转录的核酸序列。
299.如本文所用,药物、化合物或医药组合物的术语“有效剂量”或“有效量”是足以影响任何一或多种有益或所需结果的量。在更具体方面中,有效量预防、缓解和/或改善疾病(例如scd)的至少一种病征和/或症状。对于预防性用途,有益或所需结果包括消除或降低疾病的风险、减轻疾病的严重程度或延缓疾病发生,所述疾病包括疾病、其并发症和在疾病发展期间所呈现的中间病理性表型的生物化学、组织和/或行为症状。对于治疗性用途,有益或所需结果包括诸如减轻e-选择素介导的疾病、病症或病状的至少一种病征和/或症状、降低治疗所述疾病所需的其它药物的剂量、增强另一药物的效应和/或延缓患者的疾病进展的临床结果。可以一或多次给予形式来给予有效剂量。出于本发明的目的,药物、化合物或医药组合物的有效剂量是足以直接或间接实现预防性或治疗性治疗的量。如在临床情形下所理解,药物、化合物或医药组合物的有效剂量可或不可连同另一药物、化合物或医药组合物一起实现。因此,“有效剂量”可以视为处于给予一或多种治疗剂的情形下,且如果连同一或多种其它药剂可以实现或已实现所需结果,那么单个药剂可视为以有效量给出。
300.如本文所用,术语“功能性”指代生物分子呈展现出特性和/或活性的形式,其通过所述特性和/或活性表征。生物分子可以具有两种功能(即双功能)或多种功能(即多功能)。
301.如本文所用,术语“糖基化型态”意谓碳水化合物单元的型态,所述碳水化合物单元共价附着于蛋白质(例如糖型)以及位点,在所述(等)位点,糖型共价附着于蛋白质,更具体地说,免疫球蛋白的肽主链。
302.如本文所用,术语“同源”或“同源性”指代在指定区域或片段上共有至少部分一致性的两个或更多个参考实体(例如核苷酸或多肽序列)。举例来说,当两种肽中的氨基酸位置由相同氨基酸占据时,所述肽在彼位置是同源的。值得注意地,同源肽将保留与未被修饰或参考肽相关的活性或功能,且被修饰的肽一般将具有与未被修饰序列的氨基酸序列“基
本上同源”的氨基酸序列。当提及多肽、核酸或其片段时,“基本上同源性”或“基本上类似性”意谓当与另一多肽、核酸(或其互补股)或其片段最佳地以适当插入或缺失比对时,序列一致性在所述序列的至少约95%至99%。两个序列之间的同源性(一致性)的程度可以使用计算机程序和数学算法确定。所述计算序列同源性(或一致性)百分比的算法一般考虑比较区或区域内的序列空隙和错配。例示性程序和算法提供于下文中。
303.如本文所用,术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可以互换使用且意谓单独的细胞或细胞培养物,其可以是或已是用于并入多核苷酸插入物的载体的受体。宿主细胞包括“转型体”、“被转型的细胞”和“被转导的细胞”,其包括原代被转型的细胞或被转导的细胞和由其衍生的后代,不考虑传代次数。由于自然、偶然或目的性突变,宿主细胞后代可能未必与原始母细胞完全相同(在形态或基因组dna互补序列方面)。宿主细胞包括被本发明的多核苷酸(例如编码抗e-选择素抗体的氨基酸序列的多核苷酸)活体内转染和/或转型的细胞。
304.如本文所用,术语“一致性”或“与一致”指代聚合分子之间,例如核酸分子(例如dna分子和/或rna分子)之间和/或多肽分子之间的总体相关性。“一致性”测量空隙比对通过计算机程序的具体数学模型(即“算法”)定址的两个或更多个序列之间的一致匹配百分比。
305.在一些实施例中,如果聚合分子序列至少25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%一致,那么将其视为彼此“基本上一致”。
306.举例来说,两个核酸或多肽序列的一致性百分比的计算可以通过出于最佳比较目的而比对两个序列来执行(例如可以将空隙引入第一序列和第二序列中的一个或两个以用于最佳比对,且可以出于比较目的而忽略非一致序列)。在某些实施例中,出于比较目的比对的序列长度是参考序列长度的至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%或100%。接着比较对应位置处的核苷酸。当第一序列中的位置由与第二序列中的相应位置处相同的残基(例如核苷酸或氨基酸)占据时,则分子在此位置处一致。在考虑到需要引入以供用于最佳比对两个序列的空隙的数目和各空隙的长度的情况下,所述两个序列之间的一致性百分比与所述序列共有的一致位置的数目有关。比较序列和确定两个序列之间的一致性百分比可以使用数学算法来实现。
307.为了确定一致性百分比,可以使用方法和计算机程序(包括blast,在万维网ncbi.nlm.nih.gov/blast/上可用)比对序列。其它比对程序包括生物信息软件的lasergene套件中的megalign程序(dnastar,威斯康星州麦迪逊公司(inc.,madison,wi))。另一比对算法是fasta,其在遗传学计算群组(genetics computing group;gcg)包装(来自美国威斯康星州麦迪逊公司)中可用。用于比对的其它技术描述于酶学方法,第266卷:用于大分子序列分析的计算机方法(computer methods for macromolecular sequence analysis)(1996),杜利特尔(doolittle)编,美国学术出版社中的方法中。尤其受关注的是允许序列中的空隙的比对程序。史密斯-沃特曼(smith-waterman)是一种类型的允许序列比对中的空隙的算法。参见分子生物学方法(meth.mol.biol.)70:173-187(1997)。此外,使用尼德尔曼(needleman)和温什(wunsch)比对方法的gap程序可以用于比对序列。参见分子生物学杂志(j.mol.biol.)48:443-453(1970)。
308.此外,所关注的是bestfit程序使用史密斯和沃特曼的局部同源算法(1981,应用数学进展(advances in applied mathematics)2:482-489)以确定序列一致性。空隙生成罚分一般将在1至5、通常2至4的范围内,且在一些实施例中将是3。空隙扩展罚分一般将在约0.01至0.20的范围内,且在一些情况下将是0.10。程序具有由被输入以相比较的序列确定的预设参数。优选地,使用由程序确定的预设参数来确定序列一致性。也从遗传学计算群组(gcg)套装软件(来自美国威斯康星州麦迪逊公司)商购此程序。
309.另一所关注程序是fastdb算法。fastdb描述于当前序列比较和分析方法、大分子测序和分析、所选择的方法和应用(current methods in sequence comparison and analysis,macromolecule sequencing and synthesis,selected methods and applications),第127-149页,1988,阿兰出版公司(alan r.liss,inc.)中。基于以下参数通过fastdb计算序列一致性百分比:不匹配罚分:1.00;空隙罚分:1.00;空隙大小罚分:0.33;和连接罚分:30.0。
310.如本文所用,术语“增加”、“提高”、“降低”或“减少”指示相对于基线测量值的值,诸如在开始本文所描述的治疗之前相同个体的测量值,或在不存在本文所描述的治疗情况下对照个体(或多个对照个体)的测量值。在一些实施例中,“对照个体”是罹患与所治疗的个体相同形式的疾病或损伤的个体。在一些实施例中,“对照个体”是未罹患与所治疗的个体相同形式的疾病或损伤的个体。
311.如本文所用,术语“被分离的分子”(其中分子是例如多肽、多核苷酸或抗体或其抗原结合片段)意谓以下分子:其借助于其来源或衍生源(1)不与在其天然状态下与其伴随的天然相关组分结合;(2)基本上不含来自同一物种的其它分子;(3)由来自不同物种的细胞表达,或(4)不在自然界中出现。因此,被化学合成或在与天然来源的细胞不同的细胞系统中表达的分子将与其天然相关组份“分离”。使用所属领域中众所周知的纯化技术,通过分离也可以使分子基本上不含天然相关的组分。可以通过所属领域中众所周知的多种方式分析分子纯度或均匀性。举例来说,多肽样品的纯度可以使用聚丙烯酰胺凝胶电泳和凝胶染色以使用所属领域中众所周知的技术使多肽显现来分析。出于某些目的,可以通过使用hplc或所属领域中用于纯化的其它众所周知方式提供更高分辨率。
312.如本文所用,术语“前导肽”或“前导序列”或“前导信号序列”或“信号序列”(在本文中可以互换使用)意谓任何核酸序列或由此被编码的氨基酸序列,其可以存在于核酸分子的5'端上和/或多肽的n端处或附近,其在存在时可以介导多肽输送至目的细胞器,包括但不限于自细胞分泌多肽。所述前导序列包括但不限于:核酸序列,其包含例如atggaatggagctgggtctttctcttcttcctgtcagtaactacaggtgtccactcc(seq id no:140)和atgggatggagctgtatcatcctcttcttggtggcaacagctacaggcgtgcactcc(seq id no:141);和由此被编码的氨基酸序列,诸如但不限于mgwsciilflvatatgvhs(seq id no:129)和mewswvflfflsvttgvhs(seq id no:130);或其它前导序列,诸如mgwsciilflvatatgahs(seq id no:131)。本发明涵盖所属领域中已知或待鉴别的这些和任何其它前导信号(核酸和氨基酸序列),其会使得多肽输送至所需细胞器(例如内质网)和/或自细胞分泌。一般来说,信号肽从成熟多肽去除和/或不存在于成熟多肽中。
313.如本文所用,术语“残基”意谓在蛋白质和其相关氨基酸一致性中的位置。举例来说,天冬酰胺297(也称为asn297、也称为n297)是人类抗体igg1中的残基。
314.术语“类似性”是相关概念,但相比于“一致性”,其指代包括一致匹配与保守取代匹配的类似性量度。由于保守取代适用于多肽而非核酸分子,故类似性仅适用于多肽序列比较。如果两个多肽序列具有例如10/20个一致氨基酸,且剩余物是所有非保守取代,那么一致性百分比和类似性两者将均是50%。如果在同一实例中,有5个更多存在保守取代的位置,那么一致性百分比仍是50%,但类似性百分比将是75%(15/20)。因此,在存在保守取代的情况下,两个多肽序列之间的类似性程度将高于这两个多肽序列之间的一致性百分比。
315.如本文所用,术语“个体”意谓哺乳动物,更优选是人类。哺乳动物还包括但不限于农耕动物(例如母牛、猪、马、鸡等)、宠物、灵长类动物、马、狗、猫、小鼠和大鼠。在一些实施例中,个体是患者。在一些实施例中,个体处于由e-选择素结合于其配体介导或与其相关的疾病、病症或病状的风险下。在一些实施例中,个体是患有如本文所描述的疾病、病症或病状(例如scd)的患者。在一些实施例中,个体(例如患者)患有scd、scd变异体或sc疾病。在一些实施例中,个体(例如患者)患有hbss、hbsc、hbs/β
°
thal、hbs/β
+
thal、hbs/hphp、hbse或hbs-变异体基因型。
316.如本文所用,术语“基本上纯的”意谓个体物种是存在的主要物种(即以摩尔计,其比组合物中的任何其它单独物种更充足),且优选地基本上纯化的馏份是其中个体物种(例如糖蛋白,包括抗体或受体)包含所存在的所有大分子物种是至少约50%(以摩尔计)的组合物。一般来说,基本上纯的组合物将包含超过约80%、更优选超过约85%、90%、95%和99%的组合物中所存在的所有大分子物种。最佳地,将个体物种纯化至基本均质性(无法通过常规检测方法在组合物中检测到污染物种),其中组合物基本上由单一大分子物种组成。在某些实施例中,基本上纯的材料是至少50%纯(即,不含污染物)、更优选至少90%纯、更优选至少95%纯、又更优选至少98%纯、且最优选至少99%纯。
317.根据本发明的多肽或抗体“片段”或“部分”可以通过从多肽的n端和/或c端末端截短,例如通过去除一或多个氨基酸来制造。可以此方式从n和/或c端去除一个、2、3、4、5个、最多10个、最多20个、最多30个、最多40个或更多个氨基酸。片段也可以由一或多个内部缺失生成。
318.如本文所用,术语“核酸序列”和“核苷酸序列”可以互换地指由单体核苷酸构成或包含单体核苷酸的任何分子。核酸可以是寡核苷酸或多核苷酸。核苷酸序列可以是dna或rna(例如基因组dna、cdna、反义dna、mrna、trna、rrna等)。核苷酸序列可以被化学修饰或人工修饰。核苷酸序列包括肽核酸(pna)、吗啉(mopholino)和锁核酸(lna)以及二醇核酸(gna)和苏糖核酸(tna)。这些序列中的各者与天然存在的dna或rna的区别在于分子主链的变化。此外,可以使用硫代磷酸酯核苷酸。其它去氧核苷酸类似物包括可以用于本发明的核苷酸序列中的甲基膦酸酯、氨基磷酸酯、二硫代磷酸酯、n3'-p5'-氨基磷酸酯、以及寡核糖核苷酸硫代磷酸酯和其2'-0-烯丙基类似物和2'-0-甲基核糖核苷酸甲基膦酸酯。
319.如本文所用,术语“核酸建构体”指代由使用重组dna技术(例如重组核酸)产生的非天然存在的核酸分子。核酸建构体是呈单股或双股的核酸分子,其已被修饰以含有核酸序列的区段,所述区段以自然界中未发现的方式组合和排列。核酸建构体可以是“载体”(例如质粒),即,被设计成将外源产生的dna传递至宿主细胞中的核酸分子。
320.如本文所用,术语“可操作地连接”指代功能关系中多核苷酸(或多肽)元件的连接。当将核酸置于与另一核酸序列具有的功能关系中时,所述核酸可操作地连接。举例来
说,如果启动子或其它转录调节序列(例如强化子)影响编码序列的转录,那么所述启动子或其它转录调节序列可操作地连接于所述编码序列。在一些实施例中,可操作地连接意谓连接的核酸序列是连续的。在一些实施例中,可操作地连接并不意谓核酸序列是连续连接的,而介入序列即在这些连接的核酸序列之间。
321.如本文所用,术语“多核苷酸”(在本文中也称为“核酸分子”)指代由磷酸二酯键连接的核苷酸序列。在本文中在从5'至3'方向的方向上呈现多核苷酸。本发明的多核苷酸可以是去氧核糖核酸(dna)分子或核糖核酸(rna)分子且指代核酸的所有形式,诸如双股分子、单股分子、小或短发夹rna(shrna)、微小rna、小或短干扰rna(sirna)、反式剪接rna、反义rna。在多核苷酸是dna分子的情况下,所述分子可以是基因、cdna、反义分子或前述分子中的任一个的片段。在本文中通过单字母码指示核苷酸碱基:腺嘌呤(a)、鸟嘌呤(g)、胸(腺)嘧啶(t)、胞嘧啶(c)、肌核苷(i)和尿嘧啶(u)。可以使用所属领域的技术人员所众所周知的标准技术来制备本发明的多核苷酸。
322.如本文所用,由多核苷酸(核酸序列或核苷酸序列)编码的术语“多肽”、“蛋白质”和“肽”指代如同天然存在蛋白质的全长天然序列以及功能性子序列、被修饰形式或序列变异体,只要子序列、被修饰形式或变异体保留天然全长蛋白质的一定程度的功能即可。在本发明的方法和用途中,由多核苷酸序列编码的所述多肽、蛋白质和肽可能但不必需与内源蛋白一致,所述内源蛋白是缺陷性的或其表达不足或在被基因疗法治疗的个体中缺乏。
323.如本文所用,术语“预防(prevent/prevention)”指代延缓具体疾病、病症或病状(例如scd)的发作,和/或降低其的至少一种病征和/或症状(例如血管闭塞性危象、疼痛)的频率和/或严重程度。在一些实施例中,在群体基础上评估预防以使得如果在易患疾病、病症或病状的群体中观察到疾病、病症或病状的一或多个症状的发展、频率和/或强度的统计学上显著的降低,那么药剂被视为“预防”具体疾病、病症或病状。当疾病、病症或病状的发作已延缓预定时间段时,预防可视为完成。
324.如本文所用,术语“重组”指代载体、多核苷酸、多肽或细胞是克隆、限制或连接步骤(例如与包含于其中的多核苷酸或多肽相关)和/或导致建构体不同于在自然界中发现的产物的其它程序的各种组合的产物。
325.如本文所用,术语“治疗(treat/treatment)”意谓给予部分或完全缓解、改善、减轻、抑制具体疾病、病症和/或病状(例如scd),延缓其发作,降低其严重程度和/或降低其一或多个症状的发病率、特性和病因的疗法。出于本发明的目的,有益或所需临床结果包括但不限于以下中的一或多个:存活率提高(死亡率降低)、组织纤维化的量降低、疾病损坏程度降低、疾病持续时间减少和/或与疾病相关的症状的数目、程度或持续时间降低。术语包括给予本发明的化合物或药剂以预防或延缓疾病的症状、并发症或生化指标发作,从而缓解症状或阻滞或抑制疾病、病状或病症的进一步发展。治疗可以是预防性(以预防或延缓疾病发作或预防其临床或亚临床症状的显现)或治疗性抑止或缓解在疾病显现后的症状。在一些实施例中,疾病、病状或病症是scd。
326.抗体
[0327]“抗体”或“ab”是能够经由位于免疫球蛋白分子的可变区中的至少一个抗原识别位点识别和结合于特异性目标或抗原(ag)(诸如碳水化合物、多核苷酸、脂质、多肽等)的免疫球蛋白分子。如本文所用,术语“抗体”可以涵盖任何类型的抗体,包括但不限于单克隆抗
体、多克隆抗体、保留特异性结合于既定抗原(例如e-选择素)的能力的完整抗体的抗原结合片段(或部分)、和包含抗原识别位点的免疫球蛋白分子的任何其它被修饰的配置。
[0328]
抗体包括任何类别的抗体,诸如igg、iga或igm(或其子类),且所述抗体不必是任何具体类别。免疫球蛋白可视其重链(hc)的恒定区的抗体氨基酸序列而归为不同类别。存在五种主要类别的免疫球蛋白:iga、igd、ige、igg和igm,且这些免疫球蛋白中的若干种可以进一步划分成子类(同型),例如igg1、igg2、igg3、igg4、iga1和iga2。在一些实施例中,本发明的抗e-选择素抗体是和igg1抗体。对应于不同类别的免疫球蛋白的重链恒定区分别称为α、δ、ε、γ和μ。不同类别的免疫球蛋白的子单元结构和三维配置已众所周知。
[0329]
抗体可衍生自任何包括但不限于人类、猴、猪、马、兔、狗、猫、小鼠、大鼠(例如史泊格多利大鼠(sprague dawley rat))等的哺乳动物或其它动物,诸如鸟类(例如鸡)、鱼类(例如鲨鱼)和骆驼(例如骆马)。
[0330]
术语“抗原”指代用于对具有免疫潜能的脊椎动物免疫接种以产生识别抗原的抗体或筛选表达库(例如噬菌体、酵母或核糖体展示库以及其它库)的分子实体。在本文中,抗原为较概括的称呼且一般意图包括通过抗体特异性识别的目标分子,因此包括所述分子的片段或模拟物,其用于使抗体产生的免疫接种法或筛选选择抗体的库中。因此,对于本发明的结合于e-选择素、来自哺乳动物物种(例如人类、猴(包括食蟹猕猴)、小鼠、兔和大鼠)的全长e-选择素(包括单体和多聚体,诸如其二聚体、三聚体等);e-选择素的被截断和其它变异体(例如细胞外域)以及可溶性e-选择素和细胞表面表达的e-选择素的抗体来说,所述e-选择素在本文中均被称为抗原。
[0331]
抗体的“抗原结合片段”指代全长抗体的一或多个片段,其保留特异性结合于抗原(优选以基本上相同的结合亲和力)的能力。已显示,抗体的抗原结合功能可以由全长抗体的片段执行。术语抗体的“抗原结合片段”内涵盖的结合片段的实例包括(i)fab片段,由vl、vh、cl和ch1域组成的单价片段;(ii)f(ab')2片段,包含两个由铰链区处的二硫桥键连接的fab片段的二价片段;(iii)由vh和ch1域组成的fd片段;(iv)由抗体的单个臂的vl和vh域组成的fv片段,(v)dab片段(沃德(ward)等人,自然(nature)1989;341:544-546),其由vh域组成;和(vi)被分离的互补决定区(cdr)、二硫键连接的fv(dsfv)和抗个体基因型(抗id)抗体和内抗体。此外,尽管fv片段的两个域vl和vh是通过单独的基因编码,但其可以使用重组法通过合成连接子接合,所述合成连接子使得其能够成是单个蛋白链,其中vl和vh区配对以形成单价分子(称为单链fv(scfv));参见例如伯德(bird)等人,科学(science)1988;242:423-426和休斯顿(huston)等人,美国国家科学院院刊1988usa 85:5879-5883。还涵盖单链抗体的其它形式,诸如双功能抗体。所述单链抗体还意图涵盖于术语抗体的“抗原结合片段”内。双功能抗体是二价、双特异性抗体,其中vh和vl域表达于单个多肽链上,但使用过短而不允许相同链上的两个域之间配对的连接子,由此迫使所述域与其它链的互补域配对且产生两个抗原结合位点(参见例如霍利格(holliger)等人,美国国家科学院院刊,1993;90:6444-6448;波利亚克(poljak)等人,结构学(structure)1994;2:1121-1123)。
[0332]
抗体“可变域”指代单独或组合形式的抗体轻链(vl)的可变区或抗体重链(vh)的可变区。如所属领域中已知,重链和轻链的可变区各自由通过三个“互补决定区”(cdr)连接的四个构架区(fr)组成,且促成抗体的抗原结合位点的形成。如果需要个体可变区的变异体,尤其在取代cdr区外部(即构架区中)的氨基酸残基的情况下,那么合适的氨基酸取代,
优选保守性氨基酸取代可以通过比较个体可变区与其它抗体的可变区来鉴别,所述其它抗体的可变区含有处于与个体可变区相同的典型类别中的cdr1和cdr2序列(柯西亚(chothia)和莱斯克(lesk),分子生物学杂志,1987;196(4):901-917)。
[0333]
可变域中的残基通常是根据kabat编号,kabat提供用于抗体的编译的重链可变域或轻链可变域的编号系统。参见卡拜特(kabat)等人,1991,免疫学上感兴趣的蛋白质的序列(sequences of proteins of immunological interest),第5版,公共卫生署(public health service),国立卫生研究院(national institutes of health),马里兰州贝塞斯达(bethesda,md)。使用此编号系统,实际线性氨基酸序列可以含有对应于可变域的fr或cdr的缩短或向其中的插入的较少或额外氨基酸。举例来说,重链可变域可以包括在h2的残基52之后的单一氨基酸插入物(根据kabat的残基52a)和在重链fr残基82之后的插入残基(例如根据kabat的残基82a、82b和82c)。可以通过在抗体序列的同源区与“标准”kabat编号序列比对来确定所指定抗体的残基的kabat编号。用于指派kabat编号的各种算法是可用的。举例来说,在abysis的发行版本2.3.3(www.abysis.org)中实施的算法可以用于将kabat编号指派至可变区lcdr-1、lcdr-2、lcdr-3、hcdr-2和hcdr-3,且abm定义接着可以用于hcdr-1。
[0334]
在某些实施例中,对于cdr的确定性描绘和对于包含抗体结合位点的残基的鉴别通过求解抗体的结构和/或求解抗体-配体复合物的结构来实现。在某些实施例中,其可以通过所属领域的技术人员已知的多种技术中的任一种来实现,诸如x射线结晶法。在某些实施例中,可采用各种分析方法以鉴别或估计cdr区。所述方法的实例包括但不限于kabat定义、chothia定义、abm定义、接触定义和构形定义。
[0335]“互补决定区”(cdr)可以根据kabat、chothia的定义,kabat和chothia两者的累计,abm、接触、north和/或构形定义或所属领域中众所周知的任何cdr确定方法来鉴别。参见例如卡拜特等人,1991,免疫学上感兴趣的蛋白质的序列,第5版(高变区);柯西亚等人,自然(nature)1989;342:877-883(结构环结构)。具体抗体中构成cdr的氨基酸残基的一致性可以使用所属领域中众所周知的方法确定。cdr的abm定义为kabat与chothia之间的折衷方案且使用oxford molecular abm抗体建模软件(accelrys)。
[0336]
cdr的“接触”定义为基于麦卡勒姆(maccallum)等人,分子生物学杂志,1996;262:732-745中所示的所观察抗原接触。cdr的“构形”定义为基于对抗原结合作出焓贡献的残基(参见例如真壁(makabe)等人,生物化学杂志(j.biol.chem.),2008;283:1156-1166)。诺斯(north)已使用cdr定义的不同优选集合鉴别典型cdr构形(诺斯等人,分子生物学杂志,2011;406:228-256)。在本文中被称为cdr的“构形定义”的另一方法中,cdr的位置可被鉴别为对抗原结合作出焓贡献的残基(真壁等人,生物化学杂志,2008,283:1156-1166)。其它cdr边界定义仍可不严格遵循以上方法中的一种,但仍然将与kabat cdr的至少一部分重叠,但其可以根据以下预测或实验结果而缩短或延长:具体残基或残基组或甚至全部cdr不显著影响抗原结合。如本文所用,cdr可以指由所属领域中已知的任何方法,包括方法的组合所定义的cdr。本文中所用的方法可以利用根据这些方法中任一种所定义的cdr。对于含有超过一个cdr的任何既定实施例,cdr(或抗体的其它残基)可以根据kabat、chothia、north、扩展、abm、接触和/或构形定义中的任一种定义。
[0337]
如本文中关于抗体或由此特异性结合的抗原所使用,“接触残基”指代存在于包含
至少一个重原子(即非氢)的抗体/抗原上的氨基酸残基,其中所述重原子在同源抗体/抗原上所存在的氨基酸残基中的或更小范围的重原子内。
[0338]“构架”(fr)残基是除了cdr残基以外的抗体可变域残基。vh或vl域构架包含四个构架子区fr1、fr2、fr3和fr4,穿插有呈以下结构的cdr:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。
[0339]
如所属领域中已知,抗体的“恒定区”指代单独或组合形式的抗体轻链的恒定区或抗体重链的恒定区。
[0340]
如本文中可以互换地使用的术语“igg fc区”、“fc区”、“fc域”和“fc”指代免疫球蛋白(igg)分子的一部分,其与通过igg分子的番木瓜蛋白酶(papain)消化获得的可结芯片段相关。如本文所用,所述术语涉及排除第一恒定区免疫球蛋白域的抗体恒定区且进一步涉及所述区域的部分。因此,fc指代iga、igd和igg的最后两个恒定区免疫球蛋白域,和ige和igm的最后三个恒定区免疫球蛋白域以及这些域的柔性铰链n端,或其部分。对于iga和igm,fc可以包括j链。
[0341]
对于igg,fc包含免疫球蛋白域cγ2和cγ3(c伽玛2和c伽玛3)和cγ1(c伽玛1)与cγ2(c伽玛2)之间的铰链。虽然可以改变fc区的边界,但人类igg重链fc区通常被界定成包含相对于其羧基端的残基c226或p230,其中编号是根据埃德尔曼(edelman)等人,美国国家科学院院刊,1969;63(1):78-85的eu指数和如描述于kabat等人,1991中。通常,fc域包含人类igg1恒定域的约氨基酸残基236至约447。例示性人类野生型igg1 fc域氨基酸序列阐述于seq id no:16和seq id no:15(包括任选的末端赖氨酸(k)残基)中。fc多肽可以指此独立区域,或此在抗体的情况下的区域,或其抗原结合片段,或fc融合蛋白。
[0342]
重链恒定域包含fc区且进一步包含ch1结构域和铰链以及igg重链的ch2和ch3(和任选的iga和ige的ch4)域。
[0343]“功能性fc区”拥有天然序列fc区的至少一种效应功能。例示性“效应功能”包括c1q结合;补体依赖性细胞毒性(cdc);fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);噬菌作用;细胞表面受体(例如b细胞受体)的下调、b细胞活化等。所述效应功能一般需要fc区与结合域(例如,抗体可变域或其抗原结合片段)组合,且可以使用所属领域中已知用于评估所述抗体效应功能的各种分析来评估。
[0344]
如本文所用,“fc受体”或“fcr”描述结合于抗体的fc区的受体。在一些实施例中,fcγr是天然人类fcr。在一些实施例中,fcr是结合igg抗体的fcr(γ受体)且包括fcγri、fcγrii和fcγriii子类的受体,包括这些受体的等位基因变异体和交替剪接形式。fcγrii受体包括fcγriia(“活化受体”)和fcγriib(“抑制受体”),两者具有主要在其细胞质域方面不同的类似氨基酸序列。活化受体fcγriia在其细胞质域中含有基于免疫受体酪氨酸的活化模体(itam)。抑制受体fcγriib在其细胞质域中含有基于免疫受体酪氨酸的抑制模体(itim)(参见例如戴伦(daeron),免疫学年鉴(annu.rev.immunol.)1997;15:203-234)。fcr综述于例如拉文奇(ravetch)和基内特(kinet),免疫学年鉴,1991;9:457-92;卡佩尔(capel)等人,免疫方法(immunomethods),1994;4:25-34;和德哈斯(de haas)等人,临床医学实验室杂志(j.lab.clin.med.),1995;126:330-41中。其它fcr包括待在将来鉴别的fcr,由本文术语“fcr”涵盖。
[0345]
术语“fc受体”或“fcr”还包括新生儿受体fcrn,其负责将母体igg转移至胎儿(古
耶尔(guyer)等人,免疫学杂志(j.immunol.),1976;117:587和金(kim)等人,免疫学杂志,1994;24:249)且调节免疫球蛋白的稳态。与fcrn的结合的测量方法是已知的(参见例如哥帝(ghetie)和沃德,当今免疫学(immunol.today),1997;18(12):592-598;哥帝等人,自然生物技术(nature biotechnology),1997;15(7):637-640;辛顿(hinton)等人,生物化学杂志,2004;279(8):6213-6216;wo 2004/92219)。
[0346]“人类效应细胞”是表达一或多个fcr且执行效应功能的白细胞。在某些实施例中,所述细胞至少表达fcγriii且执行adcc效应功能。介导adcc的人类白细胞的实例包括外周血液单核细胞(pbmc)、自然杀手(nk)细胞、单核球、巨噬细胞、细胞毒性t细胞和嗜中性粒细胞。效应细胞可自天然来源,例如自血液分离。
[0347]
如本文所用,“抗体依赖性细胞介导的细胞毒性”或“adcc”指代细胞毒性形式,其中结合至某些细胞毒性细胞(例如,nk细胞、嗜中性粒细胞和巨噬细胞)上存在的fc受体(fcr)上的分泌ig使得这些细胞毒性效应细胞能够特异性结合于携带抗原的目标细胞且随后用细胞毒素杀死目标细胞。用于介导adcc的初级细胞nk细胞仅表达fcγriii,而单核细胞表达fcγri、fcγrii和fcγriii。为了评估所关注分子的adcc活性,可以进行活体外adcc分析,诸如描述于美国专利第5,500,362号、第5,821,337号或第6,737,056号中的那些。适用于所述分析的效应细胞包括pbmc和nk细胞。或者或另外,可以活体内评估所关注分子的adcc活性,例如在动物模型中,诸如克莱因斯(clynes)等人,美国国家科学院院刊(usa)1998;95:652-656中所公开的动物模型。具有变化的fc区氨基酸序列和提高或减少的adcc活性的额外抗体描述于例如美国专利第7,923,538号和美国专利第7,994,290号。
[0348]
具有“增强的adcc活性”的抗体指代在活体外或活体内介导adcc方面相比于亲本抗体更有效的抗体,其中抗体和亲本抗体不同之处在于至少一种结构方面,且当用于分析的所述抗体和亲本抗体的量基本上相同时。在一些实施例中,抗体和亲本抗体具有相同氨基酸序列,但抗体被去岩藻糖基化而亲本抗体被岩藻糖基化。在一些实施例中,adcc活性将使用如本文所公开的活体外adcc分析测定,但涵盖用于测定adcc活性的其它分析或方法,例如在动物模型中等。在一些实施例中,具有增强的adcc活性的抗体具有对fcγriiia增强的亲和力。
[0349]
具有“变化的”fcr结合亲和力或adcc活性的抗体是相比于亲本抗体具有增强的或减弱的fcr结合活性和/或adcc活性的抗体,其中抗体和亲本抗体不同之处在于至少一种结构方面。“展示”与fcr“提高的结合”的抗体以比亲本抗体更高的亲和力结合至少一种fcr。“展示”与fcr“减少的结合”的抗体以比亲本抗体更低的亲和力结合至少一种fcr。相比于天然序列igg fc区,展示与fcr减少的结合的所述抗体与fcr的结合可极少或无明显结合,例如0-20%结合至fcr。
[0350]“对fcγriiia的增强的亲和力”指代相较于亲本抗体对fcγriiia具有更大的亲和力的抗体,其中抗体和亲本抗体不同之处在于至少一种结构方面。
[0351]“补体依赖性细胞毒性”或“cdc”指代目标细胞在补体存在下裂解。经典补体路径的活化通过补体系统(clq)的第一组分结合于(适当子类的)抗体起始,所述抗体结合于其同源抗原。为了评估补体活化,可以进行cdc分析,例如加扎诺(gazzano)-桑托罗(santoro)等人,免疫方法杂志(j.immunol.methods)1996;202:163中所描述。例如在美国专利第6,194,551号、美国专利第7,923,538号、美国专利第7,994,290号和wo1999/51642中描述具有
变化的fc区氨基酸序列和提高或降低的clq结合能力的抗体。
[0352]
重链恒定域包含fc区且进一步包含ch1域和铰链以及igg重链的ch2和ch3(和任选的iga和ige的ch4)域。
[0353]
在抗e-选择素抗体在重链多肽上包含c端赖氨酸(k)氨基酸残基(例如,人类igg1重链包含末端赖氨酸)的一些实施例中,所属领域的技术人员将理解,可以剪切赖氨酸残基,从而产生重链缺乏c端赖氨酸残基的抗体。另外,所述抗体重链可以使用不编码赖氨酸的核酸产生。因此,在一些实施例中,抗e-选择素抗体包含重链,其中不存在另外存在的末端赖氨酸。
[0354]
在某些实施例中,本文所描述的抗体或其抗原结合片段包含fc域。fc域可以衍生自iga(例如iga1或iga2)、igd、ige、igm或igg(例如igg1、igg2、igg3或igg4)。在一些实施例中,抗e-选择素抗体是和igg抗体。在一些实施例中,抗e-选择素抗体(例如抗体1444)是igg1抗体。
[0355]“fc融合”蛋白是其中一或多个多肽可操作地连接于fc多肽的蛋白质。fc融合将免疫球蛋白的fc区与融合搭配物组合。
[0356]“天然序列fc区”包含与自然界中发现的fc区的氨基酸序列一致的氨基酸序列。“变异fc区”包含借助于至少一个氨基酸修饰而与天然序列fc区的氨基酸序列不同但又保留天然序列fc区的至少一种效应功能的氨基酸序列。优选地,相比于天然序列fc区或相比于亲本多肽的fc区,变异fc区具有至少一个氨基酸取代,例如约一个至约十个氨基酸取代;且优选地,在天然序列fc区中或亲本多肽的fc区中具有约一个至约五个氨基酸取代。在本文中,变异fc区与原生序列fc区和/或亲本多肽的fc区优选具有至少约80%序列一致性,且与其最优选具有至少约90%序列一致性,与其更优选具有至少约95%、至少约96%、至少约97%、至少约98%、至少约99%序列一致性。
[0357]“抗原决定基”指代抗体特异性结合的抗原区域或区,例如包含与抗体相互作用的残基的区域或区,如通过所属领域中众所周知的任何方法所确定,例如通过常规免疫分析或如本发明的实例9和10中所描述。所属领域中已知许多对蛋白质上的抗原决定基位置进行定位和表征的方法,包括求解抗体-抗原复合物的晶体结构、竞争分析、基因片段表达分析和基于合成肽的分析,如例如哈洛和莱恩,使用抗体,实验室手册(using antibodies,a laboratory manual),冷泉港实验室出版社,纽约冷泉港(cold spring harbor,new york),1999的第11章中所描述。在额外实例中,抗原决定基定位可以用于确定抗e-选择素抗体所结合的序列。抗原决定基定位可购自各种来源,例如肽扫描系统(pepscan systems)(埃德尔赫维格(edelhertweg)15,荷兰弗莱福兰省莱利斯塔德(ph lelystad,the netherlands)8219)。或者,在探索过程期间,抗体的生成和表征可阐明关于所需抗原决定基的信息。根据此信息,接着可竞争性地筛选结合于同一抗原决定基的抗体。实现此目标的方法是执行竞争和交叉竞争研究以寻找彼此竞争或交叉竞争结合于e-选择素的抗体,例如竞争结合于抗原的抗体。
[0358]
另外,抗e-选择素抗体所结合的抗原决定基可以通过使用衍生自e-选择素(例如,人类e-选择素序列)的重叠肽和确定抗体结合来在系统筛选中确定。根据基因片段表达分析,可以将编码e-选择素的开放阅读框架随机或通过特异性基因构造分成片段且测定e-选择素的表达片段与待测试的抗体的反应性。基因片段可以例如通过pcr产生,且接着在放射
性氨基酸存在下活体外转录且翻译成蛋白质。接着通过免疫沉淀和凝胶电泳测定抗体与放射性标记的e-选择素片段的结合。
[0359]
某些抗原决定基还可以通过使用呈现于噬菌体颗粒(噬菌体库)或酵母(酵母展示)的表面上的随机肽序列的大型库来鉴别。或者,可以在简单结合分析中测试重叠肽片段的所定义库与测试抗体的结合。在额外实例中,可以进行抗原的突变诱发、域交换实验和丙氨酸扫描突变诱发以鉴别抗原决定基结合所需、足够和/或必需的残基。
[0360]
在其最详细的程度上,用于抗原与抗体之间相互作用的抗原决定基可以通过定义存在于抗原-抗体相互作用中的原子触点的空间座标以及关于其对结合热力学的相对贡献的信息来定义。在较不详细的程度上,抗原决定基可以通过定义抗原与抗体之间原子触点的空间座标来表征。在更不详细的程度上,抗原决定基可以通过其所包含的氨基酸残基表征,如由具体准则所定义,例如通过抗体与抗原中的原子(例如重原子,即非氢原子)之间的距离表征。在更不详细的程度上,抗原决定基可以由功能,例如由与其它抗体的竞争结合来表征。抗原决定基还可以更一般地如所包含的氨基酸残基来定义,对于所述氨基酸残基来说,被另一氨基酸取代将改变抗体与抗原之间相互作用的特征(例如使用丙氨酸扫描)。
[0361]
根据视所使用的抗原决定基定位法而定,在不同细节程度下获得抗原决定基的描述和定义的事实,由此得出可类似地在不同细节程度下执行对同一抗原上的不同抗体的抗原决定基的比较。
[0362]
如果以例如由x射线晶体分析法、核磁共振(nmr)光谱法、氢/氘交换质谱分析法(h/d-ms)测定的氨基酸水平进行描述的抗原决定基含有相同氨基酸残基组,那么称所述抗原决定基是一致的。如果抗原决定基共用至少一个氨基酸,那么称所述抗原决定基是重叠的。如果抗原决定基不共用氨基酸残基,那么称所述抗原决定基是独立(独特)的。
[0363]
可以用于表征抗e-选择素抗体的另一方法是使用与已知结合于相同抗原的其它抗体的竞争分析(例如,如本发明的实例9中所描述),以确定抗e-选择素抗体是否结合于与其它抗体相同的抗原决定基。竞争分析已是所属领域的技术人员众所周知的。如果相对应的抗体的结合是互斥的,即一个抗体的结合排除另一抗体的同时或连续结合,那么称通过竞争结合表征的抗原决定基是重叠的。如果抗原能够同时容纳两个相对应抗体的结合,那么称所述抗原决定基是独立(独特)的。
[0364]
抗原决定基可以是线性的或构形的。在线性抗原决定基中,蛋白质与交互分子(诸如抗体)之间的所有相互作用点沿着蛋白质的一级氨基酸序列以线性方式存在。“非线性抗原决定基”或“构形抗原决定基”包含在对抗原决定基具有特异性的抗体所结合的抗原蛋白质内的非连续多肽(或氨基酸)。
[0365]
抗体的结合亲和力可以表示为kd值,其指代具体抗原-抗体相互作用的解离速率。kd是解离速率(也称为“解离速率(k
解离
)”或“k
d”)与缔合速率(也称为“缔合速率(k
缔合
)或“k
a”)的比率。因此,kd等于k
解离
/k
缔合
(或kd/ka)且表示为摩尔浓度(m),且kd越小,结合的亲和力越强。抗体的kd值可以使用所属领域中沿用已久的方法测定。一种用于测量kd的例示性方法是通常使用生物传感器系统(诸如biacore系统)的表面等离子共振(spr)。biacore动力学分析包含分析抗原与在表面上具有固定分子(例如包含抗原决定基结合域的分子)的芯片的结合和解离。另一种用于测定抗体的kd的方法是通过使用生物层干涉测量术(bio-layer interferometry),通常使用octet技术(octet qke系统,弗迪尔公司(fortebio))。
或者或另外,还可以使用kinexa(动力排除分析)分析,其购自萨匹迪仪器公司(sapidyne instruments)(爱达荷州博伊西城(boise,id))。
[0366]“优先结合”或“特异性结合”(在本文中可以互换地使用)于抗原决定基的抗体是所属领域中已充分理解的术语,且用以确定所述特异性或优先结合的方法也是所属领域中所众所周知的。如果分子(例如蛋白质、核酸、抗体等)与具体细胞或物质的反应或缔合比其与替代性细胞或物质的反应或缔合更频繁、更快速、持续时间更长和/或亲和力更大,那么称所述分子展现“特异性结合”或“优先结合”。如果抗体与目标的结合比与其它物质的结合具有更大亲和力、亲合力、更容易和/或具有更长持续时间,那么所述抗体“特异性结合”或“优先结合”于目标。举例来说,特异性或优先结合于e-选择素抗原决定基的抗体是比与其它e-选择素抗原决定基或非e-选择素抗原决定基(包括p-选择素和/或l-选择素抗原决定基)的结合以更大亲和力、亲合力、更容易和/或以更长持续时间结合具体抗原决定基的抗体。因此,在指定分析条件下,具体结合部分(例如抗体或其抗原结合片段或受体或其配体结合片段)优先结合于具体目标分子且不会大量结合于测试样品中存在的其它组分。一般来说,但未必,提及结合意谓优先结合。
[0367]
各种分析形式可以用于选择特异性结合所关注分子的抗体或肽。举例来说,固相elisa免疫分析(包括竞争结合elia)、alphalisa免疫分析(珀金埃尔默(perkin-elmer))、免疫沉淀、biacore
tm
(通用电气医疗集团(ge healthcare),新泽西州皮斯卡特维(piscataway,nj))、荧光活化细胞分选(facs)、octet
tm
(弗迪生物公司(fort
é
bio,inc.),加利福尼亚州门洛帕克(menlo park,ca))和蛋白质印迹法等许多分析法可以用于鉴别与抗原特异性反应的抗体或与同源配体或结合搭配物特异性结合的受体或其配体结合片段。通常,特异性或选择性反应将处于至少两倍的背景信号或噪音下,且更通常是处于超过10倍的背景、超过50倍的背景、超过1000倍的背景或更多倍下。当平衡解离常数(kd)≤1μm、≤100nm、≤10nm、≤1nm或≤100pm时,那么称抗体“特异性结合”抗原。在一些实施例中,抗e-选择素抗体以《70nm(例如68.4+/-3.18nm)的kd结合e-选择素(例如人类e-选择素)。在一些实施例中,抗e-选择素抗体以《68nm(例如64.9+/-1.13nm)的kd结合e-选择素(例如食蟹猕猴e-选择素)。
[0368]
在一些实施例中,抗e-选择素抗体以选自由以下组成的群组的kd结合人类e-选择素:约92.85nm、约70.3nm、约65.2nm、约61.8nm、约60.5nm、约68.0nm、约21.6nm、约324nm、约54.4nm、约628.5nm和2940nm。在一些实施例中,抗e-选择素抗体以选自由以下组成的群组的kd结合食蟹猕猴e-选择素:约138.5nm、约78.3nm、约76.5nm、约81.5nm、约67.8nm、约45.8nm、约243.5nm、约45.4nm、约492nm和3145nm。
[0369]
如本文所使用的关于抗体的术语“竞争”意谓第一抗体或其抗原结合片段与抗原的结合减少同一抗原通过第二抗体或其抗原结合片段之后续结合。替代方案可能但不必如此:在第一抗体存在下第二抗体与抗原的结合也可检测地减少。即,第一抗体可以抑制第二抗体与抗原的结合,而第二抗体并不抑制第一抗体与其对应抗原决定基的结合。然而,当各抗体无论在相同、较大或较小的程度上可检测地抑制另一抗体与其同源抗原决定基或配体的结合时,那么称所述抗体是彼此“交叉竞争”结合其对应抗原决定基。本发明涵盖竞争抗体和交叉竞争抗体两者。无论所述竞争或交叉竞争发生的机制(例如位阻、构形变化或结合于共同抗原决定基或其片段)如何,所属领域的技术人员基于本文中所提供的教示内容将
了解,所述竞争和/或交叉竞争抗体涵盖于且可以适用于本文中所公开的方法中。
[0370]
标准竞争分析可以用于确定两个抗体是否与彼此竞争。一种用于抗体竞争的适合分析涉及使用biacore技术,其可以使用表面等离子共振(spr)技术,通常使用生物传感器系统(诸如biacore系统)测量相互作用的程度。举例来说,spr可以用于活体外竞争性结合抑制分析,以确定一个抗体抑制第二抗体的结合的能力。用于测量抗体竞争的另一分析使用基于elisa的方法。
[0371]
此外,基于抗体的竞争将所述抗体“分组(binning)”的高通量方法描述于国际专利申请案第wo2003/48731号中。如果一种抗体(或片段)减少另一抗体(或片段)与e-选择素的结合,那么存在竞争。举例来说,可以使用依序结合竞争分析,其中不同抗体被依序添加。可以添加第一抗体以实现接近饱和的结合。接着,添加第二抗体。如果未检测到第二抗体与e-选择素的结合,或与在不存在第一抗体的情况下的平行分析(所述值可以设定为100%)相比,所述结合显著减少(例如至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%或至少约90%的减少),那么将两种抗体视为彼此竞争。
[0372]
术语“互补位”的定义通过将视角逆转而衍生自以上“抗原决定基”的定义。因此,术语“互补位”指代抗体上特异性结合抗原的区域或区,即抗体上与抗原(e-选择素或其片段)进行接触的氨基酸残基作为“触点”在本文别处定义。给定抗体/抗原对的互补位可以通过常规方法来鉴别。举例来说,可以将抗体和目标分子组合且可使抗体/抗原复合物结晶。可以测定复合物的晶体结构且将其用于鉴别抗体与其目标之间相互作用的具体位点。
[0373]
在一些实施例中,抗体是“变异抗体”。变异抗体可以包含来自本文所公开的具体序列和片段,且尤其表2中的1、2、3、4、5、最多10、最多20、最多30或更多个氨基酸取代和/或缺失和/或插入。“缺失”变异体可以包含缺失个别氨基酸;缺失较小氨基酸组,诸如1、2、3、4或5个氨基酸;或缺失较大氨基酸区,诸如缺失具体氨基酸域或缺失其它特征。“插入”变异体可以包含插入个别氨基酸;插入较小氨基酸组,诸如1、2、3、4或5个氨基酸;或插入较大氨基酸区,诸如插入具体氨基酸域或插入其它特征。“取代”变异体优选涉及用相同数目的氨基酸置换一或多个氨基酸和进行保守性氨基酸取代。举例来说,氨基酸可以被具有类似特性的替代氨基酸取代,例如另一碱性氨基酸、另一酸性氨基酸、另一中性氨基酸、另一带电荷氨基酸、另一亲水性氨基酸、另一疏水性氨基酸、另一极性氨基酸、另一芳族氨基酸或另一脂族氨基酸。
[0374]
取代变异体将抗体分子中的至少一个氨基酸残基去除且将不同残基插入其位置。最引人关注的取代型突变诱发的位点包括高变区,但也涵盖构架变化。保守性取代显示于表1中。如果所述取代致使生物活性变化,那么可以引入以下所示的命名为“例示性取代”或如下文关于氨基酸种类所进一步描述的更实质性的变化,且筛选产物。
[0375]
表1
[0376]
氨基酸和取代
[0377]
原始残基保守性取代例示性取代丙氨酸ala(a)valval;leu;ile精氨酸arg(r)lyslys;gln;asn天冬酰胺asn(n)glngln;his;asp,lys;arg
天冬氨酸asp(d)gluglu;asn半胱氨酸cys(c)serser;ala谷氨酰胺gln(q)asnasn;glu谷氨酸glu(e)aspasp;gln甘氨酸gly(g)alaala组氨酸his(h)argasn;gln;lys;arg异亮氨酸ile(i)leuleu;val;met;ala;phe;正亮氨酸亮氨酸leu(l)ile正亮氨酸;ile;val;met;ala;phe赖氨酸lys(k)argarg;gln;asn甲硫氨酸met(m)leuleu;phe;ile苯丙氨酸phe(f)tyrleu;val;ile;ala;tyr脯氨酸pro(p)alaala丝氨酸ser(s)thrthr苏氨酸thr(t)serser色氨酸trp(w)tyrtyr;phe酪氨酸tyr(y)phetrp;phe;thr;ser缬氨酸val(v)leuile;leu;met;phe;ala;正亮氨酸
[0378]
抗体生物特性的实质修饰是通过选择在维持以下的作用方面显著不同的取代来实现:(a)取代区域中多肽主链的结构,例如呈β片状或螺旋状构形;(b)目标位点处分子的电荷或疏水性;或(c)侧链的主体。基于共同侧链特性将天然存在的残基划分成以下群组:
[0379]
i.非极性:正亮氨酸、met、ala、val、leu、ile;
[0380]
ii.极性不带电荷:cys、ser、thr、asn、gln;
[0381]
iii.酸性(带负电):asp、glu;
[0382]
iv.碱性(带正电):lys、arg;
[0383]
v.影响链定向的残基:gly、pro;和
[0384]
vi.芳族:trp、tyr、phe、his。
[0385]
非保守性取代通过将这些种类的一种中的一员换成另一种类来进行。
[0386]
举例来说,可以进行的一种类型的取代是将抗体中可化学反应的一或多个半胱氨酸改变成诸如但不限于丙氨酸或丝氨酸的另一残基。举例来说,可以存在非典型半胱氨酸的取代。取代可以在抗体的可变域的cdr或构架区或恒定区中进行。在一些实施例中,半胱氨酸是典型的。不参与维持抗体的适当构形的任何半胱氨酸残基一般也可以被丝氨酸取代,以提高分子的氧化稳定性且防止异常交联。反之,尤其当抗体是诸如fv片段的抗体片段时,可以将半胱氨酸键添加至抗体以提高其稳定性。
[0387]
在称为“生殖系化”的过程中,vh和vl序列中的某些氨基酸可突变以匹配在生殖系vh和vl序列中天然存在的氨基酸。具体来说,vh和vl序列中的构架区的氨基酸序列可以突变以匹配生殖系序列,从而降低给予抗体时免疫原性的风险。如本文所用,术语“生殖系”指代抗体基因和基因片段在其经由生殖细胞自父代传递至后代时的核苷酸序列和氨基酸序列。此生殖系序列与编码抗体的核苷酸序列的区别在于成熟b细胞,其在b细胞成熟过程期间已经由于重组和超突变事件而改变。“利用”具体生殖系的抗体具有大部分与所述生殖系
核苷酸序列或与其所指定的氨基酸序列紧密比对的核苷酸或氨基酸序列。与生殖系序列相比,所述抗体频繁突变。人类vh和vl基因的生殖系dna序列是所属领域中已知的(参见例如“vbase”人类生殖系序列数据库;亦参见卡拜特(kabat,e.a.)等人,1991,免疫学上感兴趣的蛋白质的序列,第五版,美国卫生与公众服务部(u.s.department of health and human services),nih公开案第91-3242号;汤姆林森(tomlinson)等人,分子生物学杂志1992;227:776-798;和考克斯(cox)等人,欧洲免疫学杂志(eur.j.immunol.),1994;24:827-836)。
[0388]
对于e-选择素的抗体
[0389]
本发明提供结合于e-选择素的抗体和其抗原结合片段。e-选择素也称为cd62抗原样家族成员e(cd62e)、内皮-白细胞粘着分子1(elam-1)或白细胞-内皮细胞粘着分子2(lecam2)。
[0390]
如本文所用,术语“e-选择素”包括人类e-选择素的变异体、同功异型物、同源物、直系同源物和旁系同源物。在一些实施例中,本文中所公开的抗体或其抗原结合片段与来自除人类以外的物种的e-选择素(诸如食蟹猕猴的e-选择素)以及不同形式的e-选择素交叉反应。在一些实施例中,抗体或其抗原结合片段可对人类e-选择素具有完全特异性且可不展现物种交叉反应性(例如不结合小鼠e-选择素)或其它类型的交叉反应性(例如不结合p-选择素和/或l-选择素)。如本文所用,除非上下文另外规定,否则术语e-选择素指代天然存在的人类e-选择素。因此,“e-选择素抗体或其抗原结合片段”、“抗e-选择素抗体或其抗原结合片段”或其它类似名称意谓特异性和/或优先与e-选择素,其同功异型物、片段或衍生物缔合、结合或反应的任何抗体或其抗原结合片段(如本文所定义)。如由uniprotkb/swiss-prot寄存编号p16581(氨基酸22-610)所表示的人类e-选择素的全长成熟形式在本文中以seq id no:132提供。如由uniprotkb/swiss-prot寄存编号q00690(氨基酸22-612)所表示的小鼠e-选择素的全长成熟形式在本文中以seq id no:134提供。如由uniprotkb/swiss-prot寄存编号g8f370(氨基酸22-610)所表示的食蟹猕猴e-选择素的全长成熟形式在本文中以seq id no:201提供。
[0391]
e-选择素表达于内皮细胞上,l-选择素组成型表达于白细胞微绒毛上,且p-选择素储存于血小板的α-颗粒和内皮细胞的怀布尔-帕拉德体(weibel-palade body)中(泰德(tedder)等人,美国实验生物学联合会会志(faseb j.)1995;9:866-873;卡纳什(kanas)等人,血液学,1996;88:3259-3287)。所述选择素全部结合于糖蛋白或糖脂上具有唾液酸路易斯(slex)决定子的碳水化合物结构(蔡斯(chase)等人,生物医学工程纪事(ann.biomed.eng.),2012;40(4):849-885)。p-选择素和l-选择素还需要对配体进行硫酸化以用于最佳结合,而结合于配体的e-选择素更能容许仅需要唾液酸路易斯决定子。p-选择素糖蛋白配体-1(psgl-1)表达于白细胞上且结合于所有选择素。e-选择素还与包括l-选择素配体、cd44和e-选择素配体-1(esl-1)的配体相互作用(蔡斯等人,生物医学工程纪事,2012;40(4):849-885;希达尔戈(hidalgo)等人,免疫性(immunity),2007;26(4):477-489)。
[0392]
e-选择素通过内皮细胞的表达需要响应于低氧或发炎刺激的新蛋白质合成。e-选择素对于嗜中性粒细胞粘着于内皮和在内皮上生成活化信号波是关键的,所述信号产生被活化αmβ2整合素的极化表达(希达尔戈等人,自然医学(nat.med.),2009;15:384-391;普恩
map激酶和syk激酶;以及其它现在所属领域中已知或随后鉴别的方面。e-选择素的生物功能或生物活性可以(但未必)由e-选择素与其配体之间的相互作用介导。
[0398]
本发明包括可调节e-选择素的生物活性的抗体或其抗原结合片段。即,本发明包括被分离的抗体或其抗原结合片段,其特异性结合e-选择素且调节至少一种可检测e-选择素活性,使得所述抗体:(a)减少白细胞系链至内皮细胞;(b)减少稳定粘着于内皮细胞的活化;(c)减少白细胞缓慢滚动直至阻滞;(d)减少白细胞的有效跨内皮迁移;(e)降低cd18整合素的亲和力和亲合力;(f)减少运输白细胞至急性发炎部位;(g)减少胞溶质钙;(h)减少使p38 map激酶和syk激酶活化的酪氨酸磷酸化;(i)减少自血液募集血小板和白细胞至血管内皮;和/或(j)并不产生促发炎环境。
[0399]
e-选择素的生物活性可以在活体外静态中和结合分析中,使用e-选择素(例如可溶性e-选择素或表达e-选择素的cho细胞)和配体(例如可溶性唾液酸路易斯配体或细胞表面表达的配体(例如在hl-60细胞上))来评估。e-选择素的结合也可以在所属领域中已知和本发明的实例部分所示的生理流动分析中,使用可溶性或细胞表面表达的蛋白质来评估。中和抗体预防e-选择素结合的能力也可以通过在不存在或存在增加浓度的抗e-选择素抗体或其抗原结合片段的情况下,将表达e-选择素(例如人类、食蟹猕猴)的细胞与可溶性(唾液酸路易斯抗原)或细胞表面表达(例如在hl-60细胞、huvec、clmec上)的e-选择素配体一起培育来评估。
[0400]
在一些实施例中,本发明的抗e-选择素抗体涵盖一种抗体,其与具有如seq id no:11所示的重链可变区的氨基酸序列和如seq id no:5所示的轻链可变区的氨基酸序列的抗体或其抗原结合片段,竞争结合于人类e-选择素和/或结合同一抗原决定基。
[0401]
在一些实施例中,本发明的抗e-选择素抗体或其抗原结合片段涵盖抑制或减少e-选择素与至少一种e-选择素配体(例如,具有唾液酸路易斯(slex)决定子的糖蛋白或糖脂(例如α2,3唾液酸化和α1,3或α1,4岩藻糖基化四糖类唾液酸路易斯x)、唾液酸路易斯a决定子、esl-1、l-选择素、cd44、psgl-1、lamp1、lamp2、dr3和αmβ2整合素(cd11b/cd18;mac-1))的结合的抗体或其抗原结合片段。
[0402]
在一些实施例中,本发明涵盖一种抗体或其抗原结合片段,其与具有如seq id no:11所示的重链可变区的氨基酸序列和如seq id no:5所示的轻链可变区的氨基酸序列的抗体或其抗原结合片段,竞争抑制e-选择素与配体的结合。
[0403]
在一些实施例中,本发明的抗体或其抗原结合片段包括igg1重链恒定区,例如如seq id no:7或seq id no:13(无c端赖氨酸)所示的抗e-选择素重链。在一些实施例中,抗体或其抗原结合片段包括κ轻链恒定区,例如如seq id no:1所示的抗e-选择素轻链。
[0404]
本发明的抗e-选择素抗体可以涵盖单克隆抗体、多克隆抗体、抗体片段(例如fab、fab'、f(ab')2、fv、fc等)、嵌合抗体、双特异性抗体、异结合抗体、单链(scfv)、其突变体、包含抗体片段的融合蛋白(例如域抗体)、人类化抗体和包含具有所需特异性的抗原识别位点的免疫球蛋白分子的任一其它被修饰的配置,所述被修饰的配置包括抗体的糖基化变异体、抗体的氨基酸序列变异体和被共价修饰的抗体。抗体可以是鼠类、大鼠、人类或任何其它来源(包括嵌合或人类化抗体)。在一些实施例中,抗e-选择素抗体是单克隆抗体。在一些实施例中,抗e-选择素抗体是人类或人类化抗体。在一些实施例中,抗e-选择素抗体是嵌合抗体。
[0405]
表2提供如本文所描述的嵌合和人类化抗e-选择素抗体的氨基酸和核苷酸序列。一般来说,除非具体指示,否则本发明的抗e-选择素抗体可以包括一或多个cdr的任何组合。在一些实施例中,本发明的抗e-选择素抗体可以包括如表2中所示的一或多个vh和/或vl序列与由表3中的seq id no:定义的具体抗体的任何组合。使用kabat定义在被延长h1的情况下定义抗e-选择素vh和vl的cdr。对于hcdr-1,最末残基包括h36位置之前的任何插入物(即,h35a、h35b、h35c等)。cdr定义如下:hcdr-1(h26至h35c)、hcdr-2(h50至h65)、hcdr-3(h95至h102)、lcdr-1(l24至l34)、lcdr-2(l50至l56)和lcdr-3(l89至l87)。
[0406]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含hc、lc、vl域和/或vh域,其包含与表2的氨基酸序列至少80%、85%、90%、91%、925、93%、94%、95%、96%、97%、98%或99%一致的氨基酸序列。在一些实施例中,抗e-选择素抗体或其抗原结合片段包含hc、lc、vl域和/或vh域,其由与表2的核酸序列至少80%、85%、90%、91%、925、93%、94%、95%、96%、97%、98%或99%一致的核酸序列编码。
[0407]
表2.e-选择素肽、抗e-选择素抗体和其片段的序列。
[0408]
[0409]
[0410]
[0411]
[0412]
[0413]
[0414]
[0415]
[0416]
[0417]
[0418]
[0419]
[0420]
[0421]
[0422]
[0423]
[0424]
[0425]
[0426]
[0427]
[0428]
[0429]
[0430]
[0431]
[0432]
[0433]
[0434]
[0435]
[0436][0437]
表3.抗e-选择素抗体。
[0438]
[0439][0440]
在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含vh域,所述vh域包含与seq id no:11的氨基酸序列至少90%一致的氨基酸序列。在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含vh域,所述vh域包含seq id no:11的氨基酸或由其组成。
[0441]
在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含vh域,所述vh域可以包含与seq id no:11、25、30、35、39、42、45、55、60、66、75、80、90、95、104、114、118和128中的任一个的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%一致的氨基酸序列。在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含vh域,所述vh域可以包含以下或由以下组成:seq id no:11、25、30、35、39、42、45、55、60、66、75、80、90、95、104、114、118和128中的任一个的氨基酸序列。
[0442]
在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含vl域,所述vl域包含与seq id no:5的氨基酸序列至少90%一致的氨基酸序列。在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含vl域,所述vl域包含与seq id no:5的氨基酸序列至少90%一致的氨基酸序列或由其组成。
[0443]
在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含vl域,所述vl域可以包含与seq id no:5、21、27、32、50、57、71、73、85、87、100、102、109、116和122中的任一个的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%一致的氨基酸序列。在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含vl域,所述vl域可以包含以下或由以下组成:seq id no:5、21、27、32、50、57、71、73、85、87、100、102、109、116和122中的任一个的氨基酸序列。
[0444]
在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:5的氨基酸序列的vl域,和包含seq id no:11的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:5的氨基酸序列的vl域,和包含seq id no:39、42或45中的任一个的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:21的氨基酸序列的vl域,和包含seq id no:25的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:27的氨基酸序列的vl域,和包含seq id no:30的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:32的氨基酸序列的vl域,和包含seq id no:35的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:50的氨基酸序列的vl域,和包含seq id no:55的
氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:57的氨基酸序列的vl域,和包含seq id no:60的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:71的氨基酸序列的vl域,和包含seq id no:66的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:73的氨基酸序列的vl域,和包含seq id no:75的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:85的氨基酸序列的vl域,和包含seq id no:80的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:87的氨基酸序列的vl域,和包含seq id no:90的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:100的氨基酸序列的vl域,和包含seq id no:95的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:102的氨基酸序列的vl域,和包含seq id no:104的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:109的氨基酸序列的vl域,和包含seq id no:114的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:116的氨基酸序列的vl域,和包含seq id no:118的氨基酸序列的vh域。抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:122的氨基酸序列的vl域,和包含seq id no:128的氨基酸序列的vh域。
[0445]
抗e-选择素抗体或其抗原结合片段可以包含:包含seq id no:5、21、27、32、50、57、71、73、85、87、100、102、109、116和122中的任一个的氨基酸序列的vl域,和包含seq id no:11、25、30、35、39、42、45、55、60、66、75、80、90、95、104、114、118和128中的任一个的氨基酸序列的vh域。
[0446]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含lcdr-1、lcdr-2和lcdr-3,如seq id no:5、21、27、32、50、57、71、73、85、87、100、102、109、116和122中的至少一个的氨基酸序列中所示。
[0447]
在一些实施例中,抗e-选择素抗体或其抗原结合片段进一步包含hcdr-1、hcdr-2和hcdr-3,如seq id no:11、25、30、35、39、42、45、55、60、66、75、80、90、95、104、114、118和128中的至少一个的氨基酸序列中所示。
[0448]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含:如seq id no:5的氨基酸序列中所示的lcdr-1、lcdr-2、lcdr-3,和如seq id no:11的氨基酸序列中所示的hcdr-1、hcdr-2和hcdr-3。
[0449]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含:lcdr-1,其包含seq id no:2的氨基酸;lcdr-2,其包含seq id no:3的氨基酸序列;和lcdr-3,其包含seq id no:4的氨基酸。在一些实施例中,抗e-选择素抗体或其抗原结合片段包含:hcdr-1,其包含seq id no:8的氨基酸;hcdr-2,其包含seq id no:9的氨基酸序列;和hcdr-3,其包含seq id no:10的氨基酸。在一些实施例中,抗e-选择素抗体或其抗原结合片段包含:hcdr-1,其包含seq id no:8的氨基酸序列;hcdr-2,其包含seq id no:38、41或44中的任一个的氨基酸序列;和hcdr-3,其包含seq id no:10的氨基酸序列。
[0450]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含:lcdr-1,其包含seq id no:2、18、47、68、82、97或106中的任一个的氨基酸;lcdr-2,其包含seq id no:3、19、48、69、83、98、107或120中的任一个的氨基酸序列;和lcdr-3,其包含seq id no:4、20、49、70、84、99、108或121的氨基酸。在一些实施例中,抗e-选择素抗体或其抗原结合片段包含:hcdr-1,
其包含seq id no:8、23、52、63、77、92、111或125的氨基酸;hcdr-2,其包含seq id no:9、24、29、38、41、44、53、64、78、93、112或126的氨基酸序列;和hcdr-3,其包含seq id no:10、54、65、79、94、113或127的氨基酸。
[0451]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含lcdr-1、lcdr-2和lcdr-3,如通过寄存于atcc处具有寄存编号pta-126530的质粒的插入物编码的氨基酸序列中所示。
[0452]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含hcdr-1、hcdr-2和hcdr-3,如通过寄存于atcc处具有寄存编号pta-126529的质粒的插入物编码的氨基酸序列中所示。
[0453]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含通过寄存于atcc处具有寄存编号pta-126530的质粒的插入物编码的lcdr-1、lcdr-2和lcdr-3氨基酸序列,和通过寄存于atcc处具有寄存编号pta-126529的质粒的插入物编码的hcdr-1、hcdr-2和hcdr-3氨基酸序列。
[0454]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含轻链可变区,所述轻链可变区包含通过寄存于atcc处具有寄存编号pta-126530的质粒的插入物编码的氨基酸序列。
[0455]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含重链可变区,所述重链可变区包含通过寄存于atcc处具有寄存编号pta-126529的质粒的插入物编码的氨基酸序列。
[0456]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含轻链,所述轻链包含通过寄存于atcc处具有寄存编号pta-126530的质粒的插入物编码的氨基酸序列。
[0457]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含重链,所述重链包含通过寄存于atcc处具有寄存编号pta-126529的质粒的插入物编码的氨基酸序列。
[0458]
在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含lc,所述lc包含与seq id no:1的氨基酸序列至少90%一致的氨基酸序列。在一些实施例中,抗e-选择素抗体或其抗原结合片段包含seq id no:1的氨基酸序列或由其组成。
[0459]
lc可以包含与seq id no:1、17、26、31、46、56、67、72、81、86、96、101、105、115或119中的任一个的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%一致的氨基酸序列。在一些实施例中,抗体lc可以包含含有seq id no:1、17、26、31、46、56、67、72、81、86、96、101、105、115或119中的任一个或由其组成的氨基酸序列。
[0460]
在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含hc,所述hc包含与seq id no:7或13的氨基酸序列至少90%一致的氨基酸序列。在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含hc,所述hc包含与seq id no:7或13的氨基酸序列至少90%一致的氨基酸序列或由其组成。
[0461]
在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含重链,所述重链包含与seq id no:7、13、22、28、34、37、40、43、51、59、62、74、76、89、91、103、110、117或124中的任一个的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%一致的氨基酸序列。在一些实施例中,抗体hc可以包含含有seq id no:7、13、22、28、34、37、40、43、51、59、62、74、76、89、91、103、110、117或124中的任一个或由其组成的氨基酸序列。
[0462]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含:包含seq id no:1的氨基酸序列或由其组成的lc,和包含seq id no:7或seq id no:13的氨基酸序列或由其组成的hc。在一些实施例中,抗e-选择素抗体或其抗原结合片段缺乏效应功能(即,是效应无效的)。
[0463]
在一些实施例中,抗e-选择素抗体或其抗原结合片段可以包含重链,所述重链包含含有seq id no:11、25、30、35、39、42、45、55、60、66、75、80、90、95、104、114、118和128中的任一个的氨基酸序列(例如seq id no:11)的vh域,且所述重链进一步包含igg1恒定域(例如包含seq id no:15或seq id no:16的氨基酸序列的igg1恒定域)。
[0464]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含重链,所述重链包含含有seq id no:11的氨基酸序列的vh域且进一步包含含有seq id no:15或seq id no:16的氨基酸序列的igg1恒定域。在一些实施例中,抗体或其抗原结合片段包含由seq id no:11的氨基酸序列组成的vh域,且进一步包含由seq id no:15或seq id no:16的氨基酸序列组成的igg1恒定域。在一些实施例中,抗e-选择素抗体缺乏效应功能。
[0465]
在一些实施例中,抗e-选择素抗体或其抗原结合片段具有轻链恒定区,其选自例如(例如人类)κ轻链恒定区(例如由seq id no:14的氨基酸序列编码)或λ轻链恒定区。
[0466]
在一些实施例中,抗e-选择素抗体或其抗原结合片段包含轻链,所述轻链包含含有seq id no:5、21、27、32、50、57、71、73、85、87、100、102、109、116和122中的任一个的氨基酸序列(例如seq id no:5)的vl域;且进一步包含κ恒定域,所述恒定区包含seq id no:14的氨基酸序列。在一些实施例中,抗e-选择素抗体或其抗原结合片段包含轻链,所述轻链包含由seq id no:5的氨基酸序列组成的vl域;且进一步包含κ恒定域,所述恒定区由seq id no:14的氨基酸序列组成。
[0467]
在一些实施例中,抗e-选择素抗体或其抗原结合片段的恒定区可以发生改变,例如发生突变以修饰抗体的特性(例如,以增加或降低以下中的一或多个:fc受体结合、抗体糖基化、半胱氨酸残基的数目、效应细胞功能和/或补体功能)。
[0468]
在一些方面中,抗体或抗原结合片段变异体包含1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个保守性或非保守性取代,和/或1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个对于全长重链(例如seq id no:7或13的氨基酸序列的hc)和/或全长轻链的添加和/或缺失。在另一方面中,变异抗体与全长重链共有至少65%、至少75%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列一致性,且其中所述抗体或抗原结合片段特异性结合e-选择素。在另一方面中,变异抗体与全长轻链(例如,seq id no:1的氨基酸序列的lc)共有至少65%、至少75%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列一致性,且其中所述抗体或抗原结合片段特异性结合e-选择素。
[0469]
生殖系取代
[0470]
各种受体人类生殖系序列是可用的且用于使在人类中使用的非人类物种抗体“人类化”的方法在所属领域中是众所周知的且也在本文中别处已讨论。因此,所属领域的技术人员应了解,来自小鼠、大鼠等的以上cdr序列可以在人类可变域氨基酸序列的情形下置放。由此,一般使受体人类生殖系序列发生变化以保存抗体结合和原始亲本(即供体)抗体的其它所需特征。cdr和构架区(fw)两者可如下被工程改造。
[0471]
在某些实施例中,取代是人类生殖系取代,其中(供体)cdr残基被相应人类生殖系(受体)残基置换,以增加人类氨基酸含量且潜在地降低抗体的免疫原性,如例如美国专利申请公开案第2017/0073395号和汤森德(townsend)等人,美国国家科学院院报(proc.nat.acad.sci.usa),2015;112(50):15354-15359中所描述,所述文献两者均以全文引用的方式并入本文中。
[0472]
抗体或其抗原结合片段可以包含vh构架,所述vh构架包含人类生殖系vh构架序列。在一些方面中,可以使用来自以下生殖系的vh构架:ighv1-2*02、ighv1-3*01、ighv1-46*01、ighv1-69*01、ighv1-69*02、ighv1-8*01、ighv3-7*01、ighv3-13*01、ighv3-23*01、ighv3-23*04、ighv3-30*01、ighv3-30*18、ighv5-10-1*01、ighv5-10-1*04或ighv5-51*01(生殖系名称是基于imgt生殖系定义)。在一些实施例中,抗e-选择素抗体或其抗原结合片段使用来自生殖系ighv3-7*01(seq id no:202)的vh构架。在一些实施例中,抗e-选择素抗体或其抗原结合片段使用来自生殖系ighv3-7*01(seq id no:202)的vh构架用于cdr区和来自ighj4*01(seq id no:203)的vh构架用于构架区。
[0473]
优选的人类生殖系轻链构架是衍生自vk或vλ生殖系的构架。在一些方面中,可以使用来自以下生殖系的vl构架:igkv1-12*01、igkv1-13*02、igkv1-33*01、igkv1-39*01、igkv1-5*01、igkv3-11*01、igkv3-15*01、igkv3-20*01、igkv3d-20*02和igkv4-1*01(生殖系名称为基于imgt生殖系定义)。在一些实施例中,抗e-选择素抗体或其抗原结合片段使用来自生殖系ighv1-39*01(seq id no:204)的vl构架。在一些实施例中,抗e-选择素抗体或其抗原结合片段使用来自生殖系ighv1-39*01(seq id no:204)的vl构架用于cdr区和来自igkj1*01(seq id no:205)的vl构架用于构架区。
[0474]
或者或另外,构架序列可以是人类生殖系共同构架序列,诸如以下各者的构架:人类vλ1共同序列、vk1共同序列、vk2共同序列、vk3共同序列、vh3生殖系共同序列、vh1生殖系共同序列、vh5生殖系共同序列或vh4生殖系共同序列。人类生殖系构架的序列可获自各种公众数据库,诸如v-base、imgt、ncbi或abysis。
[0475]
抗e-选择素抗体或其抗原结合片段可以包含vl构架,所述vl构架包含人类生殖系vl构架序列。vl构架可以包含一或多个氨基酸取代、添加或删除,同时仍保留与衍生所述vl构架的生殖系的功能和结构类似性。在一些方面中,vl构架与人类生殖系vl构架序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%一致。在一些实施例中,抗体或其抗原结合片段包含vl构架,所述vl构架相对于人类生殖系vl构架序列包含1、2、3、4、5、6、7、8、9、10个氨基酸取代、添加或缺失。在一些实施例中,1、2、3、4、5、6、7、8、9或10个氨基酸取代、添加或缺失仅在构架区中。在一些实施例中,一致性百分比是基于与不包括在本文中定义为cdr的那些部分的vl域的类似性。
[0476]
人类生殖系vl构架可以是例如igkv1-39*01的构架。人类生殖系vl构架可以是例如igkv1-33*01的构架。人类生殖系vl构架可以是人类共同序列中的任一个的构架,所述人类共同序列包括:vλ、vλ1、vλ3、vk、vk1、vk2或vk3。
[0477]
在一些实施例中,vl构架是igk-39*01_igkj1*01。还预测其它类似构架区以递送本发明的有利抗体,所述抗体包含:以下的cdr:seq id no:2-4、18-20、47-49、68-70、82-84、97-99、106-108、120和121;和由以下vl氨基酸序列说明的cdr:seq id no:5、21、27、32、50、57、71、73、85、87、100、102、109、116、122,所述构架区相对于igkv1-12*01、igkv1-13*
02、igkv1-33*01、igkv1-39*01、igkv1-5*01、igkv3-11*01、igkv3-15*01、igkv3-20*01、igkv3d-20*02和igkv4-1*01中的任一个分别可以包含99%、97%、97%、96%、80%、76%、74%和66%一致性。在一些实施例中,一致性百分比是基于与不包括在本文中定义为cdr的那些部分的vl的类似性。
[0478]
抗e-选择素抗体或其抗原结合片段可以包含vh构架,所述vh构架包含人类生殖系vh构架序列。vh构架可以包含一或多个氨基酸取代、添加或删除,同时仍保留与衍生所述vh构架的生殖系的功能和结构类似性。在一些方面中,vh构架与人类生殖系vh构架序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%一致。在一些实施例中,抗体或其抗原结合片段包含vh构架,所述vh构架相对于人类生殖系vh构架序列包含1、2、3、4、5、6、7、8、9、10个氨基酸取代、添加或缺失。在一些实施例中,1、2、3、4、5、6、7、8、9或10个氨基酸取代、添加或缺失仅在构架区中。在一些实施例中,一致性百分比是基于与不包括在本文中定义为cdr的那些部分的vh域的类似性。
[0479]
人类生殖系vh构架可以是例如ighv3-7*01的构架。人类生殖系vh构架可以是例如ighv1-46*01的构架。人类生殖系vh构架可以是例如ighv1-69*01。人类生殖系vh构架可以是人类vh生殖系共同序列的构架。人类生殖系vh构架可以是人类生殖系共同序列的构架,所述人类生殖系共同序列包括:vh3、vh5、vh1或vh4。
[0480]
在一些实施例中,vh构架是ighv3-7*01。还预测其它类似构架区以递送本发明的有利抗体,所述抗体包含以下的cdr:seq id no:8-10、23、24、29、38、41、44、52-54、63-65、77-79、92-94、111-113、125-127;和由以下vh氨基酸序列中的任一个说明的cdr:seq id no:11、25、30、35、39、42、45、55、60、66、75、80、90、95、104、114、118、128,所述构架区包括ighv1-2*02、ighv1-3*01、ighv1-46*01、ighv1-69*01、ighv1-69*02、ighv1-8*01、ighv3-7*01、ighv3-13*01、ighv3-23*01、ighv3-23*04、ighv3-30*01、ighv3-30*18、ighv5-10-1*01、ighv5-10-1*04或ighv5-51*01,所述构架区可相对于dp-54的fw区分别包含92%、93%、94%、95%、96%、97%、98%、99%一致性和在共同结构特征方面的一个或更少的氨基酸差异(kabat编号)。在一些方面中,一致性百分比是基于与不包括在本文中定义为cdr的那些部分的vh域的类似性。
[0481]
在某些实施例中,本文所描述的抗体或其抗原结合片段包含(i)vh域,所述vh域包含与seq id no:11的氨基酸序列至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%一致的氨基酸序列,和/或(ii)vl域,所述vl域包含与seq id no:5的氨基酸序列至少50%、至少60%、至少66%、至少70%、至少75%、至少76%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%一致的氨基酸序列。本发明还涵盖这些vl和vh序列的任何组合。
[0482]
在某些实施例中,本文所描述的抗体或其抗原结合片段包含:(i)hc,所述hc包含与seq id no:7或seq id no:13的氨基酸序列至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%一致的氨基酸序列;和/或(ii)lc,所述lc包含与seq id no:1的氨基酸序列至少50%、至少60%、至少70%、至少75%、至少80%、至少
85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%一致的氨基酸序列。本发明还涵盖这些hc和lc序列的任何组合。
[0483]
在某些实施例中,本文所描述的抗体或其抗原结合片段包含fc域。fc域可衍生自iga(例如iga1或iga2)、igg、ige或igg(例如igg1、igg2、igg3或igg4)。在一些实施例中,抗e-选择素抗体是和igg1抗体。
[0484]
抗e-选择素抗体的生物活性
[0485]
除了结合e-选择素上的抗原决定基之外,本发明的抗体或其抗原结合片段还可以介导生物活性。即,本发明包括被分离的抗体或其抗原结合片段,其特异性结合e-选择素且介导至少一种选自以下的可检测活性:
[0486]
(i)特异性结合于人类e-选择素
[0487]
(ii)特异性结合于食蟹猕猴e-选择素;
[0488]
(iii)减少、抑制和/或中和可溶性e-选择素(例如人类、食蟹猕猴)与e-选择素配体(例如唾液酸-路易斯a和/或唾液酸-路易斯x配体)之间的相互作用(例如结合);
[0489]
(iv)减少、抑制和/或中和细胞表面表达的e-选择素(例如人类、食蟹猕猴)与e-选择素配体(例如唾液酸-路易斯a和/或唾液酸-路易斯x配体)之间的相互作用(例如结合);(v)减少、抑制和/或中和细胞表面表达的e-选择素(例如人类、食蟹猕猴)与细胞表面表达的e-选择素配体(例如,例如hl-60细胞上的唾液酸-路易斯a和/或唾液酸-路易斯x配体)之间的相互作用(例如粘着);
[0490]
(vi)减少、抑制和/或中和可溶性e-选择素与表达e-选择素配体的细胞(例如hl-60)的相互作用(例如粘着);
[0491]
(vii)在静态和生理流动条件下,减少、抑制和/或中和表达e-选择素配体的细胞(例如hl-60)对表达e-选择素的细胞的粘着;
[0492]
(viii)在生理流动条件下,减少、抑制和/或中和活化人类嗜中性粒细胞对表达e-选择素(例如人类和食蟹猕猴)的细胞的粘着;
[0493]
(ix)结合于至少一个氨基酸残基,其选自:人类e-选择素的t7、e8、a9、m10、t11、p46、s47、y48、n82、n83、q85、e88、e92、y94、r97、n105、e107、r108、s110、k111、k112和k113;
[0494]
(x)在25℃下,在约187mg/ml的浓度下,粘度是约38+/-7cp;
[0495]
(xi)在以3mg/kg的剂量进行皮下给予时,具有约21.5天(518小时)的半衰期;
[0496]
(xii)显示适合的配制物特性,包括高程度的热稳定性和高浓度下的最少聚集;以及
[0497]
(xiii)可以在大规模制造条件下显示可再现的表达和纯度。
[0498]
在一些实施例中,抗e-选择素抗体或其抗原结合片段具有对于可溶性人类e-选择素的结合亲和力,表示为kd,其小于或等于200nm,例如小于或等于195nm、190nm、180nm、160nm、140nm、120nm、110nm、100nm、90nm、80nm、75nm、50nm。在一些实施例中,抗e-选择素抗体或其抗原结合片段具有对于可溶性人类e-选择素的结合亲和力,表示为kd,其如通过spr所测量小于或等于200nm。在一些实施例中,抗e-选择素抗体(例如抗体1444)或其抗原结合片段具有对于可溶性人类e-选择素的结合亲和力,表示为kd,其如例如通过spr所测量为约61.8至约68.4+/-3.18nm。
[0499]
在一些实施例中,抗e-选择素抗体或其抗原结合片段具有对于可溶性食蟹猕猴e-选择素的结合亲和力,表示为kd,其小于或等于200nm,例如小于或等于195nm、190nm、180nm、160nm、140nm、120nm、110nm、100nm、90nm、80nm、75nm、50nm。在一些实施例中,抗e-选择素抗体(例如抗体1444)或其抗原结合片段具有对于可溶性食蟹猕猴e-选择素的结合亲和力,表示为kd,其如例如通过spr所测量为约64.9+/-1.13nm至约81.5nm。
[0500]
在一些实施例中,抗e-选择素抗体或其抗原结合片段具有对于细胞表面表达的人类e-选择素的结合亲和力,表示为ec
50
,其如例如通过facs所测量小于或等于50nm,例如小于或等于48nm、45nm、40nm、20nm、10nm、5nm、4nm、3nm、2nm、1nm、0.75nm、0.5nm、0.25nm或0.1nm。在一些实施例中,抗e-选择素抗体(例如抗体1444)或其抗原结合片段具有对于细胞表面表达的人类e-选择素的结合亲和力,表示为ec
50
,其如例如通过facs所测量为约0.66nm。
[0501]
在一些实施例中,抗e-选择素抗体或其抗原结合片段具有对于细胞表面表达的食蟹猕猴e-选择素的结合亲和力,表示为ec
50
,其如例如通过facs所测量小于或等于50nm,例如小于或等于48nm、45nm、40nm、20nm、10nm、5nm、4nm、3nm、2nm、1nm、0.75nm、0.5nm、0.25nm或0.1nm。在一些实施例中,抗e-选择素抗体(例如抗体1444)或其抗原结合片段具有对于细胞表面表达的食蟹猕猴e-选择素的结合亲和力,表示为ec
50
,其如例如通过facs所测量为约0.75nm。
[0502]
在一些实施例中,抗e-选择素抗体或其抗原结合片段具有对于细胞表面表达的人类p-选择素的结合亲和力,表示为ec
50
,其如例如通过facs所测量大于或等于350nm,例如大于或等于400nm、450nm、500nm、550nm、600nm、650nm或更大。
[0503]
在一些实施例中,抗e-选择素抗体或其抗原结合片段对可溶性大鼠、小鼠或兔e-选择素或可溶性人类l-选择素或p-选择素具有弱结合或无结合。在一些实施例中,如例如通过spr所测量,抗e-选择素抗体或其抗原结合片段在最多405nm下展现对于可溶性大鼠、小鼠或兔e-选择素或可溶性人类l-选择素或p-选择素的无结合。在一些实施例中,如例如通过直接结合elisa所测量,抗e-选择素抗体或其抗原结合片段在最多133.3nm下展现对于可溶性小鼠或大鼠e-选择素的弱-不饱和的结合(例如低》100倍)。
[0504]
在一些实施例中,抗e-选择素抗体或其抗原结合片段以小于或等于2nm,例如小于或等于0.010nm、0.015nm、0.020nm、0.025nm、0.030nm、0.035nm、0.040nm、0.045nm、0.05nm、0.055nm、0.06nm、0.065nm、0.070nm、0.075nm、0.080nm、0.085nm、0.090nm、0.10nm、0.12nm、0.15nm、0.2nm、0.5nm、0.9nm、0.95nm、1nm、1.5nm、1.8nm或1.9nm的ec
50
结合于可溶性人类e-选择素。在一些实施例中,如例如通过直接结合elisa所测量,抗e-选择素抗体(例如抗体1444)或其抗原结合片段以约0.085nm至约0.12的ec
50
结合于可溶性人类e-选择素。
[0505]
在一些实施例中,如例如通过alphalisa均质竞争分析所测量,抗e-选择素抗体或其抗原结合片段以小于或等于2nm,例如小于或等于0.010nm、0.015nm、0.020nm、0.025nm、0.030nm、0.035nm、0.040nm、0.045nm、0.05nm、0.055nm、0.06nm、0.065nm、0.070nm、0.075nm、0.080nm、0.085nm、0.090nm、0.10nm、0.12nm、0.15nm、0.2nm、0.5nm、0.9nm、0.95nm、1nm、1.5nm、1.8nm或1.9nm的ec
50
中和唾液酸-路易斯a配体与可溶性人类e-选择素的结合。
[0506]
在一些实施例中,抗e-选择素抗体或其抗原结合片段以小于或等于1nm,例如小于
或等于0.010nm、0.015nm、0.020nm、0.025nm、0.030nm、0.035nm、0.040nm、0.045nm、0.05nm、0.055nm、0.06nm、0.065nm、0.070nm、0.075nm、0.080nm、0.085nm、0.090nm、0.10nm、0.12nm、0.15nm、0.2nm、0.5nm、0.9nm或0.95nm的ec
50
结合于可溶性食蟹猕猴e-选择素。在一些实施例中,如例如通过直接结合elisa所测量,抗e-选择素抗体(例如抗体1444)或其抗原结合片段以0.071nm至0.093nm的ec
50
结合于可溶性食蟹猕猴e-选择素。
[0507]
在一些实施例中,抗e-选择素抗体或其抗原结合片段以约1nm至约3nm的ic
50
且优选以约1.2nm的ic
50
结合人类血清中的游离可溶性人类e-选择素。
[0508]
在一些实施例中,如例如在静态条件下通过竞争elisa所测量,抗e-选择素抗体或其抗原结合片段以小于或等于100nm,例如小于或等于95nm、90nm、80nm、70nm、60nm、50nm、40nm、30nm、20nm、10nm、5nm、2nm或1nm的ic
50
中和唾液酸-路易斯a配体与可溶性人类e-选择素的结合。在一些实施例中,如例如在静态条件下通过竞争elisa所测量,抗e-选择素抗体(例如抗体1444)或其抗原结合片段以约2.87nm至约3.01nm的ic
50
中和唾液酸-路易斯a配体与可溶性人类e-选择素的结合。
[0509]
在一些实施例中,如例如在静态条件下通过竞争elisa所测量,抗e-选择素抗体或其抗原结合片段以小于或等于100nm,例如小于或等于95nm、90nm、80nm、70nm、60nm、50nm、40nm、30nm、20nm、10nm、5nm、2nm或1nm的ic
50
中和唾液酸-路易斯a配体与可溶性食蟹猕猴e-选择素的结合。在一些实施例中,如例如在静态条件下通过竞争elisa所测量,抗e-选择素抗体(例如抗体1444)或其抗原结合片段以约2.39nm至约2.91nm的ic
50
中和唾液酸-路易斯a配体与可溶性食蟹猕猴e-选择素的结合。
[0510]
在一些实施例中,如例如在静态条件下通过竞争elisa所测量,抗e-选择素抗体或其抗原结合片段以小于或等于50nm,例如小于或等于48nm、45nm、40nm、20nm、10nm、5nm、4nm、3nm、2nm或1nm的ic
50
中和唾液酸-路易斯a配体与细胞表面表达的人类e-选择素的结合。在一些实施例中,如例如在静态条件下通过竞争elisa所测量,抗e-选择素抗体或其抗原结合片段以约1.88nm至约2.89nm的ic
50
中和唾液酸-路易斯a配体与细胞表面表达的人类e-选择素的结合。
[0511]
在一些实施例中,如例如在静态条件下通过竞争elisa所测量,抗e-选择素抗体或其抗原结合片段以小于或等于100nm,例如小于或等于95nm、90nm、80nm、70nm、60nm、50nm、40nm、20nm、10nm、5nm、2nm或1nm的ic
50
中和唾液酸-路易斯a配体与细胞表面表达的食蟹猕猴e-选择素的结合。在一些实施例中,如例如在静态条件下通过竞争elisa所测量,抗e-选择素抗体或其抗原结合片段以约1.47nm至约2.65nm的ic
50
中和唾液酸-路易斯a配体与细胞表面表达的食蟹猕猴e-选择素的结合。
[0512]
在一些实施例中,如例如在静态条件下所测量,抗e-选择素抗体或其抗原结合片段以小于或等于100nm,例如小于或等于95nm、90nm、80nm、70nm、60nm、50nm、40nm、20nm、10nm、5nm、2nm或1nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与细胞表面表达的人类e-选择素的粘着。在一些实施例中,如例如在静态条件下所测量,抗e-选择素抗体(例如抗体1444)或其抗原结合片段以约3.36nm至约4.7nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与细胞表面表达的人类e-选择素的粘着。
[0513]
在一些实施例中,如例如在静态条件下所测量,抗e-选择素抗体(例如抗体1444)
或其抗原结合片段以约3.84nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与细胞表面表达的食蟹猕猴e-选择素的粘着。
[0514]
在一些实施例中,如例如在生理流动条件下所测量,抗e-选择素抗体或其抗原结合片段以小于或等于100nm,例如小于或等于95nm、90nm、80nm、70nm、60nm、50nm、40nm、30nm、20nm、10nm、5nm、2nm或1nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与细胞表面表达的人类e-选择素的粘着。在一些实施例中,如例如在生理流动条件下所测量,抗e-选择素抗体(例如抗体1444)或其抗原结合片段以约4.25nm至约4.56nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与细胞表面表达的人类e-选择素的粘着。
[0515]
在一些实施例中,如例如在生理流动条件下所测量,抗e-选择素抗体(例如抗体1444)或其抗原结合片段以约4.32nm至约4.35nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与细胞表面表达的食蟹猕猴e-选择素的粘着。
[0516]
在一些实施例中,如例如在生理流动条件下所测量,抗e-选择素抗体或其抗原结合片段以小于或等于300nm,例如小于或等于290nm、280nm、270nm、260nm、250nm、150nm、100nm、90nm、100nm、90nm、80nm、70nm、60nm、50nm、40nm、20nm、20nm、5nm、2nm或1nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与可溶性人类e-选择素的粘着。在一些实施例中,如例如在生理流动条件下所测量,抗e-选择素抗体(例如抗体1444)或其抗原结合片段以约13.28nm至约15.94nm的ic
50
抑制表达e-选择素配体(例如e选择素配体、psgl-1和其它唾液酸路易斯配体)的细胞与可溶性人类e-选择素的粘着。
[0517]
在一些实施例中,如例如在生理流动条件下所测量,抗e-选择素抗体(例如抗体1444)或其抗原结合片段以约2.87nm至约4.65nm或9.45nm至约16.33nm的ic
50
抑制活化人类嗜中性粒细胞与细胞表面表达的人类e-选择素或细胞表面表达的食蟹猕猴e-选择素的粘着。在一些实施例中,嗜中性粒细胞由tnf-α活化。
[0518]
在一些实施例中,如例如在生理流动条件下所测量,抗e-选择素抗体(例如抗体1444)或其抗原结合片段以约6.17nm至约18.66nm的ic
50
抑制来自scd患者的血细胞与可溶性人类e-选择素的粘着。在一些实施例中,如例如在生理流动条件下所测量,抗e-选择素抗体(例如抗体1444)或其抗原结合片段以约12.4nm的ic
50
抑制来自scd患者的血细胞与可溶性人类e-选择素的粘着。
[0519]
在一些实施例中,如通过例如竞争分析使用例如octet生物传感器所测定,抗e-选择素抗体或其抗原结合片段结合于人类e-选择素的三个抗原决定基中的至少一个。
[0520]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段结合于人类e-选择素的至少一个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个或更多个氨基酸残基,其选自由以下组成的群组:t7、e8、a9、m10、t11、p46、s47、y48、n82、n83、q85、e88、e92、y94、r97、n105、e107、r108、s110、k111、k112、k113和其组合。
[0521]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段与人类e-选择素的氨基酸残基t7、e8、a9、m10、t11、p46、s47、y48、n82、n83、q85、e88、e92、y94、
r97、n105、e107、r108、s110、k111、k112和k113相互作用。
[0522]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段与人类e-选择素的内的至少一个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个或更多个氨基酸残基相互作用,所述氨基酸残基选自由以下组成的群组:t7、e8、a9、t11、p46、s47、y48、n82、n83、q85、e92、y94、n105、e107、r108、s110、k111、k112和其组合。
[0523]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段与人类e-选择素的内的氨基酸残基t7、e8、a9、t11、p46、s47、y48、n82、n83、q85、e92、y94、n105、e107、r108、s110、k111和k112相互作用。
[0524]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段与内埋表面积的人类e-选择素中的至少一个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个或更多个氨基酸残基相互作用,所述氨基酸残基选自由以下组成的群组:t7、e8、a9、t11、p46、s47、y48、n82、n83、q85、e88、e92、y94、r97、e107、r108、s110、k111、k112、k113和其组合。
[0525]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段与内埋表面积的人类e-选择素中的氨基酸残基t7、e8、a9、t11、p46、s47、y48、n82、n83、q85、e88、e92、y94、r97、e107、r108、s110、k111、k112和k113相互作用。
[0526]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段经由氢键与人类e-选择素的至少一个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个或更多个氨基酸残基相互作用,所述氨基酸残基选自由以下组成的群组:e8、s47、n82、n83、e88、e92、y94、n105、e107、r108、s110、k112和其组合。
[0527]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段经由氢键与人类e-选择素的氨基酸残基e8、s47、n82、n83、e88、e92、y94、n105、e107、r108、s110和k112相互作用。
[0528]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段经由盐桥与人类e-选择素的选自由k111、k112和其组合组成的群组的至少一个氨基酸残基相互作用。
[0529]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段经由盐桥与人类e-选择素的氨基酸残基k111和k112相互作用。
[0530]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段经由水介导的氢键与人类e-选择素的选自由r97、k112和其组合组成的群组的至少一个氨基酸残基相互作用。
[0531]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段经由水介导的氢键与人类e-选择素的氨基酸残基r97和k112相互作用。
[0532]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段与人类e-选择素的至少一个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、更多个氨基酸残基相互作用,所述氨基酸残基还在的slex氨基酸残基触点内相互作用,所述氨基酸残基选自由以下组成的群组:y48、n82、n83、e92、y94、r97、n105、e107和其组合。
[0533]
在一些实施例中,任选地根据晶体结构,抗e-选择素抗体或其抗原结合片段与人
类e-选择素的氨基酸残基y48、n82、n83、e92、y94、r97、n105和e107相互作用,所述氨基酸残基还在的slex氨基酸残基触点内相互作用。
[0534]
抗e-选择素抗体或其抗原结合片段与人类e-选择素的至少一或多个氨基酸残基的结合或相互作用可以根据所属领域中已知的方法来确定,包括如对本文实例中所描述的结合分子的晶体结构的分析。
[0535]
在一些实施例中,如通过例如ac-sins分析、dna结合分析和/或胰岛素结合分析所测量,抗e-选择素抗体或其抗原结合片段处于多反应性低风险。在一些实施例中,抗e-选择素抗体或其抗原结合片段具有低免疫原性风险,例如具有约-44、-45、-46或-47的t-reg调节的评分。
[0536]
在一些实施例中,抗e-选择素抗体或其抗原结合片段在静脉内给予时展现至少一种预测的人类药物动力学(pk)参数,其选自:(i)约0.15ml/h/kg至约0.39ml/h/kg的全身性清除;(ii)22ml/kg至36ml/kg的稳态下分布的表观体积;(iii)约102小时至约345小时的平均半衰期。在一些实施例中,皮下给予的抗e-选择素抗体或其抗原结合片段展现约243至约518小时的半衰期。
[0537]
在一些实施例中,在以0.3mg/kg的剂量进行静脉内给予之后,抗e-选择素抗体或其抗原结合片段的平均半衰期是至少约102小时(约4.25天)。在一些实施例中,在以0.6mg/kg的剂量进行静脉内给予之后,抗e-选择素抗体或其抗原结合片段的平均半衰期是至少约264小时(约11天)。在一些实施例中,在以1.0mg/kg的剂量进行静脉内给予之后,抗e-选择素抗体或其抗原结合片段的平均半衰期是至少约188小时(约7.8天)。在一些实施例中,在以10mg/kg的剂量进行静脉内给予之后,抗e-选择素抗体或其抗原结合片段的平均半衰期是至少约345小时(约14.4天)。
[0538]
在一些实施例中,在以1.0mg/kg的剂量进行皮下给予之后,抗e-选择素抗体或其抗原结合片段的平均半衰期是至少约243小时(约10天)。在一些实施例中,在以3.0mg/kg的剂量进行皮下给予之后,抗e-选择素抗体或其抗原结合片段的平均半衰期是至少约518小时(约21.5天)。
[0539]
在一些实施例中,当在25℃下通过例如动态光散射(dls)测量时,抗e-选择素抗体或其抗原结合片段具有选自由以下组成的群组的粘度:约23mg/ml浓度下的约7.97+/-1.83cp、约48mg/ml浓度下的约12.38+/-5.28cp、约90mg/ml浓度下的约4.26+/-0.6cp、约102mg/ml浓度下的约5.58+/-0.99cp、约121mg/ml浓度下的约8.44+/-1.54cp、约140mg/ml浓度下的约9.78+/-2.32cp、约158mg/ml浓度下的约17.47+/-3.24cp和约188mg/ml浓度下的约37.99+/-7.03cp。
[0540]
在一些实施例中,当在25℃下通过例如dls测量时,抗e-选择素抗体或其抗原结合片段在约150mg/ml至约190mg/ml的浓度下具有约15cp至40cp的粘度。
[0541]
在一些实施例中,当在25℃下通过例如anton parr方法测量时,抗e-选择素抗体或其抗原结合片段在185.7mg/ml下具有33.4cp的粘度。
[0542]
免疫原性
[0543]
免疫原性是开发和利用包括抗体和fc融合蛋白的蛋白治疗剂的主要障碍。若干因素可影响蛋白质免疫原性,包括但不限于蛋白质序列、给予途径和频率以及患者群体。尽管对非人类蛋白质(诸如鼠类抗体)的免疫反应通常是最严重的,但甚至具有大部分或完全人
类序列含量的治疗剂可以是免疫原性的。免疫原性是对于感知是外源的物质的一系列复杂反应,且可以包括产生中和和非中和抗体、形成免疫复合体、补体活化、肥大细胞活化、发炎和全身性过敏反应。非所需免疫反应可能通过直接干扰抗原识别、改变与效应分子的相互作用或扰动治疗剂的血清半衰期或组织分布来降低抗体和fc融合蛋白治疗剂的功效。
[0544]
可以使用市售服务(诸如通过罗德岛普罗维登斯(r.i.,providence)的艾匹瓦公司(epivax)提供的服务)分析蛋白质治疗剂以预测潜在免疫原性抗原决定基的存在。亦可以使用诸如iedb共识法(consensus method)的方法预测潜在免疫原性抗原决定基。在一些实施例中,电子杂交算法可预测结合于ii类mhc分子的抗原决定基。用所述算法分析多肽的数据集提供所预测的抗原决定基。所预测的抗原决定基用于制造肽,其通过自动化肽合成或重组dna技术的标准方法制备。由艾匹瓦公司提供的评分信息可提供在群体中识别所预测的抗原决定基的分布广泛程度的指示。评分越低,预测的免疫原性潜力越低。
[0545]
如本文所用,“t-区域抗原决定基(t-regitope)”是单克隆抗体构架区内的氨基酸序列,其可以潜在地活化天然调节t细胞且减少非所需免疫反应。在一些实施例中,抗e-选择素抗体或其抗原结合片段包含8、7、6、5、4、3、2、1或0个非生殖系t细胞抗原决定基。在一些实施例中,抗e-选择素抗体或其抗原结合片段具有低免疫原性风险,例如具有约-45.11、-45.32、-46.16或-46.26的t-reg调节的评分。在一些实施例中,抗e-选择素抗体(例如抗体1444)或其抗原结合片段具有约-45.11的t-reg调节的评分和0个非生殖系t细胞抗原决定基。
[0546]
编码抗e-选择素抗体的核酸
[0547]
本发明还提供编码本发明抗体中的任一种的多核苷酸,包括本文所描述的抗体部分和被修饰的抗体。本发明还提供制造本文所描述的多核苷酸中的任一种的方法。可以通过所属领域中已知的程序制造多核苷酸和表达蛋白质。
[0548]
所需抗体或其抗原结合片段和编码所述抗体或其抗原结合片段的核酸的序列可以使用标准定序技术测定。可以将编码所需抗体或其抗原结合片段的核酸分子插入至各种载体(诸如克隆和表达载体)中以用于重组产生和表征。编码重链或重链的抗原结合片段的核酸分子和编码轻链或轻链的抗原结合片段的核酸分子可以被克隆到同一载体或不同载体中。
[0549]
在一些实施例中,本发明提供编码以下抗e-选择素抗体和其抗原结合片段中的任一个的氨基酸序列的多核苷酸:抗体1444、0841、0978、0164、1448、1284、1282、0525、0039、0265_0254、0158、0929_548、0159、0955_0300、0170、0564、0180和0027。在一个实施例中,本发明提供编码抗e-选择素抗体1444和其抗原结合片段的氨基酸序列的多核苷酸。
[0550]
在一些实施例中,本发明提供编码一或多种抗e-选择素抗体hc多肽的多核苷酸,所述多肽包含选自由以下组成的群组的氨基酸序列:seq id no:7、13、22、28、34、37、40、43、51、59、62、74、76、89、91、103、110、117和124。在一些实施例中,本发明提供编码抗e-选择素抗体hc多肽的多核苷酸,所述多肽包含seq id no:7或seq id no:13的氨基酸序列或由其组成。
[0551]
在一些实施例中,本发明提供编码一或多种抗e-选择素抗体lc多肽的多核苷酸,所述多肽包含选自由以下组成的群组的氨基酸序列:seq id no:1、17、26、31、46、56、67、72、81、86、96、101、105、115和119。在一些实施例中,本发明提供编码抗e-选择素抗体lc多
肽的多核苷酸,所述多肽包含seq id no:1的氨基酸序列或由其组成。
[0552]
在一些实施例中,本发明提供编码一或多种抗e-选择素抗体vh域多肽的多核苷酸,所述多肽包含选自由以下组成的群组的氨基酸序列:seq id no:11、25、30、35、39、42、45、55、60、66、75、80、90、95、104、114、118和128。在一些实施例中,本发明提供编码抗e-选择素抗体vh域多肽的多核苷酸,所述多肽包含seq id no:11的氨基酸序列或由其组成。
[0553]
在一些实施例中,本发明提供编码一或多种抗e-选择素抗体vl域多肽的多核苷酸,所述多肽包含选自由以下组成的群组的氨基酸序列:seq id no:5、21、27、32、50、57、7、73、85、87、100、102、109、116和122。在一些实施例中,本发明提供编码抗e-选择素抗体vl域多肽的多核苷酸,所述多肽包含seq id no:5的氨基酸序列或由其组成。
[0554]
本发明提供多核苷酸,其包含编码抗体1444的hc域的寄存于atcc处且具有寄存编号pta-126529的质粒的插入物的核酸序列。本发明还提供多核苷酸,其包含编码抗体1444的lc的寄存于atcc处且具有寄存编号pta-126530的质粒的插入物的核酸序列。另外,本发明提供多肽,其包含由寄存于atcc处且具有寄存编号pta-126529的质粒的dna插入物编码的氨基酸序列,所述插入物编码抗体1444的vh域。本发明进一步提供多肽,其包含由寄存于atcc处且具有寄存编号pta-126530的质粒的插入物编码的氨基酸序列,所述插入物编码抗体1444的vl域。
[0555]
本发明还提供多核苷酸,其包含:编码抗体1444的hcdr-1、hcdr-2和hcdr-3的寄存于atcc处且具有寄存编号pta-126529的质粒的插入物的核酸序列;以及编码抗体1444的lcdr-1、lcdr-2和lcdr-3的寄存于atcc处且具有寄存编号pta-126530的质粒的插入物的核酸序列。
[0556]
本发明还提供多核苷酸,其包含:编码抗体1444的vh域的寄存于atcc处且具有寄存编号pta-126529的质粒的插入物的核酸序列;以及编码抗体1444的vl域的寄存于atcc处且具有寄存编号pta-126530的质粒的插入物的核酸序列。
[0557]
本发明还提供多核苷酸,其包含:编码抗体1444的重链的寄存于atcc处且具有寄存编号pta-126529的质粒的插入物的核酸序列;以及编码抗体1444的轻链的寄存于atcc处且具有寄存编号pta-126530的质粒的插入物的核酸序列。
[0558]
在一些实施例中,本发明提供编码抗e-选择素抗体的多核苷酸和其变异体,其中所述变异体多核苷酸与表2中所公开的核酸序列中的任一者共有至少70%、至少75%、至少80%、至少85%、至少87%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%核酸序列一致性。这些量并不意谓是限制性的,且所叙述百分比之间的增量具体地设想是本发明的部分。
[0559]
在一个实施例中,vh和vl域或其抗原结合片段或全长hc或lc由独立多核苷酸编码。或者,vh和vl两者或其抗原结合片段或hc和lc由单个多核苷酸编码。
[0560]
本发明还涵盖与任何所述序列互补的多核苷酸。多核苷酸可以是单股(编码或反义)或双股的,且可以是dna(基因组、cdna、或合成)或rna分子。rna分子包括hnrna分子,其含有内含子且以一对一方式对应于dna分子;和mrna分子,其不含内含子。额外编码或非编码序列可(但未必)存在于本发明的多核苷酸内,且多核苷酸可(但未必)连接于其它分子和/或支撑材料。
[0561]
多核苷酸可以包含编码抗体或其片段的核酸序列或可以包含所述序列的变异体。
多核苷酸变异体含有一或多个取代、添加、缺失和/或插入,以使得被编码的多肽的结合特征相对于天然抗体分子不会降低。可如本文所描述大体上评估对通过变异体核酸序列编码的多肽的结合特征的效应。在一些实施例中,多核苷酸变异体展现与编码不包含任何取代、添加、缺失和/或插入的原始(亲本)抗体或其片段的多核苷酸序列的至少约70%一致性、至少约80%一致性、至少约90%一致性、至少约95%一致性、至少98%一致性或至少99%一致性。这些一致性百分比并不意谓是限制性的,且所述百分比之间的增量具体地设想是本发明的部分。
[0562]
如本文中所描述,根据最大一致性比对时,如果两个序列中的核苷酸或氨基酸序列相同,那么称所述两个多核苷酸或多肽序列“一致”。两个序列之间的比较通常通过在比较窗口比较序列以鉴别且比较局部区的序列类似性来进行。如本文中所使用的“比较窗口”指代具有至少约20个邻近位置,通常30至约75或40至约50的片段,其中两个序列被最佳比对之后,序列可以与具有相同数目的邻近位置的参考序列相比较。在一些实施例中,多核苷酸与本文所公开的多核苷酸至少70%、75%、80%、85%、90%、95%、98%、99%一致。
[0563]
在一些实施例中,抗e-选择素抗体vl域由包含选自由seq id no:137、145、147、149、154、165、158、160、162、164、166、168、170、172和174组成的群组的核酸序列的多核苷酸编码。在一些实施例中,抗e-选择素抗体vl域由包含与选自由seq id no:137、145、147、149、154、165、158、160、162、164、166、168、170、172和174组成的群组的核酸至少80%、85%、90%、95%、98%或99%一致的核酸序列的多核苷酸编码。
[0564]
在一些实施例中,抗e-选择素抗体vl域由包含与seq id no:137的核酸序列至少90%一致的核酸序列的多核苷酸编码。在一些实施例中,抗e-选择素抗体vl域由包含seq id no:137的核酸序列或由其组成的多核苷酸编码。
[0565]
在一些实施例中,抗e-选择素抗体vh域由包含选自由seq id no:136、144、146、148、150、151、152、153、155、157、159、161、163、165、167、169、171和173组成的群组的核酸序列的多核苷酸编码。在一些实施例中,抗e-选择素抗体vh域由包含与选自由seq id no:136、144、146、148、150、151、152、153、155、157、159、161、163、165、167、169、171和173组成的群组的核酸至少80%、85%、90%、95%、98%或99%一致的核酸序列的多核苷酸编码。
[0566]
在一些实施例中,抗e-选择素抗体vh域由包含与seq id no:136至少90%一致的核酸序列的多核苷酸编码。在一些实施例中,抗e-选择素抗体vh域由包含seq id no:136的核酸序列或由其组成的多核苷酸编码。
[0567]
在一些实施例中,抗e-选择素抗体hc由包含与seq id no:206或207至少90%一致的核酸序列的多核苷酸编码。在一些实施例中,抗e-选择素抗体hc由包含seq id no:206或138的核酸序列或由其组成的多核苷酸编码。
[0568]
在一些实施例中,抗e-选择素抗体lc由包含与seq id no:139至少90%一致的核酸序列的多核苷酸编码。在一些实施例中,抗e-选择素抗体lc由包含seq id no:139的核酸序列的多核苷酸编码。
[0569]
多核苷酸变异体还可以或可替代地基本上与基因或其片段或互补序列同源。所述多核苷酸变异体在适当严格条件下能够与编码抗体(或互补序列)的天然存在dna序列杂交。
[0570]
合适的“适当严格条件”包括在5
×
ssc、0.5%sds、1.0mm edta(ph 8.0)的溶液中
预洗涤;在约50℃至65℃下使5
×
ssc(0.75m nacl,0.075m柠檬酸钠)杂交过夜;随后在65℃下用含有0.1%sds的2
×
、0.5
×
和0.2
×
ssc中的各者洗涤两次,持续20分钟。
[0571]
如本文所用,“高度严格条件”或“较高严格度条件”如下:(1)使用低离子强度和高温用于洗涤,例如在50℃下0.015m氯化钠/0.0015m柠檬酸钠/0.1%十二烷基硫酸钠;(2)在杂交期间使用变性剂,诸如甲酰胺,例如在42℃下具有0.1%牛血清白蛋白的50%(v/v)甲酰胺/0.1%菲科尔(ficoll)/0.1%聚乙烯吡咯烷酮/具有750mm氯化钠、75mm柠檬酸钠的50mm磷酸钠缓冲液(ph 6.5);或(3)在42℃下使用50%甲酰胺、5
×
ssc、50mm磷酸钠(ph 6.8)、0.1%焦磷酸钠、5
×
denhardt氏溶液、声波处理鲑鱼精子dna(50μg/ml)、0.1%sds和10%硫酸葡聚糖,其中在42℃下在0.2
×
ssc(氯化钠/柠檬酸钠)中和在55℃下在50%甲酰胺中洗液,随后在55℃下用由含edta的0.1
×
ssc组成的较高严格度洗液洗涤。所属领域的技术人员将认识到如何视需要调节温度、离子强度等以适应诸如探针长度等的因素。
[0572]
所属领域的一般技术人员应了解,由于遗传密码的简并性,存在多种编码如本文所描述的多肽的氨基酸序列的核苷酸序列。这些多核苷酸中的一些带有与任何天然基因的核苷酸序列的最小同源性。即,存在用以编码20个天然氨基酸的64个不同密码子,其中一些氨基酸具有编码其的多个密码子(例如6个不同密码子编码亮氨酸)。因此,大量核酸序列可编码相同蛋白质序列,使得编码相同多肽氨基酸序列的两个核酸可以共有极低核酸序列一致性。因此,本发明具体涵盖因密码子使用差异而改变的多核苷酸。
[0573]
此外,包含本文所提供的多核苷酸序列的基因的等位基因在本发明范畴内。等位基因为由于核苷酸的一或多个突变(诸如缺失、添加和/或取代)而改变的内源基因。所得mrna和蛋白可以(但未必)具有被改变的结构或功能。等位基因可以使用标准技术(诸如杂交、扩增和/或数据库序列比较)来鉴别。
[0574]
本发明的多核苷酸可以使用化学合成、重组方法或pcr获得。化学多核苷酸合成方法是所属领域中众所周知的且无需详细描述于本文中。所属领域的技术人员可以使用本文所提供的序列和商用dna合成器以产生所需dna序列。
[0575]
为了使用重组方法制备多核苷酸,可以将包含所需序列的多核苷酸插入适合载体中,且继而可以将载体引入适合宿主细胞中进行复制和扩增,如本文中进一步讨论。可以通过所属领域中已知的任何方式来将多核苷酸插入宿主细胞中。通过利用直接吸收、内吞作用、转染、f-配对或电穿孔将外源性多核苷酸引入来使细胞转型。一旦引入,外源性多核苷酸可以作为非整合载体(诸如质粒)维持在细胞内或整合至宿主细胞基因体中。如此扩增的多核苷酸可以通过所属领域中众所周知的方法与宿主细胞分离。参见例如萨姆布鲁克等人,1989。
[0576]
或者,pcr允许dna序列复制。pcr技术在所属领域中众所周知且描述于美国专利第4,683,195号、第4,800,159号、第4,754,065号和第4,683,202号以及pcr:聚合酶链反应,穆利斯等人编,博考斯沃出版社(birkauswer press),波士顿(boston),1994。
[0577]
rna可以通过使用适当载体中的被分离的dna且将其插入适合宿主细胞中获得。当细胞复制且dna转录成rna时,可接着使用所属领域的技术人员众所周知方法分离rna,例如,如萨姆布鲁克等人,1989中所示。
[0578]
如本文所用,术语“载体”意谓建构体,其能够在宿主细胞中传递且优选表达一或多个所关注的基因或序列(例如,编码抗e-选择素抗体的hc、lc、vh、vl和/或其片段的核
酸)。载体的实例包括但不限于病毒载体(例如aav)、裸dna或rna表达载体、质粒、粘质粒或噬菌体载体、与阳离子缩合剂缔合的dna或rna表达载体、囊封于脂质体中的dna或rna表达载体,和某些真核细胞,诸如生产细胞。
[0579]
适合的克隆和表达载体可以包括多种组分,诸如启动子、强化子和其它转录调节序列。载体还可以被建构成允许抗体可变域后续克隆到不同载体中。适合克隆载体可以根据标准技术建构,或可以选自大量在所属领域中可用的克隆载体。尽管所选克隆载体可以根据意图使用的宿主细胞而变化,但适用克隆载体一般将能够自我复制,可以具有具体限制性核酸内切酶的单一目标,和/或可载有可以用于选择含有载体的纯系的标记物的基因。适合实例包括质粒和细菌病毒,例如puc18、puc19、bluescript(例如pbs sk+)和其衍生物、mp18、mp19、pbr322、pmb9、cole1、pcr1、rp4、噬菌体dna和穿梭载体(诸如psa3和pat28)。这些和许多其它克隆载体可购自商业供应商,诸如伯乐(biorad)、斯达金(stratagene)和英杰(invitrogen)。
[0580]
还提供表达载体。表达载体通常是含有根据本发明的多核苷酸的可复制多核苷酸建构体。这意味着表达载体,作为游离基因体或作为染色体dna的整体部分,在宿主细胞中必须是可复制的。适合表达载体包括但不限于质粒、病毒载体(包括腺病毒、腺相关病毒、反转录病毒)、粘质粒和pct公开案第wo 87/04462号中所公开的表达载体。载体组分可以通常包括但不限于以下中的一或多个:信号序列;复制起点;一或多种标记物基因;适合转录控制元件(诸如启动子、强化子和终止子)。对于表达(即翻译),还通常需要一或多种翻译控制元件,诸如核糖体结合位点、翻译启动位点和终止密码子。
[0581]
在一些实施例中,细胞(例如被分离或在生物体内)被包含编码异源多核苷酸(例如抗e-选择素抗体的hc、lc、vh域、vl域,或其抗原结合片段)的重组核酸和aav衣壳的重组aav(raav)转导。重组核酸可以进一步包含用于在被转导的细胞内表达异源多核苷酸的调节元件(例如,启动子、强化子、内含子、外显子、polya)。重组核酸可以进一步包含病毒反向串联重复(itr)序列。在一些实施例中,aav衣壳是aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10或所属领域中已知的任何其它野生型或重组aav衣壳。itr序列可以是aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10,或所属领域中已知的任何其它野生型或重组itr序列(例如aav2)。在一些实施例中,raav包含编码抗e-选择素抗体的hc、lc、vh域、vl域,或其抗原结合片段的重组核酸;启动子;aav itr和病毒衣壳。所述raav适用于在细胞中表达抗e-选择素抗体或其抗原结合片段以治疗或预防个体(例如患者)中的由e-选择素介导的疾病、病症或病状(例如scd)。
[0582]
含有所关注多核苷酸的载体和/或多核苷酸本身可以通过多种适当方式中的任一种引入宿主细胞中,包括电穿孔,使用氯化钙或聚乙烯亚胺(pei)、氯化铷、磷酸钙、deae-聚葡萄糖或其它物质的转染;微弹轰击;脂质体转染;和感染(例如其中载体是诸如痘疮病毒的感染物)。引入载体或多核苷酸的选择将通常视宿主细胞的特征而定。
[0583]
在一些实施例中,载体包含多核苷酸,其包含选自由seq id no:137、145、147、149、154、165、158、160、162、164、166、168、170、172和174组成的群组的核酸序列。在一些实施例中,载体包含多核苷酸,其包含与seq id no:137的核酸序列至少70%、80%、85%、90%、95%、98%或99%一致的核酸序列。在一些实施例中,载体包含多核苷酸,其包含seq id no:137的核酸序列或由其组成。
virol.),1997;36:59);小鼠塞特利氏细胞(mouse sertoli cell)(tm4,玛瑟(mather),生殖生物学(biol.reprod.),1980;23:243-251);猴肾细胞(cv1 atcc ccl 70);非洲绿猴肾细胞(vero-76,atcc crl-1 587);犬肾细胞(mdck,atcc ccl 34);水牛鼠肝细胞(brl 3a,atcc crl 1442);人类肺细胞(w138,atcc ccl 75);人类肝细胞(hep g2,hb 8065);小鼠乳房肿瘤(mmt 060562,atcc ccl51);tr1细胞(玛瑟等人,纽约科学院年报(annals n.y.acad.sci.),1982;383:44-68);mrc 5细胞;fs4细胞;人类肝癌细胞系(hep g2);和大量骨髓瘤细胞系,包括但不限于balb/c小鼠骨髓瘤细胞系(ns0/1,ecacc号:85110503)、ns0细胞和sp2/0细胞。
[0592]
另外,任何数目的市售和非市售的表达多肽或蛋白质的细胞系均可以根据本发明使用。所属领域的技术人员将了解,不同细胞系可以具有不同营养需求和/或可需要不同培养条件以实现最佳生长和多肽或蛋白质表达,且将能够视需要改变条件。
[0593]
用途
[0594]
治疗方法
[0595]
在一些实施例中,本发明提供用于使用抗e-选择素抗体或其抗原结合片段来降低或抑制e-选择素活性的治疗方法,其中所述治疗方法包含给予治疗有效量的包含抗体或其抗原结合片段的医药组合物。所治疗的病症是通过去除、抑制或降低e-选择素活性来改善、缓解、抑制或预防的任何疾病或病状(例如scd)。
[0596]
使用抗e-选择素抗体或其抗原结合片段治疗的方法包括但不限于治疗和/或预防与e-选择素表达和/或e-选择素结合于配体(例如,slex a和/或x决定子)相关或由其介导的疾病、病症和病状的方法,所述疾病、病症和病状包括但不限于scd、血管闭塞性危象、疼痛、器官梗塞、缺血、中风、终末器官功能障碍、急性胸部和血管阻塞。本发明的抗e-选择素抗体或其抗原结合片段还可以用于治疗和/或预防其它疾病、病症和病状,诸如皮肤病(例如牛皮癣)、发炎疾病(例如类风湿性关节炎)和糖尿病并发症。
[0597]
本发明提供特异性结合于e-选择素且能够中和e-选择素功能活性的新型治疗性抗体。这些抗体在用作scd的预防性治疗时,可以有利地用于预防voc或减少voc的发生。在一些实施例中,与未用抗e-选择素抗体或其抗原结合片段进行治疗的个体或个体群组(例如患有scd的患者)中的voc的发生率相比,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中的voc的发生率减少了约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在一些实施例中,与在用抗e-选择素抗体或其抗原结合片段进行治疗之前的相同个体中的voc的发生率相比,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中的voc的发生率减少了约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在一些实施例中,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中的voc的发生率与未患有scd的个体或个体群体中的voc的发生率并无显著不同。在一些实施例中,在一段时间内测量voc的发生率(例如voc事件的数目)。在一些实施例中,在数天、数周、数月或数年内测量voc的发生率(例如voc事件的数目)。
[0598]
在一些实施例中,本发明的抗体或其抗体结合片段可以降低发生镰状细胞相关疼痛危象的按年计算速率。如本文所提及,镰状细胞相关疼痛危象是疼痛急性发作,除了血管闭塞事件以外并无医学上确定的病因,其可引起前往医疗机构就诊和/或可引起用口服或肠胃外麻醉剂或用肠胃外类固醇消炎药进行治疗。在一些实施例中,急性胸部综合征、肝脏
离症、脾脏离症和恒久勃起被视为镰状细胞相关疼痛危象。
[0599]
在一些实施例中,与未用抗e-选择素抗体或其抗原结合片段进行治疗的个体或个体群组(例如患有scd的患者)中发生的镰状细胞相关疼痛危象的按年计算速率相比,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中发生的镰状细胞相关疼痛危象的按年计算速率低了约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在一些实施例中,与在用抗e-选择素抗体或其抗原结合片段进行治疗之前的相同个体中发生的镰状细胞相关疼痛危象的按年计算速率相比,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中发生的镰状细胞相关疼痛危象的按年计算速率低了约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在一些实施例中,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中发生的镰状细胞相关疼痛危象的按年计算速率与未患有scd的个体或个体群体中发生的镰状细胞相关疼痛危象的按年计算速率并无显著不同。
[0600]
在一些实施例中,与未用抗e-选择素抗体或其抗原结合片段进行治疗的个体或个体群组(例如患有scd的患者)中发生的第一次镰状细胞相关疼痛危象的中值时间相比,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中发生的第一次镰状细胞相关疼痛危象的中值时间长了约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在一些实施例中,与在用抗e-选择素抗体或其抗原结合片段进行治疗之前的相同个体中发生的第一次镰状细胞相关疼痛危象的中值时间相比,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中发生的第一次镰状细胞相关疼痛危象的中值时间长了约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在一些实施例中,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中发生的第一次镰状细胞相关疼痛危象的中值时间与未患有scd的个体或个体群体中发生的第一次镰状细胞相关疼痛危象的中值时间并无显著不同。
[0601]
在一些实施例中,与未用抗e-选择素抗体或其抗原结合片段进行治疗的个体或个体群组(例如患有scd的患者)中发生的第二次镰状细胞相关疼痛危象的中值时间相比,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中发生的第二次镰状细胞相关疼痛危象的中值时间长了约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在一些实施例中,与在用抗e-选择素抗体或其抗原结合片段进行治疗之前的相同个体中发生的第二次镰状细胞相关疼痛危象的中值时间相比,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中发生的第二次镰状细胞相关疼痛危象的中值时间长了约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在一些实施例中,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中发生的第二次镰状细胞相关疼痛危象的中值时间与未患有scd的个体或个体群体中发生的第二次镰状细胞相关疼痛危象的中值时间并无显著不同。
[0602]
在一些实施例中,与未用抗e-选择素抗体或其抗原结合片段进行治疗的个体或个体群组(例如患有scd的患者)中的无并发症镰状细胞相关疼痛危象的中值速率相比,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中的无并发症镰状细胞相关疼痛危象的中值速率低了约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在一些实施例中,无并发症危象是除急性胸部综合征、肝脏离症、脾脏离症和/或恒
久勃起以外的危象。在一些实施例中,与在用抗e-选择素抗体或其抗原结合片段进行治疗之前的相同个体中的无并发症镰状细胞相关疼痛危象的中值速率相比,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中的无并发症镰状细胞相关疼痛危象的中值速率长了约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在一些实施例中,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中的无并发症镰状细胞相关疼痛危象的中值速率与未患有scd的个体或个体群体中的无并发症镰状细胞相关疼痛危象的中值速率并无显著不同。
[0603]
本发明的抗体还可以有利地用于通过减少voc的持续时间(例如,减少使voc消退的时间)、严重程度和/或强度来治疗患有scd的患者中的急性voc。在一些实施例中,与未用抗e-选择素抗体或其抗原结合片段进行治疗的个体或个体群组(例如患有scd的患者)中的voc的持续时间、严重程度和/或强度相比,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中的voc的持续时间、严重程度和/或强度减少了约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在一些实施例中,与在用抗e-选择素抗体或其抗原结合片段进行治疗之前的相同个体中的voc的持续时间、严重程度和/或强度相比,用抗e-选择素抗体治疗的个体(例如患有scd的患者)中的voc的持续时间、严重程度和/或强度减少了约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在一些实施例中,用抗e-选择素抗体或其抗原结合片段治疗的个体(例如患有scd的患者)中的voc的持续时间、严重程度和/或强度与未患有scd的个体或个体群体中的voc的持续时间、严重程度和/或强度并无显著不同。
[0604]
抗e-选择素抗体或其抗原结合片段还可以用于治疗、预防和/或改善scd的至少一种征状和/或症状,例如,影响以下的征状和/或症状:心胸系统(例如慢性限制性肺病、左心室舒张性疾病、肺高血压、急性胸部综合征、心律不整、猝死、血管闭塞性危象)、神经系统(例如出血性中风、静脉窦栓塞、脑的无症状脑梗塞、慢性疼痛、脑的急性缺血性中风、增生性视网膜病变、眼眶梗塞、认知障碍)、网状内皮系统(例如脾脏离症、功能性低脾功能症、贫血、溶血)、肌骨胳系统(例如缺血性坏死、皮肤溃疡)、泌尿生殖系统(例如乳头状坏死、蛋白尿、肾衰竭、血尿、夜间遗尿、恒久勃起)和肠胃系统(例如胆石症、胆管病、肝病、肠系膜血管闭塞)。
[0605]
在一些实施例中,本发明包括被分离的抗体或其抗原结合片段,其特异性结合e-选择素且调节至少一种可检测e-选择素活性,使得所述抗体:(a)减少白细胞系链至内皮细胞;(b)减少稳定粘着于内皮细胞的活化;(c)减少白细胞缓慢滚动直至阻滞;(d)减少白细胞的有效跨内皮迁移;(e)降低cd18整合素的亲和力和亲合力;(f)减少运输白细胞至急性发炎部位;(g)减少胞溶质钙;(h)减少使p38 map激酶和syk激酶活化的酪氨酸磷酸化;(i)减少自血液募集血小板和白细胞至血管内皮;和/或(j)并不产生促发炎环境。
[0606]
使用本发明的抗e-选择素抗体或其抗原结合片段治疗的方法包括预防性和/或治疗性治疗。如果在病状的临床表现之前给予治疗,那么治疗视为预防性的。举例来说,抗e-选择素抗体或其抗原结合片段的给予在用作针对scd的预防性治疗(例如,在一段时间内的一或多次剂量)时可以用于预防voc(例如,减少voc事件的频率)。治疗性治疗包括例如改善或减轻疾病的严重程度或缩短疾病时长。举例来说,抗e-选择素抗体或其抗原结合片段的给予可以用于通过减少voc的持续时间、强度和/或严重程度来治疗患有scd的患者中的急
性voc。
[0607]
在一些实施例中,待治疗的个体可以是哺乳动物,且尤其人类患者,例如患有scd的患者。个体可能需要治疗,这是因为,由于hbb基因编码序列中的一或多个突变,β-珠蛋白蛋白质不当地表达,例如具有不恰当的氨基酸序列。抗e-选择素抗体或其抗原结合片段的给予可以用于治疗和/或预防scd(例如voc)、scd或sc病的变异体的至少一种病征和/或症状。抗e-选择素抗体或其抗原结合片段的给予可以用于治疗和/或预防具有hbss、hbsc、hbse、hbs/β
°
thal、hbs/β
+
thal或hbs-变异体基因型的个体中的至少一种病征和/或症状。
[0608]
本发明还涵盖如本文所定义的抗e-选择素抗体或其抗原结合片段或医药组合物,其用于所定义的治疗和/或预防方法中。在提及如本文所描述的治疗和/或预防方法的实施例中,所述实施例还包括关于抗e-选择素抗体或其抗原结合片段或医药组合物用于所述治疗和/或预防,或替代地用于制造供治疗和/或预防scd症状用的药剂的其它实施例。
[0609]
组合疗法
[0610]
本发明的抗体或其抗原结合片段可以与一或多种可以有效治疗和/或预防scd的至少一种病征和/或症状的额外治疗活性化合物或治疗方法组合给予。本发明涵盖治疗和/或预防scd的至少一种病征和/或症状的方法,其包含向有需要的患者给予一定量的抗e-选择素抗体或其抗原结合片段,与一定量的可以有效治疗和/或预防scd的至少一种病征和/或症状的治疗活性化合物或治疗方法的组合。在一些实施例中,治疗scd的症状包括减少急性voc的持续时间和强度。在一些实施例中,预防scd的症状包括减少voc事件的频率。
[0611]
本发明还涵盖治疗和/或预防scd的至少一种病征和/或症状的方法,其包含向有需要的患者给予一定量的抗e-选择素抗体或其抗原结合片段和一定量的可以有效治疗和/或预防scd的至少一种病征和/或症状的治疗活性化合物或治疗方法,其中所述量结合在一起可以有效治疗和/或预防scd的至少一种病征和/或症状。
[0612]
在另一实施例中,本发明涉及治疗和/或预防scd的至少一种病征和/或症状的方法,其包含向有需要的患者给予一定量的抗e-选择素抗体或其抗原结合片段和一定量的可以有效治疗和/或预防scd的至少一种病征和/或症状的治疗活性化合物或治疗方法,其中所述量结合在一起实现治疗和/或预防scd的至少一种病征和/或症状方面的协同作用,即,所述组合是“协同的(synergistic)”(即,所述组合提供比两种或多于两种单独疗法的简单累加作用更大的作用)。所述协同组合疗法可以有利地利用较低剂量的所给予治疗剂,从而避免与各种单一疗法相关的可能毒性或并发症。
[0613]
适用于治疗和/或预防scd的至少一种病征和/或症状的额外治疗活性化合物包括例如:预防肺炎球菌感染的青霉素预防、羟基尿素(例如droxia、hydrea)、l-谷氨酰胺(例如endari)、立赞利珠单抗(adakveo)、沃西洛特(oxbryta)、阿派沙班(eliquis)、利伐沙班(xarelto)、非类固醇消炎药、镇痛剂(通常是类鸦片镇痛剂)、iw-1701、瑞司瓜特(adempas)、替卡格雷(ticagrelor)(brilinta)、美金刚胺(namenda)和其组合。
[0614]
适用于治疗和/或预防scd的至少一种病征和/或症状的额外治疗活性化合物包括以下化合物,诸如:抗p-选择素抗体(例如立赞利珠单抗(adakveo));调节hbs的化合物;调节hbs的氧亲和力的化合物(例如沃西洛特(oxbryta));通过调节2,3-二磷酸甘油酸的生成而靶向hbs聚合的化合物;通过诱发胎儿血红蛋白(hbf)的表达而靶向hbs聚合的化合物(例如羟基尿素);靶向功能障碍性细胞粘着、血管功能障碍和/或发炎的化合物(例如磷酸二酯
酶-9抑制剂);增加血液中氧化氮的含量的化合物(例如可溶性鸟苷酸环化酶刺激剂,例如iw-1701、瑞司瓜特(adempas));静脉内用免疫球蛋白;靶向高血液凝固性的化合物(例如瑞司瓜特(adempas)、阿派沙班(eliquis)、利伐沙班(xarelto));阻断nmda受体结合的化合物(例如美金刚胺(namenda))。
[0615]
适用于治疗和/或预防scd(例如voc)的至少一种病征和/或症状的额外治疗活性化合物是调节hbs以使其维持在其r状态(即含氧状态)的化合物,诸如wo 2020/109994中所描述且以引用的方式并入本文中的那些化合物。在一些实施例中,调节hbs以使其维持在其r状态的化合物包括2-氨基喹啉化合物。在一些实施例中,调节hbs以使其维持在其r状态的化合物是6-{(1s)-1-[(2-氨基-6-氟喹啉-3-基)氧基]乙基}-5-(1h-吡唑-1-基)吡啶-2-醇、任选地以固体形式制备为其酰胺互变异构体(s)-6-(1-((2-氨基-6-氟喹啉-3-基)氧基)乙基)-5-(1h-吡唑-1-基)吡啶-2(1h)-酮、
[0616][0617]
适用于治疗和/或预防scd的至少一种病征和/或症状的治疗活性治疗方法包括补充氧;输血,任选地伴有铁螯合;骨髓移植;基因疗法(例如lentiglobin);通过crispr的基因编辑疗法(例如ctx001)或锌指技术和其组合。
[0618]
本发明涵盖一种医药组合物,其包含:抗e-选择素抗体或其抗原结合片段;治疗活性化合物或治疗方法,其可以有效治疗和/或预防scd的至少一种病征和/或症状;和医药学上可接受的载剂,其用于治疗和/或预防scd(例如voc)的至少一种病征和/或症状。本发明涵盖一种医药组合物,其包含:协同治疗有效量的抗e-选择素抗体;协同治疗有效量的治疗活性化合物或治疗方法,其可以有效治疗和/或预防scd的至少一种病征和/或症状;和医药学上可接受的载剂,其用于治疗和/或预防scd(例如voc)的至少一种病征和/或症状。组合物可以进一步包含额外治疗剂,诸如但不限于至少一种可以有效治疗和/或预防scd(例如voc)的至少一种病征和/或症状的其它治疗活性化合物或治疗方法。
[0619]
所属领域的技术人员应理解,基于其中所提供的公开内容,治疗和/或预防scd的至少一种病征和/或症状的方法涵盖向先前用或当前正接受至少一种治疗和/或预防scd(例如voc)的至少一种病征和/或症状的额外治疗剂的患者,给予协同治疗有效量的抗e-选择素抗体和协同治疗有效量的可以有效治疗和/或预防scd的至少一种病征和/或症状的治疗活性化合物或治疗方法。
[0620]
所述额外治疗剂涵盖作为治疗和/或预防scd的至少一种病征和/或症状的标准照护疗法的药剂。即,可将本发明的组合疗法添加至已接受不同疗法的scd患者的治疗方案中,所述不同疗法包括但不限于l-谷氨酰胺、羟基尿素、输血(任选地伴有铁螯合)和所属领域中已知的任何其它疗法。
[0621]
所属领域的技术人员将能够根据已知方法在考虑诸如年龄、体重、一般健康状况、所给予化合物、给予途径、scd治疗的性质和进展和其它药物的存在的因素的情况下,确定向患有scd的患者给予如本发明的组合中所用的各化合物的适当量、剂量(dose)或剂量
(dosage)。
[0622]
组合疗法的预防剂或治疗剂(包括抗e-选择素抗体或其抗原结合片段)可以同一医药组合物向个体给予(例如,所述疗法是共同配制的)。或者,组合疗法的预防剂或治疗剂可以独立医药组合物向个体同时给予(例如,所述疗法是共同给予的)。组合疗法的预防剂或治疗剂可以根据相同给药方案(例如,两种疗法是每天进行给予)或根据不同给药方案(例如,一种疗法是每天进行给予,另一种疗法是每周进行给予)进行给予。预防剂或治疗剂可以通过相同或不同给予途径向个体给予。
[0623]
组合疗法的预防剂或治疗剂(包括抗e-选择素抗体或其抗原结合片段)和6-{(1s)-1-[(2-氨基-6-氟喹啉-3-基)氧基]乙基}-5-(1h-吡唑-1-基)吡啶-2-醇、任选地以固体形式制备为其酰胺互变异构体(s)-6-(1-((2-氨基-6-氟喹啉-3-基)氧基)乙基)-5-(1h-吡唑-1-基)吡啶-2(1h)-酮可以独立医药组合物向个体同时给予(例如所述疗法是共同给予的)。组合疗法的所述预防剂或治疗剂可以根据相同给药方案(例如,两种疗法是每天进行给予)或根据不同给药方案(例如,一种疗法是每天进行给予,另一种疗法是每周进行给予)进行给予。此外,所述预防剂或治疗剂可以通过相同或不同给予途径向个体给予。
[0624]
预防剂或治疗剂(包括抗e-选择素抗体或其抗原结合片段)和6-{(1s)-1-[(2-氨基-6-氟喹啉-3-基)氧基]乙基}-5-(1h-吡唑-1-基)吡啶-2-醇、任选地以固体形式制备为其酰胺互变异构体(s)-6-(1-((2-氨基-6-氟喹啉-3-基)氧基)乙基)-5-(1h-吡唑-1-基)吡啶-2(1h)-酮可以组合形式给予,以在个体中减少voc的持续时间(例如减少使voc消退的时间)、严重程度和/或强度,降低镰状细胞相关疼痛危象产生的按年计算速率,增加第一次镰状细胞相关疼痛危象产生的中值时间,增加第二次镰状细胞相关疼痛危象产生的中值时间和/或降低无并发症镰状细胞相关疼痛危象产生的中值速率。
[0625]
本发明还涵盖如本文所定义的包括抗e-选择素抗体或其抗原结合片段的组合疗法的预防剂或治疗剂,其用于所定义的治疗和/或预防方法中。在提及如本文所描述的治疗和/或预防方法的实施例中,所述实施例还包括关于组合疗法(包括抗e-选择素抗体或其抗原结合片段或医药组合物)用于所述治疗和/或预防,或可替代地用于制造供所述治疗和/或预防scd的至少一种病征和/或症状用的药剂的其它实施例。
[0626]
本发明提供用于向有需要的个体单独或与其它疗法组合给予包含本发明的e-选择素抗体或其抗原结合片段的医药组合物的方案。本发明的组合疗法中的疗法(例如,预防剂或治疗剂)可以向个体同时或连续给予。本发明的组合疗法中的疗法(例如,预防剂或治疗剂)也可以循环给予。循环疗法涉及在一段时间内给予第一疗法(例如第一预防剂或治疗剂),随后在一段时间内给予第二疗法(例如第二预防剂或治疗剂)且重复此依序给予,即循环,以降低对所述疗法(例如药剂)中的一种的耐药性的发展,以避免或降低所述疗法(例如药剂)中的一种的副作用,和/或改善所述疗法的功效。
[0627]
本发明的组合疗法中的疗法(例如,预防剂或治疗剂)可以同时向个体给予。术语“同时”不限于在恰好同一时间给予疗法(例如,预防剂或治疗剂),但实际上其意谓包含本发明的e-选择素抗体或其抗原结合片段的医药组合物以一种顺序且在一段时间间隔内向个体给予,以使得本发明的抗体或其结合物可以与其它疗法一起发挥作用以提供比其以其它方式给予时增加的益处。举例来说,各疗法可以同时或按任何次序在不同时间点连续向个体给予;然而,如果未同时给予,那么其应在时间充分接近时被给予以提供所需治疗性或
预防剂作用。各疗法可以任何适当形式且通过任何适合途径分别向个体给予。在各种实施例中,可相隔小于15分钟、小于30分钟、小于1小时,相隔约1小时、相隔约1小时至约2小时,相隔约2小时至约3小时,相隔约3小时至约4小时,相隔约4小时至约5小时,相隔约5小时至约6小时,相隔约6小时至约7小时,相隔约7小时至约8小时,相隔约8小时至约9小时,相隔约9小时至约10小时,相隔约10小时至约11小时,相隔约11小时至约12小时,相隔24小时,相隔48小时,相隔72小时或相隔1周向个体给予疗法(例如,预防剂或治疗剂)。在其它实施例中,两种或多于两种疗法(例如,预防剂或治疗剂)可以在同一患者就诊期内给予。
[0628]
组合疗法中的预防剂或治疗剂可以同一医药组合物向个体给予。或者,组合疗法中的预防剂或治疗剂可以独立医药组合物同时向个体给予。预防剂或治疗剂可以通过相同或不同给予途径向个体给予。
[0629]
诊断用途
[0630]
本发明的抗e-选择素抗体、抗体组合物和方法具有活体外和活体内效用,包括免疫分析和用于诊断和评估e-选择素介导的病症的治疗的用途。所述方法尤其适用于诊断、评估和治疗患有与e-选择素存在相关的病症的人类患者。与e-选择素存在相关的此病症包括但不限于scd、皮肤病(例如牛皮癣)、发炎疾病(例如类风湿性关节炎)和糖尿病并发症。
[0631]
本发明提供用于检测样品中e-选择素的存在的方法,所述方法包含使疑似包含e-选择素的样品与对e-选择素具有特异性的抗体接触,且检测与所述抗体结合的e-选择素的存在,由此检测所述样品中的e-选择素。用于检测与所述抗体结合的e-选择素的方法是所属领域中众所周知的,包括但不限于以下的分析,其中使e-选择素结合于固体支撑物且向其中添加样品,从而允许所述抗体结合所述样品中的e-选择素。添加与结合于固体支撑物的抗体相同或不同的第二e-选择素抗体且可以通过直接标记(即,使第二抗体与可检测标记结合)或通过添加例如来自与第二抗体的恒定域反应且包含可检测标记的另一物种的第三抗体来检测。因此,所述分析可以用于检测样品中e-选择素的存在或不存在。
[0632]
本发明还提供用于测定样品中e-选择素的浓度的方法,所述方法包含:提供被标记的竞争物,其包含偶合至可检测标记的e-选择素;提供特异性结合e-选择素的抗体或其抗原结合片段;合并样品、抗体和被标记的竞争物,其中样品中的e-选择素与被标记的竞争物竞争结合于抗体;以及通过利用检测标记而测量未结合于抗体的被标记的竞争物的量来测定所述样品中e-选择素的浓度。将在无样品存在下结合于抗体的被标记的竞争物的量与在添加样品时结合于抗体的被标记的竞争物的量进行比较。在无样品存在下所结合的被标记的竞争物的减少量是存在于样品中未被标记的e-选择素的量的指标,使得所述分析可以用于评估样品中e-选择素的存在和含量。在一些实施例中,e-选择素是可溶性e-选择素。在一些实施例中,e-选择素是膜结合e-选择素。
[0633]
在一个实施例中,本发明提供用于评估针对与个体中e-选择素的含量增加相关的疾病或病症的治疗有效性的方法,所述方法包含向个体给予治疗,且将治疗前自个体获得的样品中e-选择素的含量与治疗后从个体获得的其它方面相同的样品中e-选择素的含量进行比较,其中使用e-选择素特异性抗体评估样品中e-选择素的含量,且此外其中,与治疗前自个体收集的样品中e-选择素的含量相比,治疗后从个体收集的样品中e-选择素的较低含量是治疗过程的有效性的指标。
[0634]
关于e-选择素特异性抗体或被标记的竞争物的术语“被标记”包括通过将可检测
物质偶合(即实体连接)至抗体或被标记的竞争物进行的直接标记,以及通过使抗体或被标记的竞争物与被直接标记的另一试剂偶合而进行的抗体或被标记的竞争物的间接标记。间接标记的实例包括使用被荧光标记的二级抗体检测初级抗体。用于检测本发明的多肽的活体外技术包括酶联免疫吸附分析法(elisa)、蛋白质印迹法(western blot)、免疫沉淀法和免疫荧光法。
[0635]
术语“样品”意图包括自个体分离的组织、细胞和生物流体(例如血液、csf、尿液等),以及存在于个体内的组织、细胞和流体。
[0636]
本文所描述的抗体、被标记的竞争物和潜在治疗剂还适用于与多种具有一系列检测系统的其它均质和异质免疫分析中的任一种一起使用。
[0637]
组合物
[0638]
本发明的抗e-选择素抗体或其抗原结合片段可以配制成医药组合物。医药组合物可以进一步包含呈冻干配制物或水溶液形式的医药学上可接受的载剂、赋形剂和/或稳定剂(雷明顿:药学的科学与实践(remington:the science and practice of pharmacy),第21版,2005,威廉姆斯和威尔金斯出版社(lippincott williams and wilkins),胡佛(k.e.hoover)编)。如本文所用,术语“医药学上可接受的载剂”或“医药学上可接受的赋形剂”包括在与活性成分合并时使所述成分保留生物活性且与个体的免疫系统无反应性的任何材料。
[0639]
实例包括但不限于标准医药学载剂中的任一种,诸如磷酸盐缓冲盐水(pbs)、水、标准生理盐水(0.9%)、乳液(例如油/水乳液)和各种类型的湿润剂。用于喷雾剂或肠胃外给予的优选稀释剂是pbs和标准生理盐水。
[0640]
可接受的载剂、赋形剂或稳定剂在所述剂量和浓度下对接受者无毒性,且可以包含缓冲剂,诸如磷酸盐、柠檬酸盐和其它有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(诸如氯化十八烷基二甲基苯甲基铵;氯化六羟季铵;氯化苯甲烃铵、氯化苯索铵;苯酚、丁基醇或苯甲醇;对羟苯甲酸烷酯,诸如对羟苯甲酸甲酯或对羟苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,诸如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,诸如聚乙烯吡咯烷酮;氨基酸,诸如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、双糖和其它碳水化合物,包括葡萄糖、甘露糖或聚葡萄糖;螯合剂,诸如edta;糖,诸如蔗糖、甘露醇、海藻糖或山梨糖醇;成盐相对离子,诸如钠;金属络合物(例如zn-蛋白质络合物);和/或非离子型表面活性剂,诸如tween
tm
、pluronics
tm
、聚山梨醇酯(例如聚山梨醇酯80(ps80)、聚山梨醇酯60(ps60)、聚山梨醇酯20(ps20))或聚乙二醇(peg)。医药学上可接受的赋形剂进一步描述于本文中。
[0641]
本发明的医药化合物可以包括一或多种医药学上可接受的盐。所述盐的实例包括酸加成盐和碱加成盐。酸加成盐包括衍生自无毒无机酸的盐,诸如盐酸、硝酸、磷酸、硫酸、氢溴酸、氢碘酸、亚磷酸等;以及衍生自无毒有机酸的盐,诸如脂族单甲酸和脂族二甲酸、被苯基取代的烷酸、羟基烷酸、芳族酸、脂族和芳族磺酸等。碱加成盐包括衍生自碱土金属的盐,诸如钠、钾、镁、钙等;以及衍生自无毒有机胺的盐,诸如n,n'-二苯甲基乙二胺、n-甲基葡糖胺、氯普鲁卡因(chloroprocaine)、胆碱、二乙醇胺、乙二胺、普鲁卡因(procaine)等。
[0642]
本发明的医药组合物还可以包括医药学上可接受的抗氧化剂。医药学上可接受的抗氧化剂的实例包括:(1)水溶性抗氧化剂,诸如抗坏血酸、半胱氨酸盐酸盐、硫酸氢钠、偏
亚硫酸氢钠、亚硫酸钠等;(2)油溶性抗氧化剂,诸如抗坏血酸棕榈酸酯、丁基化羟基大茴香醚(bha)、丁基化羟基甲苯(bht)、卵磷脂、没食子酸丙酯、α-生育酚等;和(3)金属螯合剂,诸如柠檬酸、乙二胺四乙酸(edta)、山梨糖醇、酒石酸、磷酸等。
[0643]
可以用于本发明的医药组合物中的适合水性和非水性载剂的实例包括水、乙醇、多元醇(诸如甘油、丙二醇、聚乙二醇等)和其适合混合物、植物油(诸如橄榄油)和可注射有机酯(诸如油酸乙酯)。可以例如通过使用诸如卵磷脂的包衣材料、通过在分散液的任选地维持所需粒度和通过使用表面活性剂来维持适当流动性。
[0644]
这些组合物还可以含有佐剂,诸如防腐剂、湿润剂、乳化剂和分散剂。防止微生物的存在可以通过灭菌程序和通过包括各种抗菌剂和抗真菌剂(例如,对羟基苯甲酸酯、氯丁醇、苯酚山梨酸等)来确保。还可能需要在组合物中包括等张剂,诸如糖、氯化钠等。另外,对于可注射医药形式的延长吸收可以通过包括延迟吸收的药剂(诸如单硬脂酸铝和明胶)来实现。
[0645]
医药组合物通常必须在制造和储存条件下是无菌且稳定的。组合物可以配制成溶液、微乳液、脂质体或适合于较高药物浓度的其它有序结构。载剂可以是含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)和其适合混合物的溶剂或分散介质。适当流动性可以例如通过使用诸如卵磷脂的包衣、通过在分散液的任选地维持所需粒度和通过使用表面活性剂来维持。在多数情况下,组合物中适合包括等张剂,例如糖、多元醇(诸如甘露醇、山梨醇)或氯化钠。对于可注射组合物的延长吸收可以通过在组合物中包括延迟吸收的药剂(例如,单硬脂酸酯盐和明胶)来实现。
[0646]
无菌可注射溶液可以通过视需要将所需量的活性化合物与上文所列的一种成分或成分组合并入适当溶剂中,随后进行灭菌微过滤来制备。
[0647]
一般来说,分散液通过将活性化合物并入含有碱性分散介质和来自以上所列举成分的所需其它成分的无菌媒剂中来制备。在无菌粉末用于制备无菌可注射溶液的情况下,优选制备方法是真空干燥和冷冻干燥(冻干),其从其被预先无菌过滤的溶液产生具有活性成分加任何额外所需成分的粉末。
[0648]
本发明的医药组合物可以适用于经眼给予的配制物形式制备、包装或出售。所述配制物可以例如呈滴眼剂形式,包括例如0.1%-1.0%(w/w)的活性成分于水性或油性液体载剂中的溶液或悬浮液。所述滴剂可以进一步包含本文所描述的缓冲剂、盐或一或多种其它额外成分。适用的其它可以经眼给予的配制物包括包含呈微晶形式或脂质体制剂的活性成分的配制物。
[0649]
如本文所用,“额外成分”包括但不限于以下中的一或多个:赋形剂;表面活性剂;分散剂;惰性稀释剂;粒化剂和崩解剂;粘合剂;润滑剂;甜味剂;调味剂;着色剂;防腐剂;生理学上可降解的组合物,诸如明胶;水性媒剂和溶剂;油性媒剂和溶剂;悬浮剂;分散剂或润湿剂;乳化剂、缓和剂;缓冲剂;盐;增稠剂;填充剂;乳化剂;抗氧化剂;抗生素;抗真菌剂;稳定剂;和医药学上可接受的聚合或疏水性物质。本发明的医药组合物可以包括的其它“额外成分”是所属领域中已知且描述于例如雷明顿氏医药科学(remington's pharmaceutical sciences),赫纳罗(genaro)编,马克出版公司(mack publishing co.),宾夕法尼亚州伊斯顿(easton,pa)(1985)中,所述文献以引用的方式并入本文中。
[0650]
在一些实施例中,在1ml缓冲水溶液中,在含有100mg抗e-选择素抗体(例如抗体
1444)或其抗原结合片段的小瓶中配制抗e-选择素抗体或其抗原结合片段。在一些实施例中,在1ml缓冲水溶液中,在含有150mg抗e-选择素抗体(例如抗体1444)或其抗原结合片段的小瓶中配制抗e-选择素抗体或其抗原结合片段。在一些实施例中,在1ml缓冲水溶液中,在含有15mg、40mg、100mg、300mg或600mg的抗e-选择素抗体(例如抗体1444)或其抗原结合片段的小瓶中配制抗e-选择素抗体或其抗原结合片段,任选地用于皮下给予。在一些实施例中,在1ml缓冲水溶液中,在含有500mg抗e-选择素抗体(例如抗体1444)或其抗原结合片段的小瓶中配制抗e-选择素抗体或其抗原结合片段,任选地用于静脉内给予。
[0651]
在一些实施例中,医药组合物包含约25mg/ml、50mg/ml、75mg/ml、100mg/ml、125mg/ml、150mg/ml抗体或其抗原结合片段。在一些实施例中,医药组合物包含约100mg/ml抗体或其抗原结合片段。在一些实施例中,适用于皮下和/或静脉内给予的医药组合物包含约100mg/ml抗e-选择素抗体(例如抗体1444)或其抗原结合片段。
[0652]
在一些实施例中,抗e-选择素抗体或其抗原结合片段以静脉内或皮下配制物形式作为无菌水溶液给予,所述无菌水溶液包含含有seq id no:7或seq id no:13的氨基酸序列的多肽。在一些实施例中,抗e-选择素抗体或其抗原结合片段以静脉内或皮下配制物形式作为无菌水溶液给予,所述无菌水溶液包含含有seq id no:1的氨基酸序列的多肽。在一些实施例中,抗e-选择素抗体或其抗原结合片段以静脉内或皮下配制物形式作为无菌水溶液给予,所述无菌水溶液包含含有seq id no:7或seq id no:13的氨基酸序列的多肽和含有seq id no:1的氨基酸序列的多肽。
[0653]
在一些实施例中,抗e-选择素抗体(例如抗体1444)或其抗原结合片段以静脉内或皮下配制物形式给予,所述静脉内或皮下配制物是含有约5mg/ml、约10mg/ml、约15mg/ml、约20mg/ml的抗体、约25mg/ml、约50mg/ml、约75mg/ml、约100mg/ml、约125mg/ml或约150mg/ml的抗体或其抗原结合片段的无菌水溶液。在一些实施例中,静脉内或皮下配制物是包含乙酸钠、聚山梨醇酯80和氯化钠的无菌水溶液(ph在约5至6范围内)。在一些实施例中,静脉内配制物是含有5或10mg/ml的抗体,以及20mm乙酸钠、0.2mg/ml聚山梨醇酯80和140mm氯化钠的无菌水溶液(ph 5.5)。另外,包含抗体或其抗原结合片段的溶液可以在许多其它化合物当中包含谷氨酸、组氨酸、甘露醇、蔗糖、海藻糖、甘氨酸、聚(亚乙基)二醇、edta、甲硫氨酸、聚山梨醇酯80和其任何组合,以及相关技术中已知的许多其它化合物。
[0654]
在一个实施例中,本发明的医药组合物包含以下组分:50mg/ml或100mg/ml的本发明的抗e-选择素抗体(例如抗体1444)或抗原结合片段、20mm组氨酸、8.5%蔗糖和0.02%聚山梨醇酯80、0.005%edta(ph 5.8)。在一个实施例中,本发明的医药组合物包含以下组分:100mg/ml的本发明的抗e-选择素抗体(例如抗体1444)或抗原结合片段、10mm组氨酸、5%蔗糖和0.01%聚山梨醇酯80(ph 5.8)。
[0655]
在一些实施例中,医药组合物包含浓度为100mg/ml的抗e-选择素抗体或其抗原结合片段(例如抗体1444)、1.12mg/ml l-组氨酸、2.67mg/ml l-组氨酸盐酸盐单水合物、85mg/ml蔗糖、0.05mg/ml二水合乙二胺四乙酸二钠和0.2mg/ml聚山梨醇酯80,ph是5.8,标称填充体积是1.0ml。所述医药组合物适用于皮下或静脉内给予。
[0656]
所述医药组合物可以液体配制物或以冻干粉末形式提供。当粉末以完整体积复原,组合物保持相同配方。或者,粉末可以一半体积复原,在此情况下组合物包含相同组分但浓度是两倍。
therapy),生物科学出版公司(bios scientific pub.ltd),英国牛津郡(oxfordshire,uk);克里希那(kresina)(编),1991,单克隆抗体、细胞因子和关节炎(monoclonal antibodies,cytokines and arthritis),马塞尔
·
德克尔公司,纽约州纽约;巴赫(bach)(编),1993,自体免疫疾病中的单克隆抗体和肽疗法(monoclonal antibodies and peptide therapy in autoimmune diseases),马塞尔
·
德克尔公司,纽约州纽约;贝尔特(baert)等人,新英格兰医学杂志,2003;348:601-608;米尔格罗姆(milgrom)等人,新英格兰医学杂志,1999;341:1966-1973;斯莱蒙(slamon)等人,新英格兰医学杂志,2001;344:783-792;本米诺维茨(beniaminovitz)等人,新英格兰医学杂志,2000;342:613-619;戈什(ghosh)等人,新英格兰医学杂志,2003;348:24-32;利普斯基(lipsky)等人,新英格兰医学杂志,2000;343:1594-1602)。
[0663]
适当剂量由临床医师例如使用所属领域中已知或疑似影响治疗或被预测影响治疗的参数或因素来确定。一般来说,初始剂量是稍微小于最佳剂量的量,且其后以较小增量递增,直至实现所需或最佳作用(相对于任何负面的副作用来说)。具体剂量方案可以是涉及避免显著不良副作用的最大剂量或给药频率的剂量方案。
[0664]
如本文所用的术语“减小、减少、中和或抑制与e-选择素的相互作用”意谓,与在任何治疗性干预之前的相互作用程度相比,减小、减少、中和或抑制e-选择素与配体的相互作用。如本文所用,“游离e-选择素”意谓与另一分子(例如,游离或细胞表面表达的e-选择素配体)不结合或以其它方式复合的e-选择素。
[0665]
e-选择素的含量包括个体中的自由e-选择素的含量,其中使用本文中所公开的方法或用于评估所属领域中已知的自由e-选择素的含量的任何其它方法来评估所述含量。
[0666]
在一个实施例中,与在给予本发明的抗e-选择素抗体之前的个体中的e-选择素的含量相比,游离e-选择素的含量有所降低。在一个实施例中,与游离e-选择素相关或指示个体罹患与游离e-选择素相关或由其介导的疾病、病症或病状的游离e-选择素标准含量相比,游离e-选择素的含量有所降低。
[0667]
在一些实施例中,本发明涵盖将游离e-选择素的含量降低至其中降低或完全不存在由游离e-选择素介导或与其相关的可检测有害影响的含量。在一些实施例中,给予有效剂量的抗e-选择素抗体以中和e-选择素功能活性,诸如(a)白细胞系链至内皮细胞;(b)稳定粘着于内皮细胞的活化;(c)白细胞缓慢滚动直至阻滞;(d)白细胞的跨内皮迁移;(e)cd18整合素的亲和力和亲合力;(f)运输白细胞至急性发炎部位;(g)增加胞溶质钙;(h)增加使p38 map激酶和syk激酶活化的酪氨酸磷酸化;(i)自血液募集血小板和白细胞至血管内皮;和/或(j)并不产生促发炎环境。
[0668]
如本文所用,药物、化合物或医药组合物的“有效剂量(effective dosage/effective dose)”、“有效量”、或“治疗有效量”是足以实现任何一或多种有益或所需结果的量。对于预防性用途,有益或所需结果包括消除或降低风险、降低发生频率(例如在一段时间内,例如每周、每月、每年)、减轻疾病严重度和/或延缓疾病发作,包括疾病、其并发症和在疾病发展期间所呈现的中间病理性表型的生物化学、组织学和/或行为症状。对于治疗性用途,有益或所需结果包括可检测临床结果,诸如减轻voc或降低voc的速率或减轻e-选择素的表达产生的一或多个症状、降低治疗所述疾病所需的其它药物的剂量、增强另一药物的效应和/或延缓患者的疾病进展。可以一或多次给予形式来给予有效剂量。出于本发明
的目的,药物、化合物或医药组合物的有效剂量是足以直接或间接实现预防性或治疗性治疗的量。如在临床情形下所理解,药物、化合物或医药组合物的有效剂量可或不可连同另一药物、化合物或医药组合物一起实现。因此,“有效剂量”可以视为处于给予一或多种治疗剂的情形下,且如果连同一或多种其它药剂可以实现或已实现所需结果,那么单个药剂可视为以有效量给出。
[0669]
在一些实施例中,向患有scd、皮肤病(例如牛皮癣)、发炎疾病(例如类风湿性关节炎)和糖尿病并发症的患者给予有效剂量的抗e-选择素抗体。
[0670]
在一些实施例中,给予抗e-选择素抗体(例如抗体1444)的有效剂量以治疗和/或预防与e-选择素表达和/或e-选择素结合于配体(例如slex a和/或x决定子)相关或由其介导的疾病、病症和病状,所述疾病、病症和病状包括但不限于scd、血管闭塞性危象、疼痛、器官梗塞、局部缺血、中风、终末器官功能障碍、急性胸部和血管阻塞。
[0671]
在一些实施例中,在用作针对scd的预防性治疗时,给予抗e-选择素抗体(例如抗体1444)的有效剂量以预防voc或减少voc的发生。在一些实施例中,一次性给予抗e-选择素抗体(例如抗体1444)的预防性给予。在一些实施例中,抗e-选择素抗体(例如抗体1444)的预防性给予是在持续的基础上进行给予(例如在一段时间内的一或多于一次剂量)。
[0672]
在一些实施例中,通过减少voc的持续时间、强度和/或严重程度,给予抗e-选择素抗体(例如抗体1444)的有效剂量以治疗患有scd的患者中的急性voc。
[0673]
在一些实施例中,给予抗e-选择素抗体(例如抗体1444)的有效剂量以治疗、预防和/或改善scd的至少一种病征和/或症状,例如,影响以下的病征和/或症状:心胸系统(例如慢性限制性肺病、左心室舒张性疾病、肺高血压、急性胸部综合征、心律不整、猝死、血管闭塞性危象)、神经系统(例如出血性中风、静脉窦栓塞、脑的无症状脑梗塞、慢性疼痛、脑的急性缺血性中风、增生性视网膜病变、眼眶梗塞、认知障碍)、网状内皮系统(例如脾脏离症、功能性低脾功能症、贫血、溶血)、肌骨胳系统(例如缺血性坏死、皮肤溃疡)、泌尿生殖系统(例如乳头状坏死、蛋白尿、肾衰竭、血尿、夜间遗尿、恒久勃起)和肠胃系统(例如胆石症、胆管病、肝病、肠系膜血管闭塞)。
[0674]
在一些实施例中,所述方法或用途包含给予约1mg至约800mg的剂量。在一些实施例中,所述方法或用途包含给予作为初始固定剂量的约1mg至800mg的剂量。在一些实施例中,所述方法或用途包含给予任选地作为初始固定剂量的以下剂量:约1mg至约2mg、约2mg至约5mg、约5mg至约10mg、约10mg至约20mg、约20mg至约30mg、约30mg至约40mg、约40mg至约50mg、约50mg至约60mg、约60mg至约70mg、约70mg至约80mg、约80mg至约90mg、约90mg至约100mg、约100mg至约150mg、约150mg至约200mg、约200mg至约300mg、约300mg至约400mg、约400mg至约500mg、约500mg至约600mg、约600mg至约700mg或约700mg至约800mg。在一些实施例中,所述方法或用途包含给予约15mg、40mg、100mg、150mg、300mg、500mg或600mg剂量的本发明的抗e-选择素抗体或其抗原结合片段或其医药组合物。在一些实施例中,所述剂量是初始固定剂量。
[0675]
在一些实施例中,所述方法或用途包含给予约150mg剂量的本发明的抗e-选择素抗体或其抗原结合片段或其医药组合物。在一些实施例中,所述方法或用途包含以每周一次给予约150mg剂量的本发明的抗e-选择素抗体或其抗原结合片段或其医药组合物。在一些实施例中,所述方法或用途包含以每周一次皮下给予约150mg剂量的本发明的抗e-选择
素抗体(例如抗体1444)或其抗原结合片段或其医药组合物。
[0676]
在一些实施例中,所述方法或用途包含给予任选地作为初始剂量的约0.01mg/kg至约30mg/kg剂量的本发明的抗体或其抗原结合片段或医药组合物。在所述初始剂量之后可以是一或多个后续剂量。在一些实施例中,一或多个后续剂量可按每周、每隔一周、每三周、每四周、每五周、每六周、每七周、每八周、每九周、每十周、每十一周或每十二周中的至少任一种给予。
[0677]
在初始剂量之后可以是一或多个后续剂量。在一些实施例中,与初始剂量相比,后续剂量是相同剂量、较低剂量或较高剂量的抗e-选择素抗体。在一些实施例中,一或多个后续剂量可按每周、每隔一周、每三周、每四周、每五周、每六周、每七周、每八周、每九周、每十周、每十一周或每十二周中的至少任一种给予。具体剂量方案是涉及避免显著不良副作用的最大剂量或给药频率的剂量方案。
[0678]
本发明的医药组合物还可以经由一或多种给予途径、使用所属领域中已知多种方法中的一或多种来给予。如所属领域的技术人员应了解,给予途径和/或模式将视所需结果而变化。用于本发明的抗体的所选给予途径包括静脉内、肌肉内、皮内、腹膜内、皮下、脊髓或其它肠胃外给予途径,例如通过注射或输注。肠胃外给予可以表示除经肠和局部给予外的通常通过注射的给予模式,且包括但不限于静脉内、肌肉内、动脉内、鞘内、囊内、眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊椎内、硬膜外和胸骨内注射和输注。或者,本发明的组合物可以经由肠胃外途径给予,诸如表面、表皮或经粘膜给予途径,例如鼻内、口服、经阴道、经直肠、舌下或表面。
[0679]
在一些实施例中,静脉内给予本发明的抗e-选择素抗体或其抗原结合片段。在一些实施例中,皮下给予本发明的抗e-选择素抗体或其抗原结合片段。
[0680]
在一些实施例中,以每周一次静脉内或皮下给予本发明的抗e-选择素抗体或其抗原结合片段。在一些实施例中,以每周一次约15mg、约40mg、约100mg、约150mg、约300mg或约600mg的单位剂量给予本发明的抗e-选择素抗体或其抗原结合片段。在一些实施例中,以每周一次约150mg或约500mg的单位剂量静脉内给予本发明的抗e-选择素抗体或其抗原结合片段。
[0681]
在一些实施例中,以每周一次向个体给予本发明的抗e-选择素抗体或其抗原结合片段,且以每天一次、每周一次、每两周一次、每月一次或根据需要向个体给予可以有效治疗和/或预防疾病(例如scd)的至少一种病征和/或症状的治疗活性化合物或治疗方法。本发明提供用于向有需要的个体单独或与其它疗法组合给予包含本发明的抗e-选择素抗体或其抗原结合片段的医药组合物的方案。本发明的组合疗法中的疗法(例如,预防剂或治疗剂)可向个体同时或连续给予。本发明的组合疗法中的疗法(例如,预防剂或治疗剂)也可以循环给予。
[0682]
在一些实施例中,抗e-选择素抗体或其抗原结合片段、或包含其的医药组合物是约一周两次、一周一次、每两周一次、每三周一次、每四周一次、每五周一次、每六周一次、每七周一次、每八周一次、每九周一次、每十周一次、一个月两次、一个月一次、每两个月一次、每三个月一次、每四个月一次、每五个月一次、每六个月一次、每七个月一次、每八个月一次、每九个月一次、每十个月一次、每十一个月一次或每十二个月一次进行给予。
[0683]
在一些实施例中,部分剂量通过静脉内推注给予且其余剂量通过抗体配制物输注
给予。举例来说,抗e-选择素抗体或其抗原结合片段的0.01mg/kg静脉内注射可以推注形式提供,且其余部分的抗体剂量可以通过静脉内注射给予。预定剂量的抗e-选择素抗体或其抗原结合片段可例如在一个半小时至两小时至五小时的时间段内给予。
[0684]
必要时,组合物还可以包括助溶剂和诸如利多卡因(lidocaine)的局部麻醉剂以减轻注射部位的疼痛。另外,也可以采用经肺给予,例如使用吸入器或喷雾器,和具有气雾剂的配制物。参见例如美国专利第6,019,968号、第5,985,320号、第5,985,309号、第5,934,272号、第5,874,064号、第5,855,913号、第5,290,540号和第4,880,078号;和pct公开案第wo 92/19244号、第wo 97/32572号、第wo 97/44013号、第wo 98/31346号和第wo 99/66903号,其各自以全文引用的方式并入本文中。
[0685]
试剂盒
[0686]
本发明还提供一种试剂盒,其包含本文所描述的抗e-选择素抗体或其抗原结合片段中的任一种或全部。本发明的试剂盒包括一或多个包含本文所描述的抗e-选择素抗体或其抗原结合片段的容器,和根据本文所描述的本发明方法中的任一种的使用说明书。一般来说,这些说明书包含对用于上文所描述的治疗性治疗的抗体给予的说明。在一些实施例中,提供试剂盒用于产生单剂量给予单位。在某些实施例中,试剂盒可以含有具有干燥蛋白质的第一容器和具有水性配制物的第二容器。在某些实施例中,包括含有施用器(例如,单室和多室预填充注射器或装置(例如,液体注射器和冷冻干燥物注射器))的试剂盒。
[0687]
在一些实施例中,试剂盒含有包含抗e-选择素抗体或其抗原结合片段的施用器,其中所述施用器被设计成或可接受由患者(例如,患有scd的患者)自我给予。在一些实施例中,自我给予是通过皮下给予。
[0688]
与抗e-选择素抗体或其抗原结合片段的使用相关的说明书一般包括关于用于预期治疗的剂量、给药时程和给予途径(例如皮下或静脉内)的信息。容器可以是单位剂量、散装包装(例如,多剂量包装)或次单位剂量。本发明的试剂盒中所供应的说明书是通常在标签或药品说明书(例如试剂盒中所包括的纸片)上的书面说明书,但机器可读说明书(例如磁化或光学储存盘上载有的说明书)也是可接受的。
[0689]
本发明的试剂盒处于适合包装中。适合的包装包括但不限于小瓶、瓶子、罐、软质包装(例如密封聚酯薄膜(mylar)或塑料袋)等。还涵盖与具体装置,诸如吸入器、经鼻给予装置(例如,雾化器)或输注装置(诸如小型泵)组合使用的包装。试剂盒可以具有无菌进入孔(例如,容器可以是静脉内溶液袋或具有通过皮下注射针可刺穿的塞子的小瓶)。容器还可以具有无菌进入孔(例如,容器可以是静脉内溶液袋或具有可以通过皮下注射针刺穿的塞子的小瓶)。组合物中的至少一种活性剂是本发明的抗e-选择素抗体。容器可以进一步包含额外治疗剂。
[0690]
在一个实施例中,本发明包括一种进一步包含第二治疗活性化合物或治疗方法的试剂盒,其可以在治疗或预防scd的症状方面有效,其中抗e-选择素抗体和第二化合物或治疗方法的量结合在一起在治疗或预防scd的症状方面实现协同作用,即,所述组合是“协同的”(即,所述组合提供比两种或多于两种单独疗法的简单累加作用更大的作用)。所述包含协同组合疗法的试剂盒可有利地利用较低剂量的所给予治疗剂,从而避免与各种单一疗法相关的可能毒性或并发症。
[0691]
在一些实施例中,试剂盒可以进一步包含适用于治疗或预防scd的病征和/或症状
的至少一种额外治疗活性化合物,所述病征和/或症状包括例如:青霉素、羟基尿素(例如droxia、hydrea)、l-谷氨酰胺(例如endari)、立赞利珠单抗(adakveo)、沃西洛特(oxbryta)、阿派沙班(eliquis)、利伐沙班(xarelto)、非类固醇消炎药、镇痛剂(通常是类鸦片镇痛剂)、iw-1701、瑞司瓜特(adempas)、替卡格雷(brilinta)或美金刚胺(namenda)。
[0692]
试剂盒可以任选地提供诸如缓冲剂的额外组分和说明性信息。通常,试剂盒包含容器和在容器上或与容器相关联的标签或药品说明书。
[0693]
本发明还提供诊断试剂盒,其包含本文所描述的抗体或其抗原结合片段中的任一种或全部。诊断试剂盒适用于例如检测样品中的e-选择素的存在。在一些实施例中,诊断试剂盒可以用于鉴别患有潜在疾病、病症或病状的个体,所述疾病、病症或病状可使其处于罹患e-选择素介导的疾病、病症或病状的风险。在一些实施例中,诊断试剂盒可以用于检测疑似患有e-选择素介导的疾病、病症或病状的个体中的e-选择素的存在和/或含量。
[0694]
本发明的诊断试剂盒包括一或多个包含本文所描述的抗e-选择素抗体或其抗原结合片段的容器,和根据本文所描述的本发明方法中的任一种的使用说明书。一般来说,说明书包含对e-选择素抗体或其抗原结合片段的用途的描述,其用于检测处于e-选择素介导的疾病、病症或病状风险下或疑似患有e-选择素介导的疾病、病症或病状(诸如疑似或已知罹患scd的患者中的voc和或与β-珠蛋白的异常形式(包括:hbs、hbc、hbβ
+-地中海型贫血、hbβ
°‑
地中海型贫血或其它hb变异体)相关或由其介导的任何其它病状)的个体中e-选择素的存在。在一些实施例中,例示性诊断试剂盒可以被配置成含有试剂(诸如例如e-选择素抗体或其抗原结合片段)、阴性对照样品、阳性对照样品和使用试剂盒的说明。
[0695]
生物寄存
[0696]
抗e-选择素抗体1444的重链和轻链于2019年12月6日遵循根据布达佩斯条约(budapest treaty)的条款下以美国典型培养物保藏中心(atcc)(弗吉尼亚州马纳萨斯大学路(university boulevard,manassas,va.)10801,20110-2209,usa)寄存。
[0697]
抗体描述atcc寄存编号1444ab 1444-hc(抗体1444的重链)pta-1265291444ab 1444-lc(抗体1444的轻链)pta-126530
[0698]
按照国际承认用于专利程序的微生物寄存布达佩斯条约(budapest treaty on the international recognition of the deposit of microorganisms for the purpose of patent procedure)和其下条例(布达佩斯条约)的规定进行寄存。这确保自寄存日起维持寄存物的活培养物30年。寄存将由atcc遵循布达佩斯条约的条款提供,且受制于辉瑞公司(pfizer)与atcc之间的协定,其确保在相关美国专利发布后或在任何美国或外国专利申请案对公众公布后(以先者为准),公众可永久且无限制地使用寄存物培养物之后代,且确保由美国专利和商标局专员根据35u.s.c.第122节和依据其的专员规则(包括37c.f.r.第1.14节,具体参考886og 638)指定有权享有者可以使用后代。
[0699]
本技术案的受让人已同意,如果在适合条件下培养时,处于寄存的物质的培养物死亡或丢失或破坏,那么将通知以即时用另一相同物质置换所述物质。所寄存物质的可供使用性不应解释为许可以在违反由任何政府部门根据其专利法授予的权利的情况下实践本发明。
[0700]
通用技术
[0701]
应理解,本发明不限于具体合成制备方法,其当然可有所变化。除非本文中另外定义,否则结合本发明使用的科学与技术术语应具有由所属领域的一般技术人员通常理解的含义。另外,除非上下文另外需要,否则单数术语应包括复数且复数术语应包括单数。一般来说,本文所描述的与细胞和组织培养、分子生物学、免疫学、微生物学、遗传学和蛋白与核酸化学和杂交结合使用的命名法和其技术是所属领域中众所周知且常用的那些。
[0702]
除非另外指示,否则本发明的实践将采用分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学的常规技术,其处于此项技术的技术范围内。所述技术在诸如以下的文献中得以充分解释:分子克隆:实验室指南,第二版(萨姆布鲁克等人,1989)冷泉港出版社(cold spring harbor press);寡核苷酸合成(盖特编,1984);分子生物学方法,胡马纳出版社;分子生物学:实验室笔记(赛里斯编,1998),美国学术出版社;动物细胞培养(弗雷谢尼编,1987);细胞和组织培养概论(马瑟和罗伯茨,1998),普尼勒姆出版社;细胞和组织培养:实验室程序(cell and tissue culture:laboratory procedures)(道尔,格里菲斯和内维尔编,1993-1998),约翰威利及其子公司;酶学方法(美国学术出版社);实验免疫学手册(伟尔和布莱克威尔编);用于哺乳动物细胞的基因转移载体(米勒和卡洛斯编,1987);分子生物学现代方法(奥苏贝尔等人编,1987);pcr:聚合酶链反应(pcr:the polymerase chain reaction),(穆利斯等人编,1994);当前免疫学方案(科林根等人编,1991);萨姆布鲁克和罗塞尔(russell),分子克隆:实验室指南第3版,冷泉港实验室出版社,纽约冷泉港(cold spring harbor,ny)(2001);奥苏伯尔(ausubel)等人,分子生物学现代方法,约翰威利及其子公司,纽约(2002);哈洛和莱恩,使用抗体:实验室手册,冷泉港实验室出版社,纽约冷泉港(1998);克林庚(coligan)等人,精简蛋白质科技方案(short protocols in protein science),约翰威利及其子公司,纽约(2003);精编分子生物学方案(威利及其子公司,1999);免疫生物学(珍妮薇和特弗斯,1997);抗体(antibodies)(芬奇,1997);抗体:实践方法(卡蒂编,irl出版社,1988-1989);单克隆抗体:实践方法(谢泼德和迪恩编,牛津大学出版社,2000);使用抗体:实验室手册(哈洛和莱恩(冷泉港实验室出版社,1999);抗体学(萨内蒂和卡帕拉编,哈伍德学术出版社,1995)。
[0703]
酶促反应和纯化技术是根据制造商的说明书,如所属领域中通常所实现或如本文所描述来进行。本文所描述的与分析化学、生物化学、免疫学、分子生物学、合成有机化学、和医学和医药化学结合使用的命名法、和其实验室程序和技术是所属领域中众所周知且常用的那些。标准技术用于化学合成、化学分析、医药制备、配制和递送以及患者治疗。
[0704]
等效物
[0705]
前述描述和以下实例详述本发明的某些具体实施例,且描述本发明人预期的最佳模式。然而,应了解,无论以文字呈现之前述内容如何详细,本发明可以许多方式实践,且本发明应根据所附权利要求书和其任何等效物解释。
[0706]
虽然已参考不同申请案、方法、试剂盒和组合物描述所公开教示内容,但应了解,在不背离本文中的教示内容和下文所要求的本发明情况下可以进行不同变化和修改。提供以下实例以更好地说明本发明的教示内容,且并不意图限制本文中所呈现的教示内容的范畴。尽管已根据这些例示性实施例描述本发明的教示内容,但所属领域的技术人员将容易理解在无不当实验情况下可能对这些例示性实施例进行许多变化和修改。所有所述变化和修改皆在本教示内容的范畴内。
[0707]
本文中所引用的全部参考文献(包括专利案、专利申请案、论文、课本等)和其中所引用的参考文献(就其尚未被引用来说),在此以全文引用的方式并入本文中。在所并入的文献和类似材料中的一或多个(包括但不限于所定义的术语、术语用法、所描述的技术等)与本技术案不同或抵触的情况下,以本技术案为准。
[0708]
实例
[0709]
为了可以更好地理解本发明,阐述以下实例。这些实例仅为实现说明的目的且不应解释为以任何方式限制本发明的范畴。
[0710]
实例1:分离结合于人类e-选择素的大鼠单克隆抗体。
[0711]
使用rappid ip免疫接种方法,用可溶性人类e-选择素细胞外域(uniprot p16581残基22-556;seq id no:133)使史泊格多利大鼠免疫。使用直接结合hrp-elisa,筛选融合瘤上清液的与可溶性人类(id no:133)和小鼠(seq id no:135)e-选择素细胞外域和被截断的人类e-选择素(uniprotkb p16581残基22-178;seq id no:197)和被截断的小鼠e-选择素(uniprotkb q00690残基22-178;seq id no:199)e-选择素的结合。在所述组结合物中,选择与可溶性和被截断的人类e-选择素结合的6种抗体(0039、0158、0159、0164、0170和0180),且选择与可溶性和被截断的小鼠e-选择素结合的一种抗体(0027)。这些七种抗体经选择用于分子克隆和子序列分析。
[0712]
实例2:大鼠抗e-选择素抗体重链和轻链可变区的克隆。
[0713]
使用smartcdna合成系统(加利福尼亚山景城(california,mountain view)的科龙泰克公司(clontech laboratories inc.))克隆结合于人类e-选择素(抗体0039、0158、0159、0164、0170和0180)或小鼠e-选择素(抗体0027)的抗e-选择素抗体的重链(hc)和轻链(lc)可变区,随后进行pcr扩增。使用rneasy试剂盒(凯杰(qiagen))和smartiia寡核苷酸(科龙泰克公司)用superscript
tm iii逆转录酶(英杰),由从大约500,000个融合瘤细胞(对于各纯系0027、0039、0158、0159、0164、0170和0180来说)所分离的1μg总rna合成cdna。接着使cdna通过pcr使用粘接至smartiia寡核苷酸序列的引子和大鼠恒定区特异性引子(对于轻链是大鼠κ,和对于重链是大鼠igg1)、用q5高保真2倍预混液(high-fidelity 2x master mix)(纽英伦公司(new england biolabs inc.))进行扩增。将重链和轻链pcr产物次克隆到pcr4-topo载体(英杰)中且测定核酸序列。此方法是有利的,因为不需要关于所述dna序列的先前知识。此外,不通过使用简并pcr引子来改变所得dna序列。
[0714]
将可变重链区(抗体0039的vh(seq id no:60的氨基酸序列)、抗体0158的vh(seq id no:75的氨基酸序列)、抗体0159的vh(seq id no:90的氨基酸序列)、抗体0164的vh(seq id no:35的氨基酸序列)、抗体0170的vh(seq id no:104的氨基酸序列)、抗体0180的vh(seq id no:118的氨基酸序列)和抗体0027的vh(seq id no:128的氨基酸序列))克隆到含有被突变以消除效应功能的人类igg1恒定区的ptt5哺乳动物表达载体(leu234ala、leu235ala和gly237ala,eu编号;美国专利案第5,624,821号)(seq id no:15的氨基酸序列)中,从而产生嵌合重链。将可变轻链区(抗体0039的vl(seq id no:57的氨基酸序列)、抗体0158的vl(seq id no:73的氨基酸序列)、抗体0159的vl(seq id no:87的氨基酸序列)、抗体0164的vl(seq id no:32的氨基酸序列)、抗体0170的vl(seq id no:102的氨基酸序列)、抗体0180的vl(seq id no:116的氨基酸序列)和抗体0027的vl(seq id no:122的氨基酸序列))克隆到含有人类κ恒定区的ptt5哺乳动物表达载体(seq id no:14的氨基酸序列)
中,从而产生嵌合轻链。
[0715]
实例3:抗e-选择素抗体的结合和中和。
[0716]
抗e-选择素抗体与人类(seq id no:133加10his纯化尾端的氨基酸序列)和小鼠(seq id no:135的氨基酸序列加10his纯化尾部)e-选择素细胞外域的结合是使用重组抗原结合elisa与hpr检测来测量。384孔maxisorp培养盘用于捕捉人类和小鼠的被his标记的重组e-选择素多肽。将多肽与不同浓度的嵌合抗体一起培育且用被hrp标记的抗人类igg1抗体检测。抗体0039、0158、0159、0164、0170和0180分别以0.02nm、0.03nm、0.02nm、0.02nm、0.01nm和0.01nm的ec
50
结合于人类e-选择素。这些抗体中无一者以》133nm的ec
50
结合于小鼠e-选择素。抗体0027以0.02nm的ec
50
结合于小鼠e-选择素,但不以》133nm的ec
50
结合于人类e-选择素。
[0717]
在alphalisa均质竞争分析中测量抗e-选择素抗体的中和能力。此处抗体针对人类e-选择素细胞外域(seq id no:133的氨基酸序列加10his纯化尾部)、小鼠e-选择素细胞外域(seq id no:135的氨基酸序列加10his纯化尾部)或食蟹猕猴e-选择素细胞外域(seq id no:175的氨基酸序列加10his纯化尾部)与唾液酸-路易斯a配体的相互作用而竞争。对于此实验,将1μl抗体添加至384孔培养盘的孔中,随后添加1μl唾液酸路易斯a-paa-生物素,直到最终浓度为1.75nm。将此盘在室温下培育15分钟,随后添加1.4μl人类、小鼠或食蟹猕猴e-选择素,直到最终浓度为7nm。将此盘再次在室温下培育15分钟。为此,为了使最终分析浓度是10μg/ml,添加1.4μl alphalisa珠粒(ni供体/sa受体)。将此盘于暗处在室温下培育至少10小时。接着使用alphalisa方案(易美逊(envision))读取培养盘。
[0718]
针对嵌合抗e-选择素抗体0027、0158、0159、0164、0170和0180,测量人类、小鼠和食蟹猕猴e-选择素的中和的ec
50
。抗体0039、0158、0159、0164、0170和0180对于人类e-选择素的ec
50
值《1nm,而抗体0027并未中和人类e-选择素且其ec
50
》133nm。抗体0158、0159、0164、0170和0180对于食蟹猕猴e-选择素的ec
50
值《1nm,抗体0039对于食蟹猕猴e-选择素的ec
50
值》63nm,且抗体0027并未中和食蟹猕猴e-选择素且其ec
50
》133nm。抗体0027对于小鼠e-选择素的ec
50
值是1nm,而抗体0039、0158、0159、0164、0170和0180并未中和小鼠e-选择素且其ec
50
》133nm(表4)。
[0719]
表4.使用hrp结合elisa和alphalisa中和分析的抗e-选择素嵌合抗体对于人类、小鼠和食蟹猕猴e-选择素的结合和中和。
[0720][0721]
实例4:使用表面等离子共振(spr)来对抗e-选择素进行动力学评估。
[0722]
制备人类(seq id no:133的氨基酸序列)、小鼠(seq id no:135的氨基酸序列)和食蟹猕猴(seq id no:175的氨基酸序列)e-选择素细胞外域蛋白质。各蛋白质含有用于纯
化的c端10残基组氨酸标签。抗人类fc传感器芯片是根据制造商方案通过抗人类igg抗体(目录号br-1008-39,通用电气医疗集团)与被羧基甲基化聚葡萄糖涂布的传感器芯片(cm5)(目录号br100530,通用电气医疗集团)的所有四个流槽的胺偶合来制备。通过以10μl/分钟的流动速率注射400mm 1-乙基-3-(3-二甲基氨丙基)碳化二亚胺盐酸盐(edc)和100mm n-羟基丁二酰亚胺(nhs)的1:1混合物持续7分钟来使流槽活化。抗人类igg抗体在10mm乙酸钠(ph 5.0)中稀释至25μg/ml且以10μl/分钟在所有流槽中注射7分钟。以10μl/分钟用1m乙醇胺-hcl(eth)阻断所有流槽7分钟。捕捉抗体的最终固定含量是大约10,000共振单位(ru)。用于固定化和动力学的操作缓冲液是hbs-ep+(10mm 4-(2-羟乙基)-1-哌嗪乙磺酸(hepes)(ph 7.4)、150mm氯化钠、3mm乙二胺四乙酸(edta)、0.05%(v/v)tween-20)。
[0723]
为了表征抗体与人类、食蟹猕猴和小鼠e-选择素的结合,将抗体于hbs-ep+中稀释至0.5μg/ml,且在10μl/分钟的流动速率下通过固定于流槽2、3和4上的抗人类igg捕捉30秒至1分钟以实现70至300ru的捕捉含量。流槽1用作参考表面。在抗体捕捉之后,使流动速率增加至50μl/分钟,且在缔合期间将在hbs-ep+中浓度范围为15nm至405nm的缓冲液或e-选择素蛋白质在所有流槽中注射1.0分钟,且接着使其解离6至15分钟。针对所捕捉的各抗体收集的hbs-ep+缓冲液循环用于双参考(迈斯卡(myszka dg.),分子识别杂志(j.mol.recognition)1999;12(5):279-84)。在各循环结束时,整个抗igg表面通过30秒3m mgcl2的脉冲和30秒离子缓冲液脉冲(1.83m mgcl2、0.92m脲、1.83m盐酸胍,ph 7.4)再生(安德森(andersson k.),分析化学(analy.chem.)1999;71(13):2475-81)。在biacore
tm t200仪器(通用电气医疗集团)上以10赫兹(hz)的收集速率在25℃下进行动力学分析。速率常数和亲和力通过在biacore
tm t200评估软件3.0版(通用电气医疗集团)中将数据拟合至1:1结合模型来确定。
[0724]
通过首先使抗体与固定化抗人类igg结合,测定抗体0039、0158、0159、0164、0170和0180对于人类和食蟹猕猴e-选择素以及抗体0027对于小鼠e-选择素的结合亲和力。在抗体捕捉之后,使e-选择素蛋白质的稀释物流过,且测定结合于人类、食蟹猕猴和小鼠e-选择素的缔合速率常数(ka)、解离速率常数(kd)、t1/2和kd值(表5-7)。在此spr分析中,抗体0039、0158、0159、0164、0170和0180对于人类e-选择素的亲和力(kd)分别是68.0nm、21.6nm、324nm、54.4nm、628nm和2940nm。嵌合抗体0039、0159、0164、0170和0180对于食蟹猕猴e-选择素的亲和力kd分别是45.8nm、243.5nm、45.4nm、492nm和3145nm。抗体0158未显示结合于食蟹猕猴e-选择素。嵌合抗体0027对于小鼠e-选择素的亲和力kd是1.2nm。
[0725]
表5.通过表面等离子共振测量的抗e-选择素抗体对于人类e-选择素的亲和力。
[0726][0727]
表6.通过表面等离子共振测量的抗e-选择素抗体对于食蟹猕猴e-选择素的亲和力。
[0728][0729][0730]
nd:未检测到
[0731]
表7.通过表面等离子共振测量的抗小鼠e-选择素抗体对于小鼠e-选择素的亲和力。
[0732][0733]
实例5:在静态结合分析中对抗e-选择素抗体的配体结合的中和。
[0734]
在静态中和分析中使用竞争酶联免疫吸附分析(elisa)评估抗e-选择素抗体中和配体结合的能力,以评估唾液酸路易斯抗原与被工程改造成表达e-选择素的中国仓鼠卵巢细胞(cho)的中和。
[0735]
简单来说,使表达人类e-选择素的cho细胞在培养基(最低必需培养基(mem)alpha培养基,补充有10%被透析的胎牛血清、100nm甲氨蝶呤和100单位/ml青霉素和100单位/ml链霉素)中生长且以12,500个细胞/孔接种至96孔组织培养盘中且在37℃、5%co2下培育48小时以形成汇合单层。随后用200μl不含钙镁的磷酸盐缓冲盐水(pbs)洗涤培养盘两次。在存在用生物素标记的唾液酸路易斯a聚丙烯酰胺(卡博森斯有限公司(carbosynth llc);os45446)与抗生蛋白链菌素/辣根过氧化酶的小型合成结合物(总计100μl)的情况下,向分析中添加抗e-选择素抗体0039、0158、0159、0164、0170和0180或igg1同型对照物,且在37℃、5%co2下培育2小时。接着用200μl不含钙镁的pbs洗涤培养盘两次。在培育之后,将细胞用200μl含有2mm氯化钙(50mm三氨基甲烷[tris]、150mm氯化钠;0.05%聚山梨醇酯20,ph 7.4;2mm氯化钙)的洗涤缓冲液洗涤两次。通过添加100μl的1-step ultra tmb底物(赛默科技公司,34028)且在室温下培育30分钟来产生信号。使用2m硫酸使反应停止且在450nm下读取吸光度(spectramax m5e)。使用graphpad prism软件(8.0.2版)分析且图示数据。所估计的半最大抑制浓度(ic
50
)值从所述分析推导出(表8)。
[0736]
所测试的抗体以剂量依赖性方式中和配体与细胞表面表达的人类e-选择素的结合。在中和分析中对于嵌合抗体0039、0164、0158、0159、0170和0180的所估计的ic
50
值分别是3.76nm、2.77nm、2.87nm、3.24nm、2.3nm和3.83nm。抗体0027并未中和结合于细胞表面表达的人类e-选择素的唾液酸路易斯a聚丙烯酰胺配体的结合。人类igg对照抗体在这些分析中并未展现效应。
[0737]
实例6:在抗e-选择素抗体的静态粘着分析中抑制细胞结合。
[0738]
评估嵌合抗e-选择素抗体0039、0164、0158、0159、0170和0180在静态条件下抑制
表达e-选择素配体的细胞对于表达人类e-选择素的cho细胞的粘着的能力。
[0739]
将表达人类e-选择素的cho细胞在alpha培养基(最低必需培养基[mem])alpha培养基,康宁(corning))/10%被透析的胎牛血清(吉布科(gibco))/100单位/ml青霉素和100μg/ml链霉素(streptomycin)(吉布科(gibco))/100nm甲氨蝶呤中培养且在37℃下、在5%co2和95%湿度任选地维持。将hl-60细胞(表达e选择素配体、psgl-1和其它唾液酸路易斯配体的人类前髓细胞细胞系)在37℃下、在5%co2和95%湿度任选地维持于rpmi/谷氨酰胺生长培养基(吉布科)/10%胎牛血清(吉布科)/100单位/ml青霉素和100μg/ml链霉素(吉布科)中。将表达人类e-选择素的cho细胞以11,500个细胞/孔的密度接种于96孔平底黑色培养盘中且在含湿气培育箱中在37℃、5%co2和95%空气下培育48小时以形成汇合单层。
[0740]
对于静态粘着中和分析,使处于对数期的hl-60细胞在pbs中洗涤三次且再悬浮于500μl的pbs和相等体积的2μm羧基荧光素二乙酸丁二酰亚胺酯荧光染料[(cfse)(themofisher)]中。将细胞在室温下于暗处培育10分钟。通过在冰上添加4ml冷hl-60生长培养基持续5分钟来使标记停止。将被标记的hl-60细胞在hanks平衡盐溶液(hbss)/1%牛血清白蛋白(bsa)/0.1%叠氮化钠中洗涤三次,以400,000个细胞/ml的密度再悬浮以用于静态粘着分析。
[0741]
在hbss/1%bsa/0.1%叠氮化钠中连续稀释抗e-选择素嵌合抗体0039、0164、0158、0159、0154、0170和0180,阴性对照抗p-选择素抗体和对照人类igg(浓度范围为1333nm至1.83nm)。对于各抗体,未制备抗体对照物。将e-选择素cho细胞单层用hbss/1%bsa/0.1%叠氮化钠温和地洗涤三次,且将100μl细胞悬浮液添加至孔中且在冰上培育一小时。每孔添加五十微升(20,000个)被cfse标记的hl-60细胞,而不去除抗体。将被标记的hl-60细胞与cho细胞单层一起在37℃下、5%co2和95%空气下于含湿气培育箱中培育1小时。将培养盘用hbss/1%bsa/0.1%叠氮化钠洗涤三次,添加100μlhbss/1%triton-x100且于暗处培育10分钟。结合的hl-60细胞的荧光是在494/521纳米的激发/发射波长下使用spectramax i3x(分子装置)测量以测定粘着的hl-60细胞的数量。使用来自无细胞对照孔的信号减去背景结合且使用人类igg对照物测定粘着率%是100%。在graphpad prism套件中确定所估计的ec
50
值。
[0742]
在静态粘着条件下,抗体0158和0164在16.5nm下以》50%的抑制率抑制hl-60细胞对于表达人类e-选择素的cho细胞的粘着。抗体0159在49.4nm下以》50%的抑制率抑制hl-60细胞对于表达人类e-选择素的cho细胞的粘着。抗体0170和0180在444nm下以》50%的抑制率抑制hl-60对于表达人类e-选择素的cho细胞的粘着。浓度为最多1333nm的抗体0039并未抑制hl-60细胞对于表达人类e-选择素的cho细胞的粘着。阴性对照抗体并未抑制hl-60细胞的粘着(表8)。
[0743]
实例7:抗e-选择素抗体的细胞表面结合(facs)。
[0744]
使用荧光活化细胞分选(facs)评估抗体与被工程改造成表达e-选择素或p-选择素的细胞的结合。还评估与食蟹猕猴的物种交叉反应性。
[0745]
将表达人类e-选择素或p-选择素的cho细胞在补充有10%被透析的胎牛血清(吉布科)、100单位/ml青霉素和100μg/ml链霉素(吉布科)的alpha培养基(最低必需培养基[mem])alpha培养基,康宁)中培养。对于表达人类e-选择素的cho细胞,生长培养基还补充有100nm甲氨蝶呤。将表达食蟹猕猴e-选择素的cho细胞在补充有10%热灭活胎牛血清(吉
布科)、100单位/ml青霉素和100μg/ml链霉素和125μg/ml吉欧霉素(zeocin)(吉布科)的r1培养基(ri杜氏改善伊格尔培养基/哈姆氏f12改善(ri dulbecco'smodifies eagle's medium/ham's f12 modification))中培养。将细胞于含湿气培育箱中在37℃、5%co2和95%空气下维持于生长培养基中。在培养进行实验之前,自培养基去除甲氨蝶呤或吉欧霉素。使用柠檬酸盐水(135mm kcl、15mm柠檬酸钠)从t-150烧瓶分离cho-e选择素细胞或p-选择素细胞,且通过将cacl2添加至所分离细胞中立即再钙化,直至最终浓度为1mm。紧接着将生长培养基添加至被分离的细胞中,接着在室温下以300
×
g离心5分钟以集结细胞。在湿冰上将细胞接种于96孔v底培养盘中,置于低温cho缓冲液中,持续5分钟,所述缓冲液由磷酸盐缓冲盐水(pbs)组成,ph是7.4,含有最终浓度为1%的牛血清白蛋白(bsa;西格玛奥德里奇公司)、最终浓度为1mm的氯化钙和最终浓度为0.1%的叠氮化钠。在培育之后,将细胞在4℃下以300
×
g离心2分钟以去除缓冲液。
[0746]
使用cho缓冲液作为稀释剂用连续稀释液(在1333.3nm至0.0022nm范围内)制备测试抗体溶液,且添加100μl且在指定体积的被连续稀释的抗体中培育且在冰上培育45分钟。在培育之后,去除抗体,且使细胞在4℃下通过以300
×
g离心1分钟来洗涤细胞三次且再悬浮于低温cho缓冲液中。将被洗涤的细胞在湿冰上与100μl的1:1000稀释的apc结合的亲和纯化f(ab')2片段山羊抗人类igg,fcγ(艾美捷(jackson immunoresearch))一起培育30分钟。将细胞洗涤三次或四次,随后使其再悬浮于cho缓冲液中用于流式细胞测量分析。将使用640纳米激光线的becton dickinson lsrfortessa仪器用于获取细胞荧光数据。通过flowjo套装软件(弗洛跃有限公司(flowjo,llc))分析细胞的几何平均荧光且相对于抗体浓度进行绘制。在prism套件(格拉夫帕德,8版)中使用非线性回归分析计算所估计的ec
50
值(表8)。
[0747]
嵌合抗体0039、0164、0158、0159、0154、0170和0180展现以1.99nm至4.99nm范围内的所估计的ec
50
值与cho细胞上细胞表面表达的人类e-选择素的结合(表8)。抗体0039、0164、0158、0159、0170和0180以3.37至13.98范围内的所估计的ec
50
值还结合于表达食蟹猕猴e-选择素的cho细胞。抗体0164、0158、0159、0154、0170和0180并未结合于cho表达的人类p-选择素,指示针对e-选择素的选择率。抗体0039展现以》354nm的所估计的ec
50
值与cho表达的人类p-选择素的极小结合。
[0748]
表8.抗e-选择素抗体的细胞结合和中和。
[0749][0750]
实例8:使用生理流动分析的抗e-选择素抗体的离体中和
[0751]
在生理流动条件下使用bioflux
tm
系统(弗洛欣(fluxion),美国加利福尼亚圣弗朗西斯科(san francisco,ca,usa))使用bioflux
tm
培养盘/腔室(弗洛欣生物科学公司(fluxion biosciences),48孔低剪切,0-20达因/cm2;910-0004)分析离体细胞粘着。使用重组纯化的可溶性e-或p-选择素蛋白质和人类hl-60细胞(atcc ccl-240)进行粘着分析。hl-60细胞表达e选择素配体、psgl-1和其它唾液酸路易斯配体。将hl-60细胞在37℃、在5%co2和95%湿度任选地维持于具有10%胎牛血清(吉布科)、1
×
青霉素/链霉素(吉布科)的rpmi/谷氨酰胺生长培养基(吉布科)中。将细胞在37℃下维持,随后灌注且在室温下进行bioflux
tm
分析。首先,是模拟被活化的内皮细胞的表面,使流动腔室涂布有等量的人类e-选择素可溶性重组蛋白和p-选择素可溶性重组蛋白。使bioflux
tm
流动微通道涂布有10μg/ml的可溶性重组人类p-选择素(安迪公司(r&d systems),adp3)和e-选择素(安迪公司,adp1)中的各者,所述选择素于pbs中制备,以1达因/cm2灌注5分钟,在室温下培育1小时并以1达因/cm2用pbs洗涤3-5分钟。将e-选择素嵌合抗体0039、0158、0159、0164、0170和0180在pbs中稀释且将培养盘以1达因/cm2用测试物品(浓度是1.6至1000nm)或媒剂对照物处理1小时。将hl-60细胞在1000rpm下离心5分钟,用钙黄绿素(calcein)am(钙黄绿素;life technologies
tm
;c3099)染色30分钟,用磷酸盐缓冲盐水(pbs;吉布科)洗涤两次,且在pbs中再悬浮直至浓度是约3
×
106个细胞/ml。还将被稀释的抗体储备液添加至细胞悬浮液中,随后在流动腔室中进行灌注。在各通道中以1达因/cm2的生理剪切流量对hl-60细胞的100μl的等分试样进行灌注10分钟。以1达因/cm2灌注pbs持续2-3分钟以去除非粘着细胞。观察粘着细胞且使用具有40倍放大率的nikon eclipse ti-s(nis-elements br 3.2 64位)倒置级相位对比荧光显微镜对其进行计数。使细胞计数相对于磷酸盐缓冲液媒剂对照物进行标准化。各实验具有两个孔/条件。使用graphpad prism(8.0.2)图示且分析数据。所估计的半最大抑制浓度(ic
50
)值从所述分析推导出。
[0752]
在这些被设计成模拟离体经由血管结构的血流的研究中,e-选择素抗体0039、0164、0158、0159、0170和0180分别以264.7nm、1.7nm、17.9nm、21nm、74.2nm和224.7nm的所估计的ic
50
值中和hl-60细胞对于可溶性重组e-选择素蛋白质的粘着(表9)。
[0753]
表9.对hl-60在生理流动下结合于可溶性人类e-选择素蛋白质的中和。
[0754][0755]
实例9:抗e-选择素抗体的抗原决定基分组
[0756]
基于竞争分析,使用octet生物传感器将六种中和嵌合抗体(0039、0158、0159、0164、0170和0180)分组成抗原决定基组。将被抗人类fc(ahc)涂布的尖端转移至含有20μg/ml的七个抗体中的一个的孔持续600秒,以允许第一抗体结合于抗人类fc。将尖端转移至具有300nm人类e-选择素细胞外域(seq id no:133加10his纯化尾部)的第二孔且使其缔合100秒。最后,将尖端转移至含有第二抗体的第三孔中持续100秒。如果第二抗体显示生物传感器信号的增加高于第一抗体产生的生物传感器信号,那么将抗体评估为非竞争性的,且如果第二抗体不产生信号的额外增加,那么将其评估为竞争性的(表10)。
[0757]
基于这些竞争数据,抗体0159、0164、0170和0180定义一个抗原决定基组,0158定义第二抗原决定基组和0039定义第三抗原决定基组。第一组与第二组部分重叠,第二组与第三组部分重叠,且第一组与第三组并不重叠。在表10中,“+”指示在第一抗体(由列标题指示)存在下所结合的第二抗体(由行标题指示)。
“‑”
指示在添加第二抗体后信号的未增加。
[0758]
表10.通过octet生物传感器进行的抗il-e-选择素抗体的抗原决定基分组
[0759][0760]
实例10:晶体结构和抗原决定基
[0761]
通过用番木瓜蛋白酶使全长igg裂解且使用蛋白a树脂去除fc来获得抗e-选择素嵌合抗体0164的fab片段。以1:1摩尔比将fab与被截短的人类e-选择素(描述于实例1中)混合且通过尺寸排阻色谱(sec)纯化所得复合物。复合物晶体形成于200mm乙酸钙(ph 7.5)、20%peg 3350中。在先进光子源中,在光束线17-id处收集的数据。通过分子置换解析结构并精确至0.243/0.252的r/rfree(图1)。晶体结构在空间群p3121的不对称单元中具有结合于单个0164fab片段的单个e-选择素拷贝。
[0762]
基于晶体结构,与抗体0164相互作用的e-选择素的残基是基于以下而确定:i)内的残基,ii)由于0164抗体残基和e-选择素残基对之间的相互作用而内埋的标准化表面积iii)盐桥的形成,iv)氢键的形成或v)水介导的氢键的形成。编号是基于成熟人类e-选择素序列(seq id no:132)的残基的列表包括t7、e8、a9、m10、t11、p46、s47、y48、n82、n83、q85、e88、e92、y94、r97、n105、e107、r108、s110、k111、k112和k113(表11)。
[0763]
e-选择素与其天然配体唾液酸-路易斯x(slex)通过x射线晶体分析法的相互作用显示于pdb结构(1g1t)中(参见www.rcsb.org/structure/1g1t)。在此结构中,基于seq id no:132的编号,在的slex内且类似于与抗体0164的相互作用的e-选择素残基是y48、n82、n83、e92、y94、r97、n105和e107。也在3.8埃的slex内的其它残基是e80、e98和d106(基于seq id no:132的编号)。鉴于slex和抗体0164的抗原决定基显著重叠,可能由此抗体证明的中和活性是直接阻断slex和其它类似配体(如唾液酸-路易斯a(slea))与e-选择素的相互作用的结果。
[0764]
表11.e-选择素与抗e-选择素抗体0164或slex的相互作用。
[0765][0766]
实例11:大鼠抗e-选择素抗体的人类化
[0767]
中和大鼠嵌合抗体0039、0158、0159、0164、0170和0180的人类化版本由互补决定区(cdr)移植(在下文被称为“由cdr移植”)生成。对于抗体0039、0158、0164和0180,将重链cdr移植至人类dp-54构架区(vh3子组)。人类化抗体0039含有大鼠氨基酸残基,包括位置48处的甲硫氨酸、位置49处的甘氨酸和位置78处的缬氨酸。人类化抗体0158含有大鼠氨基酸残基,包括位置24处的缬氨酸、位置48处的甲硫氨酸、位置49处的甘氨酸、位置73处的苏氨酸和位置78处的缬氨酸。人类化抗体0164含有大鼠氨基酸残基,包括位置71处的丙氨酸、位置78处的丙氨酸和位置94处的甲硫氨酸。人类化抗体0180含有大鼠氨基酸残基,包括位置48处的异亮氨酸、位置49处的甘氨酸、位置69处的亮氨酸、位置71处的丝氨酸、位置73处的苏氨酸、位置78处的丙氨酸和位置94处的异亮氨酸。
[0768]
对于抗体0159,将重链cdr移植至dp-7构架区(vh1子组)。人类化抗体0159含有大
选择素的亲和力分别是92.85nm和138.5nm。
[0780]
表13.通过表面等离子共振测量的抗e-选择素抗体对于人类和食蟹猕猴e-选择素的亲和力。
[0781][0782]
实例13:人类化抗e-选择素抗体(0841)的细胞表面结合(facs)
[0783]
使用关于被工程改造成表达e-选择素的细胞的流式细胞测量术(facs)来评估抗体结合。还评估与食蟹猕猴的物种交叉反应性。
[0784]
将表达人类e-选择素的cho细胞在补充有10%被透析的胎牛血清(吉布科)、培养基(吉布科)中的100单位/ml青霉素和100μg/ml链霉素的alpha培养基(最低必需培养基[mem])alpha培养基,康宁)中培养。对于表达人类e-选择素的cho细胞,生长培养基还补充有100nm甲氨蝶呤。将表达食蟹猕猴e-选择素的cho细胞在补充有10%热灭活胎牛血清(吉布科)、100单位/ml青霉素和100μg/ml链霉素和125μg/ml吉欧霉素(吉布科)的r1培养基(ri杜氏改善伊格尔培养基/哈姆氏f12改善)中培养。将细胞于含湿气培育箱中在37℃、5%co2和95%空气下维持于生长培养基中。在培养进行实验之前,从培养基去除甲氨蝶呤或吉欧霉素。使用柠檬酸盐水(135mm kcl、15mm柠檬酸钠)从t-150烧瓶分离cho-e选择素细胞,且通过将cacl2添加至所分离细胞中而立即再钙化直到最终浓度为1mm。紧接着将生长培养基添加至被分离的细胞中,接着在室温下以300
×
g离心5分钟以集结细胞。在湿冰上将细胞接种于96孔圆底培养盘中,置于低温cho缓冲液中,持续5分钟,所述缓冲液由磷酸盐缓冲盐水(pbs)组成,ph是7.4,含有最终浓度为1%的牛血清白蛋白(bsa;西格玛奥德里奇公司)、最终浓度为1mm的氯化钙和最终浓度为0.1%的叠氮化钠。在培育之后,将细胞在4℃下以300
×
g离心2分钟以去除缓冲液。
[0785]
使用cho缓冲液作为稀释剂用连续稀释液(在1333.3nm至0.0022nm范围内)制备测试抗体溶液,在指定体积的经连续稀释的抗体中添加100μl且在冰上培育45分钟。在培育之后,去除抗体,且使细胞在4℃下通过以300
×
g离心1分钟来洗涤细胞三次且再悬浮于低温cho缓冲液中。将被洗涤的细胞再悬浮且在湿冰上与100μl的1:1000稀释的apc结合的亲和纯化f(ab')2片段山羊抗人类igg,fcγ(艾美捷)一起培育30分钟。将细胞洗涤三次或四次,随后使其再悬浮于cho缓冲液中用于流式细胞测量分析。将使用640纳米激光线的becton dickinson lsrfortessa仪器用于获取细胞荧光数据。通过flowjo套装软件(弗洛跃有限公司)分析细胞的几何平均荧光且相对于抗体浓度进行绘制。在graphpad prism套件中使用非线性回归分析计算所估计的ec
50
值。
[0786]
人类化抗体0841与表达于cho细胞表面上的人类和食蟹猕猴e-选择素的结合在分别是1.62和1.54nm的所估计的ec
50
值的情况下是类似的(表14)。相同分析中抗体0164的所估计的ec
50
值类似于cho表达的人类和食蟹猕猴e-选择素的所估计的ec
50
值(分别是1.39和1.73nm)(表14)。
[0787]
实例14:对配体结合于表达人类或食蟹猕猴e-选择素的cho细胞的人类化抗e-选择素抗体中和
[0788]
在静态配体细胞粘着分析中,辣根过氧化酶(hrp)结合e-选择素配体且e-选择素抗体竞争结合于中国仓鼠卵巢(cho)细胞上表达的人类或食蟹猕猴e-选择素。在静态中和分析中使用竞争酶联免疫吸附分析(elisa)评估抗e-选择素抗体中和配体结合的能力,以评估唾液酸路易斯抗原与被工程改造成表达人类或食蟹猕猴e-选择素的中国仓鼠卵巢细胞(cho)的中和。
[0789]
将表达人类e-选择素的cho细胞在培养基(补充有10%被透析的胎牛血清、100nm甲氨蝶呤和100单位/ml青霉素和100μg/ml链霉素的最低必需培养基(mem)alpha培养基)中生长,且将表达食蟹猕猴e-选择素的cho细胞在补充有10%热灭活胎牛血清(吉布科)、100单位/ml青霉素和100μg/ml链霉素和125μg/ml吉欧霉素(吉布科)的r1培养基(ri杜氏改善伊格尔培养基/哈姆氏f12改善)中培养。将表达e-选择素的cho细胞以12,500个细胞/孔接种至96孔组织培养盘中且在37℃、5%co2下培育48小时以形成汇合单层。随后用200μl不含钙镁的pbs洗涤培养盘两次。在存在用生物素标记的唾液酸路易斯a聚丙烯酰胺(卡博森斯有限公司,os45446)或唾液酸路易斯x聚丙烯酰胺(格莱克公司(glycotech),01-045)与抗生蛋白链菌素/辣根过氧化酶的小型合成结合物(总计100μl)的情况下,向分析中添加抗e-选择素抗体或igg1同型对照物,且在37℃、5%co2下培育2小时。接着用200μl不含钙镁的pbs洗涤培养盘两次。在培育之后,将细胞用200μl含有2mm氯化钙(50mm三氨基甲烷[tris]、150mm氯化钠;0.05%聚山梨醇酯20,ph 7.4;2mm氯化钙)的洗涤缓冲液洗涤两次。通过添加100μl的1-step ultra tm
b底物(赛默科技公司(thermo scientific),34028)且在室温下培育30分钟来产生信号。使用2m硫酸使反应停止且在450nm下读取吸光度(spectramax m5e)。使用graphpad prism软件(8.0.2版)分析且图示数据。所估计的半最大抑制浓度(ic
50
)值从所述分析推导出。
[0790]
通过人类化抗体0841的对唾液酸路易斯配体结合于表达于cho细胞表面上的人类和食蟹猕猴e-选择素的中和在分别是3.81和1.74nm的所估计的ic
50
值的情况下是类似的(表14)。相同分析中0164的所估计的ic
50
值类似于cho表达的人类和食蟹猕猴e-选择素的所估计的ic
50
值(分别是5.17和2.00nm)。
[0791]
实例15:在生理流动下对细胞粘着的人类化抗e-选择素抗体中和
[0792]
进行离体细胞滚动/粘着研究以评估抗体0841和0164的效力和中和活性,从而使用生理流动系统抑制hl-60细胞对于cho-人类e-选择素细胞的粘着。
[0793]
将cho-人类e-选择素细胞在37℃下、在5%co2和95%湿度任选地维持于alpha培养基/10%被透析的胎牛血清(吉布科)/青霉素/链霉素(1
×
)和100nm甲氨蝶呤中。使bioflux
tm
培养盘以1达因/cm2的流动速率涂布有50μg/ml于pbs中的纤维结合蛋白且在室温下培育1小时。表达人类e-选择素的中国仓鼠卵巢细胞(人类cho-e-选择素细胞)被制备成用于通过在37℃下以1:1比率处理0.05%胰蛋白酶-乙二胺四乙酸(edta)和stempro阿库酶(accutase)(吉布科;a1110501)5分钟的分析,用等体积的生长培养基中和,加以收集,以1000rpm离心5分钟且使其再悬浮,直至在生长培养基中的最终浓度为约30
×
106个细胞/ml。将培养盘在室温下用cho-人类e-选择素生长培养基以1达因/cm2灌注两次持续2-3分钟。去除所有培养基且以3-4达因/cm2灌注30μl的cho-人类e-选择素细胞(处于30
×
106个细胞/ml)持续25秒。自仪器移出培养盘且在37℃下在5%co2培育箱中培育1小时。去除培养基且添加500μl新鲜生长培养基,且在37℃下在5%co2培育箱中培育细胞过夜。培育之后,在
具有新鲜生长培养基的bioflux仪器上洗涤(3-4达因/cm2)cho-e单层。将pbs中的抗体0841(连续稀释液)、同型对照抗体和igg1对照抗体(200nm)以及媒剂对照物以1达因/cm2灌注1小时。
[0794]
将hl-60细胞在37℃、在5%co2和95%湿度任选地维持于具有10%胎牛血清(吉布科)和1
×
青霉素/链霉素(吉布科)的rpmi/谷氨酰胺生长培养基(吉布科)中。在灌注之前将细胞维持在37℃下。将hl-60细胞在1000rpm下离心5分钟,用钙黄绿素am(life technologies
tm
;c3099)染色30分钟,用磷酸盐缓冲盐水(pbs;吉布科)洗涤两次,且在pbs中再悬浮直到浓度为约3
×
106个细胞/ml。还将被稀释的抗体储备液添加至细胞悬浮液中,随后在流动腔室中进行灌注。在各通道中以1达因/cm2的生理剪切流量对hl-60细胞的100μl的等分试样加抑制剂进行灌注10分钟。将pbs以1达因/cm2灌注2-3分钟以去除非粘着细胞,且使培养盘成像且加以分析。分析是在室温下进行。
[0795]
抗体0841和0164在生理流动条件下分别以4.17和3.73nm的所估计的ic
50
值抑制hl-60细胞对于表达人类e-选择素的cho细胞的中和(表14)。
[0796]
表14.通过抗体0841和0164的结合和中和。
[0797][0798]
实例16:人类化抗e-选择素的生物物理表征
[0799]
热稳定性
[0800]
将差示扫描量热法用于确定人类化抗体0841(包含seq id no:22的hc氨基酸序列和seq id no:17的lc氨基酸序列)的稳定性。对于此分析,将处于0.3mg/ml的样品通过自动取样器(马尔文仪器公司(malvern instruments,inc.))分配至microcal vp-毛细管dsc的样品盘中,在10℃下平衡5分钟,且接着以每小时100℃的速率扫描直到110℃。选择16秒的过滤期。将原始数据进行基线校正且将蛋白质浓度标准化。origin软件7.0(奥瑞金公司(originlab corporation),马萨诸塞州北安普敦(northampton,ma))是用于利用适当翻译数目将数据拟合至mn2-状态模型。下表15显示tris/suc缓冲液(20mm tris、8.5%蔗糖,ph 7.5)、his/suc缓冲液(20mm组氨酸、8.5%蔗糖、0.005%edta,ph 5.8)和glu/tre缓冲液(20mm谷氨酸、8.5%海藻糖,ph 4.5)中分子的熔融温度(tm1-tm4和fab)。此分子显示出良好稳定性,其中ch2域中的第一转变(tm1)在tris/suc和glu/tre缓冲液中大于65℃,且仅在glu/tre缓冲液中低于65℃。
[0801]
表15.人类化抗体0841的热转变。
[0802]
配制物tm1(℃)tm2(℃)tm3(℃)tm4(℃)tm fab(℃)tris/suc75.04
±
0.2477.99
±
0.0485.31
±
0.03
‑‑‑
77.8his/suc68.65
±
0.0577.48
±
0.2479.44
±
0.0884.65
±
0.0978.9glu/tre64.78
±
0.1377.44
±
0.2179.71
±
0.10
‑‑‑
79.0
[0803]
强制降解
[0804]
将人类化抗体0841充分透析至三种缓冲液中:tris(20mm tris,ph 7.5)、his(20mm组氨酸,ph 5.8)和glu(20mm谷氨酸,ph 4.5),以用于在40℃下进行4周强制降解研究。在透析之后,将样品浓度调节至5mg/ml。在t0、t2和t4周时,获取样品用于分析性尺寸排阻色谱(asec)、成像毛细电泳法(ice)和生物分析测试。
[0805]
通过asec确定被加热的样品的聚集状态。将样品注射至具有20mm磷酸钠、400mm精氨酸(ph 7.2)作为移动相的与agilent 1260hplc系统(安捷伦科技有限公司(agilent technologies),加利福尼亚州圣克拉拉(santa clara,ca))连接的ymc-pack diol-200柱(300
×
8.0mm,孔隙尺寸)。将流动速率为0.75毫升/分钟持续20分钟的等度程序施用至asec柱进行样品溶离,且使用agilent openlab数据分析软件分析数据以整合和定量聚集物、所关注蛋白质和低分子量物种的峰面积。所有样品显示出hmms(高分子量物种)%和lmms(低分子量物种)%的变化极小,即百分比小于5%(表16)。
[0806]
表16.对人类化0841的t4周强制降解样品进行的asec。
[0807][0808]
ice用于检测强制降解样品的基于电荷的异质性。ice在高电压下分离蛋白质电荷物种且在吸光度280nm下检测。载体两性电解质产生ph梯度且蛋白质迁移,直到其净电荷为零。分析电泳图以确定酸性、主要和碱性物种的pi值和峰面积。使用具有prince自动取样器的protein simple ice3仪器分析样品。将蛋白质于水中稀释至2mg/ml。样品稀释剂含有0.01mg/ml pi标记物4.65、0.01mg/ml pi标记物9.5、4.0%pharmalyte(ph3-10)、0.25%甲基纤维素和2.0m脲。样品含有15μl 2mg/ml的蛋白质和85μl样品稀释剂。将样品在1500伏下聚焦1分钟且接着在3000伏下聚焦6分钟。empower软件用于数据分析。
[0809]
对于ice分析中具有高百分比的酸性/碱性物种的样品,需要额外质谱分析来鉴定cdr区上的序列倾向性(sequence liabilities)。对组氨酸和谷氨酸缓冲液中的样品的分析显示酸性和碱性物种的典型增加。然而,碱性物种比对于tris缓冲液中稳定抗体所预期的有更大增加,表明存在可能的化学修饰(表17)。使用质谱三部分分析和肽定位进一步分析全部三种缓冲液中的样品。
[0810]
表17.对人类化抗体0841(hc seq id no:22和lc seq id no:17)的强制降解样品的ice分析。
[0811]
[0812]
质谱分析
[0813]
对于3部分质谱分析,使用fabalactica消化抗体。将50μg抗体mab添加至100-150mm napo4(ph 7.0),体积是25μl。添加1.5μl的fabalactica酶(40u/μl)且在37℃下在平缓振荡下培育过夜(16-18小时)。在此之后,添加50μl 8m guan-hcl、12.5μl 1m dtt和12.5μl 150mm磷酸钠缓冲液(ph 7.0)。将此在37℃下在平缓振荡下培育1小时。将7-8μg(约15μl)用于3部分液相色谱质谱(lc-ms)分析。
[0814]
使用偶合至waters h-类(沃特世公司(waters),马萨诸塞州米尔福德(milford,ma))uplc的bruker maxis ii质谱仪(布鲁克公司(bruker),马萨诸塞州比尔里卡(billerica,ma))进行lc-ms分析。被维持于65℃下的waters beh c4(,2.1
×
150mm)柱以300μl/min的流动速率分离被fabalactica消化和还原的样品。移动相a是具有5%乙腈和0.05%tfa的水,移动相b是50:50的乙腈:2-丙醇和0.05%tfa。质谱仪在仅正ms模式下运行且用otof控制软件获取数据。tof-ms信号是使用compass dataanalysis v4.2(布鲁克公司)中的最大熵值进行解卷积。在时间四周(t4w)时对谷氨酸、组氨酸和tris缓冲液中的强制降解0841样品的分析显示与在时间0(t0)时的样品相比类似的型态(图2)。pyroe-fd(来自igg重链的在n端处具有焦谷氨酸(pyroe)的fd片段)显示尤其在tris缓冲液中的t4w样品的稍微增加(约3.5%)。另外,在t0和t4w样品中检测到约5%fd d/p夹子(具有被裂解的天冬氨酸/脯氨酸(d/p)位点的fd片段)。
[0815]
通过lc-ms的肽定位
[0816]
为了进一步研究样品稳定性,利用肽定位lc-ms。对于肽定位,抗体0841的变性和还原在37℃下在5m guan:hcl naac(ph 5.0)、10mm tcep中进行1小时。用100mm mes(ph 6.0)、0.5mm tcep缓冲液稀释反应混合物10次。接下来,以1:10比率添加lysc/胰蛋白酶混合物,随后以37℃过夜消化。用0.5%tfa/h2o(最终浓度)淬灭反应。接着将此消化混合物注射至赛默科技公司的orbitrap fusion lumos上以用于lc-ms分析。
[0817]
lc-ms肽定位分析使用偶合至waters h类(沃特世公司,马萨诸塞州米尔福德)uplc的orbitrap fusion lumos质谱仪(赛默科技公司,马萨诸塞州沃尔瑟姆(waltham,ma))进行。将被消化的样品用维持在60℃下的waters beh c18(,1.7μm 2.1
×
150mm)柱以200μl/min的流动速率分离。移动相a是水中的0.05%tfa,且移动相b是乙腈中的0.05%tfa。使用梯度:0.5%比35%b,在135分钟内将肽从柱溶离。质谱仪在仅正ms模式扫描中自300至1600m/z运行且用xcalibur软件获得数据。数据分析和数据库搜寻是使用xcalibur软件(赛默飞世尔科技公司(thermo fisher scientific),马萨诸塞州沃尔瑟姆)和peaks ab(拜奥公司(bioinformatics solutions inc),加拿大多伦多(toronto,canada))两者进行。
[0818]
对tris、组氨酸和谷氨酸缓冲液的t4w样品的高保真度肽定位分析鉴别hc cdr2肽中痕量的脱酰胺(《1%),其中序列idpan*gntiyaek(ng脱酰胺位点是加下划线的;seq id no:176)。ng是常见脱酰胺位点,但在这种情况下主要是稳定的。在具有序列tsqnin*rylnwyqqkpgk(nr脱酰胺位点是加下划线的;seq id n:177)的lc cdr1肽中检测到潜在脱酰胺(呈丁二酰亚胺-n形式),tris t4w样品中的脱酰胺增加至约5.1%(ms2光谱指示n(30)r位点是最可能脱酰胺位点,然而,n28和n34也可以潜在地具有痕量的脱酰胺)(表18)。
[0819]
表18.对人类化抗体0841的强制降解样品的lc/ms肽定位。
[0820][0821][0822]
竞争结合elisa
[0823]
为了另外评估强制降解样品的稳定性,在竞争结合elisa中评估应激样品的活性。在此,针对t0、t2w和t4w样品与用生物素标记的嵌合抗体0164(包含hc seq id no:34和lc seq id no:31)竞争结合于人类e-选择素的能力,比较这些样品的稳定性。人类e-选择素储存于500μg/ml的具有ca/mg的pbs中且用具有ca/mg的pbs稀释至1μg/ml的浓度。将此添加至384孔maxisorp培养盘中,加以密封且在4℃下在平缓振荡下培育过夜。次日,将各孔中的试剂移出,随后向各孔中添加50μl阻断缓冲液(具有ca/mg的pbs中的1%bsa)。将所述孔密封且在室温下在平缓震荡下培育约1小时。在0.2mg/ml的起始浓度下,将抗体0841用具有ca/mg的pbs以1/3稀释的步骤连续稀释总计12个浓度。
[0824]
将用生物素标记的抗体0164在具有ca/mg的2%bsa/pbs中稀释至0.04μg/ml。将等体积的被稀释的抗体0841与用生物素标记的抗体0164混合。接下来,在titertek上用1%bsa与pbst(0.05%tween)阻断洗涤培养盘3个循环,各洗涤使用80μl。将培养盘轻拍于纸巾上以汲水。向384孔培养盘的各孔(一式两份的孔)中添加抗体0841与用生物素标记的抗体0164的二十五微升混合物,且在室温下在平缓振荡下培育2-4小时。重复洗涤步骤,重复3个2次洗涤的循环。接着,向各孔中添加稀释抗生蛋白链菌素-hrp(约1/7500稀释于阻断缓冲液中)且在室温下在平缓振荡下培育所述培养盘约40分钟至1小时。再次用3个2次洗涤循环重复洗涤步骤,轻拍干燥,且随后添加25μl tmb底物(单组分hrp微孔底物)。接着添加25μl 0.18m硫酸以在颜色达到饱和(通过观察显色来确定)时停止反应。接着在易美逊盘式读取器上读取培养盘的od450测量值,且用graphpad,prism7分析数据。
[0825]
竞争结合结果显示于图3中且在三种缓冲液中的任一种中的t0、t2w和t4w样品之间未见差异。这些数据表明,在高温条件(即40℃)下储存后,抗体0841保持其与e-选择素结合的能力。
[0826]
高浓度稳定性
[0827]
将人类化抗体0841充分透析至三种缓冲液中:tris/suc(20mm tris、8.5%蔗糖,ph 7.5)、his/suc(20mm组氨酸、8.5%蔗糖、0.005%edta,ph 5.8)和glu/tre(20mm谷氨酸、8.5%海藻糖,ph 4.5)。在透析之后,使用旋滤浓缩器将样品浓缩至150mg/ml且储存于4℃和25℃下。在t0、t1、t2、t4和t6周时,获取样品用于实时asec分析。
[0828]
高浓度样品的聚集状态如上文针对强制降解分析所描述通过asec确定。储存于4℃和25℃下的样品在t6周(t6w)时在高浓度下稳定,但在所有三种缓冲液条件下hmms的百分比有极少增加(《5%)(表19)。
[0829]
表19.在t0和t6周时对人类化抗体0841(hc seq id no:22,lc seq id no:17)的
高浓度样品的asec分析。
[0830][0831]
在t0、t3(t3w)和t6周时,通过ice和毛细管凝胶电泳(cge)分析样品。使用与用于强制降解研究中的方法类似的方法,使用ice检测高浓度样品的基于电荷的异质性。在his/suc和glu/tre缓冲液中,在25℃下在储存6周内观察到酸性物种%和碱性物种%的极小变化,其中酸性和碱性物种的较大变化与tris/suc缓冲液相关(表20)。
[0832]
表20.对人类化抗体0841(hc seq id no:22,lc seq id no:17)的高浓度样品的ice分析。
[0833][0834]
进行cge以确定抗体0841的高浓度样品的片段化。使用来自珀金埃尔默(perkin elmer)的labchip touch ht蛋白质表达分析来分析样品。根据制造商说明设置分析且使用被修改的方法制备样品。简单来说,将处于1mg/ml的5μl样品与35μl的含有碘乙酰胺以用于非还原(nrcge)或二硫苏糖醇以还原cge的样品缓冲液混合,且在70℃下培育10分钟。在加热之后,将70μl去离子水添加至各样品中,随后在touch系统上进行分析。使用labchip gx软件定量各样品的片段化尺寸和程度。
[0835]
对片段化%和hmms%的定量表明,高浓度的抗体0841在所有三种缓冲液中是稳定的(表21)。
[0836]
表21.对人类化抗体0841(hc seq id no:22,lc seq id no:17)的高浓度样品的cge分析。
[0837][0838]
实例17:对人类化抗e-选择素的计算机模拟免疫原性风险和t细胞抗原决定基预
测。
[0839]
使用计算机模拟工具预测人类化抗e-选择素抗体0841的免疫原性风险以预测mhcii肽结合。使用这些工具:(1)用于鉴别序列中各个个别肽的潜在mhcii结合的抗原决定基,(2)用于抗原决定基分类,以评估潜在mhcii肽结合物的风险,和(3)用于总体序列评分,以预测具有mhcii结合相关免疫原性风险的整个序列的总体风险。方法于下文中描述。
[0840]
抗原决定基鉴别
[0841]
使用两种方案(下文所描述)分析序列以鉴别抗原决定基。对于任一方案,由本文中所描述的规则标记的任何序列视为抗原决定基。这些方法主要以氨基酸9-聚体的含量检验序列。
[0842]
方案1:ispri/epimatrix
[0843]
提供序列以用于ispri套装软件(ispri v 1.8.0,艾匹瓦公司,罗德岛普罗维登斯(2017))中的epimatrix分析(谢弗(schafer jra)等人(1998)疫苗(vaccine)16(19):1880-84)。原始结果提供各9-聚体氨基酸片段针对8种不同hla类型的结合的可能性的等级。因此,对于各9-聚体存在8个预测(“观察结果”)。在序列的各个别线性编号位置处开始生成9-聚体(因此,同一9-聚体有可能在同一序列中出现超过一次)。如果任何4个观察结果指示9-聚体在结合物前5%中(意谓预测9-聚体在至少4个hla类型的结合物前5%中),那么9-聚体被视为预测抗原决定基(“抗原决定基”)。或者,如果8个预测中的任何1个指示9-聚体在结合物之前1%中,那么9-聚体也被视为预测抗原决定基。
[0844]
方案2:iedb共同法
[0845]
提供序列以用于使用iedb(维塔(vita r.)等人,核酸研究(nucleic acids res.)2015;28(43):d405-12;iedb mhc-ii结合预测(iedb mhc-ii binding predictions),www.iedb.org)中的mhc-ii结合共同法(王(wang p.)等人(2010)bmc生物信息学(bmc bioinformatics)11:568;王等人(2008)公共科学图书馆计算生物学(plos comput.biol.)4(4),e1000048)进行分析。软件的输出值根据15-聚体排列结果。提供15-聚体和hla类型的各组合的共同评分和百分比等级。衍生各15-聚体的共识的个别评分是15-聚体中发现的某些9-聚体的等级:用于共识的各方法报告15-聚体内的9-聚体的百分比等级。视为总体15-聚体的值的共识是对于具有中值评分的9-聚体的预测。如果(a)选择9-聚体作为15-聚体的共识代表,和(b)对于所考虑的hla类型的结合物之前10%中具有百分比等级,和如果对于同一9-聚体的三种或更多种不同hla类型出现标准(a)和(b)(即,三个观察结果),那么将9-聚体分类是抗原决定基。所考虑的hla类型是drb1*01、1*03、1*04、1*07、1*08、1*11、1*13和1*15,其与标准ispri/epimatrix报告中的hla类型相同。因此,尽管所述方法的主要输出值是15-聚体的等级,但为了易于与方案1比较,我们将数据重新解释以获得预测的9-聚体抗原决定基的列表。
[0846]
抗原决定基分类
[0847]
各抗原决定基分类是生殖系或非生殖系抗原决定基。对于抗体,吾等基于各抗原决定基在抗体(cdr或非cdr)内的位置进一步分类各抗原决定基。我们过滤从imgt获得的人类v域的序列(www.imgt.org)以去除标注是假基因的生殖系或开放阅读框架(orf)。其余序列中发现的任何预测的9-聚体抗原决定基被视为生殖系抗原决定基。在j或c区(包括igg1、igg2、igg3和igg4)中发现的抗原决定基或这些区之间的接合点也分类为生殖系抗原决定
no:3))且将cdr-h2的末端生殖至(h59-h65 yvdsvkg(seq id no:186))的dp-54序列。使用实例16中所描述的竞争结合分析,显示抗体0978维持类似于抗体0841的结合。使此两个伸长段生殖化去除了所预测的t细胞抗原决定基中的5个(h63:fkirftisa(seq id no:179)、l46:lliynansl(seq id no:182)、l47:liynanslq(seq id no:183)、l48:iynanslqt(seq id no:184)和l49:ynanslqtg(seq id no:185),但引入了新的所预测的t细胞抗原决定基(h63:vkgrftisa(seq id no:187))。另外,l2的突变去除了位置l52处的潜在ns倾向性位点,但h2末端的突变添加了作为另一潜在倾向性位点的位置h61处的ds位点。对抗体0978使用结合于e-选择素的c型凝集素域(残基22-178)的抗体0164的x射线晶体结构进行基于结构的最佳化,以去除剩余的3个所预测的t细胞抗原决定基和序列倾向。
[0857]
为了确定用于突变诱发的适合位置,使用discovery studio 4.5(达拜维公司(dassault systems biovia corp.))和foldx进行亲和力变化和稳定性变化两者的突变的计算预测。耐受突变是对于discovery studio和foldx方法两者均未预测到具有δδg》1kcal/mol的那些突变。由这些预测,鉴别一组所预测的对结合和稳定性具有最小影响同时去除预测的t细胞抗原决定基和序列倾向的残基且将其示于表22中。
[0858]
表22.所预测以去除通过基于合理设计的结构鉴别的序列倾向性模体或预测的t细胞抗原决定基的突变列表。
[0859][0860]
使用这组突变,生成4种最佳化建构体,其去除表22中鉴别的3种序列倾向性和3个t细胞抗原决定基。这些建构体是抗体1282(包含seq id no:43的hc氨基酸序列和seq id no:1的lc氨基酸序列)、抗体1284(包含seq id no:40的hc氨基酸序列和seq id no:1的lc氨基酸序列)、抗体1444(包含seq id no:13的hc氨基酸序列和seq id no:1的lc氨基酸序列)和抗体1448(包含seq id no:37的hc氨基酸序列和seq id no:1的lc氨基酸序列)。相对于抗体0978的突变显示于表23中。使用实例16中所描述的竞争结合分析证实这些突变体的结合亲和力与抗体0978类似。
[0861]
表23.新序列的列表被最佳化以去除t细胞抗原决定基和序列倾向性。
[0862]
抗体hc突变体lc突变体1282k64en30e,s93a1284d61e,k64en30e,s93a1444k64tn30e,s93a
1448g64en30e,s93a
[0863]
实例19:对最佳化抗e-选择素抗体的中和。(0164、0841、1282、1284、1444、1448)
[0864]
对配体结合于表达细胞表面e-选择素的cho的中和
[0865]
在静态配体细胞粘着分析中,辣根过氧化酶(hrp)结合的e-选择素配体(唾液酸路易斯抗原)和e-选择素抗体竞争结合于中国仓鼠卵巢(cho)细胞上表达的人类或食蟹猕猴e-选择素。在静态中和分析中使用竞争酶联免疫吸附分析(elisa)评估抗e-选择素抗体中和配体结合的能力,以评估唾液酸路易斯抗原与被工程改造成表达人类或食蟹猕猴e-选择素的中国仓鼠卵巢细胞(cho)的中和。
[0866]
使表达人类e-选择素的cho细胞在培养基(最低必需培养基(mem)alpha培养基,补充有10%(体积/体积)被透析的胎牛血清、100nm甲氨蝶呤和100单位/ml青霉素和100μg/ml链霉素)中生长。将表达食蟹猕猴e-选择素的cho细胞在补充有10%热灭活胎牛血清(吉布科)、100单位/ml青霉素和100μg/ml链霉素和125μg/ml吉欧霉素(吉布科)的r1培养基(ri杜氏改善伊格尔培养基/哈姆氏f12改善)中培养。
[0867]
将表达e-选择素的cho细胞以12,500个细胞/孔接种至96孔组织培养盘中且在37℃、5%co2下培育48小时以形成汇合单层。随后用200μl不含钙镁的pbs洗涤培养盘两次。在存在用生物素标记的唾液酸路易斯a聚丙烯酰胺(卡博森斯有限公司,os45446)或唾液酸路易斯x聚丙烯酰胺(格莱克公司,01-045)与抗生蛋白链菌素/辣根过氧化酶的小型合成结合物(总计100μl)的情况下,向分析中添加抗e-选择素抗体或igg1同型对照物(igg对照物),且在37℃、5%co2下培育2小时。接着用200μl不含钙和镁的pbs洗涤培养盘两次。在培育之后,将细胞用200μl含有2mm氯化钙(50mm三氨基甲烷[tris]、150mm氯化钠;0.05%聚山梨醇酯20,ph 7.4;2mm氯化钙)的洗涤缓冲液洗涤两次。通过添加100μl的1-step ultra tmb底物(赛默科技公司,34028)且在室温下培育30分钟来产生信号。使用2m硫酸使反应停止且在450nm下读取吸光度(spectramax m5e)。使用graphpad prism软件(8.0.2版)分析且图示数据。自所述分析推导出的所估计的半最大抑制浓度(ic
50
)对于人类e-选择素来说在1.38至2.89nm的范围内且对于食蟹猕猴e-选择素来说在1.85至2.65nm的范围内(图5和图6)(表24)。
[0868]
表24.对配体结合于表达细胞表面e-选择素的cho的中和
[0869][0870]
在其它静态中和分析中,使用类似于上文所描述的那些方法的方法,抗体1444分别以1.88nm至2.33nm和1.47nm至1.49nm的所估计的ic
50
值中和配体与由cho细胞表达的人类或食蟹猕猴e-选择素蛋白质的结合。
[0871]
对配体结合于可溶性重组蛋白的中和
[0872]
在无钙和镁的磷酸盐缓冲盐水(pbs)中制备用重组氨酸标记的e-选择素、食蟹猕
猴e-选择素(希诺生物公司;190169-c08h)和人类e-选择素(希诺生物公司(sino biologicals);13025-h08h)储备溶液,最终浓度为3μg/ml。将被稀释的重组e-选择素蛋白质的一百μl/孔添加至ni-nta hissorb 96孔培养盘(凯杰,35061)中且将培养盘在定轨振荡器上在室温下培育2小时。将唾液酸路易斯a聚丙烯酰胺生物素即合成e-选择素配体(格莱克公司公司01-044)与抗生蛋白链菌素hrp(辣根过氧化酶)(超级抗生蛋白链菌素(ultra streptavidin)hrp,赛默科技公司n504)结合且稀释于含有2mm氯化钙(bd opteia缓冲液;bd生物科学公司(bd biosciences),555213)的分析稀释剂中。
[0873]
抗体的两倍浓缩储备溶液(igg1对照物,0160、1282、1284、1444和1448)也在含有2mm氯化钙的分析稀释剂中制得。在培育之后,将培养盘用200μl含有2mm氯化钙(50mm三氨基甲烷[tris];150mm氯化钠;0.05%聚山梨醇酯20,ph 7.4;2mm氯化钙)的洗涤缓冲液洗涤5次。在此之后,重复两次地添加100μl抗体混合物(igg1对照物,0160、1282、1284、1444和1448)和hrp结合的唾液酸路易斯a,且在定轨振荡器上在室温下培育培养盘2小时。最终抗体浓度在200nm至0.09nm的范围内且hrp结合的唾液酸路易斯a的最终浓度为5μg/ml。如之前所提及洗涤培养盘且添加100μl/孔的1-step ultra tmb底物(赛默科技公司,34028),且在室温下培育5分钟。用100μl的2m硫酸使反应停止且在450nm下读取吸光度(spectramax m5e)。使用graphpad prism软件(8.0.2版)分析且图示数据。所估计的半最大抑制浓度(ic
50
)值从所述分析推导出(表25)。
[0874]
所估计的半最大抑制浓度(ic
50
)值从所述分析推导出且在2.96nm至3.59nm(对于配体结合于可溶性重组人类e-选择素的抗体中和)和2.74nm至3.29nm(对于配体结合于可溶性重组食蟹猕猴e-选择素的抗体中和)的范围内。
[0875]
表25.对配体结合于可溶性重组e-选择素的中和
[0876][0877]
在其它静态中和分析中,使用类似于上文所描述的那些方法的方法,抗体1444分别以2.87nm至2.91nm和2.39nm至2.45nm的所估计的ic
50
值中和配体与人类或食蟹猕猴e-选择素蛋白质的结合。
[0878]
实例20:使用表面等离子共振进行的最佳化抗e-选择素的动力学评估。
[0879]
在类似于实例4的方法中使用spr测定人类和食蟹猕猴e-选择素针对最佳化抗体1282、1284、1444和1448的结合亲和力。这通过首先使抗体结合于固定化抗人类igg来进行。在抗体捕捉之后,使e-选择素蛋白质的稀释物流过,且测定结合于人类和食蟹猕猴的缔合速率常数(ka)、解离速率常数(kd)、t1/2和kd值(表26)。在此spr分析中,1282、1284、1444和1448对于人类e-选择素的亲和力分别是70.3nm、65.2nm、61.8nm和60.5nm。1282、1284、1444和1448对于食蟹猕猴e-选择素的亲和力分别是78.3nm、76.5nm、81.5nm和67.8nm。
[0880]
表26.通过表面等离子共振测量的抗e-选择素抗体对于人类和食蟹猕猴e-选择素的亲和力。
[0881][0882]
实例21:最佳化抗e-选择素抗体(0164、0841、1282、1284、1444和1448)的细胞表面结合(facs)和中和。
[0883]
通过facs的细胞表面结合
[0884]
通过facs分析抗体0841、0164、1282、1284、1444和1448与膜结合e-选择素的结合。表达人类e-选择素的cho细胞在alpha培养基((最低必需培养基[mem])alpha培养基,50-012-pc,康宁)中培养,所述培养基补充有被透析的胎牛血清(吉布科)(最终浓度为10%)和青霉素/链霉素(1x)且补充有甲氨蝶呤。简单来说,使解冻的细胞最初在100nm甲氨蝶呤存在下生长。对于后续培养,自生长培养基中省去甲氨蝶呤。
[0885]
将内皮细胞自冷冻储备液解冻且最初接种于再涂布有无菌0.1%明胶溶液(西格玛公司(sigma),es-006-b)的t-25烧瓶(康宁,353108)中。人类脐静脉内皮细胞(huvec)在内皮细胞生长培养基(西格玛奥德里奇公司(sigma aldrich),211-500)中生长,而食蟹猕猴肺微血管内皮细胞(clmec)在完整猴内皮细胞培养基(细胞生物制剂公司(cell biologics),mk1168)中生长。细胞在达到90%汇合度时分离且接种至三个预涂有0.1%明胶的t-175烧瓶中。
[0886]
使用不含酶的细胞解离缓冲液(吉布科,13151014)从汇合烧瓶分离表达人类e-选择素的cho细胞系。紧接着将生长培养基添加至被分离的细胞中,接着在室温下以300
×
g离心5分钟以集结细胞。接着将细胞再悬浮于低温cho缓冲液中,所述缓冲液由磷酸盐缓冲盐水(pbs)(ph 7.4)组成,含有最终浓度为1%的牛血清白蛋白(bsa;西格玛奥德里奇公司,a3059)、最终浓度为1mm的氯化钙和最终浓度为0.1%的叠氮化钠。
[0887]
对于初级细胞即huvec或clmec,通过用内皮细胞基本培养基(西格玛奥德里奇公司,210-500)置换生长培养基而使90%汇合度的培养物无血清饥饿。使细胞在37℃、5%co2和95%空气下在含湿气培育箱中培育2小时。紧接在血清饥饿之后,将含有10ng/ml人类组织坏死因子-α(tnf-α;吉布科)的内皮细胞基本培养基添加至细胞中以诱导e-选择素表达。在tnf-α刺激4小时后,使用柠檬酸盐水(135mm氯化钾、15mm柠檬酸钠)使细胞分离且紧接着通过添加氯化钙再钙化,直至达到1mm最终浓度。将细胞在4℃下以300
×
g离心且通过在湿冰中再悬浮于含有4%多聚甲醛(pfa;电子显微镜科学公司(electron microscopy sciences),15710)的pbs中固定15分钟。通过离心去除pfa且将细胞再悬浮于cho缓冲液中过夜。
[0888]
使用96孔圆底培养盘的两列重复两次地进行使用cho细胞的结合研究,而在96孔v底培养盘的单列中进行使用初级内皮细胞的结合研究。将培养盘在4℃下以300
×
g离心2分
钟,且将细胞再悬浮且通过在湿冰上在cho缓冲液中培育10分钟来阻断。在培育之后,将细胞在4℃下以300
×
g离心2分钟以去除缓冲液。接着使各孔中的细胞集结粒再悬浮且在指定体积的连续稀释抗体(人类igg1对照物,0841,1282,1284,1444和1448)中培育且使其在湿冰上培育30分钟。通过三倍稀释系列(1333nm至0.0226nm)使用cho缓冲液作为稀释剂制备测试抗体溶液。在与抗体一起培育之后,通过在4℃下以300
×
g离心1分钟来洗涤细胞三次且使其再悬浮于低温cho缓冲液中。将被洗涤的细胞再悬浮且在湿冰上与100μl的1:1000稀释的alexafluor647结合的山羊抗人类f(ab')2片段(fcγ片段特异性抗体,[艾美捷,109-606-170]一起培育45分钟(cho细胞)或30分钟(内皮细胞)。将细胞洗涤三次或四次,随后使其再悬浮于cho缓冲液中用于流式细胞测量分析。将使用640纳米激光线的becton dickinson lsrfortessa仪器用于获取细胞荧光数据。通过flowjo套装软件(弗洛跃有限公司)分析细胞的几何平均荧光且相对于抗体浓度进行绘制。在prism套件(格拉夫帕德,8版)中使用非线性回归分析计算所估计的ec
50
值。
[0889]
抗体0841、1282、1284、1444和1448以亚至低nm范围内的类似所估计的ec
50
值结合于被工程改造成表达的人类e-选择素的cho细胞(表27)。对照人类igg并未展现与表达人类e-选择素的cho细胞的任何结合。
[0890]
抗体0164、1282、1284、1444和1448结合于用tnf-α处理4小时以诱导e-选择素表达的huvec和clmec上的细胞表面人类和食蟹猕猴e-选择素。与未检测到结合的igg1同型对照物相比,观察到与经tnf-α活化的huvec或clmec的细胞表面上的内源性表达的e-选择素的结合。观察到高荧光背景且未计算ec
50
值(表27)。
[0891]
表27.通过facs的细胞表面抗体结合
[0892][0893]
实例22:最佳化抗e-选择素抗体对细胞粘着的静态中和
[0894]
e-选择素结合于血细胞表面上表达的被唾液酸化路易斯修饰的配体。在此研究中,人类前髓细胞性细胞系(hl-60)用作e-选择素配体的细胞来源。在静态中和粘着分析中评估抗体0164、1282、1284、1444和1448对hl-60细胞粘着于细胞表面e-选择素(cho细胞上)的中和活性。
[0895]
使表达人类e-选择素的cho细胞在补充有100nm甲氨蝶呤的新鲜生长培养基中生长。在细胞的此初始传代之后,自生长培养基中省去甲氨蝶呤用于后续培养。表达食蟹猕猴e-选择素的cho细胞在r1培养基中培养。在细胞的此初始传代之后,自生长培养基中省去吉欧霉素用于后续培养。
[0896]
将对数期的hl-60细胞使用羧基荧光素二乙酸丁二酰亚胺基酯荧光染料(cfse)标记试剂盒(themofisher,65-0850-84)进行标记。将被标记的hl-60细胞以400,000个细胞/ml的密度再悬浮于cho缓冲液(pbs,ph 7.4/1%牛血清白蛋白(bsa)/1mm氯化钙(cacl2)/
0.1%叠氮化钠(nan3))中以用于静态粘着分析。
[0897]
评估抗体0164、1282、1284、1444和1448在静态条件下抑制hl-60细胞对于表达e-选择素的cho细胞的细胞粘着的能力。简单来说,将cho细胞以100,000个细胞/孔的密度接种于96孔(技术复制)平底黑色培养盘的两列上且使其在含湿气培育箱中在37℃、5%co2和95%空气下形成汇合单层(通常在24小时之后)。使用cho缓冲液平缓地洗涤细胞单层,接着将指定孔与抗体溶液(0164、1282、1284、1444和1448)以三倍稀释系列(范围介于200μg/ml或1333nm至0.003μg/ml或0.022nm)一起培育。紧接着向孔中添加适当体积的用cfse标记的hl-60细胞悬浮液(400,000个细胞/ml),使得最终抗体浓度(范围介于200μg/ml或1333nm至0.003μg/ml或0.022nm)得以维持。将被标记的hl-60细胞与cho细胞单层一起在37℃、5%co2和95%空气下于含湿气培育箱中培育45分钟。在培育之后,将培养盘用cho缓冲液洗涤三次,且所结合hl-60细胞的荧光是在494/521纳米的激发/发射波长下使用spectramax i3x(美谷分子仪器公司(molecular devices))测量。将荧光单位绘制是抗体浓度的函数且使用非线性回归分析使用graphpad prism软件(8.0.2版)估计ic
50
。
[0898]
抗体的所估计的ic
50
值是类似的且在3.4nm至6.2nm的范围内(图7)(表28)。
[0899]
表28.hl-60细胞粘着的静态中和。
[0900][0901]
在另一静态中和分析中,使用类似于上文所描述的那些方法的方法,抗体1444分别以3.36nm和3.84nm的所估计的ic
50
值中和hl-60与细胞表面人类和食蟹猕猴e-选择素两者的粘着(表38)。
[0902]
实例23:最佳化抗e-选择素抗体的内源性人类e-选择素结合。
[0903]
使用ip-lc/ms/ms方法,进行对通过最佳化抗e-选择素抗体1282、1284、1444和1448在人类血浆中抑制e-选择素结合的分析。此方法定量人类血清中的游离可溶性人类e-选择素或食蟹猕猴血清中的游离可溶性猴e-选择素。所述方法使用在250μl pbs中的50μl血清,将其在4℃下(在冷室中,在500rpm下振荡)与1.0μg用生物素标记的抗e-选择素抗体0164一起培育过夜。在培育之后,将30μl英杰t1抗生蛋白链菌素磁性珠粒添加至各样品中,随后在室温下培育40分钟(在1000rpm下振荡)。使用hamilton microlabstar,将磁性珠粒接着用pbs/0.05%tween-20洗涤两次,随后用pbs洗涤一次。接着,将可溶性e-选择素自具有145μl的30mm盐酸(hcl)的珠粒溶离,且用32μl的1m tris hcl(ph 8)中和。随后添加50fmol的用稳定同位素标记(sil)的内部标准物,随后添加二硫苏糖醇(dtt,10μl
×
50mm)。在60℃下培育35分钟之后,使样品冷却至室温,随后添加碘乙酰胺(iaa,10μl
×
100mm)。接着将样品置于暗处持续30分钟,向其中添加1μg promega lysc/胰蛋白酶(10μl
×
100μg/ml),且接着在37℃下消化过夜。
[0904]
在过夜培育之后,将50μl所制备样品注射至纳米esilc-ms/ms。通过监测可溶性e-选择素的胰蛋白酶肽(csslavlek(seq id no:193))进行定量。此定量显示抗体1282、1284、1444和1448具有类似的对人类e-选择素的抑制,其中ic
50
分别是2.4nm、1.1nm、1.2nm和
1.8nm,且ic
90
分别是4.9nm、4.8nm、6.5nm和8.6nm。
[0905]
实例24:对人类化抗e-选择素的生物物理表征。
[0906]
热稳定性
[0907]
差示扫描量热法用于确定四种最佳化抗e-选择素抗体1282、1284、1444和1448的稳定性。使用与实例16中所描述的方法类似的dsc方法。下表29显示tris/蔗糖(“tris/suc”)缓冲液(20mm tris、8.5%蔗糖,ph 7.5)、组氨酸/蔗糖(“his/suc”)缓冲液(20mm组氨酸、8.5%蔗糖、0.005%edta,ph 5.8)和谷氨酸/海藻糖(“glu/tre”)缓冲液(20mm谷氨酸、8.5%海藻糖,ph 4.5)中这些分子的熔融温度(tm1-tm3和fab)。所有四个分子展现良好稳定性,其中tris/suc、his/suc和glu/tre缓冲液中ch2域中的第一转变(tm1)大于65℃。这些分子显示his/suc和glu/tre缓冲液中的稳定性有略微增加,和tris/suc缓冲液中的稳定性有略微降低。
[0908]
表29.通过差示扫描量热法确定的最佳化抗e-选择素抗体的热稳定性。
[0909][0910]
强制降解
[0911]
制备最佳化抗e-选择素抗体1282、1284、1444和1448用于在40℃下通过充分透析至三种缓冲液中进行4周强制降解研究:tris(20mm tris,ph 7.5)、his(20mm组氨酸,ph 5.8)和glu(20mm谷氨酸,ph 4.5)。在透析之后,将样品浓度调节至5mg/ml。在t0、t2和t4周时,将样品等分用于asec、ice和生物分析测试。
[0912]
如实例16中所描述,通过asec确定强制降解样品的聚集状态。所有样品在t4周时显示最小变化,小于5%lmms和小于1%hmms物种(表30)。
[0913]
表30.对最佳化抗e-选择素抗体的强制降解样品进行的asec。
[0914][0915]
成像毛细管等电聚焦(ice)用于检测强制降解样品的基于电荷的异质性。此使用与实例16中使用的方法类似的方法完成。对于ice分析中具有高%的酸性/碱性物种的样品,需要额外质谱分析来鉴定cdr区中的序列倾向性。对tris、his和glu缓冲液中的样品的分析显示酸性和碱性物种的典型增加(表31)。使用质谱三部分分析和肽定位进一步分析抗体1444以用于与人类化0841比较。
[0916]
表31.对最佳化抗e-选择素抗体的强制降解样品的ice分析。
[0917]
[0918][0919]
质谱分析
[0920]
对最佳化抗体1444进行3部分质谱分析。对glu、his和tris缓冲液中的t4w处抗体1444的强制降解的分析显示与t0相比的类似概况。在应激样品中观察到低含量的scfc(单链fc)氧化和d/p夹子,检测到低含量的oxi_fd(氧化fd),检测到痕量fd+hexnac(糖化fd),检测到痕量fd d/p夹子(具有裂解d/p位点的fd片段),且观察到低含量pyroe fd(在n末端具有焦谷氨酸的fd片段)(图8)。
[0921]
使用与实例16中使用的方法类似的方法进行抗体1444的肽定位。对tris、his或glu缓冲液中t0和t4周强制降解样品的高保真肽定位分析指示,仅在抗e-选择素抗体1444hc cdr 2肽idpangntiyvdsvtgr(seq id no:194)中检测到痕量异构化和脱酰胺化(表32)。所有样品均具有》96%常规肽,其中发现小于1%是脱酰胺肽且发现小于2%是含有异构化(isod)的肽。此最佳化的变异体不再在轻链位置30处含有突变成glu的化学不稳定模体。对于lc cdr1肽tsqnierylnwyqqkpgk(seq id no:195),未检测到修饰。
[0922]
表32.对来自最佳化抗e-选择素抗体1444的hc cdr2肽的强制降解样品进行的lc/ms肽定位。
[0923]
hc cdr2肽常规肽%脱酰胺肽%isod肽%t099.00%0.07%0.32%glu t4w98.30%0.18%0.56%his t4w96.60%0.16%0.65%tris t4w97.80%0.30%1.20%
[0924]
为了另外评估强制降解样品的稳定性,在竞争结合elisa中评估应激样品(抗体1282、1284、1444、1448)的活性。在此,针对t0、t2w和t4w样品与用生物素标记的嵌合抗体0164竞争结合于人类e-选择素的能力,进行比较。此方法类似于实例16中所描述的方法。竞
争结合结果显示于图9a-9d中且t0、t2w和t4w样品之间并未可见差异,指示抗体结合于e-选择素的能力在高温培育之后是稳定的。
[0925]
高浓度稳定性
[0926]
将最佳化抗e-选择素抗体1282、1284、1444和1448充分透析至三种缓冲液中:tris/suc(20mm tris、8.5%蔗糖,ph 7.5)、his/suc(20mm组氨酸、8.5%蔗糖、0.005%edta,ph 5.8)和glu/tre(20mm谷氨酸、8.5%海藻糖,ph 4.5)。在透析之后,使用旋滤浓缩器将样品浓缩至150mg/ml且储存在4℃和25℃下。在时间零(t0)、一周(t1w)、两周(t2w)、四周(t4w)、六周(t6w)和七周(t7w)时,将样品等分用于即时asec分析,其中在研究结束时进行t0、t3和t7周时的ice和cge分析。
[0927]
如实例16中所描述,通过asec确定高浓度样品的聚集状态。在4℃和25℃下的样品在所有时间点显示良好高浓度稳定性,其中在所有三个缓冲液条件下的hmms极少增加(总计《5%)(图10a-10d)。
[0928]
使用与实例16所描述的方法类似的方法,使用ice检测高浓度样品的基于电荷的异质性。经由7周研究,在25℃下储存于tris/suc、his/suc和glu/tre缓冲液中的抗体中可见酸性物种%和碱性物种%的最小变化(表33)。
[0929]
表33.对最佳化抗e-选择素抗体的25℃高浓度样品的ice分析。
[0930]
[0931][0932]
进行cge分析以确定最佳化抗体1282、1284、1444和1448的高浓度样品的片段化。所述分析使用与实例16所描述的方法类似的方法完成。定量片段化%和hmms%展现在25℃下所有三种缓冲液中抗体1282、1284、1444和1448的良好高浓度稳定性(表34)。
[0933]
表34.对最佳化抗e-选择素抗体的25℃高浓度样品的cge分析。
[0934]
[0935][0936]
粘度
[0937]
最佳化抗体1282、1284、1444和1448的粘度是使用以下基于dls(动态光散射)珠粒的方法来测量。使用膜盒装置10k mwco(赛默科技公司),将pbs中的蛋白质针对20mm组氨酸、85mg/ml蔗糖、0.05mg/ml edta(ph 6.0)充分透析。将蛋白质自透析收集且使用0.2μm针筒过滤器加以过滤。使用vivaspin离心式浓缩器10k mwco(通用电气医疗集团)浓缩蛋白
质。随着蛋白质粒积减小且蛋白质浓度增加,自浓缩器滞留物去除样品等分试样(12μl)。将300nm珠粒(nanosphere,赛默科技公司)添加至蛋白质样品和空白缓冲液(buffer blank)。将珠粒以1:10稀释于20mm组氨酸、85mg/ml蔗糖、0.05mg/ml edta(ph 6.0)中且将0.75μl被稀释的珠粒掺入蛋白质样品中。通过平缓涡流混合蛋白质/珠粒和缓冲液/珠粒样品。将八μl样品转移至1536孔培养盘(sensoplate,玻璃底部(glass bottom),格瑞纳生物科技公司(greiner bio-one))以通过dls分析。用光学透明胶带密封所述培养盘且以2000rpm离心2分钟以去除气泡。
[0938]
使用dynapro盘式读取器(怀雅特技术公司(wyatt technology),加利福尼亚州圣塔芭芭拉(santa barbara,calif.))进行dls测量。在25℃下培育样品且在15次连续25秒获取情况下进行测量。将珠粒的半径平均化以获取具有可接受衰减曲线的数据。基于斯托克斯-爱因斯坦方程序(stokes-einstein equation)计算粘度。样品粘度计算是所测量的表观半径除以标称珠粒半径乘以0.893厘泊(cp),即在25℃下水的粘度。
[0939]
高浓度配制物是抗体的所需特性,允许较高给药剂量高和较低给药频率。最佳化抗体皆显示良好粘度概况,其中其粘度不达到20cp直到大约160mg/ml。是证实此测量值,使用下文所描述的anton parr方法进行各最佳化抗体在单一浓度下的额外粘度测量。
[0940]
使用50kda分子量截止值的amicon离心式过滤器单元(密理博公司(emd millipore),马萨诸塞州比尔里卡(billerica,ma)),将蛋白质样品浓缩至170-180mg/ml的目标。通过在solovpe可变路径长度系统(variable pathlength system)(c科技公司(ctechnologies,inc),新泽西州布里奇沃特(bridgewater,nj))上进行的280nm分析来测定蛋白质浓度。在25℃下以150rpm的恒定转速使用cp25-1圆锥和培养盘在mcr-302流变仪(anton paar usa公司,ashland,va)上进行粘度测量。每个样品收集总计各自10秒的10次测量结果且使用rheoplus(美国安东帕公司(anton paar usa inc.))v 3.62软件分析数据。在179.5mg/ml下测量1282的粘度是36.29cp。在171.9mg/ml下测量1284的粘度是27.38cp。在185.7mg/ml下测量1444的粘度是33.43cp。在186.8mg/ml下测量1448的粘度是33.35cp。所有这些测量结果均与dls粘度测量结果的曲线拟合充分拟合,从而增强其准确性(图11)。
[0941]
实例25:对最佳化抗e-选择素的计算机模拟免疫原性风险和t细胞抗原决定基预测。
[0942]
使用计算机模拟工具预测最佳化抗e-选择素抗体1282、1284、1444和1448的免疫原性风险以预测mhcii肽结合。使用的方法与实例17中所描述的方法类似。最佳化抗体显示经改善的总序列评分,自-30.34(对于人类化抗体0841)减少至评分-46.26(对于抗体1282)、-46.16(对于抗体1284)、-45.11(对于抗体1444)和-45.32(对于抗体1448)。另外,在最佳化抗体中去除8种所预测的非生殖系t细胞抗原决定基(表35)。
[0943]
表35.对最佳化抗e-选择素抗体的计算机模拟免疫原性分析。
[0944]
[0945]
实例26:最佳化抗e-选择素抗体的自相互作用和多反应性。
[0946]
测试结合于dna和胰岛素的最佳化抗体1444(包含seq id no:13的hc氨基酸序列和seq id no:1的lc氨基酸序列)、1282(包含seq id no 43的hc氨基酸序列和seq id no:1的lc氨基酸序列)、1284(包含seq id no:40的hc氨基酸序列和seq id no:1的lc氨基酸序列)和1448(包含seq id no:37的hc氨基酸序列和seq id no:1的lc氨基酸序列),且除此之外还在ac-sins分析中测试自相互作用(亲和力捕捉自相互作用纳米粒子质谱分析(affinity-capture self-interaction nanoparticle spectroscopy);刘(liu)等人(2014)mabs 6:483-92)。在ac-sins分析中,如果在金纳米球上捕捉的mab彼此结合且因此引起珠粒聚集,那么所述mab诱导吸光度最大值的偏移。已表明此分析中的较高评分与较低或较差溶解度和非特异性膜相互作用相关(刘等人,mabs 2014;6:483-92)。抗体1282、1284、1444和1448具有极低ac-sins评分和dna/胰岛素评分,其与阴性对照物的那些评分类似(表36)。这些数据表明这些抗体处于低多反应性风险下,类似于阴性对照物的彼等风险。
[0947]
表36.e-选择素抗体的非特异性结合和自相互作用。
[0948][0949][0950]
实例27:使用表面等离子共振进行的最佳化抗e-选择素的交叉反应性评估。
[0951]
使用如实例20中所描述的spr,测定人类和食蟹猕猴e-选择素对于最佳化抗体1444(包含seq id no:13的hc氨基酸序列和seq id no:1的lc氨基酸序列)的结合亲和力。使用具有405nm的高分析物浓度的类似方法,我们还使用与实例5中所描述的方法类似的方法评估此抗体对于大鼠e-选择素、小鼠e-选择素、兔e-选择素、人类l-选择素和人类p-选择素的同源物的结合亲和力。在25℃下,观察到在最多405nm下抗体1444与大鼠e-选择素、小鼠e-选择素、兔e-选择素、人类l-选择素和人类p-选择素的结合或未观察到此结合(图12)。抗体1444以68.35+/-3.18nm的kd结合于人类e-选择素,且以64.9+/-1.13nm的kd结合于食蟹猕猴e-选择素。
[0952]
实例28:对抗体1282、1284、1444和1448的基于培养盘的直接结合elisa分析。
[0953]
直接结合elisa用于表征抗体0841、1282、1284、1444和1448与各种固定化可溶性重组选择素的结合。在无钙和镁的磷酸盐缓冲盐水中制备用重组氨酸标记的人类p-选择素、e-选择素或l-选择素(希诺生物公司)、小鼠e-选择素(希诺生物公司)、大鼠e-选择素(希诺生物公司)和食蟹猕猴e-选择素(希诺生物公司)储备溶液,最终浓度为1μg/ml。对照物包括针对l-选择素的抗体(拜奥伦公司(biolegend);304811)或针对p-选择素的抗体或阴性对照物igg。将一百微升/孔的被稀释的重组选择素蛋白质添加至ni-nta hissorb 96孔培养盘(凯杰;35061)中。将培养盘在室温下于定轨振荡器上培育2小时。在培育之后,将培养盘用200μl的洗涤缓冲液(50mm三氨基甲烷[tris];150mm氯化钠;0.05%聚山梨醇酯
20,ph 7.4)洗涤3次。是减少非特异性结合,将培养盘用200μl阻断缓冲液(bd opteia缓冲液;555213;bd生物科学公司)处理,在室温下于定轨振荡器上培育1小时且如上文所描述加以洗涤。在四倍稀释系列(范围介于133.33nm至0.004nm,在bd opteia缓冲液中进行)情况下将抗体(igg1对照抗体、抗e-选择素抗体、抗p-选择素抗体或抗l-选择素抗体)以100μl/孔重复两次地添加至反应,在定轨振荡器上培育1小时且如上文所描述加以洗涤。添加一百微升特异性检测抗体(描述如下)且培育1小时:
[0954]
·
使用按1比25000或1比50000稀释的过氧化酶结合的山羊抗人类igg fcγ(艾美捷;109-035-008)检测到igg1对照物、0841、1282、1284、1444、1448、抗小鼠e-选择素和抗p-选择素抗体;
[0955]
·
使用按1比25000稀释的过氧化酶结合的affinipure山羊抗小鼠igg(h+l)(艾美捷;)检测到抗l-选择素和抗大鼠e-选择素抗体。
[0956]
洗涤培养盘且添加100μl/孔的1-step ultra tmb底物(赛默科技公司,),且在室温下培育5分钟。用100μl的2m硫酸使反应停止且在450nm下读取吸光度(spectramax m5e)。使用graphpad prism软件(8.0.2)分析且图示数据。所估计的半最大浓度(ec
50
)值从所述分析推导出。
[0957]
在所估计的ec
50
值分别是0.362nm和0.081nm的针对l-选择素或p-选择素的抗体情况下,观察到与固定化人类l-选择素或人类p-选择素的剂量依赖性结合。相比之下,未观察到0841、1282、1284、1444或1448对于可溶性人类l-选择素或p-选择素蛋白质的交叉反应性(图13)。这些研究表明,抗体(例如1444)选择性地结合于e-选择素,而未观察到结合于人类l-选择素或p-选择素。
[0958]
在具有低至亚-纳摩尔结合(分别为0.153nm和0.0139nm)的对照大鼠或小鼠抗e-选择素抗体情况下,观察到与小鼠e-选择素和大鼠e-选择素的剂量依赖性结合。相比之下,观察到0841、1282、1284、1444或1448与小鼠和大鼠e-选择素的弱结合,且与阳性对照抗体相比,结合曲线向右偏移。结合曲线指示与针对对照大鼠或小鼠e-选择素的抗体相比的较弱、非饱和或可变结合(表37)。
[0959]
表37.对于可溶性重组e-选择素蛋白质的抗体交叉反应性。
[0960][0961]
在另一直接结合elisa中,使用与上文所描述的那些类似的方法,抗体1444以0.085的ec
50
结合于固定化可溶性重组人类e-选择素且以0.071至0.075nm的ec
50
结合于固定化可溶性重组食蟹猕猴e-选择素(表38)。
[0962]
实例29:静脉内或皮下给予后的猴中最佳化抗体1444的药物动力学。
[0963]
最佳化抗体1444的药物动力学研究是在食蟹猕猴中使用静脉内和皮下给予进行。血清抗体1444(包含seq id no:7的hc氨基酸序列(其包括末端赖氨酸)和seq id no:1的lc
氨基酸序列)浓度的定量是使用meso-scale discovery(msd)分析平台上的免疫分析来确定。在分析中,为了定量抗e-选择素抗体1444,使用生物素标记的山羊抗人类免疫球蛋白g(igg)结合于阻断的抗生蛋白链菌素涂布的小斑点培养盘上。抗e-选择素抗体1444由配体、重组人类可溶性e-选择素捕捉。用钌化山羊抗人类igg检测所结合抗e-选择素抗体1444。在msd sector成像器6000上读取培养盘,且通过使用用钌标记的山羊抗人类igg抗体和三丙胺(tpa)进行最终检测,以在msd仪器内产生代表所结合抗e-选择素抗体1444的量的电化学发光信号。样品浓度由使用5参数逻辑方程序(标准曲线的加权公式是1/y^2)进行拟合的标准曲线的插值确定。100%血清中的定量范围是40.0ng/ml至2560ng/ml。
[0964]
向两个动物各自静脉内(iv)给予0.3、0.6、1、3或10mg/kg之后,抗体1444展现自时间0至最后可测量浓度(cl
0-tlast
)计算的平均全身性清除率分别是0.39、0.31、0.15、0.18和0.18ml/h/kg,且在稳态(v
ss(0-tlast)
)下分布的表观体积分别是25、22、27、35和36ml/kg。抗体1444显示剂量依赖性药物动力学,清除率随着指示目标介导的药物处置的剂量的增加而降低。对于以0.3、0.6、1、3或10mg/kg静脉内给予的平均半衰期(t
1/2
)分别是102、264、188、287和345小时。
[0965]
在向两只动物各自皮下(sc)给予1或3mg/kg之后,当与静脉内给予1mg/kg的抗体相比时,抗体1444在以1mg/kg皮下给予之后具有50%的平均生物可用性(%f)。在皮下给予3mg/kg的抗体1444后,当与静脉内给予3mg/kg的抗体1444相比时,抗体1444具有65%的平均%f。对于以1和3mg/kg皮下给予抗体1444的平均半衰期(t
1/2
)分别是243和518小时。
[0966]
在meso scale discovery平台上,证实配体结合分析可以检测食蟹猕猴血清中抗药物抗体(ada)的存在。在此方法中,各培养盘上包括2种不同浓度的阳性对照物(由掺入食蟹猕猴血清中的小鼠单克隆抗-抗体1444抗体组成)和阴性对照物(由汇集的正常食蟹猕猴血清组成)以监测分析性能。在所有剂量组中,对于抗体1444的ada诱导的总发生率是0%(0/18动物)。
[0967]
实例30:在生理流动分析中通过最佳化抗体1444对细胞粘着的离体中和
[0968]
在涂布有重组蛋白或细胞单层的微流体通道内进行离体细胞粘着实验,以评估抗体1444抑制表达e-选择素配体的细胞的粘着的性能和中和活性。细胞粘着在生理流动条件下使用bioflux
tm
(s/n-008-0180-08)系统(弗洛欣,美国加利福尼亚州圣弗朗西斯科(san francisco,ca,usa))分析。使用被工程改造成表达细胞表面上的e-选择素(人类或食蟹猕猴)的重组纯化可溶性e-选择素或p-选择素蛋白质或中国仓鼠卵巢(cho)细胞进行粘着分析。将表达e-选择素配体、psgl-1和其它唾液酸路易斯x配体的人类hl-60细胞,表达e-选择素配体的经纯化人类嗜中性粒细胞或获自患有镰状细胞疾病的患者的全血,用于测试对于重组e-选择素和p-选择素和表达e-选择素的cho细胞的粘着。
[0969]
将bioflux
tm
培养盘/腔室(弗洛欣生物科学公司,48孔低剪切,0-20达因/cm2;910-0004)用于这些研究。将表达人类e-选择素(人类cho-e,辉瑞)或食蟹猕猴e-选择素(食蟹猕猴cho-e,辉瑞)的cho细胞和hl-60细胞在37℃下、在5%co2和95%湿度任选地维持于其对应生长培养基中。在使用hl-60细胞或经纯化人类嗜中性粒细胞的研究中,将细胞在1000rpm下离心5分钟,用钙黄绿素am(钙黄绿素;lifetechnologies
tm
;c3099)染色30分钟,用具有钙和镁的磷酸盐缓冲盐水(pbs)(吉布科;目录号14040-133)洗涤两次,且使其再悬浮于pbs中直到浓度为3
×
106个细胞/ml,随后在流动腔室中进行灌注。将细胞在37℃下维
持,随后灌注且在室温下进行bioflux
tm
分析。观察粘着细胞且使用具有40倍放大率的nikon eclipse ti-s(nis-elements br 3.264位)倒置级相位对比荧光显微镜对其进行计数。使细胞计数相对于磷酸盐缓冲液媒剂对照物进行标准化。各实验根据每一条件具有两个孔。使用graphpad prism(8.0.2)图示且分析数据。自所述分析推导出的所估计的半最大抑制浓度(ic
50
)值四舍五入至十进制小数点的两个有效数位。通过相对于媒剂对照物(=100%,无抑制)使数据标准化来计算所估计的ic
50
值。
[0970]
对于细胞粘着于重组e-选择素的中和
[0971]
首先,为了模拟被活化的内皮细胞的表面,使流动腔室涂布有等量的人类e-选择素可溶性重组蛋白和p-选择素可溶性重组蛋白。使bioflux
tm
流动微通道涂布有20μg/ml的可溶性重组人类p-选择素和e-选择素(希诺生物公司)中的各者,所述选择素于pbs中制备,以1达因/cm2灌注5分钟,在室温下培育1小时并以1达因/cm2用0.1%牛血清白蛋白(bsa)/pbs洗涤3-5分钟。将培养盘以1达因/cm2用包括抗体1444(浓度是0.78至200nm)、同型阴性对照抗体(200nm)、pbs中的阳性对照抗e选择素抗体(200nm)和媒剂对照物的测试制品处理1小时。在各通道中以1达因/cm2的生理剪切流量对hl-60细胞的100μl的等分试样进行灌注10分钟。将pbs以1达因/cm2灌注2-3分钟以去除非粘着细胞且如所描述进行分析。
[0972]
在腔室中灌注抗体1444(0.78至200nm)、同型阴性对照抗体或媒剂以抑制e-选择素结合。在这些研究中,使表达e-选择素配体、psgl-1和其它唾液酸路易斯x配体的hl-60细胞以1达因/cm流动。抗体1444以15.26nm的所估计的ic
50
值降低hl-60细胞对于纯化可溶性人类e-选择素蛋白质的粘着。同型阴性对照物在分析中无作用。阳性对照抗e选择素抗体使hl-60粘着度减少约43%。
[0973]
在其它流动粘着中和分析中,使用与上文所描述的方法类似的方法,抗体1444以13.28nm-15.94nm的所估计的ic
50
值中和hl-60对于重组人类e-选择素蛋白质的粘着(表38)。
[0974]
对细胞粘着于表达e-选择素的中国仓鼠卵巢细胞的中和
[0975]
使bioflux
tm
培养盘在pbs中以1达因/cm2的流动速率涂布有100μg/ml纤维结合蛋白(高级生物基质公司(advanced biomatrix),目录号5050-1mg)且在室温下培育1小时。表达e-选择素的中国仓鼠卵巢细胞(人类或食蟹猕猴cho-e)细胞被制备成用于通过在37℃下以1:1比率处理0.05%胰蛋白酶-乙二胺四乙酸(edta)(吉布科,25300054)和stempro阿库酶(吉布科;a1110501)5分钟的分析,经等体积的生长培养基中和,加以收集,以1000rpm离心5分钟且使其再悬浮于其对应生长培养基中,直到最终浓度为60
×
106个细胞/ml。将培养盘在室温下以1达因/cm2用250μl的cho生长培养基灌注2-3分钟总计两次,去除所有培养基且将10-20μl的cho-e细胞(处于60
×
106个细胞/ml)以2-3达因/cm2灌注15秒。从仪器移出培养盘且在37℃下在5%co2培育箱中培育1小时。去除培养基且添加500μl新鲜生长培养基,且在37℃下在5%co2培育箱中培育细胞过夜。培育之后,在具有新鲜生长培养基的bioflux仪器上洗涤(3-4达因/cm2)cho-e单层。将培养盘以1达因/cm2用包括抗体1444(浓度是0.78至200nm)、同型阴性对照抗体(200nm)、pbs中的阳性对照商用抗e选择素抗体(200nm)和媒剂对照物的测试制品处理1小时。在各通道中以1达因/cm2的生理剪切流量对hl-60细胞的100μl的等分试样进行灌注10分钟。将pbs以1达因/cm2灌注2-3分钟以去除非粘着细胞,且使培养盘成像且如所描述进行分析。
[0976]
e-选择素表达于内皮细胞表面上。使表达e-选择素(人类或食蟹猕猴)的cho细胞附着于流动腔室的表面以形成细胞单层。将抗体1444灌注于腔室中(0.78至200nm)且在生理流动下以1达因/cm2灌注hl-60细胞。阴性对照物包括同型阴性对照抗体和媒剂。抗e-选择素抗体1444以4.41nm的所估计的ic
50
值中和hl-60细胞与人类cho-e-选择素细胞的细胞粘着。另外,使hl-60对于表达食蟹猕猴e-选择素的细胞中和的所估计的ic
50
值是4.34nm。同型阴性对照抗体并未中和hl-60与表达人类或食蟹猕猴e-选择素的cho细胞的结合。在200nm下的阳性对照抗体测试使hl-60对于表达人类e-选择素的细胞的粘着度降低约44%。
[0977]
在其它流动粘着中和分析中,使用与上文所描述的方法类似的方法,抗体1444分别以4.25nm-4.56nm和4.32nm-4.35nm的所估计的ic
50
值中和hl-60与表达人类或食蟹猕猴e-选择素的cho细胞的粘着(表38)。
[0978]
对被纯化的嗜中性粒细胞粘着于表达e-选择素的中国仓鼠卵巢细胞的中和
[0979]
如所描述在bioflux培养盘上制备人类和食蟹猕猴cho细胞单层。全血获自四个健康志愿者供体(辉瑞)且汇集3ml的各者,且将嗜中性粒细胞根据制造商方案使用miltenyi试剂盒(macsxpress全血嗜中性粒细胞分离试剂盒,人类,130-104-434)进行纯化。
[0980]
以1达因/cm2对包括抗体1444(浓度是0.78至200nm)、同型阴性对照抗体(200nm)、pbs中的阳性对照抗e选择素抗体(200nm)和媒剂对照物的测试制品进行灌注1小时。在分析之前,将经纯化嗜中性粒细胞用钙黄绿素染色且在37℃下用肿瘤坏死因子-α(tnf-α)(百奥堂公司((biotang inc),50-751,5681)处理10分钟。在室温下收集嗜中性粒细胞300
×
g持续10分钟,且使其再悬浮于pbs(具有钙和镁)中。以1达因/cm2灌注嗜中性粒细胞10分钟。将pbs以1达因/cm2灌注2-3分钟以去除非粘着细胞,且使培养盘成像且加以分析。
[0981]
嗜中性粒细胞表达e-选择素配体且e-选择素介导对于内皮的嗜中性粒细胞粘着性。评估在离体生理流动下抗e-选择素抗体对于人类嗜中性粒细胞相对于表达e-选择素(人类或食蟹猕猴)的cho单层的中和。将抗体1444、同型阴性对照抗体或媒剂灌注至腔室中。将人类嗜中性粒细胞自4个健康供体纯化,汇集,且在分析中评估被tnf-α活化(10ng/ml)的嗜中性粒细胞。抗体1444以2.87nm的所估计的ic
50
值中和被活化的人类嗜中性粒细胞对于人类cho-e-选择素细胞的粘着。中和被活化的人类嗜中性粒细胞对于食蟹猕猴cho-e-选择素细胞的粘着的所估计的ic
50
是16.33nm。
[0982]
在其它流动粘着中和分析中,使用与上文所描述的方法类似的方法,抗体1444分别以4.65nm和9.45nm的所估计的ic
50
值中和被活化的人类嗜中性粒细胞与表达人类或食蟹猕猴e-选择素的cho细胞的粘着(表38)。
[0983]
scd血细胞粘着的中和
[0984]
scd中的促发炎反应通过镰状红细胞和经活化内皮细胞中的变化促成(麦宛尼和弗朗内蒂,血液学,2013;122(24):3892-98)。红细胞镰状化、溶血和内皮细胞功能障碍引起发炎和细胞活化且促成scd发病机制。用钙黄绿素和赫斯特(hoechst)标记来自患有scd的2个供体的全血,以观察滚动和粘着。简单来说,在出现之后24小时分析血液,且用含有1mm氯化钙、1mm氯化镁、10mm n-2-羟乙基哌嗪-n-2-甲磺酸、0.25%bsa、0.1%葡萄糖(ph 7.4)的hbss(汉克氏平衡盐溶液)缓冲液稀释至15%的血容比。在分析之前,将血细胞在37℃下用钙黄绿素和赫斯特(赛默科技公司,目录号33342)染料(1:1000)染色30分钟。使流动腔室以1达因/cm2涂布有20μg/ml的于pbs中制备的可溶性重组人类e-选择素和p-选择素蛋白质
(希诺生物公司)中的各者持续5分钟,在室温下培育1-2小时并以1达因/cm2用0.1%bsa/pbs洗涤3-5分钟。
[0985]
对于重组人类e-选择素和p-选择素蛋白质的粘着,评估来自两个供体的血液。使包括抗体1444、pbs中的抗p-选择素抗体对照物(0.78-200nm)、同型阴性对照抗体(200nm)、对照抗e-选择素抗体(200nm)或媒剂的测试制品以1达因/cm2流动1小时。使被稀释的scd血液以0.6达因/cm2流动10分钟。将pbs以1达因/cm2灌注2-3分钟以去除非粘着细胞,且使培养盘成像且加以分析。如上文所描述计算所估计的ic
50
值。基于下式:(ic
50
×
效应)/(100-效应),计算所估计的ic
20
、ic
80
和ic
90
。计算是基于最大效应模型(e
max tmodel)[e=(e
最大值
+c)/(c+ec
50
)]。
[0986]
同型阴性对照抗体并未中和结合。在200mm下测试的阳性对照抗体减少的细胞结合粘着在10%-35%之间。抗体1444以6.17nm和18.66nm(平均值是12.4nm)的所估计的ic
50
值中和人类scd细胞与重组e-选择素的结合(图14)。ic
20
、ic
80
和ic
90
值分别估计为3.1nm、49.6nm和111.6nm。使用可溶性e-选择素和p-选择素蛋白质涂布的腔室在类似生理流动条件下,与p-选择素抑制相比,在e-选择素抑制下观察到细胞粘着的较大中和。
[0987]
表38.抗体1444的关键药理学特性的概述。
[0988]
[0989][0990]
实例31:最佳化抗e-选择素抗体1444的细胞表面结合(facs)和中和。
[0991]
e-选择素表达于内皮细胞表面上和内皮细胞功能障碍的条件下,诸如发炎反应,从而使经由配体-粘着分子相互作用而粘着于血管内皮的血细胞循环。评估抗体1444结合细胞表面表达的e-选择素的能力。在这些研究中,使用表达膜结合人类或食蟹猕猴e-选择素的cho细胞系表征抗体1444与细胞表面表达的e-选择素的结合。
[0992]
通过facs分析使用抗体1444、同型对照igg1和两种对照p-选择素抗体来评估细胞表面上表达e-选择素(人类或食蟹猕猴)或人类p-选择素的cho细胞和对照未被转染的cho细胞(cho-dukx)。抗体1444以0.66至2.33nm的所估计的ec
50
结合于人类e-选择素(基于6次实验)。抗体1444以0.75至1.37nm的所估计的ec
50
结合于食蟹猕猴e-选择素(基于6次实验)。抗体1444未结合于对照cho-dukx,指示不存在可检测细胞表面结合。此外,抗体1444并未结合细胞表面p-选择素。观察到对照抗p-选择素抗体与cho-p-选择素细胞的剂量依赖性结合,指示p-选择素的表达。在同型对照igg1下未观察到结合(表38)。
[0993]
实例32:食蟹猕猴中的耐受性和毒理动力学研究
[0994]
食蟹猕猴是唯一基于活体外药理学研究的药理学相关非临床物种,所述研究被设计成评估抗体1444抑制e-选择素结合和/或生物活性的能力。在整个所评估的分析中,对于人类和食蟹猕猴e-选择素的结合亲和力类似,与其相比来说,对于来自小鼠、兔或大鼠的e-选择素不存在强效结合。活体外功能分析中,抗体1444以剂量依赖性方式中和人类前髓细胞对于可溶性重组人类e-选择素蛋白质和细胞表达的重组人类或食蟹猕猴e-选择素的细胞粘着。另外,抗体1444以在低nm范围内的所估计的50%抑制浓度(ic
50
)值,中和被纯化的嗜中性粒细胞对于人类和食蟹猕猴细胞e-选择素两者的粘着。30mg/kg的皮下剂量与353μg/ml的总最大观察浓度(c
最大值
)和92,500μg
·
h/ml的时间0至336小时的浓度-时间曲线下面积(auc
336
)相关;而100mg/kg的静脉内剂量与693μg/ml的总c
最大值
和108,000μg
·
h/ml的auc
336
相关。每周一次持续1个月以最多200mg/kg/周的剂量向雄性和雌性食蟹猕猴静脉内给予抗体1444,且耐受良好。活体外人类补体组分1q(c1q)和片段可结晶γfc受体(fcγr)结合分析和组织交叉反应性评估未产生安全问题。
[0995]
实例33:动物的药物动力学和产物代谢
[0996]
在静脉内和/或皮下给药抗体1444之后,评估食蟹猕猴中的单次剂量pk和重复剂量tk。在食蟹猕猴中单次静脉内给药后,观察到剂量依赖性清除(cl)且与饱和目标介导的药物处置(tmdd)一致。在以0.3至10mg/kg的剂量范围单次静脉内给药后,抗体1444展现分别大约0.39至0.15ml/h/kg和22至36ml/kg的平均cl和平均vss。在以1mg/kg或3mg/kg单次皮下给药抗体1444之后,在72和96小时时分别观察到t
最大值
,且皮下生物可用性》50%。以3mg/kg用于静脉内的抗体1444的所估计的t
1/2
是大约12天。
[0997]
在1个月glp重复剂量毒性研究中,重复皮下和静脉内给药后全身性暴露量无明显性别相关差异(如通过最大观察浓度[c
最大值
]、浓度-时间曲线下面积[auc]评估)。全身性暴露量随着剂量(皮下)增加而增加且在重复皮下和静脉内给药后较高。每周一次持续1个月(5个总剂量)以15或50mg/kg/周(皮下)或200mg/kg/周(静脉内)的剂量向雄性和雌性食蟹猕猴给予抗体1444。在每周一次以15和50mg/kg/周重复给药之后,在第1天和第22天的给药后,平均t
最大值
在72与112小时之间。全身性暴露量在重复给药后较高,其中对于15(皮下)、50(皮下)和200(静脉内)mg/kg/周,平均蓄积率分别是5.5、3.2和1.9(auc
168
,第22天/第1天)。
[0998]
所预测的在人类中有效的剂量是单次皮下给予150mg的抗体1444。在150mg皮下给药时所预测的最小有效浓度和暴露量分别是14μg/ml的平均浓度(c
av
[1至168小时])和2400μg
·
h/ml的auc
168
。
[0999]
实例34:动物中的e-选择素含量、聚集体和icam-1表达
[1000]
通过液相色谱-质谱分析(lc-ms),按照0.3至10mg/kg范围的抗体1444剂量对食蟹猕猴的血清中可溶性e-选择素进行表征。抗体1444显示呈浓度依赖性方式的e-选择素的有效结合,且在所有剂量组中观察到对可溶性e-选择素的》90%抑制作用,指示抗体1444的活体内e-选择素结合活性。
[1001]
在用抗体1444给药之后,将血液自食蟹猕猴收集且使用荧光活化细胞分选(facs)分析以检测细胞聚集体和粘着标记物。检验单核球血小板聚集体和嗜中性粒细胞-血小板聚集体。在此facs分析中,cd14用于使用大小扫描区别单核球和嗜中性粒细胞,且cd41用于检测单核球-血小板聚集体和嗜中性粒细胞-血小板聚集体。抗体1444显示在处理之后减少食蟹猕猴中单核球-血小板和嗜中性粒细胞-血小板聚集体的作用。
[1002]
使用facs分析,在抗体1444给药之后,检验食蟹猕猴的白细胞中的白细胞细胞间粘着分子1(icam-1)表达。给药后观察到icam-1的减少。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1