偶联脂肪酸分子的抗体及其用途的制作方法
偶联脂肪酸分子的抗体及其用途
相关申请的交叉引用
1.本技术要求2020年2月27日提交的第62/982,476号美国临时申请的优先权。该公开内容通过引用整体并入本文。
发明领域
2.本发明涉及一种分离的单克隆抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含(a)重链可变区(vh);和轻链可变区(vl);其中所述抗体或其抗原结合片段能够特异性结合靶抗原;其中vh、vl中的氨基酸残基、或距离vh或vl二十(20)个氨基酸距离(优选五(5)个氨基酸距离)以内的氨基酸残基被能够被偶联到脂肪酸(fa)的氨基酸残基取代,并且其中所述抗体或其抗原结合片段在被取代的氨基酸残基处与fa偶联后,仍能够与靶抗原特异性结合;并且其中在存在生理水平的白蛋白(例如35至50mg/ml)的情况下,所述结合fa的抗体或其抗原结合片段与靶抗原的特异性结合减少或消除。本发明还涉及多特异性抗体或其抗原结合片段,其中该多特异性抗体或其抗原结合片段包含一个或多个抗原结合臂,该抗原结合臂包含与fa偶联的被取代的氨基酸残基。本发明还涉及编码抗体的核酸和表达载体、含有该载体的重组细胞以及包含该抗体的组合物。还提供了制备抗体的方法、将抗体与fa偶联的方法、制备包含偶联的抗体的组合物的方法以及使用偶联的抗体治疗癌症的方法。以电子形式提交的序列表的引用
3.本技术包含序列表,该序列表以电子形式通过efs-web途径以ascii格式序列表提交,其文件名为“065799.32wo1序列表”,创建日期为2021年2月22日,大小为29kb。通过efs-web途径提交的序列表构成本说明书的一部分,其通过引用整体并入本文。发明背景
4.t细胞接合器是由两个结合结构域组成的分子,其中一个结合结构域结合癌细胞表面表达的肿瘤相关抗原(taa),另一个结合到t细胞表面分子以激活t细胞。虽然各种t细胞结合结构域已被用作激活成分,但抗cd3结合域已广泛用作t细胞接合器的一部分。抗cd3双特异性抗体已被用作t细胞接合免疫治疗剂,用于将t细胞招募到肿瘤细胞中,以促进癌症的杀伤。这种免疫肿瘤学方法的一个主要问题是细胞因子释放综合征(crs)的风险。在远离肿瘤微环境的部位调节这些试剂在t细胞激活中的活性可以帮助降低crs和其他毒性的风险。
5.脂肪酸(fas)在循环血液中浓度较高。由于其疏水性,脂肪酸与范围为35-50mg/ml的血液白蛋白分子结合(peters,t.,1996.关于白蛋白的一切:生物化学、遗传学和医学应用(all about albumin:biochemistry,genetics and medical applications).加利福尼亚州圣地亚哥:学术出版社有限公司)。已鉴定出白蛋白上七种常见的fa结合位点(bhattacharya等人,j mol biol.2000.303:721-32;petitpas等人,j mol biol.2001.314:955-60)。此外,有人提出肿瘤使用白蛋白作为能量来源来支持其侵袭性生长(merlot等人,front physiol.2014.5:299),这与肿瘤部位的高白蛋白分解代谢率相符
合(hradec,br j cancer.1958.12:290-304;andersson等人,j surg res.1991.50:156-62;schilling等人,int j rad appl instrum b.1992.19:685-95;stehle等人,crit rev oncol hemicol.1997.26:77-100)。肿瘤部位白蛋白的高周转率提示肿瘤微环境中白蛋白浓度降低。因此,预计某些肿瘤细胞周围的白蛋白水平低于循环血液中的白蛋白水平。此外,据报道,与血清浓度相比,脂肪组织和骨骼肌中的间质白蛋白浓度显著降低(ellmerer等人,am.j.physiol.endocrinol.metab.278:e352-e356(2000))。
6.利用组织(如脂肪组织、骨骼肌和肿瘤微环境)中与循环血液相比较低的白蛋白水平,可以使用fa与白蛋白的结合来调节靶向低白蛋白水平的组织或部位的疗法的活性。这可以通过将fa偶联到治疗活性部位来实现,以便当白蛋白结合到fa时,治疗活性降低或消除。当这种方法应用于免疫肿瘤疗法(如抗cd3单克隆抗体和/或双特异性抗体)时,它有潜力降低癌症治疗方法中crs和其他毒性的风险。
技术实现要素:
7.在一个一般方面,本发明涉及一种分离的单克隆抗体或其抗原结合片段,其中所述抗体或其抗原结合片段包含(a)重链可变区(vh);和轻链可变区(vl);其中所述抗体或其抗原结合片段结合靶抗原,优选人靶抗原;其中vh、vl中的氨基酸残基、或距离vh或vl二十(20)个氨基酸距离(优选五(5)个氨基酸距离)以内的氨基酸残基被偶联脂肪酸(fa)的氨基酸残基取代,并且其中所述抗体或其抗原结合片段在被取代的氨基酸残基处与fa偶联后,仍与靶抗原结合;并且其中在存在生理水平的白蛋白(例如35至50mg/ml)的情况下,所述结合fa的抗体或其抗原结合片段与靶抗原的特异性结合减少或消除。例如,被取代的氨基酸残基可以是半胱氨酸残基或赖氨酸残基或适合化学偶联的修饰氨基酸。
8.在某些实施方式中,被取代的氨基酸位于对应于seq id no:1的残基25、27、62、64、73、76、101、112或113的氨基酸残基处,或对应于seq id no:2的残基26、27、52、53、56或67的氨基酸残基处,优选地所述取代是选自下组的取代:对应于seq id no:1的s25c、y27c、k62c、k64c、k73c、s76c、d101c、s112c或s113c,或对应于seq id no:2的s26c、s27c、s52c、k53c、s56c或s67c,其中所述残基依照kabat编号。在某些实施方式中,所述被取代的氨基酸位于对应于seq id no:1的残基64处或对应于seq id no:2的残基26处,优选地该取代选自对应于seq id no:1的k64c取代或对应于seq id no:2的s26c取代,其中所述残基依照kabat编号。
9.在某些实施方式中,所述被取代的氨基酸位于seq id no:9、10、11或12的残基119或120处,或seq id no:13或14的残基121或124处,优选地所述取代选自seq id no:9、10、11或12的s119c或t120c、或seq id no:13或14的s121c或q124c,其中所述残基依照eu编号进行编号。在某些实施方式中,被取代的氨基酸位于seq id no:9、10、11或12的残基120处,优选地所述取代为t120c取代,其中所述残基依照eu编号进行编号。
10.在某些实施方式中,所述分离的单克隆抗体或其抗原结合片段是抗免疫细胞调节剂(icm)抗体或其抗原结合片段,并且能够与icm(优选人icm)特异性结合。icm可以例如选自下组:cd3、cd27、cd28、cd40、cd122、ox40、cd16、4-1bb、gitr、icos、ctla-4、pd-1、lag-3、tim-3、tigit、vista、siglec7、nkg2d、siglec9、kir、cd91、btla、nkp46、b7-h3、siprα和其他细胞表面免疫调节分子。
11.在某些实施方式中,所述抗icm抗体或其抗原结合片段是抗cd3的抗体或其抗原结合片段,并且能够与cd3(优选人cd3)特异性结合。分离的抗cd3抗体或其抗原结合片段可以包括例如重链互补决定区1(hcdr1)、hcdr2、hcdr3、轻链互补决定区1(lcdr1)、lcdr2和lcdr3,其分别具有seq id no:3、4、5、6、7和8所示的多肽序列,或分别具有seq id no:33、34、35、36、37和38所示的多肽序列。
12.在某些实施方式中,所述被取代的氨基酸位于抗cd3 mab的vh(seq id no:1或seq id no:27)中的残基25、27、62、64、73、76、101、112或113处,或抗cd3 mab的vl(seq id no:2或seq id no:28)中的残基26、27、52、53、56或67处,优选地,所述取代选自vh(seq id no:1或27)中的s25c、y27c、k62c、k64c、k73c、s76c、d101c、s112c或s113c,或vl(seq id no:2或28)中的s26c、s27c、s52c、k53c、s56c或s67c,其中所述残基依照kabat编号。在某些实施方式中,所述被取代的氨基酸位于vh(seq id no:1或27)中的残基64处或vl(seq id no:2或28)中的残基26处,优选地所述取代选自vh(seq id no:1或27)中的k64c取代或vl(seq id no:2或28)中的s26c取代,其中所述残基依照kabat编号。
13.所述分离的抗cd3抗体或其抗原结合片段可以例如包括具有seq id no:1所示多肽序列并具有k64c氨基酸取代的vh区和具有seq id no:2所示多肽序列的vl区;或具有seq id no:27所示多肽序列并具有k64c氨基酸取代的vh区和具有seq id no:28所示多肽序列的vl区;或具有seq id no:1所示多肽序列的vh区和具有seq id no:2所示多肽序列并具有s26c氨基酸取代的vl区;或具有seq id no:27所示多肽序列的vh区和具有seq id no:28所示多肽序列并具有s26c氨基酸取代的vl区;或具有选自seq id no:9、10、11或12所示多肽序列并具有t120c氨基酸取代的重链恒定结构域1(ch1)区和具有选自seq id no:13或14所示多肽序列的轻链恒定结构域(cl)区;或具有seq id no:1所示多肽序列的vh区、具有seq id no:2所示多肽序列的vl区、具有选自seq id no:9、10、11或12所示多肽序列且具有t120c氨基酸取代的ch1区,以及具有选自seq id no:13或14所示多肽序列的cl区;或具有seq id no:27所示多肽序列的vh区、具有seq id no:28所示多肽序列的vl区、具有选自seq id no:9、10、11或12所示多肽序列且具有t120c氨基酸取代的ch1区,以及具有选自seq id no:13或14所示多肽序列的cl区。
14.在某些实施方式中,提供了分离的多特异性抗体或其抗原结合片段,其中,所述多特异性抗体或其抗原结合片段包括本发明的单克隆抗体或其抗原结合片段,并且其中所述多特异性抗体或其抗原结合片段包括一个或多个抗原结合臂,所述抗原结合臂包含与fa偶联的被取代的氨基酸残基。所述多特异性抗体或其抗原结合片段可以例如为双特异性抗体或其抗原结合片段。
15.在某些实施方式中,所述双特异性抗体或其抗原结合片段包括第一抗原结合臂(ab1)和第二抗原结合臂(ab2),其中ab1和/或ab2包含与fa偶联的被取代的氨基酸。
16.在某些实施方式中,ab1结合免疫细胞调节剂(icm),优选人icm。icm可以例如选自下组:cd3、cd27、cd28、cd40、cd122、ox40、cd16、4-1bb、gitr、icos、ctla-4、pd-1、lag-3、tim-3、tigit、vista、siglec7、nkg2d、siglec9、kir、cd91、btla、nkp46、b7-h3、siprα和其他细胞表面免疫调节分子。在某些实施方式中,所述icm为cd3,优选人cd3。
17.在某些实施方式中,ab2结合肿瘤相关抗原(taa),优选人肿瘤相关抗原(人taa)。taa可以例如为dll3。
18.在某些实施方式中,所述双特异性抗体或其抗原结合片段包括:第一抗原结合臂(ab1),其包括h1和l1,和第二抗原结合臂(ab2),其包括h2和l2,其中(a)h1和h2各自包括人igg1、igg2、igg3或igg4的ch1区;并且(b)l1和l2各自包括人κ轻链或人λ轻链的cl区;其中,h1l1和h2l2各自包括选自下组氨基酸取代的电荷对:(1)分别在h1的ch1中的g166d/e和l1的cl中的s114k/r,以及分别在h2的ch1中的g166k/r和l2的cl中的s114d/e;(2)分别在h1的ch1中的t187d/e和l1的cl中的d/n170k/r,以及分别在h2的ch1中的t187k/r和l2的cl中的d/n170d/e;(3)分别在h1的ch1中的s131d/e和l1的cl中的p119k/r,以及分别在h2的ch1中的s131k/r和l2的cl中的p119d/e;(4)分别在h1的ch1中的a129d/e和l1的cl中的s121k/r,以及分别在h2的ch1中的a129k/r和l2的cl中的s121d/e;(5)分别在h1的ch1中的k/r133d/e和l1的cl中的k207k/r,以及分别在h2的ch1中的k/r133k/r和l2的cl中的k207d/e;(6)分别在h1的ch1中的k/r133d/e和l1的cl中的i/l117k/r,以及分别在h2的ch1中的k/r133k/r和l2的cl中的i/l117d/e;(7)分别在h1的ch1中的k/r133d/e和l1的cl中的f/v209k/r,以及分别在h2的ch1中的k/r133k/r和l2的cl中的f/v209d/e;(8)分别在h2的ch1中的g166d/e和l2的cl中的s114k/r,以及分别在h1的ch1中的g166k/r和l1的cl中的s114d/e;(9)分别在h2的ch1中的t187d/e和l2的cl中的d/n170k/r,以及分别在h1的ch1中的t187k/r和l1的cl中的d/n170d/e;(10)分别在h2的ch1中的s131d/e和l2的cl中的p119k/r,以及分别在h1的ch1中的s131k/r和l1的cl中的p119d/e;(11)分别在h2的ch1中的a129d/e和l2的cl中的s121k/r,以及分别在h1的ch1中的a129k/r和l1的cl中的s121d/e;(12)分别在h2的ch1中的k/r133d/e和l2的cl中的k207k/r,以及分别在h1的ch1中的k/r133k/r和l1的cl中的k207d/e;(13)分别在h2的ch1中的k/r133d/e和l2的cl中的i/l117k/r,以及分别在h1的ch1中的k/r133k/r和l1的cl中的i/l117d/e;或(14)分别在h2的ch1中的k/r133d/e和l2的cl中的f/v209k/r,以及分别在h1的ch1中的k/r133k/r和l1的cl中的f/v209d/e。
19.在某些实施方式中,所述双特异性抗体或其抗原结合片段包括:第一抗原结合臂(ab1),其包括具有seq id no:15所示多肽序列的vh区、具有seq id no:17所示多肽序列的vl区、具有seq id no:16所示多肽序列的ch1区,以及具有seq id no:18所示多肽序列的cl区。
20.在某些实施方式中,所述双特异性抗体或其抗原结合片段包括:第一抗原结合臂(ab1),其包括具有seq id no:19所示多肽序列的vh区、具有seq id no:21所示多肽序列的
vl区、具有seq id no:20所示多肽序列的ch1区,以及具有seq id no:22所示多肽序列的cl区。
21.在某些实施方式中,所述双特异性抗体或其抗原结合片段包括:第一抗原结合臂(ab1),其包括具有seq id no:29所示多肽序列的vh区、具有seq id no:30所示多肽序列的vl区、具有seq id no:16所示多肽序列的ch1区,以及具有seq id no:18所示多肽序列的cl区。
22.在某些实施方式中,所述双特异性抗体或其抗原结合片段包括:第一抗原结合臂(ab1),其包括具有seq id no:31所示多肽序列的vh区、具有seq id no:32所示多肽序列的vl区、具有seq id no:20所示多肽序列的ch1区,以及具有seq id no:22所示多肽序列的cl区。
23.在某些实施方式中,双特异性抗体或其抗原结合片段包含:(a)第一抗原结合臂(abl),其包含具有seq id no:15所示多肽序列的vh区,具有seq id no:17所示多肽序列的vl区、具有seq id no:16所示多肽序列的ch1区,和具有seq id no:18所示多肽序列的cl区;和第二抗原结合臂(ab2),其包含具有seq id no:23所示多肽序列的vh区、具有seq id no:25所示多肽序列的vl区、具有seq id no:24所示多肽序列的ch1区,和具有seq id no:26所示多肽序列的cl区;(b)第一抗原结合臂(abl),其包含具有seq id no:19所示多肽序列的vh区,具有seq id no:21所示多肽序列的vl区、具有seq id no:20所示多肽序列的ch1区,和具有seq id no:22所示多肽序列的cl区;和第二抗原结合臂(ab2),其包含具有seq id no:23所示多肽序列的vh区、具有seq id no:25所示多肽序列的vl区、具有seq id no:24所示多肽序列的ch1区,和具有seq id no:26所示多肽序列的cl区;(c)第一抗原结合臂(abl),其包含具有seq id no:29所示多肽序列的vh区,具有seq id no:30所示多肽序列的vl区、具有seq id no:16所示多肽序列的ch1区,和具有seq id no:18所示多肽序列的cl区;和第二抗原结合臂(ab2),其包含具有seq id no:23所示多肽序列的vh区、具有seq id no:25所示多肽序列的vl区、具有seq id no:24所示多肽序列的ch1区,和具有seq id no:26所示多肽序列的cl区;或(d)第一抗原结合臂(abl),其包含具有seq id no:31所示多肽序列的vh区,具有seq id no:32所示多肽序列的vl区、具有seq id no:20所示多肽序列的ch1区,和具有seq id no:22所示多肽序列的cl区;和第二抗原结合臂(ab2),其包含具有seq id no:23所示多肽序列的vh区、具有seq id no:25所示多肽序列的vl区、具有seq id no:24所示多肽序列的ch1区,和具有seq id no:26所示多肽序列的cl区。
24.在某些实施方式中,所述分离的抗体或其抗原结合片段在被取代的氨基酸残基处与fa偶联。所述fa可以例如选自下组:具有6个碳、8个碳、10个碳、12个碳、14个碳、16个碳,或18个碳,或介于之间的任意数量的碳的fa。在某些实施方式中,所述fa选自下组:具有14个碳或18个碳或介于之间的任意数量的碳的fa。
25.在某些实施方式中,fa包含用于偶联到被取代的氨基酸残基的连接子。所述连接子可以例如选自肽连接子或聚乙二醇(peg)连接子。肽连接子可以例如少于50个氨基酸。
26.在某些实施方式中,与抗体或其抗原结合片段偶联的fa能够结合白蛋白,其中白蛋白与fa的结合导致靶抗原与抗体或其抗原结合片段之间的结合部分或完全阻断。在某些
实施方式中,其中分离的抗体或其抗原结合片段是双特异性抗体或其抗原结合片段,白蛋白与ab1臂上的fa的结合不会影响ab2臂与其抗原的结合,或者白蛋白与ab2臂上的fa的结合不会影响ab1臂与其抗原之间的结合。在某些实施方式中,与未结合白蛋白的偶联fa的分离抗体或其抗原结合片段相比,与白蛋白结合的偶联fa的分离抗体或其抗原结合片段激活t细胞的能力降低。
27.还提供了编码本发明的分离抗体或其抗原结合片段的分离核酸。
28.还提供了包含编码本发明的分离抗体或其抗原结合片段的分离核酸的载体。
29.还提供了含有本发明的载体的宿主细胞。
30.还提供了包含本发明的分离抗体或其抗原结合片段和药学上可接受的载体的药物组合物。在某些实施方式中,所述药物组合物包含偶联fa的分离的抗体或其抗原结合片段和药学上可接受的载体。在某些实施方式中,所述药物组合物包含偶联fa的分离的抗体或其抗原结合片段和药学上可接受的载体,其中fa与白蛋白结合。
31.还提供了治疗有需要的受试者的癌症的方法,所述方法包括向所述受试者施用本发明的药物组合物。所述癌症可以例如选自下组:肺癌、胃癌、食管癌、胆道癌、胆管癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、神经胶质瘤、胶质母细胞瘤和其他实体瘤,以及非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、慢性粒细胞白血病(cml)、多发性骨髓瘤(mm)、急性髓性白血病(aml)和其他血液肿瘤。
32.还提供了生产本发明的分离的抗体或其抗原结合片段的方法。所述方法包括在生产抗体或其抗原结合片段的条件下培养包含编码抗体或其抗原结合片段的核酸的细胞,以及任选地从细胞或培养物中回收抗体或其抗原结合片段。
33.还提供了生产本发明的偶联fa的分离抗体或其抗原结合片段的方法。所述方法包括将fa与抗体或其抗原结合片段在被取代的氨基酸残基处偶联。还提供了制备偶联fa并与白蛋白结合的分离抗体或其抗原结合片段的方法,所述方法包括将偶联fa的分离的抗体或其抗原结合片段与白蛋白接触。
34.还提供了制备包含本发明的分离抗体或其抗原结合片段的药物组合物的方法。所述方法包括将抗体或其抗原结合片段与药学上可接受的载体结合以获得药物组合物。
35.还提供了一种方法,其包括将白蛋白与一偶联物接触,所述偶联物含共价连接(可选地通过连接子连接)至抗体或其抗原结合片段的脂肪酸(fa),其中所述偶联物中的抗体或其抗原结合片段能够特异性结合靶抗原,所述偶联物中的fa能够结合白蛋白,并且白蛋白结合至fa导致靶抗原与抗体或其抗原结合片段之间的结合部分或完全阻断。在某些实施方式中,抗体或其抗原结合片段在vh、vl或在距离vh或vl的二十(20)个氨基酸距离内(优选地五(5)个氨基酸的距离内),含有一个或多个被取代的氨基酸残基,并且所述一个或多个被取代的氨基酸残基共价连接到fa,可选地通过连接子连接。在某些实施方式中,所述接触步骤包括给有需要治疗肿瘤的受试者施用包含所述偶联物的药物组合物,其中所述肿瘤包含所述靶抗原。在某些实施方式中,与循环血液相比,白蛋白在肿瘤微环境中具有更高的周转率,和/或白蛋白以低于受试者循环血液中的白蛋白水平存在于肿瘤微环境中。附图简述
36.下面结合附图以更好地理解前述概要以及以下关于本技术的优选实施方式的详
细描述。应理解,本技术并不限于附图中所示的具体实施例。
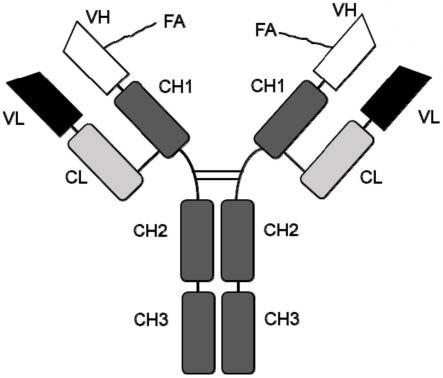
37.图1a-1e显示了vh区偶联有脂肪酸(fa)分子的单克隆抗体(mab)(图1a)和双特异性抗体(bsab)(图1b和1c)的结构示意图、偶联fa的双特异性抗体在体内的作用模式图(图1d),以及鉴定偶联fa的抗体的策略的示意图(图1e)。图1a-1c提供的示意图仅用于说明目的,因为偶联位点可以位于fab区域(包括vl区域和cl区域)内的其他合适位点上。此外,在图1b-1c中,双特异性抗体的两个臂都可被偶联。fa可以在不同程度上潜在地调节偶联的臂的抗原结合活性。在图1a中,显示了fa分子与双臂的vh区偶联;在图1b中,显示了fa分子与双特异性抗体的臂之一的vh区偶联;在图1c中,显示了fa分子与双特异性抗体臂之一的ch1区偶联。预计偶联的臂的抗原结合活性会受到白蛋白的调节,因为结合到偶联的fa上的白蛋白可以完全或部分阻断偶联的臂与靶抗原的结合。图1d显示了用于在体内使t细胞靶向癌细胞的偶联fa的双特异性抗体的作用模式。当双特异性抗体的两条臂都与fa偶联时,可以达到相同的目的;然而在这种情况下,与仅有一条臂被偶联的双特异性抗体相比,白蛋白的调节作用可以增加。此外,图1d显示了白蛋白水平如何调节偶联fa的双特异性抗体的抗原结合活性。图1e显示了鉴定偶联fa的mab或bsab的具体步骤。白蛋白依赖性活性是指偶联抗体的活性受到白蛋白的调节(即高浓度的白蛋白降低或完全阻断抗原结合活性)。
38.图2a-2d显示了示例抗体的氨基酸序列。图2a显示了抗cd3抗体的vh区的氨基酸序列(seq id no:1)。图2b显示了抗cd3抗体的vl区的氨基酸序列(seq id no:2)。图2c显示了人igg1的ch1区域(seq id no:9)、人igg2的ch1区域(seq id no:10)、人igg3的ch1区域(seq id no:11),和人igg4的ch1区域(seq id no:12)的氨基酸序列。图2d显示了人κ轻链cl区域(seq id no:13)和λ轻链cl区域(seq id no:14)的氨基酸序列。灰色突出显示了由imgt和kabat法组合确定的cdr区域。*表示已知等位基因变异的位点。
39.图3a-3g显示了在抗cd3单克隆抗体(mab)中进行取代和偶联fa的选定氨基酸残基的例子。图3a显示了fab区域(包含vh、ch1、vl和cl)在抗cd3 mab中的3d建模,以识别用于fa偶联的半胱氨酸敲入的潜在位点。在3d结构中显示了四个位点作为示例(lc_s26、lc_s31、hc_k64和hc_t120)(lc:轻链;hc:重链)。其他位点如表3所示。图3b-3g显示的图表展示了敲入半胱氨酸的抗cd3 mab与jurkat细胞上的cd3的结合。mfi:平均荧光强度。抗cd3 mab,野生型抗cd3 mab。
40.图4a-4c显示了与抗cd3 mab偶联的fa分子的结构以及偶联fa的抗cd3 mab的质谱(ms)谱图。图4a显示了用于偶联的fa分子的结构。所有fa分子都通过peg连接子偶联。图4b显示了与c18 fa偶联的单克隆抗体(lc_s26c、hc_k64c和hc_t120c)的ms谱图。图4c显示了分别与c6、c10和c14 fa偶联的hc_k64c mab的ms谱图。expt,预期的解卷积质量;obs,观察到的解卷积质量。lc_s26c代表抗cd3 mab,其中轻链s26位点的丝氨酸被半胱氨酸取代;所有其他敲入半胱氨酸的mab都遵循相同的命名规则。
41.图5a-5c显示了白蛋白对偶联c18 fa的抗cd3 mab与jurkat细胞上的cd3的结合的影响。该测定在不存在或存在50mg/ml牛血清白蛋白(bsa)的情况下进行。图5a,偶联的lc_s26c;图5b,偶联的hc_k64c;图5c,偶联的hc_t120c。
42.图6a-6c显示了不同浓度的白蛋白对偶联c18 fa的抗cd3 mab激活t细胞的影响。图6a,偶联的lc_s26c;图6b,偶联的hc_k64c;图6c,偶联的hc_t120c。测定培养基中含有1%fbs(胎牛血清);标记的bsa浓度代表添加到测定培养基中的bsa。
43.图7a-7c显示了不同浓度的白蛋白对分别偶联c6、c10和c14 fa的抗cd3 mab激活t细胞的影响。图7a,偶联c6 fa的hc_k64c;图7b,偶联c10 fa的hc_k64c;图7c,偶联c14 fa的hc_k64c。测定培养基中含有1%fbs;标记的bsa浓度代表添加到测定培养基中的bsa;对照,不添加bsa。
44.图8a-8c显示了纯化的抗dll3/抗cd3双特异性抗体bsab hc_k64c的纯度,其中抗cd3臂的hc上的残基k64被半胱氨酸取代。图8a显示了含某些杂质标准品的纯化的bsab hc_k64c的hic hplc分析结果;图8b显示了含某些杂质标准品的纯化的bsab hc_k64c的scx hplc分析结果;图8c显示了纯化的bsab hc_k64c的sec hplc分析结果。抗cd3杵(knob)同型二聚体/半分子,是从用抗cd3 hc和抗cd3 lc转染的细胞培养基中蛋白a纯化的杂质标准品;抗dll3臼(hole)同源二聚体/半分子,是从用抗dll3 hc和抗dll3 lc转染的细胞培养基中蛋白a纯化的杂质标准品;2x抗cd3 lc错配,是从用抗cd3hc、抗cd3 lc和抗dll3 hc转染的细胞培养基中蛋白a纯化的杂质标准品;2x抗dll3 lc错配,是从用抗cd3 hc、抗dll3 hc和抗dll3 lc转染的细胞培养基中蛋白a纯化的杂质标准品。半分子,只有一个hc和一个lc的半igg分子。
45.图9a-9c显示了纯化的抗dll3/抗cd3双特异性抗体bsab hc_t120c的纯度,其中抗cd3臂的hc上的残基t120被半胱氨酸取代。图9a显示了含某些杂质标准品的纯化的bsab hc_t120c的hic hplc分析结果;图9b显示了含某些杂质标准品的纯化的bsab hc_t120c的scx hplc分析结果;图9c显示了纯化的bsab hc_t120c的sec hplc分析结果。抗cd3杵(knob)同型二聚体/半分子,是从用抗cd3 hc和抗cd3 lc转染的细胞培养基中蛋白a纯化的杂质标准品;抗dll3臼(hole)同源二聚体/半分子,杂质标准品,是从用抗dll3 hc和抗dll3 lc转染的细胞培养基中蛋白a纯化的;2x抗cd3 lc错配,是从用抗cd3 hc、抗cd3 lc和抗dll3 hc转染的细胞培养基中蛋白a纯化的杂质标准品;2x抗dll3 lc错配,是从用抗cd3 hc、抗dll3 hc和抗dll3 lc转染的细胞培养基中蛋白a纯化的杂质标准品。半分子,只有一个hc和一个lc的半igg分子。
46.图10a-10b显示了与脂肪酸分子偶联的纯化的抗dll3/抗cd3双特异性抗体的纯度。图10a显示了偶联脂肪酸分子的纯化的抗dll3/抗cd3双特异性抗体的hic hplc分析结果;图10b显示了偶联脂肪酸分子的纯化的抗dll3/抗cd3双特异性抗体的sec hplc分析结果。bsab hc_t120c_c18是指与c18fa偶联的抗dll3/抗cd3双特异性抗体bsab hc_t120c;其他偶联双特异性抗体遵循相同的命名规则。
47.图11显示了在存在或不存在阻断抗体的情况下,未偶联的和偶联的抗dll3/抗cd3双特异性抗体对shp-77和jurkat细胞进行交联测定的结果。抗dll3阻断型mab是抗dll3臂的mab版本;抗cd3阻断型mab是抗cd3臂的mab版本(无半胱氨酸敲入)。wt bsab,野生型抗dll3/抗cd3双特异性抗体(无半胱氨酸敲入);shp-77+jurkat对照,用不添加抗体的细胞进行的测定。
48.图12a-12b显示了在shp-77细胞(表达dll3)存在下,由未偶联和偶联的抗dll3/抗cd3双特异性抗体介导的jurkat细胞上t细胞-受体-cd3(tcr/cd3)复合物的活化结果。抗dll3阻断型mab用于抑制活化,以证明jurkat细胞活化需要双特异性抗体同时结合shp-77细胞。测定培养基中含有0.5%fbs。
49.图13a-13b显示了在shp-77细胞(表达dll3;也即靶细胞)存在下,bsa对由未偶联
和偶联的抗dll3/抗cd3双特异性抗体介导的jurkat细胞上tcr/cd3复合物的活化的影响结果。测定培养基中含有0.5%fbs;标记的bsa浓度代表添加到测定培养基中的bsa。
50.图14显示了elisa测定的结果,所述elisa测定用于评估bsa对偶联的双特异性抗体其抗dll3臂的抗原结合活性的影响。抗dll3 f(ab')2作为对照,以抑制偶联的双特异性抗体其抗dll3臂与dll3的结合。发明详述
51.在背景和说明书中引用或描述了各种出版物、文献和专利;这些参考文献中的每一项均通过引用整体并入本文。讨论包含在本说明书中的文件、行为、材料、装置、物品等的目的是为了提供本发明的背景。这类讨论并不承认任何或所有这些事项构成与任何已公开或要求保护的发明相关的现有技术的一部分。
52.除非另外定义,否则本说明书使用的所有技术和科学术语的含义与本发明所属领域内普通技术人员通常理解的含义相同。除此之外,本文使用的某些术语具有说明书中阐述的含义。
53.须注意,如本文和所附权利要求中所用,除非上下文另有明确规定,否则单数形式“一”、“一种”和“该”包括复数引用。
54.除非另有声明,否则本文描述的任何数值,例如浓度或浓度范围,在所有情况下都应理解为被术语“约”修饰。因此,数值通常包括所列举数值的
±
10%。例如,浓度为1mg/ml包括了0.9mg/ml至1.1mg/ml。类似地,浓度范围1%至10%(w/v)包括了0.9%至11%(w/v)。除非上下文另有明确规定,否则本文所使用的数值范围明确包括所有可能的子范围、该范围内的所有单个数值,包括这些范围内的整数和这些数值的分数。
55.除非另有声明,否则出现在一系列元素前的术语“至少”应被理解为指该系列中的每个元素。本领域技术人员将认识到或能够仅通过常规实验确定本文描述的本发明的特定实施例的许多等同替代。本发明意在包含这些等同替代。
56.本文所使用的术语“包含”、“包含的”、“包括”、“包括的”、“具有”、“具有的”、“含有”或“含有的”或任何其他变体,应被理解为表示包含所阐明的整型或整型组,但不排除任何其他整型或整型组,并且是非排他性或开放性的。例如,包含一系列元素的组合物、混合物、过程、方法、物品或设备不必仅限于这些元素,也可包含其他未明确列出的元素或此类组合物、混合物、过程、方法、物品或设备固有的元素。进一步,除非另有明确相反规定,否则“或”是指包含性的或,而不是排除性的或。例如,下列任意一项都满足a或b的情况:a是正确的(或存在的)且b是错误的(或不存在的),a是错误的(或不存在的)且b是正确的(或存在的),以及a和b都是正确的(或存在的)。
57.本文所使用的在多个列举元素之间的连词术语“和/或”应被理解为包括单独和组合选项。例如,当两个元素被“和/或”连接,第一选项是适用第一元素而排除第二元素。第二选项是适用第二元素而排除第一元素。第三选项是同时适用第一和第二元素。这些选项中的任一项均应被理解为包括在其含义中,从而满足本文使用术语“和/或”的需求。这些选项中多项的同时适用也均应被理解为包括在其含义中,从而满足所述术语“和/或”的需求。
58.如本文所用,说明书和权利要求中使用的术语“由
……
组成”(consists of)或诸如“由
……
构成”(consist of)或“由
……
形成”(consisting of)之类的变体表示包括任何列举的整型或整型组,但不表示额外的整型或整型组可被添加到指定的方法、结构或组合
中。
59.如本文所用,说明书和权利要求中使用的术语“基本上由
……
组成”(consists essentially of)或诸如“基本上由
……
构成”(consist essentially of)或“基本上由
……
形成”(consisting essentially of)之类的变体表示包括任何列举的整型或整型组,并且可选地包括所列举的任何整型或整型组,只要它们不会实质性地改变特定方法、结构或成分的基本性质或新特性。见m.p.e.p.
§
2111.03。
60.本文所使用的“受试者”指任何动物,优选哺乳动物,最优选人。本文所使用的术语“哺乳动物”包括任何哺乳动物。哺乳动物的例子包括但不限于牛、马、羊、猪、猫、狗、小鼠、大鼠、兔、豚鼠、猴子、人等,更优选人。
61.词语“右”、“左”、“下”和“上”表示参考的附图中的方向。
62.应理解,当提及优选发明的组件的尺寸或特性时,本文所使用的术语“大约”、“近似”、“大体上”、“基本上”或其他类似术语,表示所描述的尺寸/特征并非严格的界限或参数,并且不排除在功能上相同或相似的微小变化,正如本领域普通技术人员所理解的那样。至少,包括数值参量的此类描述将包括使用本领域中接受的数学和工业原理(例如,舍入、测量或其他系统误差、制造公差等)的变化,该变化不会改变最低有效数值。
63.如本文所用,在说明书和权利要求书中使用的术语“不同的重链”或“不同的轻链”表明具有彼此不相同的序列的重链或轻链。
64.在有两个或多个核酸或多肽序列(例如,抗dll3抗体、抗cd3抗体、抗cd3/抗dll3双特异性抗体、dll3多肽及编码它们的多核苷酸,以及cd3多肽及编码它们的多核苷酸)的上下文中,术语“相同的”或“同一性”百分比指两条或多条相同或具有一定百分比相同氨基酸残基或核苷酸的序列或子序列,当进行比较和比对以获得最大对应时,使用以下序列比较算法之一或通过目视检查进行测量。
65.进行序列比较时,通常用一条序列作为参考序列,与测试序列进行比较。使用序列比较算法时,将测试序列和参考序列输入计算机,必要时指定子序列坐标,并指定序列算法程序参数。序列比较算法随后基于指定的程序参数计算测试序列相对于参考序列的序列同一性百分比。
66.用于比较的序列的最佳比对可以通过下述方法进行,例如,通过smith和waterman,adv.appl.math.2:482(1981)的局部同源性算法、通过pearson和lipman,proc.proc.nat’l.acad.sci.usa 85:2444(1988)的相似性搜索法,通过这些算法的计算机实现(威斯康星州遗传学软件包中的gap、bestfit、fasta和tfasta,遗传学计算机组,575科学madison博士,威斯康星州),或通过目视检查(一般参见f.m.ausubel等编辑的《分子生物学实验室指南(current protocols in molecular biology)》,刊于《实验室指南(current protocols)》,格林联合出版公司(greene publishing associates,inc)和约翰威利父子出版公司(john wiley&sons,inc.)合资企业出版,(1995年增刊)(ausubel))。
67.适用于确定序列同一性百分比和序列相似性的算法示例是blast和blast 2.0算法,分别描述于altschul等(1990)j.mol.biol.215:403-410和altschul等(1997)nucleic acids res.25:3389-3402。进行blast分析的软件可通过美国国立生物技术信息中心公开获得。该算法首先通过识别查询序列中长度为w的短片段来识别高评分序列对(hsp),当短片段与数据库序列中相同长度的片段对齐,则这些片段匹配或符合某个正阈值分数t。t指
邻近词打分阈值(altschul等,见前)。这些最初的邻近词命中充当种子,用于启动搜索以找到包含它们的更长的hsp。然后沿着每条序列向两端延伸命中序列,直到累积对齐分数不再增加。
68.对于核苷酸序列,累积分数使用参数m(一对匹配残基的奖励分数;总是>0)和n(错配残基的罚分;总是<0)计算。对于氨基酸序列,使用评分矩阵计算累积分数。命中序列在每个方向上的延伸在下列情况下停止:累积对齐分数从其达到的最大值下降了值x;由于一个或多个负评分残基比对的累积,累积分数降到了0或0以下;或到达了任一序列的末尾。blast算法的参数w、t和x决定了比对的灵敏度和速度。blastn程序(用于核苷酸序列)的默认字长(w)为11,期望值(e)为10,m=5,n=-4,并比较两条链。用于氨基酸序列的blastp程序的默认字长(w)为3、期望值(e)为10,并使用blosum62评分矩阵(参见henikoff和henikoff,proc.natl.acad.sci.usa 89:10915(1989))。
69.除了计算序列同一性百分比之外,blast算法还对两条序列之间的相似性进行统计分析(参见例如karlin和altschul,proc.nat'l.acad.sci.usa90:5873-5787(1993))。blast算法提供的一种相似性指数是最小总概率(p(n)),它提供了两条核苷酸或氨基酸序列之间偶然发生匹配的概率的指标。例如,如果测试核酸与参考核酸的比较中的最小总概率小于约0.1,更优选小于约0.01,最优选小于约0.001,则认为该核酸与参考序列相似。
70.两条核酸序列或多肽基本相同的进一步指征是由第一核酸编码的多肽与由第二核酸编码的多肽有免疫交叉反应,如下所述。因此,多肽通常与第二多肽基本相同,例如,当两条肽仅在保守取代上不同时。两条核酸序列基本相同的另一个指征是这两个分子在严格条件下彼此杂交。
71.本文所使用的术语“多核苷酸”,同义称为“核酸分子”、“核苷酸”或“核酸”,均指任何聚核糖核苷酸或聚脱氧核糖核苷酸,可以是未修饰的rna或dna,也可以是修饰的rna或dna。“多核苷酸”包括但不限于单链和双链dna、单双链区域混合的dna、单链和双链rna,以及单双链区域混合的rna、包含dna和rna的杂交分子,该杂交分子可以是单链,或更典型地是双链或单链和双链区域的混合物。此外,“多核苷酸”指包含rna或dna或rna和dna两者的三链区域。该术语多核苷酸还包括含有一个或多个修饰碱基的dna或rna,以及出于稳定性或其他原因修饰骨架的dna或rna。“修饰”碱基包括,例如三苯甲基化碱基和稀有碱基如肌苷。dna和rna可以进行多种修饰;因此“多核苷酸”包括多核苷酸的化学、酶促或代谢修饰形式,如自然界中常见的形式,也包括病毒和细胞特有的dna和rna化学形式。“多核苷酸”也包括相对较短的核酸链,通常称为寡核苷酸。
72.本文所使用的术语“载体”是一种复制子,其中可以可操作地插入其他核酸片段以致使该片段复制或表达。
73.本文所使用的术语“宿主细胞”是指包含本发明的核酸分子的细胞。“宿主细胞”可以是任何种类的细胞,如原代细胞、培养的细胞或来自细胞系的细胞。在一个实施方式中,“宿主细胞”是转染了本发明的核酸分子的细胞。在另一个实施方式中,“宿主细胞”是这类经转染细胞的子代或潜在子代。子代细胞可能与亲代细胞相同,也可能不同,例如,在后续世代中可能发生的突变或环境影响或核酸分子到宿主细胞基因组中的整合都可能导致这种不同。
74.本文所使用的术语“表达”是指基因产物的生物合成。该术语包括基因转录为rna。
该术语也包括rna翻译为一种或多种多肽,并进一步包括所有自然发生的转录后和翻译后修饰。所表达的单克隆抗体或双特异性抗体可以存在于宿主细胞的细胞质中、进入诸如细胞生长培养基的细胞外环境中或锚定在细胞膜上。
75.如本文所用,术语“肽”、“多肽”或“蛋白质”可以指由氨基酸组成的分子并且可以被本领域技术人员识别为蛋白质。本文使用氨基酸残基的常规一字母或三字母代码。术语“肽”、“多肽”和“蛋白质”在本文中可互换使用以指代任何长度的氨基酸聚合物。聚合物可以是直链或支链的,它可以包含修饰的氨基酸,并且它可以被非氨基酸打断。该术语还包括已被天然修饰的或通过干预修饰的氨基酸聚合物;例如,二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其他操作或修饰,例如偶联。定义中还包括,例如,含有一种或多种氨基酸类似物(包括,例如,非天然氨基酸等)的多肽,以及本领域已知的其他修饰。
76.本文所述的肽序列是根据通常的惯例编写的,其中肽的n-末端区域在左侧,c-末端区域在右侧。尽管氨基酸的异构形式是已知的,但除非另有明确说明,否则所代表的是氨基酸的l型。
77.如本文所述,术语“cd3”是指分化簇3,它是一种多亚单位蛋白质复合物,作为t细胞受体(tcr)的共同受体发挥作用(dong等人,nature 573(7775):546-552(2019))。tcr与靶细胞表面的肽mhc(pmhc)的结合诱导tcr-cd3复合物的聚集,并激活由cd3ζ链介导的细胞内信号传导(annu rev immunol.27:591
–
619(2009))。cd3是t细胞激活所必需的,并且通过治疗(例如在car-t细胞和基于cd3的t细胞接合器中)使其非pmhc依赖性激活在调动t细胞杀死肿瘤细胞上非常有效(brown和mackall,nat rev immunol 19(2):73-74(2019)以及clynes和desjarlais,annu rev med 70:437-450(2019))。人cd3ε亚基的氨基酸序列示例见于genbank登录号np_000724.1。
78.如本文所述,术语“dll3”是指δ样典型notch配体3(dll3),也称为δ样3或δ样蛋白3,其在早期发育期间是体节分割所必需的(dunwoodie等人,development 129:1795-806(2002))。与哺乳动物notch家族配体dll1、dll4、jag1和jag2均反式激活notch受体信号传导不同的是(ntziachristos等人,cancer cell 25(3):318-34(2014)),dll3主要定位于高尔基体,无法激活notch信号传导(chapman等人,hum mol genet 20(5):905-16(2011)和geffers等人,j cell biol178(3):465-76(2007))。在正常发育过程中,dll3通过与notch和dll1相互作用来抑制notch通路的顺式和反式作用激活(chapman等人,hum mol genet20(5):905-16(2011))。dll3在除大脑外的成人正常组织中通常缺失或以极低水平存在,但在肺癌、睾丸癌、胶质瘤和黑色素瘤样本中过度表达(uhlen等人,science 357(6352):eaan2507(2017))。此外,dll3可在小细胞肺癌(sclc)和大细胞神经内分泌癌(lcnec)肿瘤细胞表面检测到(saunders等人,sci transl med 7(302):302ra136(2015)和sharma等人,cancer res 77(14):3931-41(2017)),使其成为治疗癌症的单克隆抗体的潜在靶点。因此,抗dll3单克隆抗体可用于特异性靶向表达dll3的肿瘤细胞,并作为一种潜在的抗癌治疗药物。术语“人dll3”是指源自人的dll3。人dll3的示例性氨基酸序列见于genbank登录号np_058637.1。
79.如本文所述的“肿瘤相关抗原(taa)”是指任何在肿瘤中的表达水平高于正常组织的细胞表面肽和/或抗原或细胞表面肽和/或抗原及其翻译后修饰部分(例如糖基化)的组合。肿瘤中特异存在的一些肿瘤相关抗原也称为肿瘤特异性抗原(tsa)。肿瘤相关抗原的例
子为由致癌病毒编码的病毒蛋白;突变癌蛋白或肿瘤抑制因子;在肿瘤细胞上和/或肿瘤细胞中过度表达的正常蛋白;细胞表面蛋白质的翻译后修饰;通常在发育阶段表达受到限制,但在成人组织中不受限制的癌胚蛋白;和细胞类型特异性蛋白质,其表达仅限于非必需组织。
80.如本文所述的“脂肪酸”是指由以通常具有6-22个碳原子的以羧酸基结尾的烃链组成的化学分子。对于本发明,由于各种脂肪酸衍生物能够结合白蛋白,其也被认为是脂肪酸。脂肪酸及其衍生物是脂质的主要成分,具有疏水性。烃链的长度和饱和度因脂肪酸而异,决定了相关的物理性质。脂肪酸的类型包括不饱和脂肪酸(多不饱和和单不饱和)和饱和脂肪酸;饱和脂肪酸是氢饱和的,并且大多是具有偶数个碳原子的直烃链。
81.如本文所述的“免疫细胞调节剂(icm)”是指任何细胞表面分子,例如在免疫细胞表面表达并调节免疫细胞功能的蛋白质。icm包括刺激分子和抑制分子。当具有特定特征的特定抗体或抗原结合片段特异性结合到刺激性icm时,刺激性icm可以介导免疫细胞的激活。抑制性icm在被配体/相互作用伙伴结合时抑制免疫细胞的活性,其可被具有导致免疫细胞激活的某些特征的特定抗体或抗原结合片段阻断。这些免疫细胞可以是t细胞、nk细胞、巨噬细胞或免疫系统的其他类型的细胞。icm的示例包括但不限于:cd3、cd27、cd28、cd40、cd122、ox40、cd16、4-1bb、gitr、icos、ctla-4、pd-1、lag-3、tim-3、tigit、vista、siglec7、nkg2d、siglec9、kir、cd91、btla、nkp46、b7-h3、siprα和其他细胞表面免疫调节分子。
82.如本文所用,术语“完全阻断”或“完全的阻断”是指完全抑制靶抗原(例如icm,例如cd3)与靶抗原结合域(例如单克隆抗体或双特异性抗体或其抗原结合片段)的结合。完全抑制靶抗原结合意味着靶抗原与靶抗原结合域没有结合(例如,0%结合)。
83.如本文所用,术语“部分阻断”或“部分的阻断”是指不完全抑制靶抗原(例如icm,例如cd3)与靶抗原结合域(例如单克隆抗体或双特异性抗体或其抗原结合片段)的结合。不完全抑制靶抗原结合意味着靶抗原与靶抗原结合域至少存在一些结合(例如,1%-99%结合)。
84.如本文所用,术语“特异性结合”是指与对照抗原相比,靶抗原与抗体或其抗原结合片段的显著结合,和/或与对照抗体或抗原结合片段相比,靶抗原与抗体或其抗原结合片段的显著结合,其中,对照抗原在序列和/或结构对比上不同于靶抗原,并且对照抗体或抗原结合片段显著且选择性地仅结合到其在序列和/或结构对比上与靶抗原不同的对应抗原。
85.抗体
86.本发明总体上涉及单克隆抗体(mab)(例如,抗icm mab,例如抗cd3mab)或双特异性抗体(bsab)(如,抗cd3/抗dll3 bsab),其包含偶联到包含重链可变区(vh)和轻链可变区(vl)的抗原结合域或其附近的脂肪酸(fa)分子(例如,在vh、vl中,或在距离vh或vl的二十(20)个氨基酸距离内,优选五(5)个氨基酸的距离内)。结合位点是抗原结合域内或附近的活性残基,可以是敲入的半胱氨酸或其他活性氨基酸。对偶联位点的位置进行识别,使得敲入的半胱氨酸(或其他活性氨基酸)或偶联的fa不会消除抗原结合域的靶抗原(例如icm,例如cd3)结合活性。偶联的fa可以结合到白蛋白分子,并且结合的白蛋白分子可以在抗原结合域和靶抗原(例如,icm,例如cd3)之间占据显著的空间。结合的白蛋白分子可以在空间上
阻碍靶抗原与抗原结合域的结合,导致靶抗原与该抗原结合域的结合减少或完全阻断。偶联fa的mab或bsab的fa偶联臂可以抗免疫细胞调节剂(icm),其在抗体结合时可导致免疫细胞激活。icm的示例包括但不限于:cd3、cd27、cd28、cd40、cd122、ox40、cd16、4-1bb、gitr、icos、ctla-4、pd-1、lag-3、tim-3、tigit、vista、siglec7、nkg2d、siglec9、kir、cd91、btla、nkp46、b7-h3、sipr和其他细胞表面免疫调节分子。因此,偶联的mab或bsab的免疫细胞激活活性可由结合到偶联的fa的白蛋白调节。调节的程度取决于偶联的mab或bsab周围的白蛋白浓度、fa分子的长度和偶联位点的特定位置。本发明还涉及多特异性抗体或其抗原结合片段,其中多特性抗体或其抗原结合片段包含一个或多个抗原结合臂,其包含偶联fa的被取代的氨基酸残基。
87.mab或bsab或多特异性抗体上偶联的fa可被血液中的循环白蛋白结合,其可用于减少或阻断偶联的mab或bsab与t细胞上的靶抗原(例如,icm,如cd3)的结合,导致t细胞活化的部分或完全抑制。在肿瘤微环境中,与循环血相比,白蛋白周转率更高,并且局部白蛋白水平预计低于循环血中的白蛋白水平,偶联抗体与白蛋白的结合较少或没有结合,这可以导致靶抗原(例如cd3)结合和t细胞活化的增加。此外/或者,肿瘤微环境中较高的白蛋白周转率可以降低白蛋白与mab或bsab或多特异性抗体的结合水平,并暴露抗原结合域,导致靶抗原结合(例如cd3)和t细胞活化的增加。偶联的抗体在体内安全性方面具有优势,可用于治疗目的。偶联的bsab也可用作t细胞接合器或其他免疫细胞接合器,其中一个臂包含针对肿瘤相关抗原(taa)的抗原结合域,另一个臂包含偶联的抗icm抗原结合区域(例如,抗cd3抗原结合区域)。
88.如本文所用,术语“抗体”具有广义含义,包括免疫球蛋白或抗体分子,抗体分子包括单克隆或多克隆的人源抗体、人源化抗体、复合抗体和嵌合抗体以及抗体片段。抗体通常是表现出对特定抗原有结合特异性的蛋白质或肽链。抗体的结构是公知的。免疫球蛋白可以根据重链恒定区的氨基酸序列分为五种主要类型(即iga、igd、ige、igg和igm)。iga和igg进一步细分为同种型iga1、iga2、igg1、igg2、igg3和igg4。相应地,本发明所述的抗体可以是这五种主要类型或对应亚型的任何一种。优选地,本发明所述的抗体是igg1、igg2、igg3或igg4。脊椎动物物种的抗体轻链可以基于其恒定区的氨基酸序列分为两种明显不同的类型,称为κ和λ。相应地,本发明所述的抗体可以包括κ或λ轻链恒定区。在特定的实施方式中,本发明所述的抗体包括来自大鼠或人抗体的重链和/或轻链恒定区。除重链和轻链恒定区外,抗体还包括一段由轻链可变区和重链可变区构成的抗原结合域,每个可变区均包含三个域(即互补决定区1-3;cdr1、cdr2和cdr3)。轻链可变区的域也称为lcdr1、lcdr2和lcdr3,重链可变区的域也称为hcdr1、hcdr2和hcdr3。
89.有几种系统用于对抗体中的氨基酸残基进行编号。kabat编号方法是基于抗体可变区的方案(elvin a.kabat等人,《免疫学相关蛋白质序列》第5版(1991)。eu编号系统广泛用于恒定结构域(包括ch1、铰链和fc部分)(elvin a.kabat等人,《免疫学相关蛋白质序列》第5版(1991)。
90.如本文所用,术语“分离的抗体”是指基本上不含具有不同抗原特异性的其他抗体的抗体(例如,特异性结合dll3的分离抗体基本上不含不结合dll3的抗体,与cd3特异性结合的分离抗体基本上不含不与cd3结合的抗体,特异性结合cd3和dll3的双特异性抗体基本上不含不与cd3和dll3结合的抗体)。此外,分离的抗体基本上不含其他细胞物质和/或化学
物质。
91.如本文所用,术语“单克隆抗体”是指从基本上同质的抗体群体中获得的抗体,即,除了可能以少量存在的天然发生的突变外,组成该群体的个体抗体是相同的。本发明的单克隆抗体可以通过杂交瘤法、噬菌体展示技术、单淋巴细胞基因克隆技术或重组dna法制备。例如,单克隆抗体可以由杂交瘤产生,该杂交瘤包括从转基因非人动物如转基因小鼠或大鼠获得的b细胞,其具有包含人重链转基因和轻链转基因的基因组。
92.本文所使用的术语“抗原结合片段”是指一种抗体片段,例如双抗体、fab、fab'、f(ab')2、fv片段、二硫键稳定性fv片段(dsfv)、(dsfv)2、双特异性dsfv(dsfv-dsfv')、二硫键稳定性双抗体(ds双抗体)、单链抗体分子(scfv)、单域抗体(sdab)、scfv二聚体(二价双抗体)、由包含一个或多个cdr的抗体部分形成的多特异性抗体、驼源单域抗体、纳米抗体、域抗体、二价域抗体或其他任何与抗原结合但不包含完整抗体结构的抗体片段。抗原结合片段能够与亲本抗体或亲本抗体片段所结合的相同抗原结合。根据特定实施方式,抗原结合片段包含轻链可变区、轻链恒定区和重链的fd区段。根据其他特定实施方式,抗原结合片段包含fab和f(ab’)。
93.本文所使用的术语“单链抗体”指本领域常规的单链抗体,所述单链抗体包含一重链可变区和一轻链可变区,其间由约15至约20个氨基酸组成的短肽连接。本文所使用的术语“单域抗体”指本领域常规的单域抗体,所述单域抗体包含一重链可变区和一重链恒定区,或仅包含一重链可变区。
94.本文所使用的术语“人抗体”指由人体产生的抗体或使用本领域已知的任何技术制备的具有与人体产生的抗体相对应的氨基酸序列的抗体。人抗体的定义包括完整或全长的抗体、其抗体片段和/或包括至少一种人重链和/或轻链多肽的抗体。
95.本文所使用的术语“人源化抗体”指非人抗体但经过修饰以增加与人抗体序列同源性的抗体,以此保留了抗体的抗原结合特性,但降低了其在人体内的抗原性。
96.本文所使用的术语“嵌合抗体”指其中免疫球蛋白分子的氨基酸序列源自两种或以上物种的抗体。轻链和重链的可变区时常对应于源自一种哺乳动物(例如小鼠、大鼠、兔等)的抗体的可变区,所述可变区具有所需的特异性、亲和力和功能,而恒定区对应于源自另一种哺乳动物(例如人)的抗体序列,以避免在该物种中引发免疫反应。
97.如本文所用,术语“多特异性抗体”是指包含多个免疫球蛋白可变结构域序列的抗体,其中该多个免疫球蛋白可变结构域序列中的第一免疫球蛋白可变结构域序列具有针对第一表位的结合特异性,且第二免疫球蛋白可变结构域序列具有针对第二表位的结合特异性。在一个实施方式中,第一和第二表位在相同的抗原上,例如相同的蛋白质(或多聚体蛋白质的亚基)。在一个实施方式中,第一和第二表位重叠或基本重叠。在一个实施方式中,第一和第二表位不重叠或基本不重叠。在一个实施方式中,第一和第二表位在不同的抗原上,例如不同的蛋白质(或多聚体蛋白质的不同亚基)。在一个实施方式中,多特异性抗体包含第三、第四或第五免疫球蛋白可变结构域。在一个实施方式中,多特异性抗体是双特异性抗体分子、三特异性抗体分子或四特异性抗体分子。
98.如本文所用,术语“双特异性抗体”是指结合不超过两个表位或两个抗原的多特异性抗体。双特异性抗体的特征在于对第一表位具有结合特异性的第一免疫球蛋白可变域序列和对第二表位具有结合特异性的第二免疫球蛋白可变域序列。在一个实施方式中,第一
和第二表位在相同的抗原上,例如相同的蛋白质(或多聚体蛋白质的亚基)。在一个实施方式中,第一和第二表位重叠或基本重叠。在一个实施方式中,第一和第二表位在不同的抗原上,例如不同的蛋白质(或多聚体蛋白质的不同亚基)。在一个实施方式中,双特异性抗体包含对第一表位具有结合特异性的重链可变域序列和轻链可变域序列以及对第二表位具有结合特异性的重链可变域序列和轻链可变域序列。在一个实施方式中,双特异性抗体包含对第一表位具有结合特异性的半抗体或其片段和对第二表位具有结合特异性的半抗体或其片段。在一个实施方式中,双特异性抗体包含对第一表位具有结合特异性的scfv或其片段,以及对第二表位具有结合特异性的scfv或其片段。
99.如本文所用,术语“cd3”是指分化簇3。人cd3ε亚基的氨基酸序列示例见于genbank登录号np_000724.1。术语“4-1bb”是指肿瘤坏死因子受体超家族成员9(tnfrsf9),也称为cd137和ila(由淋巴细胞活化诱导)。人4-1bb的氨基酸序列示例见于genbank登录号np_001552.2。术语“ox40”是指肿瘤坏死因子受体超家族成员4(tnfrsf4),也称为cd134。人ox40的氨基酸序列示例见于genbank登录号np_003318.1。术语“cd28”是指分化簇28。人类cd28变体的示例性氨基酸序列见于genbank登录号np_001230006.1、np_001230007.1、np_006130.1、xp_011510496.1、和xp_011510499.1。术语“pd-1”是指程序性细胞死亡1。人pd-1的氨基酸序列示例见于genbank登录号np_005009.2。术语“gitr”是指糖皮质激素诱导的tnfr相关蛋白(gitr),也称为肿瘤坏死因子受体超家族成员18(tnfrsf18)或活化诱导的tnfr家族受体(aitr)。人类gitr变体的示例性氨基酸序列见于genbank登录号np_004186.1、np_683699.1和np_683700.1。术语“vista”是指t细胞活化的v结构域ig抑制剂,也称为v组免疫调节受体(vsir)。人vista的氨基酸序列示例见于genbank登录号np_071436.1。
100.本文所使用的“特异性结合cd3和/或dll3”的抗体指以1
×
10-7
m或更低,优选1
×
10-8
m或更低,更优选5
×
10-9
m或更低,1
×
10-9
m或更低,5
×
10-10
m或更低,或1
×
10-10
m或更低的kd结合cd3和/或dll3的抗体,优选人cd3和/或人dll3。术语“kd”指解离常数,其由kd与ka的比值(即kd/ka)得到,并以摩尔浓度(m)表示。抗体的kd值可以使用本发明所属领域的技术测定。例如,抗体的kd可以使用表面等离子体共振测定,例如使用生物传感器系统如系统,或使用生物膜层干涉技术如octet red96系统。
101.抗体的kd值越小,抗体对靶抗原的亲和力就越高。
102.在一个特定方面,本发明涉及一种分离的单克隆抗体或抗原结合片段,其中所述抗体或其抗原结合片段包含(a)重链可变区(vh);和轻链可变区(vl);其中所述抗体或其抗原结合片段结合靶抗原,优选人靶抗原;其中vh、vl中的氨基酸残基、或距离vh或vl二十(20)个氨基酸距离(优选五(5)个氨基酸距离)以内的氨基酸残基被偶联脂肪酸(fa)的氨基酸残基取代;并且其中所述抗体或抗原结合片段在被取代的氨基酸残基处与fa偶联后,仍与靶抗原结合;并且其中在存在生理水平的白蛋白(例如35至50mg/ml)的情况下,所述结合fa的抗体或其抗原结合片段与靶抗原的特异性结合减少或消除。被取代的氨基酸残基可以例如是半胱氨酸残基或赖氨酸残基。
103.如本文所用,短语“距离vh或vl二十(20)个氨基酸距离以内”是指在ch1或cl区内与可变重链或轻链的距离小于20个氨基酸的残基。短语“距离vh或vl五(5)个氨基酸距离以内”是指在ch1或cl区内与可变重链或轻链的距离小于5个氨基酸的残基。
104.如本文所用,短语“仍与靶抗原结合”表示当抗体或其抗原结合片段与脂肪酸(fa)结合时,仍然能够结合靶抗原。靶抗原与偶联fa的抗体或其抗原结合片段的结合水平可以例如为靶抗原与包含本发明的用于偶联的氨基酸取代,但不包含偶联的fa的抗体或其抗原结合片段的结合水平的约10%-100%。在某些实施方式中,靶抗原与偶联fa的抗体或其抗原结合片段的结合水平为约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%,或约100%的靶抗原与包含本发明的用于偶联的氨基酸取代,但不包含偶联的fa的抗体或其抗原结合片段的结合水平。本领域技术人员将能够利用本领域已知的方法测定偶联fa的抗体或其抗原结合片段与靶抗原的结合水平。结合水平可与包含本发明的用于偶联的氨基酸取代但并未偶联fa的抗体或其抗原结合片段的结合水平相比较。靶抗原与包含本发明的用于偶联的氨基酸取代但并未偶联fa的抗体或其抗原结合片段的结合水平至少为野生型抗体或抗原结合片段结合水平的50%。
105.在一个特定方面,被取代的氨基酸位于对应于seq id no:1的残基25、27、62、64、73、76、101、112或113的氨基酸残基处,或对应于seq id no:2的残基26、27、52、53、56或67的氨基酸残基处,优选地所述取代是选自下组的取代:对应于seq id no:1的s25c、y27c、k62c、k64c、k73c、s76c、d101c、s112c或s113c,或对应于seq id no:2的s26c、s27c、s52c、k53c、s56c或s67c,其中所述残基依照kabat编号。在某些实施方式中,所述被取代的氨基酸位于对应于seq id no:1的残基64处或对应于seq id no:2的残基26处,优选地该取代选自对应于seq id no:1的k64c取代或对应于seq id no:2的s26c取代,其中所述残基依照kabat编号。
106.如本文所用,当提及对应于一seq id no的氨基酸残基数的取代氨基酸时,seq id no是用于确定目标序列的取代氨基酸残基的参考。本领域技术人员会将目的序列与参考seq id no对齐,以确定待取代的氨基酸残基的位置。作为示例,seq id no:1(抗cd3单克隆抗体的重链可变区)的氨基酸残基编号25是丝氨酸残基。在与目标抗体的重链可变区对齐时,与seq id no:1第25位处的丝氨酸残基对齐的残基将成为氨基取代的目标。
107.在一个特定方面,所述被取代的氨基酸位于seq id no:9、10、11或12所示ch1的残基119或120处,或seq id no:13或14所示cl的残基121或124处,优选地所述取代选自seq id no:9、10、11或12所示ch1的s119c或t120c,或seq id no:13或14所示cl的s121c或q124c,其中所述残基依照eu编号进行编号。在某些实施方式中,被取代的氨基酸位于seq id no:9、10、11或12所示ch1区的残基120处,优选地所述取代为seq id no:9、10、11或12所示ch1区中的t120c取代,其中所述残基依照eu编号进行编号。
108.在一个特定方面,所述抗分离的抗体或其抗原结合片段是抗cd3的抗体或其抗原结合片段,并且能够与cd3(优选人cd3)特异性结合。分离的抗cd3抗体或其抗原结合片段可以包括例如重链互补决定区1(hcdr1)、hcdr2、hcdr3、轻链互补决定区1(lcdr1)、lcdr2和lcdr3,其分别具有seq id no:3、4、5、6、7和8所示的多肽序列,或分别具有seq id no:33、34、35、36、37和38所示的多肽序列。
109.在一个特定方面,所述被取代的氨基酸选自下组:抗cd3 mab的vh(seq id no:1或seq id no:27)中的残基25、27、62、64、73、76、101、112或113,或抗cd3 mab的vl(seq id no:2或seq id no:28)中的残基26、27、52、53、56或67,优选地,所述取代选自vh(seq id no:1或27)中的s25c、y27c、k62c、k64c、k73c、s76c、d101c、s112c或s113c,或vl(seq id no:
2或28)中的s26c、s27c、s52c、k53c、s56c或s67c,其中所述残基依照kabat编号。在某些实施方式中,所述被取代的氨基酸位于vh(seq id no:1或27)中的残基64处或vl(seq id no:2或28)中的残基26处,优选地所述取代选自vh(seq id no:1或27)中的k64c取代或vl(seq id no:2或28)中的s26c取代,其中所述残基依照kabat编号。
110.在一个特定方面,所述分离的抗cd3抗体或其抗原结合片段可以例如包括:具有seq id no:1所示多肽序列并具有k64c氨基酸取代的vh区和具有seq id no:2所示多肽序列的vl区;或具有seq id no:27所示多肽序列并具有k64c氨基酸取代的vh区和具有seq id no:28所示多肽序列的vl区;或具有seq id no:1所示多肽序列的vh区和具有seq id no:2所示多肽序列并具有s26c氨基酸取代的vl区;或具有seq id no:27所示多肽序列的vh区和具有seq id no:28所示多肽序列并具有s26c氨基酸取代的vl区;或具有选自seq id no:9、10、11或12所示多肽序列并具有t120c氨基酸取代的ch1区域和具有选自seq id no:13或14所示多肽序列的cl区;或具有seq id no:1所示多肽序列的vh区、具有seq id no:2所示多肽序列的vl区、具有选自seq id no:9、10、11或12所示多肽序列且具有t120c氨基酸突变的ch1区,以及具有选自seq id no:13或14所示多肽序列的cl区;或具有seq id no:27所示多肽序列的vh区、具有seq id no:28所示多肽序列的vl区、具有选自seq id no:9、10、11或12所示多肽序列且具有t120c氨基酸突变的ch1区,以及具有选自seq id no:13或14所示多肽序列的cl区。
111.在一个特定方面,本发明提供了一种多特异性抗体或其抗原结合片段,其中,所述多特异性抗体或其抗原结合片段包括本发明的单克隆抗体或其抗原结合片段,并且其中所述多特异性抗体或其抗原结合片段包括一个或多个抗原结合臂,其包含与fa偶联的被取代的氨基酸残基。所述多特异性抗体或其抗原结合片段可以例如为双特异性抗体或其抗原结合片段。
112.在某些实施方式中,所述多特异性抗体或其抗原结合片段的每个臂可以含有在不同残基位置与相同或不同fa偶联的取代氨基酸。在某些实施方式中,所述多特异性抗体或其抗原结合片段的每个臂可以含有在不同残基位置与相同或不同fa偶联的相同的取代氨基酸。在某些实施方式中,所述多特异性抗体或其抗原结合片段的每个臂可以含有在相同残基位置与相同或不同fa偶联的取代氨基酸。在某些实施方式中,所述多特异性抗体或其抗原结合片段的每个臂可以含有在相同残基位置与相同或不同fa偶联的相同的取代氨基酸。
113.在某些实施方式中,所述双特异性抗体或其抗原结合片段包括第一抗原结合臂(ab1)和第二抗原结合臂(ab2),其中ab1和/或ab2包含与fa偶联的被取代的氨基酸。
114.在某些实施方式中,ab1结合免疫细胞调节剂(icm),优选人icm,选自下组:cd3、cd27、cd28、cd40、cd122、ox40、cd16、4-1bb、gitr、icos、ctla-4、pd-1、lag-3、tim-3、tigit、vista、siglec7、nkg2d、siglec9、kir、cd91、btla、nkp46、b7-h3、sipr和其他细胞表面免疫调节分子。例如,icm可以是cd3,优选人cd3。
115.在某些实施方式中,ab2结合肿瘤相关抗原(taa),优选人肿瘤相关抗原(人taa)。taa可以例如为dll3。
116.在本发明的一个实施方式中,本发明的分离的双特异性抗体或其抗原结合片段是抗cd3/抗dll3双特异性抗体或其抗原结合片段,其中第一抗原结合臂(ab1)特异性结合
cd3,优选人cd3,第二抗原结合臂(ab2)特异性结合dll3,优选人dll3。
117.在一个特定方面,所述双特异性抗体或其抗原结合片段包括:第一抗原结合臂(ab1),其包括h1和l1,和第二抗原结合臂(ab2),其包括h2和l2,其中(a)h1和h2各自包括人igg1、igg2、igg3或igg4的ch1区;并且(b)l1和l2各自包括人κ轻链或人λ轻链的cl区;其中,h1l1和h2l2各自包括选自下组氨基酸取代的电荷对:(1)分别在h1的ch1中的g166d/e和l1的cl中的s114k/r,以及分别在h2的ch1中的g166k/r和l2的cl中的s114d/e;(2)分别在h1的ch1中的t187d/e和l1的cl中的d/n170k/r,以及分别在h2的ch1中的t187k/r和l2的cl中的d/n170d/e;(3)分别在h1的ch1中的s131d/e和l1的cl中的p119k/r,以及分别在h2的ch1中的s131k/r和l2的cl中的p119d/e;(4)分别在h1的ch1中的a129d/e和l1的cl中的s121k/r,以及分别在h2的ch1中的a129k/r和l2的cl中的s121d/e;(5)分别在h1的ch1中的k/r133d/e和l1的cl中的k207k/r,以及分别在h2的ch1中的k/r133k/r和l2的cl中的k207d/e;(6)分别在h1的ch1中的k/r133d/e和l1的cl中的i/l117k/r,以及分别在h2的ch1中的k/r133k/r和l2的cl中的i/l117d/e;(7)分别在h1的ch1中的k/r133d/e和l1的cl中的f/v209k/r,以及分别在h2的ch1中的k/r133k/r和l2的cl中的f/v209d/e;(8)分别在h2的ch1中的g166d/e和l2的cl中的s114k/r,以及分别在h1的ch1中的g166k/r和l1的cl中的s114d/e;(9)分别在h2的ch1中的t187d/e和l2的cl中的d/n170k/r,以及分别在h1的ch1中的t187k/r和l1的cl中的d/n170d/e;(10)分别在h2的ch1中的s131d/e和l2的cl中的p119k/r,以及分别在h1的ch1中的s131k/r和l1的cl中的p119d/e;(11)分别在h2的ch1中的a129d/e和l2的cl中的s121k/r,以及分别在h1的ch1中的a129k/r和l1的cl中的s121d/e;(12)分别在h2的ch1中的k/r133d/e和l2的cl中的k207k/r,以及分别在h1的ch1中的k/r133k/r和l1的cl中的k207d/e;(13)分别在h2的ch1中的k/r133d/e和l2的cl中的i/l117k/r,以及分别在h1的ch1中的k/r133k/r和l1的cl中的i/l117d/e;或(14)分别在h2的ch1中的k/r133d/e和l2的cl中的f/v209k/r,以及分别在h1的ch1中的k/r133k/r和l1的cl中的f/v209d/e。
118.如本文所用,术语“电荷对”是指一对氨基酸,其中一个带正电荷,另一个带负电荷,其可通过分别替换双特异性抗体第一臂的重链ch1区和轻链cl区中的天然氨基酸残基引入,同时,同一对正电荷和负电荷氨基酸可以通过分别替换双特异性抗体第二臂的轻链cl区域和重链ch1区中的天然氨基酸残基引入。或者,正电荷和负电荷氨基酸可以通过氨基酸取代分别引入双特异性抗体第一臂的重链vh区域和轻链vl区域,同时,同一对正电荷和
id no:18所示多肽序列的cl区;和第二抗原结合臂(ab2),其包含具有seq id no:23所示多肽序列的vh区、具有seq id no:25所示多肽序列的vl区、具有seq id no:24所示多肽序列的ch1区,和具有seq id no:26所示多肽序列的cl区;(b)第一抗原结合臂(abl),其包含具有seq id no:19所示多肽序列的vh区,具有seq id no:21所示多肽序列的vl区、具有seq id no:20所示多肽序列的ch1区,和具有seq id no:22所示多肽序列的cl区;和第二抗原结合臂(ab2),其包含具有seq id no:23所示多肽序列的vh区、具有seq id no:25所示多肽序列的vl区、具有seq id no:24所示多肽序列的ch1区,和具有seq id no:26所示多肽序列的cl区;(c)第一抗原结合臂(abl),其包含具有seq id no:29所示多肽序列的vh区,具有seq id no:30所示多肽序列的vl区、具有seq id no:16所示多肽序列的ch1区,和具有seq id no:18所示多肽序列的cl区;和第二抗原结合臂(ab2),其包含具有seq id no:23所示多肽序列的vh区、具有seq id no:25所示多肽序列的vl区、具有seq id no:24所示多肽序列的ch1区,和具有seq id no:26所示多肽序列的cl区;或(d)第一抗原结合臂(abl)包含第一抗原结合臂(abl),其包含具有seq id no:31所示多肽序列的vh区,具有seq id no:32所示多肽序列的vl区、具有seq id no:20所示多肽序列的ch1区,和具有seq id no:22所示多肽序列的cl区;和第二抗原结合臂(ab2),其包含具有seq id no:23所示多肽序列的vh区、具有seq id no:25所示多肽序列的vl区、具有seq id no:24所示多肽序列的ch1区,和具有seq id no:26所示多肽序列的cl区。
125.在某些实施方式中,所述分离的抗体或其抗原结合片段在被取代的氨基酸残基处与fa偶联。所述fa可以例如选自下组:具有6个碳、7个碳、8个碳、9个碳、10个碳、11个碳、12个碳、13个碳、14个碳、15个碳、16个碳、17个碳、或18个碳的fa。在某些实施方式中,所述fa选自具有14个碳或18个碳或介于之间的任意数量的碳的fa。fa的长度可确定白蛋白与fa的相对结合,其可确定抗体或其抗原结合片段与靶抗原的相对结合。偶联的fa越长,偶联的fa对白蛋白的结合亲和力越大,导致白蛋白介导的偶联的mab或bsab对靶抗原特异性结合的减少程度越大。fa越短,偶联的fa对白蛋白的结合亲和力越低,导致白蛋白介导的偶联的mab或bsab与靶抗原的特异性结合减少更轻或可忽略。
126.在某些实施方式中,fa包含用于偶联到被取代的氨基酸残基的连接子。所述连接子可以例如选自肽连接子或聚乙二醇(peg)连接子。肽连接子可以例如少于50个氨基酸。肽连接子可以是49、48、47、46、45、44、43、42、41、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6或5个或更少的氨基酸。
127.在某些实施方式中,与抗体或其抗原结合片段偶联的fa能够结合白蛋白。白蛋白与fa的结合导致靶抗原与抗体或其抗原结合片段之间的结合部分或完全阻断。在某些实施方式中,其中分离的抗体或其抗原结合片段是双特异性抗体或其抗原结合片段,其中仅ab1臂偶联fa,白蛋白与fa的结合不影响ab2臂与taa的结合。在某些实施方式中,其中分离的抗体或其抗原结合片段是双特异性抗体或其抗原结合片段,其中ab1和ab2两条臂与fa结合,白蛋白与fa的结合导致ab1和ab2分别与ab1和ab2的靶抗原结合的减少或消除。在某些实施方式中,相比未结合白蛋白的分离的抗体或其抗原结合片段,结合白蛋白的分离的抗体或其抗原结合片段激活t细胞的能力降低。
128.在本发明的一个实施例中,本发明的抗cd3/抗dll3双特异性抗体或其抗原结合片段能够激活t细胞。
129.本发明的全长双特异性抗体可以例如使用两个单特异性二价抗体之间的fab臂交换(或半分子交换),通过在每个半分子中的重链ch3接合点引入取代,以有利于在体外在无细胞环境中两个具有明显特异性的抗体半分子的异二聚体形成来产生或使用共表达来产生。fab臂交换反应是二硫键异构化反应和ch3结构域解离结合的结果。亲本单特异性抗体的铰链区中的重链二硫键被还原。所得亲本单特异性抗体之一的游离半胱氨酸与第二个亲本单特异性抗体分子的半胱氨酸残基形成重链间二硫键,同时亲本抗体的ch3结构域通过解离结合释放和重组。fab臂的ch3结构域可以设计为有利于异二聚化而不是同源二聚化。所得产物是具有两个fab臂或半分子的双特异性抗体,每个fab臂或半分子结合不同的表位,即cd3上的表位和dll3上的表位。
130.如本文所用,“同源二聚化”是指具有相同ch3氨基酸序列的两条重链的相互作用。如本文所用的“同源二聚体”是指具有两条具有相同ch3氨基酸序列的重链的抗体。
131.如本文所用的“异二聚化”是指具有不同ch3氨基酸序列的两条重链的相互作用。如本文所用,“异二聚体”是指具有两条具有不同ch3氨基酸序列的重链的抗体。
[0132]“杵-臼(knob-in-hole)”策略(参见,例如,pct公开号wo2006/028936)可用于产生全长双特异性抗体。简而言之,在人igg中形成ch3结构域接合点的选定氨基酸可以在影响ch3结构域相互作用的位置发生突变,以促进异二聚体的形成。将具有小侧链(臼)的氨基酸引入特异性结合第一抗原的抗体的重链中,将具有大侧链(杵)的氨基酸引入特异性结合第二抗原的抗体的重链中。在两种抗体共表达后,由于带有“臼”的重链与带有“杵”的重链的优先相互作用,形成了异二聚体。形成杵和臼的示例性ch3取代对是(表示为第一重链的第一ch3结构域中的修饰位置/第二重链的第二ch3结构域中的修饰位置):t366y/f405a、t366w/f405w、f405w/y407a、t394w/y407t、t394s/y407a、t366w/t394s、f405w/t394s和t366w/t366s_l368a_y407v。
[0133]
可以使用其他策略,例如通过取代一个ch3表面上的带正电残基和第二个ch3表面上带负电残基来使用静电相互作用来促进重链异二聚化,如美国专利公开号us2010/0015133;美国专利公开号us2009/0182127;美国专利公开号us2010/028637;或美国专利公开号us2011/0123532中所述。在其他策略中,异二聚化可以通过以下取代来促进(表示为第一重链的第一ch3结构域中的修饰位置/第二重链的第二ch3结构域中的修饰位置):l351y_f405ay407v/t394w、t366i_k392m_t394w/f405a_y407v、t366l_k392m_t394w/f405a_y407v、l351y_y407a/t366a_k409f、l351y_y407a/t366v k409f y407a/t366a_k409f或t350v_l351y_f405ay407v/t350v_t366l_k392l_t394w,如美国专利公开号us2012/0149876或美国专利公开号us2013/0195849中所述。
[0134]
除了上述方法之外,本发明的双特异性抗体可以在无细胞环境中通过在两个单特异性同二聚体抗体的ch3区引入不对称突变,并在还原条件下由两个亲本单特异性同二聚体抗体形成双特异性异二聚体抗体,使得产生如pct专利公开号wo2011/131746所述方法中的二硫键异构化,从而在体外产生。在这些方法中,第一单特异性二价抗体和第二单特异性二价抗体被改造为在ch3结构域具有某些取代,从而促进异二聚体稳定性;在足以使铰链区中的半胱氨酸经历二硫键异构化的还原条件下将抗体一起孵育;从而通过fab臂交换产生
双特异性抗体。孵育条件可以任选地恢复到非还原条件。可以使用的示例性还原剂是2-巯基乙胺(2-mea)、二硫苏糖醇(dtt)、二硫赤藓糖醇(dte)、谷胱甘肽、三(2-羧乙基)膦(tcep)、l-半胱氨酸和β-巯基乙醇,优选地还原剂选自下组:2-巯基乙胺、二硫苏糖醇和三(2-羧乙基)膦。例如,在至少20℃的温度下,在至少25mm 2-mea的存在下或在至少0.5mm二硫苏糖醇的存在下,在5-8的ph值(例如可以使用在7.0或7.4的ph值下)下孵育至少90分钟。
[0135]
本发明的全长双特异性抗体可以使用上述异二聚方法和以下几种方法的组合来生成:(a)改变双特异性单克隆抗体一个臂上的hc/lc链间二硫键(参见例如,2020年12月3日提交的pct/us2020/063066,其通过引用整体并入本文);(b)将电荷对引入vh/vl接合点;(c)将电荷对引入ch1/cl接合点;或(d)(a)-(c)中描述的部分或所有方法的组合(参见例如,2021年2月5日提交的美国临时专利申请号63/146334中首次描述的,其通过引用整体并入本文)。
[0136]
在另一个一般方面,本发明涉及分离的核酸,其编码分离的单克隆抗体或抗原结合片段,或分离的双特异性抗体或其抗原结合片段。本领域技术人员将理解,可以在不改变蛋白质氨基酸序列的情况下改变蛋白质的编码序列(例如替换、删除、插入等)。因此,本领域技术人员将理解可以在不改变蛋白质氨基酸序列的情况下改变本发明的编码抗体或抗原结合片段的核酸序列。
[0137]
在另一个一般方面,本发明涉及包含分离核酸的载体,所述分离核酸编码本发明的分离的单克隆抗体或抗原结合片段,或分离的双特异性抗体或其抗原结合片段。鉴于本公开,可以使用本领域技术人员已知的任何载体,例如质粒、黏粒、噬菌体载体或病毒载体。在某些实施方式中,所述载体是重组表达载体,例如质粒。载体可以包含构建表达载体常规功能的任何元件,例如,启动子、核糖体结合元件、终止子、增强子、选择性标记和复制起始位点。所述启动子可以是组成型、诱导型或抑制型启动子。本领域已知有许多能够将核酸运送进细胞的表达载体,它们均可以在本发明中应用以在细胞中生产抗体或其抗原结合片段。可使用常规克隆技术或人工基因合成来制备本发明实施例中的重组表达载体。基于本公开,这些技术对于本领域技术人员来说是众所周知的。
[0138]
在另一个一般方面,本发明涉及包含载体的宿主细胞,所述载体包含编码本发明的分离的单克隆抗体或抗原结合片段,或分离的双特异性抗体或其抗原结合片段的分离核酸。鉴于本公开,本领域技术人员已知的任何宿主细胞可用于本发明的抗体或其抗原结合片段的重组表达。在某些实施方式中,宿主细胞是大肠杆菌tg1或bl21细胞(用于表达例如scfv或fab抗体)、cho-dg44或cho-k1细胞或hek293细胞(用于表达例如全长igg抗体)。根据具体实施方式,重组表达载体通过常规方法例如化学转染、热激或电穿孔转化到宿主细胞中,其中它被稳定整合到宿主细胞基因组中,使得重组核酸得到有效表达。
[0139]
在另一个一般方面中,本发明涉及生产本发明的分离的单克隆抗体或抗原结合片段,或分离的双特异性抗体或其抗原结合片段的方法,包括在生产本发明抗体或其抗原结合片段的条件下培养包含编码抗体或其抗原结合片段的核酸的细胞,并从细胞或细胞培养物(例如,从上清液)中回收抗体或其抗原结合片段。表达的抗体或其抗原结合片段可从细胞中获得,并根据本领域已知和本文所述的常规技术进行纯化。
[0140]
在另一个一般方面中,本发明涉及生产本发明偶联fa的分离抗体或其抗原结合片段的方法。所述方法包括将fa与抗体或其抗原结合片段在被取代的氨基酸残基处偶联,并
回收偶联fa的抗体或其抗原结合片段。
[0141]
在另一个一般方面中,本发明涉及生产偶联fa并与白蛋白结合的分离抗体或其抗原结合片段的方法。所述方法包括将偶联fa的分离抗体或其抗原结合片段与白蛋白接触,并回收与白蛋白结合的偶联fa的抗体或其抗原结合片段。
[0142]
药物组合物
[0143]
在另一个一般方面,本发明涉及一种药物组合物,其包含分离的本发明单克隆抗体或其抗原结合片段,或分离的双特异性抗体或其抗原结合片段和药学上可接受的载体。所述分离的单克隆或双特异性抗体或其抗原结合片段可以例如与脂肪酸(fa)偶联。偶联fa的单克隆或双特异性抗体或其抗原结合片段可以例如与白蛋白结合。如本文所用,术语“药物组合物”是指包含本发明的抗体和药学上可接受的载体的产品。本发明的抗体和包含它们的组合物也可用于制备药物,所述药物用于本发明提及的治疗性应用。
[0144]
本文所使用的术语“载体”指任何赋形剂、稀释剂、填充剂、盐、缓冲剂、稳定剂、增溶剂、油、脂质、含脂质的囊泡、微球、脂质体封装或本领域公知的用于药物制剂的其他材料。应理解,所述载体、赋形剂或稀释剂的特性取决于特定用药的给药途径。本文所使用的术语“药学上可接受的载体”指不干扰本发明的组合物的有效性或本发明的组合物的生物活性的无毒材料。根据具体实施方式,鉴于本公开内容,适用于抗体药物组合物的任何药学上可接受的载体均可用于本发明。
[0145]
药物活性成分与药学上可接受的载体的制剂是本领域已知的,例如《雷明顿药学技术与实践(remington:the science and practice of pharmacy)》(如第21版(2005)和其后任何版本)。其他成分的非限制性示例包括但不限于:缓冲剂、稀释剂、溶剂、张力调节剂、防腐剂、稳定剂和螯合剂。可以使用一种或多种药学上可接受的载体配制本发明的药物组合物。
[0146]
在本发明的一种实施方式中,所述药物组合物是液体制剂。液体制剂的优选实例是水性制剂,即包含水的制剂。液体制剂可以包含溶液、悬浮液、乳液、微乳液、凝胶等。水性制剂通常包含至少50%w/w的水,或至少60%、70%、75%、80%、85%、90%或至少95%w/w的水。
[0147]
在一种实施方式中,所述药物组合物可以配制成可以,例如通过注射装置(例如,注射器或输液泵)注射的注射剂。例如,可以皮下、肌肉内、腹膜内、玻璃体内或静脉内递送注射剂。
[0148]
在另一种实施方式中,所述药物组合物是固体制剂,例如冷冻干燥或喷雾干燥的组合物,其可以原样使用,或在使用前由医师或患者向其添加溶剂和/或稀释剂。固体剂型可包括片剂,例如压制片剂和/或包衣片剂,以及胶囊剂(例如,硬或软明胶胶囊)。所述药物组合物也可以是例如小包装、糖衣丸、粉末、颗粒、锭剂或用于重构的粉末的形式。
[0149]
所述剂型可以是立即释放的,在这种情况下,其可以包含水溶性或分散性载体,或者其可以是延缓释放、持续释放或调节释放的,在这种情况下,其可以包含调节该剂型在胃肠道或皮下溶解速率的水不溶性聚合物。
[0150]
在其他实施方式中,所述药物组合物可以通过鼻内、颊内或舌下递送。
[0151]
水性制剂中的ph可以在ph 3至ph 10之间。在本发明的一种实施方式中,制剂的ph为约7.0至约9.5。在本发明的另一种实施方式中,制剂的ph为约3.0至约7.0。
[0152]
在本发明的另一种实施方式中,所述药物组合物包含缓冲剂。缓冲剂的非限制性实例包括:精氨酸、天冬氨酸、二甘氨酸、柠檬酸盐、磷酸氢二钠、富马酸、甘氨酸、双甘氨肽、组氨酸、赖氨酸、马来酸、苹果酸、乙酸钠、碳酸钠、磷酸二氢钠、磷酸钠、琥珀酸、酒石酸、三甲基甘氨酸和三(羟甲基)-氨基甲烷及其混合物。缓冲剂可以单独存在,或以总计约0.01mg/ml至约50mg/ml,例如约0.1mg/ml至约20mg/ml的浓度存在。包含这些特定缓冲剂中的每一种的药物组合物构成本发明的可选实施方式。
[0153]
在本发明的另一种实施方式中,所述药物组合物包含防腐剂。防腐剂的非限制性实例包括:苄索氯铵、苯甲酸、苯甲醇、溴硝醇、4-羟基苯甲酸丁酯、氯丁醇、氯甲酚、氯己定、氯苯甘醚、邻甲酚、间甲酚、对甲酚、4-羟基苯甲酸乙酯、咪唑烷脲、4-羟基苯甲酸甲酯、苯酚、2-苯氧基乙醇、2-苯基乙醇、4-羟基苯甲酸丙酯、脱氢乙酸钠、硫柳汞及其混合物。防腐剂可以单独存在,或以总计约0.01mg/ml至约50mg/ml,例如约0.1mg/ml至约20mg/ml的浓度存在。包含这些特定防腐剂中的每一种的药物组合物构成本发明的可选实施方式。
[0154]
在本发明的另一种实施方式中,所述药物组合物包含等渗剂。等渗剂的非限制性实例包括盐(例如氯化钠)、氨基酸(例如甘氨酸、组氨酸、精氨酸、赖氨酸、异亮氨酸、天冬氨酸、色氨酸和苏氨酸)、醛醇(alditol)(例如丙三醇、1,2-丙二醇(丙二醇)、1,3-丙二醇和1,3-丁二醇)、聚乙二醇(例如peg400)及其混合物。等渗剂的另一个实例包括糖。糖的非限制性实例可以是单糖、二糖或多糖,或水溶性葡聚糖,包括例如果糖、葡萄糖、甘露糖、山梨糖、木糖、麦芽糖、乳糖、蔗糖、海藻糖、右旋糖酐、支链淀粉、糊精、环糊精、α和β-hpcd、可溶性淀粉、羟乙基淀粉和羧甲基纤维素钠。等渗剂的另一个实例是糖醇,其中术语“糖醇”定义为具有至少一个-oh基团的c(4-8)烃。糖醇的非限制性实例包括甘露醇、山梨醇、肌醇、半乳糖醇、卫矛醇、木糖醇和阿拉伯糖醇。等渗剂可以单独存在,或以总计约0.01mg/ml至约50mg/ml,例如约0.1mg/ml至约20mg/ml的浓度存在。包含这些特定等渗剂中的每一种的药物组合物构成本发明的可选实施方式。
[0155]
在本发明的另一种实施方式中,所述药物组合物包含螯合剂。螯合剂的非限制性实例包括柠檬酸、天冬氨酸、乙二胺四乙酸(edta)盐及其混合物。螯合剂可以单独存在,或以总计约0.01mg/ml至约50mg/ml,例如约0.1mg/ml至约20mg/ml的浓度存在。包含这些特定螯合剂中的每一种的药物组合物构成本发明的可选实施方式。
[0156]
在本发明的另一种实施方式中,所述药物组合物包含稳定剂。稳定剂的非限制性实例包括一种或多种聚集抑制剂、一种或多种氧化抑制剂、一种或多种表面活性剂和/或一种或多种蛋白酶抑制剂。
[0157]
在本发明的另一种实施方式中,所述药物组合物包含稳定剂,其中所述稳定剂是羧基-/羟基纤维素及其衍生物(例如hpc、hpc-sl、hpc-l和hpmc)、环糊精、2-甲硫基乙醇、聚乙二醇(例如peg 3350)、聚乙烯醇(pva)、聚乙烯吡咯烷酮、盐(例如氯化钠)、含硫物质(例如硫代甘油)或巯基乙酸。稳定剂可以单独存在,或以总计约0.01mg/ml至约50mg/ml,例如约0.1mg/ml至约20mg/ml的浓度存在。包含这些特定稳定剂中的每一种的药物组合物构成本发明的可选实施方式。
[0158]
在本发明的其他实施方式中,所述药物组合物包含一种或多种表面活性剂,优选一种表面活性剂、至少一种表面活性剂,或两种不同的表面活性剂。术语“表面活性剂”是指由水溶性(亲水)部分和脂溶性(亲脂)部分组成的任何分子或离子。表面活性剂可以例如选
自下组:阴离子表面活性剂、阳离子表面活性剂、非离子表面活性剂和/或两性离子表面活性剂。表面活性剂可以单独存在,或以总计约0.1mg/ml至约20mg/ml的浓度存在。包含这些特定表面活性剂中的每一种的药物组合物构成本发明的替代实施方式。
[0159]
在本发明的另一种实施方式中,所述药物组合物包含一种或多种蛋白酶抑制剂,例如edta和/或盐酸(hcl)苯甲脒。蛋白酶抑制剂可以单独存在,或以总计约0.1mg/ml至约20mg/ml的浓度存在。包含这些特定蛋白酶抑制剂中的每一种的药物组合物构成本发明的替代实施方式。
[0160]
在另一个一般方面,本发明涉及制备包含本发明的分离的单克隆抗体或其抗原结合片段,或分离的双特异性抗体或其抗原结合片段的药物组合物的方法,包括将所述抗体或其抗原结合片段与药学上可接受的载体组合以获得所述药物组合物。
[0161]
应用方法
[0162]
在另一个一般方面中,本发明涉及靶向有需要的受试者的癌细胞表面上表达的肿瘤相关抗原(taa)(例如dll3)的方法。所述方法包括给受试者施用药物组合物,所述药物组合物包含分离的双特异性抗体或其抗原结合片段和药学上可接受的载体,所述双特异性抗体或其抗原结合片段包含本发明的与fa偶联的ab1臂(例如,抗icm臂,例如抗cd3臂)(例如,抗cd3/抗dll3双特异性抗体或其抗原结合片段)。在低白蛋白水平下,分离的偶联fa双特异性抗体或其抗原结合片段通过抗taa臂(ab2臂)和通过抗cd3臂(ab1臂)同时结合到表达taa的癌细胞和t细胞,可以介导癌细胞杀伤。在白蛋白水平较高(例如35至50mg/ml)的循环血液中,偶联fa的抗cd3臂处于白蛋白结合状态,因此结合和激活t细胞的能力降低。ab1臂结合的t细胞靶抗原可以是另一个t细胞icm,例如4-1bb、gitr、cd28或pd-1。这种方法可以通过最小化的靶向、非肿瘤毒性来增加基于抗icm(例如,抗cd3)的双特异性t细胞接合器的安全空间。此外,该方法可应用于可用作其他免疫细胞接合器的bsab(包括抗taa臂和偶联的抗icm臂)。此外,该方法可应用于将偶联fa的mab和/或bsab用于局部白蛋白水平低于循环血液中白蛋白水平的靶组织(例如脂肪组织或骨骼肌),以最小化循环中的靶向安全问题(ellmerer等人,am j physiol endocrinol metab.2000.278:e352-e356)。
[0163]
结合靶抗原(例如icm,如cd3)的单克隆抗体或其抗原结合片段,或结合taa(例如dll3)和t细胞靶抗原(如icm,例如cd3)两者的双特异性抗体及其抗原结合片段的功能活性可以通过本领域已知的方法和本文所述的方法来表征。用于表征结合taa(例如dll3)和t细胞靶抗原(例如cd3)的双特异性抗体及其抗原结合片段的方法包括但不限于亲和力和特异性分析,包括双核心(biacore)、elisa、facs和octetred分析。根据特定实施方式,用于表征结合dll3和cd3两者的双特异性抗体及其抗原结合片段的方法包括以下所述的方法。结合icm的单克隆抗体或其抗原结合片段,或结合taa(例如dll3)和cd3以外的icm的双特异性抗体及其抗原结合片段的功能活性可以通过类似于上述方法来表征。
[0164]
在另一个一般方面,本发明涉及一种治疗有需要的受试者的癌症的方法,包括向有需要的受试者施用本发明的分离的单克隆抗体或抗原结合片段,或分离的双特异性抗体或其抗原结合片段或药物组合物。所述癌症可以是任何血液或实体的癌症,例如,其可以选自但不限于:肺癌、胃癌、食管癌、胆道癌、胆管癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、神经胶质瘤、胶质母细胞瘤和其他实体瘤,以及非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白
血病(cll)、慢性粒细胞白血病(cml)、多发性骨髓瘤(mm)、急性髓性白血病(aml)和其他血液肿瘤。
[0165]
根据本发明的实施方式,药物组合物包含治疗有效量的本发明的单克隆抗体或抗原结合片段,或双特异性抗体或其抗原结合片段。本文所使用的术语“治疗有效量”指在受试者体内引发所期望的生物或医学反应的活性成分或组分的量。治疗有效量可以通过经验和常规方式决定,与所规定的目的相关。
[0166]
如本文所用,对单克隆和/或双特异性抗体或其抗原结合片段而言,治疗有效量是指调节有需要的受试者的免疫应答的单克隆和/或双特异性抗体或其抗原结合片段的量。同样地,如本文所用,对单克隆和/或双特异性抗体或其抗原结合片段而言,治疗有效量指单克隆和/或双特异性抗体或其抗原结合片段在治疗疾病、障碍或病症;预防或减缓疾病、障碍或病症的进展;或减轻或彻底缓解与疾病、障碍或病症相关的症状中取得效果的量。
[0167]
在特定的实施方式中,所述待治疗的疾病、障碍或病症指癌症,优选的癌症选自但不限于下组:肺癌、胃癌、食管癌、胆道癌、胆管癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、神经胶质瘤、胶质母细胞瘤和其他实体瘤,以及非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、慢性粒细胞白血病(cml)、多发性骨髓瘤(mm)、急性髓性白血病(aml)和其他血液肿瘤。在另外的特定实施方式中,所述待治疗的疾病、障碍或病症指炎症性疾病、代谢疾病、心血管疾病、神经系统疾病、传染病或可以使用双特异性抗体治疗的任何其他疾病。
[0168]
在特定的实施方式中,治疗有效量指足够达到以下效果中一、二、三、四或更多项的治疗量:i)减轻或改善待治疗的疾病、障碍或病症或与之相关的症状的严重程度;(ii)减少待治疗的疾病、障碍或病症或与之相关的症状的持续时间;(iii)预防待治疗的疾病、障碍或病症或与之相关的症状的发展;(iv)使待治疗的疾病、障碍或病症或与之相关的症状退化;(v)预防待治疗的疾病、障碍或病症或与之相关的症状的发展或发作;(vi)预防待治疗的疾病、障碍或病症或与之相关的症状的复发;(vii)减少患有待治疗的疾病、障碍或病症或与之相关的症状的受试者的住院治疗;(viii)减少患有待治疗的疾病、障碍或病症或与之相关的症状的受试者的住院时间;(ix)增加患有待治疗的疾病、障碍或病症或与之相关的症状的受试者的存活率;(xi)抑制或减轻受试者中待治疗的疾病、障碍或病症或与之相关的症状;和/或(xii)增强或改善另一种疗法的预防或治疗效果。
[0169]
所述治疗有效量或治疗有效剂量可以根据多种因素变动,例如待治疗的疾病、障碍或病症、给药途径、靶点部位、受试者身体状况(包括例如年龄、体重、健康程度)、受试者是人还是动物、其他用药以及疗法是预防性或治疗性的。最佳地应滴定治疗剂量以优化安全性和有效性。
[0170]
在特定的实施方式中,本文所述的组合物被配制成适合用于受试者的预期给药途径。例如,本文所述的组合物可被配制为适合静脉给药、皮下给药或肌注给药。
[0171]
本文所使用的术语“治疗”、“治疗的”、“疗法”均旨在指改善或逆转与癌症相关的至少一种可测量的身体指标,这在受试者体内不一定是需要被识别的,但可以被识别。术语“治疗”、“治疗的”、“疗法”也可以指使疾病、障碍或病症减退、防止其进展或至少减缓其进展。在特定的实施方式中,“治疗”、“治疗的”、“疗法”指减缓、防止一个或多个与疾病、障碍或病症(例如肿瘤,更优选为癌症)相关的症状发展或发作,或减少所述症状的持续时间。在
特定的实施方式中,“治疗”、“治疗的”、“疗法”指防止疾病、障碍或病症的复发。在特定的实施方式中,“治疗”、“治疗的”、“疗法”指延长患有疾病、障碍或病症的受试者的生存期。在特定的实施方式中,“治疗”、“治疗的”、“疗法”指根除受试者的疾病、障碍或病症。
[0172]
在特定的实施方式中,提供了用于治疗癌症的组合物。对于癌症治疗,所述组合物可以联合使用的另一种治疗包括但不限于:化学疗法、抗tim-3mab、抗lag-3mab、抗cd73 mab、抗cd47 mab、抗爱帕琳肽(anti-apelin)mab、抗ctla-4抗体、抗egfr mab、抗her-2mab、抗cd19 mab、抗cd20 mab、抗cd33 mab、抗tip-1mab、抗dll3 mab、抗cldn18.2 mab、抗pd-l1抗体,抗pd-1抗体,pd-1/pd-l1治疗、其他免疫肿瘤学药物、抗血管生成剂、放射疗法、抗体-药物偶联物(adc)、靶向疗法或其他抗癌药物。
[0173]
本文提到给受试者施用两种或以上疗法时所使用的术语“联合”指使用一种以上疗法。术语“联合”的使用不限制给受试者施用疗法的顺序。例如,给受试者施用第一疗法(如本文所述的组合物)可以在第二疗法施用前(如第二疗法施用前5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、16小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周)、施用同时或施用后(如第二疗法施用后5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、16小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周)。
[0174]
还提供了一种方法,其包括将白蛋白与含共价连接(可选地通过连接子连接)至抗体或其抗原结合片段的脂肪酸(fa)的偶联物接触,其中所述偶联物中的抗体或其抗原结合片段能够特异性结合靶抗原,所述偶联物中的fa能够结合白蛋白,并且白蛋白结合至fa导致靶抗原与抗体或其抗原结合片段之间的结合部分或完全阻断。在某些实施方式中,所述接触步骤包括给有需要治疗肿瘤的受试者施用包含所述偶联物的药物组合物,其中所述肿瘤包含所述靶抗原。在某些实施方式中,与循环血液相比,白蛋白在肿瘤微环境中具有更高的周转率,和/或白蛋白以低于受试者循环血液中白蛋白水平的水平存在于肿瘤微环境中。
具体实施方式
[0175]
本发明还提供了下列非限制性实施方式。
[0176]
实施方式1为一种分离的单克隆抗体或其抗原结合片段,其中所述的抗体或其抗原结合片段包括:a.重链可变区(vh);b.轻链可变区(vl);其中,所述抗体或其抗原结合片段与靶抗原结合,优选人靶抗原;其中一条或两条臂上的vh、vl中的氨基酸残基,或在距离vh或vl二十(20)个氨基酸距离以内的氨基酸残基被偶联脂肪酸(fa)的氨基酸残基取代;并且其中所述抗体或其抗原结合片段在被取代的氨基酸残基处与fa偶联后,仍与靶抗原结合。
[0177]
实施方式2为实施方式1所述的分离的单克隆抗体或其抗原结合片段,其中所述被取代的氨基酸残基在一条或两条臂上距离vh或vl五(5)个氨基酸距离以内。
[0178]
实施方式3为实施方式1或2所述的分离的单克隆抗体或其抗原结合片段,其中所述被取代的氨基酸残基为半胱氨酸残基、赖氨酸残基或适于化学偶联的修饰氨基酸。
[0179]
实施方式4为实施方式3所述的分离的单克隆抗体或其抗原结合片段,其中所述被取代的氨基酸残基出现在对应于下组的氨基酸残基:(1)vh中seq id no:1的残基25、27、62、64、73、76、101、112或113(kabat编号);(2)vl中seq id no:2的残基26、27、52、53、56,或67(kabat编号);(3)ch1中seq id no:9、10、11,或12的残基119或120(eu编号);或(4)cl中seq id no:13或14的残基121或124(eu编号)。
[0180]
实施方式5为实施方式4所述的分离的单克隆抗体或其抗原结合片段,其中所述的被取代的氨基酸残基出现在对应于下组的氨基酸残基:(1)vh中seq id no:1的k64c取代;(2)vl中seq id no:2的s26c取代;或(3)ch1区中seq id no:9、10、11,或12的t120c取代。
[0181]
实施方式6为实施方式1-5中任一项所述的分离的单克隆抗体或其抗原结合片段,其中所述的分离的抗体或其抗原结合片段是抗免疫细胞调节剂(icm)抗体或其抗原结合片段,并且能够与icm(优选人icm)特异性结合。
[0182]
实施方式7为实施方式6所述的分离的单克隆抗体或其抗原结合片段,其中所述的icm选自下组:cd3、cd27、cd28、cd40、cd122、ox40、cd16、4-1bb、gitr、icos、ctla-4、pd-1、lag-3、tim-3、tigit、vista、siglec7、nkg2d、siglec9、kir、cd91、btla、nkp46、b7-h3、siprα,和其他细胞表面免疫调节分子。
[0183]
实施方式8为实施方式7所述的分离的单克隆抗体或其抗原结合片段,其中所述icm为cd3,并且所述单克隆抗体或其抗原结合片段包括重链互补决定区1(hcdr1)、hcdr2、hcdr3、轻链互补决定区1(lcdr1)、lcdr2和lcdr3,其分别具有seq id no:3、4、5、6、7和8所示的多肽序列,或分别具有seq id no:33、34、35、36、37和38所示的多肽序列。
[0184]
实施方式9为实施方式7或8所述的分离的单克隆抗体或其抗原结合片段,其中所述icm为cd3,并且所述的被取代的氨基酸残基出现在选自下组的氨基酸残基:(1)vh中seq id no:1或27的残基25、27、62、64、73、76、101、112或113(kabat编号);(2)vl中seq id no:2或28的残基26、27、52、53、56,或67(kabat编号);(3)ch1中seq id no:9、10、11,或12的残基119或120(eu编号);或(4)cl中seq id no:13或14的残基121或124(eu编号)。
[0185]
实施方式10是实施方式5-9中任一项所述的分离的单克隆抗体或其抗原结合片段,其包括:(1)具有seq id no:1所示多肽序列并具有k64c氨基酸取代的vh区和具有seq id no:2所示多肽序列的vl区;(2)具有seq id no:27所示多肽序列并具有k64c氨基酸取代的vh区和具有seq id no:28所示多肽序列的vl区;(3)具有seq id no:1所示多肽序列的vh区和具有seq id no:2所示多肽序列并具有s26c氨基酸取代的vl区;(4)具有seq id no:27所示多肽序列的vh区和具有seq id no:28所示多肽序列并具有s26c氨基酸取代的vl区;
(5)具有选自seq id no:9、10、11或12所示多肽序列并具有t120c氨基酸取代的ch1区和具有seq id no:13或14所示多肽序列的cl区;(6)具有seq id no:1所示多肽序列的vh区、具有seq id no:2所示多肽序列的vl区、具有选自seq id no:9、10、11或12所示多肽序列并具有t120c氨基酸取代的ch1区,以及具有选自seq id no:13或14所示多肽序列的cl区;或(7)具有seq id no:27所示多肽序列的vh区、具有seq id no:28所示多肽序列的vl区、具有选自seq id no:9、10、11或12所示多肽序列并具有t120c氨基酸取代的ch1区,以及具有选自seq id no:13或14所示多肽序列的cl区。
[0186]
实施方式11为一种分离的多特异性抗体或其抗原结合片段,其中所述多特异性抗体或其抗原结合片段包括如实施方式1-10中任一项所述的单克隆抗体或其抗原结合片段,并且其中所述多特异性抗体或其抗原结合片段包括一个或多个抗原结合臂,其包含与fa偶联的被取代的氨基酸残基。
[0187]
实施方式12为实施方式11所述的分离的多特异性抗体或其抗原结合片段,其中所述的多特异性抗体或其抗原结合片段为双特异性抗体或抗原结合片段,其包括第一抗原结合臂(ab1)和第二抗原结合臂(ab2),其中ab1和/或ab2包含与fa偶联的被取代的氨基酸。
[0188]
实施方式13为实施方式12所述的分离的双特异性抗体或其抗原结合片段,其中ab1结合免疫细胞调节剂(icm),优选为人icm。
[0189]
实施方式14为实施方式13所述的分离的双特异性抗体或其抗原结合片段,其中所述的icm选自下组:cd3、cd27、cd28、cd40、cd122、ox40、cd16、4-1bb、gitr、icos、ctla-4、pd-1、lag-3、tim-3、tigit、vista、siglec7、nkg2d、siglec9、kir、cd91、btla、nkp46、b7-h3、siprα,和其他细胞表面免疫调节分子。
[0190]
实施方式15为实施方式12-14中任一项所述的分离的双特异性抗体或其抗原结合片段,其中ab2结合肿瘤相关抗原(taa),优选为人肿瘤相关抗原(人taa)。
[0191]
实施方式16为实施方式15所述的分离的双特异性抗体或其抗原结合片段,其中所述taa为dll3。
[0192]
实施方式17为实施方式12-16中任一项所述的分离的双特异性抗体或其抗原结合片段,其中所述第一抗原结合臂(ab1)其包括h1和l1,并且第二抗原结合臂(ab2)包括h2和l2,其中:(a)h1和h2各自包括人igg1、igg2、igg3或igg4的ch1区;并且(b)l1和l2各自包括人κ轻链或人λ轻链的cl区;其中,h1l1和h2l2各自包括选自下组氨基酸取代的电荷对:(1)分别在h1的ch1中的g166d/e和l1的cl中的s114k/r,以及分别在h2的ch1中的g166k/r和l2的cl中的s114d/e;(2)分别在h1的ch1中的t187d/e和l1的cl中的d/n170k/r,以及分别在h2的ch1中的t187k/r和l2的cl中的d/n170d/e;(3)分别在h1的ch1中的s131d/e和l1的cl中的p119k/r,以及分别在h2的ch1中的s131k/r和l2的cl中的p119d/e;(4)分别在h1的ch1中的a129d/e和l1的cl中的s121k/r,以及分别在h2的ch1中的a129k/r和l2的cl中的s121d/e;
(5)分别在h1的ch1中的k/r133d/e和l1的cl中的k207k/r,以及分别在h2的ch1中的k/r133k/r和l2的cl中的k207d/e;(6)分别在h1的ch1中的k/r133d/e和l1的cl中的i/l117k/r,以及分别在h2的ch1中的k/r133k/r和l2的cl中的i/l117d/e;(7)分别在h1的ch1中的k/r133d/e和l1的cl中的f/v209k/r,以及分别在h2的ch1中的k/r133k/r和l2的cl中的f/v209d/e;(8)分别在h2的ch1中的g166d/e和l2的cl中的s114k/r,以及分别在h1的ch1中的g166k/r和l1的cl中的s114d/e;(9)分别在h2的ch1中的t187d/e和l2的cl中的d/n170k/r,以及分别在h1的ch1中的t187k/r和l1的cl中的d/n170d/e;(10)分别在h2的ch1中的s131d/e和l2的cl中的p119k/r,以及分别在h1的ch1中的s131k/r和l1的cl中的p119d/e;(11)分别在h2的ch1中的a129d/e和l2的cl中的s121k/r,以及分别在h1的ch1中的a129k/r和l1的cl中的s121d/e;(12)分别在h2的ch1中的k/r133d/e和l2的cl中的k207k/r,以及分别在h1的ch1中的k/r133k/r和l1的cl中的k207d/e;(13)分别在h2的ch1中的k/r133d/e和l2的cl中的i/l117k/r,以及分别在h1的ch1中的k/r133k/r和l1的cl中的i/l117d/e;或(14)分别在h2的ch1中的k/r133d/e和l2的cl中的f/v209k/r,以及分别在h1的ch1中的k/r133k/r和l1的cl中的f/v209d/e。
[0193]
实施方式18为实施方式12-17中任一项所述的分离的双特异性抗体或其抗原结合片段,其中所述的双特异性抗体或其抗原结合片段包括:a.第一抗原结合臂(ab1),其包括具有seq id no:15所示多肽序列的vh区、具有seq id no:17所示多肽序列的vl区、具有seq idno:16所示多肽序列的ch1区,以及具有seq id no:18所示多肽序列的cl区;b.第一抗原结合臂(ab1),其包括具有seq id no:19所示多肽序列的vh区、具有seq id no:21所示多肽序列的vl区、具有seq idno:20所示多肽序列的ch1区,以及具有seq id no:22所示多肽序列的cl区;c.第一抗原结合臂(ab1),其包括具有seq id no:29所示多肽序列的vh区、具有seq id no:30所示多肽序列的vl区、具有seq idno:16所示多肽序列的ch1区,以及具有seq id no:18所示多肽序列的cl区;或d.第一抗原结合臂(ab1),其包括具有seq id no:31所示多肽序列的vh区、具有seq id no:32所示多肽序列的vl区、具有seq idno:20所示多肽序列的ch1区,以及具有seq id no:22所示多肽序列的cl区。
[0194]
实施方式19为实施方式18所述的分离的双特异性抗体或其抗原结合片段,其中所述第二抗原结合臂(ab2)包括具有seq id no:23所示多肽序列的vh区、具有seq id no:25所示多肽序列的vl区、具有seq id no:24所示多肽序列的ch1区,以及具有seq id no:26所示多肽序列的cl区。
[0195]
实施方式20为实施方式1-19中任一项所述的分离的抗体或其抗原结合片段,其中
所述fa选自下组:具有6个碳、8个碳、10个碳、12个碳、14个碳、16个碳、或18个碳,或介于之间的任意数量的碳的fa。
[0196]
实施方式21为实施方式20所述的分离的抗体或其抗原结合片段,其中所述fa选自下组:具有14个碳或18个碳或介于之间的任意数量的碳的fa。
[0197]
实施方式22为实施方式1-21中任一项所述的分离的抗体或其抗原结合片段,其中所述fa包括用于偶联至被取代的氨基酸残基的连接子。
[0198]
实施方式23为实施方式22所述的分离的抗体或其抗原结合片段,其中所述连接子选自肽连接子或聚乙二醇连接子。
[0199]
实施方式24为实施方式23所述的分离的抗体或其抗原结合片段,其中所述肽连接子小于50个氨基酸。
[0200]
实施方式25为实施方式1-24中任一项所述的分离的抗体或其抗原结合片段,其中所述偶联至抗体或其抗原结合片段的fa能够结合白蛋白,其中白蛋白结合至fa导致靶抗原与抗体或其抗原结合片段之间的结合部分或完全阻断。
[0201]
实施方式26为实施方式1-25中任一项所述的分离的抗体或其抗原结合片段,其中相比未结合白蛋白的所述分离的抗体或其抗原结合片段,结合白蛋白的所述分离的抗体或其抗原结合片段激活t细胞的能力降低。
[0202]
实施方式27为一种分离的核酸,其编码实施方式1-26中任一项所述的分离的抗体或其抗原结合片段。
[0203]
实施方式28为一种载体,所述载体包含实施方式27所述的分离的核酸。
[0204]
实施方式29为一种分离的宿主细胞,所述宿主细胞包含实施方式27所述的载体。
[0205]
实施方式30为一种药物组合物,其包含如实施方式1-26中任一项所述的分离的抗体或其抗原结合片段,和药学上可接受的载体。
[0206]
实施方式31为一种治疗有需要的受试者的癌症的方法,所述方法包括给所述受试者施用如实施方式30所述的药物组合物。
[0207]
实施方式32为实施方式31所述的方法,其中所述癌症选自下组:肺癌、胃癌、食管癌、胆道癌、胆管癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、神经胶质瘤、胶质母细胞瘤和其他实体瘤,以及非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、慢性粒细胞白血病(cml)、多发性骨髓瘤(mm)、急性髓性白血病(aml)和其他血液肿瘤。
[0208]
实施方式33为一种生产如实施方式1-26中任一项所述的分离的抗体或其抗原结合片段的方法,所述方法包括在生产所述抗体或其抗原结合片段的条件下培养包含编码所述抗体或其抗原结合片段的核酸的细胞,以及从细胞或培养物中回收抗体或其抗原结合片段。
[0209]
实施方式34为实施方式33所述的方法,其还包括将fa与抗体或其抗原结合片段在被取代的氨基酸残基处偶联。
[0210]
实施方式35为一种制备包含分离的抗体或其抗原结合片段的药物组合物的方法,所述方法包括将实施方式1-26中任一项所述的抗体或其抗原结合片段与药学上可接受的载体组合以获得所述药物组合物。
[0211]
实施方式36为一种方法,其包括将白蛋白与实施方式1-26中任一项所述的分离的
抗体或其抗原结合片段接触,其中所述抗体或其抗原结合片段能够特异性结合靶抗原,所述fa能够结合白蛋白,并且白蛋白结合至fa导致靶抗原与抗体或其抗原结合片段之间的结合部分或完全阻断。
[0212]
实施方式37为实施方式36所述的方法,其中所述接触步骤包括给有需要治疗肿瘤的受试者施用包含所述分离的抗体或其抗原结合片段的药物组合物,其中所述肿瘤包含所述靶抗原。
[0213]
实施方式37为实施方式36或37所述的方法,其中与循环血相比,白蛋白在肿瘤微环境中具有更高的周转率,和/或白蛋白以低于受试者循环血液中白蛋白水平的水平存在于肿瘤微环境中,优选地,肿瘤微环境中白蛋白水平较低是由于肿瘤微环境中白蛋白分解代谢高和/或肿瘤微环境中蛋白酶水平高。实施例
[0214]
实施例1:偶联脂肪酸分子的单克隆抗体的构建与鉴定
[0215]
图1a显示了单克隆抗体(mab)的示意图,其中vh区域中的残基被识别并用半胱氨酸(敲入的半胱氨酸)取代。包含连接子和反应基团的脂肪酸(fa)分子与敲入的半胱氨酸偶联,使得每个单抗包含两个fa分子(图1a)。单克隆抗体还可以包含vl中的被取代的氨基酸残基,或者在ch1或cl区域中距离vh或vl的二十(20)个氨基酸距离内(优选五(5)个氨基酸的距离内)的氨基酸残基。敲入的半胱氨酸残基也可以是其他适合偶联fa的活性氨基酸残基。
[0216]
偶联的fa分子可与血液和/或组织间质液中循环的白蛋白结合。由于结合白蛋白的空间位阻效应,结合白蛋白分子有望部分或完全阻断偶联的mab的抗原结合域(包括vh和vl)与抗原的相互作用。因此,偶联的mab的抗原结合活性能够由周围白蛋白水平调节。根据敲入氨基酸残基的位置、fa的长度、连接子的存在和连接子的长度,可以实现对mab与靶抗原结合的不同程度的调节。
[0217]
例如,图1a中的mab可以是抗cd3抗体。偶联后,抗cd3 mab的活性可在体内由白蛋白调节,从而使抗cd3 mab在循环血液中无活性或活性较低。在肿瘤微环境中,由于白蛋白的周转率高于循环血,空偶联mab(即未结合白蛋白的偶联的抗cd3 mab)的浓度增加,t细胞的激活导致了抗cd3 mab介导的癌症杀伤作用。mab可定向至其他癌症靶点,尤其是icm(例如,4-1bb、gitr、ox40、cd28或pd-1),其中治疗方法要求mab在循环血液中活性较低或无活性,而在肿瘤微环境中的活性较高。此外,该偶联和调节策略可用于非mab的抗原结合片段。在这种情况下,需要选择fa偶联位点、fa的长度、连接子的存在和连接子的长度,以使结合fa的白蛋白突出到抗原结合域和靶抗原之间的接合点。
[0218]
偶联的mab或其抗原结合片段可用于与另一抗体或其抗原结合片段构建双特异性抗体(bsab)或其抗原结合片段。为了便于说明,图1b-1c中显示了偶联的双特异性抗体。其ab1臂来自抗cd3抗体,ab2臂来自抗肿瘤相关抗原(taa)的mab。fa分子与抗cd3臂的区域(例如vh、vl或距离vh或vl区域的二十(20)个氨基酸距离内,优选五(5)个氨基酸的距离内)的偶联可以调节抗cd3活性,并由此调节双特异性抗体介导的t细胞活化,而抗taa臂与taa的结合不受周围白蛋白浓度的影响。偶联fa的双特异性抗体预期在白蛋白水平较高(例如35至50mg/ml)的循环血液和/或某些组织液中活性较低或无活性。在某些肿瘤微环境中,由于白蛋白的高周转率导致局部白蛋白水平降低和空偶联bsab(即未结合白蛋白的偶联的抗
cd3 bsab)的浓度提高,偶联fa的双特异性抗体有望激活t细胞,并通过激活t细胞提高癌细胞杀伤。bsab的抗cd3臂可定向至其他癌症靶点,尤其是icm(例如,4-1bb、gitr、ox40、cd28或pd-1),其中治疗方法要求bsab在循环血液中活性较低或无活性,而在肿瘤微环境中的活性更高。这种方法可以通过最小化靶向、非肿瘤毒性来增加基于抗cd3的双特异性t细胞接合器的安全空间。这种治疗方法可以降低通常在抗cd3t细胞接合器使用中观察到的细胞因子风暴综合征(crs)的风险。该偶联和调节策略可用于并非双特异性抗体的双特异性抗原结合片段。在这种情况下,需要选择fa偶联位点、fa的长度、连接子的存在和连接子的长度,以使偶联fa的白蛋白突出到抗原结合域和靶抗原之间的接合点。
[0219]
图1d提供了说明偶联fa的双特异性抗体t细胞接合器杀死癌细胞的作用机制的示意图。无论周围白蛋白水平如何,抗taa臂均与癌细胞表面的taa结合。当周围白蛋白水平较高(例如,循环血液中的35至50mg/ml)时,偶联fa的t细胞接合臂(例如,抗cd3臂)不与靶抗原(例如,cd3)结合;然而,当周围白蛋白水平较低时,偶联fa的t细胞接合臂(例如,抗cd3臂)与靶抗原(例如,cd3)结合,并激活t细胞,从而导致癌细胞死亡。fa偶联臂可以是针对其他t细胞icm的t细胞接合臂,例如4-1bb、gitr、ox40、cd28、pd-1或在t细胞上表达的任何其他靶点,并且特定抗体通过与其结合能够介导t细胞激活。此外,fa偶联臂可以抗其他免疫细胞上的icm。该方法利用了靶部位相比于循环血液中较低的白蛋白水平,也可应用于局部白蛋白水平较低的靶组织的治疗;这类组织包括脂肪组织和骨骼肌(ellmerer等人,am j physiol endocrinol metab.2000.278:e352-e356)。图1e显示了鉴定偶联fa的mab或bsab的具体步骤。
[0220]
使用修饰的抗cd3抗体构建偶联的mab。抗cd3 mab的vh和vl区域的序列和编号如图2a-2b和表1所示(分别为seq id no:1和2)。cdr区(hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3)的序列如表2所示(分别为seq id no:3、4、5、6、7和8,以及分别为seq id no:33、34、35、36、37和38)。igg1、igg2、igg3和igg4重链(hc)的ch1区的序列和编号如图2c和表1所示(分别为seq id no:9、10、11和12)。κ和λ轻链(lc)的cl区的序列和编号如图2d和表1所示(分别为seq id no:13和14)。
[0221]
使用结构建模鉴定抗cd3抗体fab区表面的残基。抗cd3 mab的序列由(schrodinger)(薛定谔;纽约州纽约市)建模为1sy6和3eo9。计算侧链溶剂可及性,选择侧链可及性均在30%-70%之间的重链和轻链可变区域内或附近的残基作为可能的半胱氨酸敲入候选位。表3列出了为确定敲入的残基。为半胱氨酸敲入实验选择的四个残基显示在抗cd3 mab的三维结构中作为示例(图3a):vl区的s26和s31、vh区的k64,以及hc的ch1区的t120(距离vh区c端3个氨基酸残基)。将这些位点上敲入半胱氨酸的mab分别命名为lc_s26c、lc_s31c、hc_k64c、和hc_t120c。lc_s26c代表轻链上s26位丝氨酸残基被半胱氨酸取代的抗cd3 mab。其他mab遵循相同的命名规则。
[0222]
表1:抗cd3 vh、抗cd3 vl、#2抗cd3 vh、#2抗cd3 vl、igg1 ch1、igg2 ch1、igg3 ch1、igg4 ch1、κcl和λcl区域的序列
[0223]
表2:抗cd3 mab和#2抗cd3 mab的cdr区域hc:重链;lc:轻链;cdr:互补决定区;抗cd3 mab的cdr利用imgt(lefranc,m.-p.等人,nucleic acids res.1999;27:209-212)和kabat方法(elvin a.kabat等人,免疫学相关蛋白质序列(sequences of proteins of immunological interest)第5版(1991))的组合确定。
[0224]
表3用于偶联的抗cd3 mab上的候选氨基酸替换
注:以粗体显示的mab已经生产出来,并在半胱氨酸敲入后表现出具有显著的cd3结合活性(最大结合大于野生型抗cd3 mab的最大抗原结合活性的50%)。氨基酸取代对抗原结合活性的影响尚未测试的残基以常规字体显示。vh和vl,kabat编号;ch1和cl,eu编号。
[0225]
在cho细胞中表达人igg4 hc和人κlc框架中的四种mab lc_s26c、lc_s31c、hc_k64c、和hc_t120c,并使用蛋白质a(protein a)色谱进行纯化,还使用jurkat细胞通过facs测试cd3结合(图3b-3e)。在半胱氨酸敲入后,lc_s31c失去了显著的活性(图3c)。lc_s26c、hc_k64c和hc_t120c具有cd3结合的高活性(图3b和图3d-3e),并被选择用于进一步研究。还对如表3所示的额外的残基进行了半胱氨酸敲入。在cho细胞中表达igg4 hc和κlc框架中产生的mab,使用蛋白质a色谱进行纯化,并使用jurkat细胞通过facs测试cd3结合。表3中粗体显示了半胱氨酸敲入后保留了野生型抗cd3mab最大抗原结合活性的50%以上的残基,使用jurkat细胞检测cd3结合的facs结果如图3f-3g所示。常规字体显示了未测试氨基酸取代对抗原结合活性影响的残基(表3)。
[0226]
实施例2:偶联脂肪酸分子的单克隆抗体的特性
[0227]
用于偶联的fa分子如图4a所示,包括c18、c14、c10和c6。所有分子都包含peg连接子和溴乙酸反应基团。为进行偶联反应,将抗体浓缩到20-30mg/ml的浓度,并将缓冲液更换
为tbs缓冲液。通过添加10当量的三(2-羧乙基)膦(tcep),抗体被部分还原,并将溶液在37℃下孵育1小时。然后将抗体缓冲液换成dpbs,并用30当量的脱氢抗坏血酸在室温(rt)下孵育1小时使抗体重新氧化。将抗体缓冲液换为偶联缓冲液(20mm tris ph 8.5+150mm nacl+10%甘油),并稀释至10mg/ml的浓度。从二甲基亚砜(dmso)的50mm溶液中以20当量添加fa分子,所得混合物在室温下孵育1或2天。最终产物的缓冲液更换为偶联缓冲液,以去除未反应的fa分子。样品通过疏水作用色谱进行纯化,并用液相色谱/质谱(lc/ms)进行分析。使用质谱(ms)对每个偶联的mab确认hc或lc上的正确偶联(图4b-4c)。fa与正确半胱氨酸敲入位点的偶联通过lc/ms得到证实(表4)。
[0228]
表4确认fa与正确半胱氨酸敲入位点的偶联注:偶联的mab经胰蛋白酶消化并使用lc/ms进行分析。对于给定的偶联mab,在lc/ms上鉴定了与fa偶联到正确半胱氨酸敲入位点的肽片段对应的峰。m/z,质荷比,其中m是质量,z是电荷数;expt,预期值;obs,观察值。
[0229]
在不存在或存在50mg/ml牛血清白蛋白(bsa)的情况下,测试c18偶联mab与jurkat细胞(已知表达cd3)结合的能力(图5a-5c)。在第一抗体结合步骤中,将jurkat细胞与所示抗体在含有0.1%酪蛋白且含或不含bsa的hbss缓冲液中孵育,然后在无bsa的缓冲液中处理。用facs定量抗体结合。证明了未偶联的mab与jurkat细胞的结合,并且该结合不受bsa的影响(图5a-5c)。偶联的mab仍然能够与jurkat细胞结合(图5a-5c)。偶联的mab与jurkat细胞的结合被bsa抑制,表明偶联的fa能够与bsa结合,从而减少了抗cd3 mab与抗原的结合。为了证实bsa对偶联的mab结合cd3的抑制作用,使用来自两个不同供体的外周血单核细胞(pbmc)进行t细胞活化试验。pbmc与所示抗体在含有多种浓度bsa的培养基中孵育16小时。通过facs测量cd25的表达来评估t细胞的活化。由于培养基中含有1%的fbs,因此在测定中各组中都存在低水平的bsa(根据1%的牛血清估计约为0.25mg/ml),预计会在bsa添加到培养基之前抑制偶联的mab对t细胞的激活(图6a-6c)。当将bsa添加到培养基中时,观察到添加的bsa对t细胞活化的抑制作用增强(图6a-6c)。
[0230]
为了测试偶联的fa分子长度的影响,将c6、c10和c14 fa分子分别与hc_k64c偶联。通过lc/ms证实了每种fa与每种mab的重链的特异性偶联(图4c)。通过lc/ms确认了fa与每个半胱氨酸敲入位点的偶联(表4)。如上所述,使用来自两个不同供体的外周血单核细胞测试偶联的mab的t细胞活化(图7a-7c)。在较高浓度的bsa存在下,c6和c10偶联在阻断cd3结
合方面效果较差(图7a-7b);在较高浓度的bsa存在下,c14偶联完全阻断cd3结合(图7c)。这些数据表明,偶联较长的fa分子(如c14和c18),能够更有效地通过结合bsa以阻断cd3结合,而偶联较短的c6和c10 fa分子,在通过结合bsa以阻断cd3结合方面的作用较弱。在肿瘤微环境的不同条件下,可以利用这些特征进行治疗。例如,根据肿瘤微环境和循环血液之间的白蛋白水平差异,可以优选较长的fa或较短的fa作为偶联分子,以实现最佳的体内疗效/安全空间。
[0231]
与脂肪酸分子偶联的双特异性抗体的表征
[0232]
fa偶联方法可用于调节双特异性抗体两臂之一的抗原结合活性。例如,双特异性抗体可以是抗taa/抗cd3 t细胞接合器,其中fa与抗cd3臂的fab区域偶联(如图1b-1c中的ab1臂所示)。此处用抗dll3臂作为抗taa臂的示例。用于构建抗dll3/抗cd3双特异性抗体的序列(如2021年2月5日提交的美国临时专利申请号63/146334中首次描述的,其通过引用整体并入本文)用于引入用于fa偶联的半胱氨酸敲入。将半胱氨酸敲入抗dll3/抗cd3双特异性抗体的抗cd3臂的k64位(vh区;kabat编号)或t120位(ch1区;eu编号)。产生的bsab分别命名为bsab hc_k64c和bsab hc_t120c,其序列列于表5中。需注意,bsab hc_k64c和bsab hc_t120c具有相同的抗dll3臂(表5)。该双特异性抗体位于人igg1 hc和人κlc框架上,在igg1的fc区域进行了以下修饰:抗cd3臂的hc具有t366w(eu编号)突变以形成“杵”,抗dll3臂的hc具有t366s、l368a和y407v突变以形成“孔”“臼”。此外,在抗cd3 hc上引入s354c半胱氨酸突变,在抗dll3 hc上引入y349c半胱酸突变以稳定异二聚体配对。此外,在h1和h2的ch2区都引入l234a和l235a突变。
[0233]
表5:敲入用于偶联的半胱氨酸的双特异性抗体的vh、vl、ch1和cl区序列
nacl]。通过强阳离子交换(scx)hplc分析洗脱部分,并将显示完全消除2x抗dll3 lc错配的组分(双臂上匹配的hc与抗dll3 lc异二聚体)合并。将(nh4)2so4添加到混合组分中,使最终浓度达到700mm,并将样品直接加载到用50mm tris(ph 7.5)+700mm(nh4)2so4+3%甘油预平衡的丁基琼脂糖高效(butyl sepharose high performance)(思拓凡(cytiva))hic(疏水相互作用色谱)柱上。样品用线性梯度洗脱[缓冲液a
–
50mm tris(ph 7.5)+700mm(nh4)2so4+3%甘油;缓冲液b
–
50mm tris(ph 7.5)+10%甘油]。通过hic hplc分析洗脱部分,并将显示完全消除2x抗cd3 lc错配的部分(双臂上匹配的hc与抗cd3 lc异二聚体)合并为纯化蛋白。用三种不同的方法分析纯化的双特异性抗体。
[0235]
对于hic hplc,在含有1m(nh4)2so4的缓冲液中将样品稀释至1mg/ml的最终浓度,并直接在安捷伦高级生物(agilent advancebio)hic 4.6x 100mm 3.6μm柱(pn:685975-908)中注入15μl进行hic hplc分析。使用线性梯度(缓冲液a
–
50mm tris ph 7.5+1m(nh4)2so4;缓冲液b
–
50mm tris ph7.5+10%甘油)在30℃1ml/min流速下分析样品。
[0236]
对于scx hplc,在含有25mm柠檬酸盐ph值4.5的缓冲液中将样品稀释至1mg/ml的最终浓度,并直接在沃特世生物解析(waters bioresolve)scx mab 4.6x 100mm 3μm柱(pn:18609060)中注入15μl进行scx hplc分析。使用线性梯度(缓冲液a
–
25mm磷酸盐ph 5.8+2%acn;缓冲液b
–
25mm磷酸盐ph 8+250mm nacl+2%acn),在30℃1ml/min流速下分析样品。
[0237]
对于尺寸排阻色谱(sec)hplc,将样品在pbs中稀释至1mg/ml的最终浓度,并直接在安捷伦高级生物(agilent advancebio)sec 300a 2.7μm 4.6x300mm柱(pn:pl1580-5301)中注入8μl进行sec hplc分析。使用等度洗脱(缓冲液
–
50mm磷酸盐ph 7.4+300mm nacl+5%异丙醇),以0.35ml/min的流速分析样品。
[0238]
在hic hplc、scx hplc和sec hplc上分析纯化的bsab(图8a-8b和9a-9b)。在图8a中,纯化的bsab hc_k64c与杂质分离,hic hplc上的2x抗dll3 lc错配除外;然而,当在scx hplc上分析时,纯化的bsab hc_k64c与2x抗dll3 lc错配分离良好(图8b)。这些数据表明,纯化的bsab hc_k64c不含杂质。此外,在sec hplc上,纯化的bsab hc_k64c是单一物质(图8c)。对bsab hc_t120c进行了类似观察(图9a-9b),表明纯化的bsab hc_t120c纯度高。
[0239]
纯化的bsab hc_k64c和bsab hc_t120c双特异性抗体与不同的fa分子偶联。为进行偶联,将在k64或t120处敲入半胱氨酸的双特异性抗体浓缩到20-30mg/ml的浓度,并将缓冲液换为tbs缓冲液。添加10当量tcep部分还原双特异性抗体,并将溶液在37℃下孵育1小时。然后将双特异性抗体缓冲液换成dpbs,并添加30当量脱氢抗坏血酸使双特异性抗体重新氧化,并在rt下将溶液孵育1小时。将最终的双特异性抗原样品缓冲液换为偶联缓冲液(20mm tris ph 8.5+150mm nacl+10%甘油),并稀释至10mg/ml的浓度。从二甲基亚砜(dmso)的50mm溶液中以12当量添加fa分子,所得混合物在rt下培养1天。最终产物的缓冲液换成偶联缓冲液以去除未反应的fa分子,然后通过hic纯化进行纯化。纯化的偶联双特异性抗体在hic hplc(图10a)和sec hplc(图10b)上进行分析。每个偶联的bsab均呈单峰,保留时间不同于相应的未偶联的bsab(图10a),表明偶联效率高。此外,每个偶联的bsab在sec hplc上显示为单峰(图10b)。
[0240]
表6确认fa与bsabs的偶联bsabmw计算值mw观测值备注
亲代bsab145307.4145310.7如预期bsab hc_k64c145282.4145404.8+1半胱氨酸bsab hc_t120c145309.4145433.0+1半胱氨酸bsab hc_k64c_c10145963.3145967.4如预期bsab hc_k64c_c14146019.4146022.5如预期bsab hc_k64c_c18146075.5146079.1如预期bsab hc_t120c_c14146046.4146051.2如预期bsab hc_t120c_c18146102.5146106.6如预期注:亲代bsab,无半胱氨酸敲入的抗dll3/抗cd3 bsab;mw,分子量mw;+1半胱氨酸,预计一个半胱氨酸将与敲入的半胱氨酸共价连接,并且所得的mw与预期一致。
[0241]
为了同时评估未偶联和偶联的双特异性抗体对dll3和cd3的结合活性,将纯化的双特性抗体与用不同荧光标记物标记的shp-77细胞和jurkat细胞孵育。通过流式细胞术检测和定量双特异性抗体诱导的双重染色事件。简而言之,根据制造商的说明,用紫色增殖染料450(violet proliferation dye 450)(bd,货号:562158)对jurkat细胞进行染色,用cfse(赛默飞世尔(thermofisher),货号:34554)对shp-77细胞进行染色。然后将标记的shp-77和jurkat细胞以1:1的比例与2μg/ml的bsab在存在或不存在1.5μm抗dll3阻断型mab或1.5μm抗cd3阻断型mab的情况下孵育(图11)。当使用阻断型mab时,在室温下用4.5μm抗-dll3阻断型mab预处理shp-77细胞10分钟,然后在最终浓度为1.5μm的抗-dll3阻断型mab中与jurkat细胞共孵育,或在室温下用4.5μm抗cd3阻断型mab预处理jurkat细胞10分钟,然后在最终浓度为1.5μm的抗cd3阻断型mab中与shp-77细胞共孵育。细胞在37℃的co2培养箱中孵育1小时后用2%甲醛固定,用tbs洗涤一次,用facs缓冲液(hbss,0.1%bsa,0.05%叠氮化钠)重悬,然后通过流式细胞仪(attune nxt)分析。在facs上检测到两种细胞类型在bsab存在下的交联,并且每个bsab(未偶联的和偶联的)的信号被抗dll3或抗cd3阻断型mab抑制(图11)。这些数据表明,未偶联的和偶联的bsab可以同时结合到两种不同的抗原。
[0242]
在功能性t细胞激活试验中,双特异性抗体也用于激活t细胞。使用jurkat nfat荧光素酶报告细胞系(bps生命科学(bps bioscience)),其在激活(包括cd3介导的激活)时条件性地表达萤火虫荧光素酶。在每种bsab(未偶联的和偶联的)存在下,以及在有或没有抗dll3阻断型抗体(最终浓度为500nm)存在下,将报告细胞与shp-77靶细胞在co2培养箱中于生长培养基中37℃孵育22小时。然后用荧光素酶检测试剂和光度计检测细胞的活化情况。当与靶细胞shp-77孵育时,每种双特异性抗体均诱导报告细胞的剂量依赖性激活,并且该信号被抗dll3阻断型抗体(抗dll3臂的mab形式)抑制(图12a-12b),证明了双特异性抗体的t细胞接合器功能。由于在试验期间需要0.5%的fbs(胎牛血清)作为用于细胞存活的培养基的一部分,因此试验中存在低水平的bsa(根据0.5%fbs估计约为0.13mg/ml),预计会导致bsab hc_k64c_c10、bsab hc_k64c_c14和bsab hc_k64c_c18的t细胞的激活信号降低(图12a)。
[0243]
还使用jurkat nfat荧光素酶报告细胞系在低和高bsa水平下进行t细胞激活试验,以评估白蛋白对偶联的双特异性抗体的t细胞激活功能的抑制作用。由于在试验期间,细胞存活需要0.5%的fbs作为培养基的一部分,因此在试验中,各组均存在较低水平的bsa(根据0.5%fbs估计约为0.13mg/ml)。当向试验中添加高水平的bsa(除了0.5%的fbs外,最
终浓度为10mg/ml的bsa)时,与对照组(仅0.5%fbs)相比,由偶联的双特异性bsab hc_k64c_c14和bsab hc_k64c_c18诱导的t细胞激活受到抑制(图13a);与对照组(仅0.5%fbs)相比,高水平的bsa(10mg/ml bsa+0.5%fbs)抑制了由偶联的双特异性bsab hc_t120c_c14和bsab hc_t120c_c18诱导的t细胞活化(图13b)。这些数据表明,偶联fa分子的抗dll3/抗cd3双特异性抗体的活性可由bsa水平调节。图5b表明fa与mab hc_k64c的偶联没有改变偶联臂与cd3的结合;此外,图11表明,fa与bsab hc_k64c的偶联并没有显著改变其双特异性活性,这表明图13a中bsab hc_k64c_c10的活性较低是因为作为培养基一部分所需的0.5%fbs携带了较低水平的bsa。对hc_k64c_c14和hc_k64c_c18进行了类似的观察(图13a)。观察结果与图6b和7a-7c中的数据一致,这表明在存在bsa的情况下,在k64位的fa偶联对抗cd3臂与cd3的结合的影响远大于t120位。这也符合以下事实,即比起t120c位,与k64c位偶联的fa结合的bsa更接近cdr,并且更有效地阻断靶抗原(cd3)结合。
[0244]
进行elisa测定,以评估bsa对每个偶联的双特异性抗体的抗dll3臂的抗原结合活性的影响。用dll3蛋白(艾迪泼吉(adipogen),货号:ag-40b-0151-c010)在rt(室温)下包被96孔elisa板1小时,然后在rt下用5%bsa在tbst中封闭1小时。用tbst洗板3次,并在rt下加或不加阻断剂(200μg/ml抗dll3 f(ab')2或50mg/ml bsa(西格玛(sigma),货号:a4612-25g);tbst用于无阻断剂组)预孵育1小时。然后在存在或不存在100μg/ml抗dll3 f(ab')2或50mg/ml bsa的情况下,在rt下将平板与1μg/ml bsab孵育30分钟。孵育后,清洗平板,并使用易美逊(envision)分光光度计使用hrp偶联抗人igg二抗(赛默飞世尔(thermofisher),货号:h10007)和tmb底物(赛默飞世尔(thermofisher),货号:34029)检测信号。图14表明,bsa对各个偶联的bsab的抗dll3臂的抗原结合活性影响很小。
[0245]
第二组抗cd3(#2抗cd3)vh和vl序列(分别为seq id no:27和28;kabat编号)也可用于构建偶联的mab和bsab,如表1所示。另外,这些序列的修饰形式也可以用于构建偶联的抗dll3/抗cd3双特异性抗体(表5),其包括第一抗原结合臂(ab1),所述第一抗原结合臂包含具有seq id no:29所示多肽序列的vh区、具有seq id no:30所示多肽序列的vl区、具有seq id no:16所示多肽序列的ch1区,和具有seq id no:18所示多肽序列的cl区;或所述第一抗原结合臂(ab1),其包含具有seq id no:31所示多肽序列的vh区、具有seq id no:32所示多肽序列的vl区、具有seq id no:20所示多肽序列的ch1区,和具有seq id no:22所示多肽序列的cl区。在上述每种情况中,第二抗原结合臂(ab2)均包括具有seq id no:23所示多肽序列的vh区、具有seq id no:25所示多肽序列的vl区、具有seq id no:24所示多肽序列的ch1区,以及具有seq id no:26所示多肽序列的cl区。此外,上述每个第一抗原结合臂(ab1)均可用于构建针对cd3的和非dll3的taa的双特异性抗体。
[0246]
本领域技术人员能够意识到,可以在不脱离上述实施例大致发明构思的情况下对其作出更改。因此,应理解,本发明不仅限于所公开的特定实施方式,其旨在包含本说明书所定义的本发明的精神和范围内作出的修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1