含有山梨糖醇和甘露糖醇的组合的达托霉素制剂的制作方法
含有山梨糖醇和甘露糖醇的组合的达托霉素制剂
1.优先权声明
2.本技术要求2020年3月12日提交的标题为“含有山梨糖醇和甘露糖醇的组合的达托霉素制剂(daptomycin formulations containing a combination of sorbitol and mannitol)”的美国临时专利申请序列号62/988,734和2020年9月25日提交的标题为“含有山梨糖醇和甘露糖醇的组合的达托霉素制剂”的美国临时专利申请序列号63/083,434的优先权和权益,所述美国临时专利申请各自的全部内容以引用的方式并入在此并作为依据。
技术领域
3.本公开总体上涉及含有山梨糖醇和甘露糖醇的组合的达托霉素制剂以及制备和使用此类制剂的方法。
背景技术:
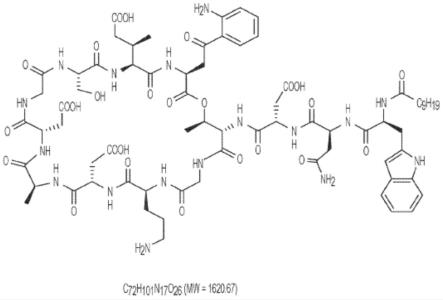
4.达托霉素(图1)是一种用于治疗由革兰氏阳性生物体(包括耐万古霉素肠球菌、耐甲氧西林金黄色葡萄球菌(staphylococcus aureus)和耐青霉素肺炎链球菌(streptococcus pneumoniae))引起的全身性致命性感染的脂肽抗生素。达托霉素是一种在土壤腐生菌玫瑰孢链霉菌(streptomyces roseosporus)中发现的天然存在的化合物。该化合物可以作为冻干饼形式提供,可以用无菌水重构,然后经静脉内施用。
5.本领域中一致认为蔗糖是用于增强冻干达托霉素在储存过程中的化学稳定性的优选赋形剂;虽然多元醇如甘露糖醇可以与蔗糖组合使用,但多元醇如甘露糖醇本身(无蔗糖时)被认为不能像蔗糖那样有效地增强冻干达托霉素的化学稳定性。
技术实现要素:
6.如本文稍后公开的实验例所示,本发明人惊讶地发现山梨糖醇和甘露糖醇的组合,特别是在其相对于达托霉素的特定重量百分比和特定摩尔重量比下,可以用于提供在高于室温(例如在约25℃)能有效储存至少一个月的有利达托霉素产品,例如在约25℃储存至少六个月。此外,在这种储存之后,如本文公开的包括山梨糖醇和甘露糖醇的组合的达托霉素制剂可以出乎意料地具有与含有通常优选的赋形剂(蔗糖)的达托霉素制剂基本相似的达托霉素稳定性,如通过主要的达托霉素杂质(即杂质d7)的形成所测量的(图2)。
7.这些结果出乎意料,因为普遍的理解是,由于山梨糖醇的tg'值相对较低,因此在此类制剂中应当避免山梨糖醇;但与之相反,发明人发现尽管tg'值相对较低,但含山梨糖醇的制剂令人惊讶地可以快速而又有效地冷冻干燥。举例来说,由斯普林格科学与商业媒体(springer science&business media)于2004年出版的由costantino和pikal编辑的《生物制药的冻干》(“lyophilization of biopharmaceuticals”)公开了应避免冻干具有极低tg'的赋形剂,如山梨糖醇,因为它倾向于促进饼塌陷。然而,发明人发现含有山梨糖醇和甘露糖醇的组合的达托霉素制剂的tg'值极低(大约-40℃),但是不影响制剂的可制造性。
8.此外,就此而言,发明人出乎意料地发现含有山梨糖醇和甘露糖醇的组合的达托
霉素制剂可以在比预期更高的温度下冷冻干燥而没有显著的稳定性损失。因此,本发明的这些达托霉素制剂可以在不到一周(例如约48小时或更短时间)内快速而又有效地冷冻干燥(例如,没有发生饼塌陷)。举例来说,在一个特定的非限制性实施方式中,通过干燥工艺将含有山梨糖醇和甘露糖醇组合的达托霉素制剂冷冻干燥成稳定的饼,所述干燥工艺包括在约-25℃至约50℃的温度下持续约15小时至约120小时的时间段的升华干燥,优选约5℃至约30℃持续约16小时至约25小时、更优选约8℃至约25℃持续约17小时至约30小时、甚至更优选约10℃至约20℃持续约18小时至约25小时、最优选约15℃持续约20小时的升华干燥,任选地在之前和/或之后进行一个或多个额外干燥步骤。
9.这个结果令人惊讶,因为山梨糖醇的极低tg'已经表明了此类制剂的干燥时间低效且在商业上不切实际。达托霉素制剂的这种由它的山梨糖醇和甘露糖醇的组合提供的出乎意料的可制造性有利地允许商业上成本有效的干燥工艺和有益的达托霉素饼稳定性。实际上,原本预期高于山梨糖醇的tg'的冷冻干燥温度会使达托霉素饼塌陷。
10.此外,山梨糖醇是甘露糖醇的异构体,因此具有与甘露糖醇相似的化学结构。因此,这些结果也令人惊讶,因为没有预料到山梨糖醇和甘露糖醇的组合会达到与通过蔗糖获得的稳定性大致相等的稳定性,而甘露糖醇本身无法达到这样的稳定性。
11.此外,就此而言,如本文公开的山梨糖醇和甘露糖醇的组合与基于它们单独效果对所述组合的预期相比,令人惊讶地减少了由在约25℃储存而产生的杂质d7的量,因此实现了出乎意料的达托霉素的稳定性水平,如依图3所示进行测量以及本文稍后更详细地讨论的。杂质d7是达托霉素冻干饼中生成的主要杂质,而山梨糖醇和甘露糖醇的组合可以防止储存过程中的d7形成,达到相对于含有通常优选的赋形剂蔗糖的达托霉素制剂基本相似的程度。
12.因此,本公开的一个方面是一种固体达托霉素制剂,所述固体达托霉素制剂包括山梨糖醇和甘露糖醇的组合,并且在25℃储存6个月后杂质d7增加不超过约1.00%,例如在25℃储存6个月后杂质d7增加不超过约0.90%或在25℃储存6个月后不超过约0.80%,优选在25℃储存6个月后杂质d7增加不超过约0.70%,更优选在25℃储存6个月后杂质d7增加不超过约0.60%,甚至更优选在25℃储存6个月后杂质d7增加不超过约0.50%,还更优选在25℃储存6个月后杂质d7增加不超过约0.40%,最优选在25℃储存6个月后杂质d7增加不超过约0.30%,如依图3所示进行测量。
13.在本公开的一个方面,提供了一种制造包含达托霉素的可药用固体组合物的方法。所述方法包括干燥水溶液,所述水溶液包含:(i)水;(ii)达托霉素;(iii)山梨糖醇,其量占所述水溶液的总体积的约3.0重量%至约6.0重量%;以及(iv)甘露糖醇,其量占所述水溶液的总体积的约3.0重量%至约5.0重量%,以形成所述固体组合物,其中水分含量占所述固体组合物的总重量的约1.0重量%或更低。所得固体组合物是本公开的另一个方面。
14.在本公开的另一个方面,提供了一种包含达托霉素的可药用固体组合物。所述可药用固体组合物包含达托霉素以及山梨糖醇和甘露糖醇组合。在一些实施方式中,山梨糖醇优选占所述固体组合物的总重量的约6.2重量%至约45.3重量%,甘露糖醇占所述固体组合物的总重量的约3.1重量%至约47.5重量%,山梨糖醇和甘露糖醇总计优选占所述固体组合物的总重量的约31.0重量%至约59.4重量%。
15.在本公开的另一个方面,提供了一种在患有细菌感染的受试者中治疗细菌感染的
方法。所述方法包括向所述受试者施用有效量的药物产品;所述药物产品包含达托霉素以及甘露糖醇和山梨糖醇组合。
附图说明
16.图1示出了达托霉素的化学结构。
17.图2示出了达托霉素杂质d7的化学结构。
18.图3示出了确定达托霉素杂质d7的量的方法。
19.图4是根据本公开的制造包含达托霉素的固体组合物的方法的实施方式的非限制性实例的流程图。
20.图5a和图5b示出了本文公开的实施例1a中的测试制品和实验研究结果。
21.图6a、图6b和图6c示出了本文公开的实施例1b的实验研究中第一次、第二次和第三个产品温度操作的冻干循环工艺参数(深蓝色线是货架温度;橙色线是室压力;黄色、淡蓝色和绿色线是所述三种制剂的产品温度;灰色线是皮拉尼读数,它表示水蒸气的量)。
22.图7和图8示出了本文公开的实施例2中的测试制品和实验研究结果。
23.图9至图11示出了本文公开的实施例3中的测试制品和实验研究结果。
24.图12至图17示出了本文公开的实施例4中的测试制品和实验研究结果。
25.图18是示出了来自实施例4的一些测试制品的表格,所述实施例将在25℃储存6个月后杂质d7的增加限制为相对于储存开始时的量增加不超过约1.00%。该表格还示出了从这些测试制品合理内推,从而同样将在25℃储存6个月后杂质d7的增加限制为增加不超过约1.00%的实施方式。该表格包括针对固体饼计算的组分量(这些计算不包括水分,水分最多占所述固体饼的约1.0重量%)。
26.图19是示出了来自实施例5中的研究的杂质d7和总杂质的结果的表格,该研究调查了三个批次的达托霉素制剂n11的18个月长期数据(25℃储存),所述制剂代表了本公开提供的实施方式。
具体实施方式
27.定义
28.下文提供了一些定义。然而,定义可能位于下面的“实施方式”部分,并且上面的标题“定义”并不意味着“实施方式”部分中的此类公开内容不是定义。
29.除非另外表述,否则本文针对固体组合物表述的重量百分比是所提及的组分的重量相对于所述固体组合物的总重量。举例来说,占固体组合物3.0重量%的组分相当于3.0g所述组分/100g总固体组合物。除非另外表述,否则本文针对水溶液组合物表述的重量百分比是所提及的组分的重量相对于所述水溶液组合物的总体积。举例来说,占水溶液组合物3.0重量%的组分相当于3.0g所述组分/100ml总水溶液组合物。
30.当本文提及ph时,值对应于在25℃用标准设备测量的ph。
31.如本文所用,“约”、“大约”和“基本上”理解为是指在一定数值范围的数值,所述数值范围例如是所提及数值的-10%至+10%、优选所提及数值的-5%至+5%、更优选所提及数值的-1%至+1%、甚至更优选所提及数值的-0.1%至+0.1%、最优选所提及数值的-0.01%至+0.01%。
32.本文的所有数值范围都应理解为包括所述范围内的所有整数、整体或分数。此外,这些数值范围应当被视为给针对该范围内的任何数值或数值子集的技术方案提供支持。举例来说,公开内容从1到10应当被视为支持从1到8、从3到7、从1到9、从3.6到4.6、从3.5到9.9等范围。
33.除非上下文另外清楚指出,否则如本公开和权利要求书中所用,单数形式“一个”、“一种”和“该”包括复数个参考物。因此,举例来说,提及“一个温度”或“该温度”包括两个或更多个温度。
34.词语“包含(comprise、comprises、comprising)”应当被包容性地而非排他性地解释。同样术语“包括(include)”、“包括(including)”、“含有”和“具有”都应当被视为包容性的,除非上下文明确禁止这样解释。此外,就此而言,这些术语规定了存在所述特征,但不排除存在额外的或其它的特征。
35.然而,本文公开的组合物和方法可能缺少本文未明确公开的任何要素。因此,对使用术语“包含”的实施方式的公开为(i)公开了具有所确定的组分或步骤以及额外的组分或步骤的实施方式,(ii)公开了“基本上由所确定的组分或步骤组成”的实施方式,以及(iii)公开了“由确定的组分或步骤组成”的实施方式。本文公开的任何实施方式都可以与本文公开的任何其它实施方式组合。
36.在“x和/或y”的上下文中所用的术语“和/或”应当解释为“x”或“y”或“x和y”。类似地,“x或y中的至少一个”应当解释为“x”或“y”或“x和y”。
37.在用于本文时,术语“实例”和“诸如”,特别是当后面跟随术语列表时,仅仅是示例性和说明性的,而不应当被视为排他性或全面性的。
[0038]“受试者”或“个体”为哺乳动物,优选人。如本文所用,“有效量”是预防缺乏、治疗个体的疾病或医学疾患,或更一般来说,减轻症状、控制疾病进展或向所述个体提供营养学、生理学或医学益处的量。
[0039]
术语“治疗(treatment和treat)”包括预防性或预防性治疗(预防和/或减缓目标病理疾患或病症的发展)以及治愈性、治疗性或疾病改善性治疗,包括治愈所诊断的病理疾患或病症、减缓所诊断的病理疾患或病症、减轻其症状和/或停止其进展的治疗措施;对有感染疾病风险或疑似已经感染疾病的患者以及患病或已被诊断为罹患疾病或医学疾患的患者进行治疗。术语“治疗”未必意味着对受试者进行治疗直到完全康复。术语“治疗”还指维持和/或促进未患病但倾向于发展不健康状况的个体的健康。术语“治疗”还旨在包括加强或以其它方式增强一种或多种主要预防或治疗措施。作为非限制性实例,治疗可以由患者、护理人员、医生、护士或另一保健专业人员进行。
[0040]
如本文所用,术语“单位剂型”是指适合作为人和动物受试者用单位剂量的物理离散单位,各单位含有与可药用稀释剂、载体或载体缔合的预定量的本文公开的组合物,所述量足以产生所需效果。单位剂型的规格取决于所采用的特定化合物、欲达到的效果以及各化合物在宿主中的相关药效动力学。
[0041]
如本文所用,术语“可药用”是指当施用于受试者时不会引起实质性不良过敏或免疫反应的物质。
[0042]
提及特定组分时所用的术语“基本上没有”意指任一种所存在的组分都占以重量计小于约2.0%,如以重量计小于约1.0%,优选以重量计小于约0.5%,或更优选以重量计
小于约0.1%。
[0043]
术语tg是指组合物在干燥状态下的玻璃化转变温度,通常受内部水分含量和配方影响,而术语tg'(tg-prime)是指组合物在冷冻浓缩状态下的玻璃化转变温度,通常仅受配方影响。
[0044]
除非另外指明,否则使用超高效液相色谱(uplc)分析测量在含有达托霉素的水性重构液体溶液中的达托霉素和结构相似化合物如杂质d7的量,使用带有紫外(uv)检测器的agilent 1290或waters h级超高效液相色谱仪。使用waters empower 3软件测量峰面积。除非另外指出,否则通过在10ml水中重构500mg固体达托霉素制剂以形成重构溶液,然后通过uplc使用图3所述的参数测量重构样品在222nm处的吸光度来确定固体达托霉素制剂的纯度。使用以下等式计算达托霉素杂质(例如杂质d7)的面积%。
[0045][0046]
其中:
[0047]
ai=样品溶液中各个别相关物质的经调节的峰面积响应。
[0048]
au=样品溶液中的达托霉素的峰面积响应
[0049]
实施方式
[0050]
本公开的一个方面是制造包含达托霉素的固体组合物的方法。所述固体组合物可以随后在水性可药用稀释剂(例如,无菌和/或抑菌水,优选含0.9重量%氯化钠)中重构,以形成供肠胃外施用的药物产品。肠胃外施用的非限制性实例包括静脉内、肌肉内、腹膜内、皮下、关节内、滑膜内、眼内、鞘内、局部和吸入。例如,所述固体组合物可以是含有约500mg达托霉素的冻干饼,在用约10ml的约0.9重量%氯化钠重构后用于静脉内施用。
[0051]
图4总体上说明了制造包含达托霉素的固体组合物的方法200的实施方式的非限制性实例的流程图。尽管方法200的一些实施方式可以包括全部所述步骤,但方法200的其它实施方式可以省略所述步骤中的一个或全部,并且除非另外指明,否则各步骤为可选的。本公开不限于图4所示的方法200的具体实施方式。
[0052]
制造包含达托霉素的固体组合物的方法包括使达托霉素、山梨糖醇和甘露糖醇的水溶液组合物经受至少一个从所述水溶液组合物除去至少一部分水的步骤,如冻干、冷冻干燥、喷雾干燥、流化床干燥、喷雾冷却、沉淀或结晶中的一个或多个(例如,方法200的步骤210)。术语“冻干”和“冷冻干燥”在本文可互换使用。“至少一个从所述水溶液组合物除去至少一部分水的步骤”在下文称为“干燥”步骤,但该术语并不意味着必须除去所有的水。
[0053]
此外,本公开不限于干燥步骤210的具体实施方式,并且干燥步骤210可以使用任何可药用方法将液体组合物转化为具有本文公开的水分含量的固体组合物。另外,就此而言,本领域技术人员将认识到可以基于固体组合物的所需水分含量来选择干燥步骤的一个或多个参数,例如干燥步骤210中的时间、温度、压力或阶段数中的一个或多个。如下文更详细讨论,固体组合物的优选水分含量占所述固体组合物的总重量的约1.0重量%水分或更低,并且本领域技术人员可以容易地确定适合实现本文公开的水分含量(例如,占所述固体组合物的总重量的约1.0重量%或更低)的冻干条件。在干燥步骤210过程中对组合物施加的温度在本文中称为“货架温度”;在干燥步骤210过程中组合物本身的温度在本文中称为“产品温度”。
[0054]
干燥步骤210优选包括通过升华除去达托霉素、山梨糖醇和甘露糖醇的组合物中的冰的升华干燥,任选除去基本上所有的冰。升华干燥在本领域中有时称为一次干燥(primary drying)。
[0055]
在升华干燥过程中,产品温度通常比货架温度低,这是因为施加到组合物的热量至少部分被用于升华相变。当冰的升华基本或完全完成时,产品温度通常会升高并接近货架温度。因此,本文公开的升华干燥在产品温度约等于货架温度时基本完成;并且在此类实施方式中,在完成升华干燥之后的任何可选干燥都被表征为升华干燥后续的额外干燥。
[0056]
另外,就此而言,一些实施方式任选地包括升华干燥后续的一个或多个额外干燥步骤。所述一个或多个后续干燥步骤可以从组合物中除去水,例如在升华干燥之后剩余的水和/或与组合物的其它组分结合的水。升华干燥的此类后续干燥有时称为解吸,并且可以进行所述后续干燥直到所述固体组合物具有目标水分含量,优选适合长期储存的水分含量。在一些实施方式中,所述后续干燥在与升华干燥所用的货架温度相同或更高的货架温度下进行。然而,在一些实施方式中,升华干燥后任选地不进行任何后续干燥。
[0057]
举例来说,在一些实施方式中,升华干燥任选地在一个或多个额外干燥步骤之前和/或之后进行,使得干燥步骤210包括升华干燥、可选的一个或多个在先干燥步骤和可选的一个或多个后续干燥步骤。举例来说,在一个特定的非限制性实施方式中,升华干燥将组合物的水分含量调节到较低的水分含量,然后,在升华干燥后续的一个或多个额外干燥步骤将组合物的水分含量调节到目标水分含量。升华干燥步骤可以使组合物经受恒定温度和/或多个不同的温度,只要所述多个不同的温度中的每一个都在所需范围内即可。
[0058]
例如,升华干燥可以在约-25℃至约50℃、优选约5℃至约30℃,更优选约8℃至约25℃、甚至更优选约10℃至约20℃、最优选约15℃的温度下进行约15小时至约120小时、优选约16小时至约25小时、更优选约17小时至约30小时、甚至更优选约18小时至约25小时、最优选约20小时的时间段。
[0059]
这些温度是对组合物施加的温度(“货架温度”,如上所述);并且组合物本身的温度(“产品温度”,如上所述)低于升华干燥过程中对组合物施加的温度(例如低于上文公开的升华干燥的示例温度)并且在升华干燥完成时达到大约货架温度。在一些实施方式中,产品温度在升华干燥期间为约-30℃至约40℃,但通常不超过货架温度。
[0060]
优选地,干燥步骤210是选自以下的工艺:(i)所述工艺包括升华干燥,(ii)所述工艺包括升华干燥和一个或多个在先干燥步骤,(iii)所述工艺包括升华干燥和一个或多个后续干燥步骤,以及(iv)所述工艺包括升华干燥、一个或多个在先干燥步骤和一个或多个后续干燥步骤。
[0061]
在一个实施方式中,可以在进行干燥之前,在等于或低于所述水溶液组合物的冰点的温度下冷冻所述水溶液组合物,例如通过在进行干燥之前使所述水溶液组合物经受低于约-14℃(如约-40℃)的温度约2小时。在此类实施方式中,在升华干燥过程中,产品温度通常会低于货架温度。
[0062]
优选地,所述固体组合物是冻干粉末,例如呈具有基本均匀的颜色(例如,浅黄色至淡棕色)和基本均匀的质地的基本均质的饼的形式。然而,本公开不限于具体的固体组合物形式,并且固体组合物形式可以是本领域技术人员已知的任何可药用形式。
[0063]
优选地,在干燥步骤之前过滤水溶液,例如通过聚醚砜(pes)或聚偏二氟乙烯
(pvdf)过滤器(例如,方法200的步骤206)。可以在干燥步骤前将水溶液(经过滤的或未过滤的)填充到一个或多个小瓶(例如玻璃小瓶)中(例如方法200的步骤208),例如以便对所述水溶液组合物的小瓶进行干燥步骤。干燥步骤(例如方法200的步骤210)的一个或多个参数可以基于所述固体组合物的所需水分含量来选择,例如干燥步骤的时间、温度或压力中的一项或多项。
[0064]
优选地,在所述水溶液组合物的干燥步骤之前和/或期间,所述水溶液组合物的ph为约4.5至约8.0,优选为约6.0至约7.5,更优选为约6.7至约7.3,最优选为约7.0。因此,所述方法的一些实施方式包括至少一个ph调节步骤(例如,方法200的步骤204),例如加入碱如氢氧化钠(例如,1n naoh或5n naoh)和/或加入酸如盐酸(例如1n hcl)。在一个特定的非限制性实例中,所述至少一个ph调节步骤包括使用5n氢氧化钠将ph调节至约6.0,然后使用1n氢氧化钠将ph调节至约7.0,然后如果不慎使ph增加过高,则在需要时使用1n盐酸将ph下调至约7.0。然而,本公开不限于可选ph调节步骤的具体实施方式,并且所述可选ph调节步骤可以是本领域技术人员已知的任何可药用ph调节步骤。
[0065]
所述水溶液组合物的非限制性实例可以包含约80至约130mg/ml、优选约90至约120mg/ml、更优选约100至约110mg/ml、最优选约105mg/ml的量的达托霉素。此外,就此而言,所述水溶液组合物的非限制性实例可以包含占所述水溶液组合物的总体积的约8.0至约13.0重量%、优选约9.0至约12.0重量%、更优选约10.0至约11.0重量%、最优选约10.5重量%的量的达托霉素。
[0066]
在一些实施方式中,所述方法包括在对所述水溶液组合物进行所述干燥步骤之前制备所述水溶液组合物(例如,方法200的步骤202)。例如,所述方法可以包括将达托霉素加入液体(例如纯水和/或超纯水),在达托霉素溶解后,将山梨糖醇和甘露糖醇加入已经含有溶解的达托霉素的液体中。在一个优选实施方式中,所述方法包括将山梨糖醇和甘露糖醇加入液体(例如纯水和/或超纯水),在山梨糖醇和甘露糖醇溶解后,将达托霉素加入已经含有溶解的山梨糖醇和溶解的甘露糖醇的液体中。在另一个优选实施方式中,所述方法包括将达托霉素、山梨糖醇和甘露糖醇一起干混,然后将干混物加入液体(例如纯水和/或超纯水)中。然而,本公开不受制备水溶液组合物的具体方法限制,制备水溶液组合物的方法可以是本领域技术人员已知可药用的任何方法。
[0067]
制备水溶液组合物的这些步骤中有至少一部分可以任选地在约2℃至约8℃,例如约5℃下,或者另外地或替代地,在环境条件,即约25℃的温度和约1大气压的压力下进行。优选地,在恒定搅拌下进行混合,例如对于各混合步骤搅拌至少约15分钟。
[0068]
如上所述,水溶液组合物包含山梨糖醇和甘露糖醇的组合。所述水溶液组合物的非限制性实例可以包含相对于所述水溶液组合物的总体积以重量计占约1.2%至约9.0%、优选以重量计占约3.5%至约5.5%、更优选以重量计占约4.0%至约5.0%、甚至更优选以重量计占约4.5%至约5.0%,最优选以重量计占约5.0%的量的山梨糖醇。所述水溶液组合物的非限制性实例可以包含相对于所述水溶液组合物的总体积以重量计占约0.6%至约9.5%、优选以重量计占约3.5%至约5.0%、更优选以重量计占约4.0%至约5.0%、甚至更优选以重量计占约4.5%至约5.0%,最优选以重量计占约5.0%的量的甘露糖醇。
[0069]
所述方法使用的水溶液的一些实施方式的达托霉素:(山梨糖醇+甘露糖醇)摩尔比可以是约1:4至约1:13,优选约1:5至约1:13,并且山梨糖醇:甘露糖醇重量比是20:80至
40:60,例如约30:70。
[0070]
所述方法使用的水溶液的其它实施方式的达托霉素:(山梨糖醇+甘露糖醇)摩尔比可以是约1:4至约1:9,优选约1:5至约1:8.5,并且山梨糖醇:甘露糖醇重量比高于40:60至高达90:10,优选高于40:60至高达约80:20,更优选约50:50至约70:30,例如约50:50、约60:40或约70:30。
[0071]
在一些实施方式中,所述水溶液组合物可以基本上由以下组成(或由以下组成):达托霉素、山梨糖醇和甘露糖醇的组合、无菌水、任选的ph调节剂如氢氧化钠和/或盐酸,以及任选的缓冲剂如柠檬酸盐、组氨酸、磷酸盐、色氨酸、马来酸盐或碳酸盐中的一种或多种。此外,就此而言,所述水溶液组合物的一些实施方式包含缓冲剂,但优选实施方式基本上不含缓冲剂。
[0072]
优选地,所述水溶液组合物基本上不含糖和/或基本上不含除山梨糖醇和甘露糖醇以外的其它多元醇,在一些实施方式中,山梨糖醇和甘露糖醇是所述水溶液组合物中仅有的多元醇。
[0073]
将所述水溶液组合物干燥成所述固体组合物之后,所述方法还可以包括储存所述固体组合物(例如,方法200的步骤212)。例如,所述固体组合物可以在约25℃至约30℃的温度下储存约1个月至约24个月的时间段,或在约40℃的温度下储存约1周至约2周的时间段。例如,所述方法还可以包括将所述固体组合物在约25℃的温度下储存约6个月的时间段。所述储存可以包括暴露于光,并且此类光暴露可能基本上不改变本文公开的固体组合物的特性(例如,外观、重构时间、颜色、ph、达托霉素浓度和/或杂质)。
[0074]
储存之后,可以将所述固体组合物重构并且肠胃外施用。例如,所述固体组合物可以重构成达托霉素浓度为约25mg/ml至约200mg/ml的可肠胃外施用的药物产品。优选地,约500mg所述固体组合物在25℃下在约2分钟或更短时间内溶解在约10ml无菌水或抑菌水中,和/或约350mg所述固体组合物在25℃下在约1分钟或更短时间内溶解在约10ml无菌水或抑菌水中。
[0075]
本公开的另一个方面是一种固体组合物,所述固体组合物包含达托霉素以及山梨糖醇和甘露糖醇的组合;作为一个非限制性实例,通过任一种上文公开的方法获得的固体组合物。在一些实施方式中,所述固体组合物的水分含量可以占所述固体组合物的总重量的不超过约1.0%,优选占所述固体组合物的总重量的不超过约0.9%,更优选占所述固体组合物的总重量的不超过约0.8%,甚至更优选占所述固体组合物的总重量的不超过约0.7%,最优选占所述固体组合物的总重量的不超过约0.5%,例如占所述固体组合物的总重量的不超过约0.2%或占所述固体组合物的总重量的不超过约0.1%。
[0076]
优选地,所述固体组合物呈单位剂型,如冻干饼,并且所述单位剂型可以包含约350mg至约600mg达托霉素,优选约450mg至约550mg达托霉素,更优选约475mg至约525mg达托霉素,最优选约500mg达托霉素。
[0077]
在所述固体组合物的优选实施方式中,山梨糖醇占所述可药用固体组合物的总重量的约6.2重量%至约45.3重量%,甘露糖醇占所述可药用固体组合物的总重量的约3.1重量%至约47.5重量%。在这些实施方式中,山梨糖醇和甘露糖醇总计优选占所述可药用固体组合物的总重量的约31.0重量%至约59.4重量%。
[0078]
例如,所述固体组合物的一些实施方式的达托霉素:(山梨糖醇+甘露糖醇)摩尔比
可以是1:4至约1:13,优选约1:5至约1:13,并且山梨糖醇:甘露糖醇重量比是20:80至40:60、例如约30:70。在此类实施方式中,山梨糖醇优选占所述固体组合物的总重量的约6.2重量%至约22.1重量%,更优选占所述固体组合物的总重量的约9.3重量%至约22.1重量%;甘露糖醇优选占所述固体组合物的总重量的约18.6重量%至约47.5重量%,更优选占所述固体组合物的总重量的约18.6重量%至约41.6重量%。在这些实施方式中,山梨糖醇和甘露糖醇总计优选占所述固体组合物的总重量的约31.0重量%至约59.4重量%。
[0079]
作为另一个实例,所述固体组合物的其它实施方式的达托霉素:(山梨糖醇+甘露糖醇)摩尔比可以是约1:4至约1:9,优选约1:5至约1:8.5,并且山梨糖醇:甘露糖醇重量比高于40:60至高达90:10,优选高于40:60至高达约80:40,更优选约50:50至约70:30,例如约50:50、约60:40或约70:30。在此类实施方式中,山梨糖醇优选占所述固体组合物的总重量的约12.4重量%至约45.3重量%,更优选占所述固体组合物的总重量的约15.5重量%至约35.2重量%;甘露糖醇优选占所述固体组合物的总重量的约3.1重量%至约25.2重量%,更优选占所述固体组合物的总重量的约9.3重量%至约25.2重量%。在这些实施方式中,山梨糖醇和甘露糖醇总计优选占所述固体组合物的总重量的约31.0重量%至约50.3重量%。
[0080]
在一些实施方式中,所述固体组合物基本上由以下组成(或由以下组成):达托霉素、山梨糖醇和甘露糖醇的组合、残余无菌水、任选的ph调节剂如氢氧化钠和/或盐酸,以及任选的缓冲剂如柠檬酸盐、组氨酸、磷酸盐或色氨酸中的一种或多种。另外,就此而言,所述固体组合物的一些实施方式包含缓冲剂,但优选实施方式基本上不含除山梨糖醇和甘露糖醇以外的缓冲剂。
[0081]
优选地,所述固体组合物基本上不含糖和/或基本上不含除山梨糖醇和甘露糖醇以外的其它多元醇,在一些实施方式中,山梨糖醇和甘露糖醇是所述固体组合物中仅有的多元醇。
[0082]
本公开的另一个方面是一种治疗患有细菌感染的受试者的细菌感染的方法。所述方法包括向所述受试者施用有效量的任一种本文公开的组合物。所述方法可以包括施用前将本文公开的固体组合物中的一种重构,优选在可药用稀释剂如无菌水、无菌氯化钠或抑菌水中的一种或多种中重构。可以通过本文公开的方法和组合物治疗的细菌感染的非限制性实例包括由革兰氏阳性细菌例如金黄色葡萄球菌(staphylococcus aureus)、化脓性链球菌(streptococcus pyogenes)、无乳链球菌(streptococcus agalactiae)、停乳链球菌似马亚种(streptococcus dysgalactiae subsp.equisimilis)和粪肠球菌(enterococcus faecalis)引起的皮肤和皮肤结构感染以及血流感染。
[0083]
实施例
[0084]
以下非限制性实施例支持通过甘露糖醇和山梨糖醇的组合稳定达托霉素的构思。
[0085]
实施例1a
[0086]
研究检查了达托霉素浓度和添加赋形剂如甘露糖醇、山梨糖醇、乳糖和β-环糊精磺丁基醚(sbe-β-cd)对达托霉素稳定性的影响。就此而言,在各个时间,通过uplc测定制剂,其条件如图3所述。
[0087]
测试制品由具有525mg达托霉素冻干饼(ph 6.8)的10ml或20ml小瓶组成。api浓度和赋形剂因制剂而异。所述研究使用了山梨糖醇、甘露糖醇、乳糖和sbe-β-cd(即)(图5a)。将小瓶放在冷冻干燥器中并冻干。
[0088]
测定制剂b7、b8和b9的玻璃化转变温度。玻璃化转变温度分别为29℃、37℃和38℃。假设在25℃稳定性良好而在40℃稳定性不佳的原因是由于在40℃储存时样品高于玻璃化转变温度。因此,在5℃下1.5个月之后,将在5℃测试的样品移到30℃储存,以查看样品在30℃是否仍然稳定。30℃样品的稳定性与25℃样品相当。
[0089]
sbe-β-cd样品(b11-b13)在25℃仅2个月后d7增加了2%,因此在2个月后从研究中去除。在25℃最能降低杂质d7增加的制剂是制剂b7、b8和b9,其中制剂b7的d7仅增加了0.2%(图5b)。
[0090]
实施例1b
[0091]
研究检查了具有山梨糖醇和甘露糖醇的制剂,发现其tg'值极低,并且所述研究调查了冰冻干燥器中的产物温度,以确定可以在没有实质性稳定性损失的情况下进行冻干周期的速度。具体来说,将如前述实施例讨论的制剂b7(5%山梨糖醇、5%甘露糖醇)、b8(2.5%山梨糖醇、5%甘露糖醇)和b9(5%山梨糖醇、0%甘露糖醇)的样品(图5a)用5ml水重构并允许溶解。然后将样品冷冻干燥以进行产品温度操作。观察饼塌陷并拍摄图像。然后使用移液管与对大气压开放的小瓶,用5ml水重构样品。记录重构时间并在允准时拍摄图像。
[0092]
对于第一个产品温度操作(图6a),在5℃货架温度下装载产品并保持六十(60)分钟;然后为了冷冻,将货架温度以0.5℃/分钟渐变到-40℃并保持四(4)小时;然后为了升华干燥,施加100毫托真空,并将货架温度以0.5℃/分钟渐变到-5℃并保持,直到所有三种制剂的产品温度都达到约-5℃(约二十八(28)小时);然后为了额外干燥,将货架温度以0.5℃/分钟渐变到40℃并保持360分钟。
[0093]
在第一个产品温度操作(图6a)时确定的临界产品温度(即在大部分一次干燥过程中保持的产品温度)为-22.2℃(对于制剂b7)和-23.0℃(对于制剂b9)。当产品温度为约-22.5℃时,所有制剂都具有可接受的饼并且未见塌陷。对于制剂b7、b8和b9,重构时间分别为约2分钟、3分钟和4分钟。
[0094]
对于第二个产品温度操作(图6b),在5℃货架温度下装载产品并保持六十(60)分钟;然后为了冷冻,将货架温度以0.5℃/分钟渐变到-40℃并保持四(4)小时;然后为了依序进行升华干燥和额外干燥,施加100毫托真空,并将货架温度以0.5℃/分钟渐变到40℃并保持十七(17)小时。在40℃保持十七(17)小时结束前若干小时完成了升华干燥。
[0095]
对于制剂b7、b8和b9,在第二个产品温度操作(图6b)的升华干燥过程中确定的临界产品温度分别为-12.2℃、-14.1℃和-13.5℃。当产品温度为约-13℃时,所有制剂都具有可接受的饼并且未见塌陷。对于制剂b7、b8和b9,重构时间分别为约1.75分钟、4分钟和4分钟。
[0096]
对于第三个产品温度操作(图6c),在5℃货架温度下装载产品并保持六十(60)分钟;然后为了冷冻,将货架温度以0.5℃/分钟渐变到-40℃并保持四(4)小时;然后为了升华干燥,施加100毫托真空,并将货架温度以0.5℃/分钟渐变到-25℃并保持,直到所有三种制剂的产品温度都达到约-25℃(对于制剂b7和b8,约一百(100)小时);然后为了额外干燥,将货架温度以0.5℃/分钟渐变到40℃并保持360分钟。制剂b9比其它样品提前达到-25℃货架温度,因此比b7和b8更早完成升华干燥。
[0097]
对于制剂b7、b8和b9,在第三个临界产品温度操作(图6c)的一次干燥过程中确定的临界产品温度分别为-28.5℃、-28.4℃和-30.0℃。当产品温度为约-29℃时,所有制剂都
具有可接受的饼并且未见塌陷。对于制剂b7、b8和b9,重构时间分别为约1.75分钟、4分钟和4分钟。
[0098]
总之,基于一次干燥过程中的临界产品温度,即使当一次干燥期间的临界产品温度达到约-12℃时,产品外观上也没有差异。未见塌陷。
[0099]
实施例2
[0100]
研究制备了达托霉素/山梨糖醇/甘露糖醇开发稳定性单位并测试了冻干样品在储存中和重构后的稳定性。测试制品由具有不同ph和赋形剂浓度的达托霉素制剂组成。测试制品制剂示于图7中。将所述制剂填充到10ml小瓶中并冷冻干燥。将小瓶倒置储存在25℃、30℃和40℃。结果示于图8中。
[0101]
实施例3
[0102]
研究调查了不同水分含量对含有山梨糖醇和甘露糖醇的优选组合的冻干达托霉素制剂(制剂b7:105mg/ml达托霉素、5%山梨糖醇、5%甘露糖醇,ph 6.8)的稳定性的影响。选择二次干燥温度以获得稳定性所需的水分含量。
[0103]
具体来说,将山梨糖醇和甘露糖醇溶解在控制在5℃的夹套容器中的约250ml水中。在115分钟的时间段内将达托霉素溶解在所述溶液中(初始ph 4.26,6.1℃)。加入naoh,并用水使所述溶液达到500ml最终体积(最终ph 6.81,21.9℃)。过滤溶液,将小瓶填充5ml溶液并放在托盘中央。托盘的其余部分填充有用4.63ml水重构并允许溶解的安慰剂小瓶。将小瓶放在冷冻干燥器中并冻干。
[0104]
将样品分组为五个残留水分含量,关于稳定性,在25℃和30℃放置12个月。在各时间点,即初始时间点、一个月、两个月、三个月、六个月和十二个月,测量或进行重构、外观、ph和hplc测定。对在25℃和30℃储存12个月的样品进行了额外的水分分析。
[0105]
对于制剂表征,在时间零点和1个月测试间隔通过近红外光谱法(nir)分析达托霉素小瓶的水分含量。得自nir的平均水分含量结果示于图9的表格中。
[0106]
为了确定水分对稳定性的影响,在t0、在25℃储存1个月和12个月时通过卡尔费休滴定法(kf)测量水分结果。将t0和1个月储存时测试的达托霉素样品与通过nir确定的值进行比较(图10)。图11示出了测试中直至12个月的25℃稳定性数据。在冻干或重构的产品中不存在可见的外观问题。此外,在25℃下,在12个月的过程中,ph和重构时间没有显著变化。
[0107]
在较高的残留水分含量下,杂质d7的增加显著较高。总之,产品的残留水分应当控制在约1.0%或更低,以减少d7的形成。
[0108]
实施例4
[0109]
研究调查了具有不同的量的山梨糖醇、蔗糖和甘露糖醇以及ph变化的达托霉素制剂。具体来说,将测试制品和对照制品储存在25℃、30℃和40℃;然后在0、1、2、3和6个月时间时,使用5ml蒸馏水重构样品并进行测试。就此而言,在各个时间,通过uplc测定制剂,其条件如图3所述。各测试制品为含有105mg/ml达托霉素的溶液。赋形剂如图12和图13中的表格中所概述那样变化;除非图14中的表格中另外指明,否则将ph调节至6.8。
[0110]
为了测试稳定性,将对照制品和测试制品在25℃储存6个月。用5ml水重构制剂n1至n25,并测试相关物质。针对在25℃储存6个月的制剂样品n1至n25测量杂质d7。
[0111]
将在25℃储存一个月、两个月和三个月的所选结果示于图15中的表格中。将在25℃储存六个月的整组结果示于图16中的表格中;来自这个完整表格的所选结果示于图17中
的表格中(全部关于杂质d7)。在图15和图17中,制剂n11表示本发明的非限制性示例性实施方式并且以星号标识,制剂n21表示使用蔗糖而不含任何糖醇的对照制剂并且以加号标识。
[0112]
关于杂质d7在25℃在6个月内的变化,山梨糖醇的存在对于控制增长很重要。山梨糖醇/甘露糖醇混合物的性能优于单独的甘露糖醇或单独的山梨糖醇。如制剂n25可见,ph越高,杂质d7形成得越快,然而,该量仍低于含有100%甘露糖醇/山梨糖醇和高多元醇与药物比的制剂。与单独的任一种赋形剂相比,山梨糖醇和甘露糖醇的组合(刚好是异构多元醇)令人惊讶地得到了更佳的结果。
[0113]
影响冻干制剂的稳定性的另一个因素是赋形剂:药物比。如果赋形剂:药物水平过低,则不能提供足够的稳定性(制剂n5、n9、n13、n17)。如果赋形剂:药物水平过高,则它会影响玻璃化转变温度tg(制剂n12、n16、n20;参见图12),从而促进药物产品降解。玻璃化转变温度不是制剂稳定性的唯一指标,因为制剂n13和n17具有高tg,但在25℃下6个月后的总杂质增长了接近2%。
[0114]
总之,以105mg/ml达托霉素,使用1.3、5.0、8.5、13.0的赋形剂:药物摩尔比配制制剂n1至n20。山梨糖醇浓度水平为0%、30%、50%、70%和100%(相对于赋形剂的总量,其余为甘露糖醇)。将样品储存在25℃并在6个月内测试。用5ml水重构各样品并测试杂质。进行统计分析。就杂质d7而论,与单独的甘露糖醇或山梨糖醇相比,含甘露糖醇和山梨糖醇二者的制剂更好地稳定了达托霉素药物产品。影响冻干制剂的稳定性的另一个因素是赋形剂:药物比。如果赋形剂:药物比过低,则无法提供足够的稳定作用。如果赋形剂:药物比过高,则使玻璃化转变温度tg降低,由此促进了药物产品降解。
[0115]
图18的表格示出了来自实施例4的一些测试制品,所述实施例在25℃储存6个月后将杂质d7的增加限制为相对于储存开始时的量增加不超过约1.00%(例如n6、n8、n10、n11、n14和n15),该表格还示出了从这些测试制品合理内推从而同样在25℃储存6个月后将杂质d7的增加限制为增加不超过约1.00%的实施方式。所述表格包括针对干燥的饼计算的组分量(不包括水分,水分最多占约1.0重量%)。
[0116]
实施例5
[0117]
研究调查了三个批次的达托霉素制剂n11的18个月长期数据(25℃储存),所述制剂代表了本公开提供的实施方式,因为先前已经在前述实施例中研究了这种制剂。具体来说,各批次具有105mg/ml达托霉素、5%甘露糖醇和5%山梨糖醇的配方,将其填充到小瓶中并冻干(两种赋形剂的百分比都是以g/100ml溶液计,如本文前述定义)。将三个批次中每一批次的杂质d7和总杂质的平均值汇总在图19的表格中(两种杂质的量都是以%w/w计,如本文前述定义)。
[0118]
令人惊讶的是,结果证明达托霉素制剂n11的长期性能至少与上文已经讨论的短期研究中所见的相同或甚至更佳。例如,在图17中,相对于储存开始时的量,达托霉素制剂n11在25℃储存6个月后d7增长了0.27%,相比之下,对照物中增长了1.82%。如图19所示,相对于储存开始时的量,实施例5的三个批次经过前6个月的d7变化分别为0.21%、0.14%和0.16%。经过18个月的储存,相对于储存开始时的量,d7变化分别为0.50%、0.45%和0.44%。该数据表明,达托霉素制剂n11在保质期内有效地控制了产品中的杂质形成。
[0119]
对本文公开的本发明优选实施方式的各种改变和修改对于本领域技术人员来说将显而易见。此类改变和修改可以在不背离本发明主题的精神和范围和不削弱其预期优点
的情况下进行。因此,意在通过权利要求书覆盖此类变化和修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1