使用突变IDH抑制剂和BCL-2抑制剂的组合疗法
使用突变idh抑制剂和bcl-2抑制剂的组合疗法
1.本发明涉及用于治疗癌症的突变体异柠檬酸脱氢酶(idh)抑制剂和bcl-2抑制剂的组合疗法。
2.idh和idh2是催化异柠檬酸转化为α-酮戊二酸(α-kg)并将烟酰胺腺嘌呤二核苷酸磷酸(nadp
+
)还原为nadph的酶(megias-vericat j等人,blood lymph.cancer:targets and therapy 2019;9:19-32)。
3.idh1中的新生形(de novo)突变,例如在idh1氨基酸残基r132处,有助于几种类型的癌症中的肿瘤发生,包括实体瘤癌症和血液学恶性肿瘤(badur mg等人,cell reports 2018;25:1680)。idh1突变可以产生高水平的2-羟基戊二酸(2-hg),其抑制细胞分化,并且突变体idh1的抑制剂可以降低2-hg水平,这促进细胞分化(molenaar rj等人,oncogene 2018;37:1949-1960)。突变也发生在idh2中,例如在氨基酸残基r172、r140和r172处(yang h等人clin.cancer.res.2012;18:5562-5571;mondesir j等人,j.blood med.2016;7:171-180)。
4.例如,急性髓性白血病(aml)的特征在于各种各样的突变基因和包含随时间并且在疗法的选择压力下动态地进化的白血病前期和白血病克隆的多克隆基因组结构(bloomfield cd等人,blood revs.2018;32:416-425)。使用阿糖胞苷和蒽环类抗生素(“7+3”)的诱导化疗已经成为患有新诊断的aml的受试者的标准护理超过四十年。
5.近年来,美国食品和药物管理局批准了五种另外的药物用于治疗aml:米哚妥林、依那替尼(enasidenib)、cpx-351、吉姆单抗奥佐米星(gemtuzumab ozogamicin)(bloomfield cd等人,blood revs.2018;32:416-425)和艾伏尼布(ivosidenib)(megias-vericat j等人,blood lymph.cancer:targets and therapy 2019;9:19-32)。可以预期约60%-70%的患有aml的成人在适当的诱导疗法后达到完全缓解(cr)状态,并且可以预期超过25%的患有aml的成人(约45%的达到cr的那些)可以存活3年或更长时间,并且可以治愈。
6.然而,在7-14%的aml受试者中观察到idhl抗性突变,并且相关的高2-hg水平可以产生表观遗传超甲基化表型和分化阻断,导致白血病发生(megias-vericat j等人,blood lymph.cancer:targets and therapy 2019;9:19-3)。此外,在大约三分之一的aml受试者中观察到flt3激酶中的突变(lee hj等人,oncotarget 2018;9:924-936)。
7.因此,仍然需要替代的突变idh相关癌症疗法。
8.某些突变idh1和idh2抑制剂公开在wo 2018/111707 al中,包括本文定义为“化合物a”的化合物,其为突变idh1的共价抑制剂,其修饰变构结合袋中的单一半胱氨酸(cys269),快速使酶失活,并且选择性地抑制2-hg产生,而不影响α
‑‑
kg水平(wo 2018/111707 a1)。
9.本发明提供一种治疗癌症的方法,其包括向具有idh突变的人类癌症受试者施用治疗有效量的(a)式i的第一化合物:
[0010][0011]
其中:
[0012]
r1为-ch2ch(ch3)2、-ch2ch3、-ch2ch2och3或
–
ch
2-环丙基;
[0013]
r2为-ch3或-ch2ch3;且
[0014]
x为n或ch,
[0015]
或其药学上可接受的盐;以及
[0016]
(b)第二化合物,其为bcl-2抑制剂或其药学上可接受的盐。
[0017]
在一个实施方案中,idh突变为idh1突变或idh2突变。在另一个实施方案中,idh突变为idh1突变。在另一个实施方案中,idh1突变为idh1 r132突变。在另一个实施方案中,idh1突变为r132h、r132c、r132g、r132l或r132s。在另一个实施方案中,idh1 r132突变为r132h。在另一个实施方案中,idh1突变为r132c。在另一个实施方案中,idh1突变为r132g。在另一个实施方案中,idh1突变为r132l。在另一个实施方案中,idh1突变为r132s。
[0018]
在另一个实施方案中,idh突变为idh2突变。在另一个实施方案中,idh2突变为idh2 r140突变或idh2 r172突变。在另一个实施方案中,idh2突变为r140突变。在另一个实施方案中,r140突变为r140q、r140l或r140w。在另一个实施方案中,idh2突变为r172突变。在另一个实施方案中,r172突变为r172k、r172m、r172g、r172s或r172w。
[0019]
在本发明方法的一个实施方案中,在式i的第一化合物或其药学上可接受的盐中,x为n。
[0020]
在另一个实施方案中,在式i的第一化合物或其药学上可接受的盐中,x为n,r1为
–
ch
2-环丙基,且r2为-ch2ch3。在另一个实施方案中,在式i的第一化合物中,x为n,r1为
–
ch
2-环丙基,且r2为-ch2ch3。
[0021]
在另一个实施方案中,第一化合物为:
[0022]
7-[[(1s)-1-[4-[(1r)-2-环丙基-1-(4-丙-2-烯酰基哌嗪-1-基)乙基]苯基]乙基]氨基]-1-乙基-4h-嘧啶并[4,5-d][1,3]噁嗪-2-酮;
[0023]
7-[[(1s)-1-[4-[(1s)-2-环丙基-1-(4-丙-2-烯酰基哌嗪-1-基)乙基]苯基]乙基]氨基]-1-乙基-4h-嘧啶并[4,5-d][1,3]噁嗪-2-酮;或
[0024]
1-乙基-7-[[(1s)-1-[4-[1-(4-丙-2-烯酰基哌嗪-1-基)丙基]苯基]乙基]氨基]-4h-嘧啶并[4,5-d][1,3]噁嗪-2-酮;
[0025]
或其药学上可接受的盐。
[0026]
在另一个实施方案中,第一化合物为7-[[(1s)-1-[4-[(1s)-2-环丙基-1-(4-丙-2-烯酰基哌嗪-1-基)乙基]苯基]乙基]氨基]-1-乙基-4h-嘧啶并[4,5-d][1,3]噁嗪-2-酮。
[0027]
在另一个实施方案中,第一化合物为:
[0028][0029]
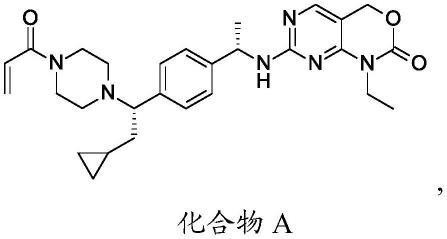
或其药学上可接受的盐。在另一个实施方案中,第一化合物为化合物a。
[0030]
在另一个实施方案中,受试者被鉴定为具有idh突变。在另一个实施方案中,受试者被鉴定为在组织中具有idh突变。在另一个实施方案中,受试者被鉴定为具有idh1突变。在另一个实施方案中,受试者被鉴定为具有idh2突变。
[0031]
在另一个实施方案中,受试者被鉴定为具有r132 idh1突变。在另一个实施方案中,受试者被鉴定为在组织中具有r132 idh1突变。在另一个实施方案中,受试者被鉴定为具有idh2突变,例如idh2 r172、r140或r172突变。在另一个实施方案中,受试者被鉴定为在组织中具有idh2 r172、r140或r172突变。
[0032]
在另一个实施方案中,所述癌症为血液学恶性肿瘤,并且受试者被鉴定为在血液、骨髓、淋巴结、淋巴液中具有idh突变(例如idh1 r132突变或idh2r172、r140或r172突变)。在另一个实施方案中,受试者被鉴定为在血细胞、骨髓细胞、淋巴结细胞或淋巴液细胞中具有idh突变(例如idh1 r132突变或idh2 r172、r140或r172突变)。
[0033]
在另一个实施方案中,所述癌症为实体瘤癌症,并且受试者被鉴定为在实体瘤组织中具有idh突变(例如idh1 r132突变或idh2 r172、r140或r172突变)。在另一个实施方案中,受试者被鉴定为在实体瘤组织细胞中具有idh突变(例如idh1 r132突变或idh2 r172、r140或r172突变)。
[0034]
在另一个实施方案中,第一化合物或其药学上可接受的盐在第二化合物或其药学上可接受的盐之前施用。
[0035]
在另一个实施方案中,第一化合物或其药学上可接受的盐在第二化合物或其药学上可接受的盐之后施用。
[0036]
在另一个实施方案中,第一化合物或其药学上可接受的盐与第二化合物或其药学上可接受的盐共同配制。
[0037]
在本发明方法的另一个实施方案中,所述癌症为实体瘤癌症。在另一个实施方案中,所述实体瘤癌症为胆管癌(cholangiocarcinoma)、头颈癌、软骨肉瘤、肝细胞癌、黑素瘤、胰腺癌、星形细胞瘤、少突神经胶质瘤、神经胶质瘤、成胶质细胞瘤、膀胱癌、结肠直肠癌、肺癌或鼻腔鼻窦未分化癌(sinonasal undifferentiated carcinoma)。在另一个实施方案中,肺癌为非小细胞肺癌。在另一个实施方案中,所述实体瘤癌症为胆管癌。
[0038]
在另一个实施方案中,所述癌症为血液学恶性肿瘤。在另一个实施方案中,所述血液学恶性肿瘤为急性髓性白血病(acute myeloid leukemia)、骨髓增生异常综合征骨髓增生性肿瘤、血管免疫母细胞性t-细胞淋巴瘤、t-细胞急性淋巴细胞白血病、真性红细胞增多症、原发性血小板增多症(essential thrombocythemia)、原发性骨髓纤维化或慢性髓性白血病(chronic myelogenous leukemia)。在另一个实施方案中,所述血液学恶性肿瘤为急
性髓性白血病。
[0039]
本发明还提供了式i的化合物:
[0040][0041]
其中:
[0042]
r1为ch2ch(ch3)2、-ch2ch3、-ch2ch2och3或
–
ch
2-环丙基;
[0043]
r2为-ch3或-ch2ch3;
[0044]
x为n或ch;或其药学上可接受的盐;
[0045]
用于与bcl-2抑制剂或其药学上可接受的盐组合以治疗在血细胞、骨髓细胞或血液和骨髓细胞中具有idh突变的人类受试者的癌症。
[0046]
在一个实施方案中,idh突变为idh1突变或idh2突变。在另一个实施方案中,idh突变为idh1突变。在另一个实施方案中,idh1突变为idh1 r132突变。在另一个实施方案中,idh1突变为r132h、r132c、r132g、r132l或r132s。在另一个实施方案中,idh1 r132突变为r132h。在另一个实施方案中,idh1突变为r132c。在另一个实施方案中,idh1突变为r132g。在另一个实施方案中,idh1突变为r132l。在另一个实施方案中,idh1突变为r132s。
[0047]
在另一个实施方案中,idh突变为idh2突变。在另一个实施方案中,idh2突变为idh2 r140突变或idh2 r172突变。在另一个实施方案中,idh2突变为r140突变。在另一个实施方案中,r140突变为r140q、r140l或r140w。在另一个实施方案中,idh2突变为r172突变。在另一个实施方案中,r172突变为r172k、r172m、r172g、r172s或r172w。
[0048]
在一个实施方案中,受试者被鉴定为具有idh突变(例如idh1 r132突变或idh2 r172、r140或r172突变)。
[0049]
在一个实施方案中,使用的化合物具有式i,其中x为n,或其药学上可接受的盐。在另一个实施方案中,使用的化合物为式i,其中r1为-ch
2-环丙基,或其药学上可接受的盐。在另一个实施方案中,使用的化合物为式i的化合物,其中r2为-ch2ch3,或其药学上可接受的盐。在另一个实施方案中,使用的化合物具有式i,其中x为n,r1为-ch
2-环丙基,并且r2为-ch2ch3,或其药学上可接受的盐。在另一个实施方案中,所述化合物具有式i,其中x为n,r1为-ch2h-环丙基,并且r2为-ch2ch3。
[0050]
在另一个实施方案中,所述化合物为:
[0051]
7-[[(1s)-1-[4-[(1r)-2-环丙基-1-(4-丙-2-烯酰基哌嗪-1-基)乙基]苯基]乙基]氨基]-1-乙基-4h-嘧啶并[4,5-d][1,3]噁嗪-2-酮;
[0052]
7-[[(1s)-1-[4-[(1s)-2-环丙基-1-(4-丙-2-烯酰基哌嗪-1-基)乙基]苯基]乙基]氨基]-1-乙基-4h-嘧啶并[4,5-d][1,3]噁嗪-2-酮;或
[0053]
1-乙基-7-[[(1s)-1-[4-[1-(4-丙-2-烯酰基哌嗪-1-基)丙基]苯基]乙基]氨基]-4h-嘧啶并[4,5-d][1,3]噁嗪-2-酮;
[0054]
或其药学上可接受的盐。
[0055]
在另一个实施方案中,所述化合物为7-[[(1s)-1-[4-[(1s)-2-环丙基-1-(4-丙-2-烯酰基哌嗪-1-基)乙基]苯基]乙基]氨基]-1-乙基-4h-嘧啶并[4,5-d][1,3]噁嗪-2-酮
或其药学上可接受的盐。
[0056]
在另一个实施方案中,所述化合物为:
[0057][0058]
(化合物a)或其药学上可接受的盐。
[0059]
在另一个实施方案中,所述化合物为化合物a。
[0060]
本文提供了使用式i的化合物和bcl-2抑制剂的组合来治疗癌症的新方法。因此,本发明的一些方面提供了式i的化合物,其用于与bcl-2抑制剂同时、分开或依次组合用于治疗癌症。另外,本发明的一些方面提供了式i的化合物,其用于与bcl-2抑制剂同时、分开或依次组合用于治疗实体瘤癌症。此外,本发明的一些方面提供了式i的化合物,其用于与bcl-2抑制剂同时、分开或依次组合用于治疗血液学恶性肿瘤。
[0061]
本发明还提供了包含式i的化合物的药物组合物,其用于治疗在血细胞、骨髓细胞、淋巴结或淋巴液中具有idh突变的人类受试者的癌症。
[0062]
在一个实施方案中,idh突变为idh1突变或idh2突变。在另一个实施方案中,idh突变为idh1突变。在另一个实施方案中,idh1突变为idh1 r132突变。在另一个实施方案中,idh1突变为r132h、r132c、r132g、r132l或r132s。在另一个实施方案中,idh1 r132突变为r132h。在另一个实施方案中,idh1突变为r132c。在另一个实施方案中,idh1突变为r132g。在另一个实施方案中,idh1突变为r132l。在另一个实施方案中,idh1突变为r132s。
[0063]
在另一个实施方案中,idh突变为idh2突变。在另一个实施方案中,idh2突变为idh2 r140突变或idh2 r172突变。在另一个实施方案中,idh2突变为r140突变。在另一个实施方案中,r140突变为r140q、r140l或r140w。在另一个实施方案中,idh2突变为r172突变。在另一个实施方案中,r172突变为r172k、r172m、r172g、r172s或r172w。
[0064]
本发明还提供了式i的化合物在制备用于治疗人类受试者的癌症的药物中的用途,所述人受试者被鉴定为在血液、骨髓、淋巴结、淋巴液、血细胞、骨髓细胞、淋巴结细胞或淋巴液细胞中具有idh突变(例如idh1r132突变或idh2r172、r140或r172突变)。、
[0065]
在本发明的方法的一个实施方案中,所述癌症为一线(frontline)癌症。在另一个实施方案中,所述一线癌症为实体瘤癌症。在另一个实施方案中,所述一线癌症为血液学恶性肿瘤。在另一个实施方案中,所述一线血液学恶性肿瘤为一线aml。
[0066]
在本发明方法的另一个实施方案中,所述癌症为复发性癌症。在另一个实施方案中,所述复发性癌症为实体瘤癌症。在另一个实施方案中,所述复发性癌症为血液学恶性肿瘤。在另一个实施方案中,所述复发性血液学恶性肿瘤为复发性aml。
[0067]
在本发明的方法的另一个实施方案中,所述癌症为难治性癌症。在另一个实施方案中,所述难治性癌症为实体瘤癌症。在另一个实施方案中,所述难治性癌症为血液学恶性肿瘤。在另一个实施方案中,所述难治性血液学恶性肿瘤为难治性aml。
[0068]
在本发明的方法的另一个实施方案中,所述癌症为晚期癌症。在另一个实施方案中,所述晚期癌症为晚期实体瘤癌症。在另一个实施方案中,所述晚期癌症为晚期血液学恶
性肿瘤。在另一个实施方案中,所述晚期血液学恶性肿瘤为晚期aml。
[0069]
在另一个实施方案中,aml为急性早幼粒细胞白血病。
[0070]
在本发明的方法的一个实施方案中,bcl-2抑制剂为维奈托克(venetoclax)、奥巴克拉(obatoclax)、纳维托克(navitoclax)或它们中任一种的药学上可接受的盐。在另一个实施方案中,bcl-2抑制剂为维奈托克或其药学上可接受的盐。在另一个实施方案中,bcl-2抑制剂为维奈托克。
[0071]
本发明还提供了鉴定用于使用以下治疗的人类受试者的方法:
[0072]
(a)式i的第一化合物:
[0073][0074]
其中
[0075]
r1为-ch2ch(ch3)2、-ch2ch3、-ch2ch2och3或
–
ch
2-环丙基;
[0076]
r2为-ch3或-ch2ch3;且
[0077]
x为n或ch,
[0078]
或其药学上可接受的盐;和
[0079]
(b)第二化合物,其为bcl-2抑制剂或其药学上可接受的盐,
[0080]
该方法包括鉴定患有癌症的人类受试者并确定所述人类受试者是否在血液、骨髓、淋巴结、淋巴液、血细胞、骨髓细胞、淋巴结细胞、淋巴液细胞或实体组织中具有idh突变,其中所述受试者患有癌症。
[0081]
在一个实施方案中,idh突变为idh1突变或idh2突变。在另一个实施方案中,idh突变为idh1突变。在另一个实施方案中,idh1突变为idh1 r132突变。在另一个实施方案中,idh1突变为r132h、r132c、r132g、r132l或r132s。在另一个实施方案中,idh1 r132突变为r132h。在另一个实施方案中,idh1突变为r132c。在另一个实施方案中,idh1突变为r132g。在另一个实施方案中,idh1突变为r132l。在另一个实施方案中,idh1突变为r132s。
[0082]
在另一个实施方案中,idh突变为idh2突变。在另一个实施方案中,idh2突变为idh2 r140突变或idh2 r172突变。在另一个实施方案中,idh2突变为r140突变。在另一个实施方案中,r140突变为r140q、r140l或r140w。在另一个实施方案中,idh2突变为r172突变。在另一个实施方案中,r172突变为r172k、r172m、r172g、r172s或r172w。
[0083]
在鉴定用于治疗的人癌症受试者的本发明方法的一个实施方案中,在式i的第一化合物或其药学上可接受的盐中,x为n。在另一个实施方案中,在式i的第一化合物或其药学上可接受的盐中,x为n,r1为-ch
2-环丙基,且r2为-ch2ch3。在另一个实施方案中,在第一化合物中,x为n,r1为
–
ch
2-环丙基,且r2为-ch2ch3。
[0084]
在鉴定用于治疗的人类癌症受试者的方法的另一个实施方案中,第一化合物为:
[0085]
7-[[(1s)-1-[4-[(1r)-2-环丙基-1-(4-丙-2-烯酰基哌嗪-1-基)乙基]苯基]乙基]氨基]-1-乙基-4h-嘧啶并[4,5-d][1,3]噁嗪-2-酮;
[0086]
7-[[(1s)-1-[4-[(1s)-2-环丙基-1-(4-丙-2-烯酰基哌嗪-1-基)乙基]苯基]乙
基]氨基]-1-乙基-4h-嘧啶并[4,5-d][1,3]噁嗪-2-酮;或
[0087]
1-乙基-7-[[(1s)-1-[4-[1-(4-丙-2-烯酰基哌嗪-1-基)丙基]苯基]乙基]氨基]-4h-嘧啶并[4,5-d][1,3]噁嗪-2-酮;
[0088]
或其药学上可接受的盐。
[0089]
在另一个实施方案中,第一化合物为7-[[(1s)-1-[4-[(1s)-2-环丙基-1-(4-丙-2-烯酰基哌嗪-1-基)乙基]苯基]乙基]氨基]-1-乙基-4h-嘧啶并[4,5-d][1,3]噁嗪-2-酮。
[0090]
在另一个实施方案中,第一化合物为:
[0091][0092]
(化合物a)或其药学上可接受的盐。在另一个实施方案中,第一化合物为化合物a。
[0093]
用于测定突变体idh1和idh2酶活性的方法是本领域普通技术人员已知的,例如在wo 2018/111707 a1中。
[0094]
如上文所用,并且在贯穿于本发明的描述中,除非另有说明,否则以下术语应理解为具有如下含义:
[0095]
术语“血液学组织”是指血液、骨髓、脾、淋巴结或淋巴液。
[0096]
术语“实体瘤组织”是指不是血液学组织的组织。实体组织的非限制性实例为胆管组织、胰腺组织、头部组织、颈部组织、肝组织、皮肤组织、星形细胞瘤组织、少突胶质(oligodendroglial)组织、神经胶质组织、脑组织、膀胱组织、结肠直肠组织和肺组织。
[0097]
如本文所用,“bcl-2抑制剂”是结合bcl-2并导致癌细胞中的细胞毒性、癌细胞中bcl-2表达的下调、癌细胞中的线粒体功能障碍和癌细胞中的细胞凋亡中的一种或多种的化合物。用于确定那些效应的方法是本领域普通技术人员已知的,例如在wen m等人,front.pharmacol.2019;10:3912中。
[0098]
术语“突变体idh抑制剂”是指化合物,其抑制突变体idh酶(例如突变体idh1酶或突变体idh2酶)活性,和/或抑制突变体idh酶(例如突变体idh1酶或突变体idh2酶)的2-hg生成。用于测定突变体idh1和突变体idh2酶活性的方法是本领域普通技术人员已知的,例如在wo 2018/111707 a1中。在术语“突变体idh抑制剂”中,词语“突变体”是指idh基因,而不是抑制剂。
[0099]
术语“实体瘤癌症”意指起源于非血液或骨髓的组织中的癌症。
[0100]
术语“血液学恶性肿瘤”涉及血液、骨髓、淋巴结或淋巴液中的癌症。
[0101]
术语“一线癌症”意指人类癌症受试者从未针对所治疗的癌症进行治疗。
[0102]
术语“难治性癌症”是指已经治疗、但人类癌症受试者对治疗无反应的癌症。
[0103]
术语“复发性癌症”是指人类癌症受试者对治疗有反应一段时间期限,但该癌症已复发。
[0104]
术语“晚期癌症”是指已经扩散到淋巴结或扩散到癌症起源点之外的其他组织的癌症。例如,aml是已经扩散到血液或骨髓外的组织的aml。
[0105]
术语“癌症受试者”是指已被诊断患有癌症的受试者。
[0106]
术语“实体瘤受试者”是指已被诊断患有实体瘤癌症的受试者。在一个实施方案中,实体瘤癌症为胆管癌。
[0107]
术语“血液学恶性肿瘤受试者”是指已被诊断患有血液学恶性肿瘤的受试者。在一个实施方案中,血液学恶性肿瘤受试者为aml受试者。术语“aml受试者”是指已被诊断患有aml的受试者。用于诊断aml的方法是本领域普通技术人员已知的,例如在dohner h等人,blood 2017;129:424-447中。
[0108]
术语“急性髓性白血病(acute myeloid leukemia)”、“急性髓性白血病(acute myelogenous leukemia)”和“急性非淋巴细胞白血病”是同义的。
[0109]“对血液学恶性肿瘤(例如aml)治疗的反应性”包括改善的总体存活、部分反应、长期稳定疾病,或长期存活的改善,特征在于完全缓解(通过如下确定:骨髓中小于5%的成髓细胞、不存在循环母细胞)、血液学恢复(根据外周血绝对中性粒细胞计数大于1,000个细胞/μl和血小板计数大于100,000/μl证明,不需要红细胞输注,并且不存在髓外疾病)(bloomfield cd等人,blood revs.2018;32:416-425)。
[0110]
术语“idh1 r132突变”与“r132 idh1突变”同义,并且是指受试者的idh1基因中氨基酸残基132处的idh1突变,如例如在受试者的核酸(例如dna)中确定的。
[0111]
术语“鉴定为具有idh突变”意指已经分析了来自人类受试者的组织或细胞的核酸(例如dna)以确定人类受试者是否具有idh突变(例如idh1 r132突变、idh2 r140突变或idh2 r172突变)。在一个实施方案中,已经分析了人类受试者的血液、血细胞、骨髓、骨髓细胞、淋巴结、淋巴结细胞、淋巴液或淋巴液细胞的idh突变。在另一个实施方案中,已经分析了人类受试者的实体组织的idh突变。在另一个实施方案中,已经分析了人类受试者的实体组织的idh突变。
[0112]
在本发明的方法中,将人受试者鉴定为具有idh突变(例如idh1 r132突变、idh2 r140突变或idh2 r172突变)的一方可以与施用第一和第二化合物的一方不同。在一个实施方案中,将人受试者鉴定为具有idh突变(例如idh1 r132突变、idh2 r140突变或idh2 r172突变)的一方与施用第一和第二化合物的一方不同。
[0113]
用于鉴定基因突变的分析方法是本领域普通技术人员已知的(clark,o.等人,clin.cancer.res.2016;22:1837-42),包括但不限于核型分析(karyotyping)(guller jl等人,j.mol.diagn.2010;12:3-16)、荧光原位杂交(yeung dt等人,pathology 2011;43:566-579)、sanger测序(lutha,r等人,haematologica 2014;99:465-473)、代谢谱(miyata s等人,scientific reports 2019;9:9787)、聚合酶链式反应(ziai,jm和aj siddon,am.j.clin.pathol 2015;144:539-554)和下一代测序(例如全转录组(transcriptome)测序)(lutha,r等人,haematologica 2014;99:465-473;wang h-y等人,j.exp.clin.cancer res.2016;35:86)。
[0114]
术语“与......组合”意指在癌症的治疗中使用式i的化合物或式i的化合物用于与bcl-2抑制剂同时、分开或依次组合使用。
[0115]
术语“治疗(treatment)”、“治疗(treat)”、“治疗(treating)”等意在包括减缓、停止或逆转癌症的进展。这些术语还包括缓解、改善、减弱、消除或减少病症或病况的一种或多种症状,即使癌症实际上没有得到消除并且即使癌症的进展本身没有得到减缓、停止或
逆转。
[0116]“治疗有效量”是指施用于受试者的化合物或其药学上可接受的盐的量,其将引起受试者的生物或医学反应或对受试者的期望的治疗效果。作为本领域技术人员,主治医师可以通过使用已知技术并通过观察在类似情况下获得的结果容易地确定治疗有效量。在确定受试者的有效量时,主治医师考虑许多因素,包括但不限于:个体受试者的体型、年龄和一般健康状况;所涉及的特定疾病或病症;疾病或病症的涉及程度或严重程度;个体受试者的反应;所施用的具体化合物;施用方式;施用的制剂的生物利用度特征;所选择的剂量方案;使用的伴随药物;以及其他相关情况。
[0117]
本文的式i化合物可以任选地配制成药物组合物,其通过使化合物生物可利用的任何途径施用,包括口服、静脉内和透皮途径。优选将此类组合物配制用于口服施用。此类药物组合物及其制备方法是本领域众所周知的。(参见例如remington:the science and practice of pharmacy(d.b.troy,editor,第21版,lippincott,williams&wilkins,2006)。
[0118]“药学上可接受的载体、稀释剂或赋形剂”为本领域通常接受的、用于将生物活性剂递送至哺乳动物(例如人)的介质。
[0119]
本领域普通技术人员将理解,在本发明的方法中施用的化合物能够成盐。化合物与许多无机酸和有机酸中的任一种反应以形成药学上可接受的酸加成盐。此类药学上可接受的酸加成盐和制备它们的常用方法为本领域众所周知的。参见例如p.stahl等人,handbook of pharmaceutical salts:properties,selection and use,(vcha/wiley-vch,2008)。
[0120]“药学上可接受的盐”或“可药用盐”是指本发明化合物的相对无毒性的一种或多种无机或有机盐(s.m.berge等人,“pharmaceutical salts”,journal of pharmaceutical sciences,第66卷,第1期,1977年1月)。
[0121]
材料和方法
[0122]
2-hg抑制测定
[0123]
细胞系构建:molm14野生型人白血病细胞和molm14_r132构建体细胞系通过使用idh1 wt(脱氧土霉素诱导型)pslik-idh1-flag(addgene plasmid#66802)和idh1 r132h(脱氧土霉素诱导型)pslik-idh1-r132h-flag(addgene plasmid#66803)、通过慢病毒转染molm14细胞产生,并且由jean-emmanuel sarry博士(centre de recherches en canc
é
rologie de toulouse,umr1037,inserm,universit
é
de toulouse 3paul sabatier,toulouse,france;biorxiv 749580;doi.org/10.1101/749580)友情提供。将molm14-wt和molm14-r132突变体细胞接种在6孔板(1x106/孔)中的5ml含有10%fbs(sigma)和1x青霉素/链霉素(sigma)的完全rpmi培养基中。在用2μg/ml脱氧土霉素诱导后,将细胞在37℃下孵育4天。
[0124]
将细胞以1ml接种在12孔板(100,000个细胞/孔)中,一式三份。用2μg/ml脱氧土霉素处理细胞以诱导idh1表达,然后用dmso、0.1或1μm化合物a处理,并在37℃下孵育4天。
[0125]
收集65μl培养基并离心,收集60μl上清液培养基并在-80℃下冷冻。
[0126]
lcms 2-hg代谢物分析:通过细胞培养上清液的液相色谱-质谱(lc-ms)分析,确定idh1抑制对总2-hg和(α-kg)浓度的影响。通过将2-hg和α-kg掺入细胞培养基中来制备校准
曲线。该方法在通过lc-ms分析之前利用o-苄基羟胺的衍生化。将10微升每种标准品或样品置于深孔96-孔板中,并与100μl含有10μm d5-2-羟基戊二酸和10μm d6-α-kg的内标溶液合并。向每个样品中加入50μl 1m o-苄基羟胺的吡啶缓冲液溶液(8.6%吡啶,ph 5)和50μl 1m n-(3-二甲基氨基丙基)-n-乙基碳二亚胺盐酸盐(edc)的吡啶缓冲液溶液。衍生化反应在室温下进行1小时。使用beckman biomek fx液体处理器,向每个样品中加入300μl乙酸乙酯。将板密封并涡旋5分钟,然后在eppendorf 5810r离心机上以4000rpm的速度离心5分钟。将220μl上层转移到新的96-孔板中。将样品在50℃下在加热氮气下干燥,并用100μl甲醇/水(1:1)重构。将1微升衍生化样品注射到由shimadzu prominence 20a hplc系统和thermo quantum ultra
tm
三重四极质谱仪组成的lc-ms系统上。在water xbridge
tm
c18柱(2.1x50mm,3.5μm)上以0.6ml/分钟的流速分离分析物。流动相a是0.1%甲酸水溶液,流动相b是甲醇。梯度曲线为:0分钟,5%b;2分钟,100%b;4.00分钟,100%b;4.1分钟,5%b;5.50分钟,停止。质谱仪利用以正离子选择反应监测模式操作的hesi-ii探头。通过绘制分析物浓度对分析物/内标峰面积比并使用1/浓度加权、用xcalibur
tm
软件进行数据的二次拟合来构建校准曲线。未知物的分析物浓度根据校准曲线反向计算。
[0127]
在基本上如上所述进行的实验中,获得了表1中的结果。
[0128][0129]
表1中的结果表明,在molm14_r132细胞系构建体中,化合物a抑制突变体ldh1的2-hg产生。
[0130]
细胞活力测定
[0131]
用2μg/ml脱氧土霉素处理molm14野生型和molm14_r132细胞,以诱导idh1wt和idh1-r132h的表达,然后在37℃下孵育4天。将细胞以10,000个细胞/孔接种在4个(12孔)板中的含有2ug/ml脱氧土霉素的1ml生长培养基中。
[0132]
如下所述用dmso(一式三份)或用0、125、250、500、1000nm的化合物a(各自一式三份)处理细胞:在上述初始诱导后,加入0.5ml含有1x脱氧土霉素加1x化合物a或dmso的培养基并孵育3天。3天后,再加入0.5ml等份的含有1x脱氧土霉素加1x化合物a或dmso的新鲜培养基,并再孵育3天。然后将维奈托克(0、25、50、100、200nm)作为单一活性剂或与1x化合物a组合加入。两天后,将细胞收集在流式细胞术过滤管中,并进行处理用于流式细胞术。用膜联蛋白v结合缓冲液(abb,2ml)[1m hepes缓冲液(10ml)、5m nacl(28ml)、1m cacl2(5ml)、h2o(957ml)]洗涤细胞,然后以1500rpm离心5min。将细胞用abb(50μl)、apc膜联蛋白v抗体(1μl,biolegend目录号640941)染色,并在黑暗中保持20分钟。用abb(2ml)洗涤细胞,并以1500rpm离心5min。将dapi(invitrogen目录号d3571)和计数珠(invitrogen目录号c36950)添加到膜联蛋白v结合缓冲液[dapi(5μl,2μg/ml)+计数珠(5μl(520,000个珠/50μl))+abb(150μl)]中,总体积160μl/管,然后用gallios流式细胞仪(beckman coulter)分析。当计数珠达到每个样品250个珠时,停止细胞收集。kalusa软件用于分析。门控膜联蛋白v阴性/
dapi阴性细胞的百分比构成%活细胞,而膜联蛋白v-阳性细胞的百分比构成%凋亡。
[0133]
在基本上如上所述进行的实验中,得到表2a-2c和3中的结果。
[0134][0135][0136]
表2a-2c中的结果表明,相对于用任一化合物单独处理的细胞的白血病细胞活力水平,维奈托克和化合物a的组合导致白血病细胞活力进一步降低。
[0137][0138]
表3中的结果表明,相对于用任一化合物单独处理的细胞的细胞凋亡水平,维奈托克和化合物a的组合导致白血病细胞中的细胞凋亡水平增加。
[0139]
aml-pdx模型
[0140]
用250cgy照射雄性nsg小鼠(6-9周龄,the jackson laboratory),并且在第二天,静脉内注射aml-pdx(1x106细胞/100μl)。通过眶后(retro-orbital)途径收集外周血并进行处理以通过流式细胞术测量hcd45+细胞,以证实白血病的建立。
[0141]
当白血病移植物植入达到超过1%时,将小鼠随机分组接受媒介物、化合物a(10mg/kg,每日口服管饲)、维奈托克(0mg/kg,口服管饲2周和停1周(2周期))或维奈托克(50mg/kg,口服管饲2周,停1周(2个周期))和化合物a(10mg/kg,每日口服管饲)的组合的治疗。基于对治疗6周后残留疾病水平的评估,可以在上述2个周期之外使用额外的给药。
[0142]
通过眶后途径每两周一次收集外周血,并进行处理以通过流式细胞术测量白血病负荷(%hcd33+/hcd45+细胞),并测量分化(%hcd14+细胞占总hcd45+细胞的百分比))。每管添加65μl染色/洗涤缓冲液(dpbs中的5%热灭活(hi)-fbs),通过移液管上下3至4次混合,并将100μl血液悬浮液转移到5ml聚丙烯管中。根据制造商的说明书添加染色剂(抗-人cd33-apc(bd biosciences目录号551378)、抗-人cd14-pe-cy7(bd biosciences目录号557742)、抗-人cd45-apc-cy7(bd biosciences目录号557833)。将样品在室温下避光孵育30分钟。孵育后,向每个样品中加入1.5ml 1x bd裂解/固定(bd lyse/fix)缓冲液(37℃,(bd#558049))并在室温下孵育12分钟。然后将管在1500rpmi下离心5分钟。抽吸bd裂解/固定溶液,并用染色/洗涤缓冲液洗涤细胞沉淀2次。然后将固定的细胞重悬于200μl染色/洗涤缓冲液中,然后转移到过滤流量管中。使用标准流式细胞术原理和技术在gallios流式细胞仪(beckman,texas)上分析样品。在flow jo软件中进行群体门控和群体百分比的数据分析。
[0143]
在基本上如上所述进行的实验中,获得了表4和5中的结果。.
[0144][0145]
nd:未测定(6周治疗后采集的数据)
[0146][0147]
nd:未测定(6周治疗后采集的数据)
[0148]
表4和表5中的结果表明,即使维奈托克和化合物a的组合不会导致aml细胞分化水
平增加,相对于单独使用任一化合物获得的白血病负荷,该组合确实导致较低的白血病负荷,并且降低的白血病负荷是相关的临床终点。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1