使用同种异体肿瘤特异性CD4+T细胞输注的癌症免疫疗法
使用同种异体肿瘤特异性cd4+t细胞输注的癌症免疫疗法
1.相关申请的交叉引用
2.本技术根据35u.s.c.
§
119(e)要求2020年2月10日提交的美国专利申请第16/786,761号的优先权的权益,该申请是2018年3月28日提交的美国申请序列号15/939,059的部分继续申请,该部分继续申请是2014年11月3日提交的美国申请序列号14/398,724的继续申请,现作为美国专利第9,931,359号颁发;该继续申请是2013年3月15日提交的国际申请第pct/us2013/032129号的35usc
§
371国家阶段申请,现已过期;该国家阶段申请根据35usc
§
119(e)要求2012年5月8日提交的美国申请序列号61/644,126的权益,该美国申请现已过期。每一个在先申请的公开内容被认为是本技术的公开内容的一部分并通过引用并入本技术的公开内容。
3.关于联邦赞助研究或开发的声明
4.本发明根据由美国国立卫生研究院(national institute of health)授予的ca105148和ca015396在美国政府支持下进行。美国政府在本发明中具有某些权利。
5.序列列表的并入
6.随附序列表中的材料特此通过引用并入本技术。随附的序列表文本文件名为jhu3680_3wo_sequence_listing.txt,创建于2021年2月8日,并且为12kb。可以在使用windows os的计算机上使用microsoft word评估该文件。
发明领域
7.本发明总体上涉及免疫学,并且更具体地,涉及包含同种异体淋巴细胞来治疗癌症的方法和组合物。
8.背景信息
9.宿主的免疫系统提供了快速和特异性地对病原微生物产生保护性应答并且也有助于恶性肿瘤的排斥的手段。免疫应答通常被描述为包括体液应答以及细胞介导的应答,体液应答中抗原特异性抗体由分化的b淋巴细胞产生,细胞介导的应答中各种类型的t淋巴细胞通过多种机制消除抗原。例如,能够识别特异性抗原的cd4(也称为cd4+)辅助性t细胞可以通过释放可溶性介质诸如细胞因子募集免疫系统的另外的细胞参与免疫应答来响应。cd8(也称为cd8+)细胞毒性t细胞也能够识别特异性抗原,并可以结合和破坏或损伤携带抗原的细胞或颗粒。特别地,包括细胞毒性t淋巴细胞(ctl)应答的细胞介导的免疫应答对于消除肿瘤细胞和被微生物(诸如病毒、细菌或寄生虫)感染的细胞可能是重要的。
10.癌症包括广泛范围的疾病,并影响全世界大约四分之一的人。ctl应答是有效的癌症疫苗的一个关键特征;有效的cd4 t细胞辅助对维持cd8t细胞的细胞毒活性起着至关重要的作用,并且从而提供临床益处。
11.关于微生物感染,疟疾、结核病、hiv-aids和其他病毒感染(诸如爱泼斯坦-巴尔病毒、乙型和丙型肝炎病毒、单纯疱疹病毒感染(hsv)和人乳头瘤病毒(hpv)),继续加剧全球健康问题。据估计,病毒引起所有人类癌症中的大约15%。人乳头瘤病毒,包括致癌和非致癌血清型两者,是世界上最常见的性传播的感染。虽然大多数有免疫能力的个体消除该病
毒,但一部分健康个体未能消除hpv的致癌毒株,这些毒株随后在上皮细胞中持续存在,并可诱导恶性转化。
12.新出现的证据表明,癌症在淋巴细胞中诱导一种对由癌症独特表达的抗原具有特异性的无应答状态。然而,这种无应答应该能够被逆转。几种人类肿瘤被cd8+t细胞浸润,并且cd8+t细胞浸润的程度通常与不存在转移和提高存活相关。然而,由于肿瘤特异性cd4+t细胞的功能麻痹,这些cd8+t细胞可能不消除癌症。
13.免疫检查点抑制剂(ci),包括伊匹单抗、纳武单抗和派姆单抗,已成功地用于多种癌症的治疗,确凿地确定了免疫系统的t细胞可引起肿瘤消退,导致延长的存活期和提高的生活质量。然而,任何癌症免疫疗法的成功都可能受到t细胞耗竭的限制,t细胞耗竭是以肿瘤特异性t细胞的增殖、细胞因子分泌和杀伤能力受损为特征的现象。因此,对开发在抗癌免疫疗法中逆转t细胞耗竭的策略存在显著的感兴趣。
14.最近的证据表明,ci不能逆转t细胞耗竭。相反,同种异体细胞治疗,特别是输注来自主要组织相容性复合体(mhc)错配供者的cd4+t细胞,被发现能够诱导甚至对免疫检查点阻断具有抗性的进展期癌症的消退,即使最终排斥供者细胞。耗尽来自供者淋巴细胞的cd8+细胞消除了持续供者细胞植入和致命移植物抗宿主病(gvhd)的风险,而不损害输注的抗肿瘤效力。当供者和接受者彼此mhc半相合(haploidentical)时(如父母对于孩子,或反之亦然),供者针对人乳头瘤病毒(hpv)血清型16的e7抗原(hpv16)的疫苗接种增强了cd8耗尽的非植入供者淋巴细胞输注(nedli)对tc-1(一种表达e7的肺癌)的抗肿瘤效力。来自e7初免供者的nedli的抗肿瘤效力可以增强,并且可以通过在输注之前与来自hpv16的e7的肽脉冲的宿主或供者来源的树突状细胞一起培养的初免的细胞来治愈接受者。通过e7初免的nedli治愈进展期tc-1肿瘤的小鼠没有供者嵌合的迹象,但含有扩增的宿主来源的e7特异性记忆cd4+t细胞和cd8+t细胞的群体,指示抗肿瘤免疫已通过nedli被印记接受者上。这些结果表明,病毒诱导的肿瘤可以通过输注来自针对病毒抗原进行疫苗接种的部分或完全hla匹配的供者的淋巴细胞来治疗,并表明通过给予来自针对肿瘤新生抗原进行疫苗接种的供者的淋巴细胞来治疗散发性肿瘤是可能的。
15.此外,通过nedli治愈tc-1的小鼠抵抗了相同肿瘤的挑战,并且来自治愈动物的脾细胞将抗肿瘤免疫转移到携带tc-1、mhc半相合的接受者。针对肿瘤特异性抗原对健康供者进行疫苗接种,并随后将疫苗接种的供者的淋巴细胞与源自肿瘤特异性抗原的肽一起培养,可以显著增强将非植入供者淋巴细胞输注到具有表达抗原的肿瘤的同种异体接受者中的抗肿瘤效应。
16.发明概述
17.本发明基于一项开创性的发现,即即使供者细胞不在接受者中长期植入,输注含有cd4+t细胞的同种异体淋巴细胞可以打破宿主抗肿瘤cd8+t细胞的耐受;并且输注同种异体反应性和新生抗原特异性cd4+t细胞可以逆转内源性、肿瘤特异性cd8+t细胞的耗竭,导致肿瘤消退。本发明包括关于将同种异体、病毒特异性和/或肿瘤新生抗原(neoag)特异性的cd4+t细胞输注到患有或倾向于发展为癌症的受试者中,以旨在逆转内源性肿瘤特异性cd8+t细胞的耗竭,导致肿瘤消退的方法和组合物。
18.在一种实施方案中,本发明提供了一种制备淋巴细胞组合物的方法,包括:a)从供者获得外周血细胞组合物,其中供者任选地针对接受者中存在的抗原进行疫苗接种,并且
其中外周血细胞组合物包含cd8+t细胞、cd4+t细胞和自然杀伤细胞;b)使外周血细胞组合物耗尽cd8+t细胞,其中使外周血细胞组合物耗尽cd8+t细胞是使外周血细胞组合物中的cd8+t细胞的数量减少至少一个数量级;以及c)通过与抗原一起培养cd4+t细胞来扩增对抗原特异性的cd4+t细胞,其中供者与接受者hla匹配、部分hla匹配或hla半相合,从而制备淋巴细胞组合物。
19.在另一种实施方案中,本发明提供了一种治疗受试者中的癌症的方法,包括a)向受试者施用淋巴耗尽性化学疗法;以及b)向受试者施用淋巴细胞组合物,其中淋巴细胞组合物从hla匹配、部分hla错配或hla半相合的供者的外周血细胞组合物中获得,其中供者任选地针对受试者中存在的病毒抗原和/或肿瘤新生抗原进行疫苗接种,其中组合物耗尽了cd8+t细胞,并且其中组合物包含扩增对受试者中存在的病毒和/或肿瘤新生抗原具有特异性的cd4+t细胞的群体。在一方面,部分hla匹配或hla半相合供者相对于接受者具有至少一个人类白细胞抗原(hla)ii类等位基因匹配,并且该hla ii类等位基因匹配位于选自由hla-drb1、hla-dqb1和hla-dpb1组成的组的基因处。
20.在一种另外的实施方案中,本发明提供了一种细胞库,该细胞库包括对病毒抗原、肿瘤新生抗原或其组合具有特异性的cd4+t细胞,其中细胞库包括cd4+t细胞的单独系,每一个系从不同人类白细胞抗原(hla)类型的单个供者采集。在一方面,病毒抗原来自hpv或爱泼斯坦巴尔病毒。
21.附图简述
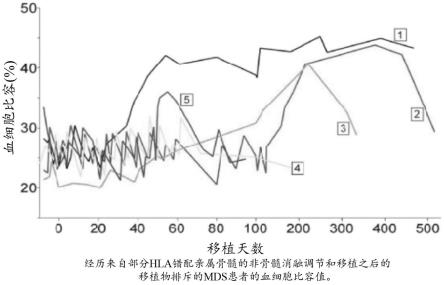
22.图1显示了五位在针对骨髓增生异常综合征的hla半相合骨髓移植后经历移植物排斥的患者的血细胞比容,其中锯齿状部分反映了输注的效果(图)。
23.图2显示了非植入dli诱导抗肿瘤免疫(图)。
24.图3a显示了供者细胞作为疫苗加同种异体cd4的植入延长了存活(图)。
25.图3b显示了供者cd4+t细胞嵌合和移植后天数的图。
26.图4显示了使用白细胞单采术制品和静脉切开术样本进行cd8耗尽的验证运行(流式细胞术结果)。
27.图5显示了解释短暂植入mhc错配供者淋巴细胞输注的抗肿瘤效力的模型。
28.图6a图示了用于获取图6b中的结果的方案。
29.c57bl/6 x c3h(b6 x c3h;b6c3)f1或balb/c x c57bl/6(balb/c x b6;cb6)f1小鼠每周进行25μg的pcdna-3-crt/e7(针对人乳头瘤病毒血清型16的e7的dna疫苗)的疫苗接种,共3剂。一周后,来自未经处理的或疫苗接种的小鼠的脾细胞未耗尽或已耗尽cd8+t细胞,并将2000万个细胞输注到b6 x c3h f1小鼠中,这些小鼠两周前已接受了50,000个表达e7的tc1肺癌细胞并在一天前接受了环磷酰胺200mg/kg ip。显示了携带肿瘤的小鼠的存活,左侧为同系(syngeneic)b6 x c3h f1细胞接受者,以及右侧为mhc半相合balb/c x b6 f1细胞接受者。
30.图7a图示了用于获得图7b中结果的方案。图7b显示了图示通过来自肿瘤ag初免的供者的脾细胞离体培养物增强nedli的抗肿瘤效力的图。来自e7初免的cb6 f1供者的脾细胞与cb6 f1(同系)或用来自hpv16的e7的重叠十五聚体(jpt peptide tech.)脉冲的b6c3 f1(半相合)树突状细胞(dc)一起培养。
31.图8a-图8h显示了通过流式细胞术获得的接受者cd8+t细胞的百分比。图8a显示了
对e7的免疫显性h-2kb限制性肽有反应的cd8+t细胞的百分比,如通过在未经处理的b6c3 f1小鼠中以用该肽脉冲的h-2k-b
四聚体染色确定的。图8b显示了对e7的免疫显性h-2kb限制性肽有反应的cd8+t细胞的百分比,如通过在半相合dli治愈的小鼠中以用该肽脉冲的h-2kb四聚体染色确定的。图8c显示了对e7的免疫显性h-2kb限制性肽有反应的cd8+t细胞的百分比,如通过在tc-1挑战后14天,在半相合dli治愈的小鼠中以用该肽脉冲的h-2kb四聚体染色确定的。图8d显示了对e7的免疫显性h-2kb限制性肽有反应的cd8+t细胞的百分比,如通过在tc1挑战后60天,在半相合dli治愈的小鼠中以用该肽脉冲的h-2kb四聚体染色确定的。图8e显示了在与图8a相同的条件下,门控的e7特异性cd8+t细胞上cd127和pd-1的细胞表面表达。图8f显示了在与图8b相同的条件下,门控的e7特异性cd8+t细胞上cd127和pd-1的细胞表面表达。图8g显示了在与图8c相同的条件下,门控的e7特异性cd8+t细胞上cd127和pd-1的细胞表面表达。图8h显示了在与图8d相同的条件下,门控的e7特异性cd8+t细胞上cd127和pd-1的细胞表面表达。
32.图9a显示的点图图示了用未经脉冲的b6 x c3h f1树突状细胞刺激五天后,来自未经治疗的b6 x c3h f1未经处理的小鼠的cd4+t细胞的细胞内干扰素γ(ifnγ)和肿瘤坏死因子α(tnfα)染色。图9b显示了在用e7肽脉冲的dc刺激五天后,来自未经治疗的b6 x c3h f1未经处理的小鼠的cd4+t细胞的细胞内干扰素γ(ifnγ)和肿瘤坏死因子α(tnfα)染色。图9c图示了在用e7肽脉冲的dc刺激5天后,来自通过非植入供者淋巴细胞输注治愈的小鼠的cd4+t细胞的细胞内干扰素γ(ifnγ)和肿瘤坏死因子α(tnfα)染色。图9d显示了通过elispot测定对如图9a-图9c所示的相同的细胞的ifnγ分泌进行量化的图。
33.图10a图示了用于获得图10b中结果的方案。
34.携带tc1的b6 x c3h f1小鼠通过环磷酰胺加cd8耗尽的淋巴细胞治愈,这些淋巴细胞取自e7疫苗接种的供者并用e7肽离体扩增。淋巴细胞输注后300天,来自治愈小鼠的脾细胞中的cd8
+
细胞被耗尽,与e7肽培养一周,并且(每个接受者有2000万个细胞投入培养)被转移到一天前用环磷酰胺治疗的携带tc1的balb/c x b6 f1小鼠中。或者,携带tc1的balb/c x b6 f1小鼠接受来自未经处理的b6 x c3h f1供者的脾细胞,这些脾细胞耗尽了cd8
+
细胞并在过继转移前与e7肽培养一周。存活率在图10b中显示。
35.图11a显示了确定肿瘤免疫中apc许可要求的双亲骨髓嵌合体的示意图。图11b显示了确定肿瘤免疫中apc许可要求的f1骨髓嵌合体的示意图。
36.图12显示了图示以下的示意图:cd4
+
t细胞辅助如何逆转对新生抗原b、c和e特异性的cd8
+
t细胞中的耗竭(ectl),这些抗原由垂死的肿瘤细胞释放。
37.发明详述
38.本发明至少部分源于对癌症的免疫应答受到患者cd4+t细胞的功能缺陷阻碍的开创性发现。同种异体淋巴细胞的输注可提供针对内源性肿瘤反应性cd8+t细胞的cd4+t细胞辅助的外源性来源。来自供者淋巴细胞输注的cd8+t细胞的耗尽降低持续植入和移植物抗宿主病的风险。从经输注的群体中去除调节性t细胞可以增强非调节性t细胞为抗肿瘤免疫的内源性效应物提供辅助的能力。同种异体t细胞疗法通常在同种异体干细胞植入的背景下给予,其中患者接受高度免疫抑制调节,然后被输注含有未选择的成熟t细胞群体的干细胞移植物。在这里描述的治疗中,移植物经过工程改造,以最小化持续供者细胞植入的可能性,并且抗肿瘤效应t细胞来源于宿主。因此,在短暂的供者细胞植入期间,该疗法需要宿主
和供者淋巴细胞的独特合作。
39.在描述本发明的组合物和方法之前,要理解本发明不限于所描述的特定组合物、方法和实验条件,因为这样的组合物、方法和条件可变化。还要理解本文使用的术语仅用于描述特定实施方案的目的,且并非旨在限制,因为本发明的范围将仅在所附的权利要求书中被限制。
40.除非上下文另外清楚地指明,否则如本说明书和所附的权利要求书中使用的单数形式“一(a)”、“一(an)”和“所述/该(the)”包括复数指示物。因此,例如,提及“该方法”包括一种或更多种本文描述的类型的方法和/或步骤,其对本领域技术人员而言在阅读本公开内容等后将变得明显。
41.在本说明书中提及的所有出版物、专利和专利申请通过引用并入本文,其程度犹如每个单独的出版物、专利或专利申请被具体地且单独地指明通过引用并入。
42.除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域内的普通技术人员通常理解的相同的含义。以下参考文献为技术人员提供了本发明中使用的许多术语的一般定义:singleton等人,dictionary of microbiology and molecular biology(第2版1994);the cambridge dictionary of science and technology(walker编著,1988);the glossary of genetics,第5版.,r.rieger等人(编著),springer verlag(1991);以及hale&marham,the harper collins dictionary of biology(1991)。尽管与本文所描述的那些方法和材料相似或等同的任何方法和材料可被用于本发明的实践或测试,将理解,修改和变化被涵盖在本公开内容的精神和范围内。现在描述优选的方法和材料。
43.在同种异体细胞输注之前施用化学疗法可以通过促进转移的淋巴细胞的稳态扩增和/或通过耗尽宿主调节性t细胞和骨髓来源的抑制细胞来增强短暂植入淋巴细胞的抗肿瘤效应。同种异体淋巴细胞的输注可提供针对内源性肿瘤反应性cd8+t细胞的cd4+t细胞辅助的外源性来源。来自供者淋巴细胞输注的cd8+t细胞的耗尽降低持续植入和移植物抗宿主病的风险。从输注的群体中去除调节性t细胞可以增强非调节性t细胞为抗肿瘤免疫的内源性效应物提供辅助的能力。
44.同种异体t细胞疗法通常在同种异体干细胞移植的背景下给予,其中患者接受高度免疫抑制调节,然后被输注含有未选择的成熟t细胞群体的干细胞移植物。allosct的目标是获得供者细胞的持续植入,并需要承担移植物抗宿主病的死亡的风险。在这里描述的治疗中,移植物经过工程改造,以最小化持续供者细胞植入的可能性,并且抗肿瘤效应t细胞来源于宿主。因此,在短暂的供者细胞植入期间,该疗法需要宿主和供者淋巴细胞的独特合作。
45.这是一种可以应用于任何人类或动物癌症的治疗。本发明的变化形式包括:1)在输注同种异体淋巴细胞之前给予的化学疗法方案的变化形式(可以包括环磷酰胺、氟达拉滨、5-氟尿嘧啶、吉西他滨、达沙替尼、它们的组合);2)供者淋巴细胞来源的变化形式(可以来自相关或无关的供者,可以包括hla
ꢀⅰ
类或ⅱ类遗传基因座处的限定错配);3)选择用于输注的细胞类型的变化形式,诸如耗尽cd4+cd25+调节性t细胞,耗尽cd8+t细胞。供者可以在淋巴细胞输注前对限定的抗原进行免疫,或者可以用细胞因子或药物进行离体极化以富集i型(产生ifn-γ)或17型(产生il-17)cd4
+
t细胞。
46.免疫系统的cd8
+
t细胞可以通过识别肿瘤新生抗原来破坏癌细胞,肿瘤新生抗原是由癌细胞突变产生并将其与健康的正常对应物区分开来的氨基酸序列。然而,癌症可以通过麻痹cd4
+
t细胞的功能来避免被免疫破坏,cd4
+
t细胞的“辅助”是防止新生抗原特异性cd8
+
t细胞变得耗竭所必需的。本发明的同种异体移植物可用于逆转新生抗原特异性cd8
+
t细胞的耗竭并通过提供新鲜来源的来自已经针对患者肿瘤新生抗原进行疫苗的健康供者的cd4
+
辅助性t细胞来恢复抗癌免疫应答。
47.在一种实施方案中,本发明提供了一种制备用于向接受者施用的同种异体淋巴细胞组合物的方法,包括:对人类供者进行针对接受者中存在的抗原的疫苗接种;提供来自与接受者同种异体的人类供者的外周血细胞组合物,该外周血细胞组合物包含许多cd4+t细胞,许多cd8+t细胞和许多自然杀伤细胞,其中(i)供者具有针对接受者中存在的抗原的cd4+t细胞免疫,(ii)供者包含相对于接受者的至少一个人类白细胞抗原(hla)ii类等位基因匹配,并且该hla ii类等位基因匹配位于选自由hla-drb1、hla-dqb1和hla-dpb1组成的组的基因处,并且(iii)接受者不具有对供者的人类白细胞抗原有反应的可检测抗体;以及通过将外周血细胞组合物中的cd8+t细胞的数量减少至少一个数量级来从外周血细胞组合物制备同种异体淋巴细胞组合物,其中同种异体淋巴细胞组合物中的cd4+t细胞的数量与外周血细胞组合物中的cd4+t细胞的数量相差小于约50%,并且其中同种异体淋巴细胞组合物中的自然杀伤细胞的数量小于或等于外周血细胞组合物中的自然杀伤细胞的数量。
48.本发明提供了一种制备待向接受者施用的淋巴细胞组合物的方法,包括a)从供者获得外周血细胞组合物,其中供者任选地针对接受者中存在的抗原进行疫苗接种,并且其中外周血细胞组合物包含cd8+t细胞、cd4+t细胞和自然杀伤细胞;b)使外周血细胞组合物耗尽cd8+t细胞,其中使外周血细胞组合物耗尽cd8+t细胞是使外周血细胞组合物中的cd8+t细胞的数量减少至少一个数量级;以及c)通过与抗原一起培养cd4+t细胞来扩增对抗原特异性的cd4+t细胞,其中供者与接受者hla匹配、部分hla匹配或hla-半相合,从而制备淋巴细胞组合物。在一方面,部分hla匹配或hla半相合的供者相对于接受者具有至少一个人类白细胞抗原(hla)ii类等位基因匹配,并且hla ii类等位基因匹配在选自hla-drb1、hla-dqb1和/或hla-dpb1的基因处。
49.优选地,供者和接受者不是同一个人。该方法包括提供来自与接受者同种异体的人类供者的外周血细胞组合物,该外周血细胞组合物包含许多cd4+t细胞、许多cd8+t细胞和许多自然杀伤细胞,一些自然杀伤细胞具有cd8+抗原,并且可以通过“减少(reducing)”步骤去除;然而,本发明优选的淋巴细胞组合物包含来自供者的至少一些自然杀伤细胞。在一方面,(i)供者包含至少一个在供者抗接受者方向上相对于接受者的人类白细胞抗原(hla)ii类等位基因错配(在供者抗接受者方向上的hla ii类等位基因错配,“移植物抗宿主方向”),并且hla ii类等位基因错配位于诸如hla-drb1、hla-dqb1或hla-dpb1的基因处。接受者不具有对供者的人类白细胞抗原有反应的可检测抗体(本文中的“可检测抗体”是使用进行此确定的标准方法定义的,例如,接受者不具有通过补体依赖性细胞毒性检测到的针对供者hla分子的抗体,在流式细胞术交叉匹配测定中阳性结果是不期望的,或者在固相免疫测定中平均荧光强度(mfi)为3000或更大是不可接受的)。在一方面,供者相对于接受者在供者抗接受者(移植物抗宿主)方向上具有至少一个hla ii类等位基因错配,并且该hla ii类等位基因错配位于选自由hla-drb1、hla-dqb1和hla-dpb1组成的组的基因处。
[0050]“扩增病毒特异性或肿瘤新生抗原特异性t细胞的细胞群体”是指生成包含对病毒或肿瘤新生抗原有反应的t细胞的频率比在未暴露于病毒或肿瘤新生抗原的健康个体中发现的更高的的淋巴细胞群体。
[0051]
同种异体淋巴细胞组合物由外周血细胞组合物通过将外周血细胞组合物中的cd8+t细胞的数量减少至少一个数量级而制成,其中(a)同种异体淋巴细胞组合物中的cd4+t细胞的数量与外周血细胞组合物中的cd4+t细胞的数量相差小于约50%。在优选实施方案中,淋巴细胞组合物中cd4+t细胞的数量/cd8+t细胞的数量的比率优选大于或等于约30。一些实施方案的实例包括但不限于以下剂量/kg接受者理想体重:包含105个cd4+细胞的淋巴细胞组合物通常具有不超过3.2
×
103个cd8+细胞,包含106个cd4+细胞的淋巴细胞组合物通常具有不超过3.2
×
104个cd8+细胞,包含107个cd4+细胞的淋巴细胞组合物通常具有不超过3.2
×
105个cd8+细胞,包含108个cd4+细胞的淋巴细胞组合物通常具有不超过3.2
×
106个cd8+细胞以及包含5
×
108个cd4+细胞的淋巴细胞组合物通常具有不超过1.6
×
107个cd8+细胞。
[0052]
同种异体淋巴细胞组合物中的自然杀伤细胞的数量小于或等于外周血细胞组合物中的自然杀伤细胞的数量。减少一个数量级,优选地约两个数量级,更优选地约五个数量级。在一种实施方案中,cd8+细胞的数量减少约2.5个数量级(例如,使用磁珠细胞分选仪方法)。
[0053]“耗尽cd8+t细胞”意指通过诸如针对cd8的抗体加补体或者通过磁细胞分离的方法减少混合细胞群体中的cd8+t细胞的数量,使得与未耗尽的群体相比,cd8+t细胞的数量相对于其他细胞(诸如cd4+t细胞)至少低10倍。例如,如果未耗尽的外周血群体中cd4+细胞与cd8+t细胞的比率为1.5:1,那么在耗尽cd8+t细胞的群体中,cd4+细胞与cd8+t细胞的比率不小于15:1。
[0054]
如本文所用,术语“疫苗接种”涉及疫苗、药物制品(药物组合物)或产品的施用,疫苗、药物制品(药物组合物)或产品在施用时诱导免疫应答,特别是可以识别和攻击病原体或疾病细胞(诸如癌细胞细胞)的免疫应答。疫苗可用于预防或治疗疾病。术语“免疫应答”是指对抗原的综合身体应答,并且优选地是指细胞免疫应答或细胞以及体液免疫应答。免疫应答可以是保护性的/防止性的(preventive)/预防性的(prophylactic)和/或治疗性的。“诱导免疫应答”可以意指在诱导前没有针对特定抗原的免疫应答,但也可以意指在诱导前存在针对特定抗原的一定水平的免疫应答,并且在诱导后所述免疫应答增强。因此,“诱导免疫应答”也包括“增强免疫应答”。优选地,在受试者中诱导免疫应答后,保护所述受试者免于发展诸如癌症疾病的疾病,或者通过诱导免疫应答来改善疾病状况。例如,可以在供者中诱导针对肿瘤表达抗原的免疫应答,这将帮助患有癌症疾病的接受者受试者对抗癌症疾病。在这种情况下诱导免疫应答可以意指受试者的疾病状况得到改善,受试者没有发展为转移,或者处于发展为癌症疾病风险的受试者没有发生癌症疾病。
[0055]
在本发明中,“针对肿瘤抗原的疫苗接种”涉及特定供者受试者,该供者受试者针对存在于肿瘤或具有癌症的接受者受试者中的肿瘤抗原进行免疫。例如,可以使用单个neoag、单剂量的疫苗或疫苗制剂来进行疫苗接种,以增强抗肿瘤免疫。如果没有实现充分的免疫接种,供者可以用mrna五表位疫苗(pentatope vaccine)进行疫苗接种。
[0056]
术语“受试者”是指可对其进行本文描述的方法的任何个体或患者。通常,受试者
是人类,但如本领域技术人员将理解的,受试者可以是动物。因此,其他动物,包括哺乳动物诸如啮齿类动物(包括小鼠、大鼠、仓鼠和豚鼠)、猫、犬、兔,农场动物包括牛、马、山羊、绵羊、猪等,以及灵长类动物(包括猴、黑猩猩、猩猩和大猩猩)也被包括在受试者的定义内。
[0057]
本文中可互换使用的术语“治疗(treat)”、“治疗(treating)”、“治疗(treatment)”意在指减少或改善与其相关的紊乱和/或症状。应理解,尽管不排除在外,但治疗紊乱或状况不要求紊乱、状况或与其相关的症状被完全消除。
[0058]
本文描述的治疗可以适当地施用至罹患、患有、易患癌症或疾病、紊乱或其症状,或处于癌症或疾病、紊乱或其症状的风险的受试者,特别是人类。确定那些受试者“处于风险”可以通过诊断测试或者受试者或卫生保健提供者的意见(例如,遗传测试、酶或蛋白质标志物、标志物(如本文定义的)、家族史等)的任何客观或主观确定来进行。
[0059]
在一方面,如果供者和接受者是abo血型不相容的,并且外周血细胞组合物包含许多红细胞,那么制备同种异体淋巴细胞组合物还包括减少红细胞的数量。如本文所用,“abo血型不相容”是指当接受者与供者有主要的abo红细胞不相容性时,例如,接受者是o型血而供者是a型、b型或ab型血,接受者是a型而供者是b型或ab型,或者接受者是b型而供者是a型或ab型。
[0060]
在一些方面,供者是无癌供者,并且其中该无癌供者具有至少一个针对患有癌症的受试者的hlaⅱ类等位基因匹配。
[0061]
如本文所用,术语“供者”是指经历疫苗接种并从中分离细胞以产生淋巴细胞组合物的受试者。如全文进一步详述的,供者是同种异体供者,其与接受者至少部分hla相容。无癌意指供者没有癌症,至少在从供者获得外周血细胞组合物时没有癌症。
[0062]
在一些方面,红细胞的数量包括包装体积小于或等于约50ml;例如,包装体积小于或等于约50ml,优选地包装体积小于或等于约30ml,还应定义“包装体积”,例如,离心淋巴细胞组合物将产生包装体积为50ml或更少的红细胞;还可以筛选淋巴细胞组合物的测量的体积样品,以提供按包装血细胞的按比例代表的体积。
[0063]
在一些方面,接受者中存在的抗原选自由以下组成的组:赘生性抗原、赘生性独特型、病毒抗原、细菌抗原、真菌抗原、寄生虫抗原、非人类动物抗原、肿瘤新生抗原及其组合。
[0064]“肿瘤新生表位”或“肿瘤新生抗原”是通过诸如将肿瘤组织的全基因组或全外显子组序列与来自同一癌症患者的非肿瘤组织的全基因组或全外显子组序列进行比较,rnaseq鉴定表达的新生表位的方法;以及诸如预测性算法、使用加标签的等位基因构建体的单等位基因纯化或免疫肽组的深度基序去卷积以鉴定癌症患者和无癌供者共有的特定hlaⅱ类等位基因所呈现的表位的方法,来鉴定的表位。
[0065]
在各方面,抗原是赘生性抗原,并且其中赘生性抗原是肿瘤抗原。
[0066]
在一方面,接受者中存在的抗原选自由赘生性抗原组成的组(赘生性抗原是与赘生物相关的抗原,其中赘生物被定义为任何新的和异常的细胞生长,特别是其中细胞复制是不受控制的和进行性的细胞生长)。赘生物可以是良性的,恶性前的(premalignant)或恶性的,并且癌症是恶性赘生物。因此,所有的癌症抗原都是赘生性抗原,但不是所有的赘生性抗原都是癌症抗原。赘生性独特型(id)是例如那些在其细胞表面表达该分子的b细胞恶性肿瘤(例如,淋巴瘤或多发性骨髓瘤)中的肿瘤特异性靶,并且包括病毒抗原、细菌抗原、真菌抗原、寄生虫抗原和非人类动物抗原。
[0067]
在一些方面,病毒抗原选自由以下组成的组:人乳头瘤病毒(hpv)e6抗原、hpv e7抗原及其组合。在其它方面,病毒抗原选自由以下组成的组:爱泼斯坦-巴尔病毒潜伏膜蛋白1(lmp1)、潜伏膜蛋白2a(lmp2a)及其组合。
[0068]
在一方面,肿瘤抗原是来自接受者的肿瘤的抗原。
[0069]
在许多方面,筛选了选自由接受者、供者和一个或更多个潜在同种异体供者组成的组的受试者对选自由人类免疫缺陷病毒(hiv)抗原、肝炎病毒抗原和巨细胞病毒抗原组成的组的感染原抗原的血清学反应性。
[0070]
在一些方面,完成对一种或更多种选择特征进行筛选,并且对选自由接受者、供者和一个或更多个潜在同种异体供者组成的组的受试者进行筛选。例如,选择特征是针对对感染原抗原的血清学反应性进行筛选。感染原抗原选自由以下组成的组:人类免疫缺陷病毒(hiv)抗原、肝炎病毒抗原和巨细胞病毒抗原。待筛选的重要感染原包括,例如,一种或更多种hiv-1抗原、一种或更多种hiv-2抗原、一种或更多种甲型肝炎病毒抗原、一种或更多种乙型肝炎病毒抗原、一种或更多种丙型肝炎病毒抗原、cmv抗原、感染性疾病等。如果病毒或感染原或其抗原是治疗的靶,不排除具有针对该感染原的期望的cd4+介导的免疫应答的供者。
[0071]
在一方面,感染原抗原是巨细胞病毒抗原,接受者和供者经过筛选,并且在接受者或供者中对巨细胞病毒抗原没有血清学反应性。在一方面,病毒抗原是流感抗原,并且流感抗原是血凝素抗原或神经氨酸酶抗原。
[0072]
在另一方面,选择特征是针对一个以上hla
ꢀⅱ
类等位基因进行筛选。在某些情况下,基于使潜在同种异体供者与接受者之间、在潜在同种异体供者与接受者方向上在一个以上hla
ꢀⅱ
类等位基因处的错配最大化来选择潜在同种异体供者,并且选择潜在同种异体供者作为供者。在某些情况下,选择特征是针对一个或更多个hla
ꢀⅰ
类等位基因进行筛选。
[0073]
可以基于使在潜在同种异体供者和接受者之间在一个以上hla
ꢀⅰ
类等位基因处的错配最小化来选择潜在同种异体供者,并且选择潜在同种异体供者作为供者。
[0074]
在一方面,同种异体淋巴细胞组合物中的cd4+t细胞的数量与外周血细胞组合物中的cd4+t细胞的数量相差小于约20%。在一些实施方案中,cd4+t细胞小于约50%,小于约40%,优选地小于约20%,更优选地小于约10%。在一些实施方案中,可以进行cd4+t细胞的离体扩增,在这样的实施方案中,cd4+t细胞的数量可以大大超过原始数量。这种扩增是一种替代的实施方案。此外,“与外周血细胞组合物中的cd4+t细胞数量相差小于约50%”意指外周血细胞组合物中的cd4+t细胞数量的正负小于50%。例如,如果外周血细胞组合物中cd4+t细胞的数量是1
×
105个cd4+细胞,则“与外周血细胞组合物中cd4+t细胞的数量相差小于50%”意指cd4+t细胞的数量在1.5
×
105和0.5
×
105之间。
[0075]
在各方面,从供者获得的cd4+t细胞不是有意离体扩增或有意离体分化的。有意扩增或有意分化与cd4+t细胞的扩增或分化相区别,后者仅仅是方法的副作用(非有意的,无意的),例如,cd4+t细胞有时可能通过进入与塑料接触而经历分化,这是此类无意事件的其他实例。在另一种实施方案中,还有一个另外的条件是干细胞尚未在与接受者同种异体的外周血细胞组合物供者中动员。
[0076]
在一些方面,减少外周血细胞组合物中的cd8+t细胞包括使用与磁性颗粒缔合的抗cd8+抗体或抗cd8+抗体加补体。外周血细胞组合物可以是例如全血制品或单采血液成分
术制品。此外,在供者对接受者方向上的hla
ꢀⅱ
类等位基因错配可能是在hla-drb1处的错配。在供者抗接受者方向上的hla ii类等位基因错配的这种限制是例如“移植物抗宿主方向”,其中在同种异体供者抗接受者方向上的至少一个hla ii类等位基因错配还包括同种异体供者与接受者的一个或更多个一级亲属之间的相同的hla ii类等位基因错配,这对于保留从一级亲属向接受者进行骨髓移植的机会是合意的;理想地,供者与接受者之间的所有错配不在潜在的家庭骨髓供者与接受者之间存在。
[0077]
在一方面,基于以千克(kg)计的接受者的理想体重的供者cd4+t细胞的数量在约1
×
105个cd4+t细胞/kg和1
×
109个cd4+t细胞/kg之间。在组合物中,基于理想体重(理想体重(ibw))的供者cd4+t细胞的数量是基于身高的。对于男性,ibw=50+2.3kg/超过5英尺的英寸。对于女性,接受者以千克(kg)计的ibw(=45.5+2.3kg/超过5英尺的英寸)在约1
×
105个cd4+t细胞/kg和1
×
109个cd4+t细胞/kg之间(在优选实施方案中,在约1
×
106个cd4+t细胞/kg和约5
×
108个cd4+t细胞/kg之间);同种异体淋巴细胞组合物中的自然杀伤细胞的数量小于或等于外周血细胞组合物中的自然杀伤细胞的数量,并且同种异体淋巴细胞组合物具有相对于外周血细胞组合物少至少一个数量级的cd8+t细胞。
[0078]
在其他方面,同种异体淋巴细胞组合物具有相对于外周血细胞组合物少至少一个数量级的cd8+t细胞。
[0079]
在一些方面,供者对不在接受者中存在的抗原具有cd4+t细胞免疫。
[0080]
在很多方面,供者对接受者中存在的抗原具有cd4+t细胞免疫。如本文所用,“具有cd4+t细胞免疫”是指疫苗接种在供者中诱导免疫应答的效力,该免疫应答转化为针对用于疫苗接种目的的特异性抗原的新的cd4+t细胞克隆在供者中的扩增。
[0081]
在其他方面,接受者不具有的对供者的人类白细胞抗原有反应的可检测抗体。
[0082]
在另一种实施方案中,本发明提供了一种治疗受试者中的癌症的方法,包括向受试者施用淋巴耗尽性化学疗法;以及向受试者施用淋巴细胞组合物,其中淋巴细胞组合物从hla匹配或hla半相合的针对存在的病毒抗原和/或肿瘤新生抗原进行疫苗接种的供者的外周血细胞组合物中获得,其中组合物耗尽了cd8+t细胞,并且其中组合物包含扩增的对受试者中存在的病毒和/或肿瘤新生抗原具有特异性的cd4+t细胞的群体。
[0083]
本发明的组合物和方法可用于对抗广泛范围的癌症和肿瘤类型,包括但不限于膀胱癌、脑癌、乳腺癌、结肠直肠癌、宫颈癌、胃肠癌、泌尿生殖系统癌、头颈癌、肺癌、卵巢癌、前列腺癌、肾癌、皮肤癌和睾丸癌。更具体地说,可通过本文描述的组合物和方法治疗的癌症包括但不限于以下:心脏癌,包括例如肉瘤(例如血管肉瘤、纤维肉瘤、横纹肌肉瘤和脂肪肉瘤);黏液瘤;横纹肌瘤;纤维瘤;脂肪瘤和畸胎瘤;肺癌,包括例如支气管癌,例如鳞状细胞癌、未分化小细胞癌、未分化大细胞癌和腺癌;肺泡癌和细支气管癌;支气管腺瘤;肉瘤;淋巴瘤;软骨瘤样错构瘤;和间皮瘤;胃肠癌,包括例如食道的癌症,例如鳞状细胞癌、腺癌、平滑肌肉瘤和淋巴瘤;胃的癌症,例如上皮癌、淋巴瘤和平滑肌肉瘤;胰腺的癌症,例如导管腺癌、胰岛素瘤、胰高血糖素瘤、胃泌素瘤、类癌肿瘤和舒血管肠肽瘤(vipoma);小肠的癌症,例如腺癌、淋巴瘤、类癌肿瘤、卡波西肉瘤、平滑肌瘤、血管瘤、脂肪瘤、神经纤维瘤和纤维瘤;大肠的癌症,例如腺癌、管状腺瘤、绒毛状腺瘤、错构瘤和平滑肌瘤;泌尿生殖道癌症,包括例如肾癌,例如腺癌、wilm肿瘤(wilm’s tumor)(肾胚细胞瘤)、淋巴瘤和白血病;膀胱和尿道的癌症,例如鳞状细胞癌、移行细胞癌和腺癌;前列腺的癌症,例如腺癌和肉瘤;睾丸
的癌症,例如精原细胞瘤、畸胎瘤、胚胎癌、畸胎癌、绒毛膜癌、肉瘤、间质细胞癌、纤维瘤、纤维腺瘤、腺瘤样肿瘤和淋巴瘤;肝癌,包括例如肝癌,例如肝细胞癌;胆管癌;肝母细胞瘤;血管肉瘤;肝细胞腺瘤;和血管瘤;骨癌,包括例如成骨性肉瘤(骨肉瘤)、纤维肉瘤、恶性纤维组织细胞瘤、软骨肉瘤、尤因氏肉瘤、恶性淋巴瘤(网状细胞肉瘤)、多发性骨髓瘤、恶性巨细胞瘤、脊索瘤、骨软骨瘤(骨软骨性外生骨疣(osteocartilaginous exostoses))、良性软骨瘤、软骨母细胞瘤、软骨肌瘤样纤维瘤(chondromyxofibroma)、骨样骨瘤和巨细胞瘤;神经系统癌症,包括例如颅骨癌症,例如骨瘤、血管瘤、肉芽肿、黄瘤和畸形性骨炎;脑膜的癌症,例如脑膜瘤、脑膜肉瘤和神经胶质瘤病;脑的癌症,例如星形细胞瘤、成神经管细胞瘤、胶质瘤、室管膜瘤、生殖细胞瘤(松果体瘤)、多形性胶质母细胞瘤、少突胶质细胞瘤、神经鞘瘤、视网膜母细胞瘤和先天性肿瘤;和脊髓的癌症,例如神经纤维瘤、脑膜瘤、胶质瘤和肉瘤;妇科癌症,包括例如子宫的癌症,例如子宫内膜癌;子宫颈的癌症,例如宫颈癌和肿瘤前宫颈发育不良;卵巢的癌症,例如卵巢癌,包括浆液性囊腺癌、黏液性囊腺癌、未分类癌、颗粒卵泡膜细胞肿瘤、支持睾丸间质细胞瘤(sertoli leydig cell tumor)、无性细胞瘤和恶性畸胎瘤;外阴的癌症,例如鳞状细胞癌、上皮内癌、腺癌、纤维肉瘤和黑色素瘤;阴道的癌症,例如透明细胞癌、鳞状细胞癌、葡萄状肉瘤和胚胎性横纹肌肉瘤;和输卵管的癌症,例如上皮癌;血液系统癌症,包括例如血液的癌症,例如急性髓系白血病、慢性髓系白血病、急性淋巴细胞白血病、慢性淋巴细胞白血病、骨髓增生性疾病、多发性骨髓瘤和骨髓增生异常综合征、霍奇金淋巴瘤、非霍奇金淋巴瘤(恶性淋巴瘤)和瓦尔登斯特伦巨球蛋白血症;皮肤癌,包括例如恶性黑色素瘤、基底细胞癌、鳞状细胞癌、卡波西肉瘤、异型增生痣(moles dysplastic cnevi)、脂肪瘤、血管瘤、皮肤纤维瘤、瘢痕瘤、银屑病;和肾上腺癌,包括例如神经母细胞瘤。在某些实施方案中,当疾病是癌症时,它可以包括例如肺癌肿瘤、乳腺癌肿瘤、前列腺癌肿瘤、脑癌肿瘤或皮肤癌肿瘤。
[0084]
本发明的组合物可以通过多种途径施用于个体,例如,口服、表面(topically)、肠胃外、阴道内、全身、肌肉内、直肠或静脉内。在某些实施方案中,组合物与药物载体一起配制。优选地,组合物是静脉内施用的。
[0085]
在一些实施方案中,该组合物与其他抗病毒或抗癌疗法(诸如抗病毒或抗癌剂的施用)、放射疗法、光疗法或免疫疗法组合。抗病毒剂或抗癌剂可与本发明的组合物以相同的制剂或单独的制剂施用,以增强治疗。在这些实施方案中,组合物和其他疗法可以在相同的时间(同时)或在分开的时间(顺序)施用,前提是它们以这样的方式并且在时间上足够接近地施用以具有期望的效果。
[0086]
本发明的组合物也可以与现有的治疗癌症的方法(例如通过化学疗法、辐照或手术)组合施用。因此,还提供了一种治疗癌症的方法,包括向需要这种治疗的个体施用有效量的本发明的组合物,其中向该个体施用有效量的至少一种另外的癌症化学治疗剂。合适的化学治疗剂的实例包括以下任何:阿巴瑞克、阿地白介素、阿仑单抗、阿利维a酸、别嘌呤醇、六甲蜜胺、阿那曲唑、三氧化二砷、天冬酰胺酶、阿扎胞苷、贝伐单抗、蓓萨罗丁、博莱霉素、硼替佐米、硼替佐米、静脉内白消安、口服白消安、卡鲁睾酮、卡培他滨、卡铂、卡莫司汀、西妥昔单抗、苯丁酸氮芥、顺铂、克拉屈滨、氯法拉滨、环磷酰胺、阿糖胞苷、达卡巴嗪、更生霉素、达肝素钠、达沙替尼、柔红霉素、地西他滨、地尼白介素、地尼白介素-毒素连接物(denileukin diftitox)、右雷佐生、多西他赛、多柔比星、屈他雄酮丙酸酯
(dromostanolone propionate)、艾库组单抗、表柔比星、埃罗替尼、雌莫司汀、依托泊苷磷酸酯、依托泊苷、依西美坦、柠檬酸芬太尼、非格司亭、氟尿苷、氟达拉滨、氟尿嘧啶、氟维司群、吉非替尼、吉西他滨、吉妥单抗奥佐米星(gemtuzumab ozogamicin)、乙酸戈舍瑞林、乙酸组氨瑞林、替伊莫单抗替昔坦(ibritumomab tiuxetan)、伊达比星、异环磷酰胺、甲磺酸伊马替尼、干扰素α2a、伊立替康,二甲苯磺酸拉帕替尼(lapatinib ditosylate),来那度胺、来曲唑、甲酰四氢叶酸(leucovorin)、乙酸亮丙立德、左旋咪唑、洛莫司汀、氮芥、乙酸甲地孕酮、美法仑、巯嘌呤、氨甲蝶呤、甲氧沙林、丝裂霉素c、米托坦、米托蒽醌、苯丙酸诺龙、奈拉滨、诺非妥单抗(nofetumomab)、奥沙利铂、紫杉醇、帕米膦酸盐、帕尼单抗、培门冬酶、聚乙二醇化非格司亭、培美曲塞二钠、喷司他汀、哌泊溴烷、普卡霉素、甲基苄肼、奎纳克林、拉布立酶、利妥昔单抗、索拉非尼、链脲菌素、舒尼替尼、马来酸舒尼替尼、他莫昔芬、替莫唑胺、替尼泊苷、睾内酯、沙利度胺、硫鸟嘌呤、塞替派、拓扑替康、托瑞米芬、托西莫单抗、曲妥珠单抗、维a酸、尿嘧啶氮芥、戊柔比星、长春花碱、长春新碱、长春瑞滨、伏立诺他和唑来膦酸盐。
[0087]
在一方面,制备用于向受试者施用的同种异体淋巴细胞组合物包括:对人类供者进行针对接受者中存在的抗原的疫苗接种,其中该接受者是受试者;提供来自与接受者同种异体的人类供者的外周血细胞组合物,该外周血细胞组合物包含许多cd4+t细胞,许多cd8+t细胞和许多自然杀伤细胞,其中(i)供者具有针对接受者中存在的抗原的cd4+t细胞免疫,(ii)供者包含相对于接受者的至少一个人类白细胞抗原(hla)ii类等位基因匹配,并且该hla ii类等位基因匹配位于选自由hla-drb1、hla-dqb1和hla-dpb1组成的组的基因处,并且(iii)接受者不具有对供者的人类白细胞抗原有反应的可检测抗体;以及通过将外周血细胞组合物中的cd8+t细胞的数量减少至少一个数量级来从外周血细胞组合物制备同种异体淋巴细胞组合物,其中同种异体淋巴细胞组合物中的cd4+t细胞的数量与外周血细胞组合物中的cd4+t细胞的数量相差小于约50%,并且其中同种异体淋巴细胞组合物中的自然杀伤细胞的数量小于或等于外周血细胞组合物中的自然杀伤细胞的数量。
[0088]
在各个方面,在向受试者施用同种异体淋巴细胞组合物之前,该方法还包括向受试者施用淋巴减少非淋巴消融治疗,以诱导受试者中的短暂性淋巴细胞减少;施用治疗以耗尽或抑制骨髓来源的抑制细胞;施用治疗以耗尽或抑制肿瘤相关巨噬细胞或施用治疗以耗尽调节性t细胞;或者其中在向受试者施用同种异体淋巴细胞组合物之后,该方法还包括施用药物以诱导同种异体反应性t细胞的选择性耗尽。
[0089]
在一方面,淋巴减少非淋巴消融治疗包括用一种或更多种细胞减少剂治疗受试者,细胞减少剂选自由以下组成的组:烷化剂、烷基磺酸盐、亚硝基脲、三氮烯、抗代谢物、嘧啶类似物、嘌呤类似物、长春花生物碱、表鬼臼毒素、抗生素、二溴甘露醇、脱氧精胍菌素(deoxyspergualine)、二甲马利兰(dimethyl myleran)和塞替派。在一方面,淋巴减少非淋巴消融治疗包括用烷化剂治疗受试者,并且该烷化剂是环磷酰胺。在一方面,在向受试者施用第一同种异体淋巴细胞组合物之后,该方法还包括向受试者施用抗肿瘤单克隆抗体或抗肿瘤单克隆抗体/药物缀合物。
[0090]“淋巴耗尽性疗法”、“淋巴减少疗法”等意在指减少外周血中淋巴细胞浓度的药物或其他剂,诸如化学疗法。“减少”其意指至少10%、25%、50%、75%或100%的负变化。
[0091]
在一方面,方法还包括施用抗肿瘤单克隆抗体,并且该抗肿瘤单克隆抗体选自由
以下组成的组:利妥昔单抗、西妥昔单抗、曲妥珠单抗和帕妥珠单抗。在一方面,本发明包括施用抗肿瘤单克隆抗体/药物缀合物,并且抗肿瘤单克隆抗体/药物缀合物选自由以下组成的组:布妥昔单抗维多汀(brentuximab vedotin)、吉妥单抗奥佐米星、曲妥珠单抗恩美坦新(trastuzumab emtansine)、英妥珠单抗奥佐米星(inotuzumab ozogamicin)、格巴妥木单抗维多汀(glembatumumab vedotin)、洛沃妥珠单抗美登素(lorvotuzumab mertansine)、坎妥珠单抗美登素(cantuzumab mertansine)和米拉珠单抗-多柔比星(milatuzumab-doxorubicin)。在一些方面,向受试者的施用首先是同种异体淋巴细胞组合物,并且然后施用化学治疗剂。例如,化学疗法剂选自由以下组成的组:达沙替尼、尼罗替尼、普纳替尼、伊马替尼、拉帕替尼和维莫德吉。
[0092]
在其他方面,在向受试者施用同种异体淋巴细胞组合物之前,治疗包括施用选自由以下组成的组的药物:达沙替尼、5-氟尿嘧啶、泰索帝(taxotere)、氯膦酸盐、吉西他滨、环磷酰胺、氟达拉滨、地尼白介素-毒素连接物和达利珠单抗。
[0093]
在一些方面,外周血细胞组合物是全血制品或单采血液成分术制品。
[0094]
在各方面,受试者已经被注射了纳米颗粒组合物到肿瘤中,其中纳米颗粒组合物包含含有不在受试者中存在的抗原的纳米颗粒。在许多方面,纳米颗粒还包含细胞因子,其中细胞因子是白细胞介素,并且选自由以下组成的组:il-2、il-7、il-12和il-15;或者细胞因子是干扰素,并且选自由以下组成的组:干扰素γ、干扰素β、干扰素α、干扰素τ、干扰素ω和共有干扰素(consensus interferon)。
[0095]
在一种另外的实施方案中,本发明提供了一种细胞库,该细胞库包括对病毒抗原、肿瘤新生抗原或其组合具有特异性的cd4+t细胞,其中细胞库包括从不同人类白细胞抗原(hla)类型的供者采集cd4+t细胞。
[0096]
在各方面,病毒抗原是hpv抗原。
[0097]
在一种实施方案中,本发明提供了通过如本文描述的本发明方法获得的用于施用于人类接受者的同种异体淋巴细胞组合物。
[0098]
如果接受者对cmv抗原呈血清反应阳性,那么供者的状态就不重要了。在某些实施方案中,其中供者未对接受者中存在的或将被递送至接受者的抗原免疫,cd4+t细胞辅助的递送取决于供者cd4+t细胞对接受者细胞上同种异体hla ii类分子的识别。然后,为了举例说明本发明的这些实施方案的目的,“理想供者”的实例在hla ii类等位基因(特别是hla-drb1、hla-dqb1和hla-dpb1)处完全错配,并在i类等位基因处完全匹配(以使供者细胞在接受者中的存活最大化并使针对i类分子的同种抗体形成最小化)。此外,理想供者与作为同种异体干细胞移植的潜在供者的接受者的一级亲属的非共有hla完全错配。
[0099]
在一种实施方案中,存在用于施用于人类接受者的来源于人类同种异体供者的外周血细胞组合物的同种异体淋巴细胞组合物,该同种异体淋巴细胞组合物包含来自供者的外周血细胞组合物的许多cd4+t细胞和许多自然杀伤细胞,其中(i)供者包含至少一个相对于接受者在供者抗接受者方向上的人类白细胞抗原(hla)ii类等位基因错配,并且该hla ii类等位基因错配位于选自由hla-drb1、hla-dqb1和hla-dpb1组成的组的基因处,(ii)接受者不具有对供者的人类白细胞抗原有反应的可检测抗体,(iii)同种异体淋巴细胞组合物中的cd4+t细胞数量与外周血细胞组合物中的cd4+t细胞数量相差小于约50%。(包括但不限于小于约50%,小于约40%,优选地小于约20%,更优选地小于约10%)。
[0100]
还提供了治疗人类受试者中的疾病或状况的方法,包括施用淋巴减少(在本发明这方面的一些实施方案中,期望提供淋巴减少非淋巴消融治疗,以促进施用的淋巴细胞组合物的稳态扩增和分化;在其他实施方案中,期望该治疗也是骨髓减少的,即,抑制或耗尽抑制性骨髓群体,包括骨髓来源的抑制细胞、肿瘤相关巨噬细胞和或n2中性粒细胞)非淋巴消融治疗,以诱导受试者中的短暂性淋巴细胞减少;并随后向受试者施用来源于人类同种异体供者的外周血细胞组合物的第一同种异体淋巴细胞组合物,该第一同种异体淋巴细胞组合物包含来自供者的外周血细胞组合物的许多cd4+t细胞和许多自然杀伤细胞,其中(i)供者包含至少一个相对于受试者在供者抗受试者方向上的人类白细胞抗原(hla)ii类等位基因错配,并且该hla ii类等位基因错配位于选自由hla-drb1、hla-dqb1和hla-dpb1组成的组的基因处,(ii)受试者不具有对供者的人类白细胞抗原有反应的可检测抗体,(iii)第一同种异体淋巴细胞组合物中的cd4+t细胞的数量与外周血细胞组合物中的cd4+t细胞的数量相差小于约50%,(iv)基于以千克(kg)计的受试者的理想体重的供者cd4+t细胞的数量在约1
×
105个cd4+t细胞/kg和1
×
109个cd4+t细胞/kg之间,(v)第一同种异体淋巴细胞组合物中的自然杀伤细胞的数量小于或等于外周血细胞组合物中的自然杀伤细胞的数量,并且(vi)第一同种异体淋巴细胞组合物具有相对于外周血细胞组合物少至少一个数量级的cd8+t细胞。
[0101]
尽管不希望受到特定理论的束缚,输注的cd4+细胞向其他细胞类型,主要是受试者的cd8+细胞、巨噬细胞和/或抗原提呈细胞提供信号,这些信号增强受试者中这些细胞的细胞毒性功能(耐受受试者的cd4+/耗竭受试者的cd8+);应该举例说明通过这种方法治疗疾病或状况的实例,至少治疗骨髓增生异常综合征。
[0102]
在一方面,提供了用于治疗受试者中的疾病或状况的试剂盒,该试剂盒包含:如本文描述的淋巴细胞组合物,其中受试者是人类接受者;和纳米颗粒组合物,该纳米颗粒组合物包含含有不在人类接受者中存在的抗原的纳米颗粒。在一方面,纳米颗粒还包含细胞因子,例如白细胞介素或干扰素。细胞因子可以是白细胞介素,并选自由以下组成的组:il-2、il-7、il-12和il-15。细胞因子可以是干扰素,例如干扰素γ、干扰素β、干扰素α、干扰素、干扰素τ、干扰素ω、和共有干扰素。
[0103]
纳米颗粒还可以包含选自由以下组成的组的化合物:趋化因子、成像剂、光天线分子、热天线分子和toll样受体配体、促进cd4+t细胞分化为i型(例如产生ifn-γ的)cd4+记忆t细胞的配体、诱导抗原提呈细胞活化的受体的配体(例如抗cd40抗体或适配体)。此外,纳米颗粒可以包含将纳米颗粒靶向肿瘤细胞或抗原提呈细胞的剂。
[0104]
在一方面,在向受试者施用第一同种异体淋巴细胞组合物之后,该方法还包括向受试者施用单克隆抗体/cd4+t细胞表位缀合物。在一方面,在向受试者施用第一同种异体淋巴细胞组合物之后,该方法还包括向受试者施用连续的淋巴减少非淋巴消融治疗,以诱导受试者中的短暂性淋巴细胞减少;并随后向受试者施用来源于另外的人类同种异体供者的另外的外周血细胞组合物的连续的同种异体淋巴细胞组合物,该连续的同种异体淋巴细胞组合物包含来自另外的供者的另外的外周血细胞组合物的许多cd4+t细胞和许多自然杀伤细胞,其中(i)另外的供者包含至少一个相对于受试者在另外的供者抗受试者方向上的人类白细胞抗原(hla)ii类等位基因错配,并且该hla ii类等位基因错配位于选自由hla-drb1、hla-dqb1和hla-dpb1组成的组的基因处,(ii)受试者不具有对另外的供者的人类白
细胞抗原有反应的可检测抗体,(iii)连续的同种异体淋巴细胞组合物中的cd4+t细胞的数量与另外的外周血细胞组合物中的cd4+t细胞的数量相差小于约50%,(iv)基于以千克(kg)计的受试者的理想体重的另外的供者cd4+t细胞的数量在约1
×
105个cd4+t细胞/kg和1
×
109个cd4+t细胞/kg之间,(v)连续的同种异体淋巴细胞组合物中的自然杀伤细胞的数量小于或等于另外的外周血细胞组合物中的自然杀伤细胞的数量,并且(vi)连续的同种异体淋巴细胞组合物具有相对于另外的外周血细胞组合物少至少一个数量级的cd8+t细胞。在向受试者施用第一同种异体淋巴细胞组合物之后,该方法还包括施用阻断t细胞中负信号传导的剂。阻断t细胞中负信号传导的剂选自由以下组成的组:抗pd-1抗体、伊匹单抗、抗pd-l2抗体和pd-1融合蛋白。疾病或状况选自由以下组成的组:癌症、自身免疫性紊乱、器官移植、同种异体移植排斥反应和病毒感染。例如,疾病或状况是癌症,并且癌症是骨髓增生异常综合征。
[0105]
在一种实施方案中,本发明提供了一种制备用于向人类接受者施用的同种异体淋巴细胞组合物的方法,包括:提供来自与接受者同种异体的人类供者的外周血细胞组合物,该外周血细胞组合物包含许多cd4+t细胞,许多cd8+t细胞和许多自然杀伤细胞,其中(i)供者具有针对接受者中存在的抗原的cd4+t细胞免疫,(ii)供者包含相对于接受者的至少一个人类白细胞抗原(hla)ii类等位基因匹配,并且该hla ii类等位基因匹配位于选自由hla-drb1、hla-dqb1和hla-dpb1组成的组的基因处,并且(iii)接受者不具有与供者的人类白细胞抗原反应的可检测抗体;以及通过将外周血细胞组合物中的cd8+t细胞的数量减少至少一个数量级来从外周血细胞组合物制备同种异体淋巴细胞组合物,其中(a)同种异体淋巴细胞组合物中的cd4+t细胞的数量与外周血细胞组合物中的cd4+t细胞的数量相差小于约50%,并且(b)同种异体淋巴细胞组合物中的自然杀伤细胞的数量小于或等于外周血细胞组合物中的自然杀伤细胞的数量。
[0106]
在一方面,基于最小化潜在同种异体供者和接受者之间在一个以上hla
ꢀⅱ
类等位基因处的错配,从一个或更多个潜在同种异体供者中选择潜在同种异体供者,并选择潜在同种异体供者作为供者。基于最小化潜在同种异体供者和接受者之间在一个或更多个hla i类等位基因处的错配,从一个或更多个潜在同种异体供者中选择潜在同种异体供者,并选择潜在同种异体供者作为供者。
[0107]
在一方面,接受者中存在的供者对其具有免疫力的的抗原是病毒抗原,并且该病毒抗原选自由以下组成的组:人乳头瘤病毒抗原、爱泼斯坦巴尔病毒抗原、卡波西肉瘤相关疱疹病毒(kshv)抗原、甲型肝炎病毒抗原、乙型肝炎病毒抗原和丙型肝炎病毒抗原。例如,病毒抗原是人乳头瘤病毒抗原,并且人乳头瘤病毒抗原是e6抗原肽或e7抗原肽。在一方面,同种异体淋巴细胞组合物中的cd4+t细胞的数量与外周血细胞组合物中的cd4+t细胞的数量相差小于约20%。
[0108]
在一种实施方案中,提供了用于施用于人类接受者的来源于人类同种异体供者的外周血细胞组合物的同种异体淋巴细胞组合物,该同种异体淋巴细胞组合物包含来自供者的外周血细胞组合物的许多cd4+t细胞和许多自然杀伤细胞,其中(i)供者具有针对接受者中存在的抗原的cd4+t细胞免疫,(ii)供者包含至少一个相对于接受者的人类白细胞抗原(hla)ii类等位基因匹配,并且该hla ii类等位基因匹配位于选自由hla-drb1、hla-dqb1和hla-dpb1组成的组的基因处,(iii)接受者不具有对供者的人类白细胞抗原有反应的可检
测抗体,(iv)同种异体淋巴细胞组合物中的cd4+t细胞的数量与外周血细胞组合物中的cd4+t细胞的数量相差小于约50%,基于以千克(kg)计的接受者的理想体重的供者cd4+t细胞的数量在约1
×
105个cd4+t细胞/kg和1
×
109个cd4+t细胞/kg之间,同种异体淋巴细胞组合物中的自然杀伤细胞的数量小于或等于外周血细胞组合物中的自然杀伤细胞的数量,并且同种异体淋巴细胞组合物具有相对于外周血细胞组合物少至少一个数量级的cd8+t细胞。
[0109]
本发明提供了用于施用于人类接受者的来源于人类同种异体供者的外周血细胞组合物的同种异体淋巴细胞组合物,该同种异体淋巴细胞组合物包含来自供者的外周血细胞组合物的许多cd4+t细胞和许多自然杀伤细胞,其中(i)供者具有针对不在接受者中存在的抗原的cd4+t细胞免疫,(ii)供者包含至少一个相对于接受者的人类白细胞抗原(hla)ii类等位基因匹配,并且该hla ii类等位基因匹配位于选自由hla-drb1、hla-dqb1和hla-dpb1组成的组的基因处,(iii)接受者不具有对供者的人类白细胞抗原有反应的可检测抗体,(iv)同种异体淋巴细胞组合物中的cd4+t细胞的数量与外周血细胞组合物中的cd4+t细胞的数量相差小于约50%,(v)基于以千克(kg)计的接受者的理想体重的供者cd4+t细胞的数量在约1
×
105个cd4+t细胞/kg和1
×
109个cd4+t细胞/kg之间,(vi)同种异体淋巴细胞组合物中的自然杀伤细胞的数量小于或等于外周血细胞组合物中的自然杀伤细胞的数量,并且(vii)同种异体淋巴细胞组合物具有相对于外周血细胞组合物少至少一个数量级的cd8+t细胞。
[0110]
本发明提供了治疗人类受试者中的疾病或状况的方法,包括向受试者施用来源于人类同种异体供者的外周血细胞组合物的同种异体淋巴细胞组合物,该同种异体淋巴细胞组合物包含来自供者的外周血细胞组合物的许多cd4+t细胞和许多自然杀伤细胞,其中(i)供者具有针对受试者中存在的抗原的cd4+t细胞免疫,(ii)供者包含至少一个相对于受试者的人类白细胞抗原(hla)ii类等位基因匹配,并且该hla ii类等位基因匹配位于选自由hla-drb1、hla-dqb1和hla-dpb1组成的组的基因处,(iii)受试者不具有对供者的人类白细胞抗原有反应的可检测抗体,(iv)同种异体淋巴细胞组合物中的cd4+t细胞的数量与外周血细胞组合物中的cd4+t细胞的数量相差小于约50%,(v)基于以千克(kg)计的受试者的理想体重的供者cd4+t细胞的数量在约1
×
105个cd4+t细胞/kg和1
×
109个cd4+t细胞/kg之间,(vi)同种异体淋巴细胞组合物中的自然杀伤细胞的数量小于或等于外周血细胞组合物中的自然杀伤细胞的数量,并且(vii)同种异体淋巴细胞组合物具有相对于外周血细胞组合物少至少一个数量级的cd8+t细胞。
[0111]
在本文描述的本发明的方法中,任选地,在向受试者施用同种异体淋巴细胞组合物之前,该方法还包括施用治疗以耗尽或抑制骨髓来源的抑制细胞。耗尽或抑制骨髓来源的抑制细胞的治疗可包括施用选自由以下组成的组的药物:例如达沙替尼、5-氟尿嘧啶、泰索帝、氯膦酸盐和吉西他滨。任选地,在向受试者施用同种异体淋巴细胞组合物之前,该方法还包括施用治疗以耗尽或抑制肿瘤相关巨噬细胞。任选地,在向受试者施用同种异体淋巴细胞组合物之前,该方法还包括施用治疗以耗尽调节性t细胞。耗尽调节性t细胞的治疗可包括施用选自由以下组成的组的药物:环磷酰胺、艾代拉里(idelalisib)、地尼白介素-毒素连接物和达利珠单抗。
[0112]
在另一种实施方案,本发明提供了治疗人类受试者中的疾病或状况的方法,包括将纳米颗粒组合物注射到肿瘤中(纳米颗粒可以注射到受试者中或输注到受试者中,其中
纳米颗粒还包含靶向剂,并且该靶向剂与靶细胞,诸如分散/非定位的赘生物(例如淋巴瘤或白血病)结合,在这种情况下直接注射到所有可能的部位是不实际或不可行的),其中纳米颗粒组合物含有包含不在受试者中存在的抗原的纳米颗粒,从而将抗原引入受试者中;向受试者施用来源于人类同种异体供者的外周血细胞组合物的同种异体淋巴细胞组合物,该同种异施体淋巴细胞组合物包含来自供者的外周血细胞组合物的许多cd4+t细胞和许多自然杀伤细胞,其中(i)供者具有针对抗原的cd4+t细胞免疫,(ii)供者包含至少一个相对于受试者的人类白细胞抗原(hla)ii类等位基因匹配,并且该hla ii类等位基因匹配位于选自由hla-drb1、hla-dqb1和hla-dpb1组成的组的基因处,(iii)受试者不具有对供者的人类白细胞抗原有反应的可检测抗体,(iv)同种异体淋巴细胞组合物中的cd4+t细胞的数量与外周血细胞组合物中的cd4+t细胞的数量相差小于约50%,(v)基于以千克(kg)计的受试者的理想体重的供者cd4+t细胞的数量在约1
×
105个cd4+t细胞/kg和1
×
109个cd4+t细胞/kg之间,(vi)同种异体淋巴细胞组合物中的自然杀伤细胞的数量小于或等于外周血细胞组合物中的自然杀伤细胞的数量,并且(vii)同种异体淋巴细胞组合物具有相对于外周血细胞组合物少至少一个数量级的cd8+t细胞。在一方面,抗原是非人类的动物抗原,并且该非人类的动物抗原是匙孔血蓝蛋白抗原。在另一方面,抗原是病毒抗原,并且该病毒抗原选自由以下组成的组:人乳头瘤病毒抗原、爱泼斯坦巴尔病毒抗原、卡波西肉瘤相关疱疹病毒(kshv)抗原、甲型肝炎病毒抗原、乙型肝炎病毒抗原和丙型肝炎病毒抗原。
[0113]
以下实施例旨在说明但不限制本发明。
实施例
[0114]
骨髓增生异常综合征(mds)是一组多样化的恶性干细胞紊乱,其特征是血细胞中的发育不良和无效的骨髓产生以及转化为急性白血病的可变风险。这些紊乱可能是新发的(develop de novo),或在暴露于潜在致突变化学疗法后数年出现。
[0115]
今年,美国将诊断出大约12,000-20,000例mds新病例,其中中位发病年龄在60岁和72岁之间。骨髓增生异常综合征目前的治疗结果令人失望。年龄、表现状态和疾病风险类别(如由国际预后评分系统(international prognostic scoring system)(ipss)确定的)通常决定治疗方式的选择。年龄《60岁、具有良好或极好的表现状态并且属于ipss中间-2或高风险类别的患者,将主要考虑高强度疗法,因为这些ipss类别分别赋予1.2年和0.4年的中位存活期。高强度疗法被定义为需要住院的治疗,包括强化联合的化学疗法和造血细胞移植。
[0116]
属于低或中间-1类的患者通常会考虑低强度疗法。这些包括可以在门诊施用的治疗,诸如造血生长因子、分化诱导剂、生物应答调节剂和低强度化学疗法。表现状态不佳的患者将被考虑支持性护理或低强度疗法。
[0117]
实施例1-ide设备
[0118]
本试验中使用的研究媒介是具有cd8试剂的clinimacs系统,该系统是用于从人类血液制品中富集或耗尽cd8+t细胞的医疗设备。意图用于选择cd8+细胞的系统包括四个主要组成部分:1)cd8试剂——与针对人cd8的鼠抗体连接的胶体超顺磁性铁-葡聚糖珠;2)clinimacsplus仪器——处理血液样品(细
胞制品)的软件控制的仪器;3)管组(标准或ls)——单次使用、无菌、一次性的管组,其具有两个专有的细胞选择柱;4)pbs/edta缓冲液——无菌、等渗磷酸盐缓冲的1mm edta盐水溶液,用作体外制备血细胞的外部洗涤和运输液。该系统利用磁细胞分选(用于分离许多细胞类型的强大工具)选择性地富集或耗尽感兴趣的细胞群体。在这种情况下,cd8+t细胞用连接到超顺磁颗粒的单克隆抗体标记,然后通过穿过clinimacs系统从血液制品中耗尽,该系统结合了强永磁体和具有铁磁基质的分离柱,以去除标记的细胞。治疗剂cd8+t细胞耗尽的血细胞从设备中出来,并且不意图包含设备的任何组分。
[0119]
实施例2-短暂植入供者淋巴细胞诱导临床肿瘤应答
[0120]
到目前为止,只有两种疗法能够延长mds患者的存活期。第一种,同种异体bmt,已经实现了一些长期的治愈,以及延缓疾病的进展。由于年龄、供者可用性和共病,这种疗法只适用于一小部分受影响的患者。第二种是甲基转移酶抑制剂,5-阿扎胞苷。与单独的支持性护理相比,这种疗法已被证明可以使中位存活期延长7个月。一些mds患者对免疫抑制方案,诸如环孢菌素、抗胸腺细胞球蛋白(atg)或类固醇有响应,并且血细胞计数(blood count)持续增加。这一发现类似于再生障碍性贫血,其中免疫抑制处理自身免疫组分,导致血细胞减少。特异性靶向免疫系统的剂获得的有利结果表明mds是一种易受免疫调节影响的疾病。atg、环孢菌素和类固醇的益处的一个潜在解释是,这些药物通过选择性抑制或杀死抑制抗肿瘤免疫的淋巴细胞暴露(unmask)内源性抗肿瘤免疫应答的活性。此外,存在针对mds的隐蔽性内源性免疫应答的潜在证据还见于非骨髓消融、部分hla错配(半相合)同种异体骨髓移植试验中,在该试验中五名患者尽管发生了移植物排斥,但仍经历了疾病应答。所有五名患者的骨髓母细胞(bone marrow blast)百分率至少有短暂的降低,并且五名患者中的三名变得不依赖输注,而他们中的每一名在移植前都依赖红细胞+/-血小板输注。表1表明,尽管在bmt后第30天不存在供者细胞植入,但五名患者中至少有三名在bmt后具有持续至少六个月的骨髓母细胞减少。
[0121]
表1
[0122][0123]
图1显示了同样五名患者在bmt后的血细胞比容,其中锯齿状部分反映了输注的效果。五名患者中有三名变得不依赖输注,其中患者#1保持形态学和血液系统缓解(remission)至少三年。更有趣的是,患者#2表现出延迟的血液系统应答,在bmt后四个月和记录到移植物排斥后三个月变得不依赖输注。鉴于mds对免疫治疗的敏感性,提出了通过短暂植入供者淋巴细胞提供的免疫扰动重新唤醒内源性(即宿主来源的)抗肿瘤免疫应答的
可能性。这种假定的机制,即移植物排斥后内源性抗肿瘤应答的觉醒,也可以解释在没有调节或仅100cgy全身辐照后接受白细胞输注的患者中白血病缓解的诱导。测试了在短暂植入供者淋巴细胞输注(dli)可以诱导小鼠模型中来自宿主t细胞的抗肿瘤免疫应答的假设。balb/c x c57bl/6f1小鼠在第-1天用cy治疗,并且在第0天它们接受了不与其他一起、与单独的半相合dli一起、与单独的自体肿瘤细胞疫苗一起、或与dli+疫苗一起的106个a20淋巴瘤细胞(balb/c来源的)iv。与在cy调节后未接受治疗或接受单独的疫苗的动物相比,用cy调节然后用单独的dli或dli+疫苗治疗的动物存活得显著更长,其中分别在5只和4只动物中实现了明显治愈(图2)。在dli后》100天进行测试时,九只治愈的动物中没有一只具有任何可检测到的供者嵌合,这表明供者t细胞被排斥。
[0124]
这些结果表明,cy随后部分mhc错配的dli的联合诱导了显著的抗肿瘤效应。为了表征供者cd4+t细胞和cd8+t细胞在抗肿瘤效应中的作用,在cy+疫苗+5000万个错配的脾细胞的接受者中重复了这项实验,这些脾细胞或者未经处理,或者耗尽cd4+t细胞、耗尽cd8+t细胞,或者两者都耗尽。在这个实验中,全脾dli的接受者全部在第20天之前死于gvhd(图3a)。相比之下,接受疫苗加cd8+t细胞耗尽脾细胞的小鼠比接受疫苗加泛t细胞耗尽脾细胞的小鼠存活得显著更长(p=0.04),表明cd8+t细胞耗尽消除了致死性gvhd而不消除抗肿瘤免疫。为了理解为什么耗尽来自同种异体dli的cd8+t细胞消除了gvhd,研究了用cy调节然后输注错配的脾细胞的小鼠中供者细胞的存活,这些脾细胞或者未经处理,或者耗尽了任一种t细胞亚群或两种t细胞亚群都耗尽。有趣的是,cd8+t细胞耗尽的脾细胞仅短暂植入,其中供者cd4+t细胞嵌合在dli后7天达到峰值,并且到21天下降到无法检测到的水平(图3b)。相反,在所有接受含有cd8+t细胞的dli的小鼠中,看到供者细胞的持续植入,并且这些动物中的大多数最终死于gvhd。总之,动物研究表明cy然后cd8+t细胞耗尽的dli诱导供者细胞的短暂植入和显著的抗肿瘤效应,而不诱导急性gvhd。更近期地,发现在“cy+dli”之前的宿主cd8+t细胞的耗尽显著降低治疗效果,强烈暗示宿主cd8+t细胞是抗肿瘤效应的关键介质。
[0125]
实施例3-cd8+t细胞耗尽的同种异体干细胞或淋巴细胞输注的临床经验
[0126]
没有用cy随后输注来自半相合供者的cd8+t细胞耗尽的pbc治疗的患者的报告,因此无法提供初步的安全性数据。然而,有接受cd8+t细胞耗尽的移植物的经历同种异体bmt的患者或接受cd8+t细胞耗尽的pbmc输注的在同种异体bmt后复发的患者的报告。cd8+t细胞耗尽的目的是减少gvhd的发生,同时保留输注的抗白血病效应。关于gvhd,研究没有得出结论性的答案,其中一些显示可能的益处,而另一些显示没有。有趣的是,输注cd8+t细胞耗尽的dli诱导了内源性cd8+t细胞的活化,这一发现与cd8+t细胞耗尽的dli能有效唤醒宿主cd8+t细胞抗癌应答的假设相一致。
[0127]
两项其他研究的结果与提议的临床试验的安全性考虑密切相关。在第一项研究中,患有各种血液系统恶性肿瘤的患者接受了来自无关供者的骨髓,这些无关供者针对一个hla-dr等位基因或一个hla i类(hla-a或hla-b)抗原错配。患者接受了含有滴定剂量的cd8+t细胞的cd4+t细胞耗尽的移植物。主要发现是,尽管进行骨髓消融调节,10名接受了含有《3.1
×
106个cd8+t细胞/kg接受者体重的移植物的患者中的6名发生了移植物排斥,但接受了》3.1
×
106个cd8+t细胞/kg的15名患者中没有一个发生了移植物排斥。因此,即使在骨髓消融调节后,cd8+t细胞耗尽(其消除移植物诱导的再生障碍和gvhd的风险)显著增加了
移植物排斥的风险。
[0128]
在第二项研究中,患者接受了t细胞耗尽、半相合的外周血干细胞(pbsc;n=15)或pbsc加骨髓移植物(n=28),分别包含平均2.7
×
104或3.5
×
104个cd3+t细胞/kg,这转化为大约1-1.5
×
104个/kg的cd8+t细胞剂量。为了在t细胞耗尽的情况下促进植入,患者被强化地调节,并接受了“超大剂量(mega-dose)”干细胞移植物,对于接受仅pbsc的接受者和接受pbsc加骨髓的接受者,干细胞移植物分别包含平均14.0
×
106或10.6
×
106个cd34+细胞/kg。鉴于低t细胞含量,未施用gvhd预防。所有43名患者中均发生植入,并且无一名患者因移植手术(transplantation procedure)而经历急性或慢性gvhd。这些数据表明,即使在接受骨髓消融调节的患者中发生持续植入时,含有《104个cd8+t细胞/kg的半相合移植物也不太可能导致gvhd。由于设备通常实现》2log的cd8+t细胞耗尽,试验中cd8+t细胞耗尽的pbc的起始剂量将可能包含少于104个cd8+t细胞/kg。因此,即使发生了持续的植入,接受该剂量的患者也将不会植入或经历gvhd。
[0129]
实施例4-使用具有clinimacs-cd8试剂的clinimacs系统的cd8耗尽
[0130]
对于本试验,将使用具有clinimacs_cd8试剂(miltenyi biotec,woburn,ma)的clinimacs_系统耗尽cd8+t细胞。进行了三次验证运行,第一次使用白细胞单采术制品,并且最后两次使用静脉切开术样本。来自最后一次耗尽的流式细胞术结果在图4中显示,表明极好的cd8+t细胞耗尽,cd8+t细胞从总细胞的8.40%耗尽至0.03%,以及相应的cd4+t细胞和cd16+或cd56+nk细胞的富集。下表表明所有三种制品都符合方案标准,即cd8+t细胞数量小于cd4+t细胞数量的3.2%。如果制品#2和制品#3被用于向70kg理想体重的接受者递送106个cd4+t细胞/kg的剂量,它们将分别包含2.6
×
103和7.7
×
102个cd8+t细胞/kg ibw,剂量远低于植入或gvhd诱导的阈值。相比之下,尽管存在移植物排斥反应,但有响应的五名患者接受包含中位数为1.43
×
107个cd4+t细胞/kg(范围0.84-3.14
×
107个/kg)和1.86
×
107个cd8+t细胞/kg(范围0.43-2.16
×
107个/kg)的骨髓。因此,mds患者能够排斥含有如此多t细胞的半相合细胞输注。
[0131]
表2-cd8耗尽的细胞制品验证结果
[0132][0133]
实施例5-预测对疗法的响应的相关性实验室研究
[0134]
鉴于免疫抑制疗法(诸如抗胸腺细胞球蛋白)在mds患者中的潜在毒性,许多研究人员努力鉴定与对疗法的响应有相关性的患者特征。这些预测疾病应答的特征包括:细胞减少的(hypocellular)骨髓、异常t细胞受体库(通过谱型分析按照t细胞受体β链可变区cdr3大小)、存在具有阵发性睡眠性血红蛋白尿(pnh)表型特征的细胞、hladr15的表达、8号染色体三体、较年轻的年龄和较短的输注史。因此,一个目标是确定预测对免疫抑制疗法的响应的特征是否也可以预测对cy+cd8+t细胞耗尽的半相合dli的响应。参与这项试验的患
者在治疗前后都将被检查t细胞受体β链可变区的多样性。将对所有患者常规进行细胞遗传学和hla分型。
[0135]
最近的研究揭示了供者自然杀伤细胞同种异体反应性在防止半相合干细胞移植后急性白血病复发中的作用。更近期地,供者来源的同种异体反应性自然杀伤细胞被发现可以防止hla相同的干细胞移植后aml和mds的复发。这些结果强调了有必要用分子和流式细胞术方法两者来表征供者nk细胞上表达的杀伤性免疫球蛋白样受体(又称kir)的库,以便鉴定表达其hla配体在接受者细胞上缺失的kir的供者。
[0136]
实施例6-提议的试验设计的基本原理
[0137]
这个是一个标准的i/ii期试验设计,其寻求在试验的i期部分确定当在环磷酰胺(cy)之后输注时cd8+t细胞耗尽的半相合外周血细胞(cd8-pbc)的最大耐受剂量(mtd),并且然后在试验的ii期部分估计用cy加mtd的cd8-pbc治疗的效力。高剂量cy(》100mg/kg)已被广泛用作用于血液系统恶性肿瘤患者的移植调节的一部分,并且其安全性在该群体,包括患有骨髓增生异常综合征的老年患者(55-66岁)中被充分记录。治疗的最严重的风险(因为它们有导致死亡的潜力)是长期的再生障碍和移植物抗宿主病,这两种疾病都需要供者细胞的持续植入。初始细胞剂量的选择,105个cd4+t细胞/kg和《3.2
×
103个cd8+t细胞/kg,完全基于安全性考虑。具体来说,包含《104个cd8+t细胞/kg的移植物不会引起严重的gvhd,即使在接受致死性调节和移植后没有药理免疫抑制的患者中也是如此。此外,标准骨髓移植物中cd8+t细胞的部分耗尽显著增加了移植物排斥的风险,这是本试验中期望的治疗结果。由于这些原因,认为包含《104个cd8+t细胞/kg的dli制品不太可能引起严重不良事件。
[0138]
最近发表了没有cd8+t细胞耗尽的半相合dli的经验。在ⅰ/ⅱ期试验中,41名复发/难治性恶性肿瘤患者接受100cgy全身辐照的非消融调节,然后被输注1
×
106至2
×
108个半相合cd3+细胞/kg,其中29名患者接受最高的剂量。在较高的剂量水平实现了目标响应。值得注意的是,1
×
108个cd3+细胞/剂量是与响应相关的最小剂量(25%响应率,或8名患者中2名),并且2
×
108个cd3+细胞/剂量(评价的最高的)与最大的响应率(近50%,21名患者中10名)相关。作为原理的证明,所有应答都发生在不存在持续供者嵌合的情况下。在最高剂量的队列中,大多数患者出现短暂的供者嵌合,但在2周内消失,而两名转化为完全供者嵌合的患者中有一名发展为严重的急性gvhd(类固醇响应性,随后发展为致命的脓毒症)。可能继发于细胞因子流的称为“半相合免疫风暴”的急性临床综合征(特征为以下一种或更多种:发热、不适、lft异常、皮疹和腹泻)在较高剂量水平常见,并对类固醇响应灵敏。这项研究表明了这种方法的生物活性和可管理的安全性谱。在该研究中,响应所需的最小cd3+t细胞剂量(未cd8+耗尽)为1
×
108个细胞/kg。
[0139]
实施例7-患者选择
[0140]
患者必须经过病理证实:有骨髓增生异常综合征(mds),ipss评分为int-2或高(使用ipss评分系统)。患者必须是5-阿扎胞苷治疗失败的或者不适合或不耐受5-阿扎胞苷治疗。
[0141]
实施例8-治疗计划
[0142]
所有患者都需要记录详细的病史和身体检查以及对心脏、肝脏和肾脏功能的标准评价。所有患者将在方案登记前不超过一个月进行骨髓抽取和活检,以进行形态学、细胞遗传学(如适用)和流式细胞术(如适用)评价,并在适用的情况下进行其他标准疾病评价(例
如胸部、腹部、骨盆ct)。
[0143]
治疗前评价
[0144]
环磷酰胺将在第-2天和第-1天作为iv输注施用1-2小时(取决于体积)。环磷酰胺的剂量为50mg/kg/天。剂量是根据调整后的理想体重或实际体重(以较少者为准)计算的。体重和身高是直接测量的。根据反映理想“值”的标准表格或等式计算身高的近似权重。
[0145]
环磷酰胺和dli前方案
[0146]
指导患者在环磷酰胺施用前过夜增加液体。在环磷酰胺前2小时开始以3cc/kg/小时iv的生理盐水补水(hydration),然后在环磷酰胺前1小时将速率降低至2cc/kg/小时,并持续到环磷酰胺后8小时。美司钠(mesna)将在环磷酰胺前30分钟和环磷酰胺后3、6和8小时分次iv给药。
[0147]
美司钠剂量将基于所给予的环磷酰胺剂量。美司钠每日总剂量等于环磷酰胺每日总剂量的80%。
[0148]
预防性的抗微生物疗法将于第0天开始,并将遵循机构实践。
[0149]
抗真菌预防将按如下方式施用:氟康唑400mg po或iv qd,从第0天开始并持续到anc》500连续3天(或3天内的2次连续测量)。可以用另一种适当的预防性抗真菌剂替代。卡氏肺孢子菌肺炎(pneumocystis carinii pneumonia,pcp)预防将从第0天开始,并应持续到第60天。对甲氧苄啶/磺胺甲噁唑(bactrim)不耐受的患者将接受氨苯砜或喷他脒作为pcp预防。从第0天到第60天,病毒预防将由伐昔洛韦或阿昔洛韦组成。口服喹诺酮类药物(例如莫西沙星或诺氟沙星)将根据机构偏好施用,直到在dli后连续3天(或3天内的2次连续测量)anc》500。
[0150]
所有患者都将接受使用系统和cd8试剂的耗尽cd8+t细胞的半相合pbc的输注。剂量水平的编号是从最低到最高的细胞剂量。第一队列患者(剂量水平1)将接受cy加包含预期剂量为1
×
105个cd4+t细胞/kg接受者ibw的cd8+t细胞耗尽的半相合pbc(cd8-pbc)。如果满足剂量递增的标准,剂量水平2、2b、3或4的患者将分别接受包含预期剂量为1
×
106、3
×
106、1
×
107、或5
×
107个cd4+t细胞/kg的cd8-pbc。
[0151]
dli剂量计算
[0152]
递送预期剂量的cd4+t细胞的最终(cd8耗尽的)制品的体积计算公式如下:预期体积(ml)=预期cd4+t细胞剂量(个细胞/kg)
×
接受者ibw*(kg)/cd4+t细胞浓度(个细胞/ml)*注意-如果实际体重《理想体重,则使用实际体重。
[0153]
然而,输注的cd8+t细胞总数量不得超过待输注的cd4+t细胞的预期数量(上述等式的分子)的3.2%。如果耗尽的制品中cd4+细胞/cd8+细胞的比率小于31.25(=1/0.032),则将由下式确定待输注制品的体积:如果最终制品的cd4/cd8比率《31.25,则:输注体积(ml)=预期体积
×
(cd4/cd8比率)/31.25。如果耗尽的制品中cd4+细胞/cd8+细胞的比率等于或大于31.25,则待输注制品的体积为预期体积(式1):如果最终制品的cd4/cd8比率》31.25,则:输注体积(ml)=预期体积。
[0154]
输注支持
[0155]
将根据当前的机构建议给予血小板和浓缩红细胞输注。
[0156]
实施例9-疗法的持续时间
[0157]
患者只有一次淋巴细胞输注的资格。这种限制的存在是因为对输注的淋巴细胞的
排斥预计会诱导对供者细胞或甚至其他近亲细胞的记忆性免疫(anamnestic immunity)。患者的外周血将在第60天获得,并测试人抗鼠抗体(hama)和针对供者细胞的细胞毒抗体的存在。
[0158]
随访的持续时间
[0159]
将在dli后对患者进行至少60天以及然后直到死亡或疾病进展的随访,以先发生者为准。因不可接受的不良事件或发展出与治疗相关的不良事件而退出研究的患者将被随访直到不良事件解决或稳定。
[0160]
dli后监测
[0161]
留在研究中的患者将在dli后第14天、第28天、第60天和6个月抽血。通过这些抽血将获得人工分类的cbc。淋巴细胞亚群,包括表达cd4或cd8的细胞百分比,将通过流式细胞术进行分析。在第60天后,只要没有记录的疾病进展,患者将每月进行全血计数和白细胞分类,直到dli后6个月。
[0162]
疾病评估
[0163]
除了上面说明的疾病评估外,将出于研究目的收集作为护理标准执行的另外的疾病评估的结果,直至死亡或疾病进展,以先发生者为准。
[0164]
实施例10-给药延迟/剂量修改
[0165]
环磷酰胺剂量不会被修改。如果cd8+t细胞含量过多,将修改dli剂量。
[0166]
不良事件:清单和报告要求
[0167]
应收集所有急性gvhd患者的以下信息:
[0168]
发病日期(定义为首次活检确认gvhd的日期);在发病时的gvhd评估表,每周一次直到gvhd解决,和第60天的gvhd评估表;初始总体临床等级;最大总体临床等级;iii-iv级急性gvhd的发病日期(如有)。
[0169]
第60天后急性和慢性gvhd的发生和严重程度将在患者6个月的评价中描述。
[0170]
所有ii-iv级急性gvhd的情况都将被描述为不良事件。iii-iv级gvhd将作为严重不良事件报告。
[0171]
dli诱导的再生障碍被定义为中性粒细胞减少(绝对中性粒细胞计数《500/ml),并在60天或更晚有供者嵌合的迹象。所有dli诱导的再生障碍的病例将作为严重不良事件报告。
[0172]
实施例11-药物信息
[0173]
环磷酰胺
[0174]
环磷酰胺商购可得。环磷酰胺是一种烷化剂,主要通过使dna链交联来阻止细胞分裂。环磷酰胺是细胞周期非特异性的。注射用环磷酰胺有以2000mg的小瓶,其用100ml无菌注射用水重构。重构制品的浓度为20mg/ml。计算的剂量将在250ml-500ml的在水中的5%右旋糖中进一步稀释。每一剂将输注1-2小时。(取决于总体积)。
[0175]
环磷酰胺的临床毒性包括脱发、恶心和呕吐、头痛和头晕、出血性膀胱炎、心脏毒性、免疫抑制、骨髓抑制、肺纤维化、肝酶升高和抗利尿激素失调综合征(siadh)。环磷酰胺将由oncology pharmacy配药,并由mead johnson pharmaceuticals生产。
[0176]
美司钠(2-巯基乙磺酸钠)
[0177]
美司钠是一种用于预防由氧磷环类(oxasophosphorines)(环磷酰胺和异环磷酰
胺(ifosphamide))诱导的出血性膀胱炎的预防性药物。它没有固有细胞毒性,并且对化学疗法无拮抗作用。美司钠与氧磷环类产生的尿毒代谢物丙烯醛结合,产生无毒的硫醚,并通过与氧磷环类的4-羟基代谢物结合来减缓丙烯醛的形成速度。
[0178]
美司钠有200mg、400mg和1000mg的小瓶,含有100mg/ml的溶液。每一剂量的美司钠将在50ml生理盐水中进一步稀释,并输注15分钟。美司钠剂量将基于所给予的环磷酰胺剂量。美司钠每日总剂量等于环磷酰胺每日总剂量的80%。在用于泌尿保护的剂量,美司钠实际上是无毒的。然而,可归因于美司钠的不良反应包括恶心和呕吐、腹泻、腹痛、味觉改变、皮疹、荨麻疹、头痛、关节或四肢疼痛、低血压和疲劳。
[0179]
cber ide设备
[0180]
供者的血液将通过稳态条件(无动员)下的外周全血采集(450ml进入cpda-1)或采集外周白细胞的白细胞单采程序采集。每一次白细胞单采采集将在连续流细胞分离器(cobe spectra,gambro)上使用用于淋巴细胞收集的机构标准操作程序进行。在献血前30天内获得外周血绝对cd4+t细胞计数,并估计获得靶cd4+t细胞剂量所需的血液的体积,以确定献血方法,即静脉切开术还是白细胞单采术。由于外周血cd4+t细胞计数的正常范围为0.5-1.5
×
106个/ml,对于剂量水平1-2可能简单的静脉切开术就足够了,对于剂量水平2b可能需要单采血液成分术,但对于剂量水平3和4,将需要白细胞单采术。
[0181]
根据广泛的先前经验,4小时的白细胞单采程序应该足以获得5
×
107个cd4+t细胞/kg接受者ibw。靶采集将至少比所需剂量多30%,以适应耗尽过程中的细胞损失。
[0182]
该制品将在移植物工程实验室(graft engineering laboratory)进行cd8耗尽。所有标准操作程序都将得到遵守。将对制品进行有核细胞计数、cd3、cd4、cd8、cd16和cd56的分析。该制品将储存过夜,并且cd8耗尽将发生在选择系统(miltenyi biotec,auburn,ca)上。在cd8耗尽之前,将首先处理全血制品以制备血沉棕黄层(buffy coat)浓缩物,并且对于主要abo不相容的供者/接受者对,血沉棕黄层浓缩物将使用淋巴细胞分离培养基进一步处理以去除污染的红细胞。然后将处理后的全血制品或单采血液成分术制品浓缩并重新悬浮在补充有0.5%人类血清白蛋白的pbs/edta中。
[0183]
添加与铁-葡聚糖超顺磁性颗粒缀合的鼠单克隆cd8抗体并在室温孵育30分钟。一小瓶抗体将用于处理多达总共40
×
109个白细胞和多达4
×
109个cd8+细胞。多余的抗体将通过洗涤1次去除,并用pbs/edta和白蛋白将制品体积调整到100ml。然后使用无菌一次性管组将其连接到clinimacs选择系统。运行由预先设置的计算机程序启动,该程序控制(i)抗体处理的细胞的流动,(ii)去除残余未结合细胞的洗涤,(iii)去除柱周围的磁场以释放选定的细胞,以及(iv)最终将cd8耗尽的细胞收集到袋中。自完成最初制品浓缩,整个过程大约需要2-6个小时。将分析随后的制品的细胞计数、生存力、cd3、cd4、cd8、cd16和cd56含量。cd4浓度将用于计算患者剂量。计算出的体积将被取出并根据机构标准操作程序准备输注。
[0184]
相关性/特异性研究
[0185]
表型免疫重建
[0186]
在dli后第14天、第28天、第60天和6个月,将使用绝对淋巴细胞计数和流式细胞术确定包括cd4+和cd8+t细胞的淋巴细胞亚群的外周血浓度。
[0187]
通过谱型分析法分析宿主cd8+t细胞库多样性。最近的研究表明,t细胞库的多样性可以通过t细胞受体v_区域谱分型来评估,谱分型评估表达给定v_基因的细胞的cdr3/多
样性/连接区域(vf3
‑‑
d-j
‑‑
cf3)。这个区域赋予t细胞受体的特异性。免疫扫描(immunoscoping)或v_谱分型对评价疗法后的抗肿瘤免疫应答和骨髓移植后的免疫重建非常有用。此外,对mds患者免疫抑制疗法前后的谱型分析揭示了t细胞库的偏向(skewing)随着对治疗的响应而正常化。因此,我们假设mds和可能的cmml患者在治疗前会有偏向的t细胞库,如谱型分析揭示的,dli最初会诱导同种异体反应性t细胞群体,并且响应者最终会获得正常的t细胞库。治疗前的cd8+t细胞将从患者外周血单个核细胞(pbmc)中获得。为了识别患者抗供者反应性t细胞,在细胞分选之前,将来自患者的治疗前pbmc与辐照过的供者pbmc一起培养7天。培养时期允许患者抗供者t细胞克隆扩增。还将在第14天、第28天、第60天和第6个月采集pbmc,并纯化cd8+t细胞。
[0188]
实施例12-增强抗肿瘤效应的nedli模型
[0189]
neoag特异性cd8
+
t细胞耗竭是人类癌症免疫疗法成功的主要障碍。目前克服这一障碍的努力已经指向免疫检查点抑制剂(ci)单独使用或与被设计为改变肿瘤免疫微环境的剂联合使用。迄今为止,这些努力只取得了适度的成功,并因此大多数癌症患者无法从免疫治疗策略中获得益处。cd4
+
t细胞不仅能防止cd8
+
t细胞耗竭,而且它们能够逆转已确立的耗竭,并且从而恢复抗癌免疫应答。cd4
+
t细胞通过抗原提呈细胞(apc)上的cd40分子许可apc为cd8
+
t细胞提供辅助。cd4
+
t细胞辅助是cd8
+
t细胞记忆的产生和防止cd8
+
t细胞耗竭所必需的。重要的是,为了使辅助被递送,cd4
+
和cd8
+
t细胞不必看到相同的抗原,但它们必须看到在相同apc上提呈的抗原。开始出现证据表明cd4辅助可以逆转已确立的耗竭,但生长中的癌症会诱导肿瘤特异性cd4
+
t细胞的耐受性,并且迄今为止,还没有已知的策略逆转cd4
+
t细胞的耐受性以恢复其对cd8
+
t细胞的辅助性功能。针对cd27分子的激动性抗体可以重演cd4
+
t细胞辅助的某些方面,因此可以刺激抗肿瘤免疫,尤其是与ci结合,但它们不太可能逆转已确定的t细胞耗竭对抗晚期癌症。
[0190]
为了逆转癌症中的t细胞耗竭,来自健康供者的mhc同种异体反应性cd4
+
t细胞的输注可以通过一种需要接受者cd8
+
t细胞的机制促进已确立的癌症的消退,尽管输注的细胞最终会被排斥。用病毒抗原给健康的同种异体供者疫苗接种增强非植入供者淋巴细胞输注(nedli)针对表达该抗原的肿瘤的治疗效力,因此可以用来自针对肿瘤新生抗原进行了疫苗接种的健康供者的cd4
+
t细胞来治疗散发性人类癌症。
[0191]
cd4
+
t细胞通过许可apc来逆转cd8
+
t细胞的耗竭。cd4
+
t细胞通过许可apc为cd8
+
t细胞提供辅助,并且cd4
+
t细胞辅助逆转cd8
+
t细胞耗竭,但尚不清楚cd4
+
t细胞是否可以通过许可apc逆转耗竭。nedli的抗肿瘤效应可以通过对供者进行针对cd4新生表位的疫苗接种来增强。供者疫苗接种可以增强同种异体bmt的抗肿瘤效应,并且健康供者cd8
+
t细胞对新生抗原应答强烈,但cd4新生表位难以鉴定。一个已经验证的cd4新生表位,m30将被用来表明对原理的证明,同时鉴定cd4新生表位的技术正在进步。
[0192]
目前可用的癌症的细胞疗法(同种异体血液或骨髓移植、car t细胞或t细胞受体修饰的t细胞、肿瘤浸润淋巴细胞)采用直接杀死癌细胞的淋巴细胞输注。与之相对,nedli的目标是通过接受者抗原提呈细胞(apc)提供辅助性信号来恢复内源性抗肿瘤免疫。短暂植入的cd4
+
t细胞可以逆转neoag特异性cd8
+
t细胞耗竭的假设是全新的。美国专利us9,931,359b2描述了一种选择hla ii类错配供者用于cd8耗尽的非植入供者淋巴细胞输注以恢复内源性抗肿瘤免疫的方法。在本技术中,供者与接受者具有至少一个hlaⅱ类等位基因匹
配,供者已经针对肿瘤或病毒新生抗原进行了疫苗接种,并且然后病毒特异性或肿瘤特异性t细胞进一步离体扩增。
[0193]
移植物抗宿主方向上的mhc ii类错配增强了该疗法的抗肿瘤效应,以确保高频率的同种异体反应性供者记忆cd4
+
t细胞(通过异源免疫,作为记忆而非初始cd4
+
t细胞)可以克服肿瘤诱导的免疫抑制并递送适当的辅助性信号。外源性cd4
+
t细胞辅助可以通过表位扩散恢复针对多个新生表位的cd8
+
t细胞(参见图12),这样靶向的抗原就不必在所有癌细胞中表达。
[0194]
由短暂植入淋巴细胞诱导的疾病应答可以“最好地解释为由短寿命供者细胞发起但由宿主细胞完成的间接过程”。本发明的发现是用环磷酰胺(cy)然后输注cd8
+
细胞耗尽的mhc错配的供者淋巴细胞(cy+cd8-dli)治疗小鼠,在血液肿瘤和实体肿瘤两者的模型中以最小毒性诱导已确立的肿瘤消退,即使供者细胞最终被宿主免疫系统排斥。cy+cd8-dli的最佳抗肿瘤效应需要供者cd4
+
t细胞、宿主cd8
+
t细胞和正常宿主而非肿瘤组织的同种异体抗原表达的存在。重要的是,dli中cd8
+
细胞的耗尽消除了持续供者细胞植入和致死性gvhd的风险,但并未影响抗肿瘤效力。基于这些结果,提出了一个模型(图5),其中同种异体反应性供者cd4
+
t细胞通过交叉提呈肿瘤抗原的apc递送信号来逆转肿瘤特异性接受者cd8
+
t细胞中的耗竭。如图5图示的,所提出的通过输注的同种异体反应性1型(th1)cd4
+
t细胞逆转耗竭的机制。接受者抗原提呈细胞(apc)表面上的主要组织相容性复合物(mhc)ii类同种异体抗原的识别导致同种异体反应性供者cd4+t细胞的活化,并且随后上调活化配体(包括apc上cd40的配体cd154)。cd40的连接诱导apc表面上的分子(包括cd8+t细胞上的cd27的配体cd70)的上调。这种信号级联已被证明是诱导cd8+t细胞记忆所必需的;有人提出,相同的相互作用参与了cd8+t细胞耗竭的逆转和向cd8+记忆t细胞的回复(reversion)。cd4+t细胞分泌的干扰素γ和/或白细胞介素21也可能在逆转t细胞耗竭中发挥作用。
[0195]
尽管nedli能够诱导针对血液系统恶性肿瘤的强力的抗肿瘤效应,但其对实体瘤的作用通常较弱且无治愈性。针对肿瘤特异性抗原对供者进行初免可以增强nedli的抗肿瘤效应。为了验证这一假设,健康的同系或mhc半相合供者进行了针对人乳头瘤病毒e7抗原的疫苗接种,并将来自未耗尽或cd8耗尽的初免的供者的脾细胞输注到14天前接种tc1(表达e7的肺癌)的小鼠体内(图6a)。
[0196]
携带肿瘤的接受者被e7初免的同系供者的未耗尽的dli治愈(图6a,左图),并且治疗效果因cd8耗尽而消除。
[0197]
有趣的是,当使用半相合供者并且供者细胞被排斥时,来自初免的供者的cd8耗尽的dli而不是未耗尽的dli获得了有益效果(图6b,右图)。由于cd8耗尽的同系dli不能延长存活期,我们得出结论,同种异体反应性和e7特异性的cd4
+
t细胞在非植入情况下协同诱导抗肿瘤免疫,并且同种异体反应性cd8
+
t细胞可以通过杀死提供逆转内源性肿瘤特异性cd8
+
t细胞耗竭的信号的(接受者)apc来损害抗肿瘤免疫。
[0198]
然后测试了nedli的抗肿瘤效力是否可以通过用e7肽脉冲的树突状细胞离体刺激初免的t细胞来增强。来自e7初免的cb6 f1供者的脾细胞未耗尽或cd8耗尽,之后与用覆盖hpv16的全长e7蛋白的重叠的十五聚体脉冲的同系cb6 f1或半相合b6c3 f1树突状细胞离体培养1周。培养后,收获细胞并输注到用cy治疗的携带tc1的b6c3 f1小鼠中。图7显示了e7初免的供者细胞与e7肽的离体培养增强了dli的抗肿瘤效力。此外,离体培养供者cd8
+
t细
胞没有引起致死性gvhd。
[0199]
图7中治愈的小鼠没有供者(h-2
d+
)嵌合的迹象,但如通过用e7的免疫显性kb结合肽脉冲的h-2k
b mhc分子的荧光发色物缀合的四聚体染色所证明的,包含扩增的e7特异性cd8
+
t细胞群体(图8b)。这一扩增的e7特异性cd8+t细胞群体显示出记忆(cd127
+
pd-1-)表型(图8f)。治愈的动物抵抗tc1的再次挑战,这引起e7特异性cd8
+
t细胞的进一步克隆扩增(图8c、图8d)及其对pd-1表达的上调(图8g、图8h)。
[0200]
如在图8中显示的,通过用肽脉冲的h-2k-b四聚体染色来确定对e7的免疫显性h-2kb限制肽有反应的接受者cd8+t细胞的百分比(顶行)。底行显示门控的e7特异性cd8+t细胞上cd127和pd-1的细胞表面表达。记忆性cd8+t细胞为cd127+和pd-1
低
;活化的t细胞是cd127+pd-1
高
,并且耗竭的t细胞是cd127-和pd-1
高
。
[0201]
将e7肽与治愈动物的cd8耗尽的淋巴细胞(图7中的空心三角形)一起培养揭示了扩增的分泌ifn-γ的cd4
+
t细胞群体(图9a和图9b)。与e7肽一起培养的初始cd4
+
t细胞还产生ifn-γ(图9a和图9b),提高了用于癌症过继免疫治疗的neoag特异性th1细胞可以从健康、未疫苗接种的供者离体扩增的可能性,从而减轻对供者安全的担忧。
[0202]
如图9图示的,测量了用未脉冲的b6 x c3h f1树突状细胞(a)或用e7肽脉冲的dc(b、c)刺激五天后,来自未治疗的b6 x c3h f1小鼠(未经处理的;a、b)或通过非植入供者淋巴细胞输注治愈的小鼠(c)的cd4
+
t细胞的细胞内干扰素γ(ifnγ)和肿瘤坏死因子α染色。图d显示通过elispot测定法的相同细胞的ifn分泌。
[0203]
如图10图示的,携带tc1的b6 x c3h f1小鼠通过环磷酰胺加cd8耗尽的淋巴细胞治愈,这些淋巴细胞取自e7疫苗接种的供者,并用e7肽离体扩增。淋巴细胞输注后300天,来自治愈小鼠的脾细胞中的cd8
+
细胞被耗尽,与e7肽培养一周,并且(每个接受者有2000万个细胞投入培养)被转移到一天前用环磷酰胺治疗的携带tc1的balb/c x b6 f1小鼠中。或者,携带tc1的balb/c x b6 f1小鼠接受来自未经处理的b6 x c3h f1供者的脾细胞,这些脾细胞耗尽了cd8
+
细胞并在过继转移前与e7肽培养一周。存活率在图10b中显示。
[0204]
来自被nedli治愈的b6c3小鼠的离体培养的、cd8耗尽的脾细胞本身能够延长小鼠的存活期,尽管同样被携带肿瘤的cb6 f1接受者排斥(图10b)。因此,通过非植入供者淋巴细胞输注治愈的小鼠含有当作为nedli给予时,能够连续转移抗肿瘤免疫的cd4+t细胞。
[0205]
人乳头瘤病毒(hpv)与几种人类癌症相关,包括口咽、子宫颈、阴茎和肛门的癌症。已发现该病毒能够通过两种病毒抗原e6和e7的细胞内表达来转化上皮细胞。e6使p53肿瘤抑制蛋白失活,并且e7使视网膜母细胞瘤蛋白失活,这两种蛋白都密切参与细胞周期的控制。转化的细胞不再受生长控制,并且e6和e7蛋白对于进展为恶性肿瘤至关重要。
[0206]
免疫系统能够对hpv做出反应并消除hpv。暴露于致癌毒株(通常是hpv16或hpv18)的个体是否消除病毒或成为慢性感染的一个关键决定因素是t细胞对hpv的应答,更确切地说是cd4
+
t细胞对hpv的应答。产生i型cd4+t细胞应答(包括产生ifnγ)的个体通常消除病毒,而未能产生这种i型应答的个体可能会成为慢性感染的并容易发生恶性转化。研究性疫苗现在可用于产生针对hpv16和hpv18的e6和e7抗原的应答。
[0207]
在动物模型中,发现当供者和接受者的主要组织相容性复合体(mhc)的所有基因都匹配时,可以通过对供者进行针对hpv e7的疫苗接种并将疫苗接种的供者cd4
+
和cd8
+
t细胞转移给接受者来转移抗肿瘤免疫(图6a,左图),而当供者和接受者mhc半相合时,可以通
过对供者进行针对hpv e7的疫苗接种并将疫苗接种的cd4
+
t细胞而不是疫苗接种的cd8
+
t细胞转移给接受者来转移抗肿瘤免疫(图6b,右图)。来自进行了针对肿瘤特异性抗原的疫苗接种的供者的nedli的抗肿瘤效力可以通过在输注到接受者之前在体外与肿瘤肽一起培养疫苗接种的t细胞来增强(图7b)。输注疫苗接种并离体刺激的供者cd4
+
t细胞可恢复接受者的免疫应答——治愈的动物现在有cd8
+
t细胞(图8b-图8d)和cd4
+
t细胞(图9c、图9d),它们对肿瘤抗原有应答并排斥肿瘤细胞,即使供者细胞已被清除。这意味着对hpv的免疫力已经有效地从供者转移到接受者。
[0208]
本发明设想了输注来自针对肿瘤特异性抗原(病毒抗原或肿瘤新生抗原)进行疫苗接种的供者的cd8耗尽的细胞,并且这些细胞与来自病毒或新生抗原的肽一起培养。或者,本发明设想了输注未免疫供者的用肽脉冲的树突状细胞离体刺激的cd8耗尽的细胞以刺激病毒特异性或新生抗原特异性cd4+t细胞。本发明还设想了建立含有来自不同人类白细胞抗原(hla)类型供者的hpv初免的cd4+t细胞的细胞库。作为一个实例,下表显示了10个细胞系的库,其中每个细胞系独特地表达十个最常见的hla ii类等位基因之一,足以提供用于95.7%的美国高加索裔(caucasian)群体的治疗剂。作为实例,hla ii类分子包括hla-drb1、hla-dpb1和hla-dqb1。
[0209][0210]
nedli的抗肿瘤效力是否可以通过增加输注中neoag-特异性cd4
+
t细胞的频率来增强是研究的重点。由于初步数据显示同种异体反应性和肿瘤特异性cd4
+
t细胞在介导nedli后的抗肿瘤免疫方面具有明显的协同作用,因此还将测试了供者neoag疫苗接种模型中mhc错配的影响。通过明智地选择供者和接受者品系,应该可以很容易地剖析同种异体反应性对比neoag初免在抗肿瘤效应中的相对作用。
[0211]
实施例13-健康供者的neoag疫苗接种对nedli抗肿瘤效应的影响的表征
[0212]
体内供者疫苗接种相比于离体t细胞扩增的益处以及同种异体反应性和neoag特异性t细胞之间的相互作用。
[0213]
本实验的目标是测试两种增强cd4
+
t细胞辅助对抗肿瘤neoag以增加cd8-nedli对抗“散发性”肿瘤的抗肿瘤效力的方法:1)用cd4
+
t细胞新生表位进行体内疫苗接种,没有或有随后的离体新生表位刺激;或2)使用新生肽+dc连续刺激cd4
+
t细胞进行体外“初免”。实验的设计在下表3中显示。c57bl/6(b6;h-2b)起源的b16-f10黑色素瘤在f1杂种中生长;已鉴定出免疫原性cd4
+
新生表位。
[0214]
1)b6 x c3h(b6c3;h-2
bxk
)f1或mhc半相合balb/c x b6(cb6;h-2
bxk
)f1小鼠将用突
变的由驱动蛋白(kinesin)家族成员18b基因(kif18b)编码的新生表位m30(第2、6组),或对应的野生型肽(第1、5组)进行疫苗接种,疫苗包含100μg合成肽和50μg聚(i:c),在200μl体积的磷酸盐缓冲盐水中注射到侧腹。通过流式细胞术和对干扰素γ(ifnγ)或肿瘤坏死因子α(tnfα)的细胞内细胞因子染色(ics)测试疫苗接种效力和应答细胞的表型(cd4相比于cd8)。疫苗接种后两周,供者小鼠将被安乐死,将脾细胞中的cd8
+
细胞耗尽,并将其输注到在输注前一天用环磷酰胺(cy)治疗的携带b16-f10的b6c3小鼠中。或者,来自免疫的供者的cd8耗尽的细胞将在输注前与m30脉冲的供者dc一起培养5天(第3、7组);
[0215]
2)来自未经处理的b6c3或cb6 f1小鼠的脾细胞将每周二次用m30脉冲的自体树突状细胞加20u/ml il-2刺激(第4、8组)。m30特异性、ifn
′y+
cd4
+
t细胞的频率将在离体刺激之前和之后通过ics测量。neoag特异性cd4
+
t细胞可以使用ifn
′
y捕获测定(miltenyi biotec)进行纯化,并使用包被有抗cd3和抗cd28的珠进一步扩增。
[0216]
表3:
[0217][0218]
*wt=pskpsfqefvdwekvspelnstdqpfl(seq id no:1);
[0219]
mut(m30)=pskpsfqefvdwenvspelnstdqpfl(seq id no:2)
[0220]
基于类似治疗组的过去数据,模拟了用于比较两个治疗组的非参数mann-whitney检验。对于80%的功效,双侧i型误差为0.05,估计每个治疗组14个的样本量就足够了。
[0221]
成功的基准将是显著延长含有扩增(通过疫苗接种或离体培养)的m30特异性cd4
+
t细胞群体的cd8耗尽的细胞的接受者(比较第6、7或8组对于第5组)的存活期,反映了获得cd4
+
t细胞辅助对肿瘤微环境的益处,在那里它们可以重新编程骨髓细胞以使其变得更具免疫刺激性,以及为cd8
+
t细胞提供辅助。供者群体的同种异体反应性可能会增强初免的nedli的抗肿瘤效力(例如比较第6组对于第2组、第7组至第3组,以及第8组对于第4组)。单一的neoag、单剂量的疫苗或疫苗制剂可能不足以增强抗肿瘤免疫。如果没有实现存活期延长,供者将接种mrna五表位疫苗。供者疫苗接种可能会加剧gvhd或细胞因子释放综合征;这可以通过减少供者细胞的剂量来缓解。
[0222]
比较单独或联合的neoag初免的nedli对比免疫检查点阻断(icb)的抗肿瘤效应。最近的一项报道表明,编码cd40配体(参与递送cd4
+
t细胞辅助的关键分子(图5))的重组腺病毒的瘤内递送,优于联合icb和抗pd-1+抗ctla4抗体抗皮下b16-f10并与其具有协同作用。我们预测,neoag初免的nedli将优于icb并与icb具有协同作用。65只b6c3 f1小鼠将各自在第-8天在侧腹皮下接种5
×
105个b16-f10黑色素瘤细胞,并在第0天接受cy 200mg/kg ip。在第1天,每组13只小鼠将接受以下任何一种治疗:1)没有;2)来自未初免的cb6 f1供者的2000万个cd8耗尽的脾细胞(这提供了适度但显著的存活益处);3)来自m30肽-(参见实验
1)疫苗接种的cb6 f1供者的2000万个cd8耗尽的脾细胞;4)每3天腹腔内给予icb和200μg针对小鼠pd-1(克隆rmp1-14)和ctla-4(克隆9h10,均来自bio x cell)单克隆抗体中的每种,共4剂;或5)m30初免的cd8耗尽的cb6 f1脾细胞加icb。每周三次测量每组七只小鼠的肿瘤生长。为了检查nedli对内源性肿瘤特异性cd8
+
t细胞的影响,将表征对gp70(在b16-f10中表达但在c57bl/6小鼠的正常组织中不表达的逆转录病毒蛋白)的p15e肽(kspwfttl)特异的h-2kb限制性cd8
+
t细胞的表型和功能。在治疗的第7天和第14天,每组三只小鼠将被处死,来自脾脏、肿瘤引流淋巴结和分解的肿瘤的单细胞悬液将用负载有p15e肽(mbl international,woburn,ma)和针对cd62l、t
bet
、cd127、cd27和klrg-1的抗体的h-2kb的荧光发色物缀合四聚体染色。肿瘤微环境将通过评估cd11c
+
骨髓细胞的cd80、cd86和pd-l1的表达来表征,并表征foxp3
+
treg与总cd4
+
t细胞的比率,以及cd8/treg的比率。til以及淋巴结和脾细胞将用p15e肽刺激,并且由细胞内细胞因子的ifn-γ、tnf-α和颗粒酶b产生将通过染色和流式细胞术进行表征。neoag初免被预期增强nedli的抗肿瘤功效,这反映在较慢的sc肿瘤生长和增强的肿瘤特异性cd8t细胞的活化。由于有证据表明cd4
+
t细胞辅助逆转了cd8
+
t细胞耗竭,但ici不能,我们预测,neoag初免的nedli将具有优于ici的抗肿瘤效力。
[0223]
混合效应模型分析使用sas(cary,nc)中的mixed程序和westfall和young的参数残差重采样方法,使用glinmix程序将事后检测调整为仅限于感兴趣的比较。流式细胞仪数据将表示为阳性细胞的平均%,或平均荧光强度(mfi)和置信区间。组均值将使用mann-whitney u检验进行比较。
[0224]
实施例14-对来自病毒抗原或neoag初免的供者的nedli如何诱导肿瘤免疫的表征
[0225]
将确定同种异体反应性供者cd4
+
t细胞是否由通过接受者apc向肿瘤特异性接受者cd8
+
t细胞提供信号来增强抗肿瘤免疫。
[0226]
先前的研究表明mhc错配、cd8耗尽的供者淋巴细胞输注的治疗效果需要供者cd4
+
t细胞、接受者cd8
+
t细胞和同种异体抗原在正常宿主组织细胞上的表达。基于这些结果,假设同种异体反应性cd4
+
t细胞通过许可apc来逆转肿瘤特异性cd8
+
t细胞的耗竭。如果是这样,那么被cd4
+
和cd8
+
t细胞识别的抗原必须在同一个apc上提呈。
[0227]
本实验的关键是将同种异体抗原和肿瘤抗原提呈隔离在不同apc上,以防止cd4
+
和cd8
+
t细胞的通讯。这是通过制备双亲骨髓嵌合体(在图11a中描绘;以及下面表4中的第3组和第4组)来实现的,其中一个亲本品系b6(h-2b)可将肿瘤抗原提呈至肿瘤特异性的h-2b限制性cd8
+
t细胞,而另一品系c3h将mhc ii类同种异体抗原(h-2i-ak或i-ek)提呈至非植入供者cd4
+
t细胞。本实验的阳性对照是制备f1亲本嵌合体(图11b;和下面的第5组和第6组),在这种情况下,apc可以将两种同种异体抗原提呈至cd4
+
t细胞和新生抗原特异性cd8
+
t细胞,并因此可以充当这些t细胞进行通讯的桥梁。
[0228]
方法:将向受辐照(950cgy)的b6小鼠移植107个t细胞耗尽(t-)的b6c3 f1骨髓(bm)细胞(第3组和第4组)或5
×
106个t-b6和5
×
106个t-c3h(h-2k)bm细胞的混合物。两个月后,嵌合体将被给予5
×
104个表达e7的tc1(h-2b)肺癌细胞iv。两周后,携带肿瘤的接受者将用cy 200mg/kg ip治疗,随后第二天不接受治疗或用来自e7免疫的供者的离体e7-肽刺激的cd8-脾脏+ln细胞进行治疗(图7中的空心三角形)。不同组的存活将通过时序(log rank)检验进行比较。
[0229]
第1组和第2组为本实验的阴性对照,因为b6 apc交叉提呈肿瘤抗原,但没有同种
异体抗原刺激供者cd4
+
t细胞辅助。在第3组和第4组中mhcⅱ类同种异体抗原和肿瘤抗原在不同的apc上提呈,而在第5组和第6组中在相同的apc上提呈。如果同种异体供者cd4
+
t细胞通过许可apc来增强内源性抗肿瘤免疫,那么第6组小鼠的存活期将明显长于第4组小鼠。如果同种异体反应性供者cd4
+
t细胞在同种异体识别后排他性地通过分泌细胞因子来延长存活期,那么第4组和第6组小鼠的存活期应大致相当,但优于第2组小鼠的存活期。
[0230][0231]
如果外源性辅助通过apc许可逆转耗竭,那么第4组减少到同系cd8耗尽的dli,这是无效的(图6b,左图,空心红色方块)。将仅有cy(图7,黑色菱形)与用肽脉冲的半相合dc(空心红色三角形;类似于第6组)离体刺激的cd8-dli进行比较,得出的风险比为15。对于0.05的双侧i型误差和每组10的样本量,功效=0.999,因此10/组足以检验主要假设。
[0232]
nedli诱导表位扩散能力的评价。
[0233]
肿瘤内克隆异质性和hla或neoag损失可能会限制针对单一肿瘤抗原的免疫疗法(例如car t细胞、抗肿瘤单克隆抗体、肿瘤疫苗)的效力。表位扩散通过扩大对疗法未直接靶向的抗原的响应来抵消肿瘤逃逸。假设cd4
+
t细胞辅助通过逆转neoag特异性cd8
+
t细胞中的耗竭来促进表位扩散(图12)。图12图示了短暂植入的肿瘤特异性cd4
+
t细胞输注后表位扩散的假定机制。抗原“a”特异性cd8+细胞毒t细胞(ctl)杀伤肿瘤细胞,导致在肿瘤微环境中抗原提呈细胞释放和交叉提呈抗原a-e。输注后,i型(th1)cd4+t细胞识别由mhc ii类分子提呈的抗原a,并提供信号以逆转cd8+t细胞中的耗竭(ectl),该细胞识别在同一抗原提呈细胞上mhc i类分子背景下提呈的抗原b、c和e。
[0234]
下面的实验就是为了检验这个假设而设计的。
[0235]
ot-i转基因小鼠(jackson labs)含有编码针对由h-2k
b mhc i类分子提呈的鸡卵白蛋白(ova)肽257-264(siinfekl,seq id no:3)的转基因t细胞受体的cd8
+
t细胞,而ot-ii小鼠(jackson labs)含有对由h-2i-ab提呈的ova肽323339(isqavhaahaeineagr,seq id no:4)特异的cd4
+
t细胞。b16-ova是mhc ii类阴性的b16-f10黑色素瘤系,其工程改造为表达鸡卵白蛋白,因此被ot-i t细胞识别。b6.sjl x c3h(h-2
kxb
,cd45.1
+
),ot-i x c3h(h-2
kxb
,cd45.1-)和ot-ii x balb/c(h-2
dxb
)f1小鼠将通过选育对应的近交品系而产生。81只b6.sjl x c3h f1小鼠各自将接受来自ot-i x c3h f1小鼠的200万个cd8
+
t细胞iv,并且两天后,将在一侧皮下接种5
×
105个b16-f10黑色素瘤细胞,以及在另一侧接种5
×
105个b16-ova细胞。当肿瘤在每侧上生长到大约5mm时,将对3只小鼠实施安乐死以进行以下研究,并
pagqaepdra hynivtfcck cdstlrlcvq sthvdirtle dllmgtlgiv cpicsqkp;seq id no:7)(jpt technologies;)的氨基酸序列的22个重叠15聚体中的每一个脉冲的同系cb6 f1或mhc半相合b6c3 f1树突状细胞一起培养来自疫苗接种的cb6 f1供者的完整或cd8耗尽的脾细胞。e7序列中彼此相邻的十五肽被c末端的11个氨基酸重叠。22个肽中的前4个如下;其余部分可以从上面的序列中推导出来:
[0243]
mhgdtptlheymldl(seq id no:8)
[0244]
tptlheymldlqpet(seq id no:9)
[0245]
heymldlqpettdly(seq id no:10)
[0246]
ldlqpettdlycyeq(seq id no:11)
[0247]
通过pan-dc磁细胞分离法(macs;miltenyi biotec)制备树突状细胞。2000万个供者脾细胞在补充有10%胎牛血清、2-me、25u/ml重组小鼠il-2和20ng/ml重组小鼠gmcsf的10ml rpmi培养基中与2000个肽脉冲的树突状细胞一起培养5天。在5天结束时,洗涤细胞并将其重悬于磷酸盐缓冲盐水中。小鼠接受了与包含在2000万个未耗尽脾细胞中的cd4+t细胞输入对应的离体培养的细胞剂量。
[0248]
治疗方案。在测试过继细胞疗法抗肿瘤效力的实验中,接受者小鼠于第0天经尾静脉静脉内(iv)给予5
×
104个tc1肿瘤细胞,然后在第13天腹膜内给予200mg/kg环磷酰胺,并在第14天给予供者细胞。未受刺激、未耗尽的供者细胞的剂量为2000万个脾细胞/接受者。将未经培养的、cd8耗尽的脾细胞的剂量针对包含与包含在2000万个未耗尽的脾细胞中相同数量的cd4+细胞归一化。将离体培养细胞的剂量针对投入培养的cd4+细胞的数量归一化。作为实例,如果小鼠脾脏包含总共1亿个细胞和2000万个cd4+细胞,如果cd8耗尽的群体包含8800个万细胞和1800万个cd4+细胞,并且如果将8800万个cd8耗尽的脾脏投入培养以进行肽刺激导致包含1000万个细胞和400万个cd4+细胞的刺激的群体,那么dli剂量将是2000万个全脾细胞(包含400万个cd4+细胞)、1956万个cd8耗尽的脾细胞(包含400万个cd4+细胞)或220万个肽刺激的细胞。
[0249]
用时序检验比较不同治疗组小鼠的存活;p值小于0.05被认为是显著的。
[0250]
提议的实验涉及导致包括移植物抗宿主病(gvhd)、抗肿瘤效应和淋巴细胞对治疗性疫苗接种的应答的现象的多种同时发生的细胞相互作用。这些复杂的生物现象根本无法通过淋巴细胞的体外研究来模拟或再现。近交、转基因和f1杂交品系的广泛可用性将使我们能够以临床相关的方式模拟(model)gvhd和癌症的过继免疫疗法。选择特定品系来模拟hla匹配的同胞个体(sibling)或hla半相合非植入供者淋巴细胞输注(nedli)的人类情况。t细胞受体转基因小鼠有助于追踪携带癌症的动物中的内源性肿瘤特异性t细胞。此外,具有限定的导致化学疗法耐药性的基因畸变或表达限定的“肿瘤抗原”的小鼠肿瘤是广泛可用的。这些实验只能在近交系和f1品系广泛可用的物种诸如小鼠或大鼠中进行。
[0251]
nedli和通过背侧尾静脉iv注射肿瘤移植后,密切监测小鼠的任何肿瘤相关发病或细胞输注的毒性,包括gvhd(体重减轻、驼背姿势、皮毛皱折、腹泻、红斑、活动力差)或细胞因子释放综合征(发热、腹泻、体重减轻、不动)。静脉内注射只是暂时的疼痛,可以在没有麻醉的情况下进行。当每组的无瘤存活率在两周观察中没有变化时,研究终止。接种肿瘤后100天的观察通常足以达到这一目的。这与美国兽医协会(avma)的建议是一致的。在肿瘤和/或同种异体淋巴细胞输注后,针对同种异体gvhd或进行性肿瘤的任何发病迹象至少每
周三次监测动物。一旦诊断出肿瘤相关的发病,就会对携带肿瘤的动物实施安乐死以防止过度痛苦。陷入gvhd痛苦的动物也将被安乐死。
[0252]
在小鼠接受皮下注射肿瘤的实验中,当肿瘤的最大二维测量值超过100mm2或肿瘤发展为大面积溃疡时,通常会对小鼠实施安乐死,以先发生者为准。在任何实验中,看起来正在受苦的动物都会被安乐死。可能导致痛苦的实验状况包括产生用力呼吸(labored breathing)的广泛肺转移、伴有显著体重减轻的移植物抗宿主病、腹泻和不动,或肿瘤诱导的麻痹。
[0253]
细胞系:b16-f10黑色素瘤(atcc)、b16-ova黑色素瘤和tc-1肺癌(由johns hopkins university tc wu提供)
[0254]
小鼠细胞系将通过短串联重复序列谱分析(美国国家标准与技术研究所小鼠细胞系认证联盟(national institute of standards and technology mouse cell line authentication consortium)/美国典型培养物保藏中心(american type culture collaboration))进行认证。还将对细胞进行支原体污染测试(genetica cell line testing,burlington,nc)。
[0255]
tc-1中e7癌基因的持续表达将通过使用针对hpv16 e7开放阅读框的引物的pcr来确认。
[0256]
从atcc获得b16-f10后,细胞将被扩增,并且然后每份100万个细胞的100等份将被冷冻保存。每次新的实验将解冻一小瓶冷冻细胞,而不是通过连续传代来维持细胞系。
[0257]
所有用于流式细胞术的抗体将从商业供应商(例如bd biosciences)购买。用于向小鼠施用的抗pd-1和ctla-4的抗体是由bio x cell提供的。抗体特异性将通过对过表达靶蛋白的细胞提取物进行免疫印迹分析来确认。
[0258]
依布替尼由pharmacyclics提供。我们将通过约翰
·
霍普金斯药物发现中心(johns hopkins drug discovery core)的液相色谱-串联质谱来确认身份。
[0259]
脊椎动物:c57bl/6、b6.sjl、balb/c、c3h、b6 x c3h f1、balb/c x b6 f1、ot-i和ot-ii小鼠品系均购自jackson laboratories(bar harbor,me)。供应商提供验证证书。
[0260]
根据本公开内容,本领域技术人员应当理解可以在所公开的特定实施方案中做出许多改变并且仍然获得类似或相似的结果,而不脱离本发明的精神和范围。本发明的范围不受本文所描述的具体实施方案的限制,这些具体实施方案旨在作为本发明各个方面的一种说明,并且功能等同的方法和组分也在本发明的范围内。事实上,除了本文所显示和描述的那些之外,本发明的各种修改对于本领域普通技术人员而言从前述描述将变得显而易见。因此,本发明仅由随后的权利要求限制。
[0261]
参考文献
[0262]
1.ribas a,wolchok jd.cancer immunotherapy using checkpoint blockade.science.2018;359(6382):1350-5.
[0263]
2.wherry ej,kurachi m.molecular and cellular insights into t cell exhaustion.nat rev immunol.2015;15(8):486-99.pmcid:pmc4889009.
[0264]
3.alfei f,zehn d.t cell exhaustion:an epigenetically imprinted phenotypic and functional makeover.trends in molecular medicine.2017;23(9):769-71.
23.pmid:pmc15968284.
[0288]
27.fu h-h,wang j,fu j,jones rj,levitsky h,fuchs ej.tumor antigen vaccination of donors to augment graft-versus-tumor effects after allogeneic bone marrow transplantation with post-transplantation cyclophosphamide.blood.2016;128(22):499-.
[0289]
28.e,toebes m,kelderman s,van buuren mm,yang w,van rooij n,donia m,m-l,lund-johansen f,olweus j,schumacher tn.targeting of cancer neoantigens with donor-derived t cell receptor repertoires.science.2016;352(6291):1337-41.pmcid:pmc27198675.
[0290]
29.kreiter s,vormehr m,van de roemer n,diken m,lower m,diekmann j,boegel s,schrors b,vascotto f,castle jc,tadmor ad,schoenberger sp,huber c,tureci o,sahin u.mutant mhc class ii epitopes drive therapeutic immune responses to cancer.nature.2015;520(7549):692-6.pmcid:26040715.
[0291]
30.ahmadzadeh m,pasetto a,jia l,deniger dc,stevanovic s,robbins pf,rosenberg sa.tumor-infiltrating human cd4(+)regulatory t cells display a distinct tcr repertoire and exhibit tumor and neoantigen reactivity.science immunology.2019;4(31).pmid:30635355.
[0292]
31.adams ab,williams ma,jones tr,shirasugi n,durham mm,kaech sm,wherry ej,onami t,lanier jg,kokko ke,pearson tc,ahmed r,larsen cp.heterologous immunity provides a potent barrier to transplantation tolerance.the journal of clinical investigation.2003;111(12):1887-95.pmcid:pmc161424.
[0293]
32.arina a,schreiber k,binder dc,karrison tg,liu rb,schreiber h.adoptively transferred immune t cells eradicate established tumors despite cancer-induced immune suppression.the journal of immunology.2014;192(3):1286-93.doi:10.4049/jimmunol.1202498.pmcid:pmc4084557.
[0294]
33.lehmann pv,forsthuber t,miller a,sercarz ee.spreading of t-cell autoimmunity to cryptic determinants of an autoantigen.nature.1992;358(6382):155-7.
[0295]
34.o'donnell pv,luznik l,jones rj,vogelsang gb,leffell ms,phelps m,rhubart p,cowan k,piantados s,fuchs ej.nonmyeloablative bone marrow transplantation from partially hla-mismatched related donors using posttransplantation cyclophosphamide.biology of blood and marrow transplantation.2002;8(7):377-86.
[0296]
35.sumner wc,foraker ag.spontaneous regression of human melanoma:clinical and experimental studies.cancer.1960;13:79-81.
[0297]
36.woodruff mf,nolan b.preliminary observations on treatment of advanced cancer by injection of allogeneic spleen cells.lancet.1963;13:426-9.
[0298]
37.slavin s,ackerstein a,or r,shapira m,gesundheit b,askenasy n,
49.pmcid:pmc3795457.
[0308]
47.willimsky g,blankenstein t.sporadic immunogenic tumours avoid destruction by inducing t-cell tolerance.nature.2005;437(7055):141-6.
[0309]
48.castle jc,kreiter s,diekmann j,l+|wer m,van de roemer n,de graaf j,selmi a,diken m,boegel s,paret c,koslowski m,kuhn an,britten cm,huber c,t
ü
reci o,sahin u.exploiting the mutanome for tumor vaccination.cancer research.2012;72(5):1081-91.
[0310]
49.bos r,sherman la.cd4+t-cell help in the tumor milieu is required for recruitment and cytolytic function of cd8+t lymphocytes.cancer research.2010;70(21):8368-77.pmcid:pmc2970736.
[0311]
50.wong sbj,bos r,sherman la.tumor-specific cd4+t cells render the tumor environment permissive for infiltration by low-avidity cd8+t cells.the journal of immunology.2008;180(5):3122-31.
[0312]
51.heusinkveld m,de vos van steenwijk p,goedemans r,ramwadhdoebe th,gorter a,welters mjp,van hall t,van der burg sh.m2 macrophages induced by prostaglandin e2 and il-6 from cervical carcinoma are switched to activated m1 macrophages by cd4+th1 cells.the journal of immunology.2011;187(3):115765.
[0313]
52.feau s,garcia z,arens r,yagita h,borst j,schoenberger sp.the cd4+t-cell help signal is transmitted from apc to cd8+t-cells viainteractions.nat commun.2012;3:948.pmcid:pmc3606886.
[0314]
53.singh m,vianden c,cantwell mj,dai z,xiao z,sharma m,khong h,jaiswal ar,faak f,hailemichael y,janssen lme,bharadwaj u,curran ma,diab a,bassett rl,tweardy dj,hwu p,overwijk ww.intratumoral cd40 activation and checkpoint blockade induces t cell-mediated eradication of melanoma in the brain.nat commun.2017;8(1):1447.pmcid:pmc5682289.
[0315]
54.zeh hj,3rd,perry-lalley d,dudley me,rosenberg sa,yang jc.high avidity ctls for two self-antigens demonstrate superior in vitro and in vivo antitumor efficacy.j immunol.1999;162(2):989-94 pubmed pmid:9916724.
[0316]
55.hayashi h,matsubara h,yokota t,kuwabara i,kanno m,koseki h,isono k,asano t,taniguchi m.molecular cloning and characterization of the gene encoding mouse melanoma antigen by cdna library transfection.j immunol.1992;149(4):1223-9.epub 1992/08/15.pubmed pmid:1380036.
[0317]
56.bachireddy p,hainz u,rooney m,pozdnyakova o,aldridge j,zhang w,liao x,hodi fs,o'connell k,haining wn,goldstein nr,canning cm,soiffer rj,ritz j,hacohen n,alyea ep,kim ht,wu cj.reversal of in situ t cell exhaustion during effective human anti-leukemia responses to donor lymphocyte infusion.blood.2013.pmcid:pmc3938152.
[0318]
57.verbeke g,molenberghs g.linear mixed models for longitudinal data:springer science&business media;2009.isbn 978-0-387-22775-7.
[0319]
58.littell rc,milliken ga,stroup ww,wolfinger rd,schabenberger o.sas for mixed models:sas institute cary,nc;2006.
[0320]
59.westfall ph,young ss.resampling-based multiple testing:examples and methods for p-value adjustment:john wiley&sons;1993.isbn:978-0-471-55761-6.
[0321]
60.liu c,cripe tp,kim m-o.statistical issues in longitudinal data analysis for treatment efficacy studies in the biomedical sciences.molecular therapy:the journal of the american society of gene therapy.2010;18(9):1724-30.pmc2956920.
[0322]
61.jim
é
nez-s
á
nchez a,memon d,pourpe s,veeraraghavan h,li y,vargas ha,gill mb,park kj,zivanovic o,konner j,ricca j,zamarin d,walther t,aghajanian c,wolchok jd,sala e,merghoub t,snyder a,miller ml.heterogeneous tumor-immune microenvironments among differentially growing metastases in an ovarian cancer patient.cell.2017;170(5):927-38.e20.pmcid:pmc5589211.
[0323]
62.mcgranahan n,rosenthal r,hiley ct,rowan aj,watkins tbk,wilson ga,birkbak nj,veeriah s,van loo p,herrero j,swanton c.allele-specific hla loss and immune escape in lung cancer evolution.cell.2017;171(6):1259-71.e11.pmc5720478.
[0324]
63.riaz n,havel jj,makarov v,desrichard a,urba wj,sims js,hodi fs,martin-algarra s,mandal r,sharfman wh,bhatia s,hwu wj,gajewski tf,slingluff cl,jr.,chowell d,kendall sm,chang h,shah r,kuo f,morris lgt,sidhom jw,schneck jp,horak ce,weinhold n,chan ta.tumor and microenvironment evolution during immunotherapy with nivolumab.cell.2017.pubmed pmid:29033130.pmc5685550.
[0325]
64.hogquist ka,jameson sc,heath wr,howard jl,bevan mj,carbone fr.t cell receptor antagonist peptides induce positive selection.cell.1994;76(1):17-27.pmc5685550.
[0326]
65.barnden mj,allison j,heath wr,carbone fr.defective tcr expression in transgenic mice constructed using cdna-based alpha-and beta-chain genes under the control of heterologous regulatory elements.immunol cell biol.1998;76(1):34-40.pmid:9553774.
[0327]
66.cheng w-f,hung c-f,chai c-y,等人tumor-specific immunity and antiangiogenesis generated by a dna vaccine encoding calreticulin linked to a tumor antigen.the journal of clinical investigation 2001;108:669-78.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1