新型淋巴特异性酪氨酸磷酸酶(LYP)抑制剂的制作方法
新型淋巴特异性酪氨酸磷酸酶(lyp)抑制剂
1.政府权利本发明在美国国立卫生研究院(national institutes of health)(nih)依据award no. ro1 ca207288给予的政府资助下完成。政府对本发明享有某些权利。
技术领域
2.本公开涉及新型淋巴特异性酪氨酸磷酸酶(lyp)抑制剂,并涉及制备和使用新型淋巴特异性酪氨酸磷酸酶(lyp)抑制剂的方法。
3.背景这一节介绍可能有助于更好地理解本公开的方面。因此,这些陈述应该从这个角度解读,而不应被理解为承认什么是或不是现有技术。
4.淋巴特异性酪氨酸磷酸酶(lyp)是由ptpn22基因编码的非受体蛋白酪氨酸磷酸酶(ptp)。其是由n端ptp结构域和具有几个富pro基序的非催化c端片段组成的110-kda蛋白。人类遗传学研究表明,ptpn22中的单核苷酸多态性在患有自身免疫性疾病,如1型糖尿病、类风湿性关节炎、系统性红斑狼疮、格雷夫斯病、阿狄森氏病、白癜风、幼年型关节炎、桥本甲状腺炎的患者中经常发生突变。生化研究表明,lyp可能通过t细胞受体(tcr)相关lck和zap-70激酶的去磷酸化来抑制t细胞活化。由于其在tcr信号传导通路调节中的关键作用,lyp最近成为用于治疗范围广泛的自身免疫性疾病的潜在靶点。
5.lyp还被发现是抗肿瘤t细胞反应的关键负调控因子。过继细胞治疗研究证实,缺乏ptpn22的cd8+ t细胞在清除已建立的肿瘤方面表现优越。ptpn22缺乏的主要影响是赋予效应物和记忆表型cd8 + t细胞增强的产生炎性细胞因子和杀死表达低亲和力肿瘤相关抗原的肿瘤的能力。此外,ptpn22的缺乏促进巨噬细胞极化成炎性m1表型,增加树突状细胞中的cd40表达(导致共培养的cd4+ t细胞的更高增殖)。这一证据为靶向t细胞中的lyp以进行癌症免疫治疗提供强有力的理由。
6.因此,鉴于lyp与自身免疫的强关联性,小分子lyp抑制剂可能具有治疗与ptpn22遗传多态性相关的疾病或障碍的治疗价值。此外,lyp的小分子抑制剂的成功开发也将提供一类新型癌症免疫疗法并鼓励开发与lyp抑制剂的新的组合策略。
7.但是,具有最佳效力、选择性和药理性质的lyp抑制剂的设计和合成仍然是具有挑战性的工作。
8.概述本公开涉及新型淋巴特异性酪氨酸磷酸酶(lyp)抑制剂,并涉及制备和使用新型淋巴特异性酪氨酸磷酸酶(lyp)抑制剂的方法。
9.在一个实施方案中,本公开提供式i的化合物:
或其立体异构体、互变异构体、溶剂化物、衍生物、可药用盐,其中:r1和r2独立地代表氢、任选取代的烷基、任选取代的环烷基、任选取代的环烷基烷基、烷基羰基,条件是所述烷基羰基不是甲基羰基、任选取代的环烷基羰基、任选取代的环烷基烷基羰基、任选取代的芳基、任选取代的芳烷基、任选取代的芳基羰基、任选取代的芳烷基羰基、任选取代的烷氧基烷基、任选取代的羟烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂环基羰基、任选取代的杂环基烷基羰基、任选取代的碳环基、任选取代的碳环基烷基、任选取代的氨基、任选取代的烷基-so
2-、任选取代的芳基-so
2-、任选取代的杂环基-so
2-、任选取代的氨基-so
2-,或r1和r2与它们所连接的n原子一起形成任选包含选自氮或氧的第二杂原子的5-10元杂环,并且其中所述杂环任选被取代;r3是h、任选取代的烷基、任选取代的烯基、任选取代的炔基、任选取代的环烷基、任选取代的芳基、任选取代的杂芳基或任选取代的杂环基;r4和r6独立地代表氢、任选取代的烷基、任选取代的环烷基、任选取代的杂环烷基、任选取代的芳基和杂芳基;任选取代的芳烷基或任选取代的杂芳烷基;(r5)n,当n是1或2时,代表1至2个-h、-f、-cl、-br、-i、-cfh2、-cf2h、-cf3、-cn、-oh、-no2、-nh2、-so2ch3、so2nh2、-so2nhch3、任选取代的-co
2-烷基、任选取代的nh(烷基)或n(烷基)2、任选取代的烷基、任选取代的烯基、任选取代的烷氧基、任选取代的s-烷基、任选取代的环烷基、任选取代的杂环、任选取代的芳基或任选取代的杂芳基;x是o或h,其中当x是h时,-c=x-是-ch
2-,并且其中当x是h时,r1和r2中的至少一个是任选取代的芳基羰基,且r1和r2之一可连接r3以形成环;和y是c-r5或n。
10.附图简述图1显示实施例1对lyp的选择性数据,及其对一组16种哺乳动物ptp的抑制活性。选择性分析揭示了实施例1对lyp表现出的选择性是对类似磷酸酶的超过7-10倍。
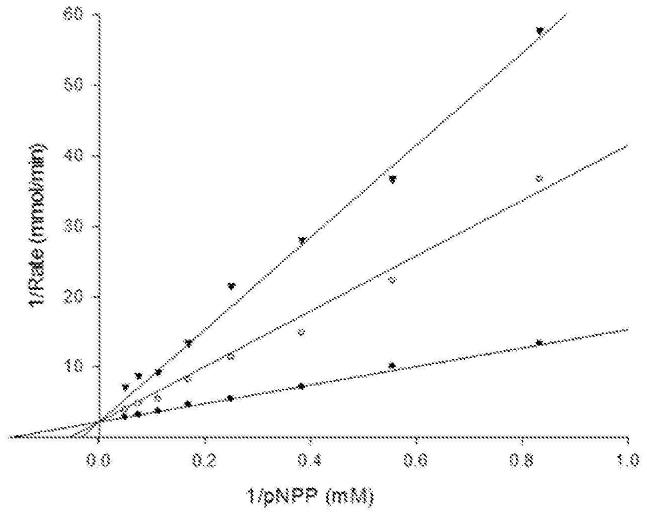
11.图2显示动力学分析,其证明实施例1对lyp的竞争性抑制,ki = 0.50
ꢀ±ꢀ
0.03
ꢀµ
m。
12.图3和图4显示对于三只小鼠,基于从腹腔内注射实施例1时开始0 h、1.0 h、1.5 h、2.0 h、2.5 h、3.0 h、6.0 h和24.0 h的质谱量化的体内药代动力学数据。
13.图5显示实施例1在癌症免疫疗法的小鼠模型中表现出有效的体内活性。
14.详述
为了利于理解本公开的原理,现在参考附图中所示的实施方案,并使用具体词汇对其进行描述。尽管如此,要理解的是,无意由此限制本公开的范围。
15.在本公开中,术语“大约”可允许数值或范围的一定程度的变异性,例如,在规定数值或规定的范围界限的10%内、5%内或1%内。
16.在本公开中,术语“基本”可允许数值或范围的一定程度的变异性,例如,在规定数值或规定的范围界限的90%内、95%内或99%内。
17.本文所用的术语“取代的”是指其中所含的一个或多个氢原子被一个或多个非氢原子替代的官能团。本文所用的术语“官能团”或“取代基”是指可以或已经取代到分子中的基团。取代基或官能团的实例包括但不限于卤素(例如f、cl、br和i);如羟基、烷氧基、芳氧基、芳烷基氧基、氧代(羰基)基团、羧基(包括羧酸、羧酸盐和羧酸酯)之类基团中的氧原子;如巯基基团、烷基硫和芳基硫基团、亚砜基团、砜基团、磺酰基和磺酰胺基团之类基团中的硫原子;如胺、叠氮化物、羟胺、氰基、硝基、n-氧化物、酰肼和烯胺之类基团中的氮原子;和各种其它基团中的其它杂原子。
18.可键合到被取代的碳(或其它,如氮)原子上的取代基的非限制性实例包括f、cl、br、i、or、oc(o)n(r)2、cn、no、no2、ono2、叠氮基、cf3、ocf3、r、o(氧代)、s(硫羰基(thiono))、c(o)、s(o)、亚甲二氧基、亚乙二氧基、n(r)2、sr、sor、so2r、so2n(r)2、so3r、(ch2)
0-2
p(o)or2、c(o)r、c(o)c(o)r、c(o)ch2c(o)r、c(s)r、c(o)or、oc(o)r、c(o)n(r)2、oc(o)n(r)2、c(s)n(r)2、(ch2)
0-2
n(r)c(o)r、(ch2)
0-2
n(r)c(o)or、(ch2)
0-2
n(r)n(r)2、n(r)n(r)c(o)r、n(r)n(r)c(o)or、n(r)n(r)con(r)2、n(r)so2r、n(r)so2n(r)2、n(r)c(o)or、n(r)c(o)r、n(r)c(s)r、n(r)c(o)n(r)2、n(r)c(s)n(r)2、n(cor)cor、n(or)r、c(=nh)n(r)2、c(o)n(or)r或c(=nor)r,其中r可以是氢或碳基部分,并且其中碳基部分可以本身进一步被取代;例如,其中r可以是氢、烷基、酰基、环烷基、芳基、芳烷基、杂环基、杂芳基或杂芳基烷基,其中任何烷基、酰基、环烷基、芳基、芳烷基、杂环基、杂芳基或杂芳基烷基或r可以独立地被单取代或多取代;或其中键合到氮原子或键合到相邻氮原子上的两个r基团可与该一或多个氮原子一起形成杂环基,其可以被单取代或独立地被多取代。
19.术语“烷基”,单独或组合地,表示具有1至8个碳原子的直链或支链烷基,优选具有1至6个碳原子的直链或支链烷基,特别优选具有1至4个碳原子的直链或支链烷基。直链和支链c
1-c8烷基的实例是甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、异构戊基、异构己基、异构庚基和异构辛基,优选甲基和乙基,最优选甲基。
20.术语“环烷基”,单独或组合地,表示具有3至8个碳原子的环烷基环,优选具有3至6个碳原子的环烷基环。c
3-c8环烷基的实例是环丙基、甲基-环丙基、二甲基-环丙基、环丁基、甲基-环丁基、环戊基、甲基-环戊基、环己基、甲基-环己基、二甲基-环己基、环庚基和环辛基,优选环丙基,特别是环戊基。
21.术语“烷氧基”,单独或组合地,表示式烷基-o-的基团,其中术语“烷基”具有先前给出的含义,如甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基和叔丁氧基、2-羟基乙氧基、2-甲氧基乙氧基,优选甲氧基和乙氧基,最优选甲氧基。
22.本文所用的术语“芳基”是指在环中不含杂原子的取代或未取代的环状芳烃。因此芳基包括但不限于苯基、薁基、庚搭烯基(heptalenyl)、联苯基、不对称引达省基(indacenyl)、芴基、菲基、三亚苯基、芘基、并四苯基、
䓛
基、亚联苯基、蒽基和萘基。在一些
实施方案中,芳基在基团的环部分中含有大约6至大约14个碳(c
6-c
14
)或6至10个碳原子(c
6-c
10
)。如本文中定义,芳基可以是未取代或取代的。术语“芳基”,单独或组合地,进一步表示任选带有一个或多个,特别是1至3个取代基的苯基或萘基,优选苯基,所述取代基各自独立地选自卤素、三氟甲基、氨基、烷基、烷氧基、芳氧基、烷基羰基、氰基、氨基甲酰基、烷氧基氨基甲酰基、亚甲二氧基、羧基、烷氧基羰基、氨基羰基、烷基氨基羰基、二烷基氨基羰基、羟基、硝基(nitrol)等。芳基,优选苯基的优选取代基独立地选自卤素、三氟甲基、烷基、烷氧基、氰基和硝基。芳基的实例是苯基、氰苯基、甲氧基苯基、氟苯基和甲基苯基。
23.术语“芳烷基”,单独或组合地,表示被一个或多个,优选一个或两个,特别优选一个芳基取代的如上文定义的烷基或环烷基,并且其中术语芳基如上文定义。实例是苄基、被羟基、烷氧基或卤素,优选氟取代的苄基。
24.术语“杂环基”,单独或组合地,表示含有一个或多个,优选一个或两个选自氮、氧和硫的杂原子(其中氧,特别是氮是优选的)的饱和、部分不饱和或芳族的4-至10-元杂环。如果需要,其可在一个或多个碳原子上被卤素、烷基、烷氧基、氧代、烷氧基烷基、羟烷基等取代和/或在仲氮原子(即-nh-)上被烷基、环烷基、芳烷氧羰基、烷酰基、苯基或苯基烷基取代或在叔氮原子(即=n-)上被氧负离子(oxido)取代,其中卤素、烷基、环烷基和烷氧基是优选的。这样的杂环基的实例是吡啶基、呋喃基、吡咯烷基、哌啶基、吗啉基、哌嗪基、3,4-二氢-1h-异喹啉基、噻吩基和氮杂环庚烷基,其中这些环各自可任选被一个或多个,优选一个独立地选自烷基和卤素的取代基取代。特别优选的是吡咯烷基、吡啶基、呋喃基、噻吩基和氯-吡啶基。
25.术语“碳环基”,单独或组合地,表示部分不饱和的4-至10-元碳环,其中任选一个或多个碳原子被卤素、烷基、环烷基、烷氧基、氧代、芳基取代,其中烷基是优选的。碳环基的一个实例是茚满基。
26.术语“氨基”,单独或组合地,表示经由氮原子键合的伯、仲或叔氨基,其中仲氨基带有烷基或环烷基取代基,且叔氨基带有两个类似或不同的烷基或环烷基取代基,或两个氮取代基一起形成环,例如-nh2、甲基氨基、乙基氨基、二甲基氨基、二乙基氨基、甲基乙基氨基、吡咯烷基和哌啶子基。特别优选的是伯氨基。
27.术语“环烷基烷基”,单独或组合地,表示被一个或多个,优选一个环烷基取代的烷基,并且其中术语烷基和环烷基具有先前给出的含义。
28.术语“环烷基烷基羰基”,单独或组合地,表示环烷基烷基-c(o)-基团,其中环烷基烷基如上文定义。
29.术语“环烷基烷氧基”,单独或组合地,表示被一个或多个,优选一个环烷基取代的烷氧基,并且其中术语烷氧基和环烷基具有先前给出的含义。
30.术语“环烷基烷氧基烷基”,单独或组合地,表示被一个或多个,优选一个环烷基烷氧基取代的烷基,并且其中术语烷基和环烷基烷氧基具有先前给出的含义。
31.术语“杂环基烷基羰基”,单独或组合地,表示杂环基烷基-c(o)-基团,其中杂环基烷基如上文定义。
32.术语“芳烷基羰基”,单独或组合地,表示芳烷基-c(o)-基团,其中芳烷基如上文定义。
33.术语“烷基羰基”,单独或组合地,表示烷基-c(o)-基团,其中烷基如上文定义。
34.术语“环烷基羰基”,单独或组合地,表示环烷基-c(o)-基团,其中环烷基如上文定义。
35.术语“芳基羰基”,单独或组合地,表示芳基-c(o)-基团,其中芳基如上文定义。
36.术语“烷氧基烷基”,单独或组合地,表示被一个或多个,优选一个烷氧基取代的烷基,并且其中术语烷基和烷氧基具有先前给出的含义。
37.术语“羟烷基”,单独或组合地,表示被一个或多个,优选一个羟基取代的烷基,并且其中术语烷基和羟基具有先前给出的含义。
38.术语“杂环基烷基”,单独或组合地,表示被一个或多个,优选一个杂环基取代的烷基,并且其中术语烷基和杂环基具有先前给出的含义。
39.术语“杂环基羰基”,单独或组合地,表示杂环基-c(o)-基团,其中杂环基如上文定义。
40.术语“碳环基烷基”,单独或组合地,表示被一个或多个,优选一个碳环基取代的烷基,并且其中术语烷基和碳环基具有先前给出的含义。
41.术语“卤素”表示氟、氯、溴或碘,优选氟、氯或溴,特别是氯。
42.式i的化合物也可溶剂化,例如水化。溶剂化可在制备过程中实现,或可以例如由于(式i)的最初无水化合物的吸湿性质而发生(水化)。术语可药用盐也包括药学上可用的溶剂化物。
43.更详细地,例如,根据式i的化合物的-cooh基团可被酯化。烷基酯和芳烷基酯是合适的酯的实例。甲基、乙基、丙基、丁基和苄基酯是优选的酯。甲基酯和乙基酯尤其优选。
44.药学上合适的酯的进一步实例是式i的化合物,其中羟基可被酯化。这样的酯的实例是甲酸酯、乙酸酯、丙酸酯、丁酸酯、异丁酸酯、戊酸酯、2-甲基丁酸酯、异戊酸酯和n,n-二甲基氨基乙酸酯。优选的酯是乙酸酯和n,n-二甲基氨基乙酸酯。
[0045]“杂芳基”代表包含至少一个杂原子,如n、s、o或se的芳环。本公开的杂芳基可以是任何杂芳基。本公开的杂芳基可以是但不限于吡咯烷基、氮杂环丁烷基、哌啶基、哌嗪基、吗啉基、苯并二氢吡喃基、吲哚啉酮基(indolinonyl)、异吲哚啉酮基、呋喃基、吡咯烷基、吡啶基、吡嗪基、嘧啶基、三嗪基、噻吩基、四氢呋喃基、吡咯基、噁唑基、噁二唑基、咪唑基、三唑基、四唑基、苯并噁唑啉基、苯并噻唑啉基、苯并咪唑啉基或它们的任何组合。
[0046]
除非另有说明,本文所用的术语“卤代”、“卤素”或“卤化(halide)”基团,本身或作为另一取代基的一部分,是指氟、氯、溴或碘原子。本文所述的化合物可能含有一个或多个手性中心,或可能另外能够作为多种立体异构体存在。要理解的是,在一个实施方案中,本文描述的本发明不限于任何特定的立体化学要求,并且化合物和包含它们的组合物、方法、用途和药物可以是光学纯的,或可以是各种立体异构体混合物中的任一种,包括对映异构体的外消旋混合物和其它混合物、非对映异构体的其它混合物等。还要理解的是,这样的立体异构体混合物可包括在一个或多个手性中心处的单一立体化学构型,同时包括在一个或多个其它手性中心处的立体化学构型的混合物。
[0047]
类似地,本文所述的化合物可能包括几何中心,如顺式、反式、e和z双键。要理解的是,在另一实施方案中,本文描述的本发明不限于任何特定的几何异构体要求,并且化合物和包含它们的组合物、方法、用途和药物可以是纯的,或可以是各种几何异构体混合物中的任一种。还要理解的是,这样的几何异构体混合物可包括一个或多个双键处的单一构型,同
时包括一个或多个其它双键处的几何混合物。
[0048]
本文所用的术语“任选取代的”或“任选取代基”是指所涉基团未被取代或被一个或多个指定取代基取代。当所涉基团被多于一个取代基取代时,取代基可能相同或不同。当使用术语“独立地”、“独立地为”和“独立地选自”时,所涉基团可能相同或不同。某些本文定义的术语可能在结构中出现多于一次,在这种情况下各个术语应该互相独立地进行定义。
[0049]
本发明涉及能够抑制lyp的活性的新型化合物。因此,根据本发明的化合物可用于治疗与ptpn22遗传多态性相关的疾病或障碍,包括1型糖尿病、类风湿性关节炎、系统性红斑狼疮、格雷夫斯病、阿狄森氏病、白癜风、幼年型关节炎、桥本甲状腺炎和其它更罕见疾病。此外,这些lyp抑制剂可用于一类新型癌症免疫疗法。该化合物可以注射或口服施用。
[0050]
实验部分本发明还包括制备本发明的化合物的方法。在所述反应中,可能必须保护反应性官能团,例如羟基、氨基、亚氨基、巯基或羧基(当在最终产物中需要这些基团时),以避免它们不合意地参与反应。可根据标准做法使用常规保护基,例如参见t. w. greene和p. g. m. wuts,
ꢀ“
protective groups in organic chemistry”, john wiley and sons, 1991。
[0051]
一般合成程序和试剂:除非另行规定,所有试剂购自商业供应商并直接使用而未进一步提纯。在0.25 mm硅胶60-f
254
上进行分析薄层色谱法(tlc)。使用kp-sil硅胶(biotage, usa)进行柱色谱法,并在biotage预装柱上使用自动化快速色谱系统biotage isolera one进行快速柱色谱法。在bruker avance 500 mhz仪器上记录 1
h和
13
c nmr谱。质子磁共振谱(1h nmr)的化学位移以百万分率(ppm)给出,参考适当的溶剂峰或以四甲基硅烷(tms)为0.0 ppm。在适当时使用以下缩写描述峰分裂模式:br = 宽,s = 单峰,d = 双重峰,t = 三重峰,q = 四重峰,m = 多重峰,dd = 双二重峰。耦合常数j以赫兹为单位(hz)报告。13c nmr的化学位移以参考dmso-d在39.52的中心线的ppm报告。使用agilent technologies 6470系列三重四极杆lc/ms 获得低分辨率质谱和纯度数据。在agilent质谱仪上使用esi-tof(电喷雾电离-飞行时间)记录高分辨率质谱(hrms)。
[0052]
根据如方案1中所示的以下一般合成制备式i的化合物。在适当时,根据本领域技术人员已知的既定合成程序视需要使用保护基,并在合成完成后可能除去或不除去。起始材料根据本领域中已知的方法合成或可购得。
(esi): m/z [m + h]
+ c
28h26
n3o5计算值: 484.19,实测值: 484.20。
[0058]
步骤g: (s)-6-(2-([1,1'-联苯]-4-基甲酰胺基)丙酰胺基)-4-氧代-1,4-二氢喹啉-3-甲酸(实施例1)向化合物(s)-6-(2-([1,1'-联苯]-4-基甲酰胺基)丙酰胺基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(500 mg, 1.03 mmol)在甲醇(20 ml)和h2o(20 ml)中的溶液中加入koh(580 mg, 10.34 mmol)。所得混合物在60℃下搅拌16小时。使混合物达到0℃,小心地用1n hcl酸化直至ph = 1。通过过滤收集形成的沉淀物并通过hplc提纯以提供为灰白色固体的所需产物(422 mg, 90%收率)。1h nmr (500 mhz, dmso) δ 10.53 (s, 1h), 8.83 (d, j = 6.8 hz, 1h), 8.78 (d, j = 6.8 hz, 1h), 8.65 (d, j = 2.4 hz, 1h), 8.10 (dd, j = 9.1, 2.4 hz, 1h), 8.04 (d, j = 8.5 hz, 2h), 7.84
ꢀ–ꢀ
7.77 (m, 3h), 7.76
ꢀ–ꢀ
7.70 (m, 2h), 7.50 (t, j = 7.6 hz, 2h), 7.45
ꢀ–ꢀ
7.39 (m, 1h), 4.68
ꢀ–ꢀ
4.61 (m, 1h), 1.49 (d, j = 7.2 hz, 3h)。
13
c nmr (126 mhz, dmso) δ 177.99 (s), 172.03 (s), 166.55 (s), 166.08 (s), 144.05 (s), 142.89 (s), 139.15 (s), 137.34 (s), 135.40 (s), 132.67 (s), 129.04 (s), 128.30 (s), 128.08 (s), 126.88 (s), 126.41 (s), 126.19 (s), 124.95 (s), 120.41 (s), 113.21 (s), 107.07 (s), 50.13 (s), 17.61 (s)。lc-ms (esi): m/z [m
ꢀ‑ꢀ
h]
‑ c
26h20
n3o5计算值: 454.14,实测值: 454.30。hrms (esi-tof): m/z [m
ꢀ‑ꢀ
h]
‑ c
26h20
n3o5计算值: 454.1403,实测值: 454.1413;纯度: 》95% (uv, λ = 254 nm)。
[0059]
根据上文对实施例1描述的程序制备实施例2至51。所有实施例1-51列在表1中。
[0060]
表1: 实施例1-51
。
[0061]
实施例52: (s)-6-(2-([1,1'-联苯]-4-基甲酰胺基)丙酰胺基)-1-(3,4-二氯苄基)-4-氧代-1,4-二氢喹啉-3-甲酸方案2. 实施例52的合成方法
步骤a: (s)-6-(2-([1,1'-联苯]-4-基甲酰胺基)丙酰胺基)-1-(3,4-二氯苄基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯向化合物(s)-6-(2-([1,1'-联苯]-4-基甲酰胺基)丙酰胺基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(200 mg, 0.41 mmol)在dmf(20 ml)中的溶液中加入k2co3(172 mg, 1.24 mmol)和4-(溴甲基)-1,2-二氯苯(110 mg, 0.45 mmol),并将溶液在80℃下保持2小时。在冷却至室温后,然后过滤剩余k2co3并蒸发溶剂。油性残留物通过柱提纯以提供为灰白色固体的所需产物(232 mg, 87%收率)。lc-ms (esi): m/z [m + h]
+ c
35h30
cl2n3o5计算值: 642.16,实测值: 642.10。
[0062]
步骤b: (s)-6-(2-([1,1'-联苯]-4-基甲酰胺基)丙酰胺基)-1-(3,4-二氯苄基)-4-氧代-1,4-二氢喹啉-3-甲酸向化合物(s)-6-(2-([1,1'-联苯]-4-基甲酰胺基)丙酰胺基)-1-(3,4-二氯苄基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(100 mg, 0.15 mmol)在甲醇(4 ml)和h2o(4 ml)中的溶液中加入koh(87 mg, 1.56 mmol)。所得混合物在60℃下搅拌16小时。使混合物达到0℃,小心地用1n hcl酸化直至ph = 1。通过过滤收集形成的沉淀物并通过hplc提纯以提供为灰白色固体的所需产物(81 mg, 84%收率)。lc-ms (esi): m/z [m
ꢀ‑ꢀ
h]
‑ c
33h24
cl2n3o5计算值: 612.11,实测值: 612.20。hrms (esi-tof): m/z [m
ꢀ‑ꢀ
h]
‑ c
26h20
n3o5计算值: 612.1093,实测值: 612.1101;纯度: 》95% (uv, λ = 254 nm)。
[0063]
根据上文对实施例52描述的程序制备实施例53至74。所有实施例52-74列在表2中。
[0064]
表2:实施例52-74
。
[0065]
x为h时的式i的化合物根据以下一般合成方案3制备。在适当时,根据本领域技术人员已知的既定合成程序视需要使用保护基,并在合成完成后可能除去或不除去。起始材料根据本领域中已知的方法合成或可购得。
[0066]
方案3. x为h时的式i的化合物的合成方法实施例75: (s)-6-(2-([1,1'-联苯]-4-基甲酰胺基)丙酰胺基)-4-氧代-1,4-二氢喹啉-3-甲酸步骤a: (s)-6-((2-((叔丁氧基羰基)氨基)丙基)氨基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯6-氨基-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(200 mg, 0.86 mmol)、(s)-(1-氧代丙-2-基)氨基甲酸叔丁酯(150 mg, 0.86 mmol)和乙酸(1 ml)在无水甲醇(15 ml)中的混合物在搅拌下回流16小时。在冷却后,加入nabh3cn(109 mg, 1.72 mmol),并将混合物在冰水浴中搅拌1小时,然后进一步回流3小时。蒸发溶剂,残留物中再添加甲醇(15 ml)。通过过滤收集形成的沉淀物并通过用二氯甲烷/甲醇10:1 v/v洗脱的柱色谱法提纯以产生为浅棕色固体的boc-保护的中间体(s)-6-((2-((叔丁氧基羰基)氨基)丙基)氨基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(320 mg, 95%收率)。lc-ms (esi): m/z [m + h]
+ c
20h28
n3o5计算值: 390.20,实测值: 390.30。
[0067]
步骤b: (s)-6-((2-氨基丙基)氨基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯将boc-保护的中间体(s)-6-((2-((叔丁氧基羰基)氨基)丙基)氨基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(250 mg, 0.64 mmol)溶解在dcm(20 ml)中。加入cf3cooh(5 ml)并将反应混合物在室温下搅拌1小时。在真空中浓缩产生棕色固体,将其溶解在乙酸乙酯中并用nahco3水溶液洗涤。收集有机溶剂并在真空中浓缩以产生棕色固体,其随后通过用二氯甲烷/甲醇10:1 v/v洗脱的柱色谱法提纯以提供标题化合物(170 mg, 91%收率)。lc-ms (esi): m/z [m + h]
+ c
15h20
n3o3计算值: 290.15,实测值: 290.20。
[0068]
步骤c: (s)-6-((2-([1,1'-联苯]-4-基甲酰胺基)丙基)氨基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯将联苯-4-甲酸(50 mg, 0.25 mmol)、hobt(38 mg, 0.28 mmol)和hbtu(106 mg, 0.28 mmol)溶解在无水二甲基甲酰胺(dmf, 10 ml)中。混合物在室温下搅拌15分钟。然后加入(s)-6-((2-氨基丙基)氨基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(73 mg, 0.25 mmol)和n,n-二异丙基乙基胺(0.134 ml, 0.76 mmol)并将所得混合物在室温下搅拌整夜。通过旋转蒸发器除去dmf,然后加入乙酸乙酯和水。通过过滤收集形成的沉淀物并用乙酸乙酯洗涤以产生(s)-6-((2-([1,1'-联苯]-4-基甲酰胺基)丙基)氨基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(85 mg, 71%收率)。lc-ms (esi): m/z [m + h]
+ c
28h28
n3o4计算值: 470.21,实测值: 484.20。
[0069]
步骤d: (s)-6-((2-([1,1'-联苯]-4-基甲酰胺基)丙基)氨基)-4-氧代-1,4-二氢喹啉-3-甲酸向化合物(s)-6-((2-([1,1'-联苯]-4-基甲酰胺基)丙基)氨基)-4-氧代-1,4-二
氢喹啉-3-甲酸乙酯(80 mg, 0.17 mmol)在甲醇(4 ml)和h2o(4 ml)中的溶液中加入koh(116 mg, 2.06 mmol)。所得混合物在60℃下搅拌16小时。使混合物达到0℃,小心地用1n hcl酸化直至ph = 1。通过过滤收集形成的沉淀物并通过hplc提纯以提供为灰白色固体的所需产物实施例75(58 mg, 77%收率)。lc-ms (esi): m/z [m
ꢀ‑ꢀ
h]
‑ c
26h22
n3o4计算值: 440.16,实测值: 440.20。纯度: 》95% (uv, λ = 254 nm)。
[0070]
根据上文对实施例75描述的程序制备实施例76至98。
[0071]
表3: 实施例75-98
dimethylglutarate)缓冲液(50 mm 3,3-二甲基戊二酸,ph 7.0,1 mm edta,150 mm nacl)中在25℃下测定ptp活性。该测定法在96孔板中进行。通常,为了测定对lyp的ic
50
值,通过在连续稀释下将酶(最终浓度为20 nm)添加到含有5.0 mm(该底物抗lyp的km)pnpp的反应混合物(0.2 ml)中而引发反应。为了测定对其它ptp的ic
50
值,在用于lyp的相同条件下进行测定法,只是将pnpp的浓度设定为各ptp的相应km值。该研究中使用的所有ptp都是内部制备的重组蛋白。用于测定ic50值的化合物的浓度为ic
50
值的0.2至5倍。使用spectramax plus 384微孔板分光光度计(molecular devices)测量反应速率。为了确定抑制模式,通过将lyp(最终浓度为5 nm)添加到含有各种浓度的pnpp和抑制剂l-1(实施例1)的反应混合物(0.2 ml)中而引发反应。使用sigmaplot enzyme kinetics module(systat software, inc.)拟合数据。
[0075]
药代动力学研究实施例1是ic
50
低至1.4
ꢀ±ꢀ
0.2 μm的新型ptpn22抑制剂。为了研究实施例1在小鼠模型中的效果,需要药代动力学数据以了解其吸收/分布/代谢/消除(adme)性质。下面给出详细实验程序和所得药代动力学参数。
[0076]
用于药代动力学研究的动物给药和样品收集首先将实施例1溶解在dmso中以制备20 mg/ml溶液。然后将该溶液进一步稀释为2 mg/ml溶液,其配方是10% dmso
ꢀ‑ꢀ
85% pbs
ꢀ‑ꢀ
5% cremophor el(crel)。每只小鼠施用10 mg/kg的单次ip剂量。根据小鼠体重,每次注射的体积为大约100 μl。在不同时间点(1 h、1.5h、2 h、2.5h、3 h、6、24 h),收集血液样品(50 μl)并离心以得到血清。然后将血清(10 μl)与乙腈(20 μl)混合并离心。收集上清液并进行液相色谱/质谱分析。
[0077]
液相色谱/质谱分析在agilent 1260分析hplc系统和配备kinetex 2.6um c18柱(3 mm x 50 mm)的agilent 6470三重四极杆ms检测器上进行液相色谱/质谱(lc/ms)分析,用0-100% meoh-含0.1% (w/v)甲酸的h2o在0.7 ml/min的流速下洗脱(梯度法: 1.2 min 0-10% meoh线性梯度,1.5 min 10-90% meoh线性梯度,接着1.3 min 90-100% meoh,接着2.5 min 100% meoh),将ms检测器设定为单离子模式(sim),监测负电荷454.2 (m-1)。对实施例1的检测限是在4 μl进样下100 nm。
[0078]
数据分析在graphpad prism 6中计算药代动力学参数,结果显示在下表4中。实施例1的药代动力学曲线显示在图3&4中。
[0079]
表4. 实施例1的药代动力学数据
。
[0080]
lyp抑制剂实施例1在癌症免疫疗法的小鼠模型中表现出有效的体内活性。
[0081]
图5表明实施例1在癌症免疫疗法的小鼠模型中表现出有效的体内活性。如在ptpn22(lyp) ko模型中观察到的,用实施例1治疗wt小鼠(a)导致mc38肿瘤生长与注射媒介物的对照组(b)相比显著减少。我们进一步测试实施例1对另一同系免疫活性模型(balb/c小鼠中的ct26)的效果,其表现出类似的抗肿瘤效果(c)。用免疫组织化学分析mc38肿瘤证明实施例1诱导cd4+和cd8+ t细胞的浸润增加(d)。此外,mc38和ct26肿瘤免疫浸润的分析显示在实施例1治疗的肿瘤中多种免疫细胞类型和t细胞亚型的存在显著改善。为了测试实施例1治疗的效果是否可归因于脱靶效应,我们用媒介物或实施例1注射治疗ptpn22 ko小鼠的mc38肿瘤。没有注意到肿瘤生长的显著差异,表明实施例1介导的抗肿瘤生长的保护作用是ptpn22(lyp)-特异性和宿主特异性的(e)。
[0082]
总之,实施例1表现出强的体内抗肿瘤活性,其接近表型模拟ptpn22 ko小鼠,几乎没有表现出脱靶活性。
[0083]
在一个实施方案中,本公开提供式i的化合物:
或其立体异构体、互变异构体、溶剂化物、衍生物、可药用盐,其中:r1和r2独立地代表氢、任选取代的烷基、任选取代的环烷基、任选取代的环烷基烷基、烷基羰基,条件是所述烷基羰基不是甲基羰基、任选取代的环烷基羰基、任选取代的环烷基烷基羰基、任选取代的芳基、任选取代的芳烷基、任选取代的芳基羰基、任选取代的芳烷基羰基、任选取代的烷氧基烷基、任选取代的羟烷基、任选取代的杂环基、任选取代的杂环基烷基、任选取代的杂环基羰基、任选取代的杂环基烷基羰基、任选取代的碳环基、任选取代的碳环基烷基、任选取代的氨基、任选取代的烷基-so
2-、任选取代的芳基-so
2-、任选取代的杂环基-so
2-、任选取代的氨基-so
2-,或r1和r2与它们所连接的n原子一起形成任选包含选自氮或氧的第二杂原子的5-10元杂环,并且其中所述杂环任选被取代;r3是h、任选取代的烷基、任选取代的烯基、任选取代的炔基、任选取代的环烷基、任选取代的芳基、任选取代的杂芳基或任选取代的杂环基;r4和r6独立地代表氢、任选取代的烷基、任选取代的环烷基、任选取代的杂环烷基、任选取代的芳基和杂芳基;任选取代的芳烷基或任选取代的杂芳烷基;(r5)n,当n是1或2时,代表1至2个-h、-f、-cl、-br、-i、-cfh2、-cf2h、-cf3、-cn、-oh、-no2、-nh2、-so2ch3、so2nh2、-so2nhch3、任选取代的-co
2-烷基、任选取代的nh(烷基)或n(烷基)2、任选取代的烷基、任选取代的烯基、任选取代的烷氧基、任选取代的s-烷基、任选取代的环烷基、任选取代的杂环、任选取代的芳基或任选取代的杂芳基;x是o或h,其中当x是h时,-c=x-是-ch
2-,并且其中当x是h时,r1和r2中的至少一个是任选取代的芳基羰基,且r1和r2之一可连接r3以形成环;和y是c-r5或n。
[0084]
在关于式i的化合物的本公开的一个实施方案中,其中x是o。
[0085]
在关于式i的化合物的本公开的一个实施方案中,其中x是h以使-c=x-为ch2基团。
[0086]
在关于式i的化合物的本公开的一个实施方案中,其中y是ch、c-f、c-cl、c-br、c-i或n。
[0087]
在关于式i的化合物的本公开的一个实施方案中,其中r4是h。
[0088]
在关于式i的化合物的本公开的一个实施方案中,其中r6是h。
[0089]
在关于式i的化合物的本公开的一个实施方案中,其中r3是任选取代的c
1-c4烷基。
[0090]
在关于式i的化合物的本公开的一个实施方案中,其中r4和r6是h,且r3是任选取代的c
1-c4烷基。
[0091]
在关于式i的化合物的本公开的一个实施方案中,其中r1和r2中的至少一个是h。
[0092]
在关于式i的化合物的本公开的一个实施方案中,其中r4和r6是h,r3是任选取代的c
1-c4烷基,且r1和r2中的至少一个是h。
[0093]
在关于式i的化合物的本公开的一个实施方案中,其中r1和r2之一是任选取代的芳基羰基、任选取代的芳烷基羰基、任选取代的杂环基羰基、任选取代的杂环基烷基羰基,且r1和r2之一是h。
[0094]
在关于式i的化合物的本公开的一个实施方案中,其中r1和r2之一是任选取代的联苯基羰基或苯基羰基,且r1和r2之一是h。
[0095]
在关于式i的化合物的本公开的一个实施方案中,其中r
1-r6、x、y和n可以是所有例举的实施例1-98中的特定r
1-r6、x、y和n的任何组合。
[0096]
在关于式i的化合物的本公开的一个实施方案中,化合物的cooh基团可形成衍生物,例如但不限于酯酰胺、氨基甲酸酯。烷基和芳烷基衍生物是合适的酯酰胺或氨基甲酸酯的实例。甲基、乙基、丙基、丁基和苄基酯是优选的酯酰胺或氨基甲酸酯。甲基和乙基酯酰胺或氨基甲酸酯尤其优选。药学上合适的酯的进一步实例是式i的化合物,其中羟基可被酯化。这样的酯的实例是甲酸酯、乙酸酯、丙酸酯、丁酸酯、异丁酸酯、戊酸酯、2-甲基丁酸酯、异戊酸酯和n,n-二甲基氨基乙酸酯。优选的酯是乙酸酯和n,n-二甲基氨基乙酸酯。
[0097]
在关于式i的化合物的本公开的一个实施方案中,其中所述化合物选自:
及其立体异构体、互变异构体、溶剂化物、衍生物、可药用盐。
[0098]
在一个实施方案中,本公开提供一种抑制有此需要的对象的lyp的方法,所述方法包括给所述对象施用治疗有效量的式i的化合物、其治疗上合适的立体异构体、互变异构体、溶剂化物或盐。
[0099]
在一个实施方案中,本公开提供一种用治疗有效量的式i的化合物、其治疗上合适的立体异构体、互变异构体、溶剂化物或盐治疗具有与ptpn22遗传多态性相关的疾病或障碍的患者的方法,所述疾病或障碍包括但不限于1型糖尿病、类风湿性关节炎、系统性红斑狼疮、格雷夫斯病、阿狄森氏病、白癜风、幼年型关节炎、桥本甲状腺炎和其它更罕见疾病。
[0100]
在一个实施方案中,本公开提供一种通过抑制lyp活性而进行癌症免疫治疗的方法,其包括给对象施用治疗有效量的式i的化合物或其立体异构体、互变异构体、溶剂化物、可药用盐。
[0101]
在一个实施方案中,本公开提供一种药物组合物,其包含式i的化合物或其立体异构体、互变异构体、溶剂化物、可药用盐,以及可药用载体。
[0102]
在关于治疗疾病或障碍的患者的治疗方法的本公开的一个实施方案中,式i的化合物或其立体异构体、互变异构体、溶剂化物、可药用盐可以注射或口服施用。
[0103]
本领域技术人员会认识到,可对上述具体实施方案作出许多修改。实施方案不应局限于所述特定限制。其它实施方案也是可能的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1