包含IL-2蛋白和CD80蛋白的融合蛋白制剂的制作方法
包含il-2蛋白和cd80蛋白的融合蛋白制剂
技术领域
1.本发明涉及具有增强的融合蛋白稳定性的液体制剂,所述融合蛋白包含il-2蛋白和cd80蛋白。
背景技术:
2.il-2,也称为t细胞生长因子,是一种在淋巴细胞的产生、存活和稳态中起核心作用的球状糖蛋白。il-2的蛋白质大小为约15.5kda至约16kda,由133个氨基酸组成。il-2通过与由三个不同亚基组成的il-2受体结合来介导各种免疫作用。此外,il-2主要由活化的t细胞合成,特别是由cd4+辅助t细胞合成。il-2刺激t细胞的增殖和分化,并诱导细胞毒性t淋巴细胞的产生和外周血淋巴细胞分化为细胞毒性细胞和淋巴因子活化的杀伤细胞。
3.此外,il-2参与b细胞的增殖和分化,并促进b细胞合成免疫球蛋白。此外,il-2刺激自然杀伤细胞的产生、增殖和活化。因此,il-2被用作抗癌剂,因为它可以增加淋巴细胞数量并增强体内免疫细胞的功能。目前,用il-2进行治疗已获批准用于转移性肾细胞癌和恶性黑色素瘤患者。
4.然而,il-2具有双重功能,因为它不仅对介导增加免疫细胞数量及增强其活性很重要,而且对维持免疫耐受也很重要。此外,据报道,il-2可能不是抑制肿瘤生长的最佳选择。原因是在il-2存在的情况下,活化诱导的细胞死亡(aicd)可能发生在所产生的细胞毒性t淋巴细胞中,并且免疫反应可能被il-2依赖性调节性t细胞(treg细胞)抑制(imai et al.,cancer sci 98,416-423,2007)。
5.此外,接受il-2的患者会出现严重的心血管、肺部、肾脏、肝脏、胃肠道、神经元、皮肤、血液和全身性副作用。因此,已经研究了多种il-2突变体以提高il-2的治疗作用并使其副作用最小化(us 5,229,109 b)。然而,为了将il-2用于药理学目的,仍有许多问题需要解决。
6.另一方面,cd80,也称为b7-1,是膜结合蛋白b7家族的成员,该b7家族通过与其配体结合,凭借传递共刺激反应和共抑制反应来参与免疫调节。cd80是一种表达于t细胞、b细胞、树突细胞和单核细胞表面上的跨膜蛋白。已知cd80与cd28、ctla4(cd152)和pd-l1结合。cd80、cd86、ctla4和cd28参与共刺激-共抑制系统。例如,已知cd80调节t细胞的活性并参与其增殖、分化和存活。
7.例如,当cd80和cd86与cd28相互作用时,会产生共刺激信号以活化t细胞。最终,cd80与在活化的t细胞的表面上表达的ctla4结合,并刺激ctla4上调。因此,cd80在由cd80/cd28相互作用引起的免疫反应操作之前抑制t细胞反应。该反馈回路允许对免疫反应进行精细调节。
8.此外,已知cd80与另一个b7家族成员pd-l1结合,其亲和力类似于cd28与pd-l1结合的亲和力。pd-l1被称为程序性死亡-1(pd-1)蛋白的两种配体之一,并且已知pd-l1参与t细胞调节。cd80与pd-l1的结合是另一种可以阻断pd-1/pd-l1相互作用的机制,这可能会阻止对肿瘤中对t细胞反应的抑制。然而,cd80水平的升高会导致cd80与cd28结合,从而诱导t
细胞反应。同时,cd80可与ctla4结合,从而抑制t细胞反应。
9.已证实包含cd80片段、免疫球蛋白fc和il-2变体的融合蛋白可活化免疫细胞,同时可以控制调节性t细胞的免疫细胞调节活性,从而可以有效地治疗癌症和传染病(kr 10-2201086 b1)。为了将这种蛋白有效地应用于癌症疾病和传染病的治疗,有必要开发一种提供给药和施用优势的稳定、高浓度的蛋白制剂。
技术实现要素:
10.技术问题
11.本发明人开发了一种具有增加的新型融合蛋白二聚体稳定性的制剂,该融合蛋白二聚体在一个分子中包含il-2蛋白和cd80蛋白,从而完成了本发明。
12.解决方案
13.为了实现上述目的,在本发明的一个方面,提供了包含融合蛋白二聚体的药物制剂,所述融合蛋白二聚体包含il-2蛋白和cd80蛋白。
14.发明效果
15.包含il-2蛋白和cd80蛋白的融合蛋白二聚体不仅可以通过il-2活化免疫细胞,还可以通过cd80有效调节treg细胞。为了在临床上使用这种融合蛋白二聚体,必须确保蛋白质制剂的稳定性。当根据本发明的药物制剂应用于包含il-2蛋白和cd80蛋白的融合蛋白二聚体时,融合蛋白二聚体的稳定性显著提高,并且该制剂可以作为液体制剂使用。因此,可以增加融合蛋白二聚体的商业适用性。
附图说明
16.图1示出了用sds-page检测获得的融合蛋白(gi-101)的结果。
17.图2示出了根据吸光度的融合蛋白(gi-101)的量。
18.图3示出了通过尺寸排阻色谱法(sec)分析获得的融合蛋白(gi-101)的结果。
19.最佳具体实施方式
20.包括含有il-2蛋白和cd80蛋白的融合蛋白的药物制剂
21.在本发明的一个方面,提供了一种药物制剂,该药物制剂包括:(i)浓度为3.0mg/ml至5.0mg/ml的包含il-2蛋白和cd80蛋白的融合蛋白二聚体;(ii)浓度为10mm至30mm的缓冲剂;和(iii)浓度为0.155w/w%至0.185w/w%的表面活性剂;其中,制剂的ph为6.5至7.5。
22.这里,药物制剂可以是液体制剂。
23.包含il-2蛋白和cd80蛋白的融合蛋白
24.如本文所用,除非另有说明,否则术语“il-2”或“白细胞介素-2”是指从任何脊椎动物来源获得的任何野生型il-2,脊椎动物包括哺乳动物,例如灵长类动物(如人类)和啮齿动物(如小鼠和大鼠)。il-2可以从动物细胞中获得,也包括从能够产生il-2的重组细胞中获得的il-2。此外,il-2可以是野生型il-2或其变体。
25.在本说明书中,il-2或其变体可以统一用术语“il-2蛋白”或“il-2多肽”来表示。il-2、il-2蛋白、il-2多肽和il-2变体特异性结合例如il-2受体。这种特异性结合可以通过本领域技术人员已知的方法来鉴定。
26.il-2的实施方式可以具有seq id no:35或seq id no:36的氨基酸序列。在这里,
il-2也可以是成熟形式。具体而言,成熟的il-2可以不包含信号序列,并且可以具有seq id no:10的氨基酸序列。在这里,il-2可以在涵盖野生型il-2的片段的概念下使用,其中野生型il-2的n端或c端的部分被截短。
27.此外,il-2的片段可以是从具有seq id no:35或seq id no:36的氨基酸序列的蛋白质的n端截短1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个连续氨基酸的形式。此外,il-2的片段可以是从具有seq id no:35或seq id no:36的氨基酸序列的蛋白质的c端被截短1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个连续氨基酸的形式。
28.如本文所用,术语“il-2变体”是指全长il-2或il-2的上述片段中的部分氨基酸被取代的形式。也就是说,il-2变体可以具有不同于野生型il-2或其片段的氨基酸序列。然而,il-2变体可具有与野生型il-2相当或相似的活性。在这里,“il-2活性”例如可以指与il-2受体的特异性结合,该特异性结合可以通过本领域技术人员已知的方法来测量。
29.具体而言,可以通过取代野生型il-2中的部分氨基酸来获得il-2变体。通过氨基酸取代获得的il-2变体的实施方式可以通过取代seq id no:10的氨基酸序列中的第38、42、45、61和72位氨基酸中的至少一个而获得。
30.具体地,il-2变体可以通过用另一种氨基酸取代seq id no:10的氨基酸序列中的第38、42、45、61或72位氨基酸中的至少一个而获得。此外,当il-2是seq id no:35的氨基酸序列中的n端的部分被截短的形式时,与seq id no:10的氨基酸序列中的位置互补对应的位置处的氨基酸可以被另一种氨基酸取代。例如,当il-2具有seq id no:35的氨基酸序列时,其il-2变体可以通过用另一种氨基酸取代seq id no:35的氨基酸序列中的第58、62、65、81或92位氨基酸中的至少一个而获得。这些氨基酸残基分别对应于seq id no:10的氨基酸序列中的第38、42、45、61和72位氨基酸残基。根据一个实施方式,一个、两个、三个、四个、五个、六个、七个、八个、九个或十个氨基酸可以被取代,只要这样的il-2变体保持il-2活性。根据另一个实施方式,可以取代一个至五个氨基酸。
31.在一个实施方式中,il-2变体可以是两个氨基酸被取代的形式。具体地,il-2变体可以通过取代seq id no:10的氨基酸序列中的第38和42位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第38和45位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第38和61位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第38和72位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第42和45位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第42和61位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第42和72位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第45和61位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第45和72位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第61和72位氨基酸来获得。
32.此外,il-2变体可以是三个氨基酸被取代的形式。具体地,il-2变体可以通过取代seq id no:10的氨基酸序列中的第38、42和45位氨基酸来获得。此外,在一个实施方式中,
il-2变体可以通过取代seq id no:10的氨基酸序列中的第38、42和61位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第38、42和72位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第38、45和61位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第38、45和72位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第38、61和72位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第42、45和61位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第42、45和72位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第45、61和72位氨基酸来获得。
33.此外,il-2变体可以是其中四个氨基酸被取代的形式。具体地,il-2变体可以通过取代seq id no:10的氨基酸序列中的第38、42、45和61位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第38、42、45和72位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第38、45、61和72位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第38、42、61和72位氨基酸来获得。此外,在一个实施方式中,il-2变体可以通过取代seq id no:10的氨基酸序列中的第42、45、61和72位氨基酸来获得。
34.此外,il-2变体可以是五个氨基酸被取代的形式。具体地,il-2变体可以通过用另一种氨基酸取代seq id no:10的氨基酸序列中的第38、42、45、61和72位氨基酸中的每个而获得。
35.在这里,通过取代引入的“另一种氨基酸”可以是选自由以下组成的组中的任意一种氨基酸:丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸。然而,关于il-2变体的氨基酸取代,在seq id no:10的氨基酸序列中,第38位氨基酸不能被精氨酸取代,第42位氨基酸不能被苯丙氨酸取代,第45位氨基酸不能被酪氨酸取代,第61位氨基酸不能被谷氨酸取代,以及第72位氨基酸不能被亮氨酸取代。
36.关于il-2变体的氨基酸取代,在seq id no:10的氨基酸序列中,第38位氨基酸精氨酸可以被精氨酸以外的氨基酸取代。优选地,关于il-2变体的氨基酸取代,在seq id no:10的氨基酸序列中,第38位氨基酸精氨酸可以被丙氨酸(r38a)取代。
37.关于il-2变体的氨基酸取代,在seq id no:10的氨基酸序列中,第42位氨基酸苯丙氨酸可以被苯丙氨酸以外的氨基酸取代。优选地,关于il-2变体的氨基酸取代,在seq id no:10的氨基酸序列中,第42位氨基酸苯丙氨酸可以被丙氨酸(f42a)取代。
38.关于il-2变体的氨基酸取代,在seq id no:10的氨基酸序列中,第45位氨基酸酪氨酸可以被酪氨酸以外的氨基酸取代。优选地,关于il-2变体的氨基酸取代,在seq id no:10的氨基酸序列中,第45位氨基酸酪氨酸可以被丙氨酸(y45a)取代。
39.关于il-2变体的氨基酸替换,在seq id no:10的氨基酸序列中,第61位氨基酸谷氨酸可以被谷氨酸以外的氨基酸取代。优选地,关于il-2变体的氨基酸取代,在seq id no:10的氨基酸序列中,第61位氨基酸谷氨酸可以被精氨酸(e61r)取代。
40.关于il-2变体的氨基酸取代,在seq id no:10的氨基酸序列中,第72位氨基酸亮
氨酸可以被亮氨酸以外的氨基酸取代。优选地,关于il-2变体的氨基酸取代,在seq id no:10的氨基酸序列中,第72位氨基酸亮氨酸可以被甘氨酸(l72g)取代。
41.具体地,il-2变体可以通过在seq id no:10的氨基酸序列中进行选自由r38a、f42a、y45a、e61r和l72g组成的组中的至少一个取代而获得。
42.具体地,il-2变体可以通过在选自由r38a、f42a、y45a、e61r和l72g组成的组中的位置中的两个、三个、四个或五个位置处的氨基酸取代而获得。
43.此外,il-2变体可以是两个氨基酸被取代的形式。具体地,il-2变体可以通过取代r38a和f42a获得。此外,在一个实施方式中,il-2变体可以通过取代r38a和y45a获得。此外,在一个实施方式中,il-2变体可以通过取代r38a和e61r获得。此外,在一个实施方式中,il-2变体可以通过取代r38a和l72g获得。此外,在一个实施方式中,il-2变体可以通过取代f42a和y45a获得。此外,在一个实施方式中,il-2变体可以通过取代f42a和e61r获得。此外,在一个实施方式中,il-2变体可以通过取代f42a和l72g获得。此外,在一个实施方式中,il-2变体可以通过取代e61r和l72g获得。
44.此外,il-2变体可以是三个氨基酸被取代的形式。具体地,il-2变体可以通过取代r38a、f42a和y45a获得。此外,在一个实施方式中,il-2变体可以通过取代r38a、f42a和e61r获得。此外,在一个实施方式中,il-2变体可以通过取代r38a、f42a和l72g获得。此外,在一个实施方式中,il-2变体可以通过取代r38a、y45a和e61r获得。此外,在一个实施方式中,il-2变体可以通过取代r38a、y45a和l72g获得。此外,在一个实施方式中,il-2变体可以通过取代f42a、y45a和e61r获得。此外,在一个实施方式中,il-2变体可以通过取代f42a、y45a和l72g获得。此外,在一个实施方式中,il-2变体可以通过取代f42a、e61r和l72g获得。此外,在一个实施方式中,il-2变体可以通过取代y45a、e61r和l72g获得。
45.此外,il-2变体可以是四个氨基酸被取代的形式。具体地,il-2变体可通过取代r38a、f42a、y45a和e61r获得。此外,在一个实施方式中,il-2变体可以通过取代r38a、f42a、y45a和l72g获得。此外,在一个实施方式中,il-2变体可以通过取代r38a、f42a、e61r和l72g获得。此外,在一个实施方式中,il-2变体可以通过取代r38a、y45a、e61r和l72g获得。此外,在一个实施方式中,il-2变体可以通过取代f42a、y45a、e61r和l72g获得。
46.此外,il-2变体可以通过取代r38a、f42a、y45a、e61r和l72g获得。
47.优选地,il-2变体的一个实施方式可以包括在seq id no:10的氨基酸序列中进行选自以下取代组合(a)至(d)中的任意一种:
48.(a)r38a/f42a
49.(b)r38a/f42a/y45a
50.(c)r38a/f42a/e61r
51.(d)r38a/f42a/l72g。
52.在这里,当il-2具有seq id no:35的氨基酸序列时,氨基酸取代可以存在于与seq id no:10的氨基酸序列中的位置互补对应的位置。此外,即使当il-2是seq id no:35的氨基酸序列的片段时,氨基酸取代也可以存在于与seq id no:10的氨基酸序列中的位置互补对应的位置。
53.具体地,il-2变体可具有seq id no:6、22、23或24的氨基酸序列。
54.此外,il-2变体的特征可以在于具有低体内毒性。在这里,低体内毒性可能是由
il-2与il-2受体α链(il-2rα)结合引起的副作用。已经开发了各种il-2变体以改善由il-2与il-2rα结合引起的副作用,并且此类il-2变体可以是美国专利号5,229,109和韩国专利号1667096中公开的那些。特别地,本技术中描述的il-2变体对il-2受体α链(il-2rα)的结合能力低,因此具有比野生型il-2更低的体内毒性。
55.如本文所用,术语“cd80”,也称为“b7-1”,是存在于树突细胞、活化的b细胞和单核细胞中的膜蛋白。cd80提供对t细胞的活化和存活至关重要的共刺激信号。cd80被认为是存在于t细胞表面的两种不同蛋白质cd28和ctla-4的配体。cd80由288个氨基酸组成,并且具体可具有seq id no:11的氨基酸序列。另外,如本文所用,术语“cd80蛋白”是指全长cd80或cd80片段。
56.如本文所用,术语“cd80片段”是指cd80的切割形式。此外,cd80片段可以是cd80的细胞外结构域。cd80片段的实施方式可以通过去除作为cd80的信号序列的从n端开始的第1至34位氨基酸而获得。具体地,cd80片段的实施方式可以是由seq id no:11中的第35至288位氨基酸组成的蛋白质。此外,cd80片段的实施方式可以是由seq id no:11中的第35至242位氨基酸组成的蛋白质。此外,cd80片段的实施方式可以是由seq id no:11中的第35至232位氨基酸组成的蛋白质。此外,cd80片段的实施方式可以是由seq id no:11中的第35至139位氨基酸组成的蛋白质。此外,cd80片段的实施方式可以是由seq id no:11中的第142至242位氨基酸组成的蛋白质。在实施方式中,cd80片段可以具有seq id no:2的氨基酸序列。
57.此外,il-2蛋白和cd80蛋白可以通过接头或载体彼此连接。具体地,il-2或其变体和cd80(b7-1)或其片段可以通过接头或载体彼此连接。在本说明书中,接头和载体可以互换使用。
58.接头连接两个蛋白质。接头的实施方式可以包括1至50个氨基酸、白蛋白或其片段、免疫球蛋白的fc结构域等。在这里,免疫球蛋白的fc结构域是指含有免疫球蛋白的重链恒定区2(ch2)和重链恒定区3(ch3)并且不含免疫球蛋白的重链可变区、轻链可变区和轻链恒定区1(ch1)的蛋白质。免疫球蛋白可以是igg、iga、ige、igd或igm,并且可以优选地是igg4。在这里,野生型免疫球蛋白g4的fc结构域可以具有seq id no:4的氨基酸序列。
59.此外,免疫球蛋白的fc结构域可以是fc结构域变体以及野生型fc结构域。此外,如本文所用,术语“fc结构域变体”可以指去糖基化形式,或,在糖基化模式方面与野生型fc结构域不同、与野生型fc结构域相比具有高糖基化、或与野生型fc结构域相比具有低糖基化的形式。此外,其中包括非糖基化的fc结构域。通过培养条件或对宿主的基因操纵,fc结构域或其变体可适于具有调整后的数量的唾液酸、岩藻糖基化或糖基化。
60.此外,免疫球蛋白的fc结构域的糖基化可以通过常规方法例如化学方法、酶方法和使用微生物的基因工程方法进行修饰。此外,fc结构域变体可以是免疫球蛋白、igg、iga、ige、igd和igm各自的fc区的混合形式。此外,fc结构域变体可以是fc结构域的部分氨基酸被其他氨基酸取代的形式。fc结构域变体的实施方式可以具有seq id no:12的氨基酸序列。
61.融合蛋白可以具有这样的结构:其中使用fc结构域作为接头(或载体),cd80蛋白和il-2蛋白,或il-2蛋白和cd80蛋白分别连接到接头或载体的n端和c端。fc结构域的n端或c端与cd-80或il-2之间的连接可以可选地通过接头肽来实现。
62.具体地,融合蛋白可以由以下结构式(i)或(ii)组成:
63.n'-x-[接头(1)]
n-fc结构域-[接头(2)]
m-y-c'(i)
[0064]
n'-y-[接头(1)]n-fc结构域-[接头(2)]m-x-c'(ii)
[0065]
在这里,在所述结构式(i)和(ii)中,
[0066]
n'是融合蛋白的n端,
[0067]
c'是融合蛋白的c端,
[0068]
x是cd80蛋白,
[0069]
y是il-2蛋白,
[0070]
接头(1)和(2)是肽接头,以及
[0071]
n和m各自独立地为0或1。
[0072]
优选地,融合蛋白可以由结构式(i)组成。il-2蛋白如上所述。此外,cd80蛋白如上所述。根据一个实施方式,il-2蛋白可以是与野生型il-2相比具有1至5个氨基酸取代的il-2变体。cd80蛋白可以是通过从野生型cd80的n端或c端截短最多约34个连续氨基酸残基而获得的片段。可选择地,cd蛋白可以是具有结合t细胞表面受体ctla-4和cd28活性的细胞外免疫球蛋白样结构域。
[0073]
具体地,融合蛋白可以具有seq id no:9、26、28或30的氨基酸序列。根据另一个实施方式,融合蛋白包括与seq id no:9、26、28或30的氨基酸序列具有85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的多肽。在这里,同一性例如是百分比同源性,并且可以通过同源性比较软件例如国家生物技术信息中心(ncbi)的blastn软件来确定。
[0074]
肽接头(1)可以包含在cd80蛋白和fc结构域之间。肽接头(1)可由5至80个连续氨基酸、20至60个连续氨基酸、25至50个连续氨基酸或30至40个连续氨基酸组成。在一个实施方式中,肽接头(1)可以由30个氨基酸组成。此外,肽接头(1)可以包含至少一个半胱氨酸。具体地,肽接头(1)可以包含一个、两个或三个半胱氨酸。此外,肽接头(1)可以来源于免疫球蛋白的铰链。在一个实施方式中,肽接头(1)可以是由seq id no:3的氨基酸序列组成的肽接头。
[0075]
肽接头(2)可由1至50个连续氨基酸、3至30个连续氨基酸或5至15个连续氨基酸组成。在一个实施方式中,肽接头(2)可以是(g4s)n(其中n是1至10的整数)。在这里,在(g4s)n中,n可以是1、2、3、4、5、6、7、8、9或10。在一个实施方式中,肽接头(2)可以是由seq id no:5的氨基酸序列组成的肽接头。
[0076]
在本发明的另一个方面,提供了通过结合两个融合蛋白获得的二聚体,两个融合蛋白各自包含il-2蛋白和cd80蛋白。包含il-2或其变体和cd80或其片段的融合蛋白如上所述。
[0077]
在这里,构成二聚体的融合蛋白之间的结合可以通过但不限于由接头中存在的半胱氨酸形成的二硫键来实现。构成二聚体的融合蛋白可以是相同的融合蛋白,也可以是彼此不同的融合蛋白。优选地,二聚体可以是同型二聚体。构成二聚体的融合蛋白的实施方式可以是具有seq id no:9的氨基酸序列的蛋白质。
[0078]
药物制剂
[0079]
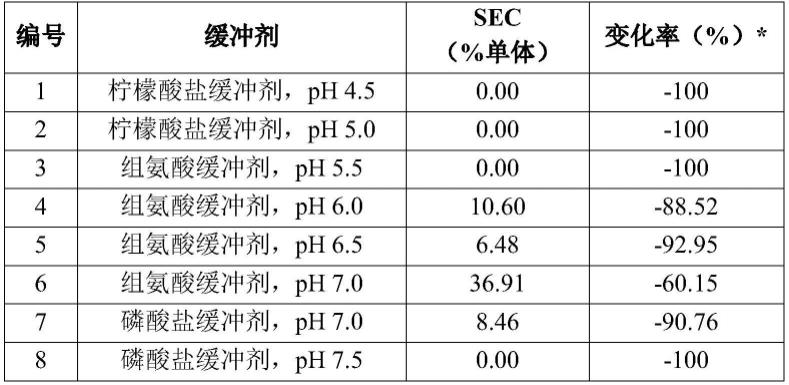
在本发明的一个方面,提供了包含融合蛋白二聚体的药物制剂,所述融合蛋白二聚体包含il-2蛋白和cd80蛋白。
[0080]
如本文所用,术语“药物制剂”是指以使得活性成分的生物活性明显有效的形式存在并且不包含在施用该制剂的对象中引起副作用的成分的制剂。
[0081]
术语“对象”可以是哺乳动物,例如人、狗、牛、马、猪、绵羊、山羊、猫、小鼠、兔和大鼠,并且可以优选地是人、狗或猫。
[0082]
如本文所用,术语“药物制剂”是指使用合适的水性溶剂如水或水性/油性混合物(例如,水醇混合物)的药物制剂。制剂可以保持稳定性例如化学或物理稳定性、生物活性。
[0083]
术语“稳定性”是指保持恒定状态的性质,并且通常与使生物活性物质如蛋白质、肽或生物活性大分子的降解、变性、聚集或解折叠最小化有关。
[0084]
同时,该制剂可以是液体制剂。液体制剂为水性溶液或悬浮液,可在室温下稳定保存,在储存期间冷藏(例如,2℃至8℃)或冷冻(例如,-20℃或-70℃)。
[0085]
本发明的药物制剂可以肠胃外施用。这里,肠胃外施用可以通过例如皮下施用、静脉内施用、粘膜施用、肌肉内施用的方法进行。在本发明的实施方式中,该制剂可以优选通过静脉注射来施用。
[0086]
药物制剂中的融合蛋白二聚体的浓度可以为3.0mg/ml至5.0mg/ml。此外,融合蛋白二聚体的浓度可以为3.0mg/ml至4.8mg/ml、3.0mg/ml至4.6mg/ml、3.0mg/ml至4.4mg/ml、3.0mg/ml至4.2mg/ml、3.2mg/ml至4.8mg/ml、3.2mg/ml至4.6mg/ml、3.2mg/ml至4.4mg/ml、3.2mg/ml至4.2mg/ml、3.4mg/ml至4.8mg/ml、3.4mg/ml至4.6mg/ml、3.4mg/ml至4.4mg/ml、3.4mg/ml至4.2mg/ml、3.6mg/ml至4.8mg/ml、3.6mg/ml至4.6mg/ml、3.6mg/ml至4.4mg/ml、3.6mg/ml至4.2mg/ml、3.8mg/ml至4.8mg/ml、3.8mg/ml至4.6mg/ml、3.8mg/ml至4.4mg/ml、3.8mg/ml至4.2mg/ml、或3.9mg/ml至4.1mg/ml。具体地,融合蛋白二聚体的浓度可以为4.0mg/ml。
[0087]
此外,缓冲剂可以是组氨酸缓冲剂。这里,组氨酸的浓度可以为10mm至30mm。此外,组氨酸的浓度可以为10mm至28mm、10mm至26mm、10mm至24mm、10mm至22mm、10mm至21mm、12mm至28mm、12mm至26mm、12mm至24mm、12mm至22mm、12mm至21mm、14mm至28mm、14mm至26mm、14mm至24mm、14mm至22mm、14mm至21mm、16mm至28mm、16mm至26mm、16mm至24mm、16mm至22mm、16mm至21mm、18mm至28mm、18mm至26mm、18mm至24mm、18mm至22mm、18mm至21mm、19mm至28mm、19mm至26mm、19mm至24mm、19mm至22mm、或19mm至21mm。具体地,组氨酸的浓度可以为20mm。
[0088]
此外,药物制剂的ph可以为6.5至7.5。此外,药物制剂的ph可以为6.5至7.3、6.5至7.2、6.5至7.1、6.7至7.3、6.7至7.2、6.7至7.1、6.8至7.3、6.8至7.2、6.8至7.1、6.9至7.3、6.9至7.2、或6.9至7.1。优选地,药物制剂的ph可以为7.0。
[0089]
此外,药物制剂的表面活性剂可以包括选自由以下组成的组中的任一种:聚山梨醇酯(例如:聚山梨醇酯20、聚山梨醇酯28、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯65、聚山梨醇酯80、聚山梨醇酯81、聚山梨醇酯85);泊洛沙姆(例如,泊洛沙姆181、泊洛沙姆188、泊洛沙姆407);聚乙二醇(peg);及其组合。优选地,药物制剂可以包含两种表面活性剂。
[0090]
此外,制剂可以包括浓度为0.065w/w%至0.2w/w%的表面活性剂。此外,制剂可以包含浓度为0.155w/w%至0.185w/w%的表面活性剂。在一个实施方式中,表面活性剂可以是泊洛沙姆188。这里,制剂可以包括浓度为0.065w/w%至0.075w/w%的表面活性剂。此外,在一个实施方式中,表面活性剂可以是泊洛沙姆80。这里,制剂可以包括浓度为约0.09w/w%至约0.11w/w%的表面活性剂。优选地,制剂可以包括泊洛沙姆188和聚山梨醇酯80,并
且可以包括浓度分别为0.065w/w%至0.075w/w%和0.09w/w%至约0.11w/w%的泊洛沙姆188和聚山梨醇酯80。具体地,制剂可以包括浓度分别为0.07w/w%和0.1w/w%的泊洛沙姆188和聚山梨醇酯80。
[0091]
此外,药物制剂还可以包含氨基酸。氨基酸可以是选自由以下组成的组中的任一种:精氨酸、组氨酸、赖氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、硒代半胱氨酸、甘氨酸、脯氨酸、丙氨酸、缬氨酸、异亮氨酸、亮氨酸、蛋氨酸、苯丙氨酸、酪氨酸和色氨酸。
[0092]
这里,氨基酸的浓度可以为10mg/ml至30mg/ml。此外,氨基酸的浓度可以为10mg/ml至25mg/ml、10mg/ml至20mg/ml、10mg/ml至18mg/ml、10mg/ml至16mg/ml、12mg/ml至25mg/ml、12mg/ml至20mg/ml、12mg/ml至18mg/ml、12mg/ml至16mg/ml、14mg/ml至25mg/ml、14mg/ml至20mg/ml、14mg/ml至18mg/ml、或14mg/ml至16mg/ml。具体地,氨基酸的浓度可以为15mg/ml。
[0093]
在实施方式中,氨基酸可以是精氨酸,并且可以优选地是精氨酸-hcl。这里,可以包括浓度为14mg/ml至16mg/ml的精氨酸,并且可以优选包括浓度为15mg/ml的精氨酸。
[0094]
此外,药物制剂还可以包含糖。糖可以是选自由蔗糖、山梨糖醇、甘油、海藻糖和甘露糖醇组成的组中的任一种。这里,可以包括浓度为120mg/ml至180mg/ml的糖。此外,糖的浓度可以为120mg/ml至170mg/ml、120mg/ml至160mg/ml、120mg/ml至155mg/ml、130mg/ml至170mg/ml、130mg/ml至160mg/ml、130mg/ml至155mg/ml、135mg/ml至170mg/ml、135mg/ml至160mg/ml、135mg/ml至155mg/ml、140mg/ml至170mg/ml、140mg/ml至160mg/ml、140mg/ml至155mg/ml、145mg/ml至170mg/ml、145mg/ml至160mg/ml、或145mg/ml至155mg/ml。
[0095]
在实施方式中,糖可以是蔗糖,并且蔗糖的浓度可以为150mg/ml。
[0096]
在本发明的实施方式中,药物制剂可以包括:(i)浓度为3.0mg/ml至5.0mg/ml的包含il-2蛋白和cd80蛋白的融合蛋白二聚体;(ii)浓度为10mm至30mm的组氨酸;(iii)浓度为0.065w/w%至0.075w/w%的泊洛沙姆188;(iv)浓度为0.09w/w%至0.11w/w%的聚山梨醇酯80;(v)浓度为10mg/ml至30mg/ml的精氨酸;和(vi)浓度为120mg/ml至180mg/ml的蔗糖,其中,药物制剂的ph可以为6.5至7.5。
[0097]
药物制剂可以储存在选自由小瓶、药筒、注射器和自动注射器组成的组的容器中。
[0098]
此外,储存制剂的容器可储存在室温、2℃至8℃或25℃至40℃,直至施用于需要治疗的对象。
[0099]
对象可以是哺乳动物,例如人、狗、牛、马、猪、绵羊、山羊、猫、小鼠、兔和大鼠,并且可以优选地是人。
[0100]
该制剂可以通过肠胃外施用方式来施用,例如皮下施用、静脉内施用、粘膜施用、肌肉内施用或腹腔内施用,但不限于此。优选地,该制剂可以静脉内施用。
具体实施方式
[0101]
下文将通过以下实施例更为详细地描述本发明。然而,以下实施例仅用于说明本发明,并且本发明的范围不受以下实施例的限制。
[0102]
制备例1.制备hcd80-fc-il-2变体(2m):gi-101
[0103]
为了产生包含人cd80片段、fc结构域和il-2变体的融合蛋白二聚体,通过
thermofisher scientific的invitrogen geneart基因合成服务合成了多核苷酸。具体地,多核苷酸包含编码融合蛋白的核苷酸序列(seq id no:8),该融合蛋白从n端开始按顺序包含:信号肽(seq id no:1)、cd80片段(seq id no:2)、与接头连接的ig铰链(seq id no:3)、fc结构域(seq id no:4)、接头(seq id no:5)和具有两个氨基酸取代(r38a和f42a)的il-2变体(2m)(seq id no:6)。将多核苷酸插入pcdna3_4运载体中。此外,将运载体导入cho细胞(expi-cho
tm
)以表达seq id no:9的融合蛋白。导入运载体后,在37℃、125rpm、8%co2的条件下培养7天。然后,收集培养物,从中纯化融合蛋白。纯化的融合蛋白被命名为“gi-101”。
[0104]
用含有mabselect sure蛋白a树脂的色谱进行纯化。将融合蛋白在25mm tris和25mm nacl以及ph 7.4的条件下与色谱柱结合。然后,用100mm nacl和100mm乙酸(ph 3)进行洗脱。将ph 9的20%1m tris-hcl置于收集管中,然后收集融合蛋白二聚体。对于收集的融合蛋白二聚体,缓冲剂用pbs缓冲剂透析16小时进行交换。
[0105]
然后,使用tskgel g3000swxl柱(tosoh bioscience)通过尺寸排阻色谱测量随时间变化的280nm波长处的吸光度,以获得高度浓缩的融合蛋白二聚体。这里,将分离纯化的融合蛋白二聚体在还原(r)或非还原(nr)条件下进行sds-page,并通过考马斯蓝染色以检查其纯度(图1)。当用nanodrop检测时,发现所含融合蛋白二聚体的浓度为2.78mg/ml(图2)。此外,通过使用尺寸排阻色谱法的分析获得的结果提供在图3中。
[0106]
实施例1.最佳缓冲剂/ph条件的评估
[0107]
为了确定含有cd80蛋白和il-2蛋白的融合蛋白二聚体(gi-101)的液体制剂的最佳缓冲剂/ph,共筛选了八种缓冲剂/ph。进行稳定性测试(40℃,2周)以选择最佳缓冲剂/ph。
[0108]
缓冲剂/ph筛选样本在40℃下储存2周,然后使用尺寸排阻色谱(sec)分析样本。为了鉴定gi-101蛋白的尺寸排阻谱,使用hplc(waters,e2695和thermo scientific,ultimate3000)进行sec。使用214nm处的色谱图计算单体的%面积。
[0109]
在制剂开发过程中,sec谱用于使%单体最大化。缓冲剂/ph筛选的稳定性测试结果总结在表1中。含有组氨酸缓冲剂,ph 7.0的样本#6与其他样本相比表现出较小的变化。
[0110]
[表1]
[0111][0112]
*变化率=(40℃储存2周后的数据-初始数据)/初始数据
×
100
[0113]
基于稳定性测试数据,ph 7.0的组氨酸缓冲剂被确定为用于gi-101的缓冲剂。
[0114]
[表2]
[0115]
组成浓度组氨酸缓冲剂,ph 7.020mm
[0116]
实施例2.赋形剂筛选测试
[0117]
实施例2.1.赋形剂筛选
[0118]
为了确定含有gi-101的液体制剂的赋形剂,在实施例1中选择的缓冲剂/ph(组氨酸缓冲剂,ph 7.0)条件下进行赋形剂筛选测试。
[0119]
对于8种不同的赋形剂[聚山梨醇酯80、泊洛沙姆188、精氨酸-hcl(l-精氨酸盐酸盐)、l-蛋氨酸、d-甘露醇、山梨糖醇、蔗糖和d-(+)-海藻糖二水合物],对通过在5种不同的测试条件下进行而获得的tm&tagg、sec和目测颗粒测试的结果进行统计学分析,选择泊洛沙姆188、精氨酸-hcl和蔗糖作为赋形剂。
[0120]
[表3]
[0121]
赋形剂类型表面活性剂氨基酸糖选择的泊洛沙姆188精氨酸-hcl蔗糖
[0122]
实施例2.2.筛选最佳赋形剂浓度
[0123]
根据实施例2.1,选择泊洛沙姆188、精氨酸-hcl和蔗糖作为含有gi-101的液体制剂的赋形剂。
[0124]
通过改变各赋形剂的浓度,在16种条件下进行筛选测试,以找到这三种赋形剂的组合的最佳浓度。
[0125]
实施例2.2.1.热稳定性测试(40℃,2周)
[0126]
将16个赋形剂筛选测试样本在40℃下储存2周,然后通过蛋白质浓度(a280)和sec测试对样本进行分析。结果如表4所示。
[0127]
[表4]
[0128][0129]
实施例2.2.2.rsm和模拟结果
[0130]
使用响应面模型(response surface model,rsm)来确定各赋形剂的最佳浓度。通过调整预测刻画器(prediction profiler)中各赋形剂的浓度,可以找到最佳反应。在预测刻画器预测的结果中,蔗糖的浓度设定为最佳值150mg/ml,这是该实验的最大值。因此,通过模拟设定了仅精氨酸-hcl和泊洛沙姆188的浓度。各赋形剂的预测的最佳浓度范围示于表5。
[0131]
[表5]
[0132]
赋形剂范围泊洛沙姆1880.05w/w%至0.075w/w%精氨酸-hcl10mg/ml至20mg/ml蔗糖150mg/ml
[0133]
实施例2.3.最终稳定性测试(4周)
[0134]
根据表5中各赋形剂的最佳浓度范围,得出表6中的最终候选制剂。对表6中的候选制剂进行了最终的4周稳定性测试。
[0135]
[表6]
[0136]
赋形剂泊洛沙姆188精氨酸-hcl蔗糖最佳条件0.07w/w%15mg/ml150mg/ml目标范围0.065w/w%至0.075w/w%14mg/ml至16mg/ml140mg/ml至160mg/ml
[0137]
在总共五种不同条件下测试了候选制剂的稳定性。制备样本后立即进行释放测试(t=0),候选样本分别在5℃(长期条件)、-70℃(长期第二条件)、25℃(加速条件)和40℃(严苛条件)下储存4周。特别是在40℃稳定性测试(严苛条件)的情况下,为了确定变化趋势,在2周时间点采集了额外的样本。在每种条件下储存4周后,通过sec、蛋白质浓度(a280)
和ph测试对样本进行分析。gi-101候选制剂的最终稳定性测试结果示于表7。
[0138]
[表7]
[0139][0140]
作为稳定性测试的结果,候选制剂在-70℃、5℃和25℃的条件下表现出稳定状态。根据该结果,确定gi-101的最终制剂为8mg/ml gi-101、20mm组氨酸缓冲剂(ph 7.0)、0.07w/w%泊洛沙姆188、15mg/ml精氨酸-hcl和150mg/ml蔗糖。
[0141]
[表8]
[0142]
物质目标浓度范围gi-1018mg/ml7.2mg/ml至8.8mg/ml缓冲剂组氨酸缓冲剂:20mmn/aphph 7.0ph 6.8至7.2表面活性剂泊洛沙姆188:0.07w/w%0.065w/w%至0.075w/w%氨基酸精氨酸-hcl:15mg/ml14mg/ml至16mg/ml糖蔗糖:150mg/ml140mg/ml至160mg/ml
[0143]
实施例3.聚山梨醇酯80添加测试
[0144]
在使用实施例2.3.中确定的候选制剂生产gi-101原料药的过程中,发现了可见颗粒,并且另外开发了一种制剂。经鉴定,当原料药中存在的有机硅(silicone)通过物理应力与蛋白质结合形成有机硅-蛋白质复合物时,会出现可见颗粒。由于在原料药生产过程中去除有机硅或减轻物理应力是有限的,因此开发了一种抑制有机硅-蛋白质复合物形成的新制剂来解决这个问题。据报道,泊洛沙姆188是一种抑制有机硅-蛋白质复合物形成的低效表面活性剂,基于此,进行了添加聚山梨醇酯80(ps80)作为表面活性剂的实验。
[0145]
具体地,通过按浓度(0w/w%、0.02w/w%、0.04w/w%、0.06w/w%、0.08w/w%和0.1w/w%)添加聚山梨醇酯80至gi-101ds(4mg/ml gi-101、20mm组氨酸缓冲剂(ph 7.0)、0.07w/w%泊洛沙姆188、15mg/ml精氨酸-hcl和150mg/ml蔗糖)来进行测试。将gi-101的浓度调整为4mg/ml以增加长期稳定性。
[0146]
实施例3.1.可见颗粒观察
[0147]
每种条件各试验了三个管,即使仅在三个管中的一个管中观察到颗粒,也将其标记为o(即,“颗粒观察”)(表9)。
[0148]
[表9]
[0149][0150]
在添加了0.08w/w%或更多ps80的样本中,直到4周都没有观察到颗粒。在第3周观察到颗粒的样本的情况下,该样本不进行第4周的实验。
[0151]
实施例3.2.品质影响评估
[0152]
为了研究添加聚山梨醇酯80(ps80)的品质影响,测量了添加0.1w/w%ps80的样本的蛋白质浓度、电荷变化和纯度。对添加了0.1w/w%ps80的样本进行了长达4周的观察,结果表明品质保持不变。每种条件的测量结果如表10所示。
[0153]
[表10]
[0154]
[0155]
考虑到以高浓度添加ps80可有效减少可见颗粒,因此确定ps80的浓度为0.1w/w%。通过结合这些结果,确定gi-101的最终制剂成分如下表11所示。
[0156]
[表11]
[0157]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1