阿卡他定和皮质类固醇的组合的制作方法
阿卡他定和皮质类固醇的组合
1.本技术要求2020年6月15日提交的印度专利申请号201921053286的权益,该专利申请通过引用并入本文。
技术领域
2.本发明涉及一种包含阿卡他定或其药学上可接受的盐和皮质类固醇或其药学上可接受的盐的局部用药物组合物,用阿卡他定或其药学上可接受的盐和皮质类固醇或其药学上可接受的盐的组合治疗过敏性鼻炎、过敏性鼻结膜炎或其症状(如鼻塞)的方法,及制备所述局部用组合物的方法。
背景技术:
3.过敏性鼻炎是累及全球的最常见疾病之一。过敏性鼻炎会持续一生。据报道,自报告过敏性鼻炎患病率在儿童中为2%至25%,在成人中为1%至大于40%。过敏性鼻炎的症状包括打喷嚏、流鼻涕、鼻痒和鼻塞。眼部症状也常见。过敏性鼻结膜炎伴有眼睛发痒、发红和流泪。
4.过敏性鼻炎的特征在于由于对鼻过敏原暴露的复杂反应而引起的鼻粘膜炎症。在过敏性鼻炎中组胺的水平升高。过敏性鼻炎的特征在于抗原特异性ige的致敏形成和表达,随后是两个阶段即早期和晚期的炎症。肥大细胞似乎在早期反应期间被激活,而嗜碱性粒细胞在晚期反应期间被激活。早期阶段在30分钟内发展并消失,其特征是打喷嚏和流鼻涕。早期反应涉及ige分子的交联,其导致肥大细胞的脱颗粒和介质如组胺、类胰蛋白酶、前列腺素、胃促胰酶、激肽、肝素和白三烯的释放。晚期反应本质上是炎性的,在暴露于过敏原后大约六小时出现鼻塞并缓慢消退。晚期反应的特征在于t淋巴细胞、嗜碱性粒细胞和嗜酸性粒细胞的炎性细胞流入。晚期反应涉及由细胞释放的介质,包括白三烯、激肽、组胺、细胞因子和趋化因子。这些介质导致流鼻涕、鼻塞、打喷嚏、发痒、鼻子发红、流泪、鼻咽区肿胀、耳压增加和鼻后滴漏的症状。
5.鼻塞是初级保健和专科诊所中最常见的症状之一,也是最令患者烦恼的症状。粘膜炎症是导致充血的许多不同且相互关联的因素的原因,包括静脉充血增加、鼻分泌物增多以及组织肿胀或水肿。
6.研究表明,超过60%的过敏性鼻炎患者对他们的当前治疗不满意,特别是由于缺乏疗效(bousquet等人,j allergy clin immunol.,2009september,124(3):428-33)。
7.us 5468743公开了阿卡他定和治疗过敏性病患的方法。
8.us 8664215公开了眼用阿卡他定组合物和治疗或预防眼部过敏的方法。
9.cn 102283849公开了阿卡他定和伪麻黄碱的组合以及阿卡他定、伪麻黄碱和对乙酰氨基酚的组合,其用于缓解与过敏性鼻炎和过敏性结膜炎相关的症状。
10.us 5164194公开了一种用于鼻用或用于眼部的药剂,其含有氮卓斯汀作为活性成分。
11.us 2009/0324699公开了一种药物组合物,其包含皮质类固醇和抗组胺药、极性脂
质脂质体和药学上可接受的水性载体。然而,这样的组合物涉及使用复杂的过程来制造这样的脂质体。
12.wo 2019/022225描述了一种无防腐剂的水性药物组合物,其含有浓度超过0.15%w/v的阿卡他定或其盐。
13.存在对与目前可用的疗法相比提供改善的缓解的鼻内组合物的需要,所述改善的缓解包括起效更快。
技术实现要素:
14.本发明涉及一种可用于治疗过敏性鼻炎、过敏性鼻结膜炎和鼻塞的局部用药物组合物,其包含阿卡他定或其药学上可接受的盐和皮质类固醇或其药学上可接受的盐。所述局部用组合物优选适合于鼻内或眼部施用。所述局部用组合物任选地包含一种或多种药学上可接受的赋形剂。所述组合物赋予鼻粘膜增强的粘膜粘附、在鼻粘膜中的最佳穿透和极小的鼻刺激。所述局部用组合物还具有改善的感官性质,与提供令人不愉快的味道的其他抗组胺产品如氮卓斯汀产品相比,其提供更好的患者依从性和治疗预后。在一个实施方案中,与其他经鼻施用的抗组胺药如奥洛他定和皮质类固醇相比,所述局部用组合物缓解起效更快。在一个实施方案中,当鼻内施用时,所述局部用组合物在小于15或10分钟内起效。在另一个实施方案中,所述组合物没有令人不愉快的味道。
15.在一个实施方案中,所述局部用药物组合物(例如,鼻用药物组合物)为水性药物组合物,其包含(i)约0.05至约5%w/w的阿卡他定或其药学上可接受的盐(如阿卡他定)(例如,约0.125至约0.75%w/w的阿卡他定,如0.125、0.25、0.35、0.45、0.5、0.6和0.75%w/w),(ii)约0.01至约5%w/w的糠酸氟替卡松或丙酸氟替卡松(例如,约0.036%w/w的丙酸氟替卡松或约0.02%w/w的糠酸氟替卡松),(iii)任选地约0.01至约1.0%w/w的悬浮剂(如羟丙基甲基纤维素、聚维酮、羧甲基纤维素钠或羟乙基纤维素),(iv)约0.068至约6.8%w/w的氯化钠,(v)约0.0019至约0.19%w/w的磷酸二氢钠,(v)约0.005至约0.5%w/w的依地酸二钠(例如,依地酸二钠二水合物),(vi)约0.0025至约0.25%w/w的苯扎氯铵,(vii)约0.001至约0.5%w/w的聚山梨醇酯80,和(viii)约0.5至约15%w/w的微晶纤维素和羧甲基纤维素钠的共喷雾干燥组合(例如,其中所述组合包含11.3至18.8%的羧甲基纤维素钠)。所述组合物可以包含一定量的氢氧化钠和/或盐酸以达到所需的ph,如6.0至7.5、6.5至7.0或6.3至7.3(例如,6.7至7.3)的ph。
16.在另一个实施方案中,所述局部用药物组合物(例如,鼻用药物组合物)为水性药物组合物,其包含(i)约0.125%w/w的阿卡他定,(ii)约0.036%w/w的丙酸氟替卡松或约0.02%w/w的糠酸氟替卡松,(iii)任选地约0.1%w/w的悬浮剂(如羟丙基甲基纤维素、聚维酮、羧甲基纤维素钠或羟乙基纤维素),(iv)约0.068至约6.8%w/w的氯化钠,(v)约0.0019至约0.19%w/w的磷酸二氢钠,(vi)约0.005至约0.5%w/w的依地酸二钠(例如,依地酸二钠二水合物),(vii)约0.0025至约0.25%w/w的苯扎氯铵,(viii)约0.001至约0.5%w/w的聚山梨醇酯80,和(ix)约0.5至约15%w/w的微晶纤维素和羧甲基纤维素钠的共喷雾干燥组合(例如,其中所述组合包含11.3至18.8%的羧甲基纤维素钠)。所述组合物可以包含一定量的氢氧化钠和/或盐酸以达到所需的ph,如6.0至7.5、6.5至7.0或6.3至7.3(例如,6.7至7.3)的ph。
17.在还另一个实施方案中,所述局部用药物组合物(例如,鼻用药物组合物)为水性药物组合物,其包含(i)约0.125%w/w的阿卡他定,(ii)约0.036%w/w的丙酸氟替卡松或约0.02%w/w的糠酸氟替卡松,(iii)约0.68%w/w的氯化钠,(iv)约0.019%w/w的磷酸二氢钠,(v)约0.05%w/w的依地酸二钠(例如,依地酸二钠二水合物),(vi)约0.0125%w/w的苯扎氯铵,(vii)约2.1%的甘油,(viii)约0.003%w/w的聚山梨醇酯80,和(ix)约3.64%w/w的微晶纤维素和羧甲基纤维素钠的共喷雾干燥组合(例如,其中所述组合包含11.3至18.8%的羧甲基纤维素钠)。所述组合物可以包含一定量的氢氧化钠和/或盐酸以达到所需的ph,如6.0至7.5、6.5至7.0或6.3至7.3(例如,6.7至7.3)的ph。
18.本文描述的局部用药物组合物是稳定的。在一个实施方案中,在于25℃和60%相对湿度或40℃和75%相对湿度下贮存24小时、3或6个月后,所述局部用组合物具有存在的每种活性成分的初始量的至少90、95或98%。在另一个实施方案中,基于存在的活性成分的量计,(活性成分的)任何单一个别杂质的量不超过按重量计0.5%、0.2%、0.1%或0.05%。在还另一个实施方案中,基于存在的活性成分的量计,(活性成分的)总杂质的量不超过按重量计3%、2%、1%、0.5%、0.3%或0.2%。
19.另一个实施方案为一种通过局部施用有效量的阿卡他定或其药学上可接受的盐和皮质类固醇或其药学上可接受的盐来在有此需要的患者中治疗过敏性鼻炎、过敏性鼻结膜炎或其症状(如鼻塞)的方法。在一个实施方案中,鼻内施用阿卡他定和皮质类固醇。在另一个实施方案中,经眼施用阿卡他定和皮质类固醇。在一个优选的实施方案中,方法包括(例如,鼻内)施用本发明的局部用组合物。在一个实施方案中,患者患有过敏性鼻炎。在另一个实施方案中,患者患有季节性过敏性鼻炎。在还另一个实施方案中,患者患有常年性过敏性鼻炎。在还另一个实施方案中,患者患有中度至重度季节性过敏性鼻炎。在还另一个实施方案中,患者患有中度至重度常年性过敏性鼻炎。
20.还另一个实施方案为一种通过局部施用有效量的本发明的局部用组合物来在有此需要的患者中治疗过敏性鼻炎、过敏性鼻结膜炎或其症状(如鼻塞)的方法。在一个实施方案中,鼻内施用局部用组合物。在另一个实施方案中,经眼施用局部用组合物。在一个实施方案中,患者患有过敏性鼻炎。在另一个实施方案中,患者患有季节性过敏性鼻炎。在还另一个实施方案中,患者患有常年性过敏性鼻炎。在还另一个实施方案中,患者患有中度至重度季节性过敏性鼻炎。在还另一个实施方案中,患者患有中度至重度常年性过敏性鼻炎。
21.还另一个实施方案为一种通过局部施用有效量的阿卡他定或其药学上可接受的盐和皮质类固醇或其药学上可接受的盐来减少鼻减充血剂的使用的方法。优选地,鼻内施用本发明的局部用药物组合物。
22.还另一个实施方案为一种通过局部施用有效量的阿卡他定或其药学上可接受的盐和皮质类固醇或其药学上可接受的盐来抑制、压制或预防鼻息肉的方法。在一个实施方案中,鼻内施用阿卡他定和皮质类固醇。在另一个实施方案中,经眼施用阿卡他定和皮质类固醇。在一个优选的实施方案中,方法包括(例如,鼻内)施用本发明的局部用组合物。
23.在本文描述的方法中,阿卡他定和皮质类固醇可以同时地、分开地或依次地施用。
24.本文描述的方法和局部用组合物可导致比针对过敏性鼻炎的其他治疗更好的患者依从性,因为本发明人发现,当鼻内施用时,阿卡他定不会导致像用抗组胺药氮卓斯汀一样的令人不愉快的味道。
25.还另一个实施方案为一种用于制备局部用药物组合物(如本文描述的那些)的方法,其包括步骤:(i)将ph调节剂(例如,盐酸)、张力调节剂(例如,氯化钠)和阿卡他定溶解在水中以形成第一活性相溶液,(ii)将表面活性剂和共溶剂(例如,甘油)和皮质类固醇(例如,丙酸氟替卡松或糠酸氟替卡松)混合在水中以形成第一分散体,(iii)将悬浮剂(例如,微晶纤维素和羧甲基纤维素钠的共喷雾干燥组合)分散(并任选地均质化)在水中以形成第二分散体,(iv)向第二分散体中加入第一分散体以形成第二活性相溶液,(v)向水中加入螯合剂(例如,依地酸二钠如依地酸二钠二水合物)和缓冲剂(例如,磷酸二氢钠)以形成第三溶液,(vi)向第二活性相溶液中(例如,在搅拌下)加入第一活性相溶液和来自步骤(v)的第三溶液以获得分散体,(vii)向步骤(vi)中制得的溶液中加入防腐剂(例如,苯扎氯铵),(viii)任选地使用氢氧化钠调节来自步骤(vii)的溶液的ph(例如,到6.0至7.5、6.5至7.0或6.3至7.3的ph),和(ix)任选地向步骤(viii)的溶液中加入水(例如,纯化水)以获得所需的体积和/或每种组分的所需浓度。
具体实施方式
26.本发明的发明人已发现,阿卡他定或其药学上可接受的盐可与皮质类固醇或其药学上可接受的盐组合以提供用于治疗过敏性鼻炎、过敏性鼻结膜炎及其症状(如鼻塞)的有利组合物。不受任何特定理论的束缚,由于其预期上调脂皮质蛋白-1的h4受体拮抗剂活性,故认为阿卡他定可增强皮质类固醇的活性,从而导致协同组合,并允许减少皮质类固醇的剂量而不损失临床活性或增加相同剂量下的临床活性。
27.用于鼻内施用的局部用组合物(如阿卡他定和氟替卡松或其酯的组合)提供快速起效,例如在0.15、0.1、0.08或0.05小时内。用于鼻内施用的局部用组合物提供对鼻痒和鼻消减充血的改善的缓解。此外,所述局部用组合物具有更少的副作用。其他抗组胺剂由于h1受体的反向激动、组胺能神经元中神经传递的抑制以及不一定伴有镇静、昏昏欲睡、疲劳或嗜眠的警觉性、认知、学习和记忆受损而对中枢神经系统有着不利影响。鼻内施用阿卡他定提供局部效果而无全身吸收并因此没有cns副作用。例如,如与奥洛他定和氮卓斯汀鼻用喷雾剂相比,阿卡他定与皮质类固醇(如氟替卡松或其酯)的鼻内组合物伴有较少的不良反应如头痛和鼻出血。
28.一个实施方案为阿卡他定与氟替卡松或其酯(如丙酸氟替卡松或糠酸氟替卡松)固定组合的鼻用组合物,其特征在于,与其他抗组胺药(如氮卓斯汀和奥洛他定)和皮质类固醇的固定组合相比,该组合物缓解起效更快。在一个优选的实施方案中,所述组合物提供快速起效,阿卡他定的t
max
为约0.25小时或更短(如0.2、0.15、0.1、0.08或0.05小时)。
29.在又一个实施方案中,本发明提供了阿卡他定与氟替卡松或其酯(如丙酸氟替卡松或糠酸氟替卡松)固定组合的药物组合物,其用于治疗与过敏性鼻炎相关联的症状如打喷嚏、鼻痒、鼻腔炎症、鼻刺激、流鼻涕、鼻瘙痒和鼻塞。所述组合物是有效的鼻减充血剂。因此,患者可减少其他鼻减充血剂的伴随使用。
30.本发明的局部用组合物可在鼻孔中施用或施用于眼睛,每天一次或两次。
31.阿卡他定
32.阿卡他定(6,11-二氢-11-(l-甲基-4-亚哌啶基)-5h-咪唑并[2,1-b][3]苯并氮杂-3-甲醛是一种抗过敏治疗剂,对h1、h2和h4受体具有反向激动剂作用,以及具有肥大细胞
稳定作用。
[0033][0034]
h2受体在鼻塞中起着至关重要的作用。h4受体影响炎症反应(嗜酸性粒细胞、t细胞、树突状细胞、嗜碱性粒细胞、肥大细胞和感觉神经细胞)。与其他抗组胺药即氮卓斯汀和奥洛他定相比,阿卡他定对h1和h2受体具有更高的结合亲和力,并且在控制包括鼻塞在内的总鼻症状方面表现出更高的功效。h1和h2受体信号传导导致瘙痒、鼻子发红、细胞因子分泌、成纤维细胞增殖、粘附分子表达、微血管通透性和前胶原的产生。estelle等人,j allergy clin immunol,2011,128:1139-50。在实验性过敏性鼻炎模型研究中,h4受体信号传导已证实影响过敏性鼻炎中的细胞因子和趋化因子释放、趋化性和粘附分子表达。hanuskova等人,open journal of molecular and integrative physiology,2013,3:6-14。
[0035]
皮质类固醇
[0036]
本文描述的方法和组合物包括一种或多种皮质类固醇。合适的皮质类固醇包括但不限于阿氯米松、倍氯米松、倍他米松、布地奈德、环索奈德、氯倍他索、氯倍他松、地夫可特、地泼罗酮、地塞米松、二氟可龙、氟轻松、依替泼诺(etiprednol)、氟尼缩松、醋酸氟轻松、氟考龙、氟泼尼定、氟米龙、氟替卡松、哈西奈德、氢化可的松、ksr-592、氯替泼诺(loteprednol)、甲基泼尼松龙、莫米松、泼尼松龙、利美索龙、去炎松、其酯和其药学上可接受的盐。在一个实施方案中,皮质类固醇选自倍氯米松、莫米松及其酯(如糠酸莫米松)、氟替卡松及其酯(如糠酸氟替卡松和丙酸氟替卡松)、布地奈德、环索奈德及其药学上可接受的盐。在还另一个实施方案中,皮质类固醇为糖皮质激素。
[0037]
在一个优选的实施方案中,当局部用组合物为鼻用组合物或皮质类固醇待鼻内施用时,皮质类固醇选自倍氯米松、莫米松及其酯(如糠酸莫米松)、氟替卡松及其酯(如糠酸氟替卡松和丙酸氟替卡松)、布地奈德、环索奈德及其药学上可接受的盐。
[0038]
在一个更优选的实施方案中,皮质类固醇为氟替卡松、其酯(如糠酸氟替卡松、丙酸氟替卡松和戊酸氟替卡松)或其药学上可接受的盐。氟替卡松的任何酯均可用于本发明的局部用组合物和方法中。优选地,氟替卡松的酯选自丙酸氟替卡松、糠酸氟替卡松和戊酸氟替卡松。氟替卡松目前可以糠酸氟替卡松和丙酸氟替卡松的形式商购获得。
[0039]
丙酸氟替卡松为具有化学名称s-(氟甲基)6α,9-二氟-11β,17-二羟基-16α-甲基-3-氧代雄甾-1,4-二烯-17β-硫代羧酸酯,17-丙酸酯的皮质类固醇。丙酸氟替卡松具有高亲脂性、高选择性和对糖皮质激素受体的亲和力、低的口服全身吸收和快速代谢清除。丙酸氟替卡松具有化学式(i)
[0040][0041]
糠酸氟替卡松具有化学式(ii)
[0042][0043]
剂型
[0044]
本发明提供了在作用部位处呈未离子化形式的阿卡他定和皮质类固醇(例如,丙酸氟替卡松或糠酸氟替卡松),从而改善其通过鼻粘膜的渗透性。喷雾剂可例如通过使用常规的喷雾-挤压瓶或泵汽化器来形成。另外,也可以使用压缩气体气溶胶。
[0045]
局部用组合物可以提供阿卡他定和皮质类固醇的同时或依次释放。局部用组合物可以是鼻用组合物,如鼻用溶液、鼻用悬浮液、鼻用粉末、鼻用喷雾剂、鼻用气溶胶、滴鼻剂、鼻用软膏、鼻用吸入剂或鼻用凝胶。
[0046]
在一个实施方案中,局部用组合物包含在0.05%至5%w/w的范围内的有效量的阿卡他定与在0.01%至5%w/w的范围内的有效量的氟替卡松或其酯(如丙酸氟替卡松或糠酸氟替卡松)的组合。例如,基于组合物的100%总重量计,局部用组合物可以包含0.1%w/w至4%w/w、如0.1%w/w至3%w/w、0.1%w/w至2%w/w、或0.1w/w%至1%w/w(例如,0.125%w/w、0.25%w/w或0.50%w/w)的阿卡他定。在一个实施方案中,阿卡他定以溶解的形式存在于组合物中。所述组合物可以包含0.01至0.1%w/w的皮质类固醇(如丙酸氟替卡松或糠酸氟替卡松),例如约0.036%w/w的丙酸氟替卡松或约0.02%w/w的糠酸氟替卡松。
[0047]
在一个实施方案中,阿卡他定或其药学上可接受的盐(例如,呈游离形式的阿卡他定)和丙酸氟替卡松以约5:1至约1:200或约1:1至约1:150、优选约1:2至约1:110的重量比存在。
[0048]
在一个实施方案中,阿卡他定或其药学上可接受的盐(例如,呈游离形式的阿卡他定)和糠酸氟替卡松以约5:1至约1:300或约3:1至约1:250、优选约1:1至约1:200的重量比存在。
[0049]
在另一个实施方案中,阿卡他定或其药学上可接受的盐(例如,呈游离形式的阿卡他定)和丙酸氟替卡松以约5:1至约1:250或约3:1至约1:200、优选约1:1至约1:180的摩尔比存在。
[0050]
在一个实施方案中,阿卡他定或其药学上可接受的盐(例如,呈游离形式的阿卡他定)和糠酸氟替卡松以约5:1至约1:500或约2:1至约1:400、优选约1:0.7至约1:360的摩尔比存在。
[0051]
在一个实施方案中,局部用组合物为悬浮液。例如,在局部用组合物中,阿卡他定呈溶解的形式而皮质类固醇(如氟替卡松或其酯,例如丙酸氟替卡松或糠酸氟替卡松)呈颗粒状形式。皮质类固醇(如丙酸氟替卡松或糠酸氟替卡松)可具有约1至约100μm、如约1至约10μm的d50。在一个实施方案中,皮质类固醇可具有约1至约100μm、如约3至约15μm的d90。
[0052]
局部用组合物可以包含一种或多种药学上可接受的赋形剂。合适的赋形剂包括但不限于粘膜粘附剂、缓冲剂、渗透剂或张力调节剂、螯合剂、渗透增强剂、表面活性剂、ph调节剂、悬浮剂、增稠剂(或粘度调节剂)、防腐剂、增溶剂和媒介物(如溶剂和共溶剂)。
[0053]
用于鼻内施用的局部用组合物可包含粘膜粘附剂以提供对鼻粘膜的更好粘附并改善阿卡他定和皮质类固醇在鼻粘膜上的停留。合适的粘膜粘附剂包括但不限于纤维素衍生物(如羟丙基甲基纤维素、羟乙基纤维素和羧甲基纤维素钠)、聚维酮、壳聚糖、泊洛沙姆和天然树胶(如瓜尔胶和黄原胶)。粘膜粘附剂通常是温度依赖性的,其在鼻腔中施用或喷射时在鼻粘膜上形成凝胶。该凝胶提供阿卡他定和皮质类固醇在鼻粘膜上的更长接触和停留时间,从而提供对鼻消减充血的长时间缓解。粘膜粘附剂可以以总组合物的重量的0.01%至10%、优选0.01%w/w至1%w/w(基于组合物计)、如0.01%w/w至0.9%w/w、0.01%w/w至0.7%w/w、0.01%w/w至0.5%w/w、0.01%w/w至0.3%w/w、或0.01%w/w至0.1%w/w的量使用。粘膜粘附剂可以是温度依赖性的,其在鼻腔中施用或喷射时在鼻粘膜上形成凝胶。该凝胶提供阿卡他定和皮质类固醇在鼻粘膜上的更长接触和停留时间,从而提供对鼻消减充血的长时间缓解。
[0054]
在一个实施方案中,所述组合物具有足够量的粘膜粘附剂以提供接触角小于109
°
、108
°
、107
°
、106
°
、105
°
、104
°
或103
°
的组合物。
[0055]
合适的缓冲剂包括但不限于磷酸二氢钠、磷酸氢二钠、磷酸一氢钠、磷酸三钠和磷酸氢二钾。缓冲剂可以以总组合物的重量的0.005%至2%、如0.0009%w/w至0.19%w/w、0.0009%w/w至0.1%w/w、0.009%w/w至0.1%w/w、0.007%w/w至0.1%w/w、或0.005%w/w至0.1%w/w的量使用。
[0056]
渗透剂或张力调节剂是指专门添加到组合物中以增加组合物中的溶质水平并有助于实现局部用组合物的等渗性的试剂。张力为“有效渗透压”并等于能够在膜上施加渗透力的溶质的浓度总和。合适的张力调节剂包括但不限于氯化钠、右旋糖(例如,右旋糖usp)、甘油(例如,甘油usp)、甘露糖醇(例如,甘露糖醇usp)和氯化钾(例如,氯化钾usp)。在一个实施方案中,用于鼻内施用的局部用组合物含有足以使组合物具有优选50-700mosmol/kg的鼻可接受的渗透压的量的氯化钠。张力调节剂可以以总组合物的重量的0.050%至7%的量使用。在一个优选的实施方案中,基于组合物计,鼻用药物组合物含有0.068%w/w至6.8%w/w的氯化钠,如0.068%w/w至5.8%w/w、0.068%w/w至4.8%w/w、0.058%w/w至3.8%w/w、0.058%w/w至2.8%w/w或0.058%w/w至1.8%w/w。
[0057]
合适的螯合剂包括但不限于依地酸二钠、二亚乙基三胺五乙酸(dtpa)、亚氨基二琥珀酸和乙二胺二琥珀酸。螯合剂可以以总组合物的重量的0.005%至0.5%的量使用。在一个实施方案中,基于组合物计,所述组合物包含在0.005%w/w至0.5%w/w的范围内的依地酸二钠二水合物,如0.005%至0.4%w/w、0.005%w/w至0.3%w/w、0.005%w/w至0.2%w/w或0.005%w/w至0.1%w/w。
[0058]
渗透增强剂可增强阿卡他定和/或皮质类固醇通过鼻粘膜的渗透。渗透增强剂可
以是含羟基基团的化合物。可以用作渗透增强剂的含羟基基团的化合物的非限制性实例包括醇(如乙醇)、二醇(如丙二醇(也称为1,2-丙二醇)、1,3-丙二醇、丁二醇(包括1,3-丁二醇、1,2-丁二醇、2,3-丁二醇和1,4-丁二醇)、己二醇、二丙二醇、1,5-戊二醇、1,2-戊二醇、1,8-辛二醇、驱蚊醇、对-薄荷烷-3,8二醇和2-甲基-2,4-戊二醇)、三醇(如甘油)、多元醇(如含有多个羟基基团的合适聚合物)(包括聚乙二醇(peg)、聚丙二醇、聚山梨醇酯和失水山梨醇酯及合适的糖醇)、环醇(如松醇、肌醇)、环状二醇(如环己二醇)、芳族二醇(如对苯二酚、双酚a、间苯二酚和邻苯二酚)或其任何组合。其他渗透增强剂包括但不限于胆盐、维生素e tpgs、烷基麦芽糖苷、具有hlb值8-14的非离子、阴离子或两性表面活性剂或其组合。这样的渗透增强剂的非限制性实例有甘氨胆酸钠、牛磺胆酸钠、十二烷基麦芽糖苷、十三烷基麦芽糖苷或十四烷基麦芽糖苷或其任何组合。在一个实施方案中,渗透增强剂可以以总组合物的重量的0.5%至50%的量存在于局部用药物组合物中,如2%w/w、5%w/w、7.5%w/w、10%w/w、20%w/w和40%w/w。
[0059]
合适的表面活性剂(或润湿剂)包括非离子、阳离子、两性和阴离子表面活性剂。合适的表面活性剂包括但不限于月桂基硫酸钠;山梨醇酐的脂肪酸偏酯的聚氧乙烯衍生物,如选自以下的聚山梨醇酯:聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯65、聚山梨醇酯80、聚山梨醇酯85、失水山梨醇脂肪酸酯如失水山梨醇单月桂酸酯(20)、失水山梨醇单棕榈酸酯(40)、失水山梨醇单硬脂酸酯(60)、失水山梨醇油酸酯(80)和失水山梨醇异硬脂酸酯(120);聚乙氧基化蓖麻油;聚乙氧基化氢化蓖麻油、十二烷基硫酸钠(月桂基硫酸钠)、聚氧乙烯失水山梨醇、辛基酚聚醚、聚氧乙烯10月桂基醚、聚氧乙烯蓖麻油、环糊精、卵磷脂、羧酸盐、磺酸盐、聚葡糖酸盐(短链淀粉)和木质素磺酸盐。在一个优选的实施方案中,表面活性剂可以以总组合物的重量的0.001或0.5%至60%(如0.001至0.1%w/w)的量使用。表面活性剂会影响来自递送的鼻用喷雾剂卷流的液滴的表面张力,从而产生具有窄液滴尺寸分布(dsd)的球形或基本上球形的颗粒,以及影响液体制剂的粘度。
[0060]
合适的ph调节剂包括但不限于盐酸、氢氧化钠、氢氧化铵、氢氧化镁、硫酸、磷酸、柠檬酸、苹果酸和酒石酸。ph调节剂可以以足以获得约3至约11、如约5至约9、约6至约8、约6至约7.5、约6.3至约7.3、或约6.7至约7.3的ph的量使用。
[0061]
合适的悬浮剂和增稠剂包括但不限于其中纤维素-羟基基团被低级不饱和脂族醇和/或低级不饱和脂族氧基醇(oxyalcohol)部分酯化的纤维素衍生物(例如,纤维素醚)(例如,甲基纤维素、羧甲基纤维素(例如,羧甲基纤维素钠)、羟丙基甲基纤维素和羟乙基纤维素)、明胶、聚乙烯基吡咯烷酮(聚维酮)、黄耆胶、褐藻酸、聚乙烯醇、聚丙烯酸、果胶、可能与或可能不与羧甲基纤维素钠共加工的微晶纤维素及其混合物。如果这些物质含有酸基团,则也可以使用相应的生理学上可接受的盐。可向根据本发明的溶液中加入增稠和悬浮剂以防止局部用组合物(如鼻用溶液)过快地流出鼻子并赋予溶液约100至约400cp的粘度。在一个优选的实施方案中,增稠剂和悬浮剂可以以总组合物的重量的0.1、0.2或0.5%至50%(如0.1或0.2%至5%w/w)的量使用。
[0062]
合适的防腐剂包括但不限于苯扎氯铵、山梨酸钾、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯丁醇、氯甲酚、氯己定、苯甲酸钠、苄醇和丙二醇。在一个优选的实施方案中,防腐
剂可以以总组合物的0.0025%至3%的量使用。在一个实施方案中,防腐剂可以以总组合物的0.0025%至2.5%的量使用。在另一个实施方案中,基于组合物的重量计,组合物含有0.0025%w/w至0.25%w/w的防腐剂,如0.0025%w/w至0.15%w/w、0.0025%w/w至0.1%w/w或0.0025%w/w至0.05%w/w。在一个优选的实施方案中,组合物包含苯扎氯铵。在一个实施方案中,基于组合物的重量计,组合物包含0.0025%w/w至2.5%w/w的苯扎氯铵。
[0063]
在另一个实施方案中,局部用组合物是无防腐剂的。
[0064]
合适的媒介物(如溶剂和共溶剂)和增溶剂包括但不限于纯化水、二醇如丙二醇、聚乙二醇、聚丙二醇、乙二醇醚、丙三醇(甘油)、聚氧乙烯醇和聚氧乙烯脂肪酸酯。基于组合物的重量计,媒介物或增溶剂可以以5%w/w至20%w/w的量存在于组合物中,如5%w/w至15%w/w、5%w/w至10%w/w或5%w/w至7%w/w。丙二醇和聚乙二醇可以以总组合物的5%w/w至20%w/w的量使用。纯化水可以以使得制剂至总组合物的重量的100%的量使用。
[0065]
在一个实施方案中,局部用组合物为其中阿卡他定或其药学上可接受的盐呈溶解的形式、皮质类固醇呈颗粒状形式并具有甘油、聚山梨醇酯(如聚山梨醇酯80)及微晶纤维素和羧甲基纤维素钠的混合物的稳定悬浮液。局部用组合物可以包含(a)按重量计0.050%至7%(如0.5至4%w/w)的甘油、(b)按重量计0.001至0.5%(如0.001至0.1%w/w)的聚山梨醇酯(例如,聚山梨醇酯80)和(c)按重量计0.1至5%(或0.2至5%)的微晶纤维素和羧甲基纤维素钠的混合物。在一个优选的实施方案中,微晶纤维素和羧甲基纤维素钠的混合物具有50至118cp的粘度(2.6%固体,120秒)并含有11.3-18.8%的羧甲基纤维素钠。
[0066]
在一个实施方案中,局部用组合物具有50至700mosmol/kg的渗透压,如100至600mosmol/kg或100至500mosmol/kg。
[0067]
在一个实施方案中,局部用组合物(例如,鼻用溶液)具有约100至约400cp的粘度。粘度可用brookfiled(dv ii+pro)ad-vs-02用ula轴和10ml样品在100rpm、环境温度和60秒测量时间下测量。粘度测量值可为三次测量的平均值。
[0068]
在一个实施方案中,局部用组合物的ph在约3至约11的范围内。在另一个实施方案中,局部用组合物的ph在约6至约8的范围内,如约6至约7.5或约6.7至7.3(如6.8、6.9、7.0、7.1或7.2)。局部用组合物可以包含有效量的缓冲剂以将ph维持在约3至约11、约6至约8、约6至约7.5或约6.7至7.3(如6.8、6.9、7.0、7.1或7.2)。
[0069]
在一个实施方案中,组合物具有小于109
°
、108
°
、107
°
、106
°
、105
°
、104
°
或103
°
的接触角。
[0070]
喷雾泵的性能可根据其发射的喷雾模式、卷流几何形状和/或液滴尺寸分布来表征。已知这些参数受喷嘴的尺寸和形状、泵的设计、计量室的尺寸和制剂的特性的影响。液滴尺寸受装置的致动参数和所施用的组合物的影响。普遍的中值液滴尺寸可在约30至约200μm之间。喷射后递送的卷流的喷雾特性(例如,卷流几何形状、喷雾模式、泵递送和液滴尺寸分布(dsd))可以在指定的实验和仪器条件下通过本领域已知的适宜且经验证和/或校准的分析程序来测量。这些包括摄影、激光衍射和冲击系统(如级联冲击和下一代冲击(ngi))。
[0071]
在一个实施方案中,本文描述的局部用药物组合物在3cm处的液滴尺寸分布中d10不大于40μm(例如,约5至约30μm),d50不大于80μm(例如,约30至约200μm或约10至约50μm),d90不大于180μm(例如,约40至约100μm)和/或跨度不大于3(例如,约1.0至约3.0)。在一个
实施方案中,喷雾内容物均匀性为约85至约115%。
[0072]
在另一个实施方案中,本文描述的局部用药物组合物在6cm处的液滴尺寸分布中d10不大于40μm(例如,约5至约30μm),d50不大于80μm(例如,约30至约200μm或约10至约50μm),d90不大于180μm(例如,约40至约100μm)和/或跨度不大于3(例如,约1.0至约3.0)。在一个实施方案中,喷雾内容物均匀性为约85至约115%。
[0073]
喷雾模式的评价、喷嘴与收集表面之间的喷雾距离、每种喷雾模式的喷雾次数、收集表面相对于喷嘴的位置和取向以及可视化程序都用椭圆度和d
max
来定义。在一个实施方案中,本发明的局部用药物组合物在3cm处的喷雾模式中d
max
不大于100mm(例如,约20至约100mm)或不大于50mm(例如,约20至约50mm),d
min
不大于75mm(例如,约15至约75mm)或不大于25mm,椭圆度不大于2.0(例如,约0.5至约2.0),并且面积不大于2000mm2。在还另一个实施方案中,本发明的鼻用药物组合物在6cm处的喷雾模式中d
max
不大于100mm(例如,约30至约100mm),d
min
不大于75mm(例如,约25至约75mm),椭圆度不大于2.0(例如,约0.5至约2.0),并且面积不大于5000mm2。
[0074]
在还另一个实施方案中,局部用药物组合物提供特征在于以下中的一个或多个的液滴尺寸分布:(i)d10在不大于40μm(如5-25μm)的范围内,其中卷流中10%的液滴具有小于d10的尺寸,(ii)d50不大于80μm(例如,10至70μm),其中卷流中50%的液滴具有小于d50的尺寸,(iiii)d90小于200μm或不大于120μm,其中卷流中90%的液滴具有小于d90的尺寸,(iv)跨度为1至6,如不大于3,其中跨度按(d90-d10)/d50计算,或任何前述的任何组合。
[0075]
在本发明的又一个实施方案中,局部用组合物呈气溶胶或溶液的形式,其包括递送系统,如瓶子或泵递送或高密度聚乙烯容器或pet(聚对苯二甲酸乙二醇酯)容器或配备有鼻喷雾泵、计量剂量喷雾泵、吸入器、点滴器和供鼻内使用的其他形式的玻璃容器。所述组合物可在喷雾滴粒或小液滴的雾中递送以在施用时包覆鼻粘膜。用于本发明的此类产品中的优选泵为计量的多剂量泵。泵的选择基于每喷雾体积所需的剂量和适合于局部递送至鼻粘膜的喷雾模式。每喷的剂量可以在1ml至100ml的范围内,其中每喷可以递送每喷100μl至400μl。
[0076]
局部用组合物可呈气溶胶的形式并包含推进剂。推进剂可以是加压液体氯化、氟化烃或各种氯化、氟化烃的混合物以及丙烷、丁烷、异丁烯或它们之间的混合物或它们与在大气压和室温下为气态的氯化、氟化烃的混合物。氢氟烃(hfc)如hfc 134a和hfc 227a也可用作推进剂,并且出于环境原因是优选的。局部用组合物可以在压力下储存。气溶胶容器可以具有剂量或计量阀,其在致动时释放限定量的局部用组合物(例如,溶液或悬浮液)。随后推进剂的非常突然的汽化将阿卡他定的溶液或悬浮液撕裂成细小的液滴或微小的颗粒,这些液滴或颗粒可被喷入鼻中或可用于吸入到鼻中。可以使用某些塑料施加器来致动阀并将喷射的局部用组合物输送到鼻中。
[0077]
在另一个实施方案中,局部用组合物呈可吹入的粉末的形式,例如,其中组合物的最大粒度不超过10μm。阿卡他定或其盐和皮质类固醇可以与一种或多种惰性载体物质混合或吸收到一种或多种惰性载体物质上。例如,可以使用的载体物质包括糖(如葡萄糖、蔗糖、乳糖和果糖)、淀粉或淀粉衍生物、低聚糖(如糊精)、环糊精及其衍生物、聚乙烯基吡咯烷酮、褐藻酸、甲基纤维素、硅酸、纤维素、纤维素衍生物(例如纤维素醚)、糖醇(如甘露糖醇或山梨醇)、碳酸钙、磷酸钙以及任何前述的任何组合。
[0078]
制备方法
[0079]
一个实施方案为一种用于制备局部用药物组合物(如本文描述的那些)的方法,其包括步骤:(i)将ph调节剂(例如,盐酸)、张力调节剂(例如,氯化钠)和阿卡他定溶解在水中以形成第一活性相溶液,(ii)将悬浮剂、张力调节剂(例如,甘油)和皮质类固醇(例如,丙酸氟替卡松或糠酸氟替卡松)混合在水中以形成第一分散体,(iii)将悬浮剂(例如,微晶纤维素和羧甲基纤维素钠的共喷雾干燥组合)分散(并任选地均质化)在水中以形成第二分散体,(iv)向第二分散体中加入第一分散体以形成第二活性相溶液,(v)向水中加入螯合剂(例如,依地酸二钠如依地酸二钠二水合物)和缓冲剂(例如,磷酸二氢钠)以形成第三溶液,(vi)向第二活性相溶液中(例如,在搅拌下)加入第一活性相溶液和来自步骤(v)的第三溶液以获得分散体,(vii)向步骤(vi)中制得的溶液中加入防腐剂(例如,苯扎氯铵),(viii)任选地使用氢氧化钠调节来自步骤(vii)的溶液的ph(例如,到6.0至7.5、6.5至7.0或6.3至7.3的ph),和(ix)任选地向步骤(viii)的溶液中加入水(例如,纯化水)以获得所需的体积和/或每种组分的所需浓度。
[0080]
最终制剂可以通过spraytec表征液滴尺寸分布并通过copley表征粒度分布。
[0081]
通过如本文所述的方法制备的组合物可承受温度和相对湿度的加速稳定性条件并且在加速稳定性条件下保持它们的物理和化学完整性。
[0082]
治疗方法
[0083]
另一个实施方案为一种通过鼻内施用有效量的阿卡他定或其药学上可接受的盐和皮质类固醇(如包含阿卡他定或其药学上可接受的盐和皮质类固醇的局部用药物组合物)来在有此需要的患者中治疗过敏性鼻炎、过敏性鼻结膜炎或其症状(如鼻塞)的方法。优选地,鼻内施用本发明的局部用药物组合物。在一个实施方案中,患者患有过敏性鼻炎。在另一个实施方案中,患者患有季节性过敏性鼻炎。在还另一个实施方案中,患者患有常年性过敏性鼻炎。在还另一个实施方案中,患者患有中度至重度季节性过敏性鼻炎。在还另一个实施方案中,患者患有中度至重度常年性过敏性鼻炎。在一个实施方案中,局部用药物组合物以患者的每个鼻孔1或2喷鼻内施用,每天一次。在另一个实施方案中,局部用药物组合物以患者的每个鼻孔1或2喷鼻内施用,每天两次。每喷局部用药物组合物可以包含(i)约171.25mcg、约342.5mcg、约685mcg的阿卡他定和(ii)约49.9mcg的丙酸氟替卡松或约27.4mcg的糠酸氟替卡松。
[0084]
本发明的局部用药物组合物可在鼻孔中施用或施用于眼睛,每天一次或两次。在一个实施方案中,每天施用约340至约5500mcg的阿卡他定和约80至约400mcg的丙酸氟替卡松(如以一个剂量每天一次施用,或以两个等分剂量每天两次施用)。例如,每天可向每个鼻孔施用约170至约2740mcg的阿卡他定和约40至约200mcg的丙酸氟替卡松。在另一个实施方案中,每天施用约340至约5500mcg的阿卡他定和约50至约250mcg的糠酸氟替卡松(如以一个剂量每天一次施用,或以两个等分剂量每天两次施用)。例如,每天可向每个鼻孔施用约170至约2740mcg的阿卡他定和约25至约125mcg的丙酸氟替卡松。
[0085]
在一个实施方案中,每个鼻孔施用一喷含有阿卡他定和皮质类固醇的局部用药物组合物(如本文描述的),每天一次。
[0086]
在另一个实施方案中,每个鼻孔施用两喷含有阿卡他定和皮质类固醇的局部用药物组合物(如本文描述的),每天一次。
[0087]
在还另一个实施方案中,每个鼻孔施用一喷含有阿卡他定和皮质类固醇的局部用药物组合物(如本文描述的),每天两次。
[0088]
在还另一个实施方案中,每个鼻孔施用两喷本文描述的局部用药物组合物,每天两次。
[0089]
每喷局部用药物组合物可以提供约170至约685mcg的阿卡他定(以游离碱计),如约171.25、342.5或685mcg的阿卡他定。每喷局部用药物组合物可以提供49至51mcg的丙酸氟替卡松(如约49.9mcg的丙酸氟替卡松)。每喷局部用药物组合物可以提供26至29mcg的糠酸氟替卡松(如约27.4mcg的糠酸氟替卡松)。
[0090]
在一个实施方案中,每天一次或两次向每个鼻孔施用约170至约1370mcg的阿卡他定和约40至约100mcg的丙酸氟替卡松。在另一个实施方案中,向每个鼻孔施用约171.25、342.5、685或1370mcg的阿卡他定和约49.9mcg的丙酸氟替卡松,每天一次。在还另一个实施方案中,向每个鼻孔施用约171.25、342.5、685或1370mcg的阿卡他定和约49.9mcg的丙酸氟替卡松,每天两次。
[0091]
在另一个实施方案中,每天一次或两次向每个鼻孔施用约170至约1370mcg的阿卡他定和约25至约60mcg的糠酸氟替卡松。在另一个实施方案中,向每个鼻孔施用约171.25、342.5、685或1370mcg的阿卡他定和约27.4mcg的糠酸氟替卡松,每天一次。在还另一个实施方案中,向每个鼻孔施用约171.25、342.5、685或1370mcg的阿卡他定和约27.4mcg的丙酸氟替卡松,每天两次。
[0092]
在本文描述的方法的一个实施方案中,每天向有此需要的患者施用约340至约5480mcg的阿卡他定和约90至约400mcg的丙酸氟替卡松。在另一个实施方案中,每天向有此需要的患者施用约340至约1370mcg的阿卡他定和约90至约200mcg的丙酸氟替卡松。在还另一个实施方案中,每天向有此需要的患者施用约340至约690mcg的阿卡他定和约90至约200mcg的丙酸氟替卡松。
[0093]
在本文描述的方法的一个实施方案中,每天向有此需要的患者施用约340至约5480mcg的阿卡他定和约90至约420mcg的丙酸氟替卡松。在另一个实施方案中,每天向有此需要的患者施用约685至约2740mcg的阿卡他定和约90至约210mcg的丙酸氟替卡松。在还另一个实施方案中,每天向有此需要的患者施用约685至约1370mcg的阿卡他定和约90至约210mcg的丙酸氟替卡松。在还另一个实施方案中,每天向有此需要的患者施用约5000至约5480mcg(例如,5280mcg)的阿卡他定和约380至约420mcg(例如,399.2mcg)的丙酸氟替卡松。
[0094]
在本文描述的方法的另一个实施方案中,每天向有此需要的患者施用约340至约5480mcg的阿卡他定和约50至约220mcg的糠酸氟替卡松。在另一个实施方案中,每天向有此需要的患者施用约340至约1370mcg的阿卡他定和约50至约110mcg的糠酸氟替卡松。在还另一个实施方案中,每天向有此需要的患者施用约340至约690mcg的阿卡他定和约50至约110mcg的糠酸氟替卡松。
[0095]
在一个实施方案中,患者年龄为6至17岁。在另一个实施方案中,患者年龄是17或18岁或更大。
[0096]
定义
[0097]“药学上可接受的赋形剂”意指药物组合物中除活性成分外并经监管机构批准或
通常认为对人或动物使用安全的任何组分。
[0098]
如本文所用,术语“粘膜粘附”是指物质粘附或依附到鼻粘膜内的粘膜。在本发明的上下文中,粘膜粘附旨在表达当置于与鼻粘膜接触时能够粘附到该表面以使得本发明的组合物能够附着到该表面的材料。这样的材料在下文中统称为“粘膜粘附剂”或“粘膜粘附试剂”。
[0099]
术语“过敏性鼻炎”包括鼻粘膜的过敏反应并包括干草热、季节性过敏性鼻炎和常年性鼻炎(非季节性过敏性鼻炎),其特征在于季节性或常年性打喷嚏、流鼻涕、鼻塞、瘙痒和眼睛发痒、发红和流泪。
[0100]
除非另有说明,否则术语“患者”或“受试者”是指人类患者。患者年龄可为12岁或更大或者18岁或更大。患者年龄也可为6至17岁。
[0101]
在向患者施用疗法的上下文中,术语“治疗(treat/treatment/treating)”是指由一种或多种疗法的施用引起的疾病或病患的进展和/或持续时间的减少或抑制、疾病或病患的严重程度的减轻或改善和/或其一种或多种症状的改善。
[0102]“有效量”是相对于化合物不存在而言足以使化合物实现所陈述的目的(例如,减轻疾病或病患的一种或多种症状)的量。“有效量”的一个实例为足以有助于治疗、预防、延迟、抑制、压制或减轻疾病或病症的一种或多种症状的量,其也可被称为“治疗有效量”。“减轻”一种或多种症状(以及该表述的语法等同物)意指降低症状的严重程度或频率,或消除症状。药物的“有效量”可以是当施用于受试者时将具有预期的预防作用的药物量,例如,预防或延迟损伤、疾病、病理学或病患的发作(或复发),或降低损伤、疾病、病理学或病患或其症状的发作(或复发)的可能性。确切的量将取决于治疗的目的,并且可由本领域技术人员使用已知的技术确定(参见例如lieberman,pharmaceutical dosage forms(卷1-3,1992);lloyd,the art,science and technology of pharmaceutical compounding(1999);pickar,dosage calculations(1999);和remington:the science and practice of pharmacy,第20版,2003,gennaro,ed.,lippincott,williams&wilkins)。剂量可随患者的要求和采用的化合物而异。在本公开的上下文中,向患者施用的剂量应足以随时间的推移在患者中产生有益的治疗反应。剂量的大小也可由任何不良副作用的存在、性质和程度决定。针对特定的情况确定合适的剂量在执业医师的技能范围内。
[0103]
如本文所用,除非另有说明,否则术语“稳定”是指本发明的药物组合物在于25℃和60%相对湿度、30℃和60%相对湿度、或40℃和75%相对湿度下贮存3或6个月后具有存在的每种活性成分的初始量的至少90、95或98%。
[0104]
如本文所用,术语“盐”或“药学上可接受的盐”意指这些盐、溶剂化物和酯,它们在合理的医学判断范围内适合与人类和低等动物的组织接触使用而没有过度的毒性、刺激和过敏反应,与合理的风险收益比相称,并且对其预期用途有效。代表性的酸加成盐包括盐酸盐、糠酸盐、氢溴酸盐、硫酸盐、硫酸氢盐、乙酸盐、草酸盐、戊酸盐、油酸盐、棕榈酸盐、硬脂酸盐、月桂酸盐、硼酸盐、苯甲酸盐、乳酸盐、磷酸盐、甲苯磺酸盐、甲磺酸盐、柠檬酸盐、马来酸盐、富马酸盐、琥珀酸盐、酒石酸盐、抗坏血酸盐、葡庚糖酸盐、乳糖酸盐和十二烷基硫酸盐。代表性的碱金属或碱土金属盐包括钠、钙、钾和镁盐。
[0105]
与“包括”、“含有”或“特征在于”同义的过渡性术语“包含”是容他性的或开放性的而不排除另外的、未记述的要素或方法步骤。说明书应理解为还包括用过渡性表述“由
……
组成”或“基本上由
……
组成”代替过渡性表述“包含”的实施方案。过渡性表述“由
……
组成”排除权利要求书中未指定的任何要素、步骤或成分,但与其相关的杂质之外。过渡性表述“基本上由
……
组成”将权利要求的范围限制为所指定的材料或步骤以及“不会实质性地影响所要求保护的发明的基本和新颖特征的那些材料或步骤”。
[0106]
本发明通过参考以下实施例进一步说明,这些实施例仅出于说明的目的而不以任何方式限制本发明的范围。
[0107]
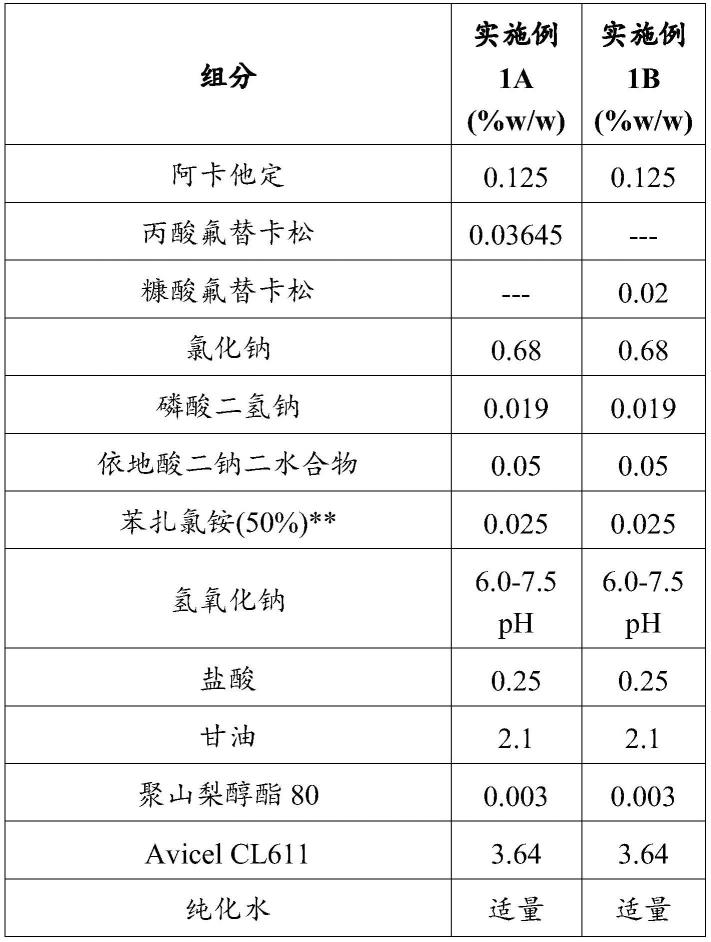
实施例1a和1b
[0108]
制备下表1a中示出的水性组合物。
[0109]
表1a
[0110][0111]
**-实施例1a和1b包含0.0125%w/w的苯扎氯铵,因为它以50%苯扎氯铵溶液的形式并入到组合物中。
[0112]
avicel cl611(可得自fmc corporation(宾夕法尼亚州费城))为微晶纤维素和11.3至18.8%的羧甲基纤维素钠的共喷雾干燥组合。
[0113]
实施例1a和1b如下制备:
[0114]
a)阿卡他定相溶液的制备:向合适的量的纯化水中加入盐酸、氯化钠和阿卡他定并搅拌以获得澄清的阿卡他定相溶液。
[0115]
b)氟替卡松相溶液的制备:向合适的量的纯化水中加入聚山梨醇酯80、甘油和丙酸氟替卡松或糠酸氟替卡松并均质化以获得第一均匀分散体。分开地将微晶纤维素和羧甲基纤维素钠分散并均质化在水中以获得第二均匀分散体。向第二均匀分散体中加入第一均匀分散体以获得氟替卡松相溶液。
[0116]
c)向纯化水中加入依地酸二钠和磷酸二氢钠并搅拌以获得澄清的第三溶液。
[0117]
d)在搅拌下向步骤(b)的氟替卡松相溶液中加入步骤(a)的阿卡他定相溶液和来自步骤(c)的第三溶液以获得均匀分散体。
[0118]
e)向步骤(d)中制得的分散体中加入苯扎氯铵并搅拌以获得均匀分散体。
[0119]
f)使用氢氧化钠(1m)将步骤(e)中制得的分散体的ph调节至6.0-7.5。
[0120]
g)向步骤(f)的分散体中加入纯化水以获得所需的浓度和体积。
[0121]
每喷实施例1a和1b可提供123.3至150.7mg(例如,137μl)的组合物,对于含有0.125%w/w阿卡他定的组合物,其将提供171.25mcg的阿卡他定。每喷实施例1a提供49.9mcg的丙酸氟替卡松。每喷实施例1b提供27.4mcg的糠酸氟替卡松。
[0122]
通过最初和在于(a)25℃和60%相对湿度(rh)、(b)30℃和75% rh或(c)40℃和75% rh下贮存3个月和6个月(3m和6m)后测量杂质的量、ph、粘度、射流重量和喷雾模式来评估实施例1a和1b的稳定性。结果示于下表1b-1g中。
[0123]
表1b
[0124]
[0125][0126]
n.d.=未测定。
[0127]
表1c
[0128][0129]
表1d
[0130]
[0131][0132]
表1e
[0133]
[0134][0135]
表1f
[0136][0137]
表1g
[0138][0139]
实施例2
[0140]
通过实施例1中描述的程序制备表2a和2b中示出的水性组合物2a-2h。
[0141]
表2a
[0142][0143]
表2b
[0144]
[0145][0146]
实施例3:鼻内阿卡他定的苦度
[0147]
评价下表中示出的阿卡他定制剂的苦味并与不含阿卡他定的类似制剂(安慰剂制剂)和三种商业鼻内产品(和)进行比较。
[0148]
成分%w/w阿卡他定0.125苯扎氯铵0.025依地酸二钠0.050磷酸二氢钠0.019氯化钠0.68羟丙甲纤维素29100.1盐酸0.25氢氧化钠适量纯化水适量
[0149]
如下制备阿卡他定制剂:
[0150]
a)活性相溶液的制备:取合适的量的纯化水并在搅拌下溶解苯扎氯铵。向该溶液中加入阿卡他定并搅拌以获得均匀分散体。加入盐酸和氯化钠以获得澄清的溶液。
[0151]
b)本体溶液的制备:取合适的量的纯化水,加入羟丙基甲基纤维素(羟丙甲纤维素2910)并搅拌以获得澄清的溶液。加入依地酸二钠和磷酸二氢钠并搅拌以获得澄清的溶液。
[0152]
c)添加阶段:在搅拌下向步骤b)中制得的本体溶液中加入步骤a)中制得的活性相溶液并获得澄清的溶液。用纯化水冲洗活性相溶液容器并加到本体溶液中。搅拌本体溶液并得到澄清的溶液。
[0153]
d)ph调节:使用氢氧化钠将步骤c)中制得的溶液的ph调节到6.0至8.0。
[0154]
e)使用纯化水补足至批次的体积。
[0155]
根据以下评价标准在20名志愿者中评价制剂。
[0156]
评价标准得分非常苦4比较苦3中度苦2无苦味1
[0157]
结果示于下表中。
[0158][0159]
发现与盐酸氮卓斯汀和盐酸奥洛他定相比,阿卡他定具有更可接受的味道。
[0160]
实施例4:鼻内阿卡他定的药代动力学
[0161]
下面示出的实施例4a、4b和4c的鼻用制剂通过如实施例3中针对阿卡他定制剂描述的方法制备。
[0162][0163]
各对6只雄性新西兰白兔测定阿卡他定试验制剂4a、4b和4c以及奥洛他定鼻用制剂的药代动力学特征。奥洛他定鼻用制剂(0.6%w/v)由olopat0.7%w/v制备,其中通过使用纯化水将olopat稀释至0.6%w/v。
[0164]
研究对总共24只雄性新西兰白兔进行,将这些白兔分成四组(g1至g4,6只兔/组)。通过吸入2%的异氟醚在所有兔中诱导轻度麻醉。使用实施例10a、10b和10c的制剂给三组麻醉兔(g1-g3)鼻内施用250μl阿卡他定,每天一次。以0.6%w/v的浓度向第四组麻醉兔g4鼻内施用对照物250μl奥洛他定,每天一次。
[0165]
试验和参考制剂的采样细节:经由边缘耳静脉从每只兔抽取大约0.5ml血液样品到含有10% edta作为抗凝剂的预先标记的eppendorf管中。在试验和参考制剂的施用后0分钟、5分钟、10分钟、15分钟、30分钟、60分钟、120分钟、240分钟、480分钟和1440分钟时抽取血液样品。
[0166]
样品制备程序:将采集的血液样品轻轻混合并保存在碎冰上。在4℃下以3500rpm离心10分钟后分离血浆样品。在样品采集后30分钟内进行血浆分离并贮存在-70
±
10℃下。通过静脉内施用过量的硫喷妥钠注射液来对动物实施安乐死,并收集鼻上皮。使用磷酸盐缓冲溶液(20%匀浆)将一半的鼻上皮组织匀浆以定量阿卡他定和奥洛他定。将剩余的一半组织储存在10%中性缓冲福尔马林中,用于详细的组织病理学大体检查,如坏死、炎症或尸检期间的任何变化。
[0167]
使用适合于目的的lc-ms/ms方法测定阿卡他定或奥洛他定的兔血浆和鼻上皮组织浓度,lloq分别为0.500ng/ml或0.250ng/ml。使用phoenixent-8.0版通过非房室分析评价药代动力学参数。
[0168]
结果:向新西兰兔施用1.5mg奥洛他定后达到峰值浓度的时间为单次施用后0.38
小时。在以0.312mg、0.625mg和1.25mg的剂量单次鼻内滴注阿卡他定后,发现所有三个组达到最大浓度的时间(t
max
)为0.08小时。在1.5mg剂量下,t
max
比奥洛他定早得多。因此,鼻内阿卡他定表现出比鼻内奥洛他定更快的起效。
[0169]
在以0.625至1.25mg的剂量单次施用阿卡他定后,曲线下面积(auc
0-24h
)和峰值血浆浓度(c
max
)与剂量成比例。
[0170]
在向兔鼻内施用0.312mg、0.625mg和1.25mg的剂量的阿卡他定后,在三个组中的任一个中均未观察到炎症或刺激的体征或症状。在组织病理学检查时,在施用试验和参考制剂的组中的少许动物中观察到鼻上皮中的极少至轻度炎性细胞(淋巴细胞/异嗜白细胞)浸润和粘液分泌增加。
[0171]
发现阿卡他定的血浆浓度与总体低全身暴露量呈剂量比例。
[0172]
本技术中援引的所有出版物、专利和专利申请通过引用并入本文,其引用的程度犹如每个单独的出版物、专利或专利申请被具体地和单独地指出通过引用并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1