用于预防和/或治疗哺乳动物疾病的组合物和方法与流程
1.本发明涉及用于治疗哺乳动物疾病的组合物和方法,所述疾病的特征在于病毒感染和/或与免疫系统病症相关的疾病和/或病毒性癌症。
背景技术:
2.被称为人类免疫缺陷病毒(“hiv”)的病毒,被分类为逆转录病毒,已经影响了全世界数百万人的生活。如果不加以治疗,该病毒感染的健康人类个体将在几年内进展为发展获得性免疫缺陷综合征(“aids”)(mann,j.等人(2016),《the latest science from the ias towards an hiv cure symposium》,2016年7月16-17日,德班,南非”,(7月),235-241页)。
3.hiv是逆转录病毒的慢病毒家族的成员(teich等人,1984年,rna tumor viruses,weiss等人编辑,csh出版社,949-956页)。逆转录病毒是含有单链rna基因组的小包膜病毒,并且通过由病毒编码的逆转录酶(一种rna依赖性dna聚合酶)产生的dna中间体复制(varmus,h.,1988年,《science》240期,1427-1439页)。
4.其他逆转录病毒包括例如致癌病毒,如人t细胞白血病病毒(htlv-1、-ii、-iii)和猫白血病病毒。
5.hiv结构和基因组组织
6.成熟的hiv病毒粒子是直径为100nm-120nm的球形结构,其由脂质双层膜组成,所述脂质双层膜包围致密的截头圆锥形核衣壳(“核心”)。核心含有两个9.8kb长的正单链线性rna分子、初始cdna合成分子、细胞trna、gag多蛋白、病毒包膜(env)蛋白和三种酶:逆转录酶(rt)、病毒蛋白酶(pr)、整合酶(in)和一些其他细胞因子(s sierra等人,2005年)。
7.hiv基因组含有侧接长末端重复(“ltr”)的辅助和调节基因。病毒基因组具有总共九个基因,其可以分成三个功能组:
8.·
结构基因,gag、pol和env;
9.·
调节基因,tat和rev;和
10.·
辅助基因,vpu、vpr、vif和nef(jm costin,2007年)。
11.gag基因编码核心蛋白,pol基因编码rt、蛋白酶、整合酶,并且env基因编码包膜蛋白(gp160)。tat基因编码tat蛋白,rev基因编码rev蛋白。tat和rev调节蛋白作为rna结合蛋白起作用。除了rna结合之外,tat蛋白还充当转录激活因子,确保形成hiv的全长基因组。rev蛋白还有助于hiv的基因表达从早期转变到晚期。另一方面,由辅助基因编码的辅助蛋白是多功能的。nef或负性因子参与t细胞活化、细胞上存在的主要组织相容性复合物(mhc)i和cd4的下调通过溶酶体中的脱粒产生表面活性,并且还刺激病毒体感染性。vpr作为核质转运因子,其允许hiv感染非分裂细胞。vpu通过离子通道的发育增强病毒粒子的释放,并且还通过泛素介导的降解下调cd4的表达。hiv在淋巴细胞、单核细胞和巨噬细胞中的复制受vif调节。
12.病毒粒子的包膜含有跨膜蛋白gp120和gp41,其以刺突的形式从病毒粒子向外突
出(数量多达72个)。作为一种高免疫原性蛋白,与cd4受体结合的gp120是大多数宿主抗体的合适靶标。这些毒株特异性抗体中的大多数通过结合这些受体来阻断cd4受体与gp120蛋白的相互作用。位于脂双层下面的基质由gag蛋白17(病毒gag蛋白切割产物)组成。核心或衣壳含有p24蛋白(gag基因的产物)的覆盖物和第三gag蛋白p7(lampejo t等人,2013年)。
13.hiv生命周期
14.人类免疫缺陷病毒的病毒进入基本上分为三个步骤:
15.(1)结合;
16.(2)激活;和
17.(3)融合。
18.主要的hiv-1和hiv-2受体和共受体分别是cd4和ccr5、cxcr4。该循环开始于细胞表面上hiv包膜三聚体复合物gp120和gp41与mhc ii类分子的cd4受体(58kda单体糖蛋白)主要共受体的识别。在cd4与gp120结合后,发生构象变化,导致gp120结构域暴露于其中ccr5趋化因子共受体结合。到目前为止,在该过程中鉴定了17种趋化因子受体配体(fanales-belasio等,2010年)。
19.在gp120双重结合后,形成稳定的连接复合物,其允许gp120肽的n-末端侧渗透到质膜中。在gp41蛋白中,hr1和hr2序列一起作用并形成gp41的发夹结构,其引起病毒和细胞膜的融合(s sierra等人,2005年)。
20.在融合病毒核心在细胞质中释放后,通过病毒的ma、nef和vif蛋白因子介导发生病毒衣壳的脱壳(lampejo t等,2013年)。
21.通过病毒rt核糖核酸酶h位点,病毒rna从引物结合位点开始转录成dna。转录完成后,核糖核酸酶h破坏dsrn/dna杂合体,并通过rt聚合活性位点转化为dsdna(fanales-belasio等,2010年)。通过整合酶将该dsdna整合到宿主细胞基因组中获得前病毒状态。整合酶蛋白在每条dna链的3'末端产生粘性末端。现在,修饰的病毒dna通过核孔在病毒vpr的指导下输出到核,并且整合功能由该整合酶(sierra s)完成。
22.对于待表达的病毒基因组,宿主基因组整合位点应处于活性状态(fanales-belasio)。
23.在原病毒状态下,病毒dna可以在宿主基因组中保留数年,并且在接收激活信号时使用宿主聚合酶表达mrna(yousaf mz等人,2011年)。
24.潜伏感染的t细胞、巨噬细胞、单核细胞和小胶质细胞是hiv基因组的主要储库。在活性细胞状态下,hiv基因组的转录由于宿主rna聚合酶ii和其他转录因子通过与病毒ltr结合而开始。转录后,翻译产生基础量的蛋白质(tat、rev和nef)。在充分产生tat时,通过tat与ltrs上的tar元件和其他转录细胞激活因子的结合来控制进一步的转录。在早期阶段,多重剪接的mrna产生rev、tat和nef。在达到足够量的rev时,产生非剪接和更长的mrnas,称为多核糖体,导致产生其他病毒蛋白和基因组rna。在未剪接的rna rre上,rev应答元件存在于其中,rev结合并导致安全转运至细胞质以进行翻译(lampejo t)。
25.rev还引起酶和结构蛋白的表达以及调节蛋白的抑制,因此在产生成熟病毒粒子中起作用。在细胞质中,env基因被翻译成在er中糖基化的gp160,通过hiv-1蛋白酶(fanales-belasio)产生成熟的gp120和gp140。
26.在翻译期间,导致gag pol蛋白的核糖体-1移码包括pr、rt和in。成熟病毒粒子的
细胞核由gag和pol基因蛋白形成。由大的160kda前体gag和pol蛋白形成,被病毒蛋白酶切割成p24、p9、p7、p17gag终产物和pol产物。这种切割对于感染性病毒颗粒env蛋白是必需的,其在翻译后向膜移动并插入其中。gag和gag-pol多聚蛋白也向细胞膜移动并开始由gag多聚蛋白介导的组装。全尺寸基因组rna、细胞trnalys-3-引物、酶和所有细胞化合物变得与未成熟的病毒核心(sierra s)连接。
27.未成熟病毒的出芽通过质膜发生。当病毒装配和出芽发生时,细胞表面上cd4分子的数量必须减少。nef、env和vpu参与该过程。早期阶段的nef介导mhc i类和ii类分子的内吞作用和吞噬。在后期,npu诱导cd4分子的降解。在出芽期间,发生蛋白质蛋白酶的活化,其自催化切割gag和gag-pol多蛋白,产生结构蛋白和病毒酶。单个蛋白质与衣壳、核衣壳蛋白的进一步相互作用导致圆锥形核衣壳,并且ma保持与病毒包膜相关联(sierra s)。
28.hiv感染的目前治疗方式
29.hiv感染的目前治疗方式涉及以下的组合:
30.·
非核苷逆转录酶抑制剂;
31.·
核苷逆转录酶抑制剂;和
32.·
蛋白酶抑制剂。
33.这种药物组合通常被称为高效抗逆转录病毒治疗(“haart”)。向患者提供haart,目的是通过抑制病毒dna掺入宿主dna中,并且还通过抑制病毒rna形成病毒dna来减缓aids发展(chupradit k等人,2017年,《current peptide and protein candidates challenging hiv therapy beyond the vaccine era》,viruses,9(10),1-14页.doi:10.3390/v9100281)。
34.这些只是给予hiv测试阳性患者的几种药物及其作用机制。
35.迄今为止,开发针对hiv感染的疫苗或治疗hiv感染的尝试尚未取得成功。
36.疫苗开发的典型方法是用病毒的部分感染身体并引发抗体应答。当接种的宿主在将来被真正的病毒感染时,免疫系统将识别疫苗中包含的病毒的抗原,并且将立即引发压倒性的免疫应答。虽然这种疫苗开发策略适用于一些病毒,但由于hi病毒突变的能力,它不适用于负责hiv感染和随后的aids的hi病毒。作为hi病毒突变的结果,病毒抗原的检测被延迟,允许病毒感染的细胞增殖。
37.在人类中,hiv复制主要发生在cd4+t淋巴细胞群中,并且hiv感染导致这种细胞类型的消耗,并最终导致免疫功能不全、机会性感染、神经功能障碍、肿瘤生长,并最终死亡。
38.发明名称为《drug delivery devices and methods for treatment of viral and microbial infections and wasting syndromes》的南非专利1998/04649教导了一种用于透皮施用治疗剂的药物递送装置,其包含含有或其上吸收有包含极性化合物n,n-二甲基甲酰胺(“dmf”)的治疗组合物的储库。
39.根据前述专利(za 1998/064649)的教导,对一些实验个体而言,尽管感染了hiv,但在没有进行抗逆转录病毒治疗的情况下,维持了超过350的cd4+t细胞计数超过20年。这些个体在本文中称为长期非进展者(“ltnp”)。
40.例如其中一个实验个体最初在1996年12月进行hiv pcr检测时,在其血浆中检测到63.298个hiv-1rna拷贝/ml。在参与透皮dmf研究数年之后,2006年3月进行的后续hiv pcr检测时,其血浆中检测到低于40个hiv-1rna拷贝/ml;更令人感到兴奋的是,在2011年,
进一步的后续hiv pcr检测时,血浆中未检测到hiv-1rna拷贝/ml,cd4计数为920/μl。
41.dmf的作用模式尚未完全了解,但对这组ltnp个体的进一步研究显示他们的cd8+细胞产生升高水平的称为ksp37的蛋白质。
42.产生ksp 37的cd8+细胞的特征包括:
43.·
这些细胞的表型类型标记是:cd 27、cd45ro和cd 57;
44.·
已经证实这些细胞的信号分子是mip-1β(bennett,salter和smith,2018年,《anew class of antiretroviral enabling innate immunity by protecting apobec3 from hiv vif-dependent degradation》,《trends in molecular medicine》.elsevier ltd,24(5),507-520页.doi:10.1016/j.molmed.2018.03.004.)。
45.虽然ksp 37存在于所有人和许多其它动物体内,但其通常以小于400ng/ml的量存在。而ltnp个体中ksp37的水平通常被认为是hiv在这些个体中不能进展的关键原因。
46.蛋白ksp 37的特征
47.ksp 37基因(也称为fgbp2)通常由nk、cd8+t、cd8+t和cd4+t细胞表达,由223个氨基酸组成(ogawa等,2001年,《a novel serum protein that is selectively produced by cytotoxic lymphocytes》,《the journal of immunology》,166(10),6404-6412页,doi:10.4049/jimmunol.166.10.6404)。
48.已分离称为ksp37或37kda的杀伤细胞特异性分泌蛋白或成纤维细胞生长因子结合蛋白2(fgf-bp2)的蛋白质,并如下测序:
49.起始
50.1 ccctttaaag ggtgactcgt cccacttgtg ttctctctcc tggtgcagag ttgcaagcaa
51.61 gtttatcaga gtatcgccat gaagttcgtc ccctgcctcc tgctggtgac cttgtcctgc
52.121 ctggggactt tgggtcaggc cccgaggcaa aagcaaggaa gcactgggga ggaattccat
53.181 ttccagactg gagggagaga ttcctgcact atgcgtccca gcagcttggg gcaaggtgct
54.241 ggagaagtct ggcttcgcgt cgactgccgc aacacagacc agacctactg gtgtgagtac
55.301 agggggcagc ccagcatgtg ccaggctttt tggaagaaga gagtttctaa tcagatgcaa cggcccaaat tcttgatctg cagcttctct
56.901 gaagtttgga aaagaaacct tcctttctgg agtttgcaga gttcagcaat atgataggga
57.961 acaggtgctg atgggcccaa gagtgacaag catacacaac tacttattat ctgtagaagt
58.1021 tttgctttgt tgatctgagc cttctatgaa agtttaaata tgtaacgcat tcatgaattt
59.1081 ccagtgttca gtaaatagca gctatgtgtg tgcaaaataa aagaatgatt tcagaaat
60.该序列以登录号ab 021123保存,用于blast鉴定。该蛋白与人成纤维细胞结合蛋白2具有99%的相似性(ogawa等,2001)。因此,fgfbp2通常被视为杀伤细胞特异性分泌蛋白37的等价替代物。fgfbp2基因在黑猩猩、恒河猴、鸡、斑马鱼和青蛙中是保守的。137种生物体具有与人基因fgfbp2的直向同源物。
61.在本发明所处的时代,还没有对ltnp中ksp 37水平或ltnp、hiv阴性个体、接受haart的hiv阳性个体和尚未开始治疗的hiv阳性个体之间ksp 37水平差异进行充分的研究。
62.鉴于上述情况,需要鉴定和表征由长期无进展者的活化cd8+t淋巴细胞分泌的蛋
45kda范围内的ksp 37蛋白在制备用于治疗和/或保护受试者免于以病毒感染为特征的疾病和/或与免疫系统病症相关的疾病和病毒性癌症的药物中的用途,其中所述药物将所述受试者中ksp37蛋白的水平增加至400ng/ml至700ng/ml。
75.本发明还进一步提供了一种药物组合物,其用于保护受试者免受以病毒感染为特征的疾病和/或与免疫系统障碍和病毒相关的疾病的方法中,所述药物组合物包含具备疗效的以下一种或多种物质:一种临床修饰的或遗传工程改造的ksp 37蛋白和/或分子量在24kda-45kda范围内的蛋白,和/或用ksp 37基因编码的载体,所述ksp 37基因将翻译成分子量在24kda-45kda范围内的ksp 37蛋白和/或蛋白,和/或极性化合物。
76.ksp 37蛋白或修饰的蛋白的疗效剂量包括当在合适的时间段内施用一次或多次时能够将受试者(哺乳动物)中ksp 37蛋白的水平增加至400ng/ml-700ng/ml的量,并且在0.001μg/kg和20μg/kg之间。
77.药物组合物或药物可另外包含药学上可接受的赋形剂,包括但不限于水、盐水、磷酸盐缓冲溶液、林格氏溶液、右旋糖溶液、汉克氏溶液、含有生理平衡盐溶液的聚乙二醇和其他水性生理平衡盐溶液以及非水性媒介物,例如固定油、芝麻籽油、油酸乙烯酯甘油三酯。
78.药物组合物或药物还可以包括能够将ksp37缓慢释放到哺乳动物体内的控释组合物。
79.药物组合物或药物可以通过可接受的施用途径施用于受试者,包括鼻、口服、局部、吸入、透皮、直肠或肠胃外施用。
80.能够增强ksp 37保护哺乳动物免受以病毒感染为特征的疾病的能力的其它化合物也可以包括在药物组合物或药物中,所述化合物包括但不限于能够调节细胞介导的免疫应答、调节t-辅助细胞活性、调节肥大细胞脱粒、保护感觉神经末梢、调节嗜酸性粒细胞和/或胚细胞活性和/或预防或松弛平滑肌收缩的化合物。
81.可以从血液成分和/或组织中提取ksp37蛋白,然后纯化、乙酰化、基因工程改造、克隆并转移回哺乳动物宿主体内,作为针对病毒感染和/或与免疫系统病症相关的疾病和/或病毒性癌症的治疗剂和/或预防性疫苗。
82.用于对抗病毒感染和/或与免疫系统病症相关的疾病和/或病毒性癌症的ksp37基因编码的载体含有翻译成与天然存在的ksp37蛋白相同的蛋白的核酸序列。
83.合适的载体包括pgem-t载体或pcmv3-c-gfpspark。
84.宿主细胞可以包括与宿主免疫系统相关的所有血液成分和哺乳动物组织细胞,所述宿主免疫系统被鉴定为产生ksp37的主要位置。
85.本发明还进一步提供了包含疗效剂量的极性化合物的药物组合物,其中所述极性化合物的疗效剂量是足以在受试者中将增加的ksp37产生激活至400ng/ml至700ng/ml的水平的量。
86.极性化合物优选是n,n-二甲基甲酰胺(dmf)。
87.用于激活ksp37产生的dmf的治疗有效剂量可以是导致约2mg/l-200mg/l、更优选约100mg/l-200mg/l、还更优选约150mg/l dmf的峰值血浆水平的剂量。特别优选的是dmf的峰值血浆水平为100mg/l-150mg/l或150mg/l-200mg/l。
88.病毒可以是逆转录病毒,并且病毒性癌症可以包括卵巢癌、白血病、伯基特淋巴
tccagtgtgagaacgttggattg-3'引物(各0.4μm)、5μl模板cdna、16μl无核酸酶的去离子水和25μl 2x预混物。pcr反应包括在95℃变性90s,引物在59℃退火30s,并在72℃延伸1min,7min。在室温下,在75伏特(v)下,在2%琼脂糖凝胶电泳上分析pcr产物至少60分钟。观察凝胶,并使用chemo(bio-rad)估计条带强度。然后使用限制性片段长度多态性确定蛋白质多态性。
105.d.不同组中的细胞因子定量
106.使用来自健康供体的新鲜外周血的单个人cd8淋巴细胞中细胞因子蛋白的直接定量测量,在不同组中确定所选细胞因子(ifn-γ、il-5、gm-csf、tnf-αil-2、il-13、il-4il-10、il12p70)的量(saxena等人,2018年,《ultrasensitive quantification of cytokine proteins in single lymphocytes from human blood following ex-vivo stimulation front.immunol.》,9:2462.doi:10.3389/fimm.2018.02462.ecollection2018)。
107.结果
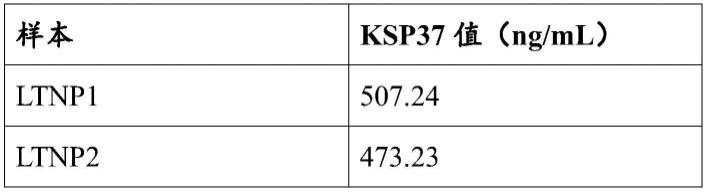
108.实时pcr分析显示ksp37水平如下表所示:
109.[0110][0111]
表1:ksp37值
[0112]
当与其他研究组的血清相比时,实时pcr结果证实了通过用于检测ltnp血清中的ksp37的较少循环(平均26个循环)观察到的hplc峰,如下图所示:
[0113][0114]
该结果表明,长期无进展者组的血清具有显著更高水平的蛋白ksp 37。
[0115]
还发现该蛋白质与更高水平的其他细胞因子和蛋白质(即il-12p70、ifn-γ和il-4)相关,如下表2所示。水平以ng/ml测量
[0116]
[0117][0118]
表2:细胞因子结果
[0119]
应当注意的是,所用样品来自培养的细胞,因此上表的值不代表从直接取自人宿主的样品中预期的细胞因子值,但是这些值确实指导了关于与高水平ksp 37相关的免疫途径的观察。
[0120]
ifn-γ和ip-12p70的产生部分地由正反馈环调节,其中ifn-γ和gm-csf促进il-12p70产生,并且il-12p70继而刺激ifn-γ和gm-csf分泌。il-12p70和ifn-γ促进th1分化,有利于细胞介导的免疫并抑制th2应答。
[0121]
当考虑上述ifn-γ结果时,ltnps的平均值显著高于来自其他研究组的值。ifn-γ是对先天和适应性免疫都至关重要的细胞因子,并且除了刺激自然杀伤细胞和嗜中性粒细胞之外,还作为巨噬细胞的主要激活剂起作用。
[0122]
ifn-γ已被鉴定为hiv感染中更好的疾病预后的相关因子,并且与cd8+t细胞和活化的nk细胞计数正相关(l
ó
pez m等人,2011年,《the expansion ability but not the quality of hiv-specific cd8+t cells is associated with protective human leucocyte antigen class i alleles in long-term non-progressors》,《immunology》,134(3),305-313页.doi:10.1111/j.1365-2567.2011.03490.x.)。
[0123]
类似地,当考虑il-12p70值时,ltnps的平均值显著高于来自其他研究组的值。il-12p70刺激t细胞的生长和功能,从t细胞和自然杀伤(nk)细胞产生干扰素-γ(ifn-γ)和肿瘤坏死因子-α(tnf-α),并减少il-4-介导的ifn-γ抑制。
[0124]
在被siv感染的猕猴中,急性感染期间的il-12p70治疗与病毒载量降低、cd8+nk和t细胞增加、表达归巢标记物的幼稚cd4+t细胞减少、hiv特异性ctl保留和存活延长相关。
[0125]
上述结果还表明当与其他研究组相比时,ltnp组中il-4的水平更高。il-4具有许多生物学作用,包括刺激活化的b细胞和t细胞增殖,以及b细胞分化为浆细胞。它是体液和适应性免疫中的关键调节剂。il-4诱导b细胞类别转换为ige,并上调mhc ii类产生。il-4和il-12p70具有互补作用。il-4的主要功能是刺激适应性免疫系统和cd8+细胞毒性细胞。整个il-12p70阻止il-4的抑制。
[0126]
最近的研究还表明il-10可以显著抑制单核细胞/巨噬细胞中的hiv-1复制。il-10对单核细胞/巨噬细胞中hiv-1产生的抑制作用是il-10诱导的对能够上调这些细胞中hiv-1表达的其他细胞因子(例如肿瘤坏死因子α和il-6)合成的抑制的结果。
[0127]
2.ksp 37的作用方式
[0128]
虽然对ksp 37的作用方式的研究正在进行中,但增加的ksp 37水平似乎通过许多不同的机制抑制hiv向aids的发展。这些包括:
[0129]
a.cd8+考虑
[0130]
ksp 37水平升高抑制hiv向aids发展的一种可能的机制与ksp 37(hiv gag特异性细胞)的产生位点有关。gag特异性cd8+细胞的特征在于cd107a ifn-γmip-1βil-2tnf-α的产生水平(t,h.c.d.等人(2006年)《immunobiology hiv nonprogressors preferentially maintain highly functional》,《blood》,107(12),4781-4789页.doi:10.1182/blood-2005-12-4818)。
[0131]
这些组分的产生被认为抵消hiv的免疫抑制能力。ksp37负责增加这些hiv特异性cd8+细胞的寿命。假设ksp 37还通过控制组分如穿孔素、tnf-α和il-2从cd8+细胞的释放来控制hiv的免疫抑制作用。ltnp个体对hiv感染的初始反应与其他研究组中所见的相同。一旦hiv特异性cd8+细胞在ltnp个体中被激活,就观察到一些结果。tnf-α的水平升高,但随着ksp37的水平升高而降低,如下表3所示:
[0132][0133]
表3:tnf-α和ksp 37的水平
[0134]
tnf-α在体内的主要作用与人体内的炎症有关。降低的tnf-α水平降低了活化位点的炎症,因此降低了cd4+细胞的应答。这使得病毒暴露在血流中并且不能感染cd4+宿主细胞。这允许hiv特异性cd8+细胞直接攻击病毒。病毒通常被病毒特异性cd8+t细胞消除,其识别在感染细胞表面作为与hla i类分子的复合物呈递的加工的病毒蛋白。通过t细胞受体(tcr)的识别启动了活化事件的级联,最终导致颗粒酶和穿孔素的释放以及感染细胞的杀伤,这可以在产生感染性子代病毒粒子之前发生(r.brad jones等人,2016年)。
[0135]
高il-2水平通过减少中枢记忆t细胞和增强效应物导致早期记忆t细胞的总体产生减少(t.kaartinen等人,2017年)。因此,il-2水平与cd8+t细胞的产生和/或寿命之间存在反比关系。表达ksp37的cd4和cd8 t细胞缺乏产生il-2的能力(ogawa等,2001年)。因此,高水平的ksp37与活化时较低水平的il-2产生相关。因此,ksp37的水平与il-2的水平成反比。
[0136]
因此,当ksp37水平高时,il-2低,并且cd8+记忆细胞产生随着寿命的延长而增加。这支持更强的杀死病毒的能力。免疫系统的初始活化是il-2的结果,并且一旦除去il-2,这就导致大量感染细胞死亡。由于hiv特异性cd8+细胞缺乏产生il-2的能力(ogawa等,2001年),因此这些细胞不受il-2水平的严重影响。
[0137]
如上所述,样品研究利用在实验室内和宿主免疫系统外生长的细胞,因此记录的il-2水平不能完全代表通常在ltnp宿主中发现的水平。
[0138]
假设极性试剂对致癌表达的作用是诱导癌细胞变得更良性。将恶性细胞转化为良性类型似乎是合理的,首先应该对导致恶性肿瘤的基因表达进行一些调节。
[0139]
ogawa等人在2001年进行的一项研究表明,ksp 37可能参与eb病毒患者中细胞毒性淋巴细胞介导的免疫的基本过程,并且ksp 37也可能具有临床价值,作为监测体内细胞毒性淋巴细胞的新型血清指示剂。ebv与伯基特淋巴瘤、鼻咽癌和一些形式的霍奇金病相关。ebv可以容易地感染和改变人b细胞的遗传密码,并且可以使免疫抑制患者易患恶性肿
瘤。
[0140]
b.ksp 37作为vif抑制剂
[0141]
ksp 37也被认为起vif抑制剂的作用。
[0142]
身体对逆转录病毒的天然免疫应答基于apobec3蛋白的功能。人apobec3(a3)蛋白是细胞胞苷脱氨酶,其通过使病毒cdna超突变和/或抑制逆转录来有效地限制逆转录病毒的复制。该家族有七个成员,包括a3a、b、c、d、e、f、g和h,全部在人染色体22上以串联阵列编码。a3f和a3g是hiv-1的最有效抑制剂,但仅在不存在病毒编码的蛋白质vif的情况下(shingo k等人,2011年)。
[0143]
胞苷脱氨酶apobec3g(a3g)发挥针对hiv-1感染的多方面抗病毒作用。首先,显示a3g能够通过在逆转录期间将病毒dna的负链中的胞嘧啶残基脱氨基为尿嘧啶来终止hiv感染(sadler h等人,2010年,《apobec3g contributes to hiv-1variation through sublethal mutagenesis》,《journal of virology》,84(14),7396-7404页,doi:10.1128/jvi.00056-10.)。一系列研究也都表明,a3g通过非编辑介导的机制抑制hiv-1逆转录。
[0144]
hiv vif通过劫持人延伸蛋白b/c(elobc)-cullin-socs盒(ecs)型e3泛素连接酶而拮抗人抗病毒蛋白apobec3g,导致apobec3g的多泛素化并随后导致其蛋白酶体降解(matsui y等人,2016年,《core binding factorβprotects hiv,type 1accessory protein viral infectivity factor from mdm2-mediated degradation》,《journal of biological chemistry》,291(48),24892-24899页.doi:10.1074/jbc.m116.734673.)。
[0145]
hiv vif蛋白具有与epstein barr病毒上发现的p23抗原相似的功能(在其他功能中,在它们各自与hsp90/70伴侣蛋白的相互作用中)。抗原p23是vif hiv蛋白的同种型。蛋白质同种型或“蛋白质变体”是源自单个基因或基因家族并且是遗传差异的结果的一组高度相似的蛋白质的成员。蛋白质同种型倾向于具有相同或相似的生物学功能。ogawa等人发现,在ebv存在下,ksp 37的产生更多。这表明ksp 37具有抗病毒特性。
[0146]
由此可以确信,ksp 37支持apobec3g蛋白抗ebv功能的机制与ksp 37支持apobec3g蛋白抗hiv功能的机制相似,因为hiv vif和ebv p23抗原相似。
[0147]
因此,ksp 37的作用机制可以使其成为vif抑制剂的亚类,抑制e3连接酶复合物的形成。vif蛋白的可能抑制将允许a3g蛋白破坏病毒dna的翻译。
[0148]
3.ksp 37最有效的浓度水平
[0149]
上表1-3中的结果表明ksp 37在400ng/ml-700ng/ml的血清浓度水平下是有功能的。
[0150]
ksp37以低于400ng/ml的浓度存在于正常健康个体中。在该水平下,它不能有效抑制hiv病毒和可能的其它逆转录病毒的免疫失能复制。相反,ksp 37的浓度水平高于750ng/ml可导致自身免疫疾病,包括哮喘和唐氏综合征,这是由于ksp 37对细胞因子如il-5和tnf-α的积极作用,所述细胞因子与免疫系统活性的增加有关。
[0151]
鉴于此,本发明提供了一种通过将受试者中ksp37的水平增加至400ng/ml至700ng/ml来保护受试者免受以病毒感染为特征的疾病和/或与免疫系统病症和病毒性癌症相关的疾病的方法。
[0152]
受试者中ksp37的水平可以通过以下途径中的一种或多种来增加:
[0153]
(a)通过向受试者施用疗效剂量的临床修饰的或基因工程化的ksp37蛋白和/或分
子量范围为24kda至45kda的蛋白;
[0154]
(b)通过向受试者施用用ksp 37基因编码的载体刺激受试者中ksp37的产生至400ng/ml-700ng/ml的浓度水平,所述ksp 37基因将翻译成ksp37蛋白;或
[0155]
(c)通过用极性化合物处理受试者刺激受试者中ksp37的产生至400-700ng/ml的浓度水平,以激活增加的ksp37产生。
[0156]
受试者可以包括所有哺乳动物,并且不仅限于人。
[0157]
4.将临床修饰的或遗传工程化的ksp 37蛋白施用于受试者
[0158]
在本发明的一个实施方案中,可以将已经被临床修饰/克隆或遗传工程化的ksp 37蛋白和/或24kda-45kda范围内的蛋白质,和/或包含已经被临床修饰/克隆或遗传工程化的ksp 37蛋白和/或24kda-45kda范围内的蛋白质的制剂施用于受试者,以治疗或预防以病毒感染为特征的疾病和/或与免疫系统紊乱相关的疾病和病毒性癌症。
[0159]
受试者是哺乳动物。
[0160]
所述蛋白质选自ksp蛋白质和所有it种类,其中所述蛋白质是哺乳动物蛋白质。
[0161]
该蛋白质具有大约37kda的分子量,具有223个氨基酸链,含有n-末端信号序列、短的c-末端疏水区和潜在的o-糖基化位点和半胱氨酸侧链。
[0162]
可以从血液组分和/或组织中提取蛋白质,然后纯化、乙酰化、基因工程化、克隆并转移回哺乳动物宿主作为治疗剂和/或预防性疫苗,用于保护或治疗病毒感染和/或与免疫系统病症和病毒性癌症相关的疾病。
[0163]
一种或多种重组分子可用于离体产生ksp37蛋白。在一个实施方案中,通过在有效产生蛋白质的条件下表达核酸分子来产生编码的产物。
[0164]
产生编码蛋白的优选方法包括用一种或多种具有编码ksp 37蛋白的核酸序列的重组分子转染宿主细胞,以形成重组细胞。用于转染的合适细胞是可以转染的任何细胞。宿主细胞可以是转染的细胞或已经用至少一种核酸分子转化的细胞。
[0165]
可用于本发明的宿主细胞可以是能够产生ksp 37蛋白的任何细胞,包括细菌、真菌、哺乳动物和昆虫细胞。
[0166]
将核酸分子转染到宿主细胞中可以通过可以将核酸分子插入细胞中的任何方法来完成。转染技术包括但不限于转染、电泳、显微注射、脂质转染、吸附和原生质融合。在使用重组dna技术时,可以通过在宿主细胞内转染核酸分子、编码ksp 37的核酸分子转录的效率、所得转录物翻译的效率和用于增加核酸分子表达的翻译后修饰重组技术的效率来改善表达。
[0167]
ksp 37蛋白的离体生产包括但不限于将核酸分子可操作地连接到高拷贝数质粒上,将核酸分子整合到一个或多个宿主细胞染色体中,将载体稳定性序列添加到质粒中,转录控制信号(启动子、操纵子、增强子)的分段或修饰,翻译控制信号(例如核糖体结合位点、shere-dalogans信号)的取代或修饰,核酸分子的修饰以对应于宿主细胞的密码子使用,以及缺失使转录物不稳定的序列。表达的重组ksp 37蛋白的活性可以通过片段化、修饰或衍生化编码这种蛋白的核酸分子来提高。
[0168]
将包含ksp37蛋白的制剂递送至哺乳动物中的靶细胞。
[0169]“靶位点”是指哺乳动物中期望递送治疗制剂的位点。例如,靶位点可以是淋巴细胞、干细胞、所有血液组分和其他递送媒介物,包括但不限于含有天然脂质的递送媒介物,
包括细胞和细胞膜;和含有人造脂质的递送媒介物,包括脂质体和胶束。
[0170]
可以通过已知技术修饰递送载体以靶向哺乳动物中的特定位点,从而靶向并利用该位点处的核酸分子。
[0171]
合适的修饰包括操纵递送媒介物的脂质位置的化学式和/或向媒介物中引入能够将递送媒介物特异性靶向优选位点(例如优选的细胞类型)的化合物。特异性靶向是指通过媒介物中的化合物与细胞表面上的分子的相互作用使递送媒介物与特定细胞结合。合适的靶向化合物包括能够在特定位点选择性结合另一分子的配体。此类配体的实例包括抗体、抗原、受体和受体配体。
[0172]
操纵递送媒介物的脂质位置的化学式可以调节递送媒介物的细胞外或细胞内靶向。例如,可以将化学物质添加到脂质体的脂质配方中,其改变脂质体的脂双层的电荷,使得脂质体与具有特定电荷特征的特定细胞融合。
[0173]
赋形剂
[0174]
待施用于受试者的包含ksp 37蛋白的制剂还可以包括其它组分,例如药学上可接受的赋形剂。例如,本发明的制剂可以在受试者可以耐受的赋形剂中配制,此类赋形剂的实例包括水、盐水、磷酸盐缓冲溶液、林格氏溶液、右旋糖溶液、汉克氏溶液、含有生理平衡盐溶液的聚乙二醇和其他水性生理平衡盐溶液。也可以使用非水性媒介物,例如固定油、芝麻籽油和油酸乙烯酯甘油三酯。
[0175]
其他有用的制剂包括含有粘度增强剂如羧甲基纤维素钠、山梨糖醇或糊精的悬浮液。赋形剂还可含有少量添加剂,诸如增强等渗性和化学稳定性的物质或缓冲剂。缓冲液的实例包括磷酸盐缓冲液、碳酸氢盐缓冲液、tres缓冲液,而防腐剂的实例包括曲美雷琐、间-邻甲酚、福尔马林和苯甲醇。
[0176]
标准制剂可以是液体或可注射的或固体,其可以作为用于注射的悬浮液或溶液吸收在合适的液体中。因此,在非液体制剂中,赋形剂可以包括糊精、人血清白蛋白、防腐剂等,可以在施用前向其中加入无菌水或盐水。
[0177]
ksp 37蛋白可以通过选自口服、鼻、局部、吸入、透皮、直肠和肠胃外(皮下/肌内)给药的至少一种途径给药。
[0178]
控释
[0179]
给哺乳动物施用的包含ksp 37蛋白或修饰蛋白的制剂可包含能够将ksp 37缓慢释放到哺乳动物中的控释组合物。如本文所用,控释组合物包含ksp37蛋白或在控释载体中。
[0180]
合适的控释载体包括但不限于生物相容性聚合物、其他聚合物基质胶囊、微胶囊、微粒、推注制剂、渗透泵、扩散装置、脂质体、脂质体球、干粉和透皮递送系统。本发明的其它控释包括在施用于哺乳动物时原位形成固体或凝胶的液体。
[0181]
附加化合物
[0182]
可以顺序或同时给予能够增强ksp 37保护哺乳动物免受以病毒感染为特征的疾病的能力的附加化合物。这些化合物包括能够调节细胞介导的免疫应答、调节t辅助细胞活性、调节肥大细胞脱颗粒、保护感觉神经末梢,调节嗜酸性粒细胞和/或母细胞活性,和/或预防或松弛平滑肌收缩。此类化合物将进一步诱导微血管通透性或调节th1和/或th2细胞亚群分化。
[0183]
本领域技术人员可以根据哺乳动物的各种特征选择与ksp 37蛋白联合给药的化合物。特别是哺乳动物的遗传背景、健康史、体征、救援药物和血气的使用以及血液分析。
[0184]
剂量
[0185]
施用给哺乳动物的治疗剂量的ksp 37蛋白或修饰的蛋白包括当在合适的时间段内施用一次或多次时,能够保护哺乳动物免受和/或治疗以感染和/或th-1型免疫应答为特征的疾病的剂量。或者,ksp 37蛋白或修饰蛋白的治疗剂量包括改善哺乳动物免疫系统的剂量。
[0186]
进一步可替代地,ksp37蛋白或经修饰的蛋白的治疗剂量包括减少病毒感染和/或增加th 1型细胞因子的剂量。
[0187]
假定产生治疗或预防结果的ksp 37蛋白或修饰蛋白的优选单剂量已被鉴定为0.001μg/kg至20μg/kg,后者为哺乳动物体重。
[0188]
5.刺激细胞中ksp37表达的方法
[0189]
基因治疗是一种正在考虑用于治疗各种遗传性和获得性疾病的新治疗方式。它是在操纵基因表达以达到治疗目的的前提下起作用的。生物技术的最新进展刺激了基于将治疗基因直接递送至体内细胞的体内基因治疗方法的发展。基因疗法旨在引入所讨论的基因的正常拷贝以恢复、增加或修饰蛋白质的功能。
[0190]
编码ksp 37蛋白的核酸分子可以从其天然来源获得,作为整个(完整)基因或其一部分。或者,可以使用重组dna技术(聚合酶链反应扩增克隆)或化学合成产生核酸分子。
[0191]
核酸分子包括天然核酸分子及其同系物,包括但不限于天然等位基因变体和修饰的核酸分子,其中核苷酸以这样的方式插入、缺失、取代和/或倒置,使得这些修饰基本上不干扰核酸编码本发明方法中有用的ksp37蛋白的能力。
[0192]
在一个实施方案中,编码可用于对抗病毒免疫系统相关感染如hiv和病毒癌症的ksp 37蛋白的核酸分子是翻译成与天然存在的ksp 37蛋白相同的蛋白的核酸序列。
[0193]
分离的或生物纯的核酸分子是已经从其天然环境中移除的核酸分子。
[0194]
编码ksp 37蛋白的核酸分子可以使用本领域技术人员已知的许多方法中的任一种来产生,包括重组dna技术,例如定点诱变、用极性化合物化学处理核酸分子以诱导突变、核酸片段的限制酶切割、核酸片段的冲洗、核酸序列的选择区域的聚合酶链反应(pcr)和/或诱变、寡核苷酸混合物的合成和混合物组的连接以构建核酸分子的混合物及其组合。通过筛选由核酸编码的功能,可以从修饰的核酸的混合物中选择核酸分子包膜。
[0195]
用于编码本发明方法中有用的ksp 37蛋白的核酸分子可以与一个或多个转录控制序列可操作地连接以形成重组分子。短语“可操作地连接”是指将核酸分子与转录控制序列连接,使得当转染、转导或转化到全细胞中时分子能够表达。转录控制序列是控制转录的起始、延伸和终止的序列。特别重要的是受控的转录起始、启动子、增强子、操纵子和阻遏物序列。
[0196]
合适的转录控制序列包括可在重组细胞中转录的任何转录控制序列,所述重组细胞可用于表达ksp 37蛋白,和/或可用于在哺乳动物中给药。在本发明的方法中,优选的转录控制序列包括在哺乳动物、细菌或昆虫细胞中起作用的转录控制序列。
[0197]
本发明的转录控制序列还可以包括天然存在的转录控制序列,所述转录控制序列与编码本发明方法中有用的ksp 37蛋白的基因天然相关。
[0198]
可以是dna或rna的本发明的重组分子还可以含有另外的调节序列,例如翻译调节序列、起点或复制,以及与重组细胞相容的其他调节序列。在一个实施方案中,本发明的重组分子含有分泌信号(信号片段核酸序列)以使表达的ksp 37蛋白能够从产生该蛋白的细胞中分泌。
[0199]
合适的信号片段包括但不限于与任何上述ksp 37蛋白天然相关的信号片段和ksp 37蛋白的所有相关种类和核苷酸。
[0200]
基因治疗的限速技术是用于完成基因转移的基因递送载体,称为载体。载体也可用于增加特定蛋白质的基因产生。
[0201]
合适的载体
[0202]
特别适用于施用编码ksp 37蛋白的核酸分子的药学级可接受载体的实例是:
[0203]
·
pgem-t载体
[0204]
·
pcmv3-c-gfpspark
[0205]
这些是目前市场上用作ksp 37序列载体的一些载体。
[0206]
表达载体,也称为表达构建体,通常是设计用于在细胞中基因表达的质粒或病毒。载体用于将特定基因引入靶细胞,并且可以征用细胞的蛋白质合成机制以产生由基因编码的蛋白质。
[0207]
在这种情况下,感兴趣的基因是ksp37,其通常由人类宿主中适应性免疫的一部分cd8+细胞产生(l
ó
pez等人,2011年)。
[0208][0209]
pcmv3-c-ddk(flag)是用于在哺乳动物细胞中表达ksp 37的表达载体。载体应含有允许表达的特定区段,这些区段包括启动子、正确的翻译片段和启动子。起始序列如核糖体结合位点和起始密码子、终止密码子和转录终止序列。在基因产物表达后,可能需要纯化表达的蛋白质;然而,将目的蛋白质与宿主细胞的绝大多数蛋白质分离可能是一个漫长的过程。为了使该纯化过程更容易,可以将纯化标签添加到克隆的基因中。
[0210]
将载体转染到细胞中,并且在稳定转染的情况下,可以通过同源重组将dna整合到基因组中,或者可以瞬时转染细胞。哺乳动物表达载体的实例包括腺病毒载体、psv和pcmv系列质粒载体、痘苗和逆转录病毒载体以及杆状病毒。巨细胞病毒(cmv)的启动子和sv40通
常用于哺乳动物表达载体中以驱动基因表达。
[0211]
特别地,由sinobiological提供的pgem-t载体ksp37/fgfbp2 cdna orf clone已被鉴定为2个单位至10个单位的人成纤维细胞生长因子结合蛋白2的全长克隆dna的合适克隆载体,用于哺乳动物中针对逆转录病毒感染、病毒癌症和朊病毒的基因治疗。
[0212]
赋形剂/递送载体
[0213]
根据本发明,编码ksp 37蛋白的核酸分子可以与药学上可接受的赋形剂一起施用。药学上可接受的赋形剂可包括但不限于含有底物、油、酯、乙二醇、病毒、金属颗粒或阳离子分子的天然脂质。
[0214]
能够靶向的药学上可接受的赋形剂在本文中称为“递送载体”。本发明的药学上可接受的赋形剂能够将包括ksp 37蛋白和/或编码ksp 37蛋白的核酸分子的制剂递送至哺乳动物的靶细胞。“靶位点”是指哺乳动物中期望递送治疗制剂的位点。例如,靶位点可以是淋巴细胞、干细胞、所有血液组分。
[0215]
递送媒介物包括但不限于含有天然脂质的递送媒介物(包括细胞和细胞膜)、含有人造脂质的递送媒介物(包括脂质体和胶束)。
[0216]
可以修饰本发明的递送媒介物以靶向哺乳动物中的特定位点,从而靶向并利用该位点处的核酸分子。合适的修饰包括操纵递送媒介物的脂质位置的化学式和/或向媒介物中引入能够将递送媒介物特异性靶向优选位点(例如,优选的细胞类型)的化合物。
[0217]
特异性靶向是指通过媒介物中的化合物与细胞表面上的分子的相互作用使递送媒介物与特定细胞结合。合适的靶向化合物包括能够在特定位点选择性结合另一分子的配体。此类配体的实例包括抗体、抗原、受体和受体配体。
[0218]
操纵递送媒介物的脂质位置的化学式可以调节递送媒介物的细胞外或细胞内靶向。例如,可以将化学物质添加到脂质体的脂质配方中,其改变脂质体的脂质双层的电荷,使得脂质体与具有特定电荷特征的特定细胞融合。
[0219]
载体的施用
[0220]
通过可接受的给药途径,包括鼻、口服、局部、吸入、透皮或肠胃外给药,将载体给予受试者。
[0221]
附加化合物
[0222]
可以顺序或同时给予能够增强ksp 37保护哺乳动物免受以病毒感染为特征的疾病的能力的附加化合物。这些化合物包括能够调节细胞介导的免疫应答、调节t辅助细胞活性、调节肥大细胞脱粒、保护感觉神经末梢,调节嗜酸性粒细胞和/或母细胞活性,和/或预防或松弛平滑肌收缩。此类化合物将进一步诱导微血管通透性或调节th1和/或th2细胞亚群分化。
[0223]
与编码ksp 37蛋白的核酸分子联合给药的化合物的选择可由本领域技术人员根据哺乳动物的各种特征进行。特别是哺乳动物的遗传背景、健康史、体征、救援药物和血气的使用以及血液分析。
[0224]
7.用极性化合物进行化学处理以激活ksp 37的产生
[0225]
如前所述,极性化合物二甲基甲酰胺(dmf)和dmso已被证明是hiv产生的强抑制剂。用含有二甲基甲酰胺(dmf)的透皮贴剂治疗感染hiv-1的患者显示出有希望的结果。
[0226]
假设极性试剂对致癌表达的作用是诱导癌细胞变得更良性。将恶性细胞转化为良
性类型似乎是合理的,首先应该对导致恶性肿瘤的基因表达进行一些调节。在hl-60人早幼粒细胞白血病细胞中,二甲基亚砜[dmso]使c-肌癌基因的表达降低80%-90%[5]。
[0227]
暗示细胞分化的化学诱导剂通过影响宿主细胞的细胞机制在病毒复制中起重要作用。
[0228]
极性化合物(包括dmf)可用于病毒感染和疾病的临床管理,其通过以cd8细胞的活化开始的级联事件,所述cd8细胞的活化继而活化ksp37的产生。
[0229]
极性化合物如二甲基甲酰胺[dmf]可用作ksp 37蛋白的活化剂。
[0230]
dmf通常用作极性溶剂,并且通过皮肤、吸入和口服摄入容易吸收。dmf主要在肝脏中快速代谢,并且排泄主要在尿液中发生。
[0231]
化学物质的透皮和栓剂递送是改变患者激素性质的常用方法。
[0232]
dmf可以使用任何合适的药物递送装置通过透皮施用向患者施用,例如通过施用一个或多个皮肤贴剂,或用于直肠施用的栓剂以激活ksp37产生。用皮肤贴剂治疗以激活ksp37产生将包括每周一次将贴剂施用于皮肤约8小时,而通过直肠施用dmf以激活ksp37产生的治疗将理想地包括每周一次使用栓剂。
[0233]
用于激活ksp37产生的dmf的治疗有效剂量是导致dmf的峰值血浆水平为约2mg/l-200mg/l,优选约100mg/l-200mg/l,还更优选约150mg/l的剂量。特别优选的是dmf的峰值血浆水平为100mg/l-150mg/l或150mg/l-200mg/l。
[0234]
对于极性化合物的透皮给药,吸收速率由受试者的皮肤决定。在暴露于人类皮肤时,液体dmf是以约9.4mg/cm2/小时的稳态速率吸收(参见mraz和nohova,1992年,occup.env.health 64:85-92页)。
[0235]
因此,通过控制暴露于药物的皮肤表面积,如通过确定每个贴剂的面积和施加到皮肤上的贴剂的数量,可以实现所需的吸收速率。例如,直径为9cm的两个贴片将127cm2的总皮肤表面积暴露于极性化合物;对于dmf,这将导致每小时约1.2g dmf的吸收速率。
[0236]
dmt的初始剂量为约15mg/kg是特别优选的。
[0237]
预期在将ksp37蛋白的产生充分遗传修饰至至少20年所需的治疗范围之前,需要用dmf长期治疗约2年。
[0238]
因此,本发明确定了最佳浓度范围,在所述最佳浓度范围内,分子量范围为24kda至45kda的ksp 37增强受试者对病毒感染和/或与免疫系统障碍相关的疾病和/或病毒性癌症的免疫应答,并提供了用于治疗病毒感染和/或与免疫系统障碍相关的疾病和/或病毒性癌症的药物和药剂的制备,以及治疗和/或保护抵抗病毒感染和/或与免疫系统障碍相关的疾病和/或病毒性癌症的方法。
[0239]
本文引用的所有出版物均通过引用整体并入。本文对参考文献的引用或讨论不应被解释为承认其是本发明的现有技术。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1