抗癌疗法的增敏剂的制作方法
1.本发明涉及放射疗法或抗癌化学疗法等抗癌疗法的增敏剂,特别涉及包含过氧化氢和透明质酸或其盐的抗癌疗法的增敏剂。
背景技术:
2.虽然乳腺癌的克服是世界性的课题,但推定在全世界有200万人患有乳腺癌,其中80%是局部进展性疾病(非专利文献1、2)。在英国,在5万5千人的新患者中,具有局部进展性病变的女性是少数派(7~13%),局部进展性疾病的终身患病率显著(非专利文献3~6)。对于不适于手术或拒绝手术的虚弱者或老年人来说,治疗是很困难的,对于这样的患者,为了缓解乳房溃疡、出血和疼痛,rt和/或内分泌疗法大多成为最适当的选择方案。浸润乳房/胸壁和/或腋窝的局部进展性的不能手术的原发癌或复发癌与有无转移无关,通常,平均剩余寿命不是以数月为单位而是以年为单位进行测定,对于患者和医疗专家来说这是很重要的课题。认为这是不满足在临床现场的需求的领域,而提高对放射线的反应性的创新途径是非常有益的。
3.最初在骨肉瘤(hs-os-1)和前列腺癌(pc-3)细胞株中报告了在h2o2和电离放射线(ir)之间的细胞水平下的相互作用,h2o2或30gy单独的任一种示出了极端的抗性(非专利文献7、8)。如果在ir之前添加0.1mm的h2o2,则得到了以下结果:不会引起介导经典的细胞死亡的dna的双链断裂,细胞毒性提高(非专利文献9、10)。据推测,作为新的机理,与伴随着强氧化剂释放的溶酶体膜破裂有关,该强氧化剂含有透过线粒体并激活凋亡的重金属离子(非专利文献11)。在体内(in vivo)的使用中,包括针对不能切除癌的高知双氧水-放射疗法(kortuc)战略,其使用0.83%透明质酸钠凝胶中的0.5%h2o2的混合物,以将注射部位的局部疼痛抑制在最小限度的方式设计。在30gy的放射治疗之前,向小鼠肿瘤内注射该h2o2凝胶混合物,结果得到了超过仅通过任一种方法实现的增殖延迟的明确的证据。未发现毒性(非专利文献12)。现有技术文献
4.非专利文献非专利文献1:ginsburg o等人,the global burden of women's cancers:a grand challenge in global health(女性癌症的全球重担:全球健康面临巨大挑战).lancet(柳叶刀)2017;389:847-860.非专利文献2:https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/global-cancer-facts-and-figures/global-cancer-facts-a nd-figures-4th-edition.pdf非专利文献3:https://www.cancerresearchuk.org/health-professional/cancer-statistics/statistics-by-cancer-type/breast-cancer/incidence-invasive#hea ding-three.非专利文献4:http://www.ncin.org.uk/publications/survival_by_stage
非专利文献5:http://www.isdscotland.org/health-topics/cancer/detect-cancer-early/非专利文献6:https://www.qub.ac.uk/research-centres/nicr/cancerinformation/official-statistics/非专利文献7:ogawa y等人,mechanism of hydrogen peroxide-induced apoptosis of the human osteosarcoma cell line hs-os-1(过氧化氢诱导人骨肉瘤细胞系hs-os-1凋亡的机制).international journal of molecular medicine(国际分子医学杂志)2003;12:459-63.非专利文献8:kariya s等人,combination treatment of hydrogen peroxide and x-rays induces apoptosis in human prostate cancer pc-3cells(过氧化氢和x射线的联合治疗诱导人前列腺癌pc-3细胞凋亡).int j radiat oncol biol phys.2009;75:449-54.非专利文献9:eriksson d.与stigbrand t.,radiation-induced cell death mechanisms(辐射诱导的细胞死亡机制).tumour biol 2010;31:363-72.非专利文献10:katsube t.等人,most hydrogen peroxide-induced histone h2ax phosphorylation is mediated by atr and is not dependent on dna double-strand breaks(大多数过氧化氢诱导的组蛋白h2ax磷酸化由atr介导并且不依赖于dna双链断裂).j biochem 2014;156:85-95.非专利文献11:ogawa y.等人,apoptotic-resistance of the human osteosarcoma cell line hs-os-1to irradiation is converted to apoptotic-susceptibility by hydrogen peroxide:a potent role of hydrogen peroxide as a new radiosensitizer(过氧化氢将人骨肉瘤细胞系hs-os-1对照射的细胞凋亡-抗性转化成细胞凋亡-敏感性:过氧化氢作为新型放射致敏剂的强效作用).int j mol med 2003;12:845-50.非专利文献12:akima r.等人,new enzyme-targeting radiosensitizer(kortuc)containing hydrogen peroxide&sodium hyaluronate for intra-tumoral injection using mice transplanted with sccvii tumor(使用移植有sccvii肿瘤的小鼠进行肿瘤内注射的含有过氧化氢和透明质酸钠的新型酶靶向放射致敏剂(kortuc)).int j cancer clin res 2016;3:1-6.
技术实现要素:
发明所要解决的技术问题
5.尚不清楚抗癌疗法的增敏剂对肿瘤有效的用量和用法以及增敏剂给药后有效的放射疗法或抗癌化学疗法等抗癌疗法的时间表。用于解决技术问题的手段
6.本发明人为了解决上述课题,进行了深入研究,结果完成了本发明。即,本发明显示出,通过将特定浓度范围的h2o2与特定浓度范围的透明质酸或其盐组合而制作的抗癌疗法的增敏剂以具体的分量、具体的顺序注入肿瘤患部,能够提高放射疗法或抗癌化学疗法等抗癌疗法的效果,解决了上述课题。
7.具体而言,本发明为了解决上述课题,提供了以下方式。[1]一种增敏剂,其特征在于,其是包含(a)0.01~3.5%(w/v)的过氧化氢和(b)0.1~10%(w/v)的透明质酸或其盐的抗癌疗法的增敏剂,根据肿瘤的尺寸,向肿瘤中的所述增敏剂的给药量从1.2ml~15.0ml中选择。[2]根据[1]所述的增敏剂,其中,所述增敏剂包含0.5%(w/v)的过氧化氢。[3]根据[1]或[2]所述的增敏剂,其中,所述给药量为以下范围:(1)对于肿瘤块的最大直径的长度为小于3.0cm的尺寸的所述肿瘤,为1.2ml以上且小于3.0ml;(2)对于肿瘤块的最大直径的长度为3.0cm以上且小于6.0cm的尺寸的所述肿瘤,为2.4ml以上且小于6.0ml;(3)对于肿瘤块的最大直径的长度为6.0cm以上且小于10.0cm的尺寸的所述肿瘤,为3.6ml以上且小于9.0ml;以及(4)对于肿瘤块的最大直径的长度为10.0cm以上的尺寸的肿瘤,为3.6ml以上且为15.0ml以下。[4]根据[1]~[3]中任一项所述的增敏剂,其特征在于,所述增敏剂除了具有抗癌作用以外,还具有疼痛降低作用、皮肤毒性降低作用、或者疼痛降低作用和皮肤毒性降低作用这两者的作用。[5]根据[1]~[4]中任一项所述的增敏剂,其中,抗癌疗法是放射疗法或抗癌化学疗法。[6]根据[1]~[5]中任一项所述的增敏剂,其特征在于,在所述肿瘤的治疗期间,每周将所述增敏剂注入到所述肿瘤中1~3次。[7]根据[1]~[6]中任一项所述的增敏剂,其特征在于,在所述肿瘤治疗期间,总计将所述增敏剂注入到所述肿瘤中2~8次。[8]根据[1]~[7]中任一项所述的增敏剂,其特征在于,在向所述肿瘤中注射所述增敏剂后24小时以内实施抗癌疗法。[9]根据[8]所述的增敏剂,其特征在于,每天实施所述抗癌疗法。[10]根据[8]或[9]所述的放射线增敏剂,其中,所述抗癌放射疗法中的每次的射线量为1.75~3.75gy。[11]根据[8]所述的增敏剂,其特征在于,每周实施1、2或3次所述抗癌疗法。[12]根据[11]所述的放射线增敏剂,其中,所述抗癌放射疗法中的每次的射线量为5~7gy。发明效果
[0008]
通过本发明抗癌疗法的增敏剂的用量和用法,能够提高抗癌疗法(放射疗法或抗癌化学疗法)的效果,有效治疗肿瘤。更具体而言,可知本发明的增敏剂除了具有作为主作用的抗癌效果之外,有时还附带地具有疼痛减低作用、皮肤毒性降低作用、或者疼痛减低作用和皮肤毒性降低作用这两者的作用。
附图说明
[0009]
图1是示出非随机化试验设计的概要的图。
图2是示出为了比较作为规定的时间表带来相同的对数细胞死亡的2gy分割照射中的等效rt射线量而使用的eqd2式的图。图3是示出了显示h2o2给药的乳房肿瘤的一系列超声波图像的图。在该图中,图3a示出了显示在超声波引导下的针的侵入(箭头)的超声波图像。图3b示出了显示h2o2+透明质酸钠凝胶混合物在肿瘤内注射的超声波图像。图3c示出了显示伴随着在肿瘤内产生声波的氧微气泡(箭头)的形成的h2o2分解(箭头)的超声波图像。图4是示出被检体自我申报肿瘤疼痛分级的图。在该图中,肿瘤疼痛是指无论有无注射h2o2,在放射疗法中在目标肿瘤部位经历的疼痛。图5a是示出进行了处置的人被检体的肿瘤体积的变化的图。在该图中,图5a示出了表示关于12名全部被检体的肿瘤体积的累积倍数减少(log2转换)的箱形图。图5b示出了表示标准化为基线的肿瘤测定值的rt后12个月为止的肿瘤体积变化率的瀑布图。数据分别表示3名被检体和8名被检体的rt后9个月和12个月的肿瘤测定值。图6是示出实施例6(6-2)中的被检体编号10号的患者的临床照片的图。在该图中,图6a是示出具有真菌性肿瘤的被检体编号10号的被检体的左乳房(基线)的临床照片。图6b是示出利用h2o2+rt治疗的12个月后的被检体编号10号的被检体的左乳房的临床照片。图7是示出实施例6(6-2)中的被检体编号8号的被检体的
18
f-fdg pet扫描图像。在该图中,图7a显示在基线的左乳房肿瘤的高示踪剂摄入,图7b显示在治疗后12个月的代谢的完全缓解。
具体实施方式
[0010]
定义为了方便,本技术中使用的特定的用语集中在此。除非另外规定,本技术中使用的所有技术术语和科学术语具有与本发明所属技术领域的本领域技术人员通常理解的相同的含义。除非在上下文中另外指明,否则单数形“a”、“an”和“the”包括多个的提及。
[0011]
本发明所示的数值范围及参数是近似值,但特定的实施例所示的数值尽可能准确地记载。但是,所有的数值本质上都包含由在各个试验测定值中看到的标准偏差必然产生的特定的误差。另外,用语“约”在本领域技术人员考虑的情况下,是指在可容许的标准误差内。
[0012]
以下,对本发明的实施方式进行说明。以下的实施方式是例示,本发明的范围并不限定于以下的实施方式所示的范围。另外,对于同样的内容,为了避免重复的繁杂,适当省略说明。
[0013]
本发明的抗癌疗法的增敏剂的特征在于,是将0.01~3.5(v/v)%的成分(a)过氧化氢和0.1~10(v/v)%的成分(b)透明质酸或其盐组合而成的,根据肿瘤的尺寸,向肿瘤中的所述增敏剂的给药量从1.2ml~15.0ml中选择。
[0014]
本发明中所述的抗癌疗法的增敏剂是在肿瘤的抗癌疗法时预先或同时直接用于肿瘤患部内部的制剂组合物,可以增强抗癌疗法对肿瘤患部的效果。
[0015]
在此,在本发明中,在提及“抗癌疗法”时,可以是放射疗法(放射线照射)、抗癌化学疗法等用于抗癌的治疗法。
[0016]
在本发明中,“放射疗法”是指通过对肿瘤患部照射放射线,对肿瘤细胞的dna造成
损伤,使癌细胞产生细胞死亡的治疗方法。也可以与后述的抗癌化学疗法组合实施。作为可以在放射疗法中使用的放射线,可以使用x射线、电子射线、质子射线、重粒子射线、α(阿尔法)射线、β(贝塔)射线、γ(伽马)射线等。放射疗法的方法有从身体外照射放射线的外部照射法,将放射线源直接插入到身体的组织、食道、子宫这样的腔中进行治疗的密封小射线源治疗法,在本发明中,可以利用外部照射法或密封小射线源治疗法中的任一种,或者也可以组合外部照射法和密封小射线源治疗法。
[0017]
在本发明中,“抗癌化学疗法”是指利用抗癌剂(控癌剂)的所有癌症治疗。在本发明中,也可以与上述的放射疗法组合来实施。利用直线加速器的放射治疗对癌细胞的效果70%左右依赖于羟基自由基等活性氧的产生。而且,肿瘤组织中的低氧状态对活性氧种的产生有影响。由于这样的特征,低氧消除对放射治疗和化学疗法都有效。因此,增强利用放射线的治疗效果的物质同时也会增强抗癌化学疗法的效果。
[0018]
在本发明中,对于作为本发明的增敏剂的使用对象的“肿瘤”而言,只要是形成血液系统肿瘤以外的肿瘤块的肿瘤(固体肿瘤),则可以是任何肿瘤,例如,可以是良性的,也可以是恶性的,另外,可以是上皮性的,也可以是非上皮性的。在这样的肿瘤中,作为给予本发明的增敏剂的对象的肿瘤,主要设想恶性的肿瘤。另外,对于肿瘤对抗癌疗法的敏感性没有限制,本发明的增敏剂对于虽然过去实施过放射疗法和/或抗癌化学疗法,但显示出抗性的肿瘤也可以利用。
[0019]
另外,在本发明中,“肿瘤患部”是指肿瘤细胞成为主体而形成的肿瘤组织,但该肿瘤组织也包括肿瘤细胞以及正常细胞和/或正常组织混合存在的肿瘤组织。肿瘤细胞以及正常细胞和/或正常组织混合存在时,肿瘤细胞相对于正常细胞和/或正常组织所占的容积或细胞数的比例并没有特别限制。
[0020]
使用或不使用本发明的增敏剂时的抗癌疗法的治疗效果可以通过肿瘤组织的缩小率、患者的生存率、治疗后的复发率等、肿瘤治疗的一般评价方法来评价。
[0021]
如上所述,本发明的增敏剂是组合成分(a)和成分(b)而成的组合物。在此,所谓“组合而成”是按照作为本发明的对象的增敏剂包含以下情况的含义而使用:(i)从最初开始就为含有成分(a)和成分(b)这两者的状态(配合剂)的情况;(ii)含有成分(a)的制剂和含有成分(b)的制剂各自以分别的包装形态存在,作为组合物(试剂盒)销售的情况;或(iii)含有成分(a)的制剂和含有成分(b)的制剂各自以分别的包装形态,另外以单独的流通路径存在于市场上,在使用时组合使用的情况。
[0022]
即,在本发明中,所谓“组合而成”的抗癌疗法的增敏剂是指只要在最终使用时的抗癌疗法的增敏剂(在本发明中,将其称为“最终制剂”)中,含有成分(a)和成分(b)这两者即可,并不特别追究包括销售在内的流通阶段中的形态。
[0023]
成分(a)本发明的增敏剂的特征在于,作为有效成分,含有0.01~3.5%(w/v)的成分(a)过氧化氢。
[0024]
在没有特别记载的情况下,本发明中使用的“过氧化氢”表示过氧化氢分子(h2o2;分子量34)本身。
[0025]
另外,在没有特别记载的情况下,“过氧化氢水”是指将过氧化氢溶解在日本药典
等的蒸馏水中的物质。另外,在本说明书中,在没有特别限制的情况下,%(w/v)表示重量/容积百分比浓度。
[0026]
成分(b)本发明的增敏剂的特征在于,作为辅助成分,含有0.1~10%(w/v)的成分(b)透明质酸或其盐。作为成分(b)的浓度,并没有限定,可以优选在0.1~5%(w/v)的范围使用,更优选在0.1~3%(w/v)的范围使用,进一步优选在0.3~1%(w/v)的范围使用。
[0027]
本发明中使用的透明质酸可以是从动物组织中提取的透明质酸,另外,也可以是通过发酵法制造的透明质酸,并不追究其起源。从安全性和制造的稳定性考虑,优选通过发酵法制造。发酵法中使用的菌株并没有特别限制,例如除了从自然界分离的属于链球菌(streptococcus)属等的透明质酸产生微生物以外,还可以任意使用日本特开昭63-123392号公报中记载的类马链球菌(streptococcus equi)fm-100(微工研菌寄第9027号)或日本特开平2-234689号公报中记载的类马链球菌(streptococcus equi)fm-300(微工研菌寄第2319号)等透明质酸产生微生物。
[0028]
作为透明质酸,以往已知有各种分子量的透明质酸。虽然没有限制,但在本发明中,例如,作为质均分子量,通常可以使用具有50万~1000万左右,优选50万~800万左右,更优选50万~500万左右的分子量的透明质酸。
[0029]
另外,透明质酸的质均分子量可以通过在尺寸排除色谱(sec)中使用多角度光散射检测器(malls)作为检测器的sec-malls法来测定(例如,参照c.yomota,bull.natl.inst.health sci.,121,030-033(2003)等)。
[0030]
作为本发明对象的透明质酸也可以是交联透明质酸。在此,交联透明质酸是具有三维网状结构的高分子,在介质中溶胀的状态下成为凝胶状。即,交联透明质酸在生理上可接受的介质中溶胀而具有水凝胶的形态。
[0031]
作为交联透明质酸的一例,可以举出由质均一次分子量大于80万的透明质酸形成的交联透明质酸。该交联透明质酸的特征在于,在切断交联透明质酸的交联点时,生成质均分子量大于80万的直链状透明质酸。另外,通过切断交联点而生成的透明质酸的质均分子量和支化度可以通过在凝胶渗透色谱(gpc)中使用差示折射率计和多角度激光散射检测器(malls)作为检测器的gpc-malls(多角度光散射)容易地测定。
[0032]
本发明中使用的交联透明质酸的交联点可以是水解性的。在此,“交联点为水解性”是指,在生理条件下,例如37℃、ph7.4、生理盐水中,具有交联点优先于透明质酸的主链分解而分解的性质。水解性优于透明质酸主链分解的交联结构可举出:氨基甲酸酯键、腙键、酰肼键和磷酸酯键等,最典型的结构是酯键。
[0033]
作为交联结构为酯键的交联透明质酸,可举出:多元醇与透明质酸的羧基的酯、多元羧酸与透明质酸的羟基的酯、多元环氧化合物与透明质酸的羧基的酯等。该交联透明质酸包括透明质酸的羧基与羟基间直接形成酯键的交联透明质酸(将其称为“具有自交联酯键的交联酯”或“自交联酯键透明质酸”)。
[0034]
自交联酯键透明质酸可以用以往公知的方法制造。例如,一部分或全部羧基被相同的多糖链或其它多糖链的醇基酯化而得到的自交联酯键透明质酸可以按照ep0341745b1的记载进行制造,另外,在wo99/10385中,通过进行至少1次将透明质酸的水溶液调节为酸性并将该水溶液冷冻,接着解冻的操作来制备自交联酯键透明质酸的方法,另外,在wo01/
57093中记载了如下方法:即使不进行冷冻,也以成为5%以上的浓度的方式混合透明质酸和酸性溶液,保持该共存状态,由此制备自交联酯键透明质酸。
[0035]
该自交联酯键透明质酸由于通过水解而释放的天然的透明质酸通过生理代谢途径代谢,因此认为安全性比通过其他交联反应制造的交联透明质酸高。
[0036]
另外,作为交联透明质酸,也可以举出透明质酸的羧基通过酯键与同一透明质酸分子的羟基和/或其他透明质酸分子的羟基交联的透明质酸(例如,参照日本特开2003-252905号公报)。
[0037]
交联透明质酸的交联度,例如导入的分子间酯键量可以根据交联透明质酸的使用目的或要求特性任意控制。酯键量可以定义为相对于透明质酸中的羧基的总数的比例。在本发明的抗癌疗法的增敏剂中,透明质酸优选作为水溶液或水溶胀凝胶使用。另外,在以水溶液的状态使用透明质酸时,并没有限制,但优选使用分子间酯键量小于0.5%的交联透明质酸。另外,在水溶胀凝胶的状态下使用透明质酸时,并没有限制,但优选使用分子间酯键量为0.5%~1%左右的交联透明质酸。需要说明的是,交联透明质酸的分子结构可以使用nmr确定(carbohydr.res.vol245,p113-128,1993,macromolecules vol29,p2894-2902,1996)。
[0038]
交联透明质酸例如可以通过将透明质酸水溶液调节为酸性,将解离的羧基转换为酸型来制备。在此,透明质酸水溶液的酸性处理在高温条件下发生n-乙酰基-d-氨基葡萄糖单元的脱乙酰化反应,与交联反应竞争(参照日本特开平1-266102公报),因此优选降低反应温度来进行。作为优先形成交联的反应温度,优选室温以下,更优选的反应温度为10℃以下。另外,为了促进分子间酯化反应,优选提高透明质酸浓度。例如,作为反应液的透明质酸浓度,优选5质量%以上,更优选地可举出10质量%以上。另外,为了促进分子间酯化反应,也可以在反应体系中添加催化脱水缩合反应的物质。作为促进脱水缩合反应的催化剂,一般为酸性催化剂,可以使用硫酸、盐酸或芳香族磺酸衍生物等。
[0039]
另外,在形成交联透明质酸时,也可以将透明质酸与生物相容性同样优异的材料(例如硫酸软骨素、羧甲基纤维素等)混合、复合化而形成交联透明质酸。另外,在形成交联透明质酸时,也可以添加药学或生理学活性物质,形成含有它们的交联透明质酸。
[0040]
这样得到的交联透明质酸接着可以供于去除用以调节为酸性的酸成分的操作。作为该酸成分的去除操作,通常可举出利用水性溶剂的清洗或透析。在此,作为水性溶剂,只要不损害交联透明质酸的功能,则没有特别限制,例如可以使用水、生理盐水、磷酸缓冲液等,优选可以使用生理盐水、磷酸缓冲液等。另外,在清洗后的交联透明质酸中残留有酸型的羧基的情况下,也可以制成钠型等盐的形态(氯化)。作为氯化方法,并没有限制,可以例示用氢氧化钠水溶液将交联透明质酸水溶液的ph调节至7左右,或将交联透明质酸浸渍于生理盐水或磷酸缓冲生理盐水中的方法。
[0041]
这样制备的交联透明质酸,根据其使用目的,能够以溶液状、浸渍于溶剂中的状态、含有溶剂的湿润状态,作为本发明的抗癌疗法的增敏剂(以下,也将它们简单地总称为“增敏剂”)的材料使用。
[0042]
交联透明质酸在生理上可接受的介质中溶胀而成为凝胶。因此,在本发明的增敏剂具有注入剂的形态的情况下,为了通过注射针将其注入到进行放射线照射或抗癌化学疗法的肿瘤患部中,需要使交联透明质酸(凝胶)作为悬浮液分散到生理上可接受的介质中。
悬浮液可以通过在其制造工序或精制工序的任一阶段,使用混合机或均化器那样的粉碎机将交联透明质酸粉碎来进行调节。交联透明质酸的水凝胶粒子的粒径可以任意调节,但如果将交联透明质酸分散到生理上可接受的介质中后用均化器进行处理,则通常可以容易地调节为0.05~2μm左右的分散粒径。
[0043]
另外,交联透明质酸凝胶的平衡溶胀倍率可以根据交联透明质酸的交联度任意调节。例如,在平衡溶胀倍率为100倍时,生理上可接受的介质中的透明质酸浓度为1%。在平衡溶胀倍率为10倍时,生理上可接受的介质中的透明质酸浓度为10%。
[0044]
在本发明的增敏剂中,如上所述,透明质酸可以是通常的透明质酸(非交联型),另外,也可以是交联型的透明质酸(交联透明质酸)中的任一种,另外,还可以将它们任意组合使用。另外,可以使用单一形态或单一分子量,也可以将不同的交联透明质酸或不同分子量的透明质酸混合使用。
[0045]
在本发明的增敏剂中,透明质酸(以包含交联型透明质酸的概念使用)也能够以盐的形态使用。在此,作为透明质酸的盐,并没有限制,可以优选例示钠、钾、锂等碱金属盐。优选为透明质酸的钠盐。
[0046]
其他成分进而,本发明的增敏剂除了上述成分(a)和成分(b)以外,还可以含有医药上可容许的生理盐水或磷酸缓冲液等(例如氯化钠、磷酸氢钠、磷酸二氢钠等)。本发明的增敏剂只要对人体具有相容性,则对其液性没有特别限制,优选调节为ph6~8.5的范围。更优选为ph6.8~7.8的范围。
[0047]
本发明的增敏剂的剂型为注入剂时,可以含有等渗剂、ph调节剂和缓冲液。作为等渗剂,可举出:氯化钠、甘油、葡萄糖、聚乙二醇、丙二醇、d-甘露醇、果糖、木糖醇、磷酸二氢钠、磷酸钠等,优选使用氯化钠。另外,作为ph调节剂,可举出盐酸、氢氧化钠等,如上所述,调节至ph6~8.5的范围,优选调节至ph6.8~7.8。而且,作为用以保持ph的缓冲液,可举出:磷酸缓冲液、tris缓冲液和醋酸缓冲液。优选使用磷酸缓冲液。
[0048]
本发明的增敏剂的剂型本发明的增敏剂具有液状(包括溶解液、乳浊液、悬浮液)或凝胶状,作为注入剂使用。因此,本发明的增敏剂可以通过使用注射器等直接注入到进行抗癌疗法的对象的肿瘤患部中,或者经由血管造影的导管注入的方法来进行给药。具体而言,注入优选在超声波检查的引导下一边确认增敏剂向组织的渗透状况,一边使用注射器或导管泵等调节注入量,一边使用注射针来进行注入。在这种情况下,通过用超声波引导器改变注入针的深度和方向,可以使增敏剂广泛地遍及肿瘤组织。
[0049]
如上所述,本发明的抗癌疗法的增敏剂的形态是注入剂的形态。注入剂可以通过以下方式而制备:使用注射用水(注射用蒸馏水、注射用灭菌水等)、等渗剂、ph调节剂和缓冲液等制备水溶液,在该水溶液中以成为上述范围的比例添加配合成分(a)和成分(b),填充到容器并进行密封后,通过高压蒸汽灭菌、热水浸渍灭菌等进行灭菌处理。另外,也可以在使用时根据需要使用注射用水(注射用蒸馏水、注射用灭菌水等),将含有成分(a)的制剂和含有成分(b)的制剂配合混合来制备(使用时制备制剂)。
[0050]
在临床现场使用本发明的增敏剂的情况下,例如,作为成分(a),能够使用封入到注射器中的0.4ml的3%h2o2(例如,stockport pharmaceuticals(英国)供给的2.0ml的灭菌
安瓿),作为成分(b),能够使用装填到2.0ml注射器中的20mg的透明质酸或其盐(例如,aah pharmaceuticals(英国)提供的2.0ml的透明质酸钠、ostenil(注册商标)),通过将它们混合,可以在使用时制备本发明的增敏剂。在这种情况下,将封入有过氧化氢水的注射器和装填有透明质酸或其盐的溶液的注射器经由双路接头连接,交替地泵送注射器,由此能够在无菌条件下混合。在使用上述例示的成分(a)(stockport pharmaceuticals(英国))供给的2.0ml的3%h2o2灭菌安瓿和成分(b)(aah pharmaceuticals(英国))提供的2.0ml的透明质酸钠,ostenil(注册商标)时,将它们混合时,可以制备2.4ml含有0.5%h2o2的增敏剂。在实际的临床现场,将制备的2.4ml的增敏剂均等地分开到两个注射器,可以将1.2ml的含有0.5%h2o2的增敏剂作为最小的给药单位。
[0051]
本发明的增敏剂的用法/用量本发明的增敏剂的给药次数可以根据治疗对象的肿瘤的状况适当确定,例如,在肿瘤的治疗期间中,每周注入到肿瘤中1~3次,优选每周注入到肿瘤中两次。另外,增敏剂在肿瘤的治疗期间中总计注入到肿瘤中2~8次,优选共计注入到肿瘤中4至6次。
[0052]
向肿瘤患部的增敏剂的给药量根据治疗对象的肿瘤的状况而可以为1.2ml~15.0ml的范围。另外,这换言之,根据肿瘤的尺寸,向肿瘤患部的增敏剂的给药量,可以将根据上述使用时制备例制作的含有0.5%h2o2的增敏剂以0.5~5制备份使用。例如,在1制备中使用2.4ml的含有0.5%h2o2的增敏剂的情况下,可以从作为1制备时的最小给药单位的0.5制备份的1.2ml到5制备份的12.0ml进行给药,在1制备中使用3.0ml的含有0.5%h2o2的增敏剂的情况下,可以从作为1制备时的最小给药单位的0.5制备份的1.5ml到5制备份的15.0ml进行给药。
[0053]
另外,向肿瘤的增敏剂的给药量考虑到可以根据肿瘤块的尺寸、肿瘤块的硬度、肿瘤边界的清晰度、治疗对象的肿瘤细胞的种类等来进行调节,例如作为肿瘤块的尺寸与给药量的关系,可举出:(1)对于肿瘤块的最大直径的长度小于3.0cm的尺寸的所述肿瘤,可以为1.2ml以上且小于3.0ml(对应于0.5制备~1制备);(2)对于肿瘤块的最大直径的长度为3.0cm以上且小于6.0cm的尺寸的肿瘤,可以为2.4ml以上且小于6.0ml(1制备~2制备);(3)对于肿瘤块的最大直径的长度为6.0cm以上且小于10.0cm的尺寸的肿瘤,可以为3.6ml以上且小于9.0ml(1.5制备~3制备);以及(4)对于肿瘤块的最大直径的长度为10.0cm以上的尺寸的肿瘤,可以为3.6ml以上15.0ml以下(1.5制备~5制备)的范围。肿瘤尺寸可以按照recist(response evaluation criteria in solid tumors:实体瘤的疗效评价标准)指南进行测定。
[0054]
本发明的增敏剂原本是为了增强抗癌疗法的抗癌作用而开发的,已知具有抗癌作用。在本研究中,实际对患者应用本发明的增敏剂的结果是可知,本发明的增敏剂表现出肿瘤的尺寸减少效果,作为该主要作用的结果,有时附带地具有疼痛减低作用、皮肤毒性降低作用、或者疼痛减低作用和皮肤毒性降低作用这两者的作用。认为本发明的增敏剂提高由放射疗法或抗癌化学疗法等抗癌疗法带来的抗癌效果,使肿瘤细胞块的尺寸大大减少,结果可获得降低由肿瘤细胞块产生的疼痛的作用。另外,通过在抗癌疗法时使用本发明的增敏剂,能够降低用于得到与仅进行抗癌疗法的情况相同的效果的抗癌疗法的强度。认为其
结果是,例如在作为抗癌疗法进行放射疗法的情况下,通过使用本发明的增敏剂,可以降低放射线射线量,作为结果,可以得到降低由放射线照射产生的皮肤毒性的作用。
[0055]
与本发明的增敏剂组合的抗癌疗法本发明的增敏剂不是单独使用,而是与放射疗法或抗癌化学疗法等临床现场使用的抗癌疗法组合使用。
[0056]
在将本发明的增敏剂作为放射疗法的增敏剂使用的情况下,在放射疗法时,在放射线照射之前对于进行放射线照射的肿瘤患部使用。优选地,可以用于以放射线抗性的肿瘤为对象的放射治疗。
[0057]
在此,作为放射线抗性的肿瘤,可以举出处于低氧肿瘤细胞多的状态的肿瘤以及含有大量抗氧化酶的肿瘤。以目前通用的直线加速器为主体的癌放射治疗中的最大课题是存在放射线抗性的癌细胞。该放射线抗性的肿瘤组织多存在于低氧状态的部位,对放射治疗显示出抗性。另外,这些细胞对放射线的抗性据说原因在于,在低氧状态下,由放射线诱导的dna损伤等中不会发生基于氧的固定,此外,抗氧化酶消除了由放射线在肿瘤细胞内产生的活性氧种,因此难以诱导凋亡。作为该放射线抗性的肿瘤,具体而言,可举出:以恶性黑色素瘤、恶性神经胶质芽瘤、骨肉瘤为代表的各种肉瘤以及生长为数cm以上的局部进展癌的几乎全部。
[0058]
在将本发明的增敏剂作为放射疗法的增敏剂使用时,放射治疗可以通过将本发明的增敏剂应用于靶肿瘤患部后,对该患部进行x射线照射或电子线照射来实施。放射疗法的用法/用量可以根据放射线的种类、治疗对象的患者的身体状况、成为治疗对象的肿瘤的状态等因素,适当决定为例如每天、两天1次、3天1次、1周1次、10天1次等。在每天进行放射治疗的情况下,放射治疗中的每一次的射线量可以从1.75~3.75gy的范围适当选择。在每天进行放射治疗的情况下,总射线量可以从31.5~67.5gy的范围适当选择。在每天进行放射治疗的情况下,放射治疗可以从16天~20天的范围适当选择。在每周进行1、2或3次放射治疗的情况下,放射治疗中的每一次的射线量可以从5.0~7.0gy的范围适当选择。在每周进行1、2或3次放射治疗的情况下,一周的总射线量可以从5.0~21.0gy的范围适当选择。在每周进行1、2或3次放射治疗的情况下,放射治疗总计次数可以从4至8次的范围适当选择,优选为6次。在向肿瘤注射增敏剂后24小时以内,优选12小时以内,更优选6小时以内,进一步优选2小时以内实施放射治疗。
[0059]
另外,在将本发明的增敏剂作为抗癌化学疗法的增敏剂使用的情况下,在抗癌化学疗法(给予抗癌剂)之前,对于该治疗对象的肿瘤患部加以使用(优选注入给药)。优选的是,能够用于抗癌化学疗法难以发挥作用的肿瘤以及较大的肿瘤。例如,胃癌、非小细胞肺癌、大肠/直肠癌、肝癌、胰腺癌、子宫癌、食道癌、乳腺癌等许多固体肿瘤大多对抗癌化学疗法显示出抗性。另外,关于这些固体肿瘤,局部进展的局部进展癌的大部分对抗癌化学疗法具有抗性。例如,抗癌化学疗法可以在抗癌化学疗法注射后24小时以内,优选12小时以内,更优选6小时以内,进一步优选2小时以内实施。
[0060]
将本发明的增敏剂作为抗癌化学疗法的增敏剂使用时,抗癌化学疗法可以通过将本发明的增敏剂应用于作为与抗癌剂的给药并行(抗癌剂的给药前后或同时)的对象的肿瘤患部来实施。抗癌化学疗法的用法/用量可以根据抗癌剂的种类、治疗对象患者的身体状况、成为治疗对象的肿瘤的状态等因素适当决定。该情况下的增敏剂的应用方法如上所述,
优选通过在超声波检查的引导下使用注射针或导管将增敏剂注入肿瘤患部来实施。在此,增敏剂注入的条件根据肿瘤的进展度、大小等而不同,但可以举出通常一次进行1ml~5ml,优选3ml的注入的方法。给药时间表可以与放射疗法的时间表相同。
[0061]
本发明的增敏剂的其他实施方式作为本发明的另一实施方式,还提供组合使用放射疗法或抗癌化学疗法与本发明的增敏剂的肿瘤治疗方法。本发明的治疗方法包括对肿瘤给予本发明的增敏剂的步骤、以及进行放射疗法或抗癌化学疗法的步骤。实施例
[0062]
实施例1:试验设计在本实施例中,进行了系统实施的研究,该研究对并用了针对局部进展性乳腺癌的rt的肿瘤内h2o2注射进行试验。
[0063]
该实验的主要目的是评价使用了中等程度的小分割照射rt的h2o2注射的安全性和容许性。另外,次要目标包括需要追加的疼痛药的被检体的比例、3级以上的皮肤毒性的发生率、肿瘤反应的评价。
[0064]
在该非随机化试验中,作为对象的是与有无转移无关而具有局部进展性或局部复发性乳腺癌的被检体,且rt被认为适于局部区域的疾病管理。被检体是由于共存疾病或局部疾病的程度而不能进行手术、或者由于转移性疾病的存在而乳房原发的手术不适当中的任一种。
[0065]
该试验在英国皇家马斯登医院(the royal marsden nhs foundation trust)(ccr4502)实施。在试验开始前取得了研究伦理委员会(rec)和英国药品局(mhra)的批准(iras203161、rec16/lo/1566、eudract2016-000833-40)。监测通过英国皇家马斯登医院的临床试验单元实施。
[0066]
试验的概要如图1所示。图1表示具有局部进展性乳腺癌的被检体的两种放射治疗分割照射时间表和与其对应的跟踪时间表的组合中,向肿瘤内给予透明质酸钠凝胶中的h2o2的试验的非随机化试验设计的试验的概要。在该图中,#表示放射治疗分割照射,us表示超声波,rt表示放射治疗。
[0067]
作为对象的被检体是如下被检体:18岁以上,组织学上确认了乳腺癌,为了进行局部控制和/或缓和局部区域的症状而需要乳房rt,在可注射的表面部位至少具有一个直径3cm以上的乳房肿瘤。雌激素受体(er)和孕激素受体(pr)以及her2表达的任意组合是容许的。作为排除基准,列举了对乳房的rt的既往史,曲妥珠单抗、帕妥珠单抗、迪诺舒单抗以外的生物学疗法的并用。关于妊娠,排除了可妊娠年龄的女性被检体。排除了接近血管或上臂神经丛等乳房肿瘤的解剖学位置妨碍肿瘤内注射的安全到达的被检体。
[0068]
根据以前发表的数据,30~100%的被检体在注射后数小时经历了“轻度”(或ctcae 1级)以上不恶化的疼痛。肿瘤溶解综合症(轻度)的病例在日本文献中总计139人的乳腺癌被检体中报告了一例。根据关于h2o2+rt的安全性的该见解,在本试验中募集了被检体12人。将接受了每天和每周两次的rt的分割照射的被检体作为一层进行分析,进行试验的登记,将接受了至少1次份的肿瘤内h2o2的全部被检体定义为试验集团。肿瘤体积使用由us扫描得到的三维测定值进行计算。
[0069]
实施例2:医药品的制剂化
本实施例说明在试验中使用的医药品的制剂化。
[0070]
作为本发明的增敏剂使用的0.5%h2o2溶液通过混合0.4ml的3%h2o2(stockport pharmaceuticals(英国)供给的2.0ml的灭菌安瓿)和2.0ml的ostenil(注册商标)aah pharmaceuticals(英国)提供的、装填在2.0ml注射器中的20mg的透明质酸钠)而制成。
[0071]
由于h2o2是低分子量(34g/mol),因此能够可靠地实现药物在凝胶内的迅速平衡化。混合物是无色的粘性溶液(ph6.8~7.8),在室温下保存,通过粘度测定(通过stockport pharmaceuticals(英国)实施),制备后稳定两小时。如注射时生成氧的微气泡所示,凝胶至少可持续24小时地释放h2o2,这样的特征是rt中每周两次给药的强有力的根据。
[0072]
在该试验中,药剂和凝胶使用经由双路接头连接的两个注射器,在无菌条件下混合。一旦混合后,各注射器总计含有2.4ml的0.5%h2o2,两个注射器的内容量通常是测定为直径30~60mm的肿瘤所必需的量。
[0073]
实施例3:放射治疗本实施例说明对各被检体实施的放射治疗的内容。
[0074]
在实施例1中募集的12名被检体中,6名被检体以2.75gy每天分割照射18次,总计照射49.5gy,6名被检体以6gy每周两次分割照射6次,总计照射36gy,对乳房整体或乳房整体及局部淋巴结进行照射。由以往的2gy分割照射(eqd2)(图2)表示的等效rt射线量(在该式中,d=总rt射线量,d=每次分割照射的射线量,α/β比表示分割照射灵敏度的指标)在这两个时间表中分别为57gy和65gy。
[0075]
对于除了乳房之外还需要淋巴结照射的每周两次6gy的时间表的被检体(被检体数为上述12人中的1人),按照标准机关的方针,以不超过上臂神经丛的容许射线量的方式,对上臂神经丛以每周两次的5次分割照射6gy,对结区域照射总计30gy。
[0076]
rt的时间表根据被检体的性能状态和并存疾病来选择,对于适合的被检体,选择每天治疗的时间表。rt利用使用6~10mv的光子的直线加速器、使用来自治疗计划用ct的扫描数据的3d规划以及标准的切线对向场来进行照射。被检体是在使两臂外翻的状态下,在胸板上成为仰卧位而进行模拟及治疗。临床靶体积(ctv)包括含有深部肌肉膜的同侧乳房整体,但处于下层的肌肉或覆盖的皮肤在与疾病无关的情况下除外。rt照射量规定为100%等射线量,使靶体积在95%~107%的等射线量内。
[0077]
说明包含心脏、肺、相对侧的乳房的有风险的脏器的概要,按照射线量容许范围的标准指南。使用了通过最初3天每天拍摄图像,之后每周拍摄图像而构成的标准治疗确认协议。在由肿瘤引起的皮肤浸润的病例中,按照标准的治疗法,在治疗中包括通过rt之间给予5mm的蜡块(wax bolus),使对皮肤的射线量最大化。在接受以18次分割照射的49.5gy的治疗的被检体中,确认了对肿瘤床的一系列的增强照射(以使用了小型切线对向射束或直接电子束的5次每天分割照射计为13.35gy),但这需要试验参加时的申报。
[0078]
通过对肿瘤床的增强照射,eqd2在6次的分割照射中增加到与36gy同等的值,成为与在使用了相同药剂的以前的被检体分组中已经报告的射线量强度同等的值。
[0079]
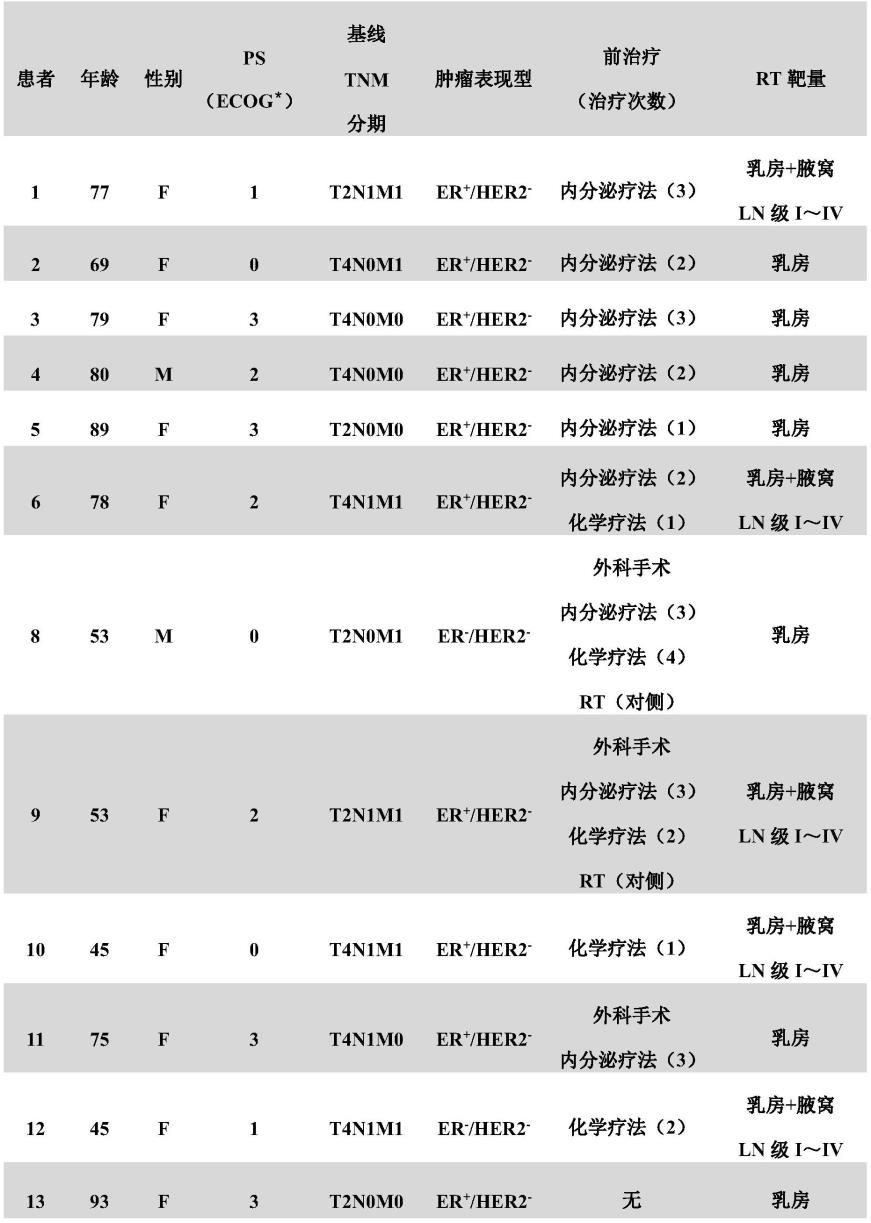
被检体的人口统计学、肿瘤的特征、前治疗及rt靶量汇总于表1。
[0080]
[表1]患者的人口统计信息、肿瘤的特征、前治疗和rt治疗量的汇总
第1、3、4、5、11、13位患者接受36gy/6次分割照射,第2、6、8、9、10、12位患者接受49.5gy/18次分割照射。*表示癌的状态的指标(performance status)(美国东海岸癌临床试验组)
[0081]
13名被检体(女性11人、男性2人)在2017年2月~2018年8月之间向本研究应募。所有被检体为局部进展或复发乳腺癌,因并存疾病、疾病的局部扩散或转移性疾病而不能手术。1名被检体在rt开始前由于与试验无关的临床恶化而退出,未给予h2o2,因此募集追加
(第13人)的被检体。年龄中位数为77岁(范围45~93岁)。3名被检体因并存疾病和虚弱性而靠轮椅生活。乳房肿瘤的分期在5/12例中为t2,在7/12例中为t4。在6/12例中为n0疾病,在6/12例中为n1疾病(腋窝淋巴结浸润)。在8/12例的被检体中,确认有远处转移。乳房肿瘤的尺寸为30mm~164mm(最大尺寸)。10名被检体具有er+her2-疾病,2人是三阴性疾病。没有炎症性乳腺癌的被检体。所有被检体对乳腺癌接受过1~4种前治疗,大多数被检体以前接受过全身治疗。3名被检体接受过乳腺癌手术,但局部复发。在rt中,7/12例的被检体继续内分泌疗法,2/12例的被检体继续针对转移性骨病的双膦酸盐疗法。
[0082]
h2o2注射的遵守以包括恐针症的一例在内的全部被检体计为100%。所有被检体在接受h2o2注射后规定的1~2小时以内接受rt,但除了错误地在h2o2注射前接受过1次rt分割照射的被检体的1个例外以外,所有被检体都接受rt。结果是,对于报告时生存的全部被检体,以最低12个月的跟踪进行报告(范围2~24个月)。11名被检体完成12个月的跟踪,被检体编号12号的被检体在rt后仅2个月因进展性的转移性疾病而死亡。
[0083]
实施例4:透明质酸钠凝胶中的h2o2的肿瘤内注射在本实施例中,对被检体进行h2o2的肿瘤内注射,确认其结果。
[0084]
在rt的第2周,每周两次给予经皮肿瘤内kortuc(高知双氧水-放射疗法)注射。各被检体总计接受了4~6次(中位数=5次)的注射,但次数更少的被检体实施了6次的分割照射。在第2周开始kortuc的理由是为了在第1周的rt中能够降低肿瘤间质压,由此能够进行技术上更简单且对于被检体而言容许性高的注射。
[0085]
注射是在注射0.5%的木质素使皮肤麻醉后,受过训练的放射科医生或放射线技师在超声波(us)引导下,用23号针进行的。在尺寸为直径30~60mm的肿瘤的情况下,在透明质酸钠凝胶中在各时刻注射0.5%h2o2的两个注射器(4.8ml)。大小超过60mm的肿瘤需要3个注射器(7.2ml)。
[0086]
利用h2o2在肿瘤内分解成氧和水时的氧微气泡(参照图3c)的迅速出现,辅助经由2~3个不同角度的针迹的us引导下的均匀且准确的送达(参照图3a)。针的前端位于肿瘤的最深的侧面,一边将针向表面拔出一边缓慢地释放凝胶(参照图3b)。关于小的肿瘤,通过经由单一的皮肤穿刺部位改变针的角度(在肿瘤内向左右或上下移动),可以实现肿瘤内的h2o2凝胶混合物的均匀分布。关于几个更大的肿瘤(例如超过60mm),为了可靠地使肿瘤的体积整体中的氧微气泡均等分布,需要经由从不同方向对皮肤的进入点对肿瘤进行注射。
[0087]
肿瘤内的针迹数量和对皮肤的进入点在超声波扫描中由放射科医生决定,以注射步骤中的氧微气泡的范围和分布为指引。在拔出针时凝胶回到皮肤表面的情况下,迅速用灭菌纱布擦拭。被检体在乳房/腋窝存在1个以上明确的肿瘤的情况下,为了有助于反应的评价,要求临床医生/放射科医生明确地记录进行了注射的病变(通常为最大的)。rt在h2o2注射后1~2小时以内进行。
[0088]
在各rt组(每天或每周两次的分割照射)的治疗的监测中,在最初的被检体与被检体编号2号的被检体之间规定最低1周的间隔,在此期间,独立数据监测委员会(idmc)审查与肿瘤内注射相关的急性毒性数据(疼痛、皮肤毒性、肿瘤溶解)。根据预先确定的基准,各组的被检体编号2号和被检体编号3号的被检体,之后各组的被检体编号4号、被检体编号5号、被检体编号6号的被检体并行地接受治疗。
[0089]
实施例5:主目标
在本实施例中,在各被检体的临床试验中确认达成了作为目标的评价项目(主要评价项目、主目标)。
[0090]
主目标与通过被检体在自家填写的自我申报询问单记录的注射后疼痛的时刻、重症度及持续时间相关。在各h2o2注射前和24小时后,将重症度及持续时间以0(无疼痛)~10(最痛的可能疼痛)的范围的11点的数值量表进行记录(参照图4)。使用被检体报告的分数,计算i)任一肿瘤内注射后超过基线5点以上的疼痛分数的被检体的比例以及ii)追加的镇痛药的需要量。
[0091]
在该实验中,将从被检体收集的疼痛分数汇总于表2,根据从各被检体得到的信息,将以下表3所示的基于ctcae v.4.02基准的肿瘤疼痛分级分配给各被检体的状态,作为表2的“rt急性皮肤毒性的最大分数”项目记载。
[0092]
[表2]疼痛分数和rt急性皮肤毒性分数的汇总疼痛分数和rt急性皮肤毒性分数的汇总疼痛强度通过患者的自我评价问卷调查而以0~10评分。rt急性皮肤毒性使用ctcae v4.02,由临床医生以0~5评分。a)恐针症患者b)h2o2注射前具有明显的乳房疼痛,镇痛剂顺应性低的患者adl:日常生活的活动(activities of daily living)[表3]
adl:日常生活的活动(activities of daily living)
[0093]
其结果是,在12名被检体中,3名被检体注射后,经历了1级(轻度)的肿瘤性疼痛,5名被检体经历了2级(中等程度的重症度,对日常生活有限制)的疼痛(ctcae v4.02)。其余被检体(4人)在肿瘤内注射后没有报告进一步的疼痛。疼痛时间的中位数为60分钟,四分位范围为20~120分钟。
[0094]
进一步进行详细的研究,结果12名被检体中,4名被检体在治疗中报告了与基线相比5点以上的疼痛。1名被检体为了控制由真菌性乳房肿瘤引起的疼痛,在开始放射治疗之前服用了鸦片类镇痛药(口服吗啡)。6名被检体为了管理症状,需要追加的镇痛药(扑热息痛及可待因类)。在这些病例中,在管理中包括可靠地遵守现有的镇痛药以及优化治疗剩余期间的镇痛和/或抗焦虑药。
[0095]
实施例6:次要目标在本实施例中,确认达成了用于评价治疗实验的主要的评价项目(主目标)以外的效果的项目(次要目标)。
[0096]
本实施例中的次要目标为利用rt的急性皮肤毒性、肿瘤反应。
[0097]
(6-1)皮肤毒性皮肤毒性是在rt期间及rt的4周后,由临床团队的成员每周对所有的被检体进行评价。标准化的proformer记录了乳房皮肤的红斑和脱屑的程度。在各rt组中,在最初的3名被检体中,在rt的6周后连1人都未确认到3级以上的持续性ctcae(v4.02)皮肤毒性的情况下,独立数据监控委员会(idmc)允许在该rt时间表内进一步继续募集3名被检体。当发现湿润性脱屑超过皮肤的褶皱时,每周继续进行评价,直至重症度减少到1级以下。在这些病例中,记录了从rt开始到rt的4周后之间显示3级以上的皮肤毒性的被检体的比例,以及从rt开始到rt的4周后所报告的最差分级的皮肤毒性。然而,当癌浸润皮肤时,通常仅通过rt就可以认识到被检体经历3级以上的皮肤毒性。
[0098]
根据在该实验中从被检体得到的信息,将以下表4所示的基于ctcae v.4.02基准的放射线皮肤炎分级分配给各被检体的状态,作为表2的“rt急性皮肤毒性的最大分数”项目记载。
[0099]
[表4]
[0100]
所报告的皮肤毒性的最高分级为12名被检体中,5名被检体的3级,4名被检体的2级,1名被检体的1级,2名被检体的0级(表2及表4)。经历了3级皮肤毒性的5名被检体全部在放射治疗中(由于肿瘤引起的皮肤浸润)接受了使用蜡块的治疗。并未暗示由h2o2的局部漏出引起的红斑的增强。在该试验中观察到的急性放射线皮肤毒性包括癌在皮肤上浸润的被检体,与标准的rt单独疗法中预想的为相同程度。没有肿瘤溶解综合症的病例。
[0101]
(6-2)肿瘤的反应肿瘤的反应在治疗后第3、6、12个月进行评价。在各时刻进行三维的us测定,如以前证实的那样,假定乳房肿瘤为半椭圆形而计算肿瘤体积。若仅以肿瘤的最大尺寸,特别是在放射治疗后肿瘤“平坦化”的情况下,认为不能准确地表示肿瘤的反应。肿瘤体积应用类似于recist的原则而与治疗前的测定值进行比较。完全缓解(cr)定义为目标病变消失,部分缓解(pr)定义为肿瘤体积减少至少30%,稳定状态(sd)定义为肿瘤体积减少小于30%或增加小于20%。
[0102]
图5a和表5表示在治疗后的连续时刻的基于us测定的肿瘤反应的详细情况。
[0103]
[表5]肿瘤的大小的测定(横截面
‘
ts’、深度
‘
d’及纵截面
‘
ls’、单位:mm)以及最终跟踪时的临床反应评价
pr:部分缓解cr:完全缓解*与在示出稳定状态的非注射部位的另两个乳房肿瘤进行比较,注射h2o2的乳房肿瘤显示出部分缓解。在pet扫描(治疗后第3个月和第12个月)中无论乳房外的疾病进展与否,患者的乳房肿瘤都显示出代谢完全缓解。在治疗后12个月(相对于6个月)肿瘤尺寸增加;在us扫描中显示出由纤维化产生的物质。
§
由于尺寸大而用ct测定的肉瘤性乳房肿瘤。从基线扫描到rt开始的期间急剧增殖,但rt后增殖和溃疡化稳定。在治疗结束后两个月以内死亡。
[0104]
在最后的图像评价中,如图5b所示,肿瘤体积减少率为50~100%。在该研究中评价的全部被检体在最终临床跟踪时(中位数12个月,范围2至24个月)维持照射靶病变中的局部区域控制。被检体编号12号的被检体在rt后第6周因转移性疾病而死亡,肿瘤反应的3个月目标无法评价。
[0105]
图6作为例示的例子,表示rt治疗前和治疗12个月后的被检体编号10号的被检体中的肿瘤的扩散(被检体维持18个月cr)。只有1/12例的被检体在rt治疗量内具有1个以上的明确的肿瘤病变。在该被检体中,仅注射h2o2的肿瘤在12个月后维持pr,与此相对,单独接受相同rt的两个病变显示出稳定状态(未注射的病变作为内部控制发挥功能)。关于肿瘤反应的评价,2名被检体在us测定和临床反应的评价中有不一致的情况(表5)。在被检体号9号的被检体中,尽管在临床检查中显示了部分优异的反应,但在第6~12个月的us测定中暗示出肿瘤的大小增加。在治疗12个月后的us图像的放射线学评述中,并非活动性的肿瘤而显示出与纤维症一致的变化。同样,被检体号8号的被检体尽管在us图像中确认到稳定的可测定的疾病,但在12个月后的临床评价中显示了完全缓解。如图7所示,根据同时执行的分期pet/ct扫描,确认到h2o2+rt治疗乳房肿瘤的代谢完全缓解。
[0106]
总结本实施例可知,在实施例中实施的试验中,对于不适合一次手术或以症状缓和为目的的调整的局部进展性的原发性或复发乳腺癌被检体,在以6gy为止的每次分割照射的rt射线量向肿瘤内送达h2o2的情况下,没有关于局部或全身毒性的担心。即使是虚弱的个体、老年人以及具有恐针症的人,也充分容许该治疗介入。
[0107]
另外,在并用放射治疗和本发明的增敏剂的情况下,确认到通过在放射治疗的第2周开始注射h2o2,在任何被检体中均没有注射规定量的药剂时的技术问题(即,由组织的压迫引起的抗性)。
[0108]
急性皮肤毒性与仅以同一rt所预想的急性皮肤毒性没有任何不同。根据预想,产生3级的放射线皮炎的仅是皮肤有浸润的被检体(利用5mm层的蜡“覆盖层”,不是将皮肤没有浸润的被检体的规定射线量的约70%,而是将规定射线量的100%可靠地照射皮肤的情况)。3级的皮肤脱屑由防护霜或敷料等标准的支护手段管理,在所有病例中症状完全消失。产业上的可利用性
[0109]
利用本发明抗癌疗法的增敏剂的用量和用法,能够提高抗癌疗法(放射疗法或抗癌化学疗法)的效果,有效治疗肿瘤。更具体而言,可知本发明的增敏剂除了具有作为主作用的抗癌效果之外,有时还附带地具有疼痛减低作用、皮肤毒性降低作用、或者疼痛减低作用和皮肤毒性降低作用这两者的作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1