用于和血管新生抑制剂组合使用的抗T细胞抗原结合分子的制作方法
用于和血管新生抑制剂组合使用的抗t细胞抗原结合分子
技术领域
1.本公开涉及用于和血管新生抑制剂组合使用的抗t细胞抗原结合分子。本公开进一步涉及药物组合物和方法,其用于预防、减轻、或治疗伴随抗t细胞抗原结合分子施用的因细胞因子产生而引起的副作用。
背景技术:
2.抗体在血浆中的稳定性高,副作用少,因此作为医药品受到关注(非专利文献1和非专利文献2)。已知抗体不仅诱导和抗原结合的作用、激动剂作用和拮抗剂作用,也诱导adcc(antibody dependent cytotoxicity:抗体依赖性细胞毒性)、adcp(antibody dependent cell phagocytosis:抗体依赖性细胞吞噬作用、cdc(补体依赖性细胞毒性)等效应细胞所引起的细胞毒性(也称为效应功能),对癌细胞发挥抗肿瘤效果(非专利文献3)。迄今为止,关于显示出优良抗肿瘤效果的多种治疗用抗体,已开发出以癌治疗为目的医药品(非专利文献4),且发现现有的治疗用抗体有优良的作用,但通过施用此类抗体得到的治疗成绩仍无法令人满意。
3.作为抑制多个靶标的分子,已研究出以1分子和两种以上抗原结合的抗体(bispecific antibodies、双特异性抗体)。如果双特异性抗体所识别的抗原均为在癌中特异性地表达的抗原,则和任一抗原结合都会显示出对于癌细胞的细胞毒性,因此可期待比识别一个抗原的通常的抗体医药品更有效率的抗肿瘤效果。
4.作为双特异性抗体的一种,从1980年代起已知有t细胞重定向抗体(t cell-redirecting antibody),其为动员t细胞作为效应细胞,且以细胞杀伤作为其抗肿瘤效果的机制的抗体(非专利文献5、6、7)。不同于动员nk细胞或巨噬细胞作为效应细胞的adcc作为其抗肿瘤效果的机制的抗体,t细胞重定向抗体是双特异性抗体,其包含:针对t细胞上的t细胞受体(tcr)复合体的构成亚单位中的任一种的抗体、特别是和cd3ε链结合的抗体,及和作为靶标的癌细胞上的抗原结合的抗体。通过t细胞重定向抗体同时和cd3ε链及癌抗原结合,t细胞接近癌细胞。其结果为,认为利用t细胞所具有的细胞杀伤作用,对癌细胞发挥抗肿瘤效果。例如,近年来,提供了新的t细胞重定向抗体,其具有以2个fab分别和癌抗原(gpc3)和在t细胞中表达的cd3ε链结合,且对于fcγr的结合活性降低的fc区(专利文献1、2)。
5.另一方面,有报告称伴随t细胞重定向抗体发挥高抗肿瘤活性而产生毒性,例如产生细胞因子释放综合征(cytokine release syndrome,crs)(非专利文献8)。
6.现有技术文献
7.[专利文献1]wo2012/073985(trab概念专利)
[0008]
[专利文献2]wo2016/047722(ery974物质专利)
[0009]
非专利文献
[0010]
[非专利文献1]nat.biotechnol.(2005)23,1073-1078
[0011]
[非专利文献2]eur j pharm biopharm.(2005)59(3),389-396
[0012]
[非专利文献3]drug des devel ther(2009)3,7-16
[0013]
[非专利文献4]clin cancer res.(2010)16(1),11-20
[0014]
[非专利文献5]nature(1985)314(6012),628-31
[0015]
[非专利文献6]int j cancer(1988)41(4),609-15.
[0016]
[非专利文献7]proc natl acad sci usa(1986)83(5),1453-7
[0017]
[非专利文献8]cancer j.2014 mar-apr;20(2):119-122.
技术实现要素:
[0018]
发明要解决的课题
[0019]
在非限定性的一个实施方案中,本公开涉及包含抗t细胞抗原结合分子和血管新生抑制剂的联合疗法和用于该联合疗法中使用的药物组合物等。
[0020]
用于解决课题的手段
[0021]
在非限定性的一个实施方案中,发明人等人发现,通过施用为代表性血管新生抑制剂的血管内皮细胞生长因子(vascular endothelial growth factor;vegf)抑制剂,可在个体中预防、减轻、或治疗伴随抗t细胞抗原结合分子施用的细胞因子释放综合征(crs)。
[0022]
在非限定性的一个实施方案中,本公开涉及以下:
[0023]
(a1)包含抗t细胞抗原结合分子的药物组合物,其特征在于,所述药物组合物通过和血管内皮细胞生长因子(vegf)抑制剂联合使用,预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放。
[0024]
(a1-1)根据(a1)所述的药物组合物,其中在所述药物组合物的施用前、同时或施用后,施用所述vegf抑制剂。
[0025]
(a1-2)根据(a1)所述的药物组合物,其中在所述药物组合物的施用前或同时,施用所述vegf抑制剂。
[0026]
(a1-3)根据(a1)至(a1-2)中任一项所述的药物组合物,其中在施用所述药物组合物的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用所述药物组合物前施用所述vegf抑制剂。
[0027]
(a1-4)根据(a1)至(a1-3)中任一项所述的药物组合物,其中所述vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上vegf抑制剂。
[0028]
(a1-5)根据(a1)至(a1-4)中任一项所述的药物组合物,其中所述vegf抑制剂为选自贝伐单抗(bevacizumab)、雷莫卢单抗(ramucirumab)和阿柏西普(aflibercept)中的1种以上vegf抑制剂。
[0029]
(a1-6)根据(a1)至(a1-5)中任一项所述的药物组合物,其中所述药物组合物为用于进一步附加地和免疫检查点抑制剂联合使用的药物组合物。
[0030]
(a1-7)根据(a1-6)所述的药物组合物,其中所述免疫检查点抑制剂为选自抗pd1抗体、抗pd-l1抗体和抗pd-l2抗体中的免疫检查点抑制剂。
[0031]
(a1-8)根据(a1-6)或(a1-7)所述的药物组合物,其中所述免疫检查点抑制剂为阿特珠单抗(atezolizumab)。
[0032]
(a1-9)根据(a1)至(a1-8)中任一项所述的药物组合物,其中在所述药物组合物的
施用前或同时,不施用皮质类固醇(corticosteroid)。
[0033]
(a1-10)根据(a1)至(a1-8)中任一项所述的药物组合物,其中在所述药物组合物的施用前、同时或施用后,进一步施用皮质类固醇。
[0034]
(a1-11)根据(a1-9)或(a1-10)所述的药物组合物,其中所述皮质类固醇为地塞米松(dexamethasone)、其药学上可接受的盐、或其衍生物。
[0035]
(a1-12)根据(a1)至(a1-11)中任一项所述的药物组合物,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗原结合分子:
[0036]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(2)包含具有癌抗原结合活性的抗体可变区的结构域。
[0037]
(a1-13)根据(a1)至(a1-12)中任一项所述的药物组合物,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:
[0038]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、
[0039]
(2)包含具有磷脂酰肌醇蛋白聚糖3(glypican 3)结合活性的抗体可变区的结构域、及
[0040]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0041]
(a1-14)根据(a1)至(a1-13)中任一项所述的药物组合物,其用于癌症的治疗。
[0042]
(a1-15)根据(a1)至(a1-14)中任一项所述的药物组合物,其用于预防或减轻细胞因子释放综合征和/或细胞因子释放,且治疗癌症。
[0043]
(a1-16)根据(a1)至(a1-15)中任一项所述的药物组合物,其中所述细胞因子释放综合征和/或细胞因子释放为伴随所述抗t细胞抗原结合分子的施用的细胞因子释放综合征和/或细胞因子释放。
[0044]
(a1-17)根据(a1)至(a1-16)中任一项所述的药物组合物,其中所述细胞因子释放综合征是从非肿瘤组织和肿瘤组织中的任一者或两者的细胞因子释放所引起的。
[0045]
或者,在非限定性的一个实施方案中,本公开涉及以下:
[0046]
(a2)试剂盒,其包含:(i)容器;(ii)该容器内的药物组合物,其包含抗t细胞抗原结合分子;及(iii)文件,其指示在该药物组合物的施用前、同时或施用后,为了预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放,施用vegf抑制剂。
[0047]
(a2-1)试剂盒,其包含:(i)容器;(ii)该容器内的药物组合物,其包含抗t细胞抗原结合分子;及(iii)文件,其指示在施用所述药物组合物的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用所述药物组合物前,为了预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放,施用所述vegf抑制剂。
[0048]
(a2-2)根据(a2)或(a2-1)所述的试剂盒,其中所述vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上vegf抑制剂。
[0049]
(a2-3)根据(a2)至(a2-2)中任一项所述的试剂盒,其中所述vegf抑制剂为选自贝伐单抗(bevacizumab)、雷莫卢单抗(ramucirumab)和阿柏西普(aflibercept)中的1种以上vegf抑制剂。
[0050]
(a2-4)根据(a2)至(a2-3)中任一项所述的试剂盒,其进一步包含附在容器中的标签,该标签显示所述药物组合物能够用于癌症的治疗。
[0051]
(a2-5)根据(a2)至(a2-4)中任一项所述的试剂盒,其包含文件,所述文件指示所述药物组合物进一步附加地和免疫检查点抑制剂联合使用。
[0052]
(a2-6)根据(a2-5)所述的试剂盒,其中所述免疫检查点抑制剂为选自抗pd1抗体、抗pd-l1抗体和抗pd-l2抗体中的免疫检查点抑制剂。
[0053]
(a2-7)根据(a2-5)或(a2-6)所述的药物组合物,其中所述免疫检查点抑制剂为阿特珠单抗(atezolizumab)。
[0054]
(a2-8)根据(a2)至(a2-7)中任一项所述的试剂盒,其进一步包含文件,所述文件指示在所述药物组合物的施用前或同时,不施用皮质类固醇(corticosteroid)。
[0055]
(a2-9)根据(a2)至(a2-7)中任一项所述的试剂盒,其进一步包含文件,所述文件指示在所述药物组合物的施用前、同时或施用后,进一步施用皮质类固醇。
[0056]
(a2-10)根据(a2-8)或(a2-9)所述的试剂盒,其中所述皮质类固醇为地塞米松(dexamethasone)、其药学上可接受的盐、或其衍生物。
[0057]
(a2-11)根据(a2)至(a2-10)中任一项所述的试剂盒,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗原结合分子:
[0058]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(2)包含具有癌抗原结合活性的抗体可变区的结构域。
[0059]
(a2-12)根据(a2)至(a2-11)中任一项所述的试剂盒,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:
[0060]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、
[0061]
(2)包含具有磷脂酰肌醇蛋白聚糖3(glypican 3)结合活性的抗体可变区的结构域、及
[0062]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0063]
(a2-13)根据(a2)至(a2-12)中任一项所述的试剂盒,其中所述药物组合物的处方按照所述文件的指示实行。
[0064]
(a2-14)根据(a2)至(a2-13)中任一项所述的试剂盒,其用于根据所述文件指示的处方治疗癌症。
[0065]
(a2-15)根据(a2)至(a2-14)中任一项所述的试剂盒,其中所述细胞因子释放综合征和/或细胞因子释放为伴随所述抗t细胞抗原结合分子的施用的细胞因子释放综合征和/或细胞因子释放。
[0066]
(a2-16)根据(a2)至(a1-15)中任一项所述的试剂盒,其中所述细胞因子释放综合征是从非肿瘤组织和肿瘤组织中的任一者或两者的细胞因子释放所引起的。
[0067]
(a2-17)根据(a2)至(a2-16)中任一项所述的试剂盒,其中所述药物组合物的处方按照所述文件的指示实行。
[0068]
(a3)抗t细胞抗原结合分子在制备药物组合物中的应用,其特征在于,通过和vegf抑制剂联合使用,预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放,且治疗癌症。
[0069]
(a3-1)根据(a3)所述的应用,其中在所述药物组合物的施用前、同时或施用后,施用所述vegf抑制剂。
[0070]
(a3-2)根据(a3)所述的应用,其中在所述药物组合物的施用前或同时,施用所述
vegf抑制剂。
[0071]
(a3-3)根据(a3)至(a3-2)中任一项所述的应用,其中在施用所述药物组合物的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用所述药物组合物前施用所述vegf抑制剂。
[0072]
(a3-4)根据(a3)至(a3-3)中任一项所述的应用,其中所述vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上vegf抑制剂。
[0073]
(a3-5)根据(a3)至(a3-4)中任一项所述的应用,其中所述vegf抑制剂为选自贝伐单抗(bevacizumab)、雷莫卢单抗(ramucirumab)和阿柏西普(aflibercept)中的1种以上vegf抑制剂。
[0074]
(a3-6)根据(a3)至(a3-5)中任一项所述的应用,其中所述药物组合物进一步附加地和免疫检查点抑制剂联合使用。
[0075]
(a3-7)根据(a3-6)所述的应用,其中所述免疫检查点抑制剂为选自抗pd1抗体、抗pd-l1抗体和抗pd-l2抗体中的免疫检查点抑制剂。
[0076]
(a3-8)根据(a3-6)或(a3-7)所述的应用,其中所述免疫检查点抑制剂为阿特珠单抗(atezolizumab)。
[0077]
(a3-9)根据(a3)至(a3-8)中任一项所述的应用,其中在所述药物组合物的施用前或同时,不施用皮质类固醇(corticosteroid)。
[0078]
(a3-10)根据(a3)至(a3-9)中任一项所述的应用,其中在所述药物组合物的施用前、同时或施用后,进一步施用皮质类固醇。
[0079]
(a3-11)根据(a3-9)或(a3-10)所述的应用,其中所述皮质类固醇为地塞米松(dexamethasone)、其药学上可接受的盐、或其衍生物。
[0080]
(a3-12)根据(a3)至(a3-11)中任一项所述的应用,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗原结合分子:
[0081]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(2)包含具有癌抗原结合活性的抗体可变区的结构域。
[0082]
(a3-13)根据(a3)至(a3-12)中任一项所述的应用,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:
[0083]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、
[0084]
(2)包含具有磷脂酰肌醇蛋白聚糖3(glypican 3)结合活性的抗体可变区的结构域、及
[0085]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0086]
(a3-14)根据(a3)至(a3-13)中任一项所述的应用,其中所述细胞因子释放综合征和/或细胞因子释放为伴随所述抗t细胞抗原结合分子的施用的细胞因子释放综合征和/或细胞因子释放。
[0087]
(a3-15)根据(a3)至(a3-14)中任一项所述的应用,其中所述细胞因子释放综合征是从非肿瘤组织和肿瘤组织中的任一者或两者的细胞因子释放所引起的。
[0088]
(a4)抗t细胞抗原结合分子在和vegf抑制剂的联合疗法中的应用,其中所述联合疗法为用于预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放、且治疗癌
症的联合疗法。
[0089]
(a4-1)根据(a4)所述的应用,其中在所述联合疗法中,在所述抗t细胞抗原结合分子的施用前、同时或施用后,施用所述vegf抑制剂。
[0090]
(a4-2)根据(a4)所述的应用,其中在所述联合疗法中,在所述抗t细胞抗原结合分子的施用前或同时,施用所述vegf抑制剂。
[0091]
(a4-3)根据(a4)至(a4-2)中任一项所述的应用,其中在所述联合疗法中,在施用所述抗t细胞抗原结合分子的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用所述抗t细胞抗原结合分子前施用所述vegf抑制剂。
[0092]
(a4-4)根据(a4)至(a4-3)中任一项所述的应用,其中所述vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上vegf抑制剂。
[0093]
(a4-5)根据(a4)至(a4-4)中任一项所述的应用,其中所述vegf抑制剂为选自贝伐单抗(bevacizumab)、雷莫卢单抗(ramucirumab)和阿柏西普(aflibercept)中的1种以上vegf抑制剂。
[0094]
(a4-6)根据(a4)至(a4-5)中任一项所述的应用,其中所述联合疗法进一步附加地施用免疫检查点抑制剂。
[0095]
(a4-7)根据(a4-6)所述的应用,其中所述免疫检查点抑制剂为选自抗pd1抗体、抗pd-l1抗体和抗pd-l2抗体中的免疫检查点抑制剂。
[0096]
(a4-8)根据(a4-6)或(a4-7)所述的应用,其中所述免疫检查点抑制剂为阿特珠单抗(atezolizumab)。
[0097]
(a4-9)根据(a4)至(a4-8)中任一项所述的应用,其中在所述联合疗法中,在所述抗t细胞抗原结合分子的施用前或同时,不施用皮质类固醇(corticosteroid)。
[0098]
(a4-10)根据(a4)至(a4-8)中任一项所述的应用,其中在所述联合疗法中,在所述抗t细胞抗原结合分子的施用前、同时或施用后,进一步施用皮质类固醇。
[0099]
(a4-11)根据(a4-9)或(a4-10)所述的应用,其中所述皮质类固醇为地塞米松(dexamethasone)、其药学上可接受的盐、或其衍生物。
[0100]
(a4-12)根据(a4)至(a4-11)中任一项所述的应用,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗原结合分子:
[0101]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(2)包含具有癌抗原结合活性的抗体可变区的结构域。
[0102]
(a4-13)根据(a4)至(a4-12)中任一项所述的应用,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:
[0103]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、
[0104]
(2)包含具有磷脂酰肌醇蛋白聚糖3(glypican 3)结合活性的抗体可变区的结构域、及
[0105]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0106]
(a4-14)根据(a4)至(a4-13)中任一项所述的应用,其中所述细胞因子释放综合征和/或细胞因子释放为伴随所述抗t细胞抗原结合分子的施用的细胞因子释放综合征和/或细胞因子释放。
[0107]
(a4-15)根据(a4)至(a4-14)中任一项所述的应用,其中所述细胞因子释放综合征是从非肿瘤组织和肿瘤组织中的任一者或两者的细胞因子释放所引起的。
[0108]
或者,在非限定性的一个实施方案中,本公开涉及以下:
[0109]
(a5)
[0110]
方法,其包括和vegf抑制剂联合使用,通过向对象施用抗t细胞抗原结合分子,预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放,且治疗癌症。
[0111]
(a5-1)根据(a5)所述的方法,其中在所述抗t细胞抗原结合分子的施用前、同时或施用后,施用所述vegf抑制剂。
[0112]
(a5-2)根据(a5)所述的方法,其中在所述抗t细胞抗原结合分子的施用前或同时,施用所述vegf抑制剂。
[0113]
(a5-3)根据(a5)至(a5-2)中任一项所述的方法,其中在施用所述抗t细胞抗原结合分子的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用所述抗t细胞抗原结合分子前施用所述vegf抑制剂。
[0114]
(a5-4)根据(a5)至(a5-3)中任一项所述的方法,其中所述vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上vegf抑制剂。
[0115]
(a5-5)根据(a5)至(a5-4)中任一项所述的方法,其中所述vegf抑制剂为选自贝伐单抗(bevacizumab)、雷莫卢单抗(ramucirumab)和阿柏西普(aflibercept)中的1种以上vegf抑制剂。
[0116]
(a5-6)根据(a5)至(a5-5)中任一项所述的方法,其包括进一步和免疫检查点抑制剂联合使用。
[0117]
(a5-7)根据(a5-6)所述的方法,其中所述免疫检查点抑制剂为选自抗pd1抗体、抗pd-l1抗体和抗pd-l2抗体中的免疫检查点抑制剂。
[0118]
(a5-8)根据(a5-6)或(a5-7)所述的方法,其中所述免疫检查点抑制剂为阿特珠单抗(atezolizumab)。
[0119]
(a5-9)根据(a5)至(a5-8)中任一项所述的方法,其中在所述抗t细胞抗原结合分子的施用前或同时,不施用皮质类固醇(corticosteroid)。
[0120]
(a5-10)根据(a5)至(a5-8)中任一项所述的方法,其中在所述抗t细胞抗原结合分子的施用前、同时或施用后,进一步施用皮质类固醇。
[0121]
(a5-11)根据(a5-9)或(a5-10)所述的方法,其中所述皮质类固醇为地塞米松(dexamethasone)、其药学上可接受的盐、或其衍生物。
[0122]
(a5-12)根据(a5)至(a5-11)中任一项所述的方法,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗原结合分子:
[0123]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(2)包含具有癌抗原结合活性的抗体可变区的结构域。
[0124]
(a5-13)根据(a5)至(a5-12)中任一项所述的方法,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:
[0125]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、
[0126]
(2)包含具有磷脂酰肌醇蛋白聚糖3(glypican 3)结合活性的抗体可变区的结构
域、及
[0127]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0128]
(a5-14)根据(a5)至(a5-13)中任一项所述的方法,其中所述细胞因子释放综合征和/或细胞因子释放为伴随所述抗t细胞抗原结合分子的施用的细胞因子释放综合征和/或细胞因子释放。
[0129]
(a5-15)根据(a5)至(a5-14)中任一项所述的方法,其中所述细胞因子释放综合征是从非肿瘤组织和肿瘤组织中的任一者或两者的细胞因子释放所引起的。
[0130]
或者,本公开包括以下实施方案:
[0131]
(b1)用于预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放的药物组合物,其包含vegf抑制剂。
[0132]
(b1-1)根据(b1)所述的药物组合物,其中所述vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上vegf抑制剂。
[0133]
(b1-2)根据(b1)或(b1-1)所述的药物组合物,其中所述vegf抑制剂选自由贝伐单抗(bevacizumab)、雷莫卢单抗(ramucirumab)和阿柏西普(aflibercept)组成的组。
[0134]
(b1-3)根据(b1)至(b1-2)中任一项所述的药物组合物,其中所述药物组合物为用于和免疫检查点抑制剂联合使用的药物组合物。
[0135]
(b1-4)根据(b1-3)所述的药物组合物,其中所述免疫检查点抑制剂为选自抗pd1抗体、抗pd-l1抗体和抗pd-l2抗体中的免疫检查点抑制剂。
[0136]
(b1-5)根据(b1-3)或(b1-4)所述的药物组合物,其中所述免疫检查点抑制剂为阿特珠单抗(atezolizumab)。
[0137]
(b1-6)根据(b1)至(b1-5)中任一项所述的药物组合物,其用于和抗t细胞抗原结合分子的联合疗法中使用。
[0138]
(b1-7)根据(b1-6)所述的药物组合物,其用于在所述抗t细胞抗原结合分子的施用前、同时或施用后施用。
[0139]
(b1-8)根据(b1-6)所述的药物组合物,其用于在所述抗t细胞抗原结合分子的施用前或同时施用。
[0140]
(b1-9)根据(b1-6)至(b1-8)中任一项所述的药物组合物,其用于在施用所述抗t细胞抗原结合分子的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用所述抗t细胞抗原结合分子前施用。
[0141]
(b1-10)根据(b1-6)至(b1-9)中任一项所述的药物组合物,其中在所述抗t细胞抗原结合分子的施用前或同时,不施用皮质类固醇(corticosteroid)。
[0142]
(b1-11)根据(b1-6)至(b1-9)中任一项所述的药物组合物,其中在所述抗t细胞抗原结合分子的施用前、同时或施用后,进一步施用皮质类固醇。
[0143]
(b1-12)根据(b1-10)或(b1-11)所述的药物组合物,其中所述皮质类固醇为地塞米松(dexamethasone)、其药学上可接受的盐、或其衍生物。
[0144]
(b1-13)根据(b1-6)至(b1-12)中任一项所述的药物组合物,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗原结合分子:
[0145]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(2)包含具有
癌抗原结合活性的抗体可变区的结构域。
[0146]
(b1-14)根据(b1-6)至(b1-13)中任一项所述的药物组合物,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:
[0147]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、
[0148]
(2)包含具有磷脂酰肌醇蛋白聚糖3(glypican 3)结合活性的抗体可变区的结构域、及
[0149]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0150]
(b1-15)根据(b1-6)至(b1-14)中任一项所述的药物组合物,其中所述药物组合物和所述抗t细胞抗原结合分子的联合使用为用于预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放、且治疗癌症的联合使用。
[0151]
(b1-16)根据(b1-6)至(b1-15)中任一项所述的药物组合物,其中所述细胞因子释放综合征和/或细胞因子释放为伴随所述抗t细胞抗原结合分子的施用的细胞因子释放综合征和/或细胞因子释放。
[0152]
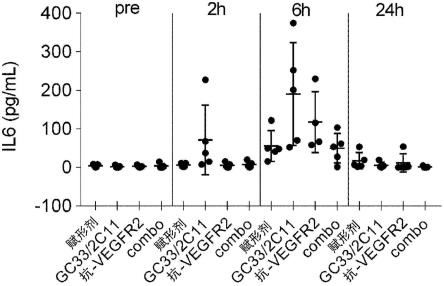
(b1-17)根据(b1)至(b1-16)中任一项所述的药物组合物,其中所述细胞因子释放综合征是从非肿瘤组织和肿瘤组织中的任一者或两者的细胞因子释放所引起的。
[0153]
或者,在非限定性的一个实施方案中,本公开涉及以下:
[0154]
(b2)试剂盒,其包含:(i)容器;(ii)该容器内的药物组合物,其包含vegf抑制剂;及(iii)文件,其指示为了预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放,施用该药物组合物。
[0155]
(b2-1)根据(b2)所述的试剂盒,其中所述vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上细胞因子抑制剂。
[0156]
(b2-2)根据(b2)或(b2-1)所述的试剂盒,其中所述vegf抑制剂为选自贝伐单抗(bevacizumab)、雷莫卢单抗(ramucirumab)和阿柏西普(aflibercept)中的1种以上vegf抑制剂。
[0157]
(b2-3)根据(b2)至(b2-2)中任一项所述的试剂盒,其进一步包含文件,所述文件指示所述药物组合物和免疫检查点抑制剂联合使用。
[0158]
(b2-4)根据(b2-3)所述的试剂盒,其中所述免疫检查点抑制剂为选自抗pd1抗体、抗pd-l1抗体和抗pd-l2抗体中的免疫检查点抑制剂。
[0159]
(b2-5)根据(b2-3)或(b2-4)所述的药物组合物,其中所述免疫检查点抑制剂为阿特珠单抗(atezolizumab)。
[0160]
(b2-6)根据(b2)至(b2-5)中任一项所述的试剂盒,其进一步包含文件,所述文件指示所述药物组合物和抗t细胞抗原结合分子联合使用。
[0161]
(b2-7)根据(b2-6)所述的试剂盒,其进一步包含文件,所述文件指示在所述抗t细胞抗原结合分子的施用前、同时或施用后,施用所述药物组合物。
[0162]
(b2-8)根据(b2-6)所述的试剂盒,其进一步包含文件,所述文件指示在所述抗t细胞抗原结合分子的施用前或同时,施用所述药物组合物。
[0163]
(b2-9)根据(b2-6)至(b2-8)中任一项所述的试剂盒,其进一步包含文件,所述文件指示在施用所述抗t细胞抗原结合分子的6天前、5天前、4天前、3天前、2天前、1天前或当
天,在施用所述抗t细胞抗原结合分子前施用所述药物组合物。
[0164]
(b2-10)根据(b2-6)至(b2-9)中任一项所述的试剂盒,其进一步包含文件,所述文件指示在所述抗t细胞抗原结合分子的施用前或同时,不施用皮质类固醇(corticosteroid)。
[0165]
(b2-11)根据(b2-6)至(b2-9)中任一项所述的试剂盒,其进一步包含文件,所述文件指示在所述抗t细胞抗原结合分子的施用前、同时或施用后,进一步施用皮质类固醇。
[0166]
(b2-12)根据(b2-10)或(b2-11)所述的试剂盒,其中所述皮质类固醇为地塞米松(dexamethasone)、其药学上可接受的盐、或其衍生物。
[0167]
(b2-13)根据(b2-6)至(b2-12)中任一项所述的试剂盒,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗原结合分子:
[0168]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(2)包含具有癌抗原结合活性的抗体可变区的结构域。
[0169]
(b2-14)根据(b2-6)至(b2-13)中任一项所述的试剂盒,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:
[0170]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、
[0171]
(2)包含具有磷脂酰肌醇蛋白聚糖3(glypican 3)结合活性的抗体可变区的结构域、及
[0172]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0173]
(b2-15)根据(b2-6)至(b2-14)中任一项所述的试剂盒,其中所述药物组合物和所述抗t细胞抗原结合分子的联合使用为用于预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放、且治疗癌症的联合使用。
[0174]
(b2-16)根据(b2-6)至(b2-15)中任一项所述的试剂盒,其中所述细胞因子释放综合征和/或细胞因子释放为伴随所述抗t细胞抗原结合分子的施用的细胞因子释放综合征和/或细胞因子释放。
[0175]
(b2-17)根据(b2)至(b2-16)中任一项所述的试剂盒,其中所述细胞因子释放综合征是从非肿瘤组织和肿瘤组织中的任一者或两者的细胞因子释放所引起的。
[0176]
(b2-18)根据(b2)至(b2-17)中任一项所述的试剂盒,其中所述药物组合物的处方按照所述文件的指示实行。
[0177]
(b3)vegf抑制剂在制备药物组合物中的应用,所述药物组合物用于预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放。
[0178]
(b3-1)根据(b3)所述的应用,其中所述vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上细胞因子抑制剂。
[0179]
(b3-2)根据(b3)或(b3-1)所述的应用,其中所述vegf抑制剂为选自贝伐单抗(bevacizumab)、雷莫卢单抗(ramucirumab)和阿柏西普(aflibercept)中的1种以上vegf抑制剂。
[0180]
(b3-3)根据(b3)至(b3-2)中任一项所述的应用,其中所述药物组合物为和免疫检查点抑制剂联合使用的药物组合物。
[0181]
(b3-4)根据(b3-3)所述的应用,其中所述免疫检查点抑制剂为选自抗pd1抗体、抗
pd-l1抗体和抗pd-l2抗体中的免疫检查点抑制剂。
[0182]
(b3-5)根据(b3-3)或(b3-4)所述的应用,其中所述免疫检查点抑制剂为阿特珠单抗(atezolizumab)。
[0183]
(b3-6)根据(b3)至(b3-5)中任一项所述的应用,其中所述药物组合物为用于和抗t细胞抗原结合分子的联合疗法的药物组合物。
[0184]
(b3-7)根据(b3-6)所述的应用,其中在所述抗t细胞抗原结合分子的施用前、同时或施用后,施用所述药物组合物。
[0185]
(b3-8)根据(b3-6)所述的应用,其中在所述抗t细胞抗原结合分子的施用前或同时,施用所述药物组合物。
[0186]
(b3-9)根据(b3-6)至(b3-8)中任一项所述的应用,其中在施用所述抗t细胞抗原结合分子的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用所述抗t细胞抗原结合分子前施用所述药物组合物。
[0187]
(b3-10)根据(b3-6)至(b3-9)中任一项所述的应用,其中在所述抗t细胞抗原结合分子的施用前或同时,不施用皮质类固醇(corticosteroid)。
[0188]
(b3-11)根据(b3-6)至(b3-9)中任一项所述的应用,其中在所述抗t细胞抗原结合分子的施用前、同时或施用后,进一步施用皮质类固醇。
[0189]
(b3-12)根据(b3-10)或(b3-11)所述的应用,其中所述皮质类固醇为地塞米松(dexamethasone)、其药学上可接受的盐、或其衍生物。
[0190]
(b3-13)根据(b3-6)至(b3-12)中任一项所述的应用,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗原结合分子:
[0191]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(2)包含具有癌抗原结合活性的抗体可变区的结构域。
[0192]
(b3-14)根据(b3-6)至(b3-13)中任一项所述的应用,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:
[0193]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、
[0194]
(2)包含具有磷脂酰肌醇蛋白聚糖3(glypican 3)结合活性的抗体可变区的结构域、及
[0195]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0196]
(b3-15)根据(b3-6)至(b3-14)中任一项所述的应用,其中所述药物组合物和所述抗t细胞抗原结合分子的联合疗法为用于预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放、且治疗癌症的联合疗法。
[0197]
(b3-16)根据(b3-6)至(b3-15)中任一项所述的应用,其中所述细胞因子释放综合征和/或细胞因子释放为伴随所述抗t细胞抗原结合分子的施用的细胞因子释放综合征和/或细胞因子释放。
[0198]
(b3-17)根据(b3)至(b3-16)中任一项所述的应用,其中所述细胞因子释放综合征是从非肿瘤组织和肿瘤组织中的任一者或两者的细胞因子释放所引起的。
[0199]
(b4)vegf抑制剂在预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放中的应用。
[0200]
(b4-1)根据(b4)所述的应用,其中所述vegf抑制剂为选自抗vegf抗原结合分子、
抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上vegf抑制剂。
[0201]
(b4-2)根据(b4)或(b4-1)所述的应用,其中所述vegf抑制剂为选自贝伐单抗(bevacizumab)、雷莫卢单抗(ramucirumab)和阿柏西普(aflibercept)中的1种以上vegf抑制剂。
[0202]
(b4-3)根据(b4)至(b4-2)中任一项所述的应用,其中所述vegf抑制剂和免疫检查点抑制剂联合使用。
[0203]
(b4-4)根据(b4-3)所述的应用,其中所述免疫检查点抑制剂为选自抗pd1抗体、抗pd-l1抗体和抗pd-l2抗体中的免疫检查点抑制剂。
[0204]
(b4-5)根据(b4-3)或(b4-4)所述的应用,其中所述免疫检查点抑制剂为阿特珠单抗(atezolizumab)。
[0205]
(b4-6)根据(b4)至(b4-5)中任一项所述的应用,其中所述vegf抑制剂和抗t细胞抗原结合分子联合使用。
[0206]
(b4-7)根据(b4-6)所述的应用,其中在所述抗t细胞抗原结合分子的施用前、同时或施用后,施用所述vegf抑制剂。
[0207]
(b4-8)根据(b4-6)所述的应用,其中在所述抗t细胞抗原结合分子的施用前或同时,施用所述vegf抑制剂。
[0208]
(b4-9)根据(b4-6)至(b4-8)中任一项所述的应用,其中在施用所述抗t细胞抗原结合分子的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用所述抗t细胞抗原结合分子前施用所述vegf抑制剂。
[0209]
(b4-10)根据(b4-6)至(b4-9)中任一项所述的应用,其中在所述抗t细胞抗原结合分子的施用前或同时,不施用皮质类固醇(corticosteroid)。
[0210]
(b4-11)根据(b4-6)至(b4-9)中任一项所述的应用,其中在所述抗t细胞抗原结合分子的施用前、同时或施用后,进一步施用皮质类固醇。
[0211]
(b4-12)根据(b4-10)或(b4-11)所述的应用,其中所述皮质类固醇为地塞米松(dexamethasone)、其药学上可接受的盐、或其衍生物。
[0212]
(b4-13)根据(b4-6)至(b4-12)中任一项所述的应用,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗原结合分子:
[0213]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(2)包含具有癌抗原结合活性的抗体可变区的结构域。
[0214]
(b4-14)根据(b4-6)至(b4-13)中任一项所述的应用,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:
[0215]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、
[0216]
(2)包含具有磷脂酰肌醇蛋白聚糖3(glypican 3)结合活性的抗体可变区的结构域、及
[0217]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0218]
(b4-15)根据(b4-6)至(b4-14)中任一项所述的应用,其中所述vegf抑制剂和所述抗t细胞抗原结合分子的联合使用为用于预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放、且治疗癌症的联合使用。
[0219]
(b4-16)根据(b4-6)至(b4-15)中任一项所述的应用,其中所述细胞因子释放综合征和/或细胞因子释放为伴随所述抗t细胞抗原结合分子的施用的细胞因子释放综合征和/或细胞因子释放。
[0220]
(b4-17)根据(b4)至(b4-16)中任一项所述的应用,其中所述细胞因子释放综合征是从非肿瘤组织和肿瘤组织中的任一者或两者的细胞因子释放所引起的。
[0221]
或者,在非限定性的一个实施方案中,本公开涉及以下:
[0222]
(b5)用于预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放的方法,其包括向对象施用vegf抑制剂。
[0223]
(b5-1)根据(b5)所述的方法,其中所述vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上vegf抑制剂。
[0224]
(b5-2)根据(b5)或(b5-1)所述的方法,其中所述vegf抑制剂为选自贝伐单抗(bevacizumab)、雷莫卢单抗(ramucirumab)和阿柏西普(aflibercept)中的1种以上vegf抑制剂。
[0225]
(b5-3)根据(b5)至(b5-2)中任一项所述的方法,其中所述细胞因子释放综合征和/或细胞因子释放为伴随抗t细胞抗原结合分子的施用的细胞因子释放综合征和/或细胞因子释放。
[0226]
(b5-4)根据(b5-3)所述的方法,其中在所述抗t细胞抗原结合分子的施用前、同时或施用后,向对象施用所述vegf抑制剂。
[0227]
(b5-5)根据(b5-3)所述的方法,其中在所述抗t细胞抗原结合分子的施用前或同时,向对象施用所述vegf抑制剂。
[0228]
(b5-6)根据(b5-3)至(b5-5)中任一项所述的方法,其中在施用所述抗t细胞抗原结合分子的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用所述抗t细胞抗原结合分子前向对象施用所述vegf抑制剂。
[0229]
(b5-7)根据(b5-3)至(b5-6)中任一项所述的方法,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗原结合分子:
[0230]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(2)包含具有癌抗原结合活性的抗体可变区的结构域。
[0231]
(b5-8)根据(b5-3)至(b5-7)中任一项所述的方法,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:
[0232]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、
[0233]
(2)包含具有磷脂酰肌醇蛋白聚糖3(glypican 3)结合活性的抗体可变区的结构域、及
[0234]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0235]
(b5-9)根据(b5)至(b5-8)中任一项所述的方法,其用于预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放,且治疗癌症。
[0236]
(b5-10)根据(b5-9)所述的方法,其中所述细胞因子释放综合征是从非肿瘤组织和肿瘤组织中的任一者或两者的细胞因子释放所引起的。
[0237]
或者,在非限定性的一个实施方案中,本公开涉及以下:
[0238]
(c1)
[0239]
方法,其包括向对象施用抗t细胞抗原结合分子和vegf抑制剂,预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放,且治疗癌症。
[0240]
(c1-1)
[0241]
用于预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放、且治疗癌症的联合疗法的方法,其包括向对象施用抗t细胞抗原结合分子的工序和施用vegf抑制剂的工序。
[0242]
(c1-2)根据(c1)或(c1-1)所述的方法,其中在所述抗t细胞抗原结合分子的施用前、同时或施用后,向对象施用所述vegf抑制剂。
[0243]
(c1-3)根据(c1)至(c1-2)中任一项所述的方法,其中在所述抗t细胞抗原结合分子的施用前或同时,向对象施用所述vegf抑制剂。
[0244]
(c1-4)根据(c1)至(c1-3)中任一项所述的方法,其中在施用所述抗t细胞抗原结合分子的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用所述抗t细胞抗原结合分子前向对象施用所述vegf抑制剂。
[0245]
(c1-5)根据(c1)至(c1-4)中任一项所述的方法,其中所述vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上vegf抑制剂。
[0246]
(c1-6)根据(c1)至(c1-5)中任一项所述的方法,其中所述vegf抑制剂为选自贝伐单抗(bevacizumab)、雷莫卢单抗(ramucirumab)和阿柏西普(aflibercept)中的1种以上vegf抑制剂。
[0247]
(c1-7)根据(c1)至(c1-6)中任一项所述的方法,其包括进一步向对象施用免疫检查点抑制剂。
[0248]
(c1-8)根据(c1-7)所述的方法,其中所述免疫检查点抑制剂为选自抗pd1抗体、抗pd-l1抗体和抗pd-l2抗体中的免疫检查点抑制剂。
[0249]
(c1-9)根据(c1-7)或(c1-8)所述的方法,其中所述免疫检查点抑制剂为阿特珠单抗(atezolizumab)。
[0250]
(c1-10)根据(c1)至(c1-9)中任一项所述的方法,其中在所述抗t细胞抗原结合分子的施用前或同时,向对象不施用皮质类固醇(corticosteroid)。
[0251]
(c1-11)根据(c1)至(c1-9)中任一项所述的方法,其包括在所述抗t细胞抗原结合分子的施用前、同时或施用后,进一步向对象施用皮质类固醇。
[0252]
(c1-12)根据(c1-10)或(c1-11)所述的方法,其中所述皮质类固醇为地塞米松(dexamethasone)、其药学上可接受的盐、或其衍生物。
[0253]
(c1-13)根据(c1)至(c1-12)中任一项所述的方法,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗原结合分子:
[0254]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(2)包含具有癌抗原结合活性的抗体可变区的结构域。
[0255]
(c1-14)根据(c1)至(c1-13)中任一项所述的方法,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:
[0256]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、
[0257]
(2)包含具有磷脂酰肌醇蛋白聚糖3(glypican 3)结合活性的抗体可变区的结构域、及
[0258]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0259]
(c1-15)根据(c1)至(c1-14)中任一项所述的方法,其中所述细胞因子释放综合征和/或细胞因子释放为伴随所述抗t细胞抗原结合分子的施用的细胞因子释放综合征和/或细胞因子释放。
[0260]
(c1-16)根据(c1)至(c1-15)中任一项所述的方法,其中所述细胞因子释放综合征是从非肿瘤组织和肿瘤组织中的任一者或两者的细胞因子释放所引起的。
[0261]
在非限定性的一个方面,本公开涉及本说明书所公开的各种实施方案的联合疗法,所述联合疗法包括施用抗t细胞抗原结合分子和vegf抑制剂;利用该联合疗法的癌症的治疗方法;及利用该联合疗法的用于选自由伴随抗t细胞抗原结合分子的施用的细胞因子释放综合征的预防、减轻及治疗组成的组的任一种或它们的组合的方法。
[0262]
或者,在非限定性的一个实施方案中,本公开涉及以下:
[0263]
(c2)
[0264]
组合疗法,其包含抗t细胞抗原结合分子和vegf抑制剂,预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放,且治疗癌症。
[0265]
(c2-1)根据(c2)所述的组合疗法,其中在所述抗t细胞抗原结合分子的施用前、同时或施用后,施用所述vegf抑制剂。
[0266]
(c2-2)根据(c2)或(c2-1)所述的组合疗法,其中在所述抗t细胞抗原结合分子的施用前或同时,施用所述vegf抑制剂。
[0267]
(c2-3)根据(c2)或(c2-1)所述的组合疗法,其中在施用所述抗t细胞抗原结合分子的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用所述抗t细胞抗原结合分子前施用所述vegf抑制剂。
[0268]
(c2-4)根据(c2)至(c2-3)中任一项所述的组合疗法,其中所述vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上细胞因子抑制剂。
[0269]
(c2-5)根据(c2)至(c2-4)中任一项所述的组合疗法,其中所述vegf抑制剂为选自贝伐单抗(bevacizumab)、雷莫卢单抗(ramucirumab)和阿柏西普(aflibercept)中的1种以上vegf抑制剂。
[0270]
(c2-6)根据(c2)至(c2-5)中任一项所述的组合疗法,其包括进一步和免疫检查点抑制剂联合使用。
[0271]
(c2-7)根据(c2-6)所述的组合疗法,其中所述免疫检查点抑制剂为选自抗pd1抗体、抗pd-l1抗体和抗pd-l2抗体中的免疫检查点抑制剂。
[0272]
(c2-8)根据(c2-6)或(c2-7)所述的组合疗法,其中所述免疫检查点抑制剂为阿特珠单抗(atezolizumab)。
[0273]
(c2-9)根据(c2)至(c2-8)中任一项所述的组合疗法,其中在所述抗t细胞抗原结合分子的施用前或同时,不施用皮质类固醇(corticosteroid)。
[0274]
(c2-10)根据(c2)至(c2-8)中任一项所述的组合疗法,其中在所述抗t细胞抗原结合分子的施用前、同时或施用后,进一步施用皮质类固醇。
[0275]
(c2-11)根据(c2-9)或(c2-10)所述的组合疗法,其中所述皮质类固醇为地塞米松(dexamethasone)、其药学上可接受的盐、或其衍生物。
[0276]
(c2-12)根据(c2)至(c2-11)中任一项所述的组合疗法,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗原结合分子:
[0277]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(2)包含具有癌抗原结合活性的抗体可变区的结构域。
[0278]
(c2-13)根据(c2)至(c2-12)中任一项所述的组合疗法,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:
[0279]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、
[0280]
(2)包含具有磷脂酰肌醇蛋白聚糖3(glypican 3)结合活性的抗体可变区的结构域、及
[0281]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0282]
(c2-14)根据(c2)至(c2-13)中任一项所述的组合疗法,其中所述细胞因子释放综合征和/或细胞因子释放为伴随所述抗t细胞抗原结合分子的施用的细胞因子释放综合征和/或细胞因子释放。
[0283]
(c2-15)根据(c2)至(c2-14)中任一项所述的组合疗法,其中所述细胞因子释放综合征是从非肿瘤组织和肿瘤组织中的任一者或两者的细胞因子释放所引起的。
[0284]
(c3)用于预防和/或减轻和/或治疗细胞因子释放综合征和/或细胞因子释放、且治疗癌症的药物组合物,其包含抗t细胞抗原结合分子和vegf抑制剂。
[0285]
(c3-1)根据(c3)所述的药物组合物,其中所述vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上细胞因子抑制剂。
[0286]
(c3-2)根据(c3)或(c3-1)所述的药物组合物,其中所述vegf抑制剂为选自贝伐单抗(bevacizumab)、雷莫卢单抗(ramucirumab)和阿柏西普(aflibercept)中的1种以上vegf抑制剂。
[0287]
(c3-3)根据(c3)至(c3-2)中任一项所述的药物组合物,其中进一步和免疫检查点抑制剂联合使用。
[0288]
(c3-4)根据(c3-3)所述的药物组合物,其中所述免疫检查点抑制剂为选自抗pd1抗体、抗pd-l1抗体和抗pd-l2抗体中的免疫检查点抑制剂。
[0289]
(c3-5)根据(c3-3)或(c3-4)所述的药物组合物,其中所述免疫检查点抑制剂为阿特珠单抗(atezolizumab)。
[0290]
(c3-6)根据(c3)至(c3-5)中任一项所述的药物组合物,其中在所述药物组合物的施用前或同时,不施用皮质类固醇(corticosteroid)。
[0291]
(c3-7)根据(c3)至(c3-5)中任一项所述的药物组合物,其中在所述药物组合物的施用前、同时或施用后,进一步施用皮质类固醇。
[0292]
(c3-8)根据(c3-6)或(c3-7)所述的药物组合物,其中所述皮质类固醇为地塞米松(dexamethasone)、其药学上可接受的盐、或其衍生物。
[0293]
(c3-9)根据(c3)至(c3-8)中任一项所述的药物组合物,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗原结合分子:
[0294]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(2)包含具有癌抗原结合活性的抗体可变区的结构域。
[0295]
(c3-10)根据(c3)至(c3-9)中任一项所述的药物组合物,其中所述抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:
[0296]
(1)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、
[0297]
(2)包含具有磷脂酰肌醇蛋白聚糖3(glypican 3)结合活性的抗体可变区的结构域、及
[0298]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0299]
(c3-11)根据(c3)至(c3-10)中任一项所述的药物组合物,其中所述细胞因子释放综合征和/或细胞因子释放为伴随所述抗t细胞抗原结合分子的施用的细胞因子释放综合征和/或细胞因子释放。
[0300]
(c3-12)根据(c3)至(c3-11)中任一项所述的药物组合物,其中所述细胞因子释放综合征是从非肿瘤组织和肿瘤组织中的任一者或两者的细胞因子释放所引起的。
[0301]
(c4)抗t细胞抗原结合分子和vegf抑制剂的组合。
[0302]
发明效果
[0303]
和cd3等t细胞抗原结合的抗t细胞抗原结合分子作为利用生物体所具备的t细胞的抗肿瘤作用的癌症的新治疗手段而受到关注。另一方面,也指出由于以产生细胞因子的t细胞为靶标,因此有可能因细胞因子产生而引起副作用(例如细胞因子释放综合征;crs)。因此担忧施用抗t细胞抗原结合分子会因细胞因子产生而导致预料之外的副作用。根据本公开,由于预先和vegf抑制剂组合施用抗t细胞抗原结合分子,因此能预防或减轻因细胞因子导致的预料之外的副作用。
[0304]
附图简单说明
[0305]
图1是显示联合使用抗小鼠vegfr2抗体(dc101)对ery974代用抗体(gc33/2c11)药效的影响的图。在图中,纵轴表示肿瘤体积(mm3),横轴表示以肿瘤移植当天设为0天的肿瘤移植后天数。
[0306]
图2-a是显示联合使用抗小鼠vegfr2抗体(dc101)对ery974代用抗体(gc33/2c11)导致的产生来自肿瘤的细胞因子(il-6)的影响的图。在图中,纵轴表示il-6的血浆中浓度(pg/ml),横轴表示向小鼠施用的成分,“combo”为两者的联合使用。图上部表示以有效成分施用时间设为0的施用后经过时间。
[0307]
图2-b是显示联合使用抗小鼠vegfr2抗体(dc101)对ery974代用抗体(gc33/2c11)导致的产生来自肿瘤的细胞因子(tnf)的影响的图。在图中,纵轴表示tnf的血浆中浓度(pg/ml),横轴表示向小鼠施用的成分,“combo”为两者的联合使用。图上部表示以有效成分施用时间设为0的施用后经过时间。
[0308]
图2-c是显示联合使用抗小鼠vegfr2抗体(dc101)对ery974代用抗体(gc33/2c11)导致的产生来自肿瘤的细胞因子(ifngamma)的影响的图。在图中,纵轴表示ifnγ的血浆中浓度(pg/ml),横轴表示向小鼠施用的成分,“combo”为两者的联合使用。图上部表示以有效成分施用时间设为0的施用后经过时间。
[0309]
图2-d是显示联合使用抗小鼠vegfr2抗体(dc101)对ery974代用抗体(gc33/2c11)导致的产生来自肿瘤的细胞因子(cxcl9)的影响的图。在图中,纵轴表示cxc配体9的血浆中
浓度(pg/ml),横轴表示向小鼠施用的成分,“combo”为两者的联合使用。图上部表示以有效成分施用时间设为0的施用后经过时间。
[0310]
图2-e是显示联合使用抗小鼠vegfr2抗体(dc101)对ery974代用抗体(gc33/2c11)导致的产生来自肿瘤的细胞因子(cxcl10)的影响的图。在图中,纵轴表示cxcl10的血浆中浓度(pg/ml),横轴表示向小鼠施用的成分,“combo”为两者的联合使用。图上部表示以有效成分施用时间设为0的施用后经过时间。
[0311]
图3是显示联合使用抗小鼠vegfr2抗体(dc101)对ery974代用抗体(gc33/2c11)导致的产生来自正常组织的细胞因子的影响的图。在图中,纵轴表示施用后2小时后的il-6(左上)、tnfα(右上)、ifnγ(左中)、il-2(右中)、cxcl9(左下)及cxcl10(右下)的血浆中浓度(pg/ml),并且横轴表示施用的有效成分。
[0312]
图4是显示轻链可变区序列和kabat等的各种编号的图。
[0313]
发明的具体实施方式
[0314]
以下定义是为了易于理解本说明书中说明的本发明而提供。
[0315]
特异地
[0316]“特异地”是指特异性地结合的分子中的一个分子对其一个或多个结合的对象方的分子以外的分子不显示任何显著的结合的状态。另外,也可用于包含抗体可变区的结构域对于某抗原中所包含的多种表位中的特定表位具有特异性的情况。另外,当包含抗体可变区的结构域所结合的表位包含于多个不同抗原时,具有该包含抗体可变区的结构域的抗原结合分子能够和包含该表位的各种抗原结合。
[0317]
结合活性(binding activity)
[0318]
术语“结合活性(binding activity)”是指分子(例如抗体)的1个或1个以上的结合位点和分子的结合伴侣(例如抗原)之间的非共价键合性的相互作用的合计强度。此处,“结合活性(binding activity)”并不严格地限定于某结合配对的成员(例如抗体和抗原)之间的1∶1相互作用。例如,在反映结合配对的成员以1价进行1∶1相互作用时,将该结合活性特别地称为固有的结合亲和性(“亲和性(affinity)”)。在结合配对的成员能够以1价进行结合和以多价进行结合这两种情况时,结合活性为这些结合力的总和。分子x对于其伴侣y的结合活性通常能够以解离常数(kd)或“每单位配体量的分析物结合量”(以下有时称为“结合量”)表示。通常,本领域技术人员应理解,解离常数(kd)的数值越低,结合活性越高,“每单位配体量的分析物结合量”或“结合量”的数值越高,结合活性越高。结合活性能够以包含本说明书所记载的、该技术领域中已知的一般方法测定。下文中说明用于测定结合活性(包含亲和性)的具体实例和例示性实施方案。下文中说明用于测定结合亲和性的具体实例和例示性实施方案。
[0319]
抗
‘
靶抗原’结合抗原结合分子
[0320]
术语“抗
‘
靶抗原’结合抗原结合分子”(此处,
‘
靶抗原’只要为能够靶标化的抗原蛋白质即可,例如包含t细胞抗原、癌抗原、细胞因子和细胞因子受体)或“和靶抗原结合的抗原结合分子”是指如下抗原结合分子,其能够以充分的亲和性和靶抗原结合,其结果为,该抗原结合分子在将该抗原靶标化时可用作诊断剂和/或治疗剂。在一个实施方案中,测定抗原结合分子对无关系的非靶抗原蛋白质的结合程度(例如利用放射免疫测定法(radioimmunoassay,ria))时,小于抗原结合分子对靶抗原的结合的约10%。在特定实施方
案中,和靶抗原结合的抗原结合分子具有≤1μm、≤100nm、≤10nm、≤1nm、≤0.1nm、≤0.01nm、或≤0.001nm(例如10-8
m以下、例如10-8
m~10-13
m、例如10-9
m~10-13
m)的解离常数(kd)。在特定实施方案中,抗原结合分子和在来自不同种类的靶抗原间保守的靶抗原的表位结合。
[0321]
与参照抗原结合分子“结合相同的表位”的抗原结分子
[0322]
与参照抗原结合分子“结合相同的表位”的抗原结分子是指在竞争分析中,阻止50%以上的该参照抗原结合分子对自身抗原进行的结合的抗原结合分子,另外,反过来说,参照抗原结合分子在竞争分析中,阻止50%以上的上述抗原结合分子对自身抗原进行的结合。本说明书中提供例示性竞争分析。
[0323]
在例示性竞争分析中,被固定的抗原(例如gpc3、cd3和/或vegf)在如下溶液中进行培养,该溶液包含:和该抗原结合的进行第1标记后的抗原结合分子;及关于对该抗原的结合,关于和第1抗原结合分子竞争的能力进行试验的第2未标记的抗原结合分子。第2抗原结合分子可存在于杂交瘤上清液。作为对照,被固定的该抗原在如下溶液中进行培养,该溶液包含进行第1标记后的抗原结合分子,但不含第2未标记的抗原结合分子。在允许第1抗原结合分子对该抗原结合的条件下培养后,除去多余的未结合的抗原结合分子,并测定和被固定的该抗原结合的标记量。和被固定的该抗原结合的标记量相较于对照样品在试验样品中实质减少时,显示第2抗原结合分子关于对该抗原的结合和第1抗原结合分子进行竞争。可参照harlow and lane(1988)antibodies:a laboratory manual ch.14(cold spring harbor laboratory,cold spring harbor,ny)。
[0324]
抗原结合分子
[0325]
本说明书中,术语“抗原结合分子”可最广义地使用,只要能显示所期望的抗原结合活性,则包括但不限于如下各种抗体结构,该各种抗体结构包含单克隆抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)、抗体衍生物和抗体片段。
[0326]
在特定实施方案中,本说明书中提供的抗体能够以包含该技术领域中已知且能够容易地获得的追加的非蛋白质部分的方式进一步修饰(将其称为“抗体衍生物”)。适合抗体的衍生物化的部分包含但不限于水溶性聚合物。水溶性聚合物的非限定例包括但不限定于聚乙二醇(peg)、乙二醇/丙二醇的共聚物、羧甲基纤维素、葡聚糖(dextran)、聚乙烯醇、聚乙烯基吡咯烷酮、聚-1,3-二噁烷、聚-1,3,6-三噁烷、乙烯/马来酸酐共聚物、聚氨基酸(均聚物或无规共聚物中的任一种)、及葡聚糖或聚(n-乙烯基吡咯烷酮)聚乙二醇、聚丙二醇均聚物、聚环氧丙烷/环氧乙烷共聚物、聚氧乙烯化多元醇类(例如甘油)、聚乙烯醇、及它们的混合物。聚乙二醇丙醛因其在水中的稳定性而有利于制备。聚合物可以具有任意分子量,可以具有分支也可不具有分支。附加在抗体上的聚合物的数量也可变化,如果附加1个以上聚合物,它们可以是相同的分子,也可以是不同的分子。通常,用于衍生物化的聚合物的数量和/或类型不限于这些,可基于对应改良的抗体的特定特性或功能、抗体衍生物是否用于规定条件下的疗法等的考量而确定。
[0327]
抗体片段
[0328]“抗体片段”是指包含和完全抗体所结合的抗原结合的该完全抗体的一部分的该完全抗体以外的分子。抗体片段的例子包括但不限定于fv、fab、fab
′
、fab
′‑
sh、f(ab
′
)2;双链抗体;线性抗体;单链抗体分子(例如scfv);及由抗体片段形成的多特异性抗体。
[0329]
参照抗体与和相同的表位结合的抗体
[0330]
参照抗体与“和相同的表位结合的抗体”是指在竞争分析中,阻止50%以上的该参照抗体对自身抗原进行的结合的抗体,另外,反过来说,参照抗体在竞争分析中阻止50%以上的上述抗体对自身抗原进行的结合。本说明书中提供例示性竞争分析。
[0331]
嵌合抗体
[0332]
术语“嵌合”抗体是指重链和/或轻链的一部分来自特定的供给源或物种,另一方面,重链和/或轻链的剩余部分来自不同的供给源或物种的抗体。
[0333]
抗体的型
[0334]
抗体的“型”是指抗体的重链所具备的恒定域或恒定区的类型。抗体有5个主要型:iga、igd、ige、igg和igm。并且,其中一些可进一步分为亚型(同型)。例如有igg1、igg2、igg3、igg4、iga1和iga2。分别将对应于不同型的免疫球蛋白的重链恒定域称为α、δ、ε、γ和μ。
[0335]
igg1、igg2、igg3、igg4的各同型的恒定区分别称为cγ1、cγ2、cγ3、cγ4。构成人cγ1、cγ2、cγ3、cγ4的fc区的多肽的氨基酸序列以序列编号:23、24、25、26例示。构成各氨基酸序列的氨基酸残基和kabat的eu编号(本说明书中也称为eu索引)的关系示于图1中。
[0336]
fc区
[0337]
本说明书中,术语“fc区”用来定义至少包含恒定区的一部分的免疫球蛋白重链的c末端区。该术语包含天然型序列的fc区和突变体fc区。在一个实施方案中,人igg重链fc区从cys226或pro230延伸到重链的羧基末端。其中,fc区的c末端的赖氨酸(lys447)或甘氨酸-赖氨酸(gly446-lys447)可存在也可不存在。本说明书中只要没有特别规定,则fc区或恒定区中的氨基酸残基的编号依据kabat et al.,sequences of proteins of immunological interest,5th ed.public health service,national institutes of health,bethesda,md 1991所记载的eu编号系统(也称为eu索引)。
[0338]
fc受体
[0339]“fc受体”或“fcr”是指和抗体的fc区结合的受体。在一些实施方案中,fcr为天然型人fcr。在一些实施方案中,fcr是和igg抗体结合的受体(γ受体),包含fcγri、fcγrii和fcγriii亚型的受体,且包含这些受体的等位基因突变体和选择性剪接的实施方案在内。fcγrii受体包含fcγriia(“激活性受体”)和fcγriib(“抑制性受体”),这些主要在其细胞质域中具有不同的类似的氨基酸序列。激活性受体fcγriia在其细胞质域中包含免疫受体酪氨酸激活基序(immunoreceptor tyrosine-based activation motif,itam)。抑制性受体fcγriib在其细胞质域中包含免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibition motif,itim)(例如参照daeron,annu.rev.immunol.15:203-234(1997))。fcr例如在ravetch and kinet,annu.rev.immunol 9:457-92(1991);capel et al.,immunomethods 4:25-34(1994);及de haas et al.,j.lab.clin.med 126:330-41(1995)中综述。包含将来鉴定的fcr在内的其他fcr也包含在本说明书的术语“fcr”中。
[0340]
术语“fc受体”或“fcr”还包含新生儿型受体fcrn,其负责母体的igg向胎儿的移动(guyer et al.,j.immunol.117:587(1976)和kim et al.,j.immunol.24:249(1994))以及免疫球蛋白的稳态调节。测定对fcrn的结合的方法众所周知(例如参照ghetie and ward.,immunol.today 18(12):592-598(1997);ghetie et al.,nature biotechnology,15(7):
637-640(1997);hinton et al.,j.biol.chem.279(8):6213-6216(2004);wo2004/92219(hinton et al.))。
[0341]
在体内的对人fcrn的结合和人fcrn高亲和性结合多肽的血浆减半期例如能够在表达人fcrn的基因转殖小鼠或者经转染的人细胞株中、或者在被施用伴有变异fc区的多肽的灵长类中进行测定。wo2000/42072(presta)记载有对于fcr的结合增加或减少后的抗体突变体。例如也可参照shields et al.j.biol.chem.9(2):6591-6604(2001)。
[0342]
含fc区的抗体
[0343]
术语“含fc区的抗体”是指包含fc区的抗体。fc区的c末端赖氨酸(依据eu编号系统为残基447)或fc区的c末端甘氨酸-赖氨酸(残基446-447)例如能够在抗体的纯化期间除去或利用编码抗体的核酸的重组操作除去。因此,根据本发明包含具有fc区的抗体的组合物可包含带有g446-k447的抗体、带有g446且不带有k447的抗体、完全除去g446-k447后的抗体、或上述3种抗体的混合物。
[0344]
对于fc受体的结合活性下降的fc区包含对于fcγi、fcγiia、fcγiib、fcγiiia和/或fcγiiib中任一种fcγ受体的结合活性下降的fc区。对fcγi、fcγiia、fcγiib、fcγiiia和/或fcγiiib中任一种fcγ受体的结合活性下降,除了本领域技术人员所公知的facs或elisa模式以外,还能够利用biacore法等加以确认(proc.natl.acad.sci.usa(2006)103(11),4005-4010),该biacore法利用了alpha筛选(amplified luminescent proximity homogeneous assay)或表面等离子体共振(spr)现象。
[0345]
包含对于fc受体的结合活性下降的fc区的抗原结合分子或抗体包含伴有减少的效应功能的抗原结合分子或抗体。伴有减少的效应功能的抗原结合分子或抗体包含伴有fc区残基238、265、269、270、297、327和329的1个或多个取代的抗原结合分子或抗体(美国专利第6,737,056号)。此类fc突变体含有包含伴有对残基265和297的丙氨酸的取代的所谓的“dana”fc突变体(美国专利第7,332,581号)在内的、伴有氨基酸位置265、269、270、297和327中的2个以上位置的取代的fc突变体。
[0346]
具有对fcrs的增加或减少的结合性的特定的抗体突变体已有记述。(参照美国专利第6,737,056号;wo2004/056312和shields et al.,j.biol.chem.9(2):6591-6604(2001))
[0347]
在特定实施方案中,抗体突变体包含具有改良adcc的1个或多个氨基酸取代(例如在fc区的位置298、333、和/或334(eu编号中的残基)处的取代)的fc区。
[0348]
在一些实施方案中,例如如美国专利第6,194,551号、wo99/51642和idusogie et al.j.immunol.164:4178-4184(2000)所记载,在fc区中进行导致经改变(即,为已增加或已减少中的任一种)的c1q结合性和/或补体依赖性细胞毒性(cdc)的改变。
[0349]
在一些实施方案中,对于fc受体的结合活性下降的fc区包含本说明书中所例示的fc区的fc突变体。
[0350]
构架
[0351]“构架”或“fr”是指超变区(hvr)残基以外的可变结构域残基。可变结构域的fr通常由4个fr域:fr1、fr2、fr3和fr4构成。据此,hvr和fr的序列通常按以下的顺序出现在vh(或vl)中:fri-h1(l1)-fr2-h2(l2)-fr3-h3(l3)-fr4。
[0352]
全长抗体
[0353]
术语“全长抗体”、“完全抗体”和“全部抗体”在本说明书中能够相互替换使用,是指具有实质上类似于天然型抗体结构的结构的抗体、或具有包含本说明书中所定义的fc区的重链的抗体。
[0354]
宿主细胞
[0355]
术语“宿主细胞”、“宿主细胞株”和“宿主细胞培养物”可相互替换使用,是指导入有外来核酸的细胞(包含此类细胞的子代)。宿主细胞包含“转化体”和“转化细胞”,其中包含初代转化细胞和不论继代数来自该细胞的子代。子代可不和母细胞在核酸内容方面完全相同,也可包含变异。本说明书中也包含和筛选或选择原始的转化细胞时所使用的子代具有相同的功能或生物学活性的突变体子代。
[0356]
人抗体
[0357]“人抗体”为人类或者人类细胞所产生的抗体、或者具有对应于使用人抗体组库或者其他人抗体编码序列的来自非人类供给源的抗体的氨基酸序列的氨基酸序列的抗体。该人抗体的定义明确排除包含非人类的抗原结合残基的人源化抗体。
[0358]
人类共有构架
[0359]“人类共有构架”为人免疫球蛋白vl或vh构架序列的选择群中显示最共同产生的氨基酸残基的构架。通常,人免疫球蛋白vl或vh序列选自可变结构域序列的亚群。通常,序列的亚群为kabat et al.,sequences of proteins of immunological interest,fifth edition,nih publication 91-3242,bethesda md(1991),vols.1-3中的亚群。在一个实施方案中,关于vl,亚群为上述kabat等人所述的亚群κi。在一个实施方案中,关于vh,亚群为上述kabat等人所述的亚群iii。
[0360]
人源化抗体
[0361]“人源化”抗体是指包含来自非人类hvr的氨基酸残基和来自人类fr的氨基酸残基的嵌合抗体。在一些实施方案中,人源化抗体包含至少1个、典型为2个可变结构域的实质上的全部,该可变区中,全部或者实质上的全部hvr(例如cdr)对应于非人抗体的hvr,且全部或者实质上的全部fr对应于人抗体的fr。人源化抗体可任意含有来自人抗体的抗体恒定区的至少一部分。抗体(例如非人抗体)的“人源化后的形态”是指经过人源化的抗体。
[0362]
超变区
[0363]
本说明书中使用的术语“超变区”、“hvr”或“cdr”是指在序列中为超变(“互补性决定区”或“complementarity determining region”),和/或形成结构上确定的环(“超变环”),和/或包含抗原接触残基(“抗原接触”)的抗体的可变结构域的各区。通常,抗体包含6个cdr:vh有3个(h1、h2、h3),和vl有3个(l1、l2、l3)。本说明书中的例示性cdr包含以下:
[0364]
(a)在氨基酸残基26-32(l1)、50-52(l2)、91-96(l3)、26-32(h1)、53-55(h2)、及96-101(h3)处产生的超变环(chothia and lesk,j.mol.biol.196:901-917(1987));
[0365]
(b)在氨基酸残基24-34(l1)、50-56(l2)、89-97(l3)、31-35b(h1)、50-65(h2)、及95-102(h3)处产生的cdr(kabat et al.,sequences of proteins of immunological interest,5th ed.public health service,national institutes of health,bethesda,md(1991));
[0366]
(c)在氨基酸残基27c-36(l1)、46-55(l2)、89-96(l3)、30-35b(h1)、47-58(h2)、及93-101(h3)处产生的抗原接触(maccallum et al.j.mol.biol.262:732-745(1996));以及
[0367]
(d)包含氨基酸残基46-56(l2)、47-56(l2)、48-56(l2)、49-56(l2)、26-35(h1)、26-35b(h1)、49-65(h2)、93-102(h3)、及94-102(h3)的(a)、(b)、和/或(c)的组合。
[0368]
除非另有说明,cdr残基和可变结构域中的其他残基(例如fr残基)在本说明书中依据上述kabat等进行编号。
[0369]
个体
[0370]“个体”、“受试体”或“受试者”为哺乳动物。哺乳动物包括但不限定于饲养动物(例如牛、羊、猫、狗、马)、灵长类(例如人类和猴等非人类灵长类)、兔、以及啮齿类(例如小鼠和大鼠)。在特定实施方案中,个体或受试体为人类。
[0371]
分离的抗原结合分子
[0372]“分离的”抗原结合分子是从其原本环境的成分中分离的抗原结合分子。在一些实施方案中,例如以电泳(例如sds-page、等电点分离法(isoelectric focusing,ief)、毛细管电泳法)或色谱法(例如离子交换或逆相hplc)测定,纯化至超过95%或99%的纯度。作为用来评估抗体纯度的方法的综述,例如可参照flatman et al.,j.chromatogr.b 848:79-87(2007)。
[0373]
经分离的核酸
[0374]“经分离的”核酸是指从其原本环境的成分中分离的核酸分子。经分离的核酸包括通常包含该核酸分子的细胞中所含的核酸分子,该核酸分子存在于染色体外或存在于和本来的染色体上的位置不同的染色体上的位置。
[0375]
编码抗原结合分子的经分离的核酸
[0376]“编码抗原结合分子的经分离的核酸”是指编码抗原结合分子的1个或2个以上的多肽链或其片段(当为抗体时,为抗体的重链和轻链或其片段)的1个或多个核酸分子,包含搭载于1个载体或不同载体的核酸分子、和存在于宿主细胞中的1个或多个位置的核酸分子。
[0377]
单克隆抗体
[0378]
本说明书中所指的术语“单克隆抗体”是指由实质上均匀的抗体群得到的抗体。即,构成该群的各个抗体除了能够产生的突变抗体(例如包含自然产生的突变的突变抗体、或单克隆抗体制备物的制备中产生的突变抗体。此类突变体通常存在若干量)外,和同一和/或相同的表位结合。和典型地包含对于不同决定基(表位)的不同抗体的多克隆抗体制备物形成对比,单克隆抗体制备物的各单克隆抗体是对于抗原上的单一决定基的抗体。因此,修饰语“单克隆”显示其是由实质上均匀的抗体群得到这一抗体的特征,不应解释为需要利用某些特定方法制备抗体。例如,依据本发明使用的单克隆抗体可利用各种方法制作,所述方法包括但不限定于杂交瘤法、重组dna法、噬菌体展示法、利用包含人免疫球蛋白基因座的全部或一部分的基因转殖动物的方法,本说明书中记载有用来制作单克隆抗体的此类方法和其他例示性方法。
[0379]
药品说明书
[0380]
术语“药品说明书”通常包含于治疗用品的商用包装,用于说明使用说明书,该使用说明书包含涉及此类治疗用品的使用,和适应症、用法、剂量、施用方法、联合疗法、禁忌、和/或警告相关的信息。
[0381]
氨基酸序列同源性
immunology,6th ed.,w.h.freeman and co.,page 91(2007))。(例如,参见kindt et al.kuby immunology,6th ed.,w.h.freeman and co.,page 91(2007)。)单一的vh或vl域足以赋予抗原结合特异性。进一步地,和某特定抗原结合的抗体也可使用来自和该抗原结合的抗体的vh或vl域,分别筛选vl或vh域的互补基因库并分离。例如可参照portolano et al.,j.immunol.150:880-887(1993);clarkson et al.,nature 352:624-628(1991)。
[0393]
载体
[0394]
本说明书中使用的术语“载体”是指可增加其所连结的另一核酸的核酸分子。该术语包含作为自我复制核酸结构的载体、和掺入到已被导入的宿主细胞的基因组中的载体。某些载体自身能够引导与其有效连结的核酸的表达。此类载体在本说明书中也称为“表达载体”。
[0395]
多特异性抗体
[0396]
在特定实施方案中,本说明书中提供的抗原结合分子(或抗体)为多特异性抗体(例如双特异性抗体)。多特异性抗体为对至少2个不同位点具有结合特异性的单克隆抗体。多特异性抗体(例如双特异性抗体)可制备为全长抗体或抗体片段。
[0397]
用来制作多特异性抗体的方法包括但不限定于具有不同特异性的2个免疫球蛋白重链-轻链对的重组共表达(参照milstein and cuello,nature 305:537(1983)、wo93/08829、和traunecker et al.,emboj.10:3655(1991))、和knob-in-hole技术(例如参照美国专利第5,731,168号)。多特异性抗体还可通过如下方法制作:为了制作fc异二聚体分子而改造静电转向效果(electrostatic steering effects)(wo2009/089004a1);使2种以上抗体或片段交联(参照美国专利第4,676,980号和brennan et al.,science,229:81(1985));使用白氨酸拉链制作具有2个特异性的抗体(参照kostelny et al.,j.immunol.,148(5):1547-1553(1992));使用“双链抗体”技术制作双特异性抗体片段(参照hollinger et al.,proc.natl.acad.sci.usa,90:6444-6448(1993));及使用单链fv(scfv)二聚体(参照gruber et al.,j.immunol.,152:5368(1994));及例如依tutt et al.j.immunol.147:60(1991)所记载制备三特异性抗体。
[0398]
本说明书中也包含包括“章鱼抗体”的带有3个以上功能性抗原结合位点的改造抗体(例如参照美国专利公开案第2006/0025576号a1)。
[0399]
本说明书中抗原结合分子或片段也包含“双效fab”或“daf”,其包含和特定抗原及另一不同的抗原结合的1个抗原结合位点(例如参照美国专利公开案第2008/0069820号)。
[0400]
ii.抗t细胞抗原结合分子和药物组合物
[0401]
在一个实施方案中,“抗t细胞抗原结合分子”是和t细胞上的抗原结合的抗原结合分子,包含和t细胞受体复合体结合的抗原结合分子。在一个实施方案中,抗t细胞抗原结合分子为多特异性抗原结合分子。在一个实施方案中,抗t细胞抗原结合分子是包含“包含具有t细胞受体复合体结合活性的抗体可变区的结构域”、和“包含具有癌抗原结合活性的抗体可变区的结构域”的双特异性抗原结合分子,优选为双特异性抗体。在一个实施方案中,双特异性抗体可以具有单链抗体的结构,例如以连接子结合抗体可变区的结构。在一个实施方案中,抗t细胞抗原结合分子进一步包含对于fcγ受体的结合活性下降的fc区。
[0402]
另外,在一个实施方案中,包含具有t细胞受体复合体结合活性的抗体可变区的结构域优选包含具有t细胞受体结合活性的抗体可变区的结构域,进一步优选包含具有cd3结
合活性的抗体可变区的结构域。另外,在一个实施方案中,上述“包含抗体可变区的结构域”由一个或多个抗体的可变结构域提供,优选包含抗体可变区的结构域包含抗体轻链可变区(vl)和抗体重链可变区(vh)。作为此类包含抗体可变区的结构域的例子,可适宜地列举各种抗体片段、例如“scfv(single chain fv)”、“单链抗体(single chain antibody)”、“fv”、“scfv2(single chain fv 2)”、“fab”或“f(ab’)2”等。
[0403]
包含具有癌抗原结合活性的抗体可变区的结构域
[0404]
在本说明书中,“包含具有癌抗原结合活性的抗体可变区的结构域”是指包含和癌抗原的一部分或全部特异性地结合且互补的区域而成的抗体的部分。
[0405]
癌特异性抗原
[0406]
在本说明书中,“癌特异性抗原”意指能够区分癌细胞和健康细胞的癌细胞所表达的抗原,例如包含伴随细胞的恶性化所表达的抗原、细胞在癌化时在细胞表面或蛋白质分子上显现的异常糖链。具体来说,例如可列举:gpc3;alk受体(多效生长因子受体);多效生长因子;ks 1/4胰腺癌抗原;卵巢癌抗原(ca125);前列腺酸磷酸;前列腺特异性抗原(psa);黑色素瘤相关抗原p97;黑色素瘤抗原gp75;高分子量黑色素瘤抗原(hmw-maa);前列腺特异性膜抗原;癌胚抗原(cea);多态性上皮粘蛋白抗原;人乳脂肪球抗原;cea、tag-72、co17-1a、gica 19-9、cta-1和lea等结肠直肠肿瘤相关抗原;伯基特淋巴瘤抗原-38.13;cd19;人b淋巴瘤抗原-cd20;cd33;神经节苷脂gd2、神经节苷脂gd3、神经节苷脂gm2和神经节苷脂gm3等黑色素瘤特异性抗原;肿瘤特异性移植型细胞表面抗原(tsta);t抗原、dna肿瘤病毒和rna肿瘤病毒的包膜抗原等由病毒诱导的肿瘤抗原;结肠的cea;5t4癌胚滋养层糖蛋白和膀胱肿瘤癌胚抗原等癌胚抗原;α-胎儿蛋白;人肺癌抗原l6和l20等分化抗原;纤维肉瘤的抗原;人白血病t细胞抗原-gp37;新生糖蛋白;神经鞘脂类;egfr(表皮生长因子受体)等乳癌抗原;ny-br-16;ny-br-16和her2抗原(p185her2);多态性上皮粘蛋白(pem);恶性人淋巴细胞抗原-apo-1;胎儿红细胞中发现的i抗原等分化抗原;成人红细胞中发现的初期内胚层i抗原;移植前的胚;胃癌中发现的i(ma);乳腺上皮中发现的m18、m39;骨髓细胞中发现的ssea-1、vep8、vep9、myl、vim-d5;结肠直肠癌中发现的d156-22、tra-1-85(血液群h);精巢和卵巢癌中发现的scp-1;结肠癌中发现的c14;肺癌中发现的f3;胃癌中发现的ah6;y半抗原;胚性癌细胞中发现的ley、tl5(血液群a);a431细胞中发现的egf受体;胰腺癌中发现的e1系列(血液群b);胚性癌细胞中发现的fc10.2;胃癌抗原;腺癌中发现的co-514(血液群lea);腺癌中发现的ns-10、co-43(血液群leb);a431细胞的egf受体中发现的g49;结肠癌中发现的mh2(血液群aleb/ley);结肠癌中发现的19.9;胃癌粘蛋白;骨髓细胞中发现的t5a7;黑色素瘤中发现的r24;胚性癌细胞中发现的4.2、gd3、d1.1、ofa-1、gm2、ofa-2、gd2、及m1:22:25:8;以及4~8细胞阶段的胚胎中发现的ssea-3和ssea-4;皮下t细胞淋巴瘤抗原;mart-1抗原;sialyl tn(stn)抗原;结肠癌抗原ny-co-45;肺癌抗原ny-lu-12突变体a;腺癌抗原art1;伴肿瘤性相关脑-精巢癌抗原(癌神经抗原ma2、伴肿瘤性神经抗原);神经癌腹部抗原2(nova2);血液细胞癌抗原基因520;肿瘤相关抗原co-029;肿瘤相关抗原mage-c1(癌/精巢抗原ct7)、mage-b1(mage-xp抗原)、mage-b2(dam6)、mage-2、mage-4a、mage-4b和mage-x2;癌-精巢抗原(ny-eos-1);ykl-40;和上述多肽中的任一片段或对于这些进行修饰的结构等(上述修饰磷酸基或糖链等);epcam;ereg;ca19-9;ca15-3;sialyl ssea-1(slx);her2;psma;cea;clec12a等。作为本发明的癌特异性抗原结合域的对象的癌特异性抗原,特
别优选为在细胞表面表达的癌特异性抗原,作为此类癌特异性抗原,例如可列举:cd19、cd20、egfr、her2、epcam、ereg。
[0407]
包含具有gpc3结合活性的抗体可变区的结构域
[0408]
本说明书中,“包含具有磷脂酰肌醇蛋白聚糖3(gpc3)结合活性的抗体可变区的结构域”是指包含和上述gpc3蛋白质或其部分肽的一部分或全部特异性地结合且互补的区域而成的抗体的部分。
[0409]
在本说明书中,磷脂酰肌醇蛋白聚糖3(gpc3)是属于通过糖基磷脂酰肌醇和细胞表面结合的硫酸类肝素蛋白多糖的一群、即磷脂酰肌醇蛋白聚糖家族的蛋白质(filmus,j.clin.invest.,2001,108,497-501)。磷脂酰肌醇蛋白聚糖对细胞的增殖、分化、迁移发挥重要作用。gpc3在通过外科切除或活体组织检查得到的肝细胞癌组织的70%以上中有表达,而在邻接的非肿瘤性肝脏病变和大部分成人组织中则完全或几乎没有表达(zhu-zu-w,gut,2001,48,558-564、yamauchi,mod.pathol.,2005,18,1591-1598)。
[0410]
包含具有t细胞受体复合体结合活性的抗体可变区的结构域
[0411]
在本说明书中,“包含具有t细胞受体复合体结合活性的抗体可变区的结构域”是指包含和t细胞受体复合体的一部分或全部特异性地结合、且互补的区域而成的t细胞受体复合体抗体的部分。t细胞受体复合体可为t细胞受体自身,也可以和t细胞受体一起构成t细胞受体复合体的衔接分子。作为衔接分子优选为cd3。
[0412]
包含具有t细胞受体结合活性的抗体可变区的结构域
[0413]
在本说明书中,“包含具有t细胞受体结合活性的抗体可变区的结构域”是指包含和t细胞受体的一部分或全部特异性地结合且互补的区域而成的t细胞受体抗体的部分。
[0414]
作为本发明的结构域所结合的t细胞受体的部分,可为可变区,也可为恒定区,但优选为存在于恒定区的表位。作为恒定区的序列,例如可列举refseq登记编号caa26636.1的t细胞受体α链(序列编号:9)、refseq登记编号c25777的t细胞受体β链(序列编号:10)、refseq登记编号a26659的t细胞受体γ1链(序列编号:11)、refseq登记编号aab63312.1的t细胞受体γ2链(序列编号:12)、refseq登记编号aaa61033.1的t细胞受体δ链(序列编号:13)的序列。
[0415]
包含具有cd3结合活性的抗体可变区的结构域
[0416]
本说明书中,“包含具有cd3结合活性的抗体可变区的结构域”是指包含和cd3的一部分或全部特异性地结合且互补的区域而成的cd3抗体的部分。
[0417]
关于本发明的包含具有cd3结合活性的抗体可变区的结构域,只要为存在于构成人cd3的γ链、δ链或ε链序列的表位,则能够和任一种表位结合。在本发明中,优选使用如下结构域,其包含和存在于人cd3复合体的ε链的细胞外区的表位结合的抗cd3抗体的轻链可变区(vl)、和抗cd3抗体的重链可变区(vh)。作为这种域,优选使用除了实施例所记载的抗cd3抗体的轻链可变区(vl)和抗cd3抗体的重链可变区(vh)以外,还包含okt3抗体(proc.natl.acad.sci.usa(1980)77,4914-4917)和各种公知的cd3抗体的轻链可变区(vl)和cd3抗体的重链可变区(vh)的cd3结合域另外,可适当地使用包含如下抗体可变区的结构域,该抗体可变区来自通过将构成人cd3的γ链、δ链或ε链以上述方法使所目标动物免疫而取得的具有所期望的性质的抗cd3抗体。成为包含具有cd3结合活性的抗体可变区的结构域的来源的抗cd3抗体如上所述,可适当地使用经适当地人源化的抗体或人抗体。关于构成
cd3的γ链、δ链或ε链的结构,其多核甙酸序列以序列编号:9(nm_000073.2)、10(nm_000732.4)和11(nm_000733.3)记载,且其多肽序列以序列编号:12(np_000064.1)、13(np_000723.1)和14(np_000724.1)记载(括号内表示refseq登记编号)。
[0418]
本发明的抗原结合分子中的包含抗体可变区的结构域能够和相同的表位结合。此处,相同的表位能够存在于由序列编号:2或序列编号:14记载的氨基酸序列所构成的蛋白质中。或者,本发明的抗原结合分子中的包含抗体可变区的结构域能够和相互不同的表位结合。此处,不同的表位能够存在于由序列编号:2或序列编号:14记载的氨基酸序列所构成的蛋白质中。
[0419]
对于fcγ受体的结合活性下降的fc区
[0420]
在一个实施方案中,对于fcγ受体的结合活性下降是指例如相较于成为对照的抗原结合分子的结合活性,受检抗原结合分子的结合活性显示50%以下、优选为45%以下、40%以下、35%以下、30%以下、20%以下、15%以下、特别优选为10%以下、9%以下、8%以下、7%以下、6%以下、5%以下、4%以下、3%以下、2%以下、1%以下的结合活性。
[0421]
作为成为对照的抗原结合分子,可适当地使用具有igg1、igg2、igg3或igg4单克隆抗体的fc区的抗原结合分子。另外,使用具有某特定的同型的抗体的fc区的突变体的抗原结合分子作为受检物质时,通过使用该具有特定的同型的抗体的fc区的抗原结合分子作为对照,能够检验该突变体所具有的变异对fcγ受体的结合活性的效果。如上所述,可适当地制作如下抗原结合分子,其具有对于fcγ受体的结合活性下降得以检验的fc区的突变体。
[0422]
作为此类突变体的例子,已知根据eu编号特定的氨基酸即231a-238s的缺失(wo 2009/011941)、c226s、c229s、p238s、(c220s)(j.rheumatol(2007)34,11)、c226s、c229s(hum.antibod.hybridomas(1990)1(1),47-54)、c226s、c229s、e233p、l234v、l235a(blood(2007)109,1185-1192)等突变体。
[0423]
即,可适宜地列举构成特定的同型抗体的fc区的氨基酸中,具有根据eu编号特定的下述任一个氨基酸;220位、226位、229位、231位、232位、233位、234位、235位、236位、237位、238位、239位、240位、264位、265位、266位、267位、269位、270位、295位、296位、297位、298位、299位、300位、325位、327位、328位、329位、330位、331位、332位被取代的fc区的抗原结合分子。作为fc区的来源的抗体的同型没有特别限定,可适当地利用来自igg1、igg2、igg3或igg4单克隆抗体的fc区,但优选利用来自igg1抗体的fc区。
[0424]
例如,也可适当地使用如下抗原结合分子,其具有在构成igg1抗体的fc区的氨基酸中,根据eu编号特定的下述任一个实施了取代(数字表示根据eu编号特定的氨基酸残基的位置,位于数字之前的单字母的氨基酸符号表示取代前的氨基酸残基、位于数字之后的单字母的氨基酸符号表示取代前的氨基酸残基)的fc区、或231位至238位的氨基酸序列缺失的fc区;
[0425]
(a)l234f、l235e、p331s、
[0426]
(b)c226s、c229s、p238s、
[0427]
(c)c226s、c229s、
[0428]
(d)c226s、c229s、e233p、l234v、l235a
[0429]
(e)l234a、l235a或l235r、n297a
[0430]
(f)l235a或l235r、s239k、n297a。
[0431]
另外,也可适当地使用如下抗原结合分子,其具有在构成igg2抗体的fc区的氨基酸中,根据eu编号特定的下述任一个实施了取代(数字表示根据eu编号特定的氨基酸残基的位置,位于数字之前的单字母的氨基酸符号表示取代前的氨基酸残基、位于数字之后的单字母的氨基酸符号表示取代前的氨基酸残基)的fc区;
[0432]
(g)h268q、v309l、a330s、p331s
[0433]
(h)v234a
[0434]
(i)g237a
[0435]
(j)v234a、g237a
[0436]
(k)a235e、g237a
[0437]
(1)v234a、a235e、g237a。
[0438]
另外,也可适当地使用如下抗原结合分子,其具有在构成igg3抗体的fc区的氨基酸中,根据eu编号特定的下述任一个实施了取代(数字表示根据eu编号特定的氨基酸残基的位置,位于数字之前的单字母的氨基酸符号表示取代前的氨基酸残基、位于数字之后的单字母的氨基酸符号表示取代前的氨基酸残基)的fc区;
[0439]
(m)f241a
[0440]
(n)d265a
[0441]
(o)v264a。
[0442]
另外,也可适当地使用如下抗原结合分子,其具有在构成igg4抗体的fc区的氨基酸中,根据eu编号特定的下述任一个实施了取代(数字表示根据eu编号特定的氨基酸残基的位置,位于数字之前的单字母的氨基酸符号表示取代前的氨基酸残基、位于数字之后的单字母的氨基酸符号表示取代前的氨基酸残基)的fc区;
[0443]
(p)l235a、g237a、e318a
[0444]
(q)l235e
[0445]
(r)f234a、l235a。
[0446]
作为其他优选例,可列举如下抗原结合分子,其具有构成igg1抗体的fc区的氨基酸中,根据eu编号特定的下述任一个氨基酸;233位、234位、235位、236位、237位、327位、330位、331位被取代为相应的igg2或igg4中其eu编号所对应的氨基酸的fc区。
[0447]
作为其他优选例,可适宜地列举如下抗原结合分子,其具有构成igg1抗体的fc区的氨基酸中,根据eu编号特定的下述任一个或一个以上的氨基酸;234位、235位、297位被其他氨基酸取代的fc区。取代后存在的氨基酸的种类没有特别限定,特别优选具有234位、235位、297位的任一个或一个以上的氨基酸被取代为丙氨酸的fc区的抗原结合分子。
[0448]
作为其他优选例,可适宜地列举如下抗原结合分子,其具有构成igg1抗体的fc区的氨基酸中,根据eu编号特定的下述任一个氨基酸;265位被另一氨基酸取代的fc区。取代后存在的氨基酸的种类没有特别限定,特别优选具有265位的氨基酸被取代为丙氨酸的fc区的抗原结合分子。
[0449]
抗磷脂酰肌醇蛋白聚糖3(gpc3)/t细胞受体复合体双特异性抗体
[0450]
在一个实施方案中,抗t细胞抗原结合分子为包含如下结构域的双特异性抗体:(1)包含具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区的结构域、(2)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(3)包含对于fcγ受体的结合活性下降的fc
区的结构域。在一个实施方案中,关于本发明的具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区和具有t细胞受体复合体结合活性的抗体可变区中所包含的抗体l链可变区,优选取得能够向对于磷脂酰肌醇蛋白聚糖3具有结合活性的h链、和对于t细胞受体复合体3具有结合活性的h链这两者提供结合能的共用l链,并将其用作上述双特异性抗体的共用l链可变区。
[0451]
作为本公开中优选的具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区所包含的抗体h链可变区,例如可列举:表1所记载的抗体h链可变区;或者具有cdr1、cdr2及cdr3的氨基酸序列和表1所记载的抗体h链可变区所具有的cdr1、cdr2及cdr3的氨基酸序列相同的cdr序列的抗体h链可变区;或者功能上和该可变区相同的抗体h链可变区。
[0452]
[表1]
[0453]
[0454]
另外,作为本公开中优选的具有t细胞受体复合体结合活性的抗体可变区,可列举具有对于t细胞受体的结合活性的抗体可变区。t细胞受体中优选为cd3,特别优选为cd3ε。作为此类抗体可变区中所包含的抗体h链可变区,例如可列举:表2所记载的抗体h链可变区;或者具有cdr1、cdr2及cdr3的氨基酸序列和表2所记载的抗体h链可变区所具有的cdr1、cdr2及cdr3的氨基酸序列相同的cdr序列的抗体h链可变区;或者功能上和该可变区相同的抗体h链可变区。
[0455]
[表2]
[0456]
[0457]
构成抗体h链氨基酸序列的氨基酸残基的cdr区和kabat编号的关系例示在图2中。
[0458]
作为本发明所使用的共用l链可变区,可列举:表3所记载的l链可变区;或者具有cdr1、cdr2及cdr3的氨基酸序列和表3所记载的抗体l链可变区所具有的cdr1、cdr2及cdr3的氨基酸序列相同的cdr序列的抗体l链可变区;或者功能上和该可变区相同的抗体l可变区。
[0459]
[表3]
[0460][0461]
构成抗体l链氨基酸序列的氨基酸残基的cdr区和kabat编号的关系例示在图4中。
[0462]
在一优选实施方案中,作为具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区和具有t细胞受体复合体结合活性的抗体可变区的组合,例如可列举:表4所记载的抗体h链可变区的组合;或者具有cdr1、cdr2及cdr3的氨基酸序列和表4所记载的抗体h链可变区所具
有的cdr1、cdr2及cdr3的氨基酸序列相同的cdr序列的抗体h链可变区的组合;或者功能上和该可变区相同的抗体h链可变区的组合。
[0463]
[表4]
[0464]
gpc3侧/t细胞受体复合体侧序列编号h0000/hce115ha40/52h0000/ce115ha25140/430h0000/ce115ha23640/429h0000/tr01h00240/421h0000/ce115ha12240/426h0610/rce115h215/424h0610/tr01h040215/103h0610/tr01h061215/122h0610/tr01h068215/129h0610/tr01h071215/132gch054/tr01h067197/128gch094/tr01h082211/142gch094/tr01h084211/144gch065/tr01h084206/144gch065/tr01h082206/142gch094/tr01h109211/164gch065/tr01h109206/164gch094/tr01h113211/168gch065/tr01h113206/168
[0465]
对于上述具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区和具有t细胞受体复合体结合活性的抗体可变区的组合,作为优选的共用l链,例如可列举:l0000、l0011、l0201、l0203、l0204、l0206、l0208、l0209、l0211、l0212、l0222、或具有共用l链的cdr1、cdr2及cdr3的氨基酸序列和这些共用l链的cdr1、cdr2及cdr3的氨基酸序列相同的cdr序列的共用l链。作为具体的优选的组合,例如可列举:表5所记载的抗体h链可变区和共用l链的组合;或者具有cdr1、cdr2及cdr3的氨基酸序列和表5所记载的抗体可变区及共用l链所具有的cdr1、cdr2及cdr3的氨基酸序列相同的cdr序列的抗体可变区的组合;或者功能上和该可变区相同的抗体h链可变区及共用l链的组合。
[0466]
[表5]
[0467]
gpc3侧/t细胞受体复合体侧/共用l链序列编号h0610/rce115h/l0000215/424/53h0610/tr01h040/l0000215/103/53h0610/tr01h040/l0201215/103/299h0610/tr01h040/l0203215/103/301h0610/tr01h040/l0204215/103/302h0610/tr01h040/l0206215/103/304
h0610/tr01h040/l0208215/103/306h0610/tr01h040/l0209215/103/307h0610/tr01h040/l0211215/103/309h0610/tr01h061/l0000215/122/53h0610/tr01h068/l0000215/129/53h0610/tr01h071/l0000215/132/53gch054/tr01h067/l0201197/128/299gch054/tr01h067/l0212197/128/310gch054/tr01h067/l0222197/128/319gch054/tr01h067/l0000197/128/53gch094/tr01h082/l0201211/142/299gch094/tr01h082/l0011211/142/223gch094/tr01h084/l0011211/144/223gch065/tr01h084/l0011206/144/223gch065/tr01h082/l0011206/142/223gch094/tr01h109/l0011211/164/223gch065/tr01h109/l0011206/164/223gch094/tr01h113/l0011211/168/223gch065/tr01h113/l0011206/168/223
[0468]
抗t细胞抗原结合分子(优选为双特异性抗体)中所包含的fc区只要为对于fcγ受体的结合活性下降的fc区,则没有特别限制,作为优选的fc区,例如可列举:e22hh的fc区部分和e22hk的fc区部分的组合、e2702gsksc的fc区部分和e2704sepsc的fc区部分的组合、e2702sksc的fc区部分和e2704sepsc的fc区部分的组合。
[0469]
ery974
[0470]
在一个实施方案中,本公开的抗t细胞抗原结合分子为ery974。ery974为包含如下结构域的双特异性抗体:(1)包含具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区的结构域、(2)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(3)包含对于fcγ受体的结合活性下降的fc区的结构域;且包含tr01h113(序列编号:168)作为cd3侧的重链可变区,包含e2702sksc(序列编号:62)作为cd3侧的重链恒定区,包含gch065(序列编号:206)作为gpc3侧的重链可变区,包含e2704sepsc(序列编号:61)作为gpc3侧的重链恒定区,包含l0011(序列编号:223)作为共用轻链可变区,及包含k0(序列编号:63)作为共用轻链恒定区。在另一个实施方案中,ery974的cd3侧重链包含序列编号:402的氨基酸序列,gpc3侧重链包含序列编号:385的氨基酸序列,共用轻链包含序列编号:410的氨基酸序列。
[0471]
在一个实施方案中,本公开的氨基酸序列中所包含的氨基酸有时也会在翻译后受到修饰。例如,n末端的谷氨酰胺残基(q)通过焦谷氨酸化而成为焦谷氨酸(pglu)为本领域技术人员所熟知的修饰。氨基酸以这种方式进行了翻译后修饰的情况也当然包含在本公开所记载的氨基酸序列中。
[0472]
作为本公开中其他优选的抗t细胞抗原结合分子,可列举如下双特异性抗体,其含有具有对于磷脂酰肌醇蛋白聚糖3的结合活性的抗体可变区、和具有对于cd3ε的结合活性
的抗体可变区。更优选为相较于作为双特异性抗体的gpc3_ery22_rce115(wo2015156268的实施例1所公开),细胞毒性优选为相同或以上。作为此类双特异性抗体,例如可列举:wo2015156268的实施例3(表13)所记载的具有h链和l链的双特异性抗体;或者与和该抗体所结合的表位重复的表位结合,且具有上述对于fcγ受体的结合活性下降的fc区的双特异性抗体。
[0473]
此处,在本公开中,“功能上相同”是指对于抗原的结合亲和性相同,或者当用作双特异性抗体时,对于表达磷脂酰肌醇蛋白聚糖3的细胞或包含该细胞的组织的细胞毒性相同。结合亲和性和细胞毒性能够基于本说明书的记载测定。供测定细胞毒性的细胞可以使用表达gpc3的所期望的细胞或包含该细胞的所期望的组织,例如能够使用作为表达gpc3的人癌细胞株的pc-10或nci-h446。另外,在抗体恒定区中,对于fcγ受体的结合活性的下降也可以相同。
[0474]
例如,和本技术案说明书所记载的抗体h链可变区(原本的h链可变区)功能上相同的抗体h链可变区是指当作为原本的h链对,和本技术案说明书所记载的抗体l链可变区组合时,结合亲和性相同,或者当用作双特异性抗体时,对于表达磷脂酰肌醇蛋白聚糖3的细胞或包含该细胞的组织的细胞毒性相同。另外,和本技术案说明书所记载的抗体l链可变区(原本的l链可变区)功能上相同的抗体l链可变区是指当作为原本的l链对,和本技术案说明书所记载的抗体h链可变区组合时,结合亲和性相同,或者当用作双特异性抗体时,对于表达磷脂酰肌醇蛋白聚糖3的细胞或包含该细胞的组织的细胞毒性相同。
[0475]
另外,“相同”并不一定需要相同程度的活性,也可增强活性。具体来说,可列举如下情况:在对于抗原的结合亲和性的情况下,和成为对照的抗体可变区的结合亲和性(亲kd值)相比的值(kd值/亲kd值)为1.5以下。kd值/亲kd值的值优选为1.3以下,更优选为1.2以下、1.1以下、1.0以下、0.9以下、0.8以下、0.7以下、0.6以下、或者0.5以下。下限并没有限制,例如可为10-1
、10-2
、10-3
、10-4
、10-5
、或10-6
。具体来说,本发明中kd值/亲kd值的值优选为10-6
~1.5x10-0
,更优选为10-6
~10-1
,更优选为10-6
~10-2
,更优选为10-6
~10-3
。在细胞毒性的情况下,可列举如下情况:和成为对照的双特异性抗体的细胞增殖抑制率(母细胞增殖抑制率)相比的值(细胞增殖抑制率/母细胞增殖抑制率)为0.7以上。所添加的多特异性抗原结合分子的浓度可适当地决定,优选为例如以0.01nm、0.05nm、0.1nm、0.5nm、或1nm、优选为0.05nm或0.1nm测定。细胞增殖抑制率/母细胞增殖抑制率的值优选为0.8以上,更优选为0.9以上、1.0以上、1.2以上、1.5以上、2以上、3以上、5以上、10以上、或20以上。上限并没有限制,例如可为10、102、103、104、105、或106。
[0476]
另外,在细胞毒性的情况下,可列举如下情况:和原本的双特异性抗体对于细胞的50%增殖抑制浓度(母细胞50%增殖抑制浓度)相比的值(细胞50%增殖抑制浓度/母细胞50%增殖抑制浓度)为1.5以下。50%增殖抑制浓度是指相较于未添加多特异性抗原结合分子的情况,使细胞增殖率减半所需要的多特异性抗原结合分子的浓度。“细胞50%增殖抑制浓度/母细胞50%增殖抑制浓度”的值优选为1.3以下,更优选为1.2以下、1.1以下、1.0以下、0.9以下、0.8以下、0.7以下、0.6以下、或者0.5以下。下限并没有限制,例如可为10-1
、10-2
、10-3
、10-4
、10-5
、或10-6
。具体来说,优选为10-6
~1.5x10-0
,更优选为10-6
~10-1
,更优选为10-6
~10-2
,更优选为10-6
~10-3
。
[0477]
另外,关于包含具有gpc3结合活性的抗体可变区的结构域,对于gpc3(例如人
gpc3)的kd值例如可为5x10-9
m以下,优选可为4x10-9
m以下、例如3x10-9
m以下、2x10-9
m以下、1x10-9
m以下、8x10-10
m以下、5x10-10
m以下、4x10-10
m以下、3x10-10
m以下、2x10-10
m以下、1x10-10
m以下、8x10-11
m以下、5x10-11
m以下、4x10-11
m以下、3x10-11
m以下、2x10-11
m以下、1x10-11
m以下、8x10-12
m以下、5x10-12
m以下、4x10-12
m以下、3x10-12
m以下、2x10-12
m以下、1x10-12
m以下、8x10-13
m以下、5x10-13
m以下、4x10-13
m以下、3x10-13
m以下、2x10-13
m以下、或1x10-13
m以下。
[0478]
另外,关于包含具有t细胞受体复合体结合活性的抗体可变区的结构域,对于人t细胞受体复合体、例如人t细胞受体、更具体来说例如人cd3ε链的kd值例如可为2x10-7
m以下,优选为1.5x10-7
m以下、例如1.4x10-7
m以下、1.3x10-7
m以下、1.2x10-7
m以下、1x10-7
m以下、3x10-8
m以下、2x10-8
m以下、1x10-8
m以下、8x10-9
m以下、5x10-9
m以下、4x10-9
m以下、3x10-9
m以下、2x10-9
m以下、1x10-9
m以下、8x10-10
m以下、5x10-10
m以下、4x10-10
m以下、3x10-10
m以下、2x10-10
m以下、1x10-10
m以下、8x10-11
m以下、5x10-11
m以下、4x10-11
m以下、3x10-11
m以下、2x10-11
m以下、1x10-11
m以下、8x10-12
m以下、5x10-12
m以下、4x10-12
m以下、3x10-12
m以下、2x10-12
m以下、或1x10-12
m以下。
[0479]
本公开的双特异性抗体优选为对于人gpc3和人t细胞受体复合体(例如人cd3ε链)的kd值分别为5x10-9
m以下和2x10-7
m以下,更优选分别为1x10-9
m以下和5x10-8
m以下。
[0480]
在本发明中,“功能上相同”的抗体可变区只要为满足上述条件的抗体h链可变区和/或抗体l链可变区,则没有特别限定。作为此类抗体可变区,例如也可在上述表1~3所记载的可变区的氨基酸序列中,1个或多个氨基酸(例如1、2、3、4、5或10个氨基酸)发生取代、缺失、添加和/或插入。在氨基酸序列中,作为用于使1个或多个氨基酸进行取代、缺失、添加和/或插入的本领域技术人员所熟知的方法,已知有向蛋白质中导入变异的方法。例如,本领域技术人员能够通过使用定点诱变法(hashimoto-gotoh,t,mizuno,t,ogasahara,y,and nakagawa,m.(1995)an oligodeoxyribonucleotide-directed dual amber method for site-directed mutagenesis.gene 152,271-275、zoller,mj,and smith,m.(1983)oligonucleotide-directed mutagenesis of dna fragments cloned into m13 vectors.methods enzymol.100,468-500、kramer,w,drutsa,v,jansen,hw,kramer,b,pflugfelder,m,and fritz,hj(1984)the gapped duplex dna approach to oligonucleotide-directed mutation construction.nucleic acids res.12,9441-9456、kramer w,and fritz hj(1987)oligonucleotide-directed construction of mutations via gapped duplex dna methods.enzymol.154,350-367、kunkel,ta(1985)rapid and efficient site-specific mutagenesis without phenotypic selection.proc natl acad sci u s a.82,488-492)等向氨基酸序列中适当地导入变异,制备和具有上述功能的抗体可变区功能上相同的可变区。
[0481]
在对氨基酸残基进行改变时,希望变异为保留有氨基酸侧链的性质的其他氨基酸。例如作为氨基酸侧链的性质,可列举:疏水性氨基酸(a、i、l、m、f、p、w、y、v)、亲水性氨基酸(r、d、n、c、e、q、g、h、k、s、t)、具有脂肪族侧链的氨基酸(g、a、v、l、i、p)、具有含羟基侧链的氨基酸(s、t、y)、具有含硫原子侧链的氨基酸(c、m)、具有含羧酸和酰胺侧链的氨基酸(d、n、e、q)、具有含碱侧链的氨基酸(r、k、h)、和具有含芳香族侧链的氨基酸(h、f、y、w)(括弧内均表示氨基酸的单字母标记)。这些各群内的氨基酸的取代称为保守取代。已知如下多肽维持其生物学活性,该多肽具有利用对于某氨基酸序列的1个或多个氨基酸残基的缺失、添加
和/或其他氨基酸的取代而进行了修饰的氨基酸序列(mark,d.f.et al.,proc.natl.acad.sci.usa(1984)81:5662-6;zoller,m.j.and smith,m.,nucleic acids res.(1982)10:6487-500;wang,a.et al.,science(1984)224:1431-3;dalbadie-mcfarland,g.et al.,proc.natl.acad.sci.usa(1982)79:6409-13)。包含这种氨基酸改变的本发明可变区和改变前可变区的cdr序列、fr序列或整个可变区的氨基酸序列具有至少70%、更优选为至少75%、更优选为至少80%、进一步优选为至少85%、进一步更优选为至少90%、并且最优选为至少95%的氨基酸序列的同源性。本说明书中,序列的同源性定义为:以序列同源性成为最大的方式根据需要排列序列,适当地导入空位后,和原本的h链可变区或l链可变区的氨基酸序列的残基相同的残基的比例。氨基酸序列的同源性能够以后述方法确定。
[0482]
另外,“功能上相同的抗体可变区”例如也能够由如下核酸得到,该核酸和由编码上述表1~3所记载的可变区的氨基酸序列的碱基序列所构成的核酸在严格条件下进行杂交。作为用来分离和由编码可变区的氨基酸序列的碱基序列所构成的核酸在严格条件下杂交的核酸的严格的杂交条件,可例示6m尿素、0.4%sds、0.5
×
ssc、37℃的条件、或和其相同的严格的杂交条件。如果使用更严格的高条件、例如6m尿素、0.4%sds、0.1
×
ssc、42℃的条件,则能够期待同源性更高的核酸的分离。关于杂交后的冲洗条件,例如为在0.5
×
ssc(1
×
ssc为0.15m nacl、0.015m柠檬酸钠、ph7.0)、和0.1%sds、60℃的条件下冲洗,更优选为在0.2
×
ssc、和0.1%sds、60℃的条件下冲洗,更优选为在0.2
×
ssc、和0.1%sds、62℃的条件下冲洗,更优选为在0.2
×
ssc、和0.1%sds、65℃的条件下冲洗,更优选为在0.1
×
ssc、和0.1%sds、65℃的条件下冲洗。分离后的核酸的序列的确定能够利用后述公知方法进行。关于分离后的核酸的同源性,在全部碱基序列中具有至少50%以上、进一步优选70%以上、进一步优选90%以上(例如95%、96%、97%、98%、99%以上)的序列的同源性。
[0483]
也能够利用使用基于编码可变区的氨基酸序列的碱基序列信息合成的引物的基因扩增法、例如聚合酶链反应(pcr)法来代替上述利用杂交技术的方法,分离和由编码可变区的氨基酸序列的碱基序列所构成的核酸在严格条件下杂交的核酸。
[0484]
碱基序列和氨基酸序列的同源性能够利用karlin和altschul的算法blast(proc.natl.acad.sci.usa(1993)90:5873-7)确定。基于该算法,开发出了称为blastn或blastx的程序(altschul et al.,j.mol.biol.(1990)215:403-10)。在基于blast利用blastn分析碱基序列时,参数例如设为score=100、wordlength=12。另外,在基于blast利用blastn分析氨基酸序列时,参数例如设为score=50、wordlength=3。在使用blast和gapped blast程序时,使用各程序的默认参数。这些分析方法的具体方法众所周知(参照ncbi(national center for biotechnology information,美国国家生物技术信息中心)的blast(basic local alignment search tool,基本局部比对搜索工具)的网站;http://www.ncbi.nlm.nih.gov)。
[0485]
包含抗t细胞抗原结合分子的药物组合物
[0486]
在另一观点中,本公开提供一种药物组合物,其含有抗t细胞抗原结合分子、优选包含如下结构域的双特异性抗体作为有效成分:(1)包含具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区的结构域、(2)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(3)包含对于fcγ受体的结合活性下降的fc区的结构域。另外,本公开涉及含有该抗t
细胞抗原结合分子作为有效成分的诱导细胞杀伤的药物组合物。本公开的药物组合物诱导该细胞杀伤、特别是t细胞依存性细胞杀伤,优选为对罹患了预防或治疗需要该活性的疾病的个体或有可能复发的个体施用。
[0487]
如上所述,人磷脂酰肌醇蛋白聚糖3(gpc3)是在癌细胞中特异性地表达的癌抗原。因此,以由包含具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区的结构域构成的抗t细胞抗原结合分子作为有效成分的药物组合物,优选在患癌症或有可能复发的个体中,以其治疗和预防中的任一者或两者为目的施用。即,本公开提供一种药物组合物。所述药物组合物含有包含如下结构域的双特异性抗体作为有效成分:(1)包含具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区的结构域、(2)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(3)包含对于fcγ受体的结合活性下降的fc区的结构域。所述药物组合物用于和vegf抑制剂一同施用,用于癌症的治疗和预防中的任一者或两者。所述药物组合物用于选自所述药物组合物施用引起的crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。
[0488]
另外,本公开涉及一种药物组合物的制备。所述药物组合物将包含如下结构域的双特异性抗体:(1)包含具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区的结构域、(2)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(3)包含对于fcγ受体的结合活性下降的fc区的结构域;和vegf抑制剂一同施用,用于癌症的治疗和预防中的任一者或两者。所述药物组合物用于选自所述药物组合物施用引起的crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。
[0489]
或者,本公开涉及一种方法。所述方法将包含如下结构域的双特异性抗体:(1)包含具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区的结构域、(2)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(3)包含对于fcγ受体的结合活性下降的fc区的结构域;和vegf抑制剂一同施用而用于癌症的治疗和预防中的任一者或两者。所述方法用于选自所述药物组合物施用引起的crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。
[0490]
进一步地,本公开提供包含如下结构域的双特异性抗体:(1)包含具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区的结构域、(2)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(3)包含对于fcγ受体的结合活性下降的fc区的结构域;在和vegf抑制剂一同施用的癌症的治疗和预防的任一者或两者中的应用中的、所述vegf抑制剂用于选自所述双特异性抗体施用引起的crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合的应用。
[0491]
因此,在本公开的优选实施方案中,可以包括在施用药物组合物前鉴定表达gpc3的患癌症对象的工序。从生物体采集癌组织,特定采集组织中所包含的癌细胞,确定其gpc3的表达水平的方法众所周知。根据需要,作为试样的细胞的gpc表达水平与正常组织中的gpc3的表达水平相比更高时,也可以判断为gpc3的表达水平高。用于比较表达水平的优选的正常组织是与癌细胞来源的组织(脏器)相同的组织(脏器)的正常细胞。
[0492]
进一步地,具体来说,在本公开的一些实施方案中,提供一种方法。所述方法包括:鉴定gpc3的表达水平高的患癌症对象的工序以及将包含如下结构域的双特异性抗体:(1)包含具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区的结构域、(2)包含具有t细胞受体
复合体结合活性的抗体可变区的结构域、及(3)包含对于fcγ受体的结合活性下降的fc区的结构域;和vegf抑制剂一同向经鉴定了的对象施用的工序,用于癌症的治疗和预防中的任一者或两者。所述方法用于选自所述双特异性抗体施用引起的crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。
[0493]
另外,在本公开中,含有包含:
[0494]
(1)包含具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区的结构域、
[0495]
(2)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及
[0496]
(3)包含对于fcγ受体的结合活性下降的fc区的结构域的多特异性抗原结合分子作为有效成分细胞杀伤诱导剂和细胞增殖抑制剂也可表现为:包括对个体施用该抗t细胞抗原结合分子的工序的诱导细胞杀伤的方法;或该抗t细胞抗原结合分子在细胞杀伤诱导剂和细胞增殖抑制剂的制备中的用途。
[0497]
本公开中,“含有包含:(1)包含具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区的结构域、(2)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(3)包含对于fcγ受体的结合活性下降的fc区的结构域的多特异性抗原结合分子作为有效成分”意指包含该抗t细胞抗原结合分子作为主要活性成分,并不限制该抗t细胞抗原结合分子的含有率。
[0498]
另外,本发明的抗t细胞抗原结合分子、优选为双特异性抗体可根据需要封入到微胶囊(羟甲基纤维素、明胶、聚[甲基丙烯酸甲酯]等微胶囊)中,制成胶体药物递送系统(脂质体、白蛋白微球、微乳胶、纳米粒子和纳米胶囊等)(参照
″
remington’s pharmaceutical science 16
th edition
″
,oslo ed.(1980)等)。进一步地,将药剂制成缓释性药剂的方法也众所周知,该方法能够应用于本发明的抗t细胞抗原结合分子(j.biomed.mater.res.(1981)15,267-277、chemtech.(1982)12,98-105、美国专利第3773719号、欧州专利公开公报ep58481号
·
ep133988号、biopolymers(1983)22,547-556)。
[0499]
本公开的包含抗t细胞抗原结合分子的药物组合物能够以口服、非肠道施用的任一种对患者施用。优选为非肠道施用。作为该施用方法,具体可列举:注射施用、经鼻施用、经肺施用、经皮施用等。作为注射施用,例如可列举:静脉内注射、肌肉注射、腹腔内注射、皮下注射等。例如通过注射施用能够全身或局部地施用本发明的药物组合物、或细胞杀伤诱导剂和细胞增殖抑制剂。另外,可以根据患者的年龄、症状适当地选择施用方法。作为施用量,例如能够在每次施用每1kg体重0.0001mg至1000mg的范围内选择施用量。或者,例如能够在每位患者0.001mg/身体至100000mg/身体的范围内选择施用量。但是,本发明的药物组合物、或细胞杀伤诱导剂和细胞增殖抑制剂。
[0500]
并不限于这些施用量。
[0501]
本公开的包含抗t细胞抗原结合分子的药物组合物可以根据常规方法进行制剂化(例如remington
′
s pharmaceutical science,latest edition,mark publishing company,easton,u.s.a),也可同时包含医药上可接受的载体或添加物。例如可列举:表面活性剂、赋形剂、着色料、香料、防腐剂、稳定剂、缓冲剂、悬浮剂、等张剂、结合剂、崩解剂、润滑剂、流动性促进剂、矫味剂等。进一步地,并不限于这些,可适当地使用其他常用的载体。具体来说,可列举如下作为载体:轻质无水硅酸、乳糖、结晶纤维素、甘露醇、淀粉、羧甲基纤维素钙、羧甲基纤维素钠、羟丙基纤维素、羟丙基甲基纤维素、聚乙烯醇缩乙醛二乙氨基乙
酸酯、聚乙烯基吡咯烷酮、明胶、中链脂肪酸三甘油酯、聚氧乙烯硬化蓖麻油60、白糖、羧甲基纤维素、玉米淀粉、无机盐类等。
[0502]
在一个实施方案中,本公开涉及一种药物组合物。所述药物组合物包含抗t细胞抗原结合分子、例如双特异性抗体、优选和癌抗原及cd3结合的双特异性抗体,用于和vegf抑制剂的联合疗法中使用。所述药物组合物用于选自所述双特异性抗体施用引起的crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。在一个实施方案中,vegf抑制剂可以选自由例如抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂组成的组。其中,和vegf或者vegfr1或vegfr2结合的抗体为优选的vegf抑制剂。具体来说,贝伐单抗(bevacizumab)为人源化抗vegf抗体,或者雷莫卢单抗(ramucirumab)为抗vegfr2人抗体。除此之外,如阿柏西普(aflibercept)以vegf作为靶标开发的分子靶向药物也是vegf抑制剂的优选例。该联合疗法的详细情况揭示在本说明书的“v.联合疗法”中。
[0503]
iii.vegf抑制剂
[0504]
在一个实施方案中,“vegf抑制剂”或“vegf拮抗剂”是指能够抑制vegf,使vegf失活,或减少其表达水平或活性水平的物质。vegf抑制剂例如为如下化合物、例如拮抗剂,该化合物和vegf结合,部分或全面地阻断、减少、预防其活性,使激活延迟、失活、脱敏,或下调其活性或者表达。在另一例中,vegf抑制剂为如下化合物,该化合物通过和vegf的受体结合,或者阻碍vegf对受体的结合,部分或全面地阻断、减少、预防vegf的活性,使激活延迟、失活、脱敏,或下调其活性。vegf抑制剂包含但并不限定于抗原结合分子、抗体、抗体衍生物、抗体片段、可溶性受体等这类多肽抑制剂、它们的衍生物、以及sirna或反义rna等核酸抑制剂、它们的衍生物、可溶性因子的基因改造型、例如具有变更后的活性的型、以及天然存在和合成的可溶性因子拮抗剂、小分子化合物。
[0505]
在一个实施方案中,vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上vegf抑制剂。在一个实施方案中,vegf抑制剂为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白或酪氨酸激酶抑制剂中的1种以上信号转导因子或和其受体结合的抗体、抗体衍生物或抗体片段。
[0506]
vegf信号转导抑制剂
[0507]
在一个实施方案中,vegf抑制剂为vegf信号转导的抑制剂、例如vegf或vegf受体的抑制剂。在一个实施方案中,抑制剂也可为抗vegf抗原结合分子、抗vegf抗体(包含嵌合抗vegf抗体、人源化抗vegf抗体、人抗vegf抗体)、其抗原结合片段或抗体衍生物。在另一个实施方案中,抑制剂也可为抗vegf受体(vegfr)抗原结合分子、抗vegfr抗体(包含嵌合抗vegfr抗体、人源化抗vegfr抗体、人抗vegfr抗体)或其抗原结合片段或抗体衍生物。在一个实施方案中,这些抑制剂也可为能够阻断vegf信号转导的可溶性vegf或其片段。在进一步的实施方案中,vegf受体或其片段也可为和异种域、例如fc域融合的融合蛋白、例如vegfr-fc融合蛋白。
[0508]
在一个实施方案中,抗vegf抗体例如包含贝伐单抗(bevacizumab)或雷珠单抗(ranibizumab)。在另一个实施方案中,抗vegf受体抗体例如包含雷莫卢单抗(ramucirumab)。在一个实施方案中,vegf信号转导的抑制剂包含阿柏西普(afiibercept)
等重组融合蛋白。
[0509]
贝伐单抗(bevacizumab)
[0510]
贝伐单抗(bevacizumab)为人源化抗vegf抗体。贝伐单抗是以日本医药品通用名称(japanese accepted names for pharmaceuticals,简称jan)贝伐单抗或cas registry编号216974-75-3或inn名称贝伐单抗(bevacizumab)表示的抗体。贝伐单抗(bevacizumab)也是基因重组人源化单克隆抗体,由小鼠抗人血管内皮生长因子(vegf)单克隆抗体的互补性决定部、人构架部和人igg1的恒定部组成。贝伐单抗(bevacizumab)由中国仓鼠卵巢细胞产生。贝伐单抗(bevacizumab)是由2条h链(γ1链)和2条l链(κ链)构成的糖蛋白(分子量:约149000),所述h链(γ1链)由453个氨基酸残基组成,所述l链(κ链)由214个氨基酸残基组成。“贝伐单抗(bevacizumab)”中还包括生物仿制药(biosimilar)的贝伐单抗(bevacizumab)。
[0511]
包含vegf抑制剂的药物组合物
[0512]
在另一观点中,本公开提供一种药物组合物,其含有vegf抑制剂、优选针对vegf或其受体的抗体、进一步优选贝伐单抗(bevacizumab)或雷莫卢单抗(ramucirumab)作为有效成分。另一方面,本公开提供一种药物组合物,其含有包含vegf受体的细胞外结构域的融合蛋白、优选阿柏西普(aflibercept)作为有效成分。另外,本公开涉及一种药物组合物,其含有vegf抑制剂作为有效成分,用于选自细胞因子释放综合征(crs)和细胞因子释放的任一者或两者症状的预防、减轻和治疗中的任一目的或它们的组合。本公开的药物组合物优选对如下个体施用,该个体有可能发生crs或细胞因子释放、和/或发生crs或crs的征兆而需要治疗。在本公开的一些实施方案中,导致(或将来导致)对象中的crs或细胞因子释放的机制是任意的。也就是说,无论是何种原因,对于观察到crs或细胞因子释放或者预测到发生的对象,都可以施用该vegf抑制剂。例如,施用某些药剂有可能导致crs或细胞因子释放时,可以选择施用了(或施用)该药剂的对象而施用vegf抑制剂。例如,对过去施用某些药剂而观察到crs或细胞因子释放的对象,再次施用相同的药剂时,有可能导致crs或细胞因子释放。
[0513]
在本公开的一些实施方案中,提供一种工序和vegf抑制剂。所述工序从过去施用某些药剂而观察到crs或细胞因子释放的对象中,选择预定施用相同的药剂或已经施用相同的药剂的对象。所述vegf抑制剂用于和所述药剂一同向该对象施用。或者,本公开提供vegf抑制剂的应用。所述vegf抑制剂为了对过去施用某些药剂而观察到crs或细胞因子释放的对象施用相同的药剂,和所述药剂一同向该对象施用。另外,本公开提供一种方法,其包括:从过去施用某些药剂而观察到crs或细胞因子释放的对象中,选择施用相同的药剂的对象的工序;及和所述药剂一同向该对象施用vegf抑制剂的工序,用于选自预防、减轻和治疗选自施用相同的药剂导致的crs和细胞因子释放中的至少一种症状中的任一目的或它们的组合。根据本公开,作为在对象中有可能导致crs或细胞因子释放的处置,可列举向对象施用抗t细胞抗原结合分子、例如双特异性抗体、优选和癌抗原及cd3结合的双特异性抗体。
[0514]
作为本公开中的含有vegf抑制剂作为有效成分的药物组合物能够使用于选自预防或减轻、治疗crs或细胞因子释放的任一者或两者中的任一目的或它们的组合的机制,通过抑制vegr信号而可抑制il-6的释放,但并不限于此。作为本公开中的含有vegf抑制剂作为有效成分的药物组合物能够使用于选自预防或减轻、治疗crs中的任一目的或它们的组
合的另一机制,通过vegr抑制剂,可抑制血管透过性,可抑制细胞因子从血管向组织的浸透,但并不限于此。
[0515]
因此,在本公开中,含有vegf抑制剂作为有效成分的药物组合物也可表现为:用于选自预防、减轻和治疗伴随抗t细胞抗原结合分子的施用的crs和细胞因子释放的任一者或两者中的任一目的或它们的组合的方法,该方法包括对个体施用该vegf抑制剂的工序;或者该vegf抑制剂在制备医药中的应用,该医药用于选自伴随抗t细胞抗原结合分子的施用的crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。
[0516]
本公开中,“含有vegf抑制剂作为有效成分”意指包含该vegf抑制剂作为主要活性成分,并不限制该vegf抑制剂的含有率。
[0517]
另外,本发明的vegf抑制剂可根据需要封入到微胶囊(羟甲基纤维素、明胶、聚[甲基丙烯酸甲酯]等微胶囊)中,制成胶体药物递送系统(脂质体、白蛋白微球、微乳胶、纳米粒子和纳米胶囊等)(参照
″
remington’spharmaceutical science 16
th edition
″
,oslo ed.(1980)等)。进一步地,将药剂制成缓释性药剂的方法也众所周知,该方法能够应用于本发明的vegf抑制剂(j.biomed.mater.res.(1981)15,267-277、chemtech.(1982)12,98-105、美国专利第3773719号、欧州专利公开公报ep58481号
·
ep133988号、biopolymers(1983)22,547-556)。
[0518]
本公开的包含vegf抑制剂的药物组合物能够以口服、非肠道施用的任一种对患者施用。优选为非肠道施用。作为该施用方法,具体可列举:注射施用、经鼻施用、经肺施用、经皮施用等。作为注射施用,例如可列举:静脉内注射、肌肉注射、腹腔内注射、皮下注射等。例如通过注射施用能够全身或局部地施用本发明的药物组合物、或细胞杀伤诱导剂和细胞增殖抑制剂。另外,可以根据患者的年龄、症状适当地选择施用方法。作为施用量,例如能够在每次施用每1kg体重0.0001mg至1000mg的范围内选择施用量。或者,例如能够在每位患者0.001mg/身体至100000mg/身体的范围内选择施用量。但是,本发明的药物组合物并不限于这些施用量。
[0519]
在一个实施方案中,当vegf抑制剂为贝伐单抗(bevacizumab)时,有效成分是以每次约5~15mg/kg,例如体重为30kg以上的患者按每次选自5mg/kg或其以下的剂量、7.5mg/kg或其以下的剂量、10mg/kg或其以下的剂量、15mg/kg或其以下的剂量中的剂量,例如经过0.5小时、1小时、2小时、或者3小时以静脉内注射施用。在一个实施方案中,当vegf抑制剂为雷莫卢单抗(ramucirumab)时,有效成分是以每次约4~15mgmg/kg,例如体重为30kg以上的患者按每次8mg/kg或其以下的剂量、10mg/kg或其以下的剂量,例如经过0.5小时、1小时、2小时、或者3小时以静脉内注射施用。在不同的实施方案中,贝伐单抗(bevacizumab)或雷莫卢单抗(ramucirumab)是以crs的治疗为目的而施用,当对患者施用第1次的贝伐单抗(bevacizumab)或雷莫卢单抗(ramucirumab)后crs的症状仍没有改善时,最多能够追加3次贝伐单抗(bevacizumab)或雷莫卢单抗(ramucirumab)的施用。在一例中,在这样持续施用贝伐单抗(bevacizumab)或雷莫卢单抗(ramucirumab)时,必须从上次施用起隔开8小时以上的间隔。
[0520]
本公开的包含vegf抑制剂的药物组合物可以根据常规方法进行制剂化(例如remington
′
s pharmaceutical science,latest edition,mark publishing company,easton,u.s.a),也可同时包含医药上可接受的载体或添加物。例如可列举:表面活性剂、赋
形剂、着色料、香料、防腐剂、稳定剂、缓冲剂、悬浮剂、等张剂、结合剂、崩解剂、润滑剂、流动性促进剂、矫味剂等。进一步地,并不限于这些,可适当地使用其他常用的载体。具体来说,可列举如下作为载体:轻质无水硅酸、乳糖、结晶纤维素、甘露醇、淀粉、羧甲基纤维素钙、羧甲基纤维素钠、羟丙基纤维素、羟丙基甲基纤维素、聚乙烯醇缩乙醛二乙氨基乙酸酯、聚乙烯基吡咯烷酮、明胶、中链脂肪酸三甘油酯、聚氧乙烯硬化蓖麻油60、白糖、羧甲基纤维素、玉米淀粉、无机盐类等。
[0521]
在一个实施方案中,本公开涉及如下药物组合物,其包含vegf抑制剂、优选为vegf抑制剂、进一步优选为针对vegf或其受体的抗体、最优选为贝伐单抗(bevacizumab)或雷莫卢单抗(ramucirumab),且用于和抗t细胞抗原结合分子的联合疗法中使用。进一步地,本公开涉及如下药物组合物,其含有由包含vegf受体的配体结合位点的融合蛋白构成的vegf抑制剂、优选阿柏西普(aflibercept)作为有效成分,且用于和抗t细胞抗原结合分子的联合疗法中使用。在一个实施方案中,抗t细胞抗原结合分子例如为双特异性抗体,优选为和癌抗原及cd3结合的双特异性抗体。该联合疗法的详细情况揭示在本说明书的“v.联合疗法”中。
[0522]
iv.细胞因子释放综合征(cytokine release syndrome;crs)
[0523]
在一个实施方案中,细胞因子释放综合征(crs)为施用药剂、例如抗体医药品(例如抗t细胞抗体)或t细胞医药品(例如嵌合抗原受体(chimeric antigen receptor,car)t细胞(car-t细胞))时可能产生的严重且可能威胁生命的副作用。通过施用抗体医药品和t细胞医药品,体内的免疫应答被超出需要地激活,释放出炎症性细胞因子等,由此产生发冷、恶心、倦怠感、头痛、发烧、心跳过速、血压变动等各种症状。有时特别将重症的情况称为细胞因子风暴。crs为大量淋巴细胞和/或骨髓性细胞激活时释放炎症性细胞因子时的高水平免疫激活的结果。crs的严重程度和症状开始的时间点可根据个体中的免疫细胞激活的规模、所施用的药剂的种类、和/或全身肿瘤组织量的程度而变化。在用于癌症的t细胞疗法时,例如在具有体内的t细胞增殖的峰时,症状的开始典型地在t细胞疗法施用后的数天至数周之间。例如可参照lee et al.blood.124.2(2014):188-95。
[0524]
在一个实施方案中,crs的症状也可包括神经毒性、弥散性血管内凝血、心功能障碍、成人呼吸窘迫综合征、肾衰竭、和/或肝衰竭。例如,crs的症状也可包括伴有或者不伴有发冷的发烧
·
高烧、疲劳、不适、肌肉痛、呕吐、头痛、恶心、食欲不振、关节痛、腹泻、发疹、缺氧症、呼吸急促、低血压、脉压增大、心输出量的潜在性下降(后期)、心输出量的增加(前期)、高氮血症、伴有或者不伴有出血的低纤维蛋白原血症、d-二聚体的上升、高胆红素血症、转氨酶升高、混乱、谵妄、精神状态的变化、幻觉、震颤、精神状态的变化、幻觉、震颤(颤抖)、痉挛、步态改变、唤词困难、明显的失语症、或认知症。
[0525]
在一个实施方案中,crs是以个体中的一些细胞因子的浓度上升为特征。在一个实施方案中,细胞因子包含但不限于il-1β、il-2、il-4、il-5、il-6、il-8、il-10、il-12、il-13、il-15、il-17、il-1ra、il-2r、ifn-α、ifn-γ、mip-1α、mip-1β、mcp-1、tnfα、gm-csf、g-csf、cxcl9、cxcl10、cxcr因子、vegf、rantes、嗜酸性粒细胞趋化因子、egf、hgf、fgf-β、cd30、cd30l、cd40、cd40l、铁蛋白、rage。细胞因子优选包含il-6、il-1β、或tnf-α、或它们的任意组合。细胞因子最优选为il-6。在一个实施方案中,具有大肿瘤量的患者的细胞因子综合征的发生率和严重程度高。
[0526]
在一个实施方案中,本领域技术人员应可理解“细胞因子浓度”这一术语包含浓度的测定值、倍数变化的大小、百分比(%)变化的大小、或变化比例的大小。进一步地,测定血液、唾液、血清、尿、血浆、和/或血清中的细胞因子的方法在该领域中众所周知。
[0527]
crs的严重程度(等级)
[0528]
在一个实施方案中,crs能够分类为1~5的严重程度(grade、等级)。在一个实施方案中,关于1级crs,只需要对症处置(例如恶心、发烧、疲劳、肌肉痛、不适、头痛),症状不会威胁生命。关于2级crs,症状需要适度的干预,一般对适度的干预有应答。患有2级crs的个体会发生对液体或者1种低剂量升压剂有应答的低血压症状;或者他们会发生2级脏器毒性或者对低流量的氧气(不足40%的氧气)有应答的轻度呼吸器症状。在患有3级crs的个体中,低血压一般无法以液体疗法或1种低剂量升压剂逆转。这些个体一般需要更低流量的氧气,患有3级脏器毒性(例如肾或者心功能障碍或血液凝固障碍)和/或4级转氨酶升高。患有3级crs的个体需要更积极的干预、例如40%以上的氧气、高剂量升压剂、和/或多种升压剂。患有4级crs的个体罹患包括4级脏器毒性或需要机械人工通气在内的立即威胁生命的症状。具有4级crs的个体一般不患有转氨酶升高。在患有5级crs的个体中,毒性会导致死亡。
[0529]
在一个实施方案中,crs的分级是基于如下标准进行:表6所示的不良事件通用术语标准v4.03(common terminology criteria for adverse events(ctcae)v4.03)、表7所示的不良事件通用术语标准v5.0(common terminology criteria for adverse events(ctcae)v5.0)、表8所示的2014年的lee的标准(lee dw,et al.current concepts in the diagnosis and management of cytokine release syndrome.blood,124(2014),pp.188-195)、表9所示的2019年的astct crs共识分级(lee dw,et al.astct consensus grading for cytokine release syndrome and neurologic toxicity associated with immune effector cells.biol blood marrow transplant.2019apr;25(4):625-638)、penn标准、mskcc标准、cartox标准(上述biol blood marrow transplant.2019 apr;25(4):625-638)。crs的分级优选基于ctcae v 4.03、ctcae v 5.0、或2014年的lee标准进行。除非另有规定,本说明书中所使用的crs是指依据表8的基准(2014年的lee的标准)的crs。
[0530]
[表6]
[0531]
ctcae v 4.03
[0532]
[0533][0534]
[表7]
[0535]
ctcae v 5.0
[0536][0537]
[表8]
[0538]
lee的标准
[0539][0540][0541]
[表9]
[0542]
astct crs共识分级
[0543][0544]
在一个实施方案中,crs的症状在药剂施用开始后的数分钟以内、数小时以内、或者数天以内发生,但一部分也可见迟发性症状。优选为crs的症状在抗t细胞抗原结合分子施用开始后的约96小时以内、约72小时以内、或者约48小时以内发生,进一步优选为在施用抗t细胞抗原结合分子的当天至次日发生。在另一个实施方案中,crs的症状的严重程度和细胞因子的峰浓度相关。
[0545]
crs的征兆
[0546]
在一个实施方案中,crs的征兆是指成为上述crs(不论等级)的先兆的类似crs的症状。作为具体例子,包括但不限于在施用抗t细胞抗原结合分子后最初发生的发烧或低血压。
[0547]
crs的治疗
[0548]
在一个实施方案中,作为crs的治疗方法,可列举:vegf抑制剂、巴多昔芬、sgp130阻断剂、血管活性药剂、全身性肾上腺皮质激素(例如皮质类固醇)、免疫抑制剂、及机械人工通气。
[0549]
在一个实施方案中,为选自抗vegf抗原结合分子、抗vegfr1抗原结合分子、抗
vegfr2抗原结合分子、包含vegf受体或其片段的融合蛋白和酪氨酸激酶抑制剂中的1种以上vegf抑制剂或拮抗剂抑制剂。优选的vegf抑制剂揭示在本说明书的“iii.vegf抑制剂”中。
[0550]
在一个实施方案中,当vegf抑制剂为贝伐单抗(bevacizumab)时,有效成分是以每次约5~15mg/kg,例如体重为30kg以上的患者按每次选自5mg/kg或其以下的剂量、7.5mg/kg或其以下的剂量、10mg/kg或其以下的剂量、15mg/kg或其以下的剂量中的剂量,例如经过0.5小时、1小时、2小时、或者3小时以静脉内注射施用。在一个实施方案中,当vegf抑制剂为雷莫卢单抗(ramucirumab)时,有效成分是以每次约4~15mgmg/kg,例如体重为30kg以上的患者按每次8mg/kg或其以下的剂量、10mg/kg或其以下的剂量,例如经过0.5小时、1小时、2小时、或者3小时以静脉内注射施用。在不同的实施方案中,贝伐单抗(avastin)或雷莫卢单抗(lucentis)是以crs的治疗为目的而施用,当施用第1次后crs的症状仍没有改善时,最多能够追加3次贝伐单抗(avastin)或雷莫卢单抗(lucentis)的施用。在一例中,在这样持续施用贝伐单抗(avastin)或雷莫卢单抗(lucentis)时,必须从上次施用起隔开8小时以上的间隔。
[0551]
作为例示性血管活性药剂,可列举:血管紧张素-11、内皮素-1、α肾上腺素激动剂、前列腺素类、磷酸二酯酶抑制剂、内皮素拮抗剂、促进血液循环药(例如肾上腺素、多巴酚丁胺、异丙肾上腺素、麻黄碱)、升压剂(例如正肾上腺素、血管升压素、间羟胺、血管升压素、亚甲基蓝)、强心性血管扩张药(例如甲氰吡酮、左西孟旦)和多巴胺,但并不限定于这些。
[0552]
作为例示性升压剂,可列举:去甲肾上腺素、多巴胺、苯肾上腺素、肾上腺素和血管升压素,但并不限定于这些。在一个实施方案中,升压剂包含高剂量升压剂和低剂量升压剂。在一个实施方案中,高剂量升压剂包含下述:20μg/min以上的去甲肾上腺素单剂疗法、10μg/kg/min以上的多巴胺单剂疗法、200μg/min以上的苯肾上腺素单剂疗法、和/或10μg/min以上的肾上腺素单剂疗法中的1种或多种。在一部分实施方案中,当个体在血管升压素施用中的情况下,高剂量升压剂包含血管升压素+10μg/min以上的去甲肾上腺素等效物(此处,去甲肾上腺素等效物剂量=[去甲肾上腺素(μg/min)]+[多巴胺(μg/kg/min)/2]+[肾上腺素(μg/min)]+[苯肾上腺素(μg/min)/10])。在一部分实施方案中,当个体在施用组合升压剂(非血管升压素)中的情况下,高剂量升压剂包含20μg/min以上的去甲肾上腺素等效物(此处,去甲肾上腺素等效物剂量=[去甲肾上腺素(μg/min)]+[多巴胺(μg/kg/min)/2]+[肾上腺素(μg/min)]+[苯肾上腺素(μg/min)/10])。例如可参照上述。
[0553]
在一个实施方案中,低剂量升压剂是以小于上述关于高剂量升压剂所列举的1种或多种剂量的剂量施用的升压剂。
[0554]
作为例示性皮质类固醇,可列举:地塞米松、氢化可的松和甲泼尼龙,但并不限定于这些。在一个实施方案中,以口服或静脉注射来使用0.5mg/kg的剂量的地塞米松。在一个实施方案中,以口服或静脉注射来使用每次剂量8~20mg的地塞米松、其药学上可接受的盐、或其衍生物。地塞米松的施用量并不限定于上述,本领域技术人员应可理解,可以根据个体状态或crs的严重程度适当地变更。
[0555]
作为例示性免疫抑制剂,可列举tnf-α的抑制剂或il-1的抑制剂。在一个实施方案中,tnf-α的抑制剂包含抗tnf-α抗体、例如单克隆抗体、例如英夫利西单抗(infliximab)。在一个实施方案中,tnf-α的抑制剂包含可溶性tnf-α受体(例如依那西普(etanercept))。
在一个实施方案中,il-1或il-1r抑制剂包含阿那白滞素(anakinra)。
[0556]
v.联合疗法
[0557]
在一个实施方案中,本公开涉及一种联合使用,其是任意的药剂和vegf抑制剂的联合使用,用于选自该药剂施用引起的crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。所述药剂是在施用对象中成为crs和细胞因子释放的任一者或两者的原因的药剂。对于本公开中的联合疗法,也可以如下定义。
[0558]
即,联合疗法为药剂a和药剂b的联合疗法。药剂a具有通过向对象施用而可诱导crs和细胞因子释放的任一者或两者的作用,药剂b是vegf抑制剂。所述联合疗法用于选自药剂a施用所诱导的crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。
[0559]
在另一个实施方案中,本公开涉及一种药物组合物,其包含任意的药剂(药剂a),用于和vegf抑制剂(药剂b)的联合疗法中使用。所述药剂是在施用对象中可诱导crs和细胞因子释放的任一者或两者的药剂。所述药物组合物用于选自该药剂施用引起的crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。在进一步的一个实施方案中,本公开涉及一种药物组合物,其包含vegf抑制剂,用于和任意的药剂的联合疗法中使用。所述药剂是在施用对象中可诱导crs和细胞因子释放的任一者或两者的药剂。所述药物组合物用于选自该药剂施用引起的crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。本公开中涉及治疗癌症的方法,其以如下为特征,即,有可能诱导crs和细胞因子释放的任一者或两者的药剂为抗t细胞抗原结合分子时,通过施用vegf抑制剂,实现选自抗t细胞抗原结合分子引起的crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。
[0560]
在本公开中,在施用对象中可诱导crs和细胞因子释放的任一者或两者的药剂是指有可能成为crs和细胞因子释放的任一者或两者的原因的药剂。具体来说,包括作为伴随施用的副作用,报告有诱导crs和细胞因子释放的任一者或两者的药剂。例如,以淋巴细胞作为靶标的药剂是通过其刺激可诱导细胞因子产生的药剂。换言之,具有淋巴细胞刺激性的药剂可成为导致crs和细胞因子释放的任一者或两者的原因。作为此类药剂的例子,可以显示包含抗t细胞抗原结合分子作为有效成分的药剂。
[0561]
在一个实施方案中,通过施用vegf抑制剂,在个体中实现选自crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。因此,本公开可改称为用于选自crs和细胞因子释放的任一者或两者发生的预防、减轻和治疗中的任一目的或它们的组合的方法,该方法包括施用vegf抑制剂。
[0562]
在一个实施方案中,在成为crs和细胞因子释放的任一者或两者的原因的任意药剂的施用前、同时或施用后,对个体皮下或静脉注射vegf抑制剂。优选在所述药剂的施用前、同时或施用后,对个体静脉注射vegf抑制剂。虽然无意限定,但在施用所述药剂前或同时施用时,vegf抑制剂具有预防或减轻伴随施用该药剂的crs和细胞因子释放的任一者或两者的发生的效果。在一个实施方案中,在施用成为crs和细胞因子释放的任一者或两者的原因的任意药剂的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用该药剂前施用vegf抑制剂。或者,在施用该药剂的当天,vegf抑制剂可以和该药剂同时施用(在本公开中,将施用成为crs和细胞因子释放的任一者或两者的原因的任意药剂前的vegf抑制剂的施
用、及和施用该药剂同时进行的vegf抑制剂的施用统称为“vegf抑制剂的预先施用”)。在一个实施方案中,通过预先施用vegf抑制剂,在不明显损害成为crs和细胞因子释放的任一者或两者的原因的任意药剂的药效(例如tdcc(t cell-dependent cellular cytotoxicity;t细胞依赖性细胞毒性)或抗肿瘤效果等)的情况下,预防或减轻伴随施用该药剂的crs的发生。
[0563]
另外,在施用成为crs和细胞因子释放的任一者或两者的原因的任意药剂后、且crs发生前施用vegf抑制剂时,具有预防或减轻之后可能发生的crs的效果。另外,在施用该药剂后,在发生crs或crs的征兆后施用vegf抑制剂时,具有治疗crs,并减轻其症状的效果。
[0564]
因此,本公开提供用于治疗crs和减轻症状的任一者或两者的方法,所述方法包括在成为crs和细胞因子释放的任一者或两者的原因的任意处置后,监测crs的发生,选择出现该征兆的对象并施用vegf抑制剂的工序。如上所述,用于监测crs的发生而了解其征兆的方法众所周知。
[0565]
通过vegf抑制剂实现选自crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合的效果是本公开中首次揭示的作用。因此,本公开提供一种药物组合物,其含有vegf抑制剂,用于选自细胞因子释放综合征(crs)和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。或者,本公开提供vegf抑制剂在制备药物组合物中的应用。所述药物组合物用于选自crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。进一步地,本公开提供vegf抑制剂在选自crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合目的中的应用。并且,本发明提供用于选自crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合的方法,所述方法包括如下工序,即,选择选自发生crs和细胞因子释放的任一者或两者症状的对象、出现其发生征兆的对象、及实施了有可能伴有crs和细胞因子释放的任一者或两者的处置的对象中的一些对象并施用vegf抑制剂。在本公开中,有可能伴有crs和细胞因子释放的任一者或两者的处置中,包括例如抗t细胞抗原结合分子的施用。
[0566]
在一个实施方案中,用于该联合疗法的抗t细胞抗原结合分子是包含:“包含具有t细胞受体复合体结合活性的抗体可变区的结构域”和“包含具有癌抗原结合活性的抗体可变区的结构域”的双特异性抗原结合分子,优选双特异性抗体。在一个实施方案中,双特异性抗体可以具有单链抗体的结构,例如以连接子结合抗体可变区的结构。在一个实施方案中,抗t细胞抗原结合分子进一步包含对于fcγ受体的结合活性下降的fc区。抗t细胞抗原结合分子优选为包含如下结构域的双特异性抗体:(1)包含具有磷脂酰肌醇蛋白聚糖3结合活性的抗体可变区的结构域、(2)包含具有t细胞受体复合体结合活性的抗体可变区的结构域、及(3)包含对于fcγ受体的结合活性下降的fc区的结构域。
[0567]
在一个实施方案中,用于该联合疗法的vegf抑制剂为vegf抑制剂,优选为针对vegf或其受体的抗体,最优选为贝伐单抗(bevacizumab)或雷莫卢单抗(ramucirumab)。在其他实施方案中,用于该联合疗法的vegf抑制剂为包含vegf受体的配体结合位点的融合蛋白,作为其优选例,可列举阿柏西普(aflibercept)。在一个实施方案中,当贝伐单抗(bevacizumab)或雷莫卢单抗(ramucirumab)在施用抗t细胞抗原结合分子前或同时施用时,对人类的成人和儿童,将例如选自5mg/kg~100mg/kg、例如5mg/kg~90mg/kg、5mg/kg~
80mg/kg、5mg/kg~70mg/kg、5mg/kg~60mg/kg、5mg/kg~50mg/kg、5mg/kg~40mg/kg、5mg/kg~30mg/kg、5mg/kg~20mg/kg、5mg/kg~15mg/kg、且例如10mg/kg~100mg/kg、20mg/kg~100mg/kg、30mg/kg~100mg/kg、40mg/kg~100mg/kg、50mg/kg~100mg/kg、60mg/kg~100mg/kg、70mg/kg~100mg/kg、80mg/kg~100mg/kg、90mg/kg~100mg/kg等中的剂量作为每次的剂量而施用贝伐单抗(bevacizumab)或雷莫卢单抗(ramucirumab)。此外,为了避免疑义而阐明,例如在记载为5mg~100mg/kg时,意在将如同5.0mg/kg、5.1mg/kg、5.2mg/kg、5.3mg/kg、5.4mg/kg、49.9mg/kg、50mg/kg、50.1mg/kg、50.2mg/kg、......99.8mg/kg、99.9mg/kg、100mg/kg这样,以0.1mg/kg的变动量包含于5mg~100mg/kg之间的所有施用量分别具体地记载在本说明书中。在一个实施方案中,在施用抗t细胞抗原结合分子前或同时,每次对体重30kg以上的患者施用15mg/kg以下、0.5~15mg/kg、1~15mg/kg、2~15mg/kg、3~15mg/kg、4~15mg/kg的贝伐单抗(bevacizumab)。在一个实施方案中,在施用抗t细胞抗原结合分子前或同时,每次对体重30kg以上的患者施用10mg/kg以下、0.5~10mg/kg、1~10mg/kg、2~10mg/kg、3~10mg/kg、4~10mg/kg的雷莫卢单抗(ramucirumab)。
[0568]
根据本公开,在一些实施方案中,除了所述抗t细胞抗原结合分子和vegf抑制剂的联合使用以外,还可以进一步附加地联合使用免疫检查点抑制剂。“免疫检查点”是指在免疫活性细胞(包含t细胞)上表达,通过和配体结合,向该免疫活性细胞转导抑制免疫应答的信号的分子。免疫检查点及其配体中,例如包含pd-1、ctla-4、tim3、lag3、pd-l1、pd-l2、btnl2、b7-h3、b7-h4、cd48、cd80、2b4、btla、cd160、cd60、cd86、或vista等分子,但并不限于此。在一些实施方案中,本发明中的“免疫检查点抑制剂”是指通过抑制免疫检查点和其配体的结合而抑制由该免疫检查点引起的信号转导的药剂。
[0569]
在本公开的非限定的一个实施方案中,作为免疫检查点抑制剂的优选例,可列举pd1抗体、pdl1抗体、ctla-4抗体、tim3抗体或lag3抗体,但并不限于此。例如,作为pd-1抗体的例子,可列举派姆单抗(pembrolizumab)(cas注册编号:1374853-91-4)、纳武单抗(nivolumab)(cas注册编号:946414-94-4)、medi0680、pdr001、bgb-a317、regn2810、shr-1210、pf-06801591或各种众所周知的pd1抗体。作为pd-l1抗体的例子,可列举阿特珠单抗(atezolizumab)(cas注册编号:1380723-44-3)、阿维鲁单抗(avelumab)(cas注册编号:1537032-82-8)、度伐利尤单抗(durvalumab)(cas注册编号:1428935-60-7)、mdx-1105或各种众所周知的pd-l1抗体。作为ctla-4抗体的例子,可列举伊匹单抗(ipilimumab)(cas注册编号:477202-00-9)、曲美木单抗(tremelimumab)(cas注册编号:745013-59-6)或各种众所周知的ctla-4抗体。作为tim3抗体的例子,可列举mbg452或各种众所周知的tim3抗体。作为lag3抗体的例子,可列举bms-986016、lag525或各种众所周知的lag3抗体。
[0570]
在本公开的一些实施方案中,除了所述抗t细胞抗原结合分子和vegf抑制剂的联合使用以外,进一步附加地联合使用免疫检查点抑制剂时,可以在任何时间向对象施用免疫检查点抑制剂。具体来说,例如,可以在所述抗t细胞抗原结合分子和vegf抑制剂的联合施用之前或之后,施用免疫检查点抑制剂。因此,例如,可以在评估所述抗t细胞抗原结合分子和vegf抑制剂的联合使用或免疫检查点抑制剂中的任一种对癌症的退缩效果之后,附加地施用其他。或者,也可以同时施用上述3剂。
[0571]
本公开的联合疗法可进一步附加地包括施用皮质类固醇。在一个实施方案中,为了预防或减轻伴随抗t细胞抗原结合分子的施用的crs,在施用该抗t细胞抗原结合分子的
日的2天前、1天前、或0天前(当天),在施用该抗t细胞抗原结合分子前,使个体口服或静脉注射皮质类固醇。或者,和施用抗t细胞抗原结合分子同时,使个体口服或静脉注射皮质类固醇(有时将这些称为“皮质类固醇的预先施用”或“类固醇的预先施用”)。优选为除了vegf抑制剂的预先施用,还追加(和vegf抑制剂的预先施用组合)进行皮质类固醇的预先施用。虽然无意限定,但作为优选的皮质类固醇的例子,可列举:地塞米松、氢化可的松和甲泼尼龙。皮质类固醇优选为地塞米松、其药学上可接受的盐、或其衍生物,以口服或静脉注射来施用。地塞米松的施用量并不限定于上述,本领域技术人员应可理解,可以根据个体状态或crs的发生状况等适当地变更。
[0572]
在一个实施方案中,联合疗法是在施用抗t细胞抗原结合分子的当天,依照如下顺序进行的:(1)预先施用皮质类固醇、(2)预先施用vegf抑制剂、(3)施用抗t细胞抗原结合分子。此时,例如在vegf抑制剂施用开始的1小时以上、2小时以上、3小时以上、4小时以上、或5小时以上之前,优选为在2小时以上之前,结束对个体施用皮质类固醇,且在抗t细胞抗原结合分子施用开始的1小时以上、2小时以上、3小时以上、4小时以上、或5小时以上之前,优选为2小时以上之前,结束对个体施用vegf抑制剂。在另一个实施方案中,施用是在施用抗t细胞抗原结合分子的当天,依照如下顺序进行的:(1)预先施用vegf抑制剂、(2)预先施用皮质类固醇、(3)施用抗t细胞抗原结合分子。此时,例如在皮质类固醇施用开始的1小时以上、2小时以上、3小时以上、4小时以上、或5小时以上之前,优选为2小时以上之前,结束对个体施用vegf抑制剂,且在抗t细胞抗原结合分子施用开始的1小时以上、2小时以上、3小时以上、4小时以上、或5小时以上之前,优选为2小时以上之前,结束对个体施用皮质类固醇。
[0573]
在一个不同的实施方案中,本公开的联合疗法不包括皮质类固醇的预先施用。虽然无意限定,但通过预先施用vegf抑制剂,预防或减轻伴随抗t细胞抗原结合分子的施用的crs的发生,不需要为了预防或减轻crs而施用皮质类固醇。
[0574]
本公开的联合疗法可以进一步包括施用托珠单抗(tocilizumab)。在一个实施方案中,为了预防或减轻伴随抗t细胞抗原结合分子的施用的crs,在施用该抗t细胞抗原结合分子的日的2天前、1天前、或0天前(当天),在施用该抗t细胞抗原结合分子前,对个体静脉注射托珠单抗(tocilizumab)。或者,和施用抗t细胞抗原结合分子同时,对个体静脉注射托珠单抗(tocilizumab)(有时将这些称为“托珠单抗(tocilizumab)的预先施用”或“托珠单抗(tocilizumab)的预先施用”)。优选为除了vegf抑制剂的预先施用,还追加(和vegf抑制剂的预先施用组合)进行托珠单抗(tocilizumab)的预先施用。托珠单抗(tocilizumab)的施用量并不限定于上述,本领域技术人员应可理解,可以根据个体状态或crs的发生状况等适当地变更。
[0575]
在一个实施方案中,联合疗法是在施用抗t细胞抗原结合分子的当天,依照如下顺序进行的:(1)预先施用托珠单抗(tocilizumab)、(2)预先施用vegf抑制剂、(3)施用抗t细胞抗原结合分子。此时,例如在vegf抑制剂施用开始的1小时以上、2小时以上、3小时以上、4小时以上、或5小时以上之前,优选为在2小时以上之前,结束对个体施用托珠单抗(tocilizumab),且在抗t细胞抗原结合分子施用开始的1小时以上、2小时以上、3小时以上、4小时以上、或5小时以上之前,优选为2小时以上之前,结束对个体施用vegf抑制剂。在另一个实施方案中,施用是在施用抗t细胞抗原结合分子的当天,依照如下顺序进行的:(1)预先施用vegf抑制剂、(2)预先施用托珠单抗(tocilizumab)、(3)施用抗t细胞抗原结合分子。此
时,例如在托珠单抗(tocilizumab)施用开始的1小时以上、2小时以上、3小时以上、4小时以上、或5小时以上之前,优选为2小时以上之前,结束对个体施用vegf抑制剂,且在抗t细胞抗原结合分子施用开始的1小时以上、2小时以上、3小时以上、4小时以上、或5小时以上之前,优选为2小时以上之前,结束对个体施用托珠单抗(tocilizumab)。
[0576]
在一个不同的实施方案中,本公开的联合疗法不包括托珠单抗(tocilizumab)的预先施用。虽然无意限定,但通过预先施用vegf抑制剂,预防或减轻伴随抗t细胞抗原结合分子的施用的crs的发生,不需要为了预防或减轻crs而施用托珠单抗(tocilizumab)。
[0577]
本领域技术人员当然能够理解,关于本公开中的抗t细胞抗原结合分子、vegf抑制剂、和/或其他药剂的任一者,施用时间点、施用间隔、和施用量可分别伴有一定的“允许范围”,且本领域技术人员能够适当地确定该允许范围。例如基于个体的症状等,依据医生的判断适时增减抗t细胞抗原结合分子、vegf抑制剂、和/或其他药剂的施用间隔,或者适当地增减施用量在上述“允许范围”的范围内。
[0578]
以下,说明包含抗t细胞抗原结合分子和vegf抑制剂的联合疗法的非限定性具体例子。
[0579]
伴随vegf抑制剂的预先施用的抗t细胞抗原结合分子的施用
[0580]
在一个实施方案中,本公开提供一种药物组合物,其包含抗t细胞抗原结合分子,且用于和vegf抑制剂的联合疗法中使用。在不同的实施方案中,本公开提供一种药物组合物,其包含vegf抑制剂,且用于和抗t细胞抗原结合分子的联合疗法中使用。在进一步的实施方案中,在施用上述抗t细胞抗原结合分子前或同时对个体施用vegf抑制剂。虽然无意限定,但vegf抑制剂在施用抗t细胞抗原结合分子前或同时施用时,具有预防或减轻伴随抗t细胞抗原结合分子的施用的crs的发生的效果。在一个实施方案中,在施用抗t细胞抗原结合分子的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用上述双特异性抗体前施用vegf抑制剂。或者,在施用抗t细胞抗原结合分子的当天,vegf抑制剂和上述抗t细胞抗原结合分子同时施用。在一个实施方案中,通过预先施用vegf抑制剂,在不明显损害抗t细胞抗原结合分子的药效(例如tdcc(tcell-dependent cellular cytotoxicity;t细胞依赖性细胞毒性)或抗肿瘤效果等)的情况下,预防或减轻伴随施用该抗t细胞抗原结合分子的crs的发生。
[0581]
vi.抗磷脂酰肌醇蛋白聚糖3(gpc3)/t细胞受体复合体双特异性抗体和vegf抑制剂的联合疗法
[0582]
在一个实施方案中,本公开提供一种药物组合物,其包含抗gpc3/t细胞受体复合体双特异性抗体,且用于和vegf抑制剂的联合疗法中使用。在不同的实施方案中,本公开提供一种药物组合物,其包含vegf抑制剂,且用于和抗磷脂酰肌醇蛋白聚糖3(gpc3)/t细胞受体复合体双特异性抗体的联合疗法中使用。在一个实施方案中,在上述抗gpc3/t细胞受体复合体双特异性抗体的施用前或同时,对个体施用vegf抑制剂。
[0583]
虽然无意限定,但vegf抑制剂在施用抗gpc3/t细胞受体复合体双特异性抗体前或同时施用时,具有预防或减轻伴随抗gpc3/t细胞受体复合体双特异性抗体的施用的crs的发生的效果。在一个实施方案中,在施用抗gpc3/t细胞受体复合体双特异性抗体的6天前、5天前、4天前、3天前、2天前、1天前或当天,在施用上述双特异性抗体前施用vegf抑制剂。或者,在抗gpc3/t细胞受体复合体双特异性抗体的施用当天,vegf抑制剂和上述双特异性抗
体同时施用(vegf抑制剂的预先施用)。作为包括vegf抑制剂的预先施用的联合疗法的具体例子,请参照上述各种实施方案。在一个实施方案中,通过预先施用vegf抑制剂,在不明显损害抗gpc3/t细胞受体复合体双特异性抗体的药效(例如tdcc(tcell-dependent cellular cytotoxicity;t细胞依赖性细胞毒性)和抗肿瘤效果等)的情况下,预防或减轻伴随该抗gpc3/t细胞受体复合体双特异性抗体的施用的crs的发生。
[0584]
vii.制备方法及试剂盒
[0585]
另外,本发明还提供一种用于本发明的方法的试剂盒,其包含本发明的抗t细胞抗原结合分子、或者利用本发明的制备方法制备的抗t细胞抗原结合分子。此外,该试剂盒中可预先包装有药学上可接受的载体、介质、记载有使用方法的使用说明等。
[0586]
另外,本发明还涉及用于本发明的方法的本发明的抗t细胞抗原结合分子、或者利用本发明的制备方法制备的抗t细胞抗原结合分子。
[0587]
另外,本发明提供用于本发明方法中使用的试剂盒,其包含vegf抑制剂。此外,该试剂盒中可预先包装有药学上可接受的载体、介质、记载有使用方法的使用说明等。
[0588]
另外,本发明涉及用于本发明方法中使用的vegf抑制剂。
[0589]
另外,本发明也涉及编码这些分子的核酸;导入了该核酸的载体;包含该核酸或该载体的细胞;通过培养该细胞来制备该分子的方法;及利用该方法制备的抗t细胞抗原结合分子或vegf抑制剂。
[0590]
例如,通过将编码抗t细胞抗原结合分子的核酸、或导入了该核酸的载体导入到适当的宿主细胞中,并且培养宿主细胞,能够制备该抗t细胞抗原结合分子。在分泌抗t细胞抗原结合分子时,可以从其培养上清液中回收目标抗t细胞抗原结合分子。从培养物中将目标抗t细胞抗原结合分子纯化的方法也众所周知。另一方面,vegf抑制剂也同样,如果其为抗体等蛋白成分,则通过将编码该vegf抑制剂分子的核酸、或导入了该核酸的载体导入到适当的宿主细胞中,并且培养宿主细胞,能够和该多特异性抗原结合分子同样地制备。
[0591]
在本公开中,抗t细胞抗原结合分子和vegf抑制剂能够分别独立地和药学上可接受的载体、介质、记载有使用方法的使用说明等一起包装。或者也可在将两者制剂化后,组合构成试剂盒。具体来说,试剂盒例如能够包含容纳有制剂化后的抗t细胞抗原结合分子的包装、和容纳有制剂化后的vegf抑制剂的包装。当构成试剂盒的各制剂为经冷冻干燥的制剂、或液状浓缩制剂时,也可将用于溶解、或稀释其的液体介质组合到试剂盒中。
[0592]
本公开提供一种药物组合物。所述药物组合物包含上述的抗t细胞抗原结合分子。所述药物组合物用于和vegf抑制剂一同施用,用于癌症的治疗和预防中的任一者或两者。所述药物组合物用于选自所述药物组合物施用引起的crs和细胞因子释放的任一者或两者的预防、减轻和治疗中的任一目的或它们的组合。
[0593]
此处,所述药物组合物不限于包含抗t细胞抗原结合分子的药物组合物,也可以是通过将编码嵌合抗原受体(chimeric antigen receptor:以下也称为“car”)的基因导入到通常的外周血t细胞(外周血t淋巴细胞)中而制成的car表达t细胞(以下简称为“car-t细胞”)。car是将识别癌细胞等细胞表面抗原的抗体和诱导t细胞活化的信号转导区域人工融合而成的嵌合蛋白。通过在外周血t淋巴细胞中导入编码car的基因,制备car-t细胞。用此类方法制备的car表达t细胞用于利用过继免疫疗法(adoptive immunotherapy)的癌症等疾病治疗。这样的car-t细胞对表达抗原的靶细胞具有反应性,在不依赖于和主要组织相容
基因复合体(mhc)的相互作用的情况下,可以引导靶细胞的杀伤。
[0594]
关于利用car-t细胞施用的癌症免疫疗法,更具体来说,从患者采集t细胞,在该t细胞中导入编码car的基因并扩大培养,再次移入患者的疗法,全世界进行临床试验(非专利文献1)。得到了如下结果,即,利用car-t细胞施用的癌症免疫疗法在白血病或淋巴瘤等造血器官恶性肿瘤等中显示出有效性。2017年,kymriah(注册商标)(novartis、tisagenlecleucel、ctl-019、cd3 zeta-cd137)和yescarta(注册商标)(kite、axicabtagene ciloleucel、cd3 zeta-cd28)在美国被批准为医药品,上述kymriah(注册商标)是以cd19为抗原的car-t。
[0595]
已报告有,利用car-t细胞施用的癌症免疫疗法引起的crs和细胞因子释放(lee dw,et al.current concepts in the diagnosis and management of cytokine release syndrome.blood.2014 jul 10;124(2):188-95.)。由于启示施用包含抗t细胞抗原结合分子的药物组合物的情况和施用car-t细胞的情况所引起的crs机制是通用的,因此可以理解成通过施用vegf抑制剂,可预防、减轻或治疗伴随car-t细胞施用的细胞因子释放综合征(crs)。
[0596]
此外,本说明书中所引用的所有现有技术文献是作为参照编入到本说明书中的。
实施例
[0597]
[实施例1]
[0598]
联合使用抗小鼠vegfr2抗体(dc101)对ery974代用抗体(gc33/2c11)药效的影响
[0599]
以如下方式进行试验,该试验评估在使用同系小鼠模型的试验中,联合使用抗小鼠vegfr2抗体、dc101(bio x cell(us)公司制)对ery974代用抗体药效的影响。此外,作为对ery974代用抗体,使用gc33/2c11(是包含如下氨基酸序列的抗体:作为gpc3侧的重链的序列编号:433的氨基酸序列、作为gpc3侧的轻链的序列编号:434的氨基酸序列、作为cd3侧的重链的序列编号:435的氨基酸序列、作为cd3侧的轻链的序列编号:436的氨基酸序列)。
[0600]
使小鼠癌细胞株即mc38高效表达人gpc3得到mc38/hgpc3癌细胞,将该mc38/hgpc3癌细胞移植到c57bl/6j小鼠的皮下。移植日设为第0天。第14天,根据肿瘤大小将该小鼠分为4组。第14天、第18天,对于分组的小鼠分别尾静脉注射(1)赋形剂(vehicle)、(2)gc33/2c11(5mg/kg)、(3)抗小鼠vegfr2抗体(dc101)(10mg/kg)、以及(4)gc33/2c11(5mg/kg)和抗小鼠vegfr2抗体(10mg/kg)。
[0601]
其结果为,与各抗体的单剂相比,gc33/2c1和抗小鼠vegfr2抗体的联合使用增强了药效。(图1)
[0602]
[实施例2]
[0603]
联合使用抗小鼠vegfr2抗体(dc101)对ery974代用抗体(gc33/2c11)导致的产生来自肿瘤的细胞因子的影响
[0604]
以如下方式进行试验,该试验评估在使用同系小鼠模型的试验中,联合使用抗小鼠vegfr2抗体(dc101)对ery974代用抗体(gc33/2c11)导致的产生来自肿瘤组织的细胞因子的影响。
[0605]
使小鼠癌细胞株即mc38高效表达人gpc3得到mc38/hgpc3癌细胞,将该mc38/hgpc3癌细胞移植到c57bl/6j小鼠的皮下。移植日设为第0天。
[0606]
第13天,根据肿瘤大小将该小鼠分为4组。第13天,对于分组的小鼠尾静脉注射(1)赋形剂(vehicle)、(2)gc33/2c11(5mg/kg)、抗小鼠vegfr2抗体(10mg/kg)、以及(4)gc33/2c11(5mg/kg)和抗小鼠vegfr2抗体(10mg/kg)。在施用前、抗体施用后2、6、24小时后采集小鼠的血液,回收血浆成分,进行血浆中细胞因子的测定。在细胞因子的测定中,使用小鼠细胞因子/趋化因子磁珠板1(millipore)试剂,并使用magpixrxpont4.2系统(merck)进行测定。
[0607]
其结果发现,与仅施用gc33/2c11的情况相比,gc33/2c11和抗小鼠vegfr2抗体的联合使用组的来自肿瘤的细胞因子的产生量趋于减少。因此启示,通过联合使用血管新生抑制剂,减少ery974导致的来自肿瘤的细胞因子的产生量(图2a~2e)。
[0608]
[实施例3]
[0609]
联合使用抗小鼠vegfr2抗体(dc101)对ery974代用抗体(gc33/2c11)导致的产生来自正常组织的细胞因子的影响
[0610]
以如下方式进行试验,该试验评估在使用人gpc3基因敲入(knock-in)小鼠的试验中,联合使用抗小鼠vegfr2抗体(dc101)对ery974代用抗体(gc33/2c11)导致的产生来自正常组织的细胞因子的影响。
[0611]
表达人gpc3的人gpc3基因敲入小鼠是在小鼠gpc3启动子的表达控制下表达人gpc3的小鼠(wo2018/038046)。另一方面,已报告有小鼠和人类的gpc3阳性组织是通用的。发现人类、小鼠共同在肺中轻微表达gpc3(clin.cancer.res(2004)10,8630-40)。因此,通过对上述人gpc3基因敲入小鼠施用gc33/2c11而测定细胞因子的产生量,可以预测、评估对人类施用ery974时的、来自正常组织的细胞因子产生机制。
[0612]
将表达人gpc3的人gpc3基因敲入小鼠分为4组,分别尾静脉注射(1)赋形剂(vehicle)、(2)gc33/2c11(5mg/kg)、(3)抗小鼠vegf2抗体(10mg/kg)、以及(4)gc33/2c11(5mg/kg)和抗小鼠vegfr2抗体(10mg/kg)。在施用前、抗体施用后24小时后采集小鼠的血液,回收血浆成分,进行血浆中细胞因子的测定。在细胞因子的测定中,使用小鼠细胞因子/趋化因子磁珠板1(millipore)试剂,并使用magpixrxpont4.2系统(merck)进行测定。
[0613]
其结果确认到,与仅施用gc33/2c11的情况相比,gc33/2c11和抗小鼠vegfr2抗体的联合使用组的来自正常组织的细胞因子的产生量趋于减少。因此启示,通过联合使用血管新生抑制剂,减少ery974导致的来自正常组织的细胞因子的产生量(图3)。
[0614]
产业上的可利用性
[0615]
本公开对预防、减轻、或治疗伴随抗t细胞抗原结合分子施用等的细胞因子产生所引起的副作用有用。抗t细胞抗原结合分子作为癌症的治疗手段等不断受到关注。因此,在一些实施方案中,本公开在利用抗t细胞抗原结合分子治疗癌症方面有用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1