与抗病毒治疗剂有关的组合物和方法
与抗病毒治疗剂有关的组合物和方法
1.相关申请的交叉引用
2.本技术要求2020年6月16日提交的美国临时专利申请序列号63/039,598和2020年8月27日提交的美国临时专利申请序列号63/070,888的优先权和权益,所述申请两者以引用的方式并且出于所有目的整体并入本文。
技术领域
3.本公开提供了与抗病毒治疗剂有关的组合物和方法。特别地,本公开提供了使用源自肺类球体细胞(lsc)的囊泡治疗和/或预防病毒感染的新型组合物和方法。如本文所提供的,lsc来源的囊泡可用作用于治疗应用的病毒诱饵纳米颗粒、用作用于疫苗生产的病毒样颗粒(vlp)以及用作抗病毒药物递送平台。
背景技术:
4.严重急性呼吸综合征冠状病毒2(sars-cov-2)是处于当前全球大流行中心的病原体,是冠状病毒疾病-2019(covid-19)的原因。冠状病毒被认为是常见病毒;alpha(α-)冠状病毒和beta(β-)冠状病毒可感染哺乳动物并且通常表现为普通感冒或胃肠(gi)不适。很少出现更严重和致命的形式,如sars-cov-2,其能够感染呼吸和免疫系统并诱导促炎性细胞因子的分泌,从而触发肺泡性水肿、低氧血症、呼吸困难和全身性炎症反应综合征(sirs)的增加。与其前驱物sars-cov-1(2003年sars的原因)和mers-cov(2012年mers的原因)一样,sars-cov-2是具有危险的高人际间传播率的包膜正义β-冠状病毒,报告的r0范围为2-6。对抗病毒的初步努力主要集中在遏制以阻止传播和阐明其发病机制上;然而,所述病毒仍在继续传播,在全球范围内夺走了超过350,000条生命。越来越明显的是,不仅需要有效的疫苗,而且需要治疗性治疗选择来控制病毒的传播并预防随后的感染浪潮。不幸的是,疗法尚未批准,并且治疗仍主要集中在姑息治疗和对症治疗上。不可否认的是明显地,除了有效的疫苗之外,治疗剂的开发对于彻底结束这一流行病并为重症covid-19患者提供解决方案是必要的。世界各地的研究人员正在紧急竞相寻找用于covid-19的有效疗法。根据来自2020年10月15日世界卫生组织团结试验(solidarity trial)的公布的中期结果,所有4种评估的治疗(瑞德西韦、羟氯喹洛匹那韦/利托那韦和干扰素)对住院covid-19患者的总体死亡率、机械通气的必要性和住院时间的影响很小或没有影响。
技术实现要素:
5.本公开的实施方案包括一种组合物,所述组合物包含源自细胞的多个纳米囊泡,所述多个纳米囊泡包含能够结合病毒的至少一种细胞表面蛋白。
6.在一些实施方案中,所述细胞是肺类球体细胞(lsc)。在一些实施方案中,所述至少一种细胞表面蛋白包含血管紧张素转化酶2(ace2)或其衍生物或片段。在一些实施方案中,所述ace2蛋白或其衍生物或片段对所述细胞而言是内源性的。在一些实施方案中,所述ace2蛋白或其衍生物或片段对所述细胞而言是外源性的。
7.在一些实施方案中,所述至少一种细胞表面蛋白还包含aqp5、sftpc、cd68、epcam、cd90和/或muc5b。
8.在一些实施方案中,所述多个纳米囊泡包括在约50nm至约1000nm范围内的平均尺寸。在一些实施方案中,所述多个纳米囊泡包括约320nm的平均尺寸。
9.在一些实施方案中,所述组合物还包含至少一种药学上可接受的赋形剂或载体。
10.在一些实施方案中,所述病毒是冠状病毒。在一些实施方案中,所述冠状病毒选自由以下组成的组:229e、nl63、oc43、hku1、mers-cov、sars-cov和sars-cov-2。
11.在一些实施方案中,所述多个纳米囊泡包含至少一种治疗性蛋白质、肽、多肽、核酸分子、多核苷酸、mrna、sirna、mirna、反义寡核苷酸、药物或治疗性小分子。
12.本公开的实施方案还包括一种治疗病毒感染的方法,所述方法包括向有需要的受试者施用上述任何组合物。
13.在一些实施方案中,所述组合物经口服、胃肠外、肌内、腹膜内、静脉内、脑室内、脑池内、气管内、鼻内、皮下、通过注射或输注、通过吸入、喷雾、经鼻、阴道、直肠、舌下或局部施用来施用。在一些实施方案中,所述组合物通过雾化施用于肺组织。在一些实施方案中,所述多个纳米囊泡的施用降低所述受试者中的病毒载量。在一些实施方案中,所述组合物以在每kg所述受试者体重约1
×
108至约1
×
10
12
个颗粒的范围内的剂量施用。
14.本公开的实施方案还包括一种产生能够治疗病毒感染的多个纳米囊泡的方法。根据这些实施方案,所述方法包括培养多个肺类球体细胞(lsc),并使所述多个lsc经受挤出过程以产生所述多个纳米囊泡。
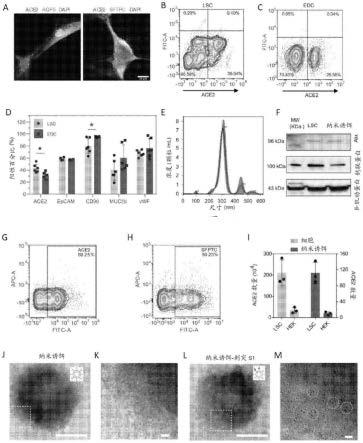
15.在一些实施方案中,所述挤出过程包括使所述lsc通过包括5μm、1μm和400nm孔径的膜过滤器的挤出机。
16.在一些实施方案中,所述方法还包括使用超滤纯化和浓缩所述多个纳米囊泡。
17.本公开的实施方案还包括一种组合物,所述组合物包含源自肺类球体细胞(lsc)的多个外泌体。根据这些实施方案,所述组合物包含多个lsc外泌体,所述多个lsc外泌体包含(i)所述多个lsc外泌体的表面上的至少一种膜相关蛋白,和/或(ii)包含在所述多个lsc外泌体内的至少一种抗病毒治疗剂。
18.在一些实施方案中,所述多个lsc外泌体的表面上的至少一种膜相关蛋白包含病毒特异性蛋白。在一些实施方案中,所述病毒特异性蛋白包括刺突蛋白(s蛋白)。在一些实施方案中,包含在所述多个lsc外泌体内的至少一种抗病毒治疗剂包含编码所述s蛋白的mrna。
19.在一些实施方案中,所述多个lsc外泌体的表面上的至少一种膜相关蛋白包含能够结合病毒的蛋白质。
20.在一些实施方案中,能够结合病毒的所述蛋白质包含血管紧张素转化酶2(ace2)或其衍生物或片段。
21.在一些实施方案中,包含在所述多个lsc外泌体内的至少一种抗病毒治疗剂包括瑞德西韦。
22.在一些实施方案中,所述组合物还包含至少一种药学上可接受的赋形剂或载体。
23.本公开的实施方案还包括一种预防病毒感染的方法,所述方法包括向受试者施用上述任何组合物。
24.在一些实施方案中,所述组合物经口服、胃肠外、肌内、腹膜内、静脉内、脑室内、脑池内、气管内、鼻内、皮下、通过注射或输注、通过吸入、喷雾、经鼻、阴道、直肠、舌下或局部施用来施用。在一些实施方案中,所述组合物通过雾化施用于肺组织。在一些实施方案中,所述病毒是冠状病毒。在一些实施方案中,所述冠状病毒选自由以下组成的组:229e、nl63、oc43、hku1、mers-cov、sars-cov和sars-cov-2。
附图说明
25.图1a-1m:肺类球体细胞来源的纳米诱饵的表征。(a)用ace2、aqp5和sftpc抗体标记的lsc的代表性共聚焦图像。比例尺,20μm。(b)用于ace2表达的lsc(b)和edc(c)的代表性流式细胞术分析和(d)用于ace2、epcam、cd90、muc5b和vwf的edc和lsc的流式细胞术分析的定量结果。数据显示为平均值
±
sd,n=4或6个独立实验。通过使用杜凯氏事后检验(tukey post hoc test)的双因素anova进行统计分析。对于门控策略,参见图32。(e)使用nanosight进行纳米诱饵的尺寸测量。(f)lsc-纳米诱饵和lsc中alix和钙联蛋白的蛋白质印迹。显示lsc-纳米诱饵上ace2(g)和ii型肺细胞标志物sfptc(h)的表达的流式细胞术分析。对于门控策略,参见图32。(i)细胞和纳米诱饵两者上ace2数量的测量。hek表示hek293。数据显示为平均值
±
sd,n=3个独立实验。显示裸纳米诱饵(j)和放大的图1k的透射电子显微术(tem)图像。显示刺突s1结合的纳米诱饵(l)和放大的图1m的tem图像。使用直径为10nm的金纳米颗粒标记的第二抗体检测刺突s1。卡通图片(图1j和1l中的插图)是用biorender.com创建的。
26.图2a-2l:纳米诱饵对刺突s1的中和。(a)lsc-纳米诱饵或hek-纳米诱饵对刺突s1的剂量依赖性中和。数据显示为平均值
±
sd,n=3个独立实验。(b)说明实验设计的示意图。(c)当与肺细胞(绿色)共培养时,刺突s1(红色)和纳米诱饵(白色)的相互作用。(d)说明实验设计的示意图。(e)显示巨噬细胞(cd4,红色)对纳米诱饵的内化的代表性共聚焦图像。(f)说明共培养实验的示意图和(g)与肺细胞(cd90,绿色)共培养的巨噬细胞对纳米诱饵的内化的共聚焦图像。每组拍摄至少三张图像。显示lsc(i)和巨噬细胞(k)对did标记的纳米诱饵的内化和(l)其相应的定量的流式细胞术分析。pbs用作lsc(h)和巨噬细胞(j)的对照组。对于门控策略,参见图33。数据显示为平均值
±
sd,n=3个独立实验。使用双尾学生t检验进行统计分析。比例尺,对于图2c、2e和2g为50μm。卡通图片是使用biorender.com创建的。
27.图3a-3n:纳米诱饵对sars-cov-2模拟病毒的中和。(a)激活的nta的合成和化学结构。(b)说明用刺突s1修饰慢病毒以产生sars-cov-2模拟物的示意图。显示慢病毒(c)、sars-cov-2模拟物(d)和使用直径为10nm的金纳米颗粒标记的第二抗体的慢病毒上的刺突s1(e)的tem图像,其中sars-cov-2模拟病毒(黄色箭头)连接至纳米诱饵(虚线圆圈)。比例尺,对于图3c-3e为100nm。(f)纳米诱饵对sars-cov-2模拟物的中和测定。数据显示为平均值
±
sd,n=4个独立实验。(g)显示实验设计的示意图。(h)纳米诱饵(白色)在与肺细胞(绿色)和巨噬细胞的共培养物中中和sars-cov-2模拟物(红色)。比例尺,50μm。(i-l)显示纳米诱饵抑制sars-cov-2模拟病毒(红色)进入肺细胞(绿色)的代表性共聚焦图像(每只动物拍摄至少三张图像)和(m)流式细胞术分析。比例尺,50μm。(n)来自(m)的相应定量。对于门控策略,参见图33。数据显示为平均值
±
sd,n=3个独立实验。通过使用杜凯氏事后检验的双
因素anova进行统计分析。卡通图片是使用biorender.com创建的。
28.图4a-4e:吸入后纳米诱饵的生物分布。(a)显示cd1小鼠中纳米诱饵吸入的实验设计的示意图。使用biorender.com创建。(b)来自(c)的did标记的纳米诱饵在心脏、肺、肝、肾和脾组织中的相应定量结果。数据显示为平均值
±
sd,n=3只动物。(c)组织切片中did标记的纳米诱饵(红色)的代表性共聚焦图像。(d)显示吸入后24小时肺组织中的纳米诱饵与肺细胞(aqp5、sftpc)和巨噬细胞(cd68)共定位的代表性共聚焦图像。(e)纳米诱饵阳性巨噬细胞的百分比的定量。数据显示为平均值
±
sd,n=3只动物。比例尺,对于图4c-4d为200μm。
29.图5a-5j:纳米诱饵吸入加速小鼠模型中sars-cov-2模拟病毒的清除。(a)显示动物研究设计的示意图。使用biorender.com创建。(b)来自使用各种治疗的小鼠的肺组织的代表性离体ivis成像。n=3只动物/组。(c)从(b)中的成像数据定量sars-cov-2模拟物的荧光强度。数据显示为平均值
±
sd,n=3只动物/组。通过使用用于多重比较的杜凯氏事后检验的双因素anova进行统计分析。(d)肺切片中af647标记的sars-cov-2模拟物(红色)的代表性共聚焦图像。比例尺,50μm。(e)肺组织中af647标记的sars-cov-2模拟物的相应半定量分析。数据显示为平均值
±
sd,n=3只动物/组。通过使用用于多重比较的杜凯氏事后检验的双因素anova进行统计分析。(f-j)治疗后3天血清中的各种炎性细胞因子的细胞因子阵列分析。
30.图6a-6i:lsc-纳米诱饵吸入治疗食蟹猴中的sars-cov-2感染。(a)描绘食蟹猴研究设计的示意图。使用biorender.com创建。(b和c)在激发后的不同时间点鼻拭子(ns)和支气管肺泡灌洗液(bal)中的病毒亚基因组rna(sgrna)拷贝数/拭子。每个点代表来自一只动物的数据。n=3只动物/组。(d)来自sars-cov-2感染的食蟹猴的固定肺组织的代表性h&e图像,并且每只动物拍摄了至少三张图像。上图:比例尺,500μm;下图:比例尺,100μm。(e)来自感染sars-cov-2的食蟹猴的固定肺组织中sars核衣壳(sars-n)免疫组织化学(ihc)染色的代表性图像,所述食蟹猴在病毒激发后8天用对照或lsc-纳米诱饵进行治疗。上图:比例尺,100μm;下图:比例尺,20μm。(f)通过ashcroft评分定量被感染的食蟹猴的肺纤维化;每个点代表来自一只动物的数据;数据显示为平均值
±
sd,n=3只动物/组。通过双尾学生t检验进行统计分析。盲法进行ashcroft评分。g)被感染的食蟹猴的肺组织中阳性sars核衣壳数量的定量。每个点代表来自一只动物的数据;数据显示为平均值
±
sd,n=3只动物/组。使用双尾学生t检验进行统计分析。(h)被感染的食蟹猴中vrna的rnascope原位杂交检测的代表性图像。zika作为对照探针。比例尺,100μm。(i)sars-n(红色)、pan-ck(绿色)、iba-1(灰度级)、cd68(绿色)、cd206(洋红色)和dapi(蓝色)的代表性免疫荧光图像。比例尺,50μm。每只动物拍摄至少三张图像。
31.图7a-7f:ace2
+
外泌体的表征。(a)肺类球体细胞(lsc)和hek293t(hek)亲本对照细胞中ace2表达的免疫荧光。(b)图7a中ace2表达的定量。(c)lsc来源的外泌体(lsc-exo)和hek细胞来源的外泌体(hek-exo)的tem图像。(d)lsc-exo和hek-exo的纳米颗粒追踪分析。(e)lsc、hek、lsc-exo和hek-exo中ace2表达的流动剖面。(f)图7e中ace2表达的相应定量。
32.图8a-8f:lsc-exo抑制对人类宿主细胞的sars-cov-2假病毒感染。用通过lsc-exo抑制的gfp报告基因表达检测的感染假病毒的a549-ace2细胞的流式图(a)和定量(b)。(c)分别与sars-cov-2-gfp假病毒和ace2或hek-exo或lsc-exo一起孵育的a549-ace2细胞的共
聚焦成像。鬼笔环肽(红色)、sars-cov-2-gfp(绿色)。(d)接种后24小时来自各组的小鼠肺部的离体成像,其中小鼠在-2小时吸入ace2蛋白、hek-exo或lsc-exo,然后鼻内接种sars-cov-2-gfp假病毒。(e)图8d中肺组织中的sars-cov-2-gfp假病毒的相应半定量分析。(f)dapi(蓝色)、鬼笔环肽(红色)和sars-cov-2假病毒(绿色)的全肺、气管、支气管和实质切片的代表性免疫染色。这些图像是在4x的放大倍数下获得的。
33.图9a-9e:lsc-exo保护仓鼠中的sars-cov-2感染。(a)显示动物研究设计的示意图。(b)在指定时间点lsc-exo保护对口腔拭子(os)中的病毒grna的影响。(c)激发后7天lsc-exo保护对支气管肺泡灌洗(bal)液中的病毒基因组rna(grna)的影响。(d)在激发后7天来自仓鼠的肺组织的代表性h&e和马森氏(masson’s)三色染色图像。(e)激发后7天仓鼠的肺组织中vrna的rnascope原位杂交检测的代表性图像。
34.图10a-10k:负载rfp的lsc-外泌体具有优异的肺部分布。(a)负载rfp的lsc外泌体和负载rfp的脂质体在健康cd1小鼠中的实验性示意图;n=3只/组。(b)4小时和24小时后负载rfp的lsc-外泌体或负载rfp的脂质体递送后小鼠肺的离体成像。(c)离体小鼠肺中rfp荧光的整合密度的定量;每个点代表来自一个肺的数据;n=3只/组。(d)dapi(蓝色)、鬼笔环肽(绿色)和外泌体或脂质体(红色)的全肺、气管、支气管和实质切片的代表性免疫染色。这些图像是在10的放大倍数下获得的。(e)所有组中来自全肺图像的气管、支气管和实质图块(tiles)中的rfp荧光的整合密度的定量;每个点代表来自一个图像分块的数据;n=12-276。(f-h)来自全肺图像的气管(f)、支气管(g)和实质(h)图块中rfp荧光的整合密度的定量;每个点代表来自一个图像分块的数据;n=2-82。(i)dapi(蓝色)、cd11b(绿色)和外泌体或脂质体(红色)的实质切片的代表性免疫染色。这些图像是在60的放大倍数下获得的。(j)离体小鼠肺中cd11b+apc对外泌体或脂质体摄取的定量;红色数字指示所有代表性图像中的阳性细胞的总数;n=6个图像/组。自始至终,数据是平均值
±
s.d.。p值如由单因素anova、随后事后邦弗朗尼校正(bonferroni correction)所指示。*指示p《0.05;**p《0.01;***p《0.001;****p《0.0001。(k)吸入rbd-exo vlp疫苗的代表性示意图,所述疫苗诱导仓鼠中sars-cov-2的中和并保护肺部。
35.图11a-11k:rbd-exo的表征和稳定性研究。(a)说明用rbd修饰lsc-exo以产生rbd-exo的示意图。(b)lsc-exo和rbd-exo的透射电子显微镜(tem)图像。使用直径为15nm的金纳米颗粒标记的第二抗体检测rbd。(c)裂解的rbd-exo、rbd和exo中rbd和cd63的免疫印迹。(d)通过纳米颗粒追踪分析进行的lsc-exo和rbd-exo的尺寸测量。(e)分别在-80℃、4℃和rt下储存21天后rbd-exo的代表性tem图像、(f)尺寸变化、(g)总数和(h)rbd水平变化。rbd水平通过治疗组和冻干前(pre-lyo)的比率计算。(i)在21天内rbd-exo的稳定性数据的汇总。(j)dapi(蓝色)和rbd或rbd-exo(红色)的raw264.7细胞的代表性免疫染色。比例尺,50μm。(k)raw264.7细胞对rbd和rbd-exo内化的流式细胞术分析。数据是平均值
±
s.d.。p值如通过未配对t检验所指示。***指示p《0.001。
36.图12a-12f:rbd-exo疫苗接种诱导抗体产生并增强小鼠中sars-cov-2模拟物的清除。(a)显示动物研究设计的示意图。(b)第二次接种疫苗后一周,在不同时间点吸入sars-cov-2模拟物后肺部的离体荧光成像。(c)来自共聚焦图像肺切片的肺组织中af647标记的sars-cov-2模拟物的相应半定量分析。(d)通过elisa检测的鼠血清中的抗rbd抗体滴度。通过elisa检测的鼻咽灌洗液(nplf)(e)和支气管肺泡灌洗液(balf)(f)中的rbd特异性分泌
型iga(siga)抗体滴度。自始至终,数据是平均值
±
s.d.。p值如由未配对t检验所指示。*指示p《0.05;**p《0.01;***p《0.001。ns表示不显著。
37.图13a-13d:rbd-exo疫苗接种小鼠中全身细胞因子的诱导。(a)在rbd存在下具有106个脾细胞/孔的96孔板中ifn-γ释放斑点的代表性图像。源自接受静脉内(iv)和雾化(n)施用的每个治疗组的脾细胞。(b)ifn-γ脾细胞表示为每106个细胞的斑点形成单位(sfu)。(c)来自通过rbd再刺激的脾细胞上清液的tnf-α水平。(c)来自通过rbd再刺激的脾细胞上清液的il-6脾细胞水平。自始至终,数据是平均值
±
s.d.。p值如由未配对t检验所指示。*指示p《0.05;**p《0.01;***p《0.001;****p《0.0001。ns表示不显著。
38.图14a-14g:rbd-exo疫苗在sars-cov-2感染的叙利亚仓鼠模型中的保护作用。(a)实验设计的概述。(b)激发后7天rbd-exo对支气管肺泡灌洗(bal)液中的病毒基因组rna(grna)的影响。(c)在指定时间点rbd-exo对口腔拭子(os)中的病毒grna的影响。(d)通过elisa检测的第2周(激发前)仓鼠血清中的rbd特异性结合抗体。在激发后7天来自仓鼠的肺组织的代表性h&e(e)和马森氏三色染色(f)图像。上图:比例尺,500μm;下图:比例尺,100μm。(g)通过ashcroft评分对受激发的仓鼠的肺纤维化的定量;每个点代表来自一只动物的数据;盲法进行ashcroft评分分析。自始至终,数据是平均值
±
s.d.。p值如由单因素anova所指示。*指示p《0.05;**p《0.01;***p《0.001;****p《0.0001。
39.图15a-15g:用rbd-exo疫苗接种的叙利亚仓鼠中的组织病理学变化和rnascope分析。(a)来自在病毒激发后7天用pbs、rbd或rbd-exo疫苗接种的仓鼠的固定肺组织中sars核衣壳(sars-n)免疫组织化学(ihc)染色的代表性图像。比例尺,100μm。(b)仓鼠中的肺组织的sars-n(洋红色)、pan-ck(绿色)和dapi(蓝色)的代表性免疫荧光图像,以研究sars-n的分布。比例尺,50μm。(c)激发后7天仓鼠的肺组织中vrna的rnascope原位杂交检测的代表性图像。比例尺,100μm。(d)激发后7天仓鼠中的肺组织的sars-n(灰度级)、ibal-1(红色)、cd206(绿色)和dapi(蓝色)的代表性免疫荧光图像。比例尺,50μm。(e)激发后7天仓鼠的cd3 t淋巴细胞、mpo和干扰素诱导型基因mx1 ihc染色的代表性图像。比例尺,50μm。(f)仓鼠的肺组织中阳性sars-n细胞数量的定量。每个点代表来自一个图像文件的数据,n=15。(g)分别地,仓鼠的肺组织中阳性cd3、mpo和mx1细胞数量的定量。每个点代表来自一个图像文件的数据,n=15。自始至终,数据是平均值
±
s.d.。p值如由单因素anova所指示。*指示p《0.05;**p《0.01;***p《0.001;****p《0.0001。
40.图16:说明从肺类球体细胞产生纳米诱饵到可吸入纳米诱饵和用于sars-cov-2感染的潜在纳米诱饵疗法的示意图。使用biorender.com创建。
41.图17:显示用ace2、aqp5和sftpc抗体标记的肺外植体来源的细胞(edc)的共聚焦图像。比例尺,20μm。
42.图18a-18c:用于ace2表达的hek293细胞、人成纤维细胞、人肺外植体来源的细胞(edc)和人肺类球体细胞(lsc)的免疫印迹和流式细胞术。(a)hek293、人肺成纤维细胞、edc和lsc的蛋白质印迹。(b)来自(a)的定量结果。数据显示为平均值
±
sd,n=3个独立实验。(c)hek293细胞、人肺成纤维细胞、edc、lsc、lsc-外泌体和lsc-纳米诱饵中ace2阳性百分比的流式细胞术分析。数据显示为平均值
±
sd,n=3或6个独立实验。
43.图19a-19e:人lsc的流式细胞术表征。对于门控策略,参见图32。
44.图20:ace2
+
lsc的双重染色流式细胞术表征。对于门控策略,参见图32。
45.图21:巨噬细胞对纳米诱饵的内化。左图,显示源自外周血或肺组织的巨噬细胞对纳米诱饵的内化的共聚焦图像。右图,关于内化的定量结果。数据显示为平均值
±
sd,n=4个独立实验。比例尺,50μm。
46.图22:显示通过lsc内化的sars-cov-2模拟物的代表性共聚焦图像。比例尺,20μm。
47.图23:显示慢病毒和nta标记的慢病毒的内化的共聚焦成像和流式细胞术分析。对于门控策略,参见图33。
48.图24a-24b:纳米诱饵阻止sars-cov-2模拟物的病毒进入。(a)流式细胞术分析显示纳米诱饵以剂量依赖性方式阻止病毒进入肺细胞,和(b)来自(a)的相应定量结果。数据显示为平均值
±
sd,n=3个独立实验。通过使用杜凯氏事后检验的双因素anova进行统计分析。对于门控策略,参见图33。
49.图25:吸入的纳米诱饵的生物分布。在吸入lsc-纳米诱饵后的不同时间点主要器官的离体荧光图像。
50.图26:纳米诱饵吸入不会触发肺中的炎症。左图,显示在吸入lsc-纳米诱饵后的不同时间点肺组织中的cd68阳性细胞的代表性共聚焦图像。右图,来自左侧图像的定量结果。数据显示为平均值
±
sd,n=3只动物/组,并且每组拍摄5张图像。通过使用杜凯氏事后检验的双因素anova进行统计分析。比例尺,200μm。
51.图27:未合并的图5d。显示吸入后24小时肺组织中的lsc-纳米诱饵与肺细胞(aqp5、sftpc)和巨噬细胞(cd68)共定位的代表性共聚焦图像。比例尺,200μm。
52.图28:关于lsc-纳米诱饵吸入疗法的毒性的病理学研究。在lsc-纳米诱饵治疗后14天主要器官的h&e染色。比例尺,560μm(40
×
)和110μm(200
×
)。
53.图29:关于纳米诱饵吸入后14天小鼠中的纳米诱饵毒性的血液学和生物化学研究。数据显示为平均值
±
sd,n=3只动物/组。
54.图30:在lsc-纳米诱饵疗法后食蟹猴中的血液学研究。数据显示为平均值
±
sd,n=3只动物/组。
55.图31:单独食蟹猴中sars-cov-2激发后的体重和温度变化的百分比。n=3只动物/组。
56.图32:用于图1b-1c、1g-1h和图19-20中的实验的流式细胞术门控策略。
57.图33a-33b:用于图2i-2l(a)和图3m-3n(b)以及图23-24(b)中的实验的流式门控策略。
58.图34:来自病毒激发后2天处死的小鼠的肺切片中dapi(蓝色)和af647标记的sars-cov-2模拟物(红色)的代表性免疫染色。
59.图35:来自病毒激发后6天处死的小鼠的肺切片中dapi(蓝色)和af647标记的sars-cov-2模拟物(红色)的代表性免疫染色。
60.图36:在通过rbd再刺激后,源自经疫苗接种的小鼠的脾细胞中表达共刺激分子cd86的树突细胞(dc)的流式细胞术分析。
61.图37:在通过rbd再刺激后,源自经疫苗接种的小鼠的脾细胞中表达cd40的树突细胞(dc)的流式细胞术分析。
62.图38:在通过rbd再刺激后,源自经疫苗接种的小鼠的脾细胞中表达cd80的树突细胞(dc)的流式细胞术分析。
63.图39:来自激发后7天仓鼠的外周血的临床化学和血液学参数。每个点代表来自一只动物的数据。灰色区域代表正常仓鼠的临床化学和血液学范围。
具体实施方式
64.本公开的实施方案提供了与抗病毒治疗剂有关的组合物和方法。特别地,本公开提供了使用源自肺类球体细胞(lsc)的囊泡治疗和/或预防病毒感染的新型组合物和方法。如本文所提供的,lsc来源的囊泡可用作用于治疗应用的病毒诱饵纳米颗粒、用作用于疫苗生产的病毒样颗粒(vlp)以及用作抗病毒药物递送平台。
65.病毒诱饵纳米颗粒。血管紧张素转化酶2(ace2)存在于许多细胞类型中并且存在于几乎所有组织中,是已显示在宿主细胞病毒进入中起关键作用的羧肽酶。sars-cov-2特异性地攻击肺中的ace2呈递呼吸ii型肺细胞和鼻粘膜中的杯状分泌型细胞作为其主要感染部位。在本公开中,病毒的细胞进入被用作特洛伊木马策略。正如之前的研究所证明,从初始啮齿动物研究到正在进行的1期临床试验(nct04262167),肺类球体细胞(lsc)已被开发作为治疗肺纤维化和炎症的细胞疗法。lsc是驻留型肺上皮细胞(含有i型和ii型肺细胞)和间充质细胞的混合物。作为驻留型肺细胞,它们表达ace2。基于此,产生lsc膜纳米囊泡作为ace2纳米诱饵。充当细胞模拟物的那些纳米诱饵能够结合sars-cov-2刺突(s-)蛋白并触发来自巨噬细胞的应答用于病毒消除。
66.治疗性抗体和融合抑制剂已被开发用于靶向sars-cov-2的刺突蛋白。然而,已经发现了与sars-cov-2的刺突蛋白中的突变相关的更具侵袭性的变体。因此,基于人受体ace2(被病毒用于进入宿主细胞而不是病毒组分)的抗病毒策略将引起更大的兴趣,因为预期宿主细胞上没有突变。本公开的结果提供了用于中和sars-cov-2的非侵入性治疗策略。这种方法与目前的两种策略:抗病毒药物和疫苗有着根本上的不同。用于制造纳米诱饵的lsc是通过稳健、可重复和可扩展的培养方法产生的,所述方法适用于生产临床适用数量的细胞治疗产品。此外,这种纳米诱饵技术具有高度可转化性,因为亲本细胞目前处于作为肺纤维化的潜在治疗方法的早期临床试验阶段。
67.如本文进一步描述的,本公开的实施方案在活sars-cov-2感染的非人灵长类动物模型中提供了第一个证据,即细胞来源的和细胞模拟纳米诱饵可保护肺细胞免受sars-cov-2的感染和损害。食蟹猴模型概括了covid-19人患者的许多临床特征。在sars-cov-2激发后8天,四个剂量的纳米诱饵吸入导致bal和ns两者中的病毒载量减少。未观察到诸如体重减轻、发热或死亡的不良事件。肺组织的组织病理学、免疫组织化学、rnascope和免疫荧光分析证明,纳米诱饵不仅有效减轻炎症性细胞浸润和减少肺纤维化,而且更重要的是,能够降低sars核衣壳蛋白(sars-n)和病毒rna的水平。为此,本公开的结果证明,lsc-纳米诱饵可充当治疗covid-19的有力且有效的治疗剂。
68.先前的研究表明,ace2是新型冠状病毒(sars-cov-2)的宿主受体,并且sars-cov-2的病毒进入取决于病毒刺突s1与宿主细胞上的ace2的结合。因此,抑制刺突s1与ace2的结合是对抗covid-19的可能的治疗策略。基于此,先前的研究集中于通过使用重组ace2(race2)蛋白如单独race2或与fc片段融合的race2(race2-fc)来阻断sars-cov-2进入。然而,这些基于蛋白质的中和策略受到施用后总体半衰期短的限制。此外,细胞外ace2的不需要的剂量和分布可能对身体造成未知的毒性影响。此外,除ace2外,细胞膜上的其他组分也
在病毒对接中发挥作用;因此,仅靶向ace2可能不够。
69.先前的研究表明通过利用基于细胞膜的纳米诱饵的多种抗微生物应用。例如,来自白纹伊蚊(c6/36)细胞膜包被的明胶纳米颗粒的纳米诱饵已被开发用于捕获寨卡病毒以预防病毒感染。此外,由于存在用于hiv结合的t细胞表面抗原,t细胞膜包被的纳米颗粒被用作hiv中和的诱饵。除了基于细胞膜的纳米诱饵外,工程化脂质体也被制造为诱饵靶标,以鳌合在体内活动性感染期间产生的细菌毒素。如本文进一步描述的,本公开的实施方案提供了用于covid-19的纳米诱饵治疗(图16)。纳米诱饵可使用市售的挤出装置从人肺细胞大规模产生。它们不仅表达天然人ace2,而且代表人肺细胞的模拟物,人肺细胞是sars-cov-2的主要靶标。
70.药物开发的一个问题是潜在脱靶效应和不需要的生物分布。本公开的实施方案提供了简单且临床相关的纳米诱饵递送方法,所述方法使用雾化器代替传统静脉内(iv)注射通过吸入进行(图4a)。吸入纳米诱饵导致治疗颗粒在肺中的直接累积,肺是sars-cov-2感染和复制的主要部位之一。仅通过一次单次吸入治疗,72小时后仍可在肺中发现did标记的纳米诱饵(图4b)。在整个72小时内,还在肝、肾和脾中检测到纳米诱饵,这可归因于纳米诱饵可能通过巨噬细胞进行的代谢。最近,纳米技术工具已被用于治疗covid-19,并且一些最近的观点和研究论文通过一些基本的体外或体内数据暗示了“纳米诱饵”或“纳米海绵”用于治疗sars-cov-2的潜力。然而,以前没有研究在任何活sars-cov-2感染动物模型中测试了纳米诱饵。
71.基于外泌体的vlp疫苗平台。冠状病毒疾病2019(covid-19)在大流行中席卷全球,对各国的金融和社会系统产生负面影响。迫切需要针对新型严重急性呼吸综合征冠状病毒2(sars-cov-2)的有效疫苗。在美国前两种获批的疫苗均是基于信使rna(mrna)的疫苗(由pfizer/biontech和moderna制造)。它们均需要深度冷冻才能运输和长期储存。此外,施用途径是肌内注射,因此只能由医疗保健提供者进行。这些限制使大流行中已经疲惫不堪的医疗保健系统受重压。为了规避此类限制,
72.本公开的实施方案包括具有以下优点的新型疫苗候选物:1)可冻干并在室温下稳定数周;2)可用于通过吸入递送在家中自我施用。
73.sars-cov-2属于冠状病毒家族,所述家族由包膜正链rna病毒组成,所述病毒利用刺突蛋白复合物来识别和结合至宿主细胞受体。具体来说,sars-cov和sars-cov-2刺突蛋白s1亚基中的受体结合结构域(rbd)结合至宿主气道上皮血管紧张素转化酶2(ace2)受体,然后通过s2亚基使病毒和宿主膜融合,从而使rbd成为中和抗体和疫苗的特异性靶标。先前的研究已经证明了sars-cov rbd作为有效中和抗体的靶标的功效。sars-cov-2的体外研究显示宿主抗体与rbd接合,从而结合并发挥中和作用。它还阻止了sars-cov-2和sars-cov进入宿主ace2表达细胞,从而表明它作为病毒附着抑制剂的潜力。然而,单独施用rbd并不允许特异性靶向递送,并且不能避免降解或快速清除。必须通过优化抗原呈递细胞(apc)的剂量的药物递送平台来保护rbd。
74.病毒样颗粒(vlp)和纳米颗粒(np)是能够增强靶向药物递送的强大药物递送载体。特别地,外泌体是一种在体内发现的天然存在的细胞外囊泡,从而使其成为靶向药物递送的天然和理想的递送囊泡。因为它们携带和表达其亲本细胞的rna、蛋白质和脂质并且表达亲本表面蛋白和受体,所以它们在靶向相同的组织受体细胞方面具有优势。它们含有由
具有治疗特性的蛋白质、脂质和核酸组成的分子组分的混合物。此外,可通过产生表面修饰来对外泌体进行工程化以表达蛋白质或肽来增强靶向性。
75.如本文进一步所述,肺类球体细胞(lsc)成功地来源于人肺供体样品。它们的再生能力已在啮齿动物模型中得到证实,并且正在人临床试验中进行测试(halt-ipf,www.clinicaltrials.gov)。lsc来源的外泌体(lsc-exo)的安全性和生物分布以前进行了研究,例如通过ipf啮齿动物模型中的雾化治疗。lsc-exo是用于肺治疗剂的天然np,来源于包括i型和ii型肺细胞和间充质细胞的异质肺细胞群。先前的研究也证实了在整个啮齿动物肺的支气管和实质中的成功外泌体递送。利用lsc-exo和rbd的特征,通过将rbd缀合到lsc-exo的表面上(rbd-exo)对可吸入疫苗进行了工程化,从而产生模拟天然病毒的形态学的vlp。之后,通过雾化递送rbd-exo。与报告的肌内注射covid-19疫苗相比,吸入的rbd-exo不仅诱导了中和抗体的产生,而且触发了粘膜免疫系统来产生抗原特异性分泌型iga(siga)。rbd-exo吸入能够抑制肺上皮细胞对病毒的摄取并诱导针对sars-cov-2的中和抗体(图10k)。
76.尽管已经针对covid-19提出了新型药理学和纳米医学治疗策略,但有效的疫苗接种仍然是控制和消除这种流行病的唯一方式。基于rbd的疫苗在产生能够预防和中和sars-cov-2的抗体应答方面已显示出临床前景。气道粘膜免疫应答在早期病原体入侵中起着不可或缺的作用,触发体液和细胞介导的免疫应答,从而触发全身应答。为此,将sars-cov-2rbd缀合到肺源性外泌体上作为可吸入vlp疫苗。这些vlp触发rbd特异性igg和iga的稳健生产,以中和sars-cov-2。lsc-exo是用于sars-cov-2vlp的理想平台。lsc及其来源的lsc-exo对于肺而言是天然的,与气道上皮细胞中发现的膜特征共享表面蛋白和受体。出于这个原因,外泌体在肺中分布更广且保留时间更长,并且增强了肺中apc的内化,从而提供与常用脂质体相比更具靶向性的递送载体。这些数据证明,rbd-exo疫苗接种导致体液和细胞免疫应答,从而保护免受小鼠中的sars-cov-2模拟物感染和仓鼠模型中的活sars-cov-2感染。重要的是,rbd-exo疫苗接种产生了高滴度的rbd特异性igg和iga,它们在保护肺部免受气道粘膜中的病毒入侵方面发挥关键作用。
77.尽管大多数报告的疫苗是通过肌内注射递送的,但本公开的实施方案证明,当外泌体用作疫苗载体时,吸入是有效的施用途径。无需使用针头,vlp的雾化非常容易,因为它可由单一个体在家中进行,并且因此避免在医疗机构由训练有素的专业人员进行施用。这简化物流配送,减轻大流行对医护人员的负担,并且大大减少对covid-19的暴露。另一个挑战是当前疫苗产品需要低至-20℃或-70℃的储存温度来确保稳定性和保存。然而,在运输中保持这样的温度是昂贵的,并且需要专门的容器来控制温度。抵达后,疫苗必须储存在深度冷冻器中以保持功效和保质期,但许多消费者(如医院)没有适当的设施配置或空间来容纳这些冷冻器,从而限制了疫苗分发。相反,rbd-exo vlp在室温下稳定并且可冻干,从而延长保质期、降低运输成本、方便配送并增加可及性。这些结果表明,这种室温稳定且可吸入的rbd-exo疫苗代表控制sars-cov-2感染和持续covid-19大流行的有希望的疫苗候选物。
78.本章节中使用的章节标题和本文的全部公开内容仅用于组构目的,并且不旨在进行限制。
79.1.定义
80.除非另有定义,否则本文使用的所有技术和科学术语均具有与本领域普通技术人
pharmaceutical sciences,easton pa.,mack publishing company,第19版,1995)描述了可与本发明结合使用的制剂。
87.适合用于雾化施用的制剂包括例如水性无菌注射溶液,所述无菌注射溶液可含有抗氧化剂、缓冲剂、抑菌剂和使所述制剂与预期接受者的血液等渗的溶质;以及水性和非水性无菌混悬液,所述无菌混悬液可包含悬浮剂和增稠剂。制剂可呈现于单剂量或多剂量容器中,例如密封安瓿和小瓶,并且可在冷冻干燥(冻干)条件下储存,仅需要在使用前即刻添加无菌液体载体(例如注射用水)。临时注射溶液和悬浮液可由无菌粉末、颗粒和片剂制备。应理解的是,除了上文特别提到的成分之外,本发明的制剂可包含与所讨论制剂类型有关的本领域常规的其他剂。
88.如本文所用的术语“药学上可接受的载体、赋形剂或媒介物”是指不会干扰活性成分的有效性或活性且对施用它的宿主无毒且由联邦或州政府的监管机构批准的或在美国药典或其他普遍认可的药典中列出的用于在动物中、并且更特别地在人中使用的介质。载体、赋形剂或媒介物包括稀释剂、粘合剂、粘结剂、润滑剂、崩解剂、填充剂、润湿剂或乳化剂、ph缓冲剂和混杂材料,如为了制备特定组合物可能需要的吸收剂。载体等的实例包括但不限于盐水、缓冲盐水、葡萄糖、水、甘油、乙醇以及其组合。用于活性物质的此类介质和剂的使用在本领域中是熟知的。
89.如本文所用的术语“培养”是指在适合于存活的受控条件下生长细胞或组织,通常在体外(例如,离体或体外)。当提及培养过程的细胞培养时,所述术语包括“扩增”、“传代”、“维持”等。培养细胞可导致细胞生长、分化和/或分裂。
90.如本文所用的术语“源自”是指细胞或生物样品(例如,血液、组织、体液等),并且指示细胞或生物样品是在某个时间点从所陈述来源获得的。例如,源自个体的细胞可表示直接从个体获得的原代细胞(例如,未修饰的)。在一些情况下,源自给定来源的细胞经历一轮或多轮细胞分裂和/或细胞分化,使得原始细胞不再存在,但后续细胞(例如,来自所有传代的子代细胞)将被理解为源自相同来源。所述术语包括直接获得、分离和培养,或获得、冷冻和解冻。术语“源自”还可指从组织或细胞获得的细胞的组分或片段,包括但不限于蛋白质、核酸、膜或膜的片段等。
91.如本文所用的术语“外泌体”是指可含有或在它们的膜中存在或在它们的膜内含有核酸、蛋白质、小分子治疗剂或其他生物分子并且可在身体或生物系统中的不同位置之间充当这种货物的载体的小分泌囊泡(通常约30nm至约250nm(或在颗粒不是类球体的情况下,最大尺寸))。如本文所用的术语“外泌体”有利地是指可具有治疗特性的细胞外囊泡,包括但不限于lsc外泌体。
92.外泌体可从多种生物来源分离,包括哺乳动物,如小鼠、大鼠、豚鼠、兔、狗、猫、牛、马、山羊、绵羊、灵长类动物或人。外泌体可从诸如血清、血浆、全血、尿液、唾液、母乳、眼泪、汗液、关节液、脑脊液、精液、阴道液、腹水和羊水的生物体液中分离。外泌体也可从实验样品,如取自经培养的细胞的培养基(“条件培养基”、细胞培养基(cell media)和细胞培养基(cell culture media))中分离。外泌体也可从组织样品如手术样品、活检样本和经培养的细胞中分离。当从组织来源分离外泌体时,可能需要将组织均质化以获得单细胞悬浮液,然后裂解细胞以释放外泌体。从组织样品中分离外泌体时,重要的是选择不会导致外泌体破坏的均质化和裂解程序。外泌体可从新鲜收集的样品或从冷冻或冷藏储存的样品中分离。
尽管不是必需的,但如果流体样品在沉淀前用体积排除聚合物澄清以除去样品中的任何碎片,则可获得更高纯度的外泌体。澄清方法包括离心、超速离心、过滤或超滤。
93.细胞外囊泡(如外泌体)内的遗传信息可容易地通过融合至受体细胞的膜并在细胞内将遗传信息释放到细胞中而传递。尽管外泌体作为一般类别的化合物代表巨大的治疗潜力,但外泌体的一般群体是几类核酸和蛋白质的组合,所述核酸和蛋白质具有一系列有利的和有害的生物效应。
94.如本文所用的术语“囊泡”或“纳米囊泡”可指由细胞分泌或源自细胞(例如,通过挤出过程)的囊泡,所述囊泡可具有与称为“外泌体”的直径相比更大的直径。囊泡和纳米囊泡(或者称为“微泡”或“膜囊泡”)可具有介于约10nm至约5000nm之间(例如,介于约50nm与1500nm之间、介于约75nm与1500nm之间、介于约75nm与1250nm之间、介于约50nm与1250nm之间、介于约30nm与1000nm之间、介于约50nm与1000nm之间、介于约100nm与1000nm之间、介于约50nm与750nm之间等)的直径(或在颗粒不是类球体的情况下,最大尺寸)。通常,细胞外囊泡的膜的至少部分是直接从细胞(也称为供体细胞)获得的。
95.当提及细胞或分子(例如核酸或蛋白质)时,术语“分离”或“分离的”指示细胞或分子与或已经与其天然、原始或先前的环境分离。例如,分离的细胞可从源自其宿主个体的组织中除去,但可在其他细胞存在下(例如,在培养物中)存在,或重新引入其宿主个体中。
96.如本文所用,如本文可互换使用的术语“受试者”和“患者”是指任何脊椎动物,包括但不限于哺乳动物(例如牛、猪、骆驼、美洲驼、马、山羊、兔、绵羊、仓鼠、豚鼠、猫、狗、大鼠和小鼠、非人灵长类动物(例如猴,诸如食蟹猴或恒河猴、黑猩猩、猕猴等)和人)。在一些实施方案中,受试者可以是人或非人。在一个实施方案中,受试者是人。受试者或患者可能正在进行各种形式的治疗。
97.如本文所用,术语“治疗(treat)”、“治疗(treating)”或“治疗(treatment)”在本文中各自可互换使用以描述逆转、减轻或抑制此类术语所适用的疾病和/或损伤或此类疾病的一种或多种症状的进展。取决于受试者的状况,所述术语还指预防疾病,并且包括预防疾病的发作,或预防与疾病(例如,病毒感染)相关的症状。治疗可以急性或慢性方式进行。所述术语还指在罹患疾病之前降低疾病或与这种疾病相关的症状的严重性。这种在罹患之前预防疾病或降低疾病的严重性是指将治疗施用于受试者,所述受试者在施用时并未罹患所述疾病。“预防”还指预防疾病或与这种疾病相关的一种或多种症状的复发。
98.除非本文另有定义,否则与本公开结合使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。例如,本文所述的与细胞和组织培养、分子生物学、免疫学、微生物学、遗传学以及蛋白质和核酸化学以及杂交结合使用的任何术语和所述领域的技术是本领域公知和通常使用的那些。术语的含义和范围应该是清楚的;然而,如果存在任何潜在的歧义,则本文提供的定义优先于任何词典或外部定义。另外,除非上下文另有要求,否则单数术语应包括复数且复数术语应包括单数。
99.2.纳米囊泡和相关组合物
100.本公开的实施方案包括包含多个纳米囊泡的组合物,所述多个纳米囊泡具有能够结合病毒的至少一种细胞表面蛋白。一般而言,根据本文进一步描述的方法(例如,挤出过程),纳米囊泡可源自任何细胞,包括但不限于肺类球体细胞(lsc)。如本领域普通技术人员基于本公开将认识到,源自细胞的纳米囊泡不是天然存在的;然而,它们可共享它们所来源
的亲本细胞的一种或多种特征。
101.在一些实施方案中,源自肺类球体细胞(lsc)的纳米囊泡包含细胞表面蛋白,所述细胞表面蛋白结合感染性病原体(如病毒或细菌)或被感染性病原体识别。在一个实施方案中,被感染性病原体识别的细胞表面蛋白是血管紧张素转化酶2(ace2)或其衍生物或片段。在一些实施方案中,ace2蛋白或其衍生物或片段对于细胞而言是内源性的(例如,存在于纳米囊泡所来源的亲本细胞上)。在一些实施方案中,ace2蛋白或其衍生物或片段对于细胞而言是外源性的(例如,不存在于纳米囊泡所来源的亲本细胞上)。外源性细胞表面蛋白包括可能已经进行工程化以在亲本细胞或纳米囊泡中表达但通常不是内源性存在的那些(例如,重组蛋白、肽和多肽)。
102.在一些实施方案中,至少一种细胞表面蛋白包括作为亲本细胞的标志物的其他蛋白值、肽或多肽。在lsc的情况下,其他细胞表面蛋白可包括但不限于aqp5、sftpc、cd68、epcam、cd90和/或muc5b。此类细胞表面蛋白可用作生物标志物和/或它们可用于分选或纯化目的。在一些情况下,细胞表面蛋白也被病毒或其他致病性生物体识别。
103.纳米囊泡的尺寸将取决于用于从亲本细胞获得它们的方法,以及其他因素,如纳米囊泡将被递送或施用于受试者以用于治疗目的的方式。在一些实施方案中,多个纳米囊泡包括在约50nm至约1000nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约50nm至约900nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约50nm至约800nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约50nm至约700nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约50nm至约600nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约50nm至约500nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约50nm至约400nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约100nm至约1000nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约200nm至约1000nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约300nm至约1000nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约400nm至约1000nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约500nm至约1000nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约600nm至约1000nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约700nm至约1000nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约00nm至约1000nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约00nm至约1000nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约200nm至约900nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约300nm至约800nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约400nm至约700nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约200nm至约400nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括在约300nm至约400nm范围内的平均尺寸。在一些实施方案中,多个纳米囊泡包括约300nm的平均尺寸。在一些实施方案中,多个纳米囊泡包括约310nm的平均尺寸。在一些实施方案中,多个纳米囊泡包括约320nm的平均尺寸。在一些实施方案中,多个纳米囊泡包括约330nm的平均尺寸。在一些实施方案中,多个纳米囊泡包括约340nm的平均尺寸。在一些实施方案中,多个纳米囊泡包括约350nm的平均尺寸。
104.在一些实施方案中,组合物还包含至少一种药学上可接受的赋形剂或载体。药学
上可接受的赋形剂和/或载体或诊断上可接受的赋形剂和/或载体包括但不限于无菌蒸馏水、盐水、磷酸盐缓冲溶液、基于氨基酸的缓冲液或碳酸氢盐缓冲溶液。所选择的赋形剂和所使用的赋形剂的量将取决于施用方式。特定受试者/患者的有效量可取决于诸如所治疗的疾患、患者的总体健康状况、施用途径和剂量以及副作用的严重程度的因素而有所不同。可获得治疗和诊断方法的指导(参见例如,maynard等人(1996)a handbook of sops for good clinical practice,interpharm press,boca raton,fla.;dent(2001)good laboratory and good clinical practice,urch publ.,london,uk)。对于本文所述的包含纳米囊泡的任何组合物,治疗有效量可最初从动物模型中确定。治疗有效剂量也可从已知表现出类似药理活性的人类数据,如其他佐剂来确定。对于胃肠外施用,可能需要更高的剂量。所施加的剂量可基于所施用的纳米囊泡和任何相应货物(例如疫苗)的相对生物利用度和效力进行调整。基于上述方法和本领域中熟知的其他方法调整剂量以实现最大功效完全在本领域的普通技术人员的能力范围内。
105.在一些实施方案中,多个纳米囊泡包括能够结合病毒(如冠状病毒)的细胞表面蛋白。在一些实施方案中,冠状病毒选自由以下组成的组:229e、nl63、oc43、hku1、mers-cov、sars-cov和sars-cov-2。冠状病毒是包膜rna病毒(正链rna病毒)的家族,其广泛分布于哺乳动物和鸟类中,主要引起呼吸道或肠道疾病,但在一些情况下引起神经病学疾病或肝炎。个别冠状病毒通常以物种特异性方式感染其宿主,并且感染可以是急性的或持续的。感染主要通过呼吸道和粪口途径传播。此病毒家族的最显著特征是基因组大小:冠状病毒在所有rna病毒(包括具有分段基因组的那些rna病毒)中具有最大的基因组。这种广泛的编码能力似乎即提供丰富的基因表达策略,并且也使丰富的基因表达策略成为必要。
106.在一些实施方案中,本公开的纳米囊泡包含囊泡内货物。在一些实施方案中,多个纳米囊泡可具有货物,所述货物包括至少一种治疗性蛋白质、肽、多肽、核酸分子、多核苷酸、mrna、sirna、mirna、反义寡核苷酸、药物或治疗性小分子。在一些实施方案中,货物可增强与病毒的结合和/或增强纳米囊泡针对病毒所发挥的治疗效果。
107.本公开的实施方案还包括产生用于治疗和/或预防病毒感染的多个纳米囊泡的方法。根据这些实施方案,所述方法包括培养纳米囊泡所来源的多个亲本细胞,如肺类球体细胞(lsc)。亲本细胞可在2d或3d细胞培养平台中培养。在一些实施方案中,所述方法包括使多个亲本细胞经受挤压过程以产生具有所需特征的多个纳米囊泡。在一些实施方案中,挤出过程包括使亲本细胞(例如,lsc)通过包括5μm、1μm和400nm孔径的膜过滤器中的至少一个的挤出机。如本领域普通技术人员将认识到,取决于所需的纳米囊泡尺寸和特征,其他过滤器尺寸和组合可用于挤出过程中。
108.在一些实施方案中,所述方法还包括使用超滤或本领域中已知的其他过滤方式纯化和浓缩多个纳米囊泡。在一些实施方案中,可基于一种或多种细胞表面蛋白的使用来选择、分选、纯化或浓缩纳米囊泡。
109.本公开的实施方案还包括组合物,所述组合物包含源自细胞的多个外泌体。一般来说,根据本文进一步描述的方法以及在pct/us2019/039721(其以引用的方式整体并入本文)中描述的那些方法,外泌体可源自任何细胞,包括但不限于肺类球体细胞(lsc)。如本领域普通技术人员基于本公开将认识到,源自细胞的外泌体不是天然存在的;然而,它们可共享它们所来源的亲本细胞的一种或多种特征。
110.根据这些实施方案,本公开的组合物包含多个外泌体,所述多个外泌体包含在所述多个外泌体的表面上的至少一种膜相关蛋白(例如,细胞表面受体或结合蛋白)。在一些实施方案中,多个外泌体的表面上的膜相关蛋白是病毒特异性蛋白,如可在受试者中诱导免疫原性应答的病毒蛋白、肽或多肽(例如,病毒抗原或表位)。在一些实施方案中,外泌体的表面上的病毒特异性蛋白包括冠状病毒(例如,229e、nl63、oc43、hku1、mers-cov、sars-cov和sars-cov-2)的刺突蛋白(s蛋白)或其片段或衍生物。如本领域普通技术人员基于本公开将认识到,可产生多个外泌体以在它们的表面上包含能够在受试者中产生免疫原性应答的任何其他膜相关蛋白作为疫苗组合物的一部分。
111.在一些实施方案中,可产生多个外泌体以包括包含在它们的膜内的一种或多种治疗剂(例如,货物),所述一种或多种治疗剂可进一步增强受试者中的免疫应答。此类治疗剂可包括可增强受试者中的免疫应答的任何蛋白质、肽、多肽、核酸、小分子化合物或其任何组合或衍生物。在一些实施方案中,治疗剂是mrna或其片段,其可以是用于产生更多病毒抗原或抗原表位以刺激受试者的免疫系统作为疫苗组合物的一部分的基础。在一些实施方案中,mrna可编码与上述多个外泌体的表面上的膜相关蛋白相同或不同的病毒抗原或抗原表位。在一些实施方案中,mrna可编码冠状病毒(例如,229e、nl63、oc43、hku1、mers-cov、sars-cov和sars-cov-2)的刺突蛋白(s蛋白)或其片段或衍生物。
112.在一些实施方案中,多个外泌体的表面上的膜相关蛋白包含能够结合病毒的蛋白质。根据这些实施方案,外泌体可用作药物递送平台,以用于用一种或多种抗病毒治疗剂靶向病毒。例如,在一些实施方案中,能够结合病毒的蛋白质包括血管紧张素转化酶2(ace2)或其衍生物或片段,其已被鉴定为sars-cov-2(covid-19)的结合位点。如本领域普通技术人员基于本公开将认识到的,可产生多个外泌体以在它们的表面上包含能够与病毒结合的任何其他膜相关蛋白作为治疗性抗病毒药物递送平台的一部分。
113.根据这些实施方案,可产生外泌体以包含一种或多种抗病毒治疗剂,如通过靶向病毒在受试者内感染或繁殖的能力来降低病毒载量的剂。抗病毒治疗剂可包括但不限于sars-cov-2(covid-19)抗病毒剂,如瑞德西韦、干扰素β-1b和/或洛匹那韦-利托那韦等。在一些实施方案中,抗病毒治疗剂是瑞德西韦、干扰素β-1b和/或洛匹那韦-利托那韦,并且它包含在多个lsc外泌体内以靶向sars-cov-2(covid-19)。
114.在一些实施方案中,本文所述的外泌体组合物还包含至少一种药学上可接受的赋形剂或载体。本公开的实施方案包括药物组合物,所述药物组合物包含当递送至有需要的动物或人受试者时有效调节肺部病理学疾患的量的多个lsc来源的外泌体。在本公开的一些实施方案中,肺部病理学疾患是病毒感染,如冠状病毒感染(例如,covid-19)。
115.在本公开的一些实施方案中,药物组合物可包含至少一种分离的lcs外泌体,所述分离的lcs外泌体在其膜表面上包含或在其内含有多肽、肽、核酸或小分子治疗剂。在本公开的一些实施方案中,药物组合物可包含从肺类球体细胞条件培养基分离的肺类球体细胞来源的外泌体群体。在本公开的一些实施方案中,核酸可以是mirna(例如,编码免疫原性病毒表位的mrna)。在本公开的一些实施方案中,施用于动物或人受试者的呼吸道的药物组合物还可包含药学上可接受的载体。根据这些实施方案,药物组合物在受试者中诱导免疫应答。例如,组合物可诱导针对外源性多肽的粘膜和全身免疫应答。在一些实施方案中,组合物增加对病毒抗原具有特异性的免疫球蛋白a(iga)抗体。在一些实施方案中,组合物增加
对病毒抗原具有特异性的免疫球蛋白g(igg)抗体。在一些实施方案中,药物组合物在受试者中诱导免疫应答,使得产生足够的抗体来中和病毒载量。
116.在一些实施方案中,本公开的疫苗组合物在室温(例如,15℃-25℃)下是稳定的。在一些实施方案中,本公开的疫苗组合物在低于室温下是稳定的。在一些实施方案中,本公开的疫苗组合物在高于室温下是稳定的。在一些实施方案中,本公开的疫苗组合物在室温下稳定至少6小时。在一些实施方案中,本公开的疫苗组合物在室温下稳定至多包括6个月。在一些实施方案中,本公开的疫苗组合物在室温下稳定约1天至约6个月、约1天至约5个月、约1天至约4个月、约1天至约3个月、约1天至约2个月、约1天至约1个月、约1天至约4周、约1天至约3周、约1天至约2周和约1天至约1周。
117.药学上可接受的赋形剂和/或载体或诊断上可接受的赋形剂和/或载体包括但不限于无菌蒸馏水、盐水、磷酸盐缓冲溶液、基于氨基酸的缓冲液或碳酸氢盐缓冲溶液。所选择的赋形剂和所使用的赋形剂的量将取决于施用方式。特定受试者/患者的有效量可取决于诸如所治疗的疾患、患者的总体健康状况、施用途径和剂量以及副作用的严重程度的因素而有所不同。可获得治疗和诊断方法的指导(参见例如,maynard等人(1996)a handbook of sops for good clinical practice,interpharm press,boca raton,fla.;dent(2001)good laboratory and good clinical practice,urch publ.,london,uk)。对于本文所述的包含纳米囊泡的任何组合物,治疗有效量可最初从动物模型中确定。治疗有效剂量也可从已知表现出类似药理活性的人类数据,如其他佐剂来确定。对于胃肠外施用,可能需要更高的剂量。所施加的剂量可基于所施用的纳米囊泡和任何相应货物(例如疫苗)的相对生物利用度和效力进行调整。基于上述方法和本领域中熟知的其他方法调整剂量以实现最大功效完全在本领域的普通技术人员的能力范围内。
118.本文所述的药物组合物可使用一种或多种生理学上可接受的载体以常规方式配制,所述载体包括赋形剂和助剂,其有助于将活性成分加工成用于药物用途的组合物。配制药物组合物的方法是本领域已知的(参见例如“remington’s pharmaceutical sciences,”mack publishing co.,easton,pa)。在一些实施方案中,对所述药物组合物进行压片、冻干、直接压制、常规混合、溶解、制粒、研磨、乳化、包封、包埋或喷雾干燥以形成片剂、颗粒、纳米颗粒、纳米胶囊、微胶囊、微片剂、丸剂或粉末,其可以是肠溶衣或未包衣的。适当的制剂取决于施用途径。
119.本文所述的疫苗组合物可配制成呈任何合适的剂型(例如,液体、胶囊、小袋、硬胶囊、软胶囊、片剂、肠溶包衣片剂、悬浮粉末、颗粒或用于口服施用的基质持续释放制剂)和用于任何合适类型的施用(例如,口服、可吸入、局部、可注射、立即释放、脉冲释放、延迟释放或持续释放)的药物组合物。疫苗组合物可被配制成药物组合物,所述药物组合物包含一种或多种药学上可接受的载体、增稠剂、稀释剂、缓冲剂(buffer)、缓冲剂(buffering agent)、表面活性剂、中性或阳离子脂质、脂质复合物、脂质体、渗透促进剂、载体化合物和其他药学上可接受的载体或剂。例如,药物组合物可包括但不限于添加碳酸氢钙、碳酸氢钠、磷酸钙、各种糖和多种类型的淀粉、纤维素衍生物、明胶、植物油、聚乙二醇和表面活性剂,包括例如聚山梨醇酯20。在一些实施方案中,本发明的遗传工程化的细菌可配制在碳酸氢钠溶液中,例如1摩尔碳酸氢钠溶液(以缓冲酸性细胞环境,例如胃)。遗传工程化的细菌可以中性或盐形式施用和配制。药学上可接受的盐包括与阴离子形成的盐,诸如衍生自盐
酸、磷酸、乙酸、草酸、酒石酸等的盐;和与阳离子形成的盐,诸如衍生自钠、钾、铵、钙、氢氧化铁、异丙胺、三乙胺、2-乙氨基乙醇、组氨酸、普鲁卡因等的盐。
120.3.治疗方法
121.本公开的实施方案还包括一种治疗病毒感染的方法,所述方法包括向有需要的受试者施用上述任何组合物。在一些实施方案中,组合物经口服、胃肠外、肌内、腹膜内、静脉内、脑室内、脑池内、皮下、通过注射或输注、通过吸入、喷雾、经鼻、阴道、直肠、舌下或局部施用来施用。在一些实施方案中,组合物通过雾化施用于肺组织。
122.在一些实施方案中,多个纳米囊泡或外泌体的施用降低受试者中的病毒载量。如本领域普通技术人员基于本公开将认识到,包含多个纳米囊泡或外泌体的药物组合物可以有效的量施用,使得实现病毒(例如,sars-cov-2)的中和。在一些实施方案中,组合物以每kg体重约1x107至约1x10
13
个颗粒的剂量施用(例如,通过吸入)。在一些实施方案中,组合物以每kg体重约1x108至约1x10
12
个颗粒的剂量施用。在一些实施方案中,组合物以每kg体重约1x109至约1x10
11
个颗粒的剂量施用。在一些实施方案中,组合物以每kg体重约1x107个颗粒、每kg体重约1x108个颗粒、每kg体重约1x109个颗粒、每kg体重约1x10
10
个颗粒、每kg体重约1x10
11
个颗粒、每kg体重约1x10
12
个颗粒、每kg体重约1x10
13
个颗粒、每kg体重约1x10
14
个颗粒或每kg体重约1x10
15
个颗粒的剂量施用。
123.根据这些实施方案,本公开的多个纳米囊泡或外泌体可在施用后在受试者的组织(例如,肺组织)中持续存在至少72小时。在一些实施方案中,多个纳米囊泡或外泌体在受试者中持续存在至少12小时、至少24小时、至少36小时、至少48小时、至少60小时、至少72小时、至少84小时和至少96小时。在一些实施方案中,取决于所施用的剂量和受试者的生理特征,每24小时、每48小时、每72小时或每96小时施用多个纳米囊泡或外泌体。
124.在一些实施方案中,单剂量的本公开的多个纳米囊泡或外泌体可对受试者发挥有益效果(例如,促进病毒清除、减少组织损伤、降低病毒感染率等)。在一些实施方案中,需要两个或更多个剂量来提供有益效果。在一些实施方案中,需要三个或更多个剂量来提供有益效果。在一些实施方案中,需要四个或更多个剂量来提供有益效果。在一些实施方案中,需要五个或更多个剂量来提供有益效果。在一些实施方案中,需要六个或更多个剂量来提供有益效果。在一些实施方案中,需要七个或更多个剂量来提供有益效果。在一些实施方案中,需要八个或更多个剂量来提供有益效果。在一些实施方案中,需要九个或更多个剂量来提供有益效果。在一些实施方案中,需要十个或更多个剂量来提供有益效果。
125.在一些实施方案中,纳米囊泡(例如,纳米诱饵)和lsc外泌体可用于治疗和/或预防病毒感染。在一些实施方案中,病毒感染由冠状病毒(例如,229e、nl63、oc43、hku1、mers-cov、sars-cov和sars-cov-2)引起。在一些实施方案中,所述组合物经口服、胃肠外、肌内、腹膜内、静脉内、脑室内、脑池内、气管内、鼻内、皮下、通过注射或输注、通过吸入、喷雾、经鼻、阴道、直肠、舌下或局部施用来施用。在一些实施方案中,组合物通过雾化施用于肺组织。在一些实施方案中,所述病毒是冠状病毒。在一些实施方案中,冠状病毒选自由以下组成的组:229e、nl63、oc43、hku1、mers-cov、sars-cov和sars-cov-2。
126.本公开的实施方案的重要优点之一包括使用lsc来源的外泌体作为疫苗递送平台。也就是说,胃肠外疫苗接种的这种替代策略包括在传播和复制点:呼吸道和肠粘膜靶向sars-cov-2。保护粘膜和相关的初始细胞靶标的疫苗策略可对于防止sars-cov-2感染和复
制至关重要。粘膜免疫系统在许多方面独立于全身免疫系统。例如,90%的粘膜iga是局部产生的,并且粘膜免疫的诱导最佳通过粘膜疫苗接种实现。虽然疫苗测试的重点通常是诱导中和抗体,但iga已显示以更广泛的效应功能,包括免疫排斥、病原体聚集、细胞内中和、病毒排泄(反向转胞吞作用)以及经典中和来防止病毒感染。如本文进一步描述,吸入的rbd-exo疫苗不仅诱导了中和抗体的产生,而且触发了粘膜免疫系统来产生抗原特异性分泌型iga(siga)。rbd-exo吸入抑制肺上皮细胞对病毒的摄取并诱导针对sars-cov-2的中和抗体。
127.如本领域普通技术人员基于本公开将认识到,由本文所述的疫苗组合物诱导的中和抗体可结合至任何已知的或尚未发现的冠状病毒,例如冠状病毒oc43、冠状病毒229e、冠状病毒nl63、冠状病毒hku1、mers-cov、sars-cov或sars-cov-2(covid-19)。在一些实施方案中,由本公开的疫苗组合物产生的中和抗体是针对sars-cov-2(covid-19)。在本公开的上下文中,“中和抗体”可包括与病毒(例如,冠状病毒)结合并干扰病毒感染宿主细胞的能力的抗体。已知冠状病毒刺突蛋白引发有效中和抗体和t细胞应答。病毒(例如,冠状病毒oc43、冠状病毒229e、冠状病毒nl63、冠状病毒hku1、mers-cov、sars-cov或sars-cov-2(covid-19))进入细胞并建立感染的能力是通过其刺突糖蛋白与人细胞表面受体的相互作用介导的。在冠状病毒的情况下,刺突蛋白是从冠状病毒病毒粒子的表面突出的大型i型跨膜蛋白三聚体。每种刺突蛋白包含大的胞外结构域(包含s1和s2)、跨膜锚和短细胞内尾部。胞外结构域的s1亚基通过其受体结合结构域(rbd)介导病毒粒子与宿主细胞表面受体的结合。s2亚基通过经历结构变化与宿主和病毒膜融合。
128.sars-cov-2利用刺突糖蛋白与细胞受体ace2相互作用(zhou等人,nature 579:270-273,doi:10.1038/s41586-020-2012-7(2020);hoffmann等人,cell,s0092-8674(0020)30229-30224,doi:10.1016/j.ce ll.2020.02.052(2020)doi:10.1016/j.cell.2020.02.052(2020)。sars-co v-2刺突蛋白的氨基酸序列以登录号qhd43416保藏在美国国家生物技术信息中心(ncbi)。与ace2的结合触发细胞膜融合事件级联以用于病毒进入。最近确定了与ace2的n末端肽酶结构域结合的sars-cov-2rbd的高分辨率结构,并且总体ace2结合机制在sars-c ov-2与sars-cov rbd之间几乎相同,表明这两种病毒之间的趋同ace2结合进化(gui等人,cellres 27,119-129,doi:10.1038/cr.2016.152(2017);song等人,plos pathog 14,e1007236-e1007236,doi:10.1371/journal.ppat.1007236(2018);yuan等人,nat commun 8,15092-15092,doi:10.1038/ncomms15092(2017);和wan等人,j virol,jvi.00127-00120,doi:10.1128/jvi.00127-20(2020))。这表明例如通过中和抗体破坏rbd和ace2相互作用将阻止sars-cov-2进入靶细胞。包含冠状病毒刺突蛋白的受体结合结构域(rbd)的肽可使用常规分子生物学技术,如本文公开的那些制备。各种冠状病毒刺突蛋白的rbd的核酸和氨基酸序列是本领域已知的(参见例如,tai等人,cell mol immunol 17,613-620(2020).doi.org/10.1038/s41423-020-0400-4;和chakraborti等人,virology journal第2卷,文章编号:73(2005);以及chen等人,biochemical and biophysical research commun ications,525(1):135-140(2020))。
129.在另一个方面,本公开的实施方案涵盖治疗动物或人肺部系统的病理学疾患的方法,其中所述方法包括向动物或人受试者的呼吸道区域施用药物组合物,所述药物组合物包含当递送至所述有需要的动物或人受试者时有效调节肺部病理学疾患的量的多个肺类
球体细胞来源的外泌体。在本公开的这一方面的一些实施方案中,肺部病理学疾患是病毒感染,如冠状病毒感染(例如,covid-19)。在本公开的这一方面的一些实施方案中,药物组合物可包含从肺类球体细胞条件培养基分离的肺类球体细胞来源的外泌体群体。
130.本公开的各种组合物提供了赋予优势和/或有益的药代动力学特征的剂型、制剂和方法。本公开的组合物可以纯或基本上纯的形式、以其药学上可接受的盐的形式以及还以包括无水或水合形式的其他形式用于剂型中。有益的药代动力学特征可通过施用适合每天一次、每天两次或每天三次或更多次施用的制剂或剂型来获得,所述制剂或剂型包含以足以向使用环境提供所需浓度或剂量的组合物以治疗本文公开的疾病的量存在的本公开的一种或多种组合物。
131.可以基本上任何所需的时间表用本公开的组合物或其组合物或单位剂量治疗受试者。它们可每天施用一次或多次,特别是每天1或2次、每周一次、每月一次或连续施用。然而,可不那么频繁地治疗受试者,如每隔一天或每周一次,或者更频繁地治疗受试者。组合物或组合物可施用于受试者持续约或至少约24小时、2天、3天、1周、2周至4周、2周至6周、2周至8周、2周至10周周、2周至12周、2周至14周、2周至16周、2周至6个月、2周至12个月、2周至18个月、2周至24个月或超过24个月,定期地或连续地。可通过以足以提供所需剂量的组合物的量施用适合于每天一次、两次或三次施用的制剂或剂型来获得有益的药代动力学特征。某些剂型和制剂可使本公开组合物的峰值与谷值血浆和/或脑水平之间的变化最小化,并且特别是提供持续治疗有效量的组合物。本公开还涵盖包含一定量的本公开的一种或多种组合物的制剂或剂型,所述制剂或剂型在给药期内,特别是24小时给药期内产生治疗有效量的组合物。本公开的药物或治疗可包含单位剂量的至少一种本公开的组合物以提供治疗效果。“单位剂量”或“剂量单位”是指单一的(例如,单剂量),其能够施用于受试者并且可容易地处理和包装,保持为物理上和化学上稳定的包含活性剂本身或与一种或多种固体或液体药物赋形剂、载体或媒介物的混合物的单位剂量。
132.4.材料和方法
133.ace2纳米诱饵
134.由严重急性呼吸综合征冠状病毒2(sars-cov-2)引起的冠状病毒疾病2019(covid-19)已发展成为全球大流行病,并且迄今为止尚未批准任何特定抗病毒治疗。血管紧张素转化酶2(ace2)在sars-cov-2发病机制中起重要作用,因为它允许病毒进入宿主细胞。本公开的实施方案证明,源自人肺类球体细胞(lsc)的ace2纳米诱饵可结合并中和sars-cov-2且保护宿主肺细胞免受感染。例如,在小鼠中,纳米诱饵通过吸入疗法递送,并在递送后在肺中驻留超过72小时。此外,吸入纳米诱饵加速了sars-cov-2模拟物从肺部的清除,没有观察到的毒性。在用活sars-cov-2激发的食蟹猴中,通过吸入递送的四个剂量的纳米诱饵促进了病毒清除并减少了肺损伤。本文所述的结果表明lsc-纳米诱饵可充当治疗covid-19的潜在治疗剂。
135.纳米诱饵的产生。纳米诱饵通过挤出机(avestin liposofast lf-50,avestin,inc)源自lsc或hek293细胞(crl-1573tm)。收集细胞并以5
×
106个细胞/ml的浓度悬浮于pbs中。可立即挤出大量细胞或将其储存在-80℃直至准备就绪。将细胞顺序地通过5μm、1μm和400nm孔径的聚碳酸酯膜过滤器(avanti polar lipids,inc.)通过挤出机两次。使用超滤离心管(100kda mwco;millipore)纯化和浓缩所得纳米诱饵,并以4,500g离心10
分钟并用pbs洗涤。使用纳米颗粒追踪分析系统(nanosight,malvern)测量纳米诱饵的尺寸和浓度。将纳米诱饵在4℃下储存一周或长期储存在-80℃。使用免疫印迹、免疫染色、流式细胞术和透射电子显微镜(tem)与免疫金标记来检测纳米诱饵上的ace2受体。
136.使用elisa进行的ace2分析。收集大约5
×
106个lsc和hek293细胞,并且制备10
10
个lsc-纳米诱饵和hek293-纳米诱饵。根据制造商的说明书,使用ace2 elisa试剂盒(abcam,ab235649)对它们进行分析。
137.纳米诱饵的体外内化实验。将人巨噬细胞原代细胞和lsc(104个细胞/ml)接种在4孔培养室载玻片(thermo fisher scientific)中。然后将纳米诱饵(1x 106个细胞/ml)用did标记并与单独巨噬细胞或lsc以及两者的共培养物(1:1)一起培养以模拟体内微环境。孵育4小时后,通过用1x pbs洗涤3次除去游离纳米诱饵。使用4% pfa固定细胞,然后使用巨噬细胞(cd4;12-0041-82,invitrogen)和lsc(cd90;11-0909-42,invitrogen)的标志物进行免疫细胞化学染色并用olympus fluoview共聚焦显微镜成像。此外,为了定量不同细胞类型对纳米诱饵的内化率,将细胞和纳米诱饵如前所述在t75烧瓶中培养并收集用于流式细胞术分析(cytoflex;beckman coulter)。
138.纳米诱饵的体外刺突s1中和实验。将重组刺突s1(sino biological 40591-v08h,10ng/ml,mw=76.5kda)以不同浓度(5
×
109、1
×
109、2
×
108、4
×
107、8
×
106、1.6
×
106和3.2
×
105)添加至纳米诱饵并孵育三小时。之后,通过超速离心(100kda)除去未结合的刺突s1。根据制造商的方案,使用elisa试剂盒(sino biological sars-cov-2spike elisa试剂盒,sino biological)测定与纳米诱饵结合之前和之后的刺突s1。为了研究在原代肺来源的细胞(lsc)中用纳米诱饵中和刺突s1,首先根据制造商的说明书使用nhs-罗丹明(46406,thermo fisher scientific)标记刺突s1。首先将rhb-刺突s1(100ng)在4孔载玻片中与lsc(2
×
104)一起孵育1小时,然后用pbs洗涤3次。之后,添加did标记的纳米诱饵(2
×
107)并再孵育4小时。将细胞洗涤并使用4% pfa固定细胞,之后用alexa fluortm488鬼笔环肽(invitrogentma12379)染色。使用olympus fluoview共聚焦显微镜对细胞进行成像。
139.sars-cov-2模拟病毒的产生。将刺突s1(40591-v08h;sino biological)缀合至慢病毒(cellomics technology llc)以创建sars-cov-2模拟物。通过化学相互作用将his标记的刺突s1连接至ni次氮基三乙酸酯(ni-nta)。首先将含巯基的nta(n-[nα,nα-双(羧甲基)-l-赖氨酸]-12-巯基十二酰胺)与4-(n-马来酰亚胺基甲基)环己烷-1-羧酸3-磺基-n-羟基琥珀酰亚胺酯钠盐(磺基-smcc)反应得到nta-smcc,然后添加至慢病毒中。nta基团通过慢病毒上的-nh2基团和nta-smcc上的n-羟基琥珀酰亚胺酯与慢病毒缀合。使用超滤管(100kda mwco;millipore)通过离心除去游离nta-smcc,得到sars-cov-2模拟病毒(刺突s1-慢病毒)。使用tem确认慢病毒上成功缀合的刺突s1。简言之,将sars-cov-2模拟物与抗刺突s1抗体在4℃下孵育过夜。使用超滤管(100kda mwco;millipore)除去游离抗体并用pbs洗涤3次。将sars-cov-2模拟物上的刺突s1用免疫金(10nm)抗体标记,并进行负染色以用于tem可视化。根据制造商的方案,使用elisa(sino biological sars-cov-2spike elisa试剂盒,sino biological)测定慢病毒上刺突s1的缀合效率。
[0140]
细胞中的sars-cov-2模拟病毒。将lsc细胞(104个细胞/ml)接种在8孔培养室载玻片(thermo fisher scientific)中并使其粘附24小时。将sars-cov-2模拟物(104tu/ml)添加至8孔载玻片中并孵育4小时。之后,用pbs洗涤lsc细胞两次以除去非内化的sars-cov-2
模拟物,并在37℃下用100μm lyso染料(invitrogen,绿色)染色30分钟。随后,用含有4,6-二脒基-2-苯基吲哚(dapi,invitrogen,waltham,ma,usa)的prolong gold抗荧光衰减封固剂固定载玻片,并在具有olympus uplansapo 60x物镜(olympus;1-u2b832,shinjuku,tokyo,japan)的olympus fluoview clsm(olympus;fv3000,shinjuku,tokyo,japan)上成像。
[0141]
sars-cov-2模拟物中和实验。首先使用dii标记纳米诱饵。之后,将200μl于ph 9.6包被缓冲液中的sars-cov-2模拟物(5
×
105)添加至96孔板的每个孔中,并在4℃下孵育过夜以进行包被。此外,将没有刺突s1的慢病毒也包被至板上作为对照。孵育后,除去蛋白质溶液,并用1
×
pbs洗涤孔。为了研究结合,将板与浓度为1
×
104、2
×
104、4
×
104、8
×
104、1.6
×
105、3.2
×
105、6.4
×
105、1.28
×
106的dii标记的纳米诱饵一起在室温下孵育两小时。之后,将板用1
×
pbs冲洗3次,并使用酶标仪(molecular devices)测定荧光强度。
[0142]
通过icc和流式细胞术评估sars-cov-2模拟物与lsc的相互作用。首先将rhb-nhs用nta标记的慢病毒重新激活,然后用s1蛋白修饰以合成rhb标记的sars-cov-2模拟物。将lsc(104个细胞/ml)接种在4孔培养室载玻片中。将rhb标记的慢病毒(104tu/ml)、rhb标记的sars-cov-2模拟物(104tu/ml)、rhb标记的sars-cov-2模拟物(104tu/ml)+lsc纳米诱饵(105)、rhb标记的sars-cov-2模拟物(104tu/ml)+hek纳米诱饵(105)分别与lsc一起孵育。孵育4小时后,除去游离sars-cov-2模拟物并用pbs洗涤3次。将细胞用4% pfa固定,用lsc标志物染色(fitc-cd90;11-0909-42,invitrogen)染色,并用olympus fluoview共聚焦显微镜成像。通过流式细胞术分析(cytoflex;beckman coulter)检查细胞对sars-cov-2模拟物的内化。
[0143]
纳米诱饵保护肺细胞免受sars-cov-2模拟病毒感染。进行了实验以测试纳米诱饵是否能够中和sars-cov-2模拟病毒并保护肺细胞免受感染。将巨噬细胞和lsc(1:1)在4孔培养室载玻片中共培养,并且添加rhb标记的慢病毒-刺突(104tu/ml)和did标记的纳米诱饵(105)。孵育两小时后,除去游离的rhb标记的慢病毒-刺突和did标记的纳米诱饵,并使用pbs洗涤样品3次。将细胞用4% pfa固定,用lsc(fitc-cd90;11-0909-42,invitrogen)或巨噬细胞(cd4)标志物染色,并用olympus fluoview共聚焦显微镜成像。进行流式细胞术分析以确认显微术数据。
[0144]
纳米诱饵在小鼠中的生物分布。所有动物程序均由北卡罗莱纳州立大学机构动物护理和使用委员会(iacuc)批准(方案#19-806-b)。雄性cd1小鼠(7周)获自charles river laboratory(massachusetts,usa)。使用雾化器(pari trek s便携式压缩机雾化器气溶胶系统;047f45-lcs)通过吸入治疗将did标记的纳米诱饵(每kg体重1x10
10
个颗粒)递送至cd1小鼠。在24、48和72小时对小鼠实施安乐死。收集所有主要器官并冷冻切片,以用于吸入后纳米诱饵体内生物分布的进一步免疫荧光分析。
[0145]
小鼠中纳米诱饵对sars-cov-2模拟病毒的体内清除。在进行清除测定之前,通过elisa分析(ab235649,abcam)对纳米诱饵上ace2的水平进行定量,并确定为每个纳米诱饵112个ace2。首先使用雾化器(pari trek s便携式压缩机雾化器气溶胶系统;047f45-lcs)通过吸入治疗将af647标记的sars-cov-2模拟物(每kg体重5x106)递送至雄性cd1小鼠(7周)。24小时后,分别吸入纳米诱饵(每kg体重1x10
10
个颗粒)或在纳米诱饵上具有相同量的ace2的游离race2。pbs治疗用作对照。收集肺并使用xenogen活体成像仪(ivis)在治疗后1、
2、3、4、5和6天成像。此外,对肺组织进行冷冻切片,以用于吸入后体内sars-cov-2模拟物生物分布的进一步分析。收集血液样品用于根据制造商的说明书进行细胞因子阵列分析(小鼠细胞因子阵列c1000,raybiotech)。
[0146]
小鼠中的毒性研究。通过吸入将雄性cd1小鼠(7周)用pbs、lsc-或hek-纳米诱饵(每kg体重1x 10
10
个颗粒)进行治疗。治疗14天后,收集血液(验血)和主要器官(h&e)用于毒性评价。
[0147]
非人灵长类动物研究。所有动物研究均按照所有相关的地方、州和联邦法规进行,并由bioqual机构动物护理和使用委员会(iacuc)在批准的iacuc#20-090p下批准。通过平衡随机化分配六只食蟹猴(三只雌性,三只雄性)。所有动物都圈养在bioqual,inc.(rockville,md)。使用鼻内和气管内途径用sars-cov-2对猕猴进行激发。将病毒接种物(0.5ml)逐滴施用到每个鼻孔中,并且将使用french橡皮导管/饲管,尺寸10,无菌(切割4
”‑
6”长度)气管内递送1.0ml的病毒接种物。将猕猴用1.1x10
5 pfu sars-cov-2的总剂量接种。在激发后2-5天,每天使用雾化和贴合面罩通过吸入施用pbs或lsc-纳米诱饵。在整个本公开中监测或收集支气管肺泡灌洗液(bal)、鼻拭子(ns)、血液、体重和体温。在激发后第8天对猕猴进行尸检。所有免疫学和病毒学测定均以盲法进行。
[0148]
统计数据和重现性。所有实验独立进行至少3次。结果显示为平均值
±
sd。使用双尾非配对学生t检验进行任何两组之间的比较。对于多组比较,单因素anova和双因素anova与邦弗朗尼后校正一起使用。小于0.05的p值被视为统计学上显著的。
[0149]
细胞培养。购买人巨噬细胞原代细胞(celprogen)并在具有人巨噬细胞原代细胞培养完整细胞外基质(目录号e36070-01)和含血清培养基(目录号m36070-01s)的预包被烧瓶中培养。人肺类球体细胞(lsc)和外植体来源的细胞(edc)是由从北卡罗莱纳大学教堂山分校的囊性纤维化和肺部疾病研究和治疗中心获得的健康全肺供体产生的,并如前所述进行扩增。人肺组织收集和使用由北卡罗来纳大学教堂山分校的irb批准,并且在组织收集之前从所有受试者获得了知情同意。在本公开中进行的涉及人样品的所有程序和实验都根据irb的伦理标准和赫尔辛基宣言设定的指导方针进行。人肺成纤维细胞(pcs-201-013tm)获自atcc。在本公开中进行的涉及人样品的所有程序都根据机构研究委员会的伦理标准和赫尔辛基宣言设定的指导方针进行。
[0150]
免疫印迹和免疫染色。在1:1000稀释度下通过蛋白质印迹分析lsc和edc细胞裂解物的ace2(ma5-31394;invitrogen和pa5-85139;invitrogen)和β-肌动蛋白(ma5-15739;invitrogen),然后在1:10,000稀释度下与相应的hrp缀合的第二抗体孵育一小时。在bio-rad chemidoc上可视化印迹。对固定在4%多聚甲醛(pfa)中的细胞或冷冻切片组织载玻片进行免疫染色,所述载玻片透化并用含有0.1%皂苷(47036;sigma-aldrich)的dako蛋白封闭溶液(dako;x0909)封闭。在1:100-1:200的稀释度下将细胞和组织用针对ace2(ma5-31394;invitrogen和pa5-85139;invitrogen)、sftpc(ab3786;abcam)、鬼笔环肽(ab176753;abcam)、cd4(12-0041-82,invitrogen)、cd90(11-0909-42,invitrogen)和cd68(ab955;abcam)的抗体染色。将载玻片在olympus fluoview共聚焦显微镜上成像并在imagej(imagej.nih.gov/ij/)上进行分析。
[0151]
流式细胞术。用macs流动缓冲液(130-091-222;macs)洗涤细胞并用bd cytofix/cytoperm(554714;bd)透化,之后与针对ace2(pa5-85139;invitrogen)、epcam(ab71916;
abcam)、cd90(555595;bd)、muc5b(ab77995;abcam)和vwf(ab11713;abcam)的抗体一起孵育。通过在4℃下将颗粒结合至4μm醛/硫酸酯乳胶珠粒(a37304;thermo fisher)过夜来制备纳米诱饵。通过在室温下将纳米诱饵-珠粒混合物与等体积的200nm甘氨酸一起孵育30分钟、然后用macs流动缓冲液洗涤两次来终止结合反应。然后将纳米诱饵结合的珠粒与ace2(pa5-85139;invitrogen)和sfptc(ab3786;sigma-aldrich)抗体一起在4℃下孵育1小时,然后用macs流动缓冲液洗涤两次。然后将荧光第二抗体(a32731;thermo fisher)在4℃下在黑暗中孵育1小时,然后用macs流动缓冲液洗涤一次。普通珠粒和未染色的纳米诱饵键珠粒用作对照。在cytoflex(beckman coulter)或lsr-ii(bd)上进行流式细胞术,并使用fcs express v6(de novo software)或facsdiva软件(bd)进行分析。
[0152]
sars-cov-2储备液。sars-cov-2usa-wa1/2020储备液在vero e6细胞中从bei resource(nr-52281;批号70033175;courtesy natalie thornburg,疾病控制和预防中心)扩增,并在以90%细胞病变效应(cpe)感染后第5天收获病毒激发储备液。全基因组测序揭示与亲本病毒序列(genbank mn985325.1;courtesy david o’connor,shelby o’connor,威斯康星大学)的100%同一性。
[0153]
猕猴肺组织的组织病理学和免疫组织化学。将组织固定在新鲜制备的4% pfa中24小时,转移至70%乙醇中,并且在7天内石蜡包埋,并以5μm进行封闭切片。然后将载玻片在65℃下烘烤60分钟,在二甲苯中脱蜡,并通过一系列分级乙醇再水合至蒸馏水中。随后,将载玻片用苏木精(hss16,sigma-aldrich)和曙红y(318906,sigma-aldrich)染色。进行光学显微术以分析这些载玻片。对于免疫组织化学(ihc)染色的sars核衣壳蛋白(sars-n),首先在柠檬酸盐缓冲液(ap9003125,thermo)中进行修复,然后用甲醇中的3% h2o2处理。将载玻片透化并用含有0.1%皂苷(47036,sigma-aldrich)的dako蛋白封闭溶液(x0909,dako)封闭。将兔抗sars-n第一抗体(nb100-56576,novus,1:200)在4℃下孵育过夜,然后将山羊抗兔hrp第二抗体(ab6721,abcam,1:1000)孵育30分钟,然后用苏木精复染,然后使用0.25%氨水蓝化(bluing)。
[0154]
亚基因组mrna测定。通过rt-pcr评估sars-cov-2e基因亚基因组mrna(sgrna)。为了生成标准曲线,将sars-cov-2e基因sgrna克隆到pcdna3.1表达质粒中;使用amplicap-max t7 high yield message maker试剂盒(cellscript)转录此插入物,以获得用于标准品的rna。在rt-pcr之前,根据制造商的说明书,使用superscript iii vilo(invitrogen)将从经激发的动物或标准品中收集的样品进行逆转录。使用靶向e基因sgrna的序列设计了taqman定制基因表达测定(thermofisher scientific)。根据制造商的说明书,在quantstudio6和7flex实时pcr系统(applied biosystems)上进行反应。标准曲线用于计算每ml或每拭子的sgrna拷贝数;定量测定灵敏度是每ml或每拭子50个拷贝。
[0155]
rnascope原位杂交。使用靶向正义病毒rna的sars-cov-2反义特异性探针v-ncov2019-s(acd目录号848561)进行rnascope原位杂交,靶向负义基因组病毒rna的sars-cov-2有义特异性探针vncov2019-orf1ab-有义(acd目录号859151)和zika探针v-zikvsph2015(acd目录号467871)作为阴性对照。简言之,首先将载玻片在二甲苯中脱蜡,然后通过一系列分级乙醇再水合至蒸馏水中,然后在室温下与h2o2(acd目录号322335)一起孵育10分钟,修复在acd p2修复缓冲液(acd目录号322000)中在95℃-98℃下进行15分钟,然后在40℃下用protease plus(acd目录号322331)处理30分钟。根据制造商
的说明书,使用2.5hd检测试剂-red(acd目录号322360)开发探针杂交和检测。
[0156]
猕猴肺组织的免疫荧光染色。简言之,载玻片的预处理与ihc测定相同,包括脱蜡、再水合、修复和3% h2o2处理。之后,首先将载玻片用5%bsa封闭30分钟,然后在pbs缓冲液中冲洗。将兔抗sars-n第一抗体(1:200)在4℃下孵育过夜,然后将山羊抗兔alexa594(abcam,ab150080,1:500)、af-488-cd206(santa cruz biotechnologies,sc-376108,1:150)、efluor 660-cd68(ebioscience,50-0681-82,1:200)和alexa568-iba-1(abcam,ab221003,1:200)在室温下孵育1小时。对于共定位测定,将fitc-pan-ck(abcam,ab78478,1:200)在sars-n孵育后在室温下孵育1小时。所有载玻片均在olympus fluoview共聚焦显微镜上成像。
[0157]
基于外泌体vlp的sars-cov-2疫苗
[0158]
严重急性呼吸综合征(sars-cov-2)感染已进展为大流行病。有效的疫苗接种是控制和消除这种大流行病的唯一方式。fda批准的前两种疫苗是mrna疫苗。它们在运输和储存过程中需要深度冷冻(-70℃或-20℃),并且需要通过注射施用,从而给在这场大流行病中已经陷入困境的医疗保健系统造成了过度负担。本公开的实施方案提供了针对sars-cov-2的可冻干、室温稳定且可吸入的疫苗。将重组rbd缀合到肺源性外泌体(exo)上以制成病毒样颗粒(vlp)疫苗。如本文进一步描述的,结果证明了使用exo相对于脂质体的优势,在粘液内衬的呼吸道和肺实质两者中的保留增加。结果进一步证明,在冻干后,rbd-exo vlp疫苗在室温下储存21天后是稳定的。吸入rbd-exo vlp触发了rbd特异性igg和iga应答,以清除小鼠模型中的sars-cov-2模拟病毒。在活sars-cov-2感染的仓鼠模型中,两个剂量的rbd-exo改善sars-cov-2感染、减轻重症肺炎并减少炎症浸润。
[0159]
细胞培养。肺类球体细胞(lsc)是由来自北卡罗莱纳大学教堂山分校的囊性纤维化和肺部疾病研究和治疗中心的健康人全肺样品产生的,并如前所述进行扩增。将lsc涂铺在纤连蛋白包被(corning incorporated,corning,ny,usa)的烧瓶上,并保持在含有20%胎牛血清(fbs;corning incorporated,corning,ny,usa)的伊斯科夫氏改良的杜尔贝科氏培养基(imdm;thermofisher scientific,waltham,ma,usa)中。每隔一天进行培养基更换。如前所述,在产生无血清分泌蛋白质组(lsc-分泌蛋白质组)之前允许lsc达到70%-80%汇合。收集lsc-分泌蛋白质组并通过0.22μm过滤器过滤以除去细胞碎片。购买鼠巨噬细胞raw 264.7细胞(atcc,manassas,va,usa)并维持在含有10% fbs(corning incorporated,corning,ny,usa)的杜尔贝科氏改良的伊格尔氏培养基(dmem;thermofisher scientific,waltham,ma,usa)培养基中。每隔一天进行培养基更换。在与rbd和rbd-exo共培养之前,允许raw 264.7细胞达到70%-80%汇合。如前所述,从疫苗接种的小鼠分离脾细胞。在本公开中进行的涉及人样品的所有程序都根据机构研究委员会的伦理标准和赫尔辛基宣言设定的指导方针进行。
[0160]
外泌体分离和表征。通过超滤从人lsc-分泌蛋白质组中收集和分离外泌体。将经过滤的分泌蛋白质组吸移到100kda amicon离心过滤器单元(milliporesigma,burlington,ma,usa)中,并在10℃下以400rcf离心。一旦过滤了所有培养基,就将剩余的外泌体从过滤器脱离,并使用杜尔贝科氏磷酸盐缓冲盐水(dpbs;thermofisher scientific,waltham,ma,usa)与25mm海藻糖(milliporesigma,burlington,ma,usa)重新悬浮用于进一
步分析。lsc-exo、rfp-exo、rfp-lipo和rbd-exo通过纳米颗粒追踪分析(nta;nanosight ns3000,malvern panalytical,malvern,uk)进行定量。将所有样品固定到铜网格上并用钒负染色染色用于tem(jeol jem-2000fx,peabody,ma,usa),以分析rbd结合之前和之后的外泌体内部组成和形态。为了通过tem确定rbd的存在,将rbd-exo与抗rbd第一抗体(nc1792214;fisher scientific,pittsburgh,pa,usa)在4℃下孵育过夜。通过在100,000g下超速离心30分钟除去未结合的抗体。添加用山羊抗兔igg第二抗体标记的金纳米颗粒(15nm),并在室温下孵育2小时。
[0161]
lsc-外泌体上的rbd缀合。购买重组sars-cov-2rbd蛋白(sino biological,beijing,china)并在dpbs中重构。通过在4℃下共孵育24小时使用dspe-peg-nhs接头将rbd缀合至lsc-exo。为了定量lsc-exo上的rbd部分,将rbd-exo重新悬浮在100μl去离子水中,并超声处理以裂解外泌体。通过elisa定量所释放的rbd的量。
[0162]
sds-page和蛋白质印迹。通过免疫印迹进一步表征样品中是否存在外泌体标志物cd63(pa5-100713;thermofisher scientific,waltham,ma,usa)和rbd(nc1792214;fisher scientific,pittsburgh,pa,usa)。将样品裂解、变性并通过laemmli样品缓冲液(bio-rad,hercules,ca,usa)和β-巯基乙醇(bio-rad,hercules,ca,usa)在90℃下还原5分钟。将蛋白质样品和分子梯(precision plus蛋白质未染色标准品;bio-rad,hercules,ca,usa)负载到10%丙烯酰胺预制tris-甘氨酸凝胶(bio-rad,hercules,ca,usa)中用于十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)分离。将凝胶在100v的堆叠电压下运行,直到样品从孔中流出,然后在200v的恒定电压下运行。在bio-rad成像仪(bio-rad,hercules,ca,usa)中通过uv光对凝胶进行可视化和成像。使用bio-rad湿式电印迹转移系统(bio-rad,hercules,ca,usa)将凝胶转移到pvdf膜(bio-rad,hercules,ca,usa)上。转移后,将膜在含有0.1% tween洗涤剂(pbs-t;milliporesigma,burlington,ma,usa)的1x磷酸盐缓冲盐水中洗涤3次,每次5分钟,并使用pbs-t阻断5%乳在室温下封闭一小时。将膜在pbs-t中的5%乳中针对第一抗体进行印迹。将第一抗体在4℃下孵育一周。孵育后,将膜与相应的hrp缀合的第二抗体在室温下孵育1.5小时。然后在bio-rad成像仪(bio-rad,hercules,ca,usa)中通过uv光对膜进行可视化和成像。
[0163]
关于rbd-exo vlp的稳定性研究。将rbd-exo冻干物在-80℃、4℃和室温下储存21天。然后,将rbd-exo冻干物分散在pbs中,并使用nta检测尺寸和浓度。此外,使用elisa试剂盒对exo上的rbd的浓度进行定量。
[0164]
apc的rbd-exo内化。根据制造商的方案,使用nhs-罗丹明(thermofisher scientific,waltham,ma,usa)标记rbd。将rbd-rhb和rbd-rhb-exo与raw264.7细胞在相同浓度的rbd(1μg)下共培养1小时。除去游离rbd-rhb和rbd-rhb-exo,并用dpbs洗涤细胞3次。用olympus fluoview clsm(olympus;fv3000,shinjuku,tokyo,japan)对细胞进行成像。
[0165]
sars-cov-2模拟物的合成。根据之前的报告,将刺突蛋白(sino biological,beijing,china)缀合至慢病毒(cellomics technology llc,halethorpe,maryland,usa)以产生sars-cov-2模拟物。通过化学相互作用将his标记的刺突蛋白结合至ni次氮基三乙酸酯(ni-nta)。首先将含巯基的nta(n-[nα,nα-双(羧甲基)-l-赖氨酸]-12-巯基十二酰胺)与4-(n-马来酰亚胺基甲基)环己烷-1-羧酸3-磺基-n-羟基琥珀酰亚胺酯钠盐(磺基-smcc)反应得到nta-smcc,然后添加至慢病毒中。nta基团通过慢病毒上的-nh2基团和nta-smcc上
的n-羟基琥珀酰亚胺酯与慢病毒缀合。使用100kda amicon离心过滤器单元(milliporesigma,burlington,ma,usa)通过离心除去游离nta-smcc,得到sars-cov-2模拟病毒(s-蛋白-慢病毒)。简言之,将sars-cov-2模拟物与抗刺突蛋白抗体在4℃下孵育过夜。使用elisa测量刺突蛋白至慢病毒的获得效率。简言之,将sars-cov-2模拟物(106个转导单位(tu)/ml)裂解,并将裂解物均质化且根据制造商的方案使用elisa试剂盒(sino biological sars-cov-2spike elisa试剂盒,sino biological,beijing,china)进行测量。
[0166]
流式细胞术。通过流式细胞术进一步表征apc的抗原内化。将细胞用macs流动缓冲液(miltenyi biotec,bergisch gladbach,germany)洗涤并用bd cytofix/cytoperm(bd biosciences,san jose,ca,usa)透化,之后与针对cd86-apc(565479;bd biosciences,san jose,ca,usa)、cd40-pe(553791;bd biosciences,san jose,ca,usa)和cd80-apc(a14724;invitrogen,waltham,ma,usa)的抗体一起孵育。用cd11b(53-0112-82;ebioscience,san diego,ca,usa)对样品进行门控。在cytoflex流式细胞仪(beckman coulter,brea,ca,usa)上进行流式细胞术,并使用fcs express v6(de novo software;denovosoftware.com)进行分析。
[0167]
使用sars-cov-2模拟物的小鼠研究。所有研究均符合机构动物护理和使用委员会的要求。七周龄的雄性cd1小鼠(crl:cd1(icr))从charles river laboratory(wilmington,ma,usa)获得。将rfp-exo和rfp-lipo通过雾化(pari trek s便携式459压缩机雾化器气溶胶系统;047f45-lcs,pari,starnberg,germany)施用。pbs、exo、rbd和rbd-exo治疗通过雾化或iv注射以两个剂量每周一次给予,持续两周。在第二治疗剂量后一周,通过雾化用af647标记的sars-cov-2模拟物(每kg体重106个颗粒)对小鼠进行激发。收集肺器官并在疫苗接种后第2天和第6天用xenogen活体成像仪(perkinelmer,waltham,ma,usa)进行成像。收集血液和主要器官用于进一步分析。
[0168]
小鼠中的组织学研究。对固定于dpbs中的4%多聚甲醛(pfa;electron microscopy sciences,hatfield,pa,usa)中的组织载玻片进行免疫染色,然后透化并用含有0.1%皂苷(sigma-aldrich,st.louis,mo,usa)的dako蛋白质封闭溶液(aglient technologies,santa clara,ca,usa)封闭。将细胞用针对鬼笔环肽(ab176753;abcam,cambridge,united kingdom)和cd11b(ab216524;abcam,cambridge,united kingdom)的抗体染色。将载玻片用含有4
′
,6-二脒基-2-苯基吲哚(invitrogen,waltham,ma,usa)的prolong gold抗荧光衰减封固剂固定,并在具有olympus uplansapo 10x物镜(olympus;1-u2b824,shinjuku,tokyo,japan)和olympus uplansapo 60x物镜(olympus;1-u2b832,shinjuku,tokyo,japan)的olympus fluoview clsm(olympus;fv3000,shinjuku,tokyo,japan)上成像。
[0169]
igg抗体滴度。将微量滴定板(nunc cell culture,thermofisher scientific,waltham,ma,usa)用100μl的于包被缓冲液(r&d systems,minneapolis,mn,usa)中的10μg/ml rbd包被并在4℃下孵育过夜。为了减少非特异性结合,在37℃下将孔用200μl的于pbs-t中的1%(w/v)牛血清白蛋白(bsa;sigma-aldrich st.louis,mo,usa)封闭1小时。用pbs-t充分洗涤后,添加血清样品的连续稀释液(1:100、1:1000、1:5000、1:10000、1:50000、1:100000、1:200000),并将对照血清样品稀释至1:100。在37℃下孵育1.5小时后,将样品用
pbs-t洗涤三次,并与hrp标记的抗小鼠igg第二抗体以1/2000稀释度(每孔100μl)或hrp标记的抗仓鼠igg第二抗体以1/20000稀释度(每孔100μl)在37℃下孵育1小时。将样品用pbs-t洗涤四次,并将3,3',5,5'-四甲基联苯胺(tmb;thermofisher scientific,waltham,ma,usa)可溶性底物添加至每个孔中(每孔100μl)。在室温下孵育30分钟后,通过添加50μl终止溶液(2m h2so4,sigma-aldrich st.louis,mo,usa)终止显色,并在酶标仪上在450nm处测量光吸收。igg的终点滴度由超过平均对照组光密度的sd两倍的最大血清稀释度的倒数确定。单独抗体滴度表示为[log10计算为最大血清稀释度的倒数。
[0170]
iga抗体滴度。使用elisa测量来自nplf和balf的rbd特异性iga。为了收集nplf,从中间切开气管,并用200μl dpbs从切口向上冲洗鼻咽。收集流体并重复冲洗三次,总计600μl洗涤液。为了收集balf,通过胸廓切开术暴露气管,并在支气管分叉的顶部做横向切口。将针插入气管中以用200μl的dpbs清洗肺部。收集洗涤液并重复冲洗三次,总计600μl洗涤液。将微量滴定板(nunc cell culture,thermofisher scientific,waltham,ma,usa)用100μl的于包被缓冲液(r&d systems,minneapolis,mn,usa)中的5μg/ml rbd包被并在4℃下孵育过夜。为了减少非特异性结合,在37℃下将孔用200μl的于pbs-t中的1%(w/v)bsa(sigma-aldrich st.louis,mo,usa)封闭1小时。用pbs-t充分洗涤后,添加nplf和balf的连续稀释液(1:50、1:100、1:1000、1:5000、1:10000、1:50000)并将对照样品稀释至1:50。在37℃下孵育1.5小时后,将样品用pbs-t洗涤三次,并与hrp标记的抗小鼠igg第二抗体以1/2000稀释度(每孔100μl)在37℃下孵育1小时。将样品用pbs-t洗涤四次,并将tmb(thermofisher scientific,waltham,ma,usa)可溶性底物添加至每个孔中(每孔100μl)。在室温下孵育30分钟后,通过添加50μl终止溶液(2m h2so4,sigma-aldrich st.louis,mo,usa)终止显色,并在酶标仪上在450nm处测量光吸收。iga的终点滴度由超过平均对照组od的sd两倍的最大血清稀释度的倒数确定。单独抗体滴度表示为[log10并且计算为最大血清稀释度的倒数。
[0171]
脾细胞中的细胞因子测量。将来自每只疫苗接种小鼠的脾细胞用1μg/ml rbd激发并涂铺到elispot孔中(每孔106个)(r&d systems,minneapolis,mn,usa),所述孔用抗小鼠ifn-γ捕获抗体包被。根据制造商的方案,使用elispot测定检测分泌ifn-γ的抗原特异性细胞。使用解剖显微镜(nikon,minato city,tokyo,japan)分析sfu,并使用imagej软件(nih;imagej.nih.gov/ij/)对斑点进行计数。将来自每只疫苗接种小鼠的脾细胞在6孔板中培养(每孔5
×
106个细胞)并用5μg/ml rbd再刺激。孵育48小时后,根据制造商的方案使用小鼠il-6elisa试剂盒(rab0308,sigma-aldrich st.louis,mo,usa)和小鼠肿瘤坏死因子αelisa试剂盒(rab0477,sigma-aldrich,st.louis,mo,usa)通过elisa检测来自培养基的il-6和tnf-α的抗原特异性细胞因子水平。除去培养基后收集脾细胞并固定在4% pfa(electron microscopy sciences,hatfield,pa,usa)中并用抗小鼠cd11b-af488(53-0112-82;ebioscience,san diego,ca,usa)染色。
[0172]
活sars-cov-2储备液。sars-cov-2usa-wa1/2020储备液在vero e6细胞中从bei resource(nr-52281;批号70033175;courtesy natalie thornburg,疾病控制和预防中心)扩增,并在以90%细胞病变效应(cpe)感染后第5天收获病毒激发储备液。全基因组测序揭示与亲本病毒序列(genbank mn985325.1;courtesy david o’connor,shelby o’connor,
威斯康星大学)的100%同一性。
[0173]
使用活sars-cov-2的仓鼠研究。将15只雄性和雌性叙利亚金仓鼠(envigo),6-8周龄随机分配至三个治疗组。所有动物都圈养在bioqual inc。使用雾化和贴合面罩通过吸入间隔1周向仓鼠施用两个剂量的pbs(安慰剂)、rbd或rbd-exo(n=5只/组,3f/2m)。第二剂疫苗后1周,使用鼻内和气管内途径(每个鼻孔50μl)用100μl的sars-cov-2(5.5
×
105pfu)激发仓鼠。在指定时间监测或收集支气管肺泡灌洗液(bal)、口腔拭子(os)和血液。在激发后第7天对仓鼠进行尸检。所有免疫学和病毒学测定均以盲法进行。所有动物研究均按照所有相关的地方、州和联邦法规进行,并由bioqual机构动物护理和使用委员会(iacuc)批准。
[0174]
被感染仓鼠中的组织病理学和免疫组织化学。将组织固定在新鲜制备的4%多聚甲醛中24小时,转移至70%乙醇中,并且在7天内石蜡包埋,并以5μm进行封闭切片。然后将载玻片在65℃下烘烤60分钟,并在二甲苯中脱蜡,并通过一系列分级乙醇再水合至蒸馏水中。随后,将载玻片用苏木精(hss16,sigma-aldrich)和曙红y(318906,sigma-aldrich)染色。还根据制造商的说明书进行三色(ht10516,sigma-aldrich)染色。进行光学显微术以分析这些载玻片。对于ihc染色的sars-n、cd3、mpo和mx1,首先在柠檬酸盐缓冲液(ap9003125,thermo)中进行修复,然后在脱蜡和再水合后用甲醇中的3% h2o2处理10分钟。将载玻片透化并用含有0.1%皂苷(47036,sigma-aldrich)的dako蛋白封闭溶液(x0909,dako)封闭。将兔抗sars-n第一抗体(novus,nb100-56576,1:200)、兔抗cd3(abcam,ab16669,1:200)、兔抗mpo(thermo,pa5-16672,1:200)和抗mx1(millipore sigma,mabf938,1:200)分别在4℃下孵育过夜,并且随后将山羊抗兔hrp第二抗体(abcam,ab6721,1:1000)或山羊抗小鼠hrp第二抗体(abcam,ab6789,1:1000)在室温下孵育1小时,然后用苏木精复染,然后使用0.25%氨水蓝化。
[0175]
仓鼠中的病毒载量测定。每毫升sars-cov-2rna拷贝数(拷贝数/ml)由杜克人类疫苗研究所(duke human vaccine institute)的临床实验室改进修正案认证的免疫学和病毒学质量评估中心开发的两步实时定量pcr测定确定。dsp病毒/病原体迷你试剂盒(qiagen,hilden,germany)用于在qiasymphony sp自动化样品制备平台上提取病毒rna。将对sars-cov-2包膜基因具有特异性的反向引物与提取的rna退火,并使用superscript iii逆转录酶和rnaseout(thermo fisher scientific,waltham,ma)逆转录成cdna。用rnase h处理cdna,然后添加至含有包膜基因特异性引物和荧光标记的水解探针的定制4x taqman基因表达主混合物(applied biosystems,foster city,ca)中;定量pcr在quantstudio 3实时pcr系统(thermo fisher scientific,waltham,ma)上进行。每个反应的sars-cov-2rna拷贝数使用定量循环数据和含有sars-cov-2包膜基因序列的高度表征的定制dna质粒的连续稀释进行内插。定量限是如通过与临床环境中的使用一致的广泛验证过程确定的62个rna拷贝/ml样品。
[0176]
仓鼠中的rnascope原位杂交。使用靶向刺突序列的正义的sars-cov-2反义特异性探针v-ncov2019-s(acd目录号848561)、靶向刺突序列的负反义的sars-cov-2v-ncov2019-s-有义(acd目录号845701)进行rnascope原位杂交。简言之,首先将载玻片在二甲苯中脱蜡,然后通过一系列分级乙醇再水合至蒸馏水中,然后在室温下与h2o2(acd目录号322335)一起孵育10分钟,修复在acd p2修复缓冲液(acd目录号322000)中在95℃-98℃下进行15分钟,然后在40℃下用protease plus(acd目录号322331)处理30分钟。根据
制造商的说明书,使用2.5hd检测试剂-red(acd目录号322360)开发探针杂交和检测。
[0177]
仓鼠肺切片的免疫荧光染色。简言之,载玻片的预处理与ihc测定相同,包括脱蜡、再水合、修复和3% h2o2处理。之后,首先将载玻片用5% bsa封闭30分钟,然后用dpbs冲洗3次。将兔抗sars-n第一抗体(1:200)在4℃下孵育过夜,然后将山羊抗兔alexa647(abcam,ab150080,1:500)、af-488-cd206(santa cruz biotechnologies,sc-376108,1:150)和alexa568-iba-1(abcam,ab221003,1:200)在室温下孵育1小时,或随后将山羊抗兔alexa647(abcam,ab150079,1:500)和fitc-pan-ck(abcam,ab78478,1:200)在室温下孵育1小时。最后,将所有载玻片用含有4
′
,6-二脒基-2-苯基吲哚(invitrogen,waltham,ma,usa)的prolong gold抗荧光衰减封固剂固定,并在olympus fluoview clsm(olympus;fv3000,shinjuku,tokyo,japan)上成像。
[0178]
统计分析。所有实验独立进行至少3次。结果显示为平均值
±
标准偏差。使用双尾非配对学生t检验进行任何两组之间的比较。使用单因素anova进行超过两组之间的比较,然后进行事后邦弗朗尼测试。单、双、三和四个星号分别表示p《0.05、0.01、0.001和0.0001;p《0.05被认为是统计上显著的。
[0179]
5.实施例
[0180]
对本领域技术人员来说显而易见的是,本文描述的本公开的方法的其他合适的修改和改编是容易应用和可理解的,并且可在不脱离本公开的范围或本文公开的方面和实施方案的情况下使用合适的等效物进行。现在已详细描述了本公开,通过参考以下实施例将对其有更明确理解,所述实施例仅意图用于说明本公开的一些方面和实施方案,并且不应被视为对本公开范围的限制。本文引用的所有期刊参考文献、美国专利和公布的公开内容据此通过引用以其整体并入。
[0181]
本公开具有多个方面,所述方面通过以下非限制性实例说明。
[0182]
实施例1
[0183]
lsc-纳米诱饵的制造。纳米诱饵设计的总体原理在图16中示出。首先,筛选lsc及其亲本细胞肺外植体来源的细胞(edc)的ace2表达,以确定纳米诱饵制造的最佳细胞类型。通过免疫染色(图1a;图17)、免疫印迹和流式细胞术(图1b-1c;图18)分析lsc和edc的ace2表达。此外,使用免疫印迹和流式细胞术研究了hek293和人肺成纤维细胞的ace2表达水平作为对照(图18)。发现与其他细胞类型(包括它们的亲本细胞edc)相比,lsc具有更高的ace2表达水平。相比之下,hek293和成纤维细胞具有明显更低的ace2表达。与之前的研究一致,共聚焦成像显示ace2存在于aqp5
+
i型肺细胞和sftpc
+
ii型肺细胞(lsc内的两个亚群)的膜上(图1a)。分析发现ace2与其他lsc标志物如epcam、cd90和muc5b共表达(图1d和图19-20)。先前的研究表明,肺组织中83%的ace2表达细胞是ii型肺细胞,表明肺是sars-cov-2病毒的最易受攻击的靶器官。因此,这些结果证明,作为主要的驻留肺细胞,lsc可能充当理想的细胞类型来产生具有高水平ace2表达的纳米诱饵。相比之下,hek293细胞用作制备具有低水平ace2表达的纳米诱饵的对照。
[0184]
lsc和hek293膜纳米囊泡(纳米诱饵)是通过使用商业挤出机将lsc或hek293细胞通过孔径为5μm、1μm和最后0.4μm的聚碳酸酯膜连续挤出而产生的。所获得的lsc-纳米诱饵
通过纳米颗粒追踪分析进行表征,显示由5
×
106个细胞产生的均匀纳米粒子群体,平均尺寸分布为320nm且平均数量为5.51
×
10
10
个颗粒/ml(图1e)。换句话说,平均而言,一个lsc产生了11,020个纳米诱饵。因为整个细胞被用来制备纳米诱饵,所以假设纳米诱饵不是完全由质膜产生,而且由细胞内膜产生。为了证实这一假设,通过测试alix(一种系统发育上保守的细胞溶质支架蛋白)和钙联蛋白(一种内质网的标志物)来研究纳米诱饵的细胞内组分。结果显示检测到这两种细胞内标志物,这支持了所述分析(图1f)。流式细胞术分析证实了ace2保留在纳米诱饵(图1g)以及ii型肺细胞标志物sftpc(图1h)的表面上。此外,通过elisa分析研究了lsc和hek293细胞上ace2的数量,以及它们的纳米诱饵。ace2的频率被确定为每个lsc 2.1
×
106个受体和每个lsc-纳米诱饵112个受体。与此形成鲜明对比的是,发现每个hek293细胞和hek-纳米诱饵上分别存在3.4
×
105各和10个ace2受体(图1i)。此外,透射电子显微镜(tem)图像揭示了纳米诱饵的球形形态(图1j-1k)。
[0185]
实施例2
[0186]
纳米诱饵可在体外结合并中和s蛋白。在证明了纳米诱饵上存在ace2后,然后测试了它们结合sars-cov-2s蛋白的能力。刺突蛋白的刺突s1含有特异性地识别ace2的受体结合结构域(rbd)。因此,通过tem与免疫金标记,首次证实了刺突s1可结合至纳米诱饵(图1l-1m)。以剂量响应性方式,50%的刺突s1(6.5
×
10
10
)被109个lsc-纳米诱饵捕获并结合,而源自hek293细胞的纳米诱饵未能结合至刺突s1(图2a)。然后使用基于肺细胞的测定检查lsc-和hek293-纳米诱饵的结合效力(图2b)。4小时孵育后发现刺突s1结合至肺细胞(图2c)。did标记的lsc-纳米诱饵与刺突s1共定位,而hek293-纳米诱饵没有,表明lsc-纳米诱饵能够识别并竞争性地结合至刺突s1。此外,巨噬细胞对纳米诱饵的内化效率高于肺细胞(图2d-2g),表明巨噬细胞和/或其他免疫细胞潜在清除纳米诱饵及其中和的sars-cov-2,这通过流式细胞术分析证实(图2h-2l)。此外,外周血和肺泡巨噬细胞两者具有相同的lsc-纳米诱饵内化率(图21)。
[0187]
实施例3
[0188]
纳米诱饵结合并中和sars-cov-2模拟物。接下来,通过修饰没有刺突s1的慢病毒以在其表面上表达刺突s1而制造了刺突s1病毒来模拟sars-cov-2。首先用ni次氮基三乙酸酯(ni-nta)修饰慢病毒(图3a),然后通过ni与his标签的相互作用将his标记的刺突s1缀合到慢病毒上以产生这种sars-cov-2模拟物(图3b)。免疫金标记用于确认sars-cov-2模拟物上的刺突s1。tem成像使裸慢病毒(图3c)、sars-cov-2模拟物(图3d)和纳米诱饵结合的sars-cov-2模拟物可视化,通过经修饰的慢病毒以及纳米诱饵的表面上存在刺突s1所示(图3e),从而表明成功制造了sars-cov-2模拟物。检查表明,每个sars-cov-2模拟病毒存在大约6,900个刺突s1。发现2.16
×
105个lsc-纳米诱饵可结合5
×
105个sars-cov-2模拟物(每个纳米诱饵2.31个sars-cov-2模拟物),而hek293-纳米诱饵显示对sars-cov-2模拟物的较低结合效率,这是由于相应的低ace2水平(图3f)。这种结合相互作用是特异性的,因为对照慢病毒(没有刺突s1)对lsc-纳米诱饵具有低亲和力。然后将巨噬细胞和lsc共培养(图3g),并且发现sars-cov-2模拟物被lsc-纳米诱饵识别并在共培养4小时后被巨噬细胞内化(图3h)。然后检查模拟物的细胞内分布,并且共焦成像显示一些模拟物在溶酶体内,而其他模拟物位于细胞质中(图22)。此外,修饰之前和之后的慢病毒在被lsc内化方面略有不同(图23)。然后检查了lscs对纳米诱饵的抑制内化作用。免疫细胞化学(图3i-3l)和流式细胞术
(图3m-3n)证实lsc-纳米诱饵能够阻止sars-cov-2模拟物进入宿主细胞,但hek293-纳米诱饵不能。初始慢病毒无法有效进入肺细胞(14.8%感染率)(图3i)。然而,刺突s1修饰的慢病毒(sars-cov-2模拟物)有效地促进了进入宿主细胞(73.8%的感染率)(图3j),而与hek-纳米诱饵相比,lsc-纳米诱饵显著降低了sars-cov-2模拟物的内化(从73.8%到28.8%)(图3k-3l)。此外,研究了lsc-纳米诱饵的剂量依赖性阻断作用。流式细胞术分析显示,递增剂量的lsc-纳米诱饵以剂量依赖性方式阻止更多病毒进入肺细胞(图24)。这些结果共同表明纳米诱饵可保护宿主细胞免受sars-cov-2模拟物感染。
[0189]
然后检查吸入后小鼠中的lsc-纳米诱饵的保留和生物分布。使用市售的便携式雾化器以kg体重1x10
10
个纳米诱饵的剂量通过吸入将did标记的纳米诱饵施用于小鼠以获得临床相关性(图4a)。如图4b-4c和图25所示,在单次吸入治疗后72小时,仍然可在肺中发现纳米诱饵。除肺外,还在肝、肾和脾中检测到纳米诱饵,表明通过网状内皮系统进行清除以及纳米诱饵在体内的代谢。此外,吸入纳米诱饵对cd68
+
巨噬细胞浸润没有显著影响,从而表明它们的生物安全性(图26)。尽管一些纳米诱饵与apq5
+
(i型)和sftpc
+
(ii型)细胞(图4d和图27)共定位,但大多数纳米诱饵在体内24小时后共定位在巨噬细胞中(图4e)。
[0190]
进行了实验以测试吸入的lsc-纳米诱饵是否能够加速小鼠模型中sars-cov-2模拟物的清除(图5a)。为了模拟人患者中的感染,在开始施用治疗性纳米诱饵之前,允许小鼠接受sars-cov-2模拟物。由于治疗在病毒暴露后24小时开始,因此并非所有的sars-cov-2模拟物都在细胞内;因此,纳米诱饵可阻止病毒模拟物进一步进入细胞。至于细胞内sars-cov-2模拟物,被细胞内化的纳米诱饵可捕获它们,从而避免进一步感染。离体成像(图5b-5c)表明,吸入lsc-纳米诱饵后,sars-cov-2模拟物的量显著减少。发现吸入游离形式的race2和hek293-纳米诱饵是无效的。共聚焦显微术证实,吸入lsc-纳米诱饵加速了sars-cov-2模拟物的清除(图5d-5e)。细胞因子阵列分析(图5f-5g)表明,与对照组相比,纳米诱饵吸入不会升高促炎性细胞因子。此外,所有主要器官的h&e染色、血液学和生化参数表明lsc或hek293纳米诱饵吸入没有明显异常或副作用(图28-29)。
[0191]
实施例4
[0192]
sars-cov-2感染的非人灵长类动物的纳米诱饵疗法。进行了试点非人灵长类动物研究,以评估lsc-纳米诱饵的安全性和初步治疗功效。猕猴模型可概括sars-cov-2感染的许多临床症状,并在上呼吸道和下呼吸道中显示出强大病毒复制。通过鼻内和气管内途径用sars-cov-2激发六只食蟹猴(图6a)。激发后,将动物随机分为两个治疗组:在激发后第2、3、4和5天吸入pbs或lsc-纳米诱饵(以kg体重10
10
个颗粒的剂量)。支气管肺泡灌洗液(bal)和鼻拭子(ns)中的病毒载量通过对病毒亚基因组rna(sgrna,指示病毒复制)具有特异性的rt-pcr进行评估。结果,在对照动物中观察到高水平的sgrna,在第2天在bal中的中值峰值为6.243log
10
个rna拷贝/ml并且在ns中的中值峰值为5.595log
10
个rna拷贝/拭子(图6b-6c)。在纳米诱饵治疗的动物中,sgrna水平显著降低,在激发后第8天,在bal和ns两者中存在中值峰值sgrna的《1.70log
10
降低。尽管随时间推移,对照组和lsc-纳米诱饵组两者中的sgrna水平均下降,但lsc-纳米诱饵治疗诱导了更快速的病毒清除。在两组的血液学参数之间观察到可忽略不计的差异(图30)。令人感兴趣地,lsc-纳米诱饵组中的温度和体重波动不如对照治疗的动物中那样剧烈(图31)。
[0193]
在研究结束时,收集被感染的食蟹猴的肺组织并通过组织病理学进行评估。在激
发后第8天,观察到多灶性炎症区域和病毒性肺炎的证据—包括肺泡隔扩张伴单核细胞浸润、实变和水肿(图6d)。值得注意的是,与对照组相比,lsc-纳米诱饵治疗显著减少了多形核细胞和嗜中性粒细胞的数量。此外,ashcroft评分分析显示lsc-纳米诱饵治疗显著降低了肺纤维化(图6f)。为了检测和可视化肺组织中的病毒,通过免疫组织化学(ihc)染色评估sars核衣壳蛋白(sars-n)表达。如图6e和6g所示,多灶性阳性肺细胞和肺泡隔存在于对照治疗的动物中。相比之下,在lsc-纳米诱饵治疗的情况下,sars-n蛋白的水平显著降低。此外,通过原位rna杂交(rnascope)评估了sars-cov-2病毒rna(vrna)。与对照组相比,在lsc-纳米诱饵治疗后,正义和负义vrna的水平均降低(图6h),表明病毒复制减少。通过共染色sars-n和泛细胞角蛋白(pan-ck,以鉴定上皮细胞)评估了sars-cov-2在肺组织中的分布。发现病毒感染的细胞与泛细胞角蛋白(pan-ck)阳性细胞有很大的重叠(图6i表明它们是肺泡上皮细胞。此外,病毒感染的细胞的病灶经常与激活的iba-1
+
(作为泛巨噬细胞标志物的离子化钙结合衔接子)、cd68
+
(单核细胞/巨噬细胞标志物)和cd206
+
(巨噬细胞标志物)巨噬细胞相关(图6i)。与ihc和rnascope分析一致,免疫荧光结果表明纳米诱饵可降低肺组织中的病毒水平。
[0194]
实施例5
[0195]
吸入后外泌体相对于脂质体的优异肺生物分布。脂质纳米颗粒(np)已被广泛用于rna疫苗递送,以应对covid-19的大流行。例如,mrna-1273疫苗(moderna)、bnt162b1(biontech和pfizer)和arcov mrna疫苗(academy of military medical sciences、suzhou abogen biosciences和walvax biotechnology)都是脂质纳米颗粒配制的rna疫苗。在此,进行了实验以确定np(lsc外泌体或脂质体)在鼠类肺中的生物分布和保留。通过电穿孔将红色荧光蛋白(rfp)负载到lsc-exo(rfp-exo)和市售脂质体(rfp-lipo)中,以用于离体成像和显微镜可视化。将rfp-exo的分布和荧光强度与金标准递送囊泡rfp-lipo进行了比较。将rfp-exo和rfp-lipo雾化至健康cd1小鼠,将所述小鼠在np施用后4或24小时处死(图10a)。全肺的离体成像(图10b)和分析(图10c)显示在接受了rfp-exo并在24小时后处死的小鼠中np的最大整合密度。与脂质体相比,显著更多的外泌体保留并分布在整个肺中(图10d-10e)。与脂质体相比,显著更多的外泌体到达气管,但两种np均随时间推移扩散(图10f)。施用后4小时的外泌体生物分布在细支气管中最高(图10g),在24小时后实质开始显示外泌体信号(图10h)。显著更少的脂质体到达细支气管(图10g)并扩散到实质中(图10h),从而表明肺中脂质体的更快降解和/或全身清除。为了验证抗原呈递细胞(apc)是否能够摄取这些np,对实质肺切片进行免疫组织化学(图10i)并定量cd11b+apc对rfp+np的摄取。与脂质体相比,更多的apc存在并摄取外泌体(图10j)。由于外泌体在肺中的优异保留以及对apc的增强的靶向,所以外泌体被用作vlp的主链。
[0196]
实施例6
[0197]
rbd-exo vlp的制造和表征。根据之前的方法使用[1,2-二瓢儿菜基-sn-甘油基-3-磷酸乙醇胺-聚(乙二醇)-n-羟基琥珀酰胺](dspe-peg-nhs)接头将rbd抗原缀合到lsc-exo表面上(图11a)。接下来,将结合能力优化为每10
10
个外泌体0.52μg rbd。相应地,大约892个抗体分子可与每个单独vlp结合。使用透射电子显微术(tem)进一步表征了初始exo和rbd-exo。将金纳米颗粒缀合至抗rbd抗体以确认外泌体表面上存在rbd(图11b)。rbd-exo、rbd和exo裂解物上的免疫印迹进一步证明rbd存在于rbd-exo和rbd中,而不存在于exo对照
中(图11c)。同样,发现外泌体标志物cd63存在于rbd-exo和exo中,而不存在于游离rbd对照中(图11c)。此外,纳米颗粒追踪分析揭示rbd修饰略微增加了外泌体的平均直径(图11d)。这些复合数据证实了rbd-exo vlp的成功产生。
[0198]
实施例7
[0199]
rbd-exo vlp疫苗在室温下是稳定的。进行了实验以测试rbd-exo vlp在室温储存下是否稳定。将rbd-exo vlp冻干并在-80℃、4℃或室温(rt)下储存21天(3周)。再水合后,rbd-exo的形态和结构得到良好保存,如由tem图像所指示(图11e)。它们的尺寸和浓度分别使用纳米颗粒追踪分析来确定。如图11f-11g所示,室温储存对vlp的尺寸和浓度具有最小影响。此外,rbd-exo上的rbd数量在储存后保持不变(图11h)。总的来说,这些数据表明rbd-exo在所有温度下都具有高物理和抗原稳定性(图11i),优于其他报告的疫苗(表1)。
[0200]
表1:covid-19疫苗的比较。
[0201][0202][0203]
实施例8
[0204]
巨噬细胞对rbd-exo vlp的内化。为了有效地引发免疫应答,vlp需要被抗原呈递细胞(apc)如巨噬细胞识别并内化。使用nhs-罗丹明(rhs-rhb)标记rbd和rbd-exo,然后与apc(鼠类巨噬细胞raw264.7细胞)共培养。共聚焦激光扫描显微术(clsm)揭示了与游离rbd相比,raw264.7细胞的增强的rbd-exo内化(图11j)。这表明外泌体作为载体增强了apc对rbd的细胞摄取。流式细胞术证实了clsm的结果(图11k)。
[0205]
实施例9
[0206]
rbd-exo vlp疫苗接种产生抗体以清除小鼠中的sars-cov-2模拟物。将cd1小鼠随机分组以通过静脉内(iv)注射或吸入(雾化)接受间隔两周两次疫苗接种安慰剂(pbs)、对照exo、游离rbd或rbd-exo。在第二次疫苗接种后7天,将小鼠通过气管内递送用sars-cov-2模拟物(由af647标记)进行激发(图12a)。在激发后2天和7天处死小鼠,并使用体内成像系统(ivis)对肺组织进行成像以可视化sars-cov-2模拟物的清除(图12b)。制备肺切片并染色用于clsm成像。ivis(图12c)和clsm(图34-35)表明rbd-exo vlp疫苗接种加速了sars-cov-2模拟物的清除。此外,与iv注射相比,所有组中的雾化施用诱导sars-cov-2模拟物的更快速清除,表明雾化是rbd疫苗的更具靶向性且有效的递送策略。酶联免疫吸附测定(elisa)揭示,吸入rbd-exo vlp在小鼠血清中诱导了最多针对rbd的中和抗体(图12d)。
[0207]
实施例10
[0208]
rbd-exo vlp疫苗接种诱导粘膜免疫应答。由于粘膜是病原体的主要进入途径,所以宿主免疫系统通过抗原特异性siga应答提供动态免疫屏障,所述抗原特异性siga应答在防止病原体入侵中起关键作用。为了评估粘膜免疫应答,从来自小鼠的鼻咽灌洗液(nplf)和支气管肺泡灌洗液(balf)测量了针对rbd的siga抗体。elisa揭示吸入rbd-exo vlp在nplf(图12e)和balf(图12f)中产生了最高量的siga抗体。令人感兴趣地,在通过iv注射接受疫苗接种的动物中只发现了可忽略不计的量的siga抗体。将病毒抗原呈递给apc如树突细胞(dc)以获得进一步免疫应答和针对病原体的保护。在安乐死后分离鼠类脾细胞并用rbd再激发以通过流式细胞术评估dc激活。在源自rbd-exo吸入治疗的小鼠的脾细胞中,更大百分比的dc是cd86+(图36)、cd40+(图37)和cd80+(图38),表明更多的dc被激活。这些数据表明,吸入rbd-exo产生了针对rbd(一种重要的sars-cov-2抗原)的中和抗体和siga应答。
[0209]
实施例11
[0210]
通过rbd-exo vlp疫苗接种针对sars-cov-2模拟物的细胞应答。进行实验以评估疫苗接种小鼠中的细胞免疫应答和全身细胞因子。对来自每个治疗组的动物的脾细胞进行针对ifn-γ的酶联免疫吸收斑点(elispots)(图13a)。rbd和rbd-exo疫苗接种在用rbd再刺激后诱导了显著更大的ifn-γ分泌(图13b)。具体而言,rbd-exo吸入诱导了每106个脾细胞大约300个斑点形成单位(sfu),在所有组中最高(图13b)。此外,通过rbd再刺激在用rbd-exo吸入疫苗接种的动物中诱导了最高水平的tnf-α(图13c)和il-6(图13d)分泌。这些复合数据集表明,rbd-exo吸入强烈诱导了全身性t细胞免疫应答,所述免疫应答可进一步保护受试者免于病毒复制。
[0211]
实施例12
[0212]
rbd-exo vlp疫苗接种保护仓鼠免受活sars-cov-2感染。进行了实验以评估rbd-exo vlp疫苗在高剂量sars-cov-2感染的仓鼠中的保护作用,所述仓鼠可复制严重临床疾病,伴有快速体重减轻和严重肺部病变。在两个剂量的rbd-exo疫苗接种后,将15只叙利亚金仓鼠(6-8周龄)通过鼻内和气管内途径用5
×
105组织培养感染剂量(tcid
50
)sars-cov-2进行激发(图14a)。通过rt-pcr测定口腔拭子(os)和支气管肺泡灌洗液(bal)中的病毒载量。结果,在pbs、rbd、rbd-exo的所有三个免疫组中都观察到高水平的rna拷贝,在第2天os中的中值峰值为6.632、6.454和6.042log
10
个rna拷贝/ml(图14c)。在rbd-exo免疫的动物中
rna水平显著降低,在激发后第7天os中的中值峰值rna具有3.43log
10
降低。与os结果一致,在rbd-exo免疫组中bal病毒载量是大约1.942log
10
个rna拷贝/ml,其远低于pbs-(5.916)和rbd-(5.548)治疗组(图14b)。此外,与rbd疫苗接种相比,rbd-exo疫苗接种引发了10-100倍高的中值elisa滴度(图14d)。用rbd-exo疫苗接种的仓鼠的临床化学和血液学参数在正常范围内(图39)。在病毒激发后第7天通过组织病理学对仓鼠进行了评估。苏木精和伊红(h&e)染色揭示了在接受pbs疫苗接种的仓鼠中伴有明显炎症浸润的严重肺部病变和伴有肺泡壁增厚的多灶性致密结节(图14e)。相反,在ebd-exo疫苗接种组中肺泡高度可见,并且多形核和嗜中性粒细胞的数量显著减少(图14e)。马森氏三色染色和ashcroft评分分析揭示,与pbs疫苗接种或rbd疫苗接种相比,rbd-exo免疫通过保留肺泡上皮结构而显著降低了纤维化的消退(图14f-14g)。
[0213]
为了可视化肺组织中的病毒,评估了sars核衣壳蛋白(sars-n)的表达和分布。如图15a所示,多灶性阳性肺细胞和肺泡隔存在于pbs治疗的动物中。并且这些病毒抗原阳性细胞经常与泛细胞角蛋白(pan-ck,以鉴定上皮细胞)共染色,进一步证实它们是肺泡上皮细胞(图15b)。特别值得注意的是,肺中的sars-n蛋白的水平在rbd-exo疫苗接种后显著降低(图15f)。此外,肺中的sars-cov-2病毒rna(vrna)是通过原位rna杂交(rnascope)测定的。与pbs或rbd疫苗接种相比,rbd-exo免疫组中正义和负义vrna两者的水平均显著降低(图15c),表明通过抗rbd抗体中和减少病毒复制。发现病毒感染的细胞的病灶经常与iba-1
+
(作为泛巨噬细胞标志物的离子化钙结合衔接子)和cd206
+
(巨噬细胞标志物)的大量炎症浸润相关(图15d)。此外,在经激发的仓鼠中,在整个肺中检测到许多嗜中性粒细胞,具有嗜中性粒细胞髓过氧化物酶(mpo)的高表达(图15e)。然而,rbd-exo疫苗接种显示肺中mpo阳性细胞最少(图15g)。在经激发的仓鼠中发现了cd3阳性t淋巴细胞的弥漫性表达(图15e),其能够促进被感染细胞的快速清除。重要的是,与pbs疫苗接种或rbd疫苗接种相比,抗病毒蛋白,即具有针对多种rna病毒的抗病毒活性的1型干扰素反应基因mx1的表达在rbd-exo疫苗接种中显著降低,进一步验证了由于疫苗所诱导的高效中和抗体所致的病毒复制减少。总之,这些组织学结果强烈表明,rbd-exo疫苗接种能够有效保护仓鼠肺免受sars-cov-2感染。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1