用于产生趋化因子受体抗体的硫酸化肽的制作方法
本发明涉及用于产生特异性结合趋化因子受体如cc或cxc趋化因子受体的抗体的工具和方法。提供了分离的硫酸化多肽及其缀合物,其可用作例如抗原或用于脱靶淘选以促进抗人、抗食蟹猴和/或抗小鼠趋化因子的产生,例如用于产生具有完全人cdr和/或其他有利特性以用于治疗用途的抗体。本发明还涉及可通过应用上述工具和方法获得的抗体及其缀合物。提供了特异性结合人、食蟹猴和/或鼠ccr8并具有有利特性用于治疗用途的抗体,例如交叉反应抗体、全人抗体、低内化(包括非内化)抗体、和在treg细胞中有效诱导adcc和/或adcp的抗体。还提供了本发明抗体或缀合物的医学用途和/或治疗方法,包括将这些抗体单独或组合施用给患者或受试者。最终提供了生物标志物、分层方法和诊断方法来预测或评估对抗ccr8抗体单一疗法或组合疗法的响应。本发明还提供了用于产生前述抗体的工具和方法、药物组合物、抗体的诊断用途以及带有使用说明书的试剂盒。技术问题产生cc和cxc趋化因子受体的抗体cxc和cc趋化因子受体是特定的七次跨膜g蛋白偶联受体,可介导趋化梯度中的细胞迁移。由于其固有的结构、生物物理和生物学特性,趋化因子受体是抗体生成的具有挑战性的目标类别。难以获得针对趋化因子受体的最佳抗体的原因有多种,这将以示例性方式进行讨论,重点放在人ccr8上。趋化因子受体的特点是嵌入细胞膜中的七个结构域,因此在其天然确认中不易纯化。纯化的天然趋化因子受体将从膜环境中移除,因此可能在构象上受到损害。这些损坏的结构通常不适合抗体生成,因为抗体需要识别呈现在细胞表面的完整抗原。虽然一些趋化因子受体,如cxcr4和ccr5,具有一些固有的稳定性,允许在温和的洗涤剂中纯化,但这不适用于大多数趋化因子受体(hutchings,catherine j.,et al.″opportunities fortherapeutic antibodies directed at g-protein-coupled receptors.″naturereviews drug discovery 16.11(2017):787.)。事实强调了这一点,直到今天,蛋白质数据库pdb(rcsb.org)中还没有可用于ccr8的x射线晶体结构。因此,对于趋化因子受体来说,为了获得天然构象中所需数量的蛋白质以及正确的方向和折叠以用作免疫原而进行增溶是很困难的(参见cf.klarenbeek,alex,et al.″targeting chemokines and chemokine receptors with antibodies.″drug discoverytoday:technologies 9.4(2012):e237-e244.)。人ccr8整体结构的示意图如图2b所示。在355个氨基酸中,残基1-35(n端)、94-107(ecl1)、172-202(ecl2)和264-280(ecl3)被预测为细胞外结构域(uniprot.org)。假设这些细胞外结构域采用三级结构,由二硫键稳定。因此,平均不到30%的趋化因子受体暴露在细胞表面。因此,趋化因子受体尤其是ccr8不易接近抗体结合,如wo200744756中所述。此外,针对对应于趋化因子受体细胞外结构域的肽产生的抗体通常无法识别细胞上的完整受体,这可能是由于二级结构的差异。因此,该领域的研究人员在开发抗体方面的成功率很低(tschammer,nuska,ed.chemokines:chemokines and their receptors indrug discovery.vol.14.springer,2015,chapter by j.e.pease&r.horuk,section 6,page 12,2nd para)。获得抗鼠ccr8抗体的抗体生成似乎稍微不那么困难,发明人可以复制传统方法,例如kremer和márquez描述的方法(d’ambrosio,daniele,and francescosinigaglia.cell migration in inflammation and immunity.springer,2004.,chapterby kremer and márquez p.243-260)。鼠和人ccr8的序列同一性约为70%,对于细胞外结构域而言甚至更低,如实施例2中更详细的描述。然而,kremer和márquez讨论,抗小鼠趋化因子受体单克隆抗体的产生是一项艰巨的挑战,尽管自首次报道其氨基酸序列以来已经过去了一段时间,但针对小鼠趋化因子受体的抗体却相对稀少。ccr8的治疗性抗体及其医药用途尽管它们的产生存在困难,但靶向cc趋化因子受体的抗体已被建议作为各种疾病的有前途的治疗工具,例如基于对涉及免疫细胞的疾病或以趋化因子受体异常表达为特征的各种癌症适应症的机制洞察。2004年,curiel等可以显示对于104名卵巢癌患者的cd4+cd25+foxp3+调节性t细胞(treg细胞或tregs),人肿瘤treg细胞抑制肿瘤特异性t细胞免疫并促进体内人类肿瘤的生长(curiel,tyler j.,et al.″specific recruitment of regulatory t cells inovarian carcinoma fosters immune privilege and predicts reduced survival.″nature medicine 10.9(2004):942-949.)。肿瘤细胞和微环境巨噬细胞产生趋化因子,例如ccl22,它介导treg细胞向肿瘤的运输。肿瘤微环境中高水平的tregs不仅与许多癌症(如卵巢癌、乳腺癌、肾癌和胰腺癌)的预后不良有关,而且会抑制针对这些癌症的免疫应答,例如通过抑制免疫系统效应细胞的作用。因此,treg细胞的这种特异性募集代表了肿瘤可以促进免疫特权的一种机制。因此,有人建议阻断treg细胞迁移或功能以战胜人类癌症。意识到curiel的发现后,围绕plitas/rudensky和de simone/abrignani/pagani的两个独立团队发现肿瘤浸润性treg细胞的特征在于ccr8的选择性表达。事实上,对于肿瘤浸润性treg,treg细胞耗竭的选择性很重要,因为treg细胞的全身耗竭可能导致严重的自身免疫(nishikawa,hiroyoshi,and shimon sakaguchi.″regulatory t cells intumor immunity.″international j ournal of cancer127.4(2010):759-767)。由于treg细胞显示出类似于效应淋巴细胞的分子模式,因此寻找特定的treg标记变得复杂,参见实施例11.2。外周treg和肿瘤特异性效应细胞在肿瘤内treg耗竭期间不应遭受友军攻击,因为外周treg对于避免自身免疫很重要,而肿瘤特异性效应细胞有助于控制肿瘤。基于这些发现,多个团队建议使用ccr8抗体选择性耗竭肿瘤浸润性调节性t细胞。虽然一些人提供的数据证实了使用抗人ccr4或抗鼠ccr8抗体在肿瘤模型中减小肿瘤,从而证实了treg耗竭的机制概念,但仍需要治疗性抗人ccr8抗体,例如在治疗应用中具有卓越的性能。
背景技术:
0、现有技术
1、1.1抗原、方法和抗体
2、抗体生成中抗原的选择对于所得抗体的特性至关重要,并且可能造成严重问题,如本文别处所讨论的趋化因子受体如ccr8。在某些情况下,已经使用全细胞作为抗原获得了抗体,这些细胞被工程化用于过度表达趋化因子受体。至少对于某些趋化因子受体而言,这些方法似乎受到产生的结合物数量少的影响。此外,用这些抗原获得的抗体通常具有对趋化因子受体的脱靶结合和低特异性的特征。如果将整个细胞用作抗原,则免疫显性表位可以掩盖其他抗原性较低的表位,而抗原性较低的表位可能会产生所需的选择性和特异性抗体。
3、对于ccr8,wo2007044756(icos)中描述了一种成功的“全细胞”方法。简而言之,抗ccr8单克隆抗体是通过用在细胞表面表达高水平ccr8的用ccr8转染的辐射细胞免疫balb/c小鼠而开发的。来自这些小鼠的脾细胞通过标准方法融合以产生产生抗体的杂交瘤。阳性库由facs鉴定,并通过有限稀释进行克隆。其中两种抗体433h和459m在免疫组织化学中显示出对人ccr8的特异性反应性。抗体433h仍然可用,可从bd购买。
4、biolegend分发克隆l263g8,这是一种纯化的小鼠igg2a抗人ccr8抗体,是使用人ccr8转染子作为免疫原产生的。
5、kremer和márquez描述了针对鼠ccr8的单克隆抗体的产生(d’ambrosio,daniele,and francesco sinigaglia.cell migration in inflammation andimmunity.springer,2004.,chapter by kremer and márquez p.243-260)。简而言之,kremer和márquez描述了使用源自鼠ccr8细胞外结构域的肽作为免疫原,但并未暗示酪氨酸的硫酸化。事实上,发明人发现kremer和márquez描述的方法可以成功应用于识别鼠ccr8的抗体,但用于识别人ccr8的抗体的成功率很低。
6、schaerli等通过用人ccr8肽缀合物(对应于ccr8 n端区域的1-34位与klh或bsa偶联)免疫兔子产生了抗人ccr8抗体,但同样,不建议酪氨酸硫酸化(schaerli,patrick,etal.″a skin-selective homing mechanism for human immune surveillance t cells.″the journal of experimental medicine 199.9(2004):1265-1275.)。
7、haque等描述了一种与来自ccr8细胞外n端部分的含有26个氨基酸的肽结合的鼠单克隆抗体(haque,nasreen s.,et al.″the chemokine receptor ccr8 mediates humanendothelial cell chemotaxis induced by i-309and kaposi sarcoma herpesvirus-encoded vmip-i and by lipoprotein(a)-stimulated endothelial cell conditionedmedium.″blood,the journal of the american society of hematology 97.1(2001):39-45.)。
8、这些用于抗体产生的方法均未使用包含趋化因子受体或跨膜蛋白的富含酪氨酸结构域(trd)的分离的硫酸化多肽作为抗原。使用包含趋化因子受体或跨膜蛋白的trd的分离的硫酸化多肽作为抗原影响所获得抗体组的结构和功能特征,如本文别处所讨论的。
9、因此,认为根据本发明的抗体在结构和功能上确实不同于上述现有技术的抗体,例如至少在它们对硫酸化ccr8的亲和力、它们对未硫酸化ccr8的亲和力、它们调节受体信号传导的方式和程度、它们的内化行为、交叉反应性、清除率和药代动力学行为以及最终的treg耗竭和/或功效方面用于治疗应用。
10、此外,使用本文公开的抗原能够产生完全人抗体。相反,所讨论的针对ccr8的现有技术抗体是非人来源的并且与本发明的一些抗体不同,至少因为它们不包含人类cdr。
11、1.2医学用途和作用方式
12、癌症免疫疗法涉及使用受试者的免疫系统来治疗或预防癌症。免疫疗法通常利用这样一个事实,即癌细胞表面通常具有可以被免疫系统检测到的细微不同的分子,即癌症抗原。因此,免疫疗法涉及激发免疫系统通过这些癌抗原攻击肿瘤细胞。然而,一些癌症,如实体瘤或血液癌症,可以逃避免疫监视。例如,调节性t细胞(treg细胞或tregs)的肿瘤浸润,更具体地说,效应t细胞(teff)与tregs的低比率已被认为是肿瘤躲避免疫系统的关键因素(smyth,mark j.,shin foong ngiow,and michele wl teng.″targeting regulatoryt cells in tumor immunotherapy.″immunology and cell biology 92.6(2014):473-474.)。
13、众所周知,表达foxp3的调节性t细胞是预防自身免疫不可或缺的,可有效抑制肿瘤免疫。treg细胞大量浸润到肿瘤组织中,这通常与癌症患者的不良预后有关。去除treg细胞可增强抗肿瘤免疫应答,但也可能引发自身免疫。定制靶向treg的癌症免疫疗法的一个关键问题在于特异性耗竭浸润到肿瘤组织中的treg细胞而不影响肿瘤反应性效应t细胞,同时抑制自身免疫。
14、早在2010年,各种团队就已经研究对treg耗竭例如通过用抗cd25抗体耗竭可以提高小鼠的抗肿瘤免疫力。已经表明,在接种肿瘤细胞之前耗竭treg会导致它们的有效排斥,而在肿瘤接种同时或之后发生的treg耗竭不会导致肿瘤消退。也有人认为,这是由于施用的耗竭抗体也去除了表达cd25的效应t细胞,而cd25-foxp3+tregs持续存在(klages,katjana,et al.″selective depletion of foxp3+regulatory t cells improveseffective therapeutic vaccination against established melanoma.″cancerresearch 70.20(2010):7788-7799.)。
15、2015年,无岩藻糖基化人源化抗人ccr4单克隆抗体mogamulizumab(kw-0761)在一项针对ccr4阳性癌症患者的临床研究中进行了评估(kurose,koji,et al.″phase iastudy of foxp3+cd4 treg depletion by infusion of a humanized anti-ccr4antibody,kw-0761,in cancer patients.″clinical cancer research 21.19(2015):4327-4336.)。ccr4在调节性t细胞上表达。事实上,mogamulizumab有效地耗尽了treg细胞,并观察到对癌症抗原的特异性免疫反应的增强或诱导。然而,mogamulizumab靶向外周和肿瘤内treg以及其他效应细胞群,从而导致免疫学副作用,例如皮疹或史蒂文斯约翰逊综合征。
16、因此,虽然treg耗竭在癌症治疗中的巨大潜力是显而易见的,但缺少选择性靶向treg和避免明显自身免疫的概念。2015年和2016年,plitas/rudensky和de simone/abrignani/pagani这两个团队的工作改变了这一点。
17、plitas等证明ccr8由人乳腺癌浸润性treg细胞选择性表达,并立即得出结论,靶向ccr8代表了一种有前途的免疫治疗方法,用于治疗患有乳腺癌和其他肿瘤的患者(plitas,g.,et al.″abstract p4-04-11:preferential expression of the chemokinereceptor 8(ccr8)onregulatory t cells(treg)infiltrating human breast cancersrepresents a novel immunotherapeutic target.″(2016):p4-04.;plitas,george,etal.″regulatory t cells exhibit distinct features in human breast cancer.″immunity 45.5(2016):1122-1134.;us10087259)。
18、在plitas等的初步工作发表后不久,de simone等发表了关于肿瘤浸润性调节性t细胞的转录图景的分析,发现肿瘤浸润性treg细胞具有高度免疫抑制作用,并在其细胞表面表达ccr8作为特定的特征分子(de simone,marco,et al.″transcriptional landscapeof human tissue lymphocytes unveils uniqueness of tumor-infiltrating tregulatory cells.″immunity 45.5(2016):1135-1147.,wo2017198631)。作者描述了ccr8与不良预后相关,并得出结论认为ccr8可能是一个有趣的治疗靶点,可以抑制treg细胞运输到肿瘤部位,同时不会干扰不表达ccr8的其他效应t细胞的募集。
19、wo2018112032和wo2018112033描述了降低肿瘤中肿瘤浸润性调节性t细胞(titr)的数量或活性的方法,包括施用在表达基因产物例如ccr8的细胞中诱导细胞毒性的试剂。
20、wo2018112033和ep3431105描述了一种可以调节至少一种标志物(在肿瘤浸润调节性t细胞中选择性失调)的表达和/或功能的分子用于预防和/或治疗该肿瘤。
21、wo2018181425涉及具有adcc活性的针对ccr8的抗体,用于治疗癌症的方法,其中针对ccr8的抗体是ccr8中和抗体。wo2018181425没有公开具体的抗体序列,而是指由biolegend在目录号150302下分发的大鼠抗小鼠ccr8克隆sa214g2。该抗体用作工具抗体,以概括先前描述的小鼠treg耗竭的抗肿瘤发生作用。
22、根据本发明,提供了一种促进抗ccr8抗体的产生并产生具有用于治疗用途的优异特性的抗体的方法。将根据本发明的抗体与现有技术的抗体进行比较,发现在结构、功能和治疗功效上存在差异,如本文别处所讨论的。
23、问题的解决方案
24、1.1cc和cxc趋化因子受体的抗体的生成
25、由于现有技术方法产生cc趋化因子受体的抗体的成功率低,并且所得抗体通常表现不佳(参见例如实施例3),发明人开发了一种新方法来产生趋化因子受体的抗体,并且特别地,产生抗ccr8抗体。
26、使用经过特殊修饰的分离多肽作为抗原来选择人抗人ccr8抗体解决了提供针对cc和cxc趋化因子受体的抗体生成的改进方法的问题,例如可以首次获得完整的人抗ccr8抗体,参见实施例6。更详细地,通过在特定位置引入硫酸盐修饰来修饰包含人ccr8的富含酪氨酸结构域(任选地包括lid结构域)的多肽以形成抗原,参见实施例4,表4.1。噬菌体展示方法任选地与这种特别修饰的抗原一起使用以选择完全人抗人ccr8抗体。或者,硫酸化抗原可用于各种其他方法,例如在常规免疫方法中。
27、获得的抗体对硫酸化抗原和在生理条件下表达的生物靶标显示出极好的结合特征,参见实施例6、10.1.1,但对未修饰抗原的亲和力相对较低或没有亲和力,参见实施例10.1.2、实施例10.1.3,表明硫酸化残基确实对抗原抗体结合至关重要。本发明的抗体还显示出对经工程化以表达人、食蟹猴或鼠ccr8的细胞系以及激活的人tregs的极好且特异的结合,参见实施例10.1.1。
28、在抗体的六个cdr环中,h3环显示出最大的结构多样性并且位于结合位点的中心。它还通过亲和力成熟获得最多的突变,平均与抗原的接触次数最多。因此,它在抗原结合中起着至关重要的作用。分析根据本发明的方法获得的抗体的具体结构,令人惊奇地发现,hcdr3的组成在结构上不同于通常的人hcdr3结构域,参见实施例9。特别地,具有治疗上最有益特性和与ccr8特异性结合的抗体的hcdr3结构域的特征在于平均频率为~21%的酪氨酸残基和平均含量为~10%的组氨酸,强调了这些残基对特异性硫酸化抗原识别的有益影响(参见表9.2)。
29、不受理论的束缚,发明人认为这些结构特征转化为某些功能特征,这使得获得的抗体更适合于治疗应用。例如,与测试的现有技术抗体相比,根据本发明的几种抗体阻断g蛋白依赖性信号传导,参见实施例10.4.3,但不影响g蛋白非依赖性途径,参见实施例10.4、10.4.1、10.4.2,并且基本上不内化到具有靶趋化因子受体内源性表达的细胞中,参见实施例10.5。此外,根据本发明的特别优选的抗体对靶受体和靶细胞具有特异性,参见实施例10.2、11,并且在癌症治疗方法中特别适用/显示出优异的特性,参见实施例12ff。此外,使用这些合成多肽作为抗原或用于脱靶淘选促进或能够产生交叉反应抗体,例如特异性结合人ccr8和/或食蟹猴ccr8的抗体,参见实施例10.1.1。
30、1.2提供特异性结合趋化因子受体的治疗性抗体
31、1.2.1获得具有人cdr的趋化因子受体抗体
32、虽然用鼠cdr对抗体进行人源化可能会提高抗体的免疫原性,但残留的免疫原性存在于cdr区域(harding,fiona a.,et al.″the immunogenicity of humanized andfully human antibodies:residual immunogenicity resides in the cdr regions.″mabs.vol.2.no.3.taylor&francis,2010)。因此,与包含来自其他物种的cdr的抗体相比,包含人cdr的抗体被认为更适合作为人类治疗剂。
33、例如,可以通过噬菌体展示技术或使用能够产生完全人抗体的转基因动物来生产具有人cdr的抗体。然而,获得完全人抗体并不总是微不足道的。虽然理论上hcdr3区域的多样性几乎是无限的,但在实践中,抗体库多样性的产生似乎受到多种机制的仔细调节,这些机制产生的体内库在其多样性和抗原结合位点的范围内受到限制。人类噬菌体展示文库也是如此,它们通常旨在反映体内库。因此,在某些情况下,啮齿动物cdr可以满足“复杂”抗原的结构要求,而人cdr无法轻易识别相同的结构。根据观察到酪氨酸在人hcdr3中的表现比在鼠hcdr3中平均低约50%,可以假设在需要酪氨酸和组氨酸的独特结合能力才能实现靶标结合的情况下,寻找人抗人抗体显然更具挑战性。事实上,本发明人不知道完全人抗人ccr8现有技术抗体。根据本发明,提供了包含人源cdr的ccr8抗体,以及完全人抗体,参见实施例6、7、8。
34、1.2.2获得交叉反应性趋化因子受体抗体
35、交叉反应性抗趋化因子受体抗体如交叉反应性抗ccr8抗体有利于治疗性抗体的开发,因为它们可用于非人类动物模型,以在药理学数据和安全性方面表征治疗剂,然后将抗体施用于人类。然而,交叉反应抗体,例如在两个物种中具有相似结合行为的很难产生并且不容易亲和力成熟,例如因为ccr8等趋化因子受体的细胞外部分在物种之间具有低同源性(参见实施例2)。根据本发明,针对ccr8的交叉反应抗体尤其可以通过使用包含在物种之间具有更高保守性的基序的小硫酸化酪氨酸来产生,使得结合来自两个或更多物种的趋化因子受体如ccr8的交叉反应抗体例如可以通过简单方便的方式获得具有相同数量级的亲和力,参见实施例6、7、10.1.1。
36、1.2.3获得用于治疗的趋化因子受体抗体
37、为了诱导杀死表达靶标趋化因子受体或ccr8的细胞,可以设想多种作用模式。一种作用模式是将靶向趋化因子受体或ccr8的抗体与药物缀合为抗体药物缀合物(adc)的形式。其他可能的作用模式是诱导抗体依赖性细胞毒性(adcc)、抗体依赖性细胞吞噬作用(adcp)和/或补体依赖性细胞毒性(cdc)。对于adcc、cdc和adcp,涉及两步机制:一方面,需要抗体或片段有效结合靶细胞,例如通过ccr8的treg,另一方面,抗体的fc部分(或可以与抗体或片段缀合的替代结合部分,如本文别处所述)必须结合效应细胞,然后介导靶标细胞的杀伤。对于adcp,作为效应细胞与巨噬细胞的结合通常通过抗体fc部分与巨噬细胞表达的fcγriia(cd32a)的相互作用发生。相反,adcc是通过抗体或片段与fcγriiia的相互作用介导的。在人类中,fcγriii以两种不同的形式存在:fcγriiia(cd16a)和fcγriiib(cd16b)。fcγriiia作为跨膜受体在肥大细胞、巨噬细胞和自然杀伤细胞上表达,而fcγriiib仅在中性粒细胞上表达。这些受体与igg抗体的fc部分结合,然后激活由人类效应细胞介导的抗体依赖性细胞介导的细胞毒性(adcc)。
38、1.2.4获得低内化(包括非内化)趋化因子受体抗体
39、当发明人分析已知的抗人ccr8现有技术抗体时,他们发现这些抗体很容易内化到具有内源靶标表达的细胞中,但不会长时间驻留在细胞表面。抗体的内化行为不仅会影响其清除和药理学行为,还会影响其对治疗用途的特定作用模式的适用性。
40、虽然高内化对于某些抗体药物缀合物的产生是可取的,但对于adcc诱导的肿瘤细胞或treg细胞的耗竭是不可取的。更详细地说,需要抗体药物缀合物将药物转运到细胞中,以实现对靶细胞的有效和特异性耗竭。相反,adcc作用模式需要抗体及其fc结构域暴露在靶细胞外部,免疫效应细胞可以在此处结合fc结构域以裂解靶细胞。因此,低或甚至没有内化率会增加adcc/adcp诱导抗体的作用时间。
41、在对用新方法获得的抗体进行表征后,发明人惊奇地发现,根据本发明的几种抗体在具有内源性ccr8表达水平的细胞中表现出特别低或甚至不存在内化特征,参见实施例10.5,而识别相同靶标的现有技术抗体具有更高的内化率。例如,现有技术的抗体433h和l263g8很容易内化到靶细胞中,并且不会长时间驻留在细胞表面。由于它们的低内化特性,因此根据本发明的一些抗体特别适用于adcc、adcp、cdc或混合方法,例如组合的adcc/adcp方法。
42、通常,靶标的选择是强烈影响抗体内化进入细胞的重要因素。根据islam sa等的说法,ccl1配体结合会诱导ccr8的ca2+通量(flux)和快速受体内化(islam,sabina a.,etal.″identification of human ccr8 as a ccl18receptorccr8 is a ccl18receptor.″the journal of experimental medicine 210.10(2013):1889-1898.)。发明人惊奇地发现抗体本身能够如此大程度地影响内化特性。然而,当他们表征本发明的抗体调节其靶趋化因子受体的g蛋白非依赖性信号通路的能力时,他们发现所有测试的现有技术抗体不仅阻断g蛋白依赖性信号,而且还调节g蛋白非依赖性信号,参见实施例10.4ff。g蛋白非依赖性信号先前已与内化行为相关联,参见fox,james m.,et al.″structure/functionrelationships of ccr8 agonists and antagonists:amino-terminal extension ofccl1by a single amino acid generates a partial agonist.″journal of biologicalchemistry 281.48(2006):36652-36661。
43、1.2.5获得调节靶受体信号的趋化因子受体抗体
44、抗体调节趋化因子受体的方式有多种。例如,抗体可以
45、a)阻断g蛋白非依赖性信号,
46、b)阻断g蛋白依赖性信号,
47、c)阻断g蛋白依赖性和g蛋白非依赖性信号传导,
48、d)增加g蛋白非依赖性信号,
49、e)增加g蛋白依赖性信号,
50、f)增加g蛋白依赖性和g蛋白非依赖性信号传导。
51、不受理论的束缚,发明人假设相应趋化因子受体的硫酸化trd可能与配体诱导的趋化因子受体信号传导相关。有趣的是,大多数本发明的抗体有效地阻断了配体诱导的g蛋白依赖性信号但不影响g蛋白非依赖性信号,参见实施例10.4ff。相反,所有现有技术抗体同样阻断配体诱导的g蛋白依赖性信号传导但激动g蛋白非依赖性信号传导。不受理论的束缚,这些差异可能导致内化行为的差异。
52、避免治疗性抗体诱导g蛋白非依赖性信号传导也可能是有利的,因为非特异性信号传导可能导致无法控制的下游效应,例如细胞增殖增加,参见hutchings,catherine j.,et al.(2017);webb,david r.,et al.″opportunities for functional selectivity ingpcr antibodies.″biochemical pharmacology 85.2(2013):147-152.;fox,james m.,etal.(2006)。
53、1.2.6获得adcc/adcp诱导趋化因子受体抗体
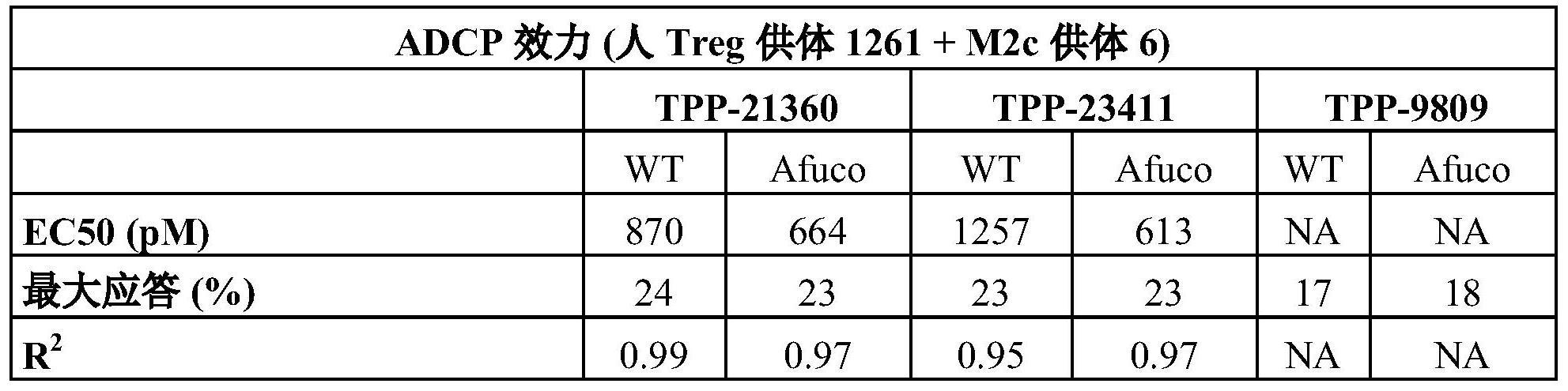
54、根据本发明的抗体的特征在于对adcc和adcp的优异诱导,如例如在实施例10.3.3、10.3.4中所示。在一些优选的实施方式中,通过消除n297处的岩藻糖(无岩藻糖基化)来工程化抗体以获得高adcc率,参见实施例10.3.1。有趣的是,许多本发明的抗ccr8抗体似乎通过使用两种机制(即adcc和adcp)的联合作用模式诱导靶细胞耗竭。
55、1.3治疗方法
56、虽然几个研究小组已经建议基于机制见解在治疗方法中使用结合ccr8的抗体,但提供具有最佳治疗特性的抗体的方法一直很缺乏。通过提供根据本发明的抗体产生方法,现在可以容易地获得具有优异治疗特性的趋化因子受体抗体。根据本发明,公开了具有有利特性的各种序列定义的抗体,其可用于治疗方法,例如在基于adcc的方法中,在基于adcp的方法中,在基于cdc的方法中,或在混合的基于adcc/adcp的方法中,作为缀合物的一部分。实施例12ff显示用根据本发明的方法产生的替代抗体在treg耗竭、总体反应率和肿瘤与对照比率方面显示出显著的功效。
57、1.4联合治疗
58、虽然在使用本发明的抗ccr8抗体的单一疗法中获得了显著的反应率,但令人惊讶地发现,通过将抗体与免疫检查点抑制剂、进一步的靶向疗法、甚至非特异性化学疗法或放射疗法相结合,可以进一步提高治疗益处。这些联合治疗在具有挑战性的肿瘤模型中特别有益。特别地,发现特定的联合治疗方案是有效的,其中仅在抗-ccr8抗体引起大量treg耗竭后施用第二治疗剂或疗法(参见实施例12.6ff.)。此外,观察到即使是单一的抗ccr8抗体治疗也显示出显著的治疗效果(见实施例12.4.2)。
59、1.5分层方案及诊断方法
60、在评估不同同基因小鼠模型对抗ccr8抗体治疗的反应性时,发明人可以确定可预测治疗效果和总体响应的几种机制、生物标志物和生物标志物组合。例如,令人惊讶地发现,对免疫检查点抑制剂(如pd-1、pd-l1或ctla4抗体)的响应程度也可预测对抗ccr8抗体治疗的响应。由于pd-l1表达有时被用作预测免疫检查点抑制剂响应性的替代标志物,发明人评估了pd-l1是否也可用于预测抗ccr8抗体治疗的响应性。这一假设最终可以通过相关数据得到证实,请参见实施例12.7.1。在鉴定最有可能受益于抗ccr8治疗的那些受试者的进一步尝试中,进一步的标志物基因例如免疫细胞和treg标志物被评估为生物标志物(见实施例12.1.2、12.7.2、12.8)。
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!