针对SARS-CoV-2病毒的单域VHH抗体
针对sars-cov-2病毒的单域vhh抗体
技术领域
1.本发明涉及一组针对sars-cov-2的单域vhh抗体及其在检测、诊断、中和和治疗野生型sars-cov-2病毒及其变体中的用途。
现有技术
2.冠状病毒病2019(covid-19)是由sars-cov-2感染引起的疾病的名称,sars-cov-2感染是一种新型冠状病毒并与肺炎有关,对健康和经济系统构成前所未有的威胁。自首次报道以来已经过去了数月,我们仍在不断了解该病毒及其相关的临床表现、其临床意义和可能的治疗。截至2020年4月底,全世界已有三百多万人被感染,二十多万人死亡,这加剧了对更好的诊断和治疗程序的迫切需求。目前,没有疫苗或药物可以有效遏制大流行,因此,全球已实施非药物公共卫生措施诸如保持社交距离、关闭边境和封锁,以拉平曲线并避免卫生系统崩溃。
3.遗传学研究确定,导致这次疫情爆发的病原体属于β冠状病毒属、沙贝病毒亚属和冠状病毒科。它与蝙蝠冠状病毒ratg13具有很高的序列同源性,提供了新病毒可能起源于蝙蝠的证据。有八种冠状病毒与人类疾病有关:hku1、hcov-oc43、hcov-nl-63、hcov-229e和大流行sars-cov-1、mers和sars-cov-2。
4.sars-cov-2序列包含29903bp,其包括14个开放阅读框(orf),其编码复制酶orf1ab、刺突(s)、包膜(e)、膜(m)和核衣壳(n)结构蛋白,以及几种非结构(nsps)和辅助蛋白。病毒表面的糖蛋白刺突(s)负责附着和侵袭宿主细胞。刺突是一种高度糖基化的三聚体i类融合蛋白,包含两个亚基s1和s2。cryoem研究表明,它保持亚稳定的预融合构象,具有与宿主细胞受体结合的s1亚基的铰链状运动。附着之后,s1脱落并使s2亚基处于稳定的融合后构象中。后者介导膜融合并负责侵袭宿主细胞。
5.血管紧张素转换酶2蛋白(ace2)似乎是通向宿主的入口,因为sars-cov-1刺突结合该受体,病毒需要由tmprrs2丝氨酸蛋白酶启动蛋白水解,其攻击s蛋白上的弗林(furin)样切割位点。然后构象的变化稳定复合物,使病毒能够感染宿主细胞。ace2的存在在不同的组织中得到证实,这可能与covid-19的一些临床表现有关;他们中的一些人已经有sars-cov-2感染的体外证据。这种由s糖蛋白介导的机制突出了这种蛋白质作为开发疗法诸如中和抗体和疫苗的靶标的重要性和抗原特性。特异性抗体的分离可以用于开发针对该病毒的有效诊断和治疗库。
6.一些天然存在的抗体缺乏轻链,称为单域抗体(hcab,仅重链抗体)。它们是igg的衍生物,并且存在于整个骆驼科中。骆驼科包括骆驼、单峰骆驼、美洲驼、骆马原驼(guanaco)和羊驼。hcab的抗原结合片段包含一个由3个高变区(cdr)组成的单可变vhh结构域。来源于骆驼科hcab的靶标特异性vhh是在用靶蛋白加佐剂免疫后获得的。我们的平台开发了一种改进的程序,使用羊驼作为供体物种进行vhh生产。为了分离免疫后产生的靶标特异性vhh的基因序列,我们必须首先分离外周b淋巴细胞以获得总rna,然后进行cdna制备以最终扩增vhh区域。编码vhh的cdna片段短至360nt,并且在来自120ml的血液中的细菌展
示文库中,可获得多达~3x106个单克隆。我们使用细菌展示系统来克隆完整的单vhh。在这里,我们获得并选择了针对sars-cov-2的刺突rbd域的一组vhh。
7.单域vhh抗体
8.来源于骆驼科的hcab的靶标特异性vhh在用靶蛋白加佐剂免疫后一般可迅速获得。对vhh结构的分析揭示了高变区如何在核心结构之外的环中突出。为了分离靶标特异性vhh的基因组序列,必须首先获得外周b淋巴细胞以分离总rna,然后进行cdna制备以最终从库的基因v中扩增vhh区域。编码在基因v中vhh的片段短至360nt长。vhh序列在细菌展示载体中克隆,因此,在感受态细菌转化之后。细菌展示技术允许vhh在细菌的表面表达,并且因此表达目的vhh,使得能够亲和纯化。最终分离的vhh在细菌中重组表达,并且其结合能力可以通过elisa和定量的生化参数诸如itc表征。然后以可再生和经济的方式生产vhh。vhh的进一步优点是它们的体积小,它们可以被人源化,它们在水性溶液中结构和行为稳定,它们与单个靶蛋白的特异性和高亲和力结合以及它们的通过骆驼科的自然产生。因此,vhh是当今可以用于基于亲和力的诊断和治疗的最佳工具。
9.单域vhh抗体的优势
10.我们在此详细总结了vhh的优点和用途。
11.纯化
12.与任何其他抗体源相比,vhh纯化是简单的。通常将它们连接亲和标签诸如6x组氨酸标签进行表达,以允许亲和纯化。富集通常在细菌周质中建立,其中氧化环境允许形成适当的二硫键。可以从一升培养物中分离出几毫克,并且重组分离的vhh可以通过标准生化技术进一步分离。
13.稳定性
14.vhh是小而紧凑的多肽,并且它们通常在细菌的周质中表达。与人vh相比,从6℃开始它们在高温下非常稳定,并且它们还可以抵抗变性化学剂。此外,vhh结构的分子工程化表明,当在位置54和78处引入半胱氨酸以形成额外的二硫键时,稳定性会增加。有趣的是,由此产生的超稳定vhh对蛋白酶诸如胃蛋白酶或糜蛋白酶也更具抗性。
15.免疫隐蔽性
16.vhh可以用作针对肿瘤、病原体和慢性疾病的治疗子弹,但是,作为外来蛋白质,它们本身可能触发免疫应答。幸运的是,体积小、从血液中快速清除以及与人类重链可变区vh的高度同源性使它们几乎没有免疫原性。在vhh和人vh之间只有少数氨基酸不同,已经将用骆驼氨基酸置换人氨基酸用于人源化骆驼科vhh,并使它们在治疗中更加安全。
17.可及性
18.vhh是严格的单体,它们对底物的亲和力取决于三个高变环的突出。因此,vhh趋于与多肽的空间结构腔相互作用,但不能有效地与肽相互作用。例如,几个已经鉴定的vhh直接阻断活性酶位点。一些vhh甚至可以通过转胞吞作用穿过血脑屏障和形成用于治疗方法的部分双特异性抗体。最后,分子可及性会影响对大分子复合物的可及。
19.单域vhh抗体的用途
20.诊断学
21.单域vhh抗体是用于诊断的高级工具。其不受限的体外生产能力使vhh比传统抗体更可靠,并且不受批次制备或动物血清限制的影响。vhh可以作为蛋白质产生,其与用于直
接染色或可视化的报告肽或蛋白质融合,包括亲和标签(flag、ha、v5和cmyc)、荧光蛋白(gfp、rfp等)和用于比色测量的酶诸如辣根过氧化物酶(hrp)。例如,通过使用vhh进行特异性固定或使用与辣根过氧化物酶(hrp)偶联的特定vhh进行检测,可以改进elisa测定。
22.在今天,癌症生存的最佳机会是早期发现和适时手术。因此,基于vhh的体内检测是未来最有前途的抗癌技术之一。
23.治疗
24.在针对不同病毒的不同实验性治疗应用的背景下,已经开发了几种vhh,所述病毒包括:hiv、乙型肝炎病毒、流感病毒、呼吸道合胞病毒、狂犬病病毒、fmdv、脊髓灰质炎病毒、轮状病毒和perv。值得注意的是,vhh可以中和hiv感染;使用从患者分离的hiv抑制了细胞至细胞的传播。由于vhh在人体中的免疫反应性低,可以将它们注射到患者体内,几乎没有或没有副作用。为了使它们更有效和更具特异性,vhh可以被连接以产生二价、多价和/或多特异性vhh,或与其他vhh或循环蛋白诸如白蛋白结合以增加它们的周转和治疗效果。狂犬病病毒在人中引起致命的脑部感染。暴露后不久,就用血浆来源的免疫球蛋白和疫苗提供抗狂犬病的预防。通常,这在被可能感染的动物攻击之后立即进行。在动物模型中抗狂犬病vhh可以显著延长生存期或者甚至完全治愈疾病。呼吸道合胞病毒(rsv)是儿童住院的主要原因之一,每年有超过190万的一岁以下的儿童被感染,有超过30万的五岁以下儿童住院。目前尚无针对rsv的治疗方法。然而,基于三价vhh的治疗正处于ii期临床试验中。由ablynx开发的rsv疗法alx-0171的绝对新颖之处在于直接中和受感染实验动物肺部的病毒。vhh通过雾化给药,并且它将病毒滴度降低10000倍。vhh也用于针对癌症的免疫治疗。
25.covid-19和单域vhh抗体
26.感染2019冠状病毒cov变体产生的症状与2002-2003年流行病中sars-cov引起的严重急性呼吸系统综合症的症状相似。两种病毒共享高度同源的基因序列和相同的受体来进入和感染人类宿主细胞:血管紧张素转换酶2(ace2)(zhao,y.,et al."single-cell rna expression profiling of ace2,the receptor of sars-cov-2.biorxiv."preprint.posted(2020))。出于这个原因,该病毒被命名为sars-cov-2,并且在2020年2月,who将该感染命名为covid-19,并被宣布为国际关注的第六次突发公共卫生事件。根据who在2020年4月27日发布的报告,有2,878,196例确诊病例和198,668例死亡。研究人员正在利用他们所有的资源来制定快速治疗策略,以中和病毒并防止感染传播。
27.vhh中和病毒通过阻断病毒与受体的结合来防止病毒进入。致病性中东呼吸综合征冠状病毒(mers-cov)和严重急性呼吸综合征冠状病毒(sars-cov-1)通过结合ace2受体的、称为刺突(s)的大包膜糖蛋白进入人体细胞。刺突蛋白具有高度的免疫原性,并且由于它们在感染中的作用,它们是开发新疗法的易于突破的靶标。因此,抗病毒抗体的高效力和特异性可以成为有前途的治疗工具。针对中东呼吸综合征冠状病毒和严重急性呼吸综合征冠状病毒的vhh,先前已有描述。但是,尚未有针对sars-cov-2的特定vhh的报告。迄今为止,来自康复的sars-cov-2感染患者的多克隆抗体已被用于治疗covid-19。
28.在本技术中获得的和受保护的vhh是对抗sars-cov-2大流行的有力工具,它们可以应用于检测方法以及还可以是治疗方法,以在体内和离体下中和病毒。
附图说明
29.图1.sars-cov-2的刺突的免疫和用于vhh选择的简单密度梯度方法。(a)sds-page用以确保免疫前sars-cov-2的全长刺突的蛋白质完整性。(b)通过斑点印迹评估羊驼的免疫应答。图像显示了使用预免疫对照(上膜)以及使用羊驼血清作为一抗来源,然后使用抗骆驼igg-hrp二抗,用全长sars-cov-2刺突进行一次免疫(1周,中膜)或两次免疫(3周低膜)后,对减少量的刺突(下排)和牛血清白蛋白(上排,阴性对照)的反应。(c)第二次免疫前和免疫后3周的elisa,n=4,误差条表示标准偏差统计t检验,**p≤0.005。(d)使用密度梯度分离进行vhh分离的新方案的示意图:将表达细菌表面上的vhh的细菌展示文库(i)与用目的抗原包被的常规琼脂糖珠粒短暂温育(ii)。在将混合物沉积在ficoll密度梯度锥形管(iii)中并以200g离心1min之后,具有表达特定vhh的细菌的珠粒立即通过连续密度梯度选择移动到管底部,而未结合的细菌保留在梯度的表面上。然后将珠粒重悬,并分离细菌克隆(iv,琼脂平板温育)。
30.图2.在0.2μm孔径的硝酸纤维素膜中,以发明的w25、w23和w5的vhh为一抗,然后通过小鼠抗myc和偶联hrp的山羊抗小鼠igg,进行免疫检测刺突sars-cov-2。阴性和阳性对照也包括在内。
31.图3.基于生化和显微镜的双重vhh选择。(a)使用选定克隆的总蛋白提取物作为一抗,然后使用小鼠抗myc(1:3000)和抗小鼠alexa 647对hela细胞中瞬时转染的刺突-gfp进行免疫检测。该图像显示了两个阳性克隆(w25和w23),以及进行了一次阴性vhh的筛选测定实例,比例尺表示20μm。(b)显示如何制作荧光强度的图,测量细胞交叉截面中的绿色(刺突-gfp)和红色通道(vhh)的荧光。图描述了阴性对照vhh(c)、w25(d)和w23(e)的刺突-gfp(连续线)和vhh(点线)的荧光强度。
具体实施方式
32.本发明提供了针对sars-cov-19刺突蛋白的受体结合域(rbd)结构域的单域vhh抗体。
33.尽管全世界都在努力控制covid-19发展为严重急性呼吸综合症及其对卫生系统的影响,但情况仍然严峻。为了满足全球需求,需要在成本、时间和劳动力方面采取有效的诊断、治疗和预防措施:重组抗体诸如羊驼vhh可能有助于满足这些要求。在这里,我们描述了针对sars-cov-2刺突蛋白的受体结合域(rbd)结构域的vhh。
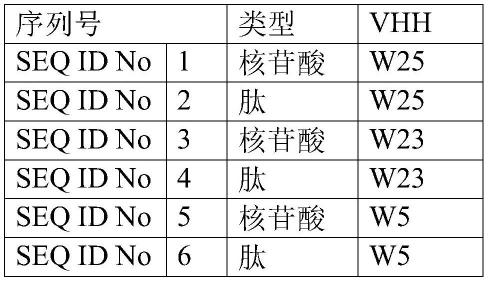
34.本发明人获得了特异性识别sars-cov-2刺突的单域vhh抗体,vhh的核苷酸和氨基酸序列,在seq id no.1至6中示出。cdr序列在seq idno.7至15中示出。
35.使用刺突蛋白作为纯化的抗原开发本发明。对羊驼进行免疫,并且进一步从周围淋巴细胞中克隆出单域vhh抗体并且进一步表征。
36.根据本发明的针对sars-cov-2刺突蛋白的vhh,包括与根据seq id no 7、8和9的氨基酸序列具有至少90%同一性的3个cdr。
37.在本发明的实施方式中,vhh具有与seq id no 2、4或6具有至少90%同一性的氨基酸序列。
38.在本发明的实施方式中,vhh由与seq id no 1、3或5具有至少90%同一性的核苷酸序列编码。
39.在本发明的其他实施方式中,vhh包括3个具有根据seq id no 7、8和9的氨基酸序列的cdr。
40.在本发明的其他实施方式中,vhh包括3个具有根据seq id no 10、11和12的氨基酸序列的cdr。
41.一种检测sars-cov-2的方法,其中,根据权利要求1所述的vhh用于检测样品中病毒的存在。
42.序列号和本发明的vhh的幻想号之间的相关性描述于表1中。
43.表1
[0044][0045][0046]
对于在该领域工作的专家来说,很明显,识别sars-cov-2刺突的vhh可用于covid-19的诊断和治疗。
[0047]
在治疗中,识别sars-cov-2刺突的vhh可以用于中和病毒并控制个体的疾病。可以产生单域vhh抗体作为与人抗体的fc结构域融合,称为微抗体(minibody)。这允许单域vhh抗体与人体免疫系统之间的联系,以增强由人体免疫系统对病毒的识别。
[0048]
因此,本发明还提供了一种中和sars-cov-2的方法,其中使用根据本发明的vhh来中和病毒。病毒的体内中和可以控制个体的疾病。
[0049]
在本发明的优选实施方式中,在中和方法中使用的vhh是人源化的。在本发明的另一种实施方式中,所述vhh结合载体分子,诸如抗体融合物、人fc片段、聚乙二醇、唾液酸聚合物、β羧基端肽、白蛋白或白蛋白结合肽和其他。任选地,相应地将一种或多种vhh结合人fc片段以增加循环时间并连接宿主的免疫应答。
[0050]
在人类和动物的诊断或病毒检测中,识别sars-cov-2刺突的vhh可以以任何可用的技术使用,例如用elisa、免疫印迹、免疫组织化学、免疫沉淀、侧向流检测(lateral flow test)、乳胶凝集、基于细胞术的研究、细胞术微球阵列(cba)和其他。
camelidae.antimicrob agents chemother.2001oct;45(10):2807-12.doi:10.1128/aac.45.10.2807-2812.2001)。在1.2%(w/v)低熔点琼脂糖凝胶中进行对应于vhh-ch2结构域的~0.6kb和对应于常规vh-ch1-ch2结构域的~0.9kb的扩增片段的分离,并纯化~0.6kb带(qiaex ii凝胶提取试剂盒,qiagen)。将该片段用作具有寡核苷酸vhh-sfi2(5'-gtc ctc gca act gcg gcc cag ccggcc atg gct cag gtg ga-3')和vhh-not2(5'-gga cta gtg cgg ccg ctg agag aga cgg tga cct gg t-3')的第二次pcr反应中的模板,最终获得~0.4kb的扩增片段,对应于vhh结构域。将扩增的vhh片段用sfii和noti(thermo scientific)限制性酶消化,并连接到纯化的载体pneae2的相同位点中(salema v,l
ó
pez-guajardo a,gutierrez c,menc
í
a m,fern
á
ndezcharacterization of nanobodies binding human fibrinogen selected by e.coli display.j biotechnol.2016sep20;234:58-65.doi:10.1016/j.jbiotec.2016.07.025.)。在大肠杆菌dh10b-t1 r细胞中电穿孔连接,达到文库大小为~3
×
106个个体克隆,其通过在具有2%w/v葡萄糖的lb-氯霉素琼脂平板上接种并在30℃下温育而确定。在没有dna插入的情况下平行进行的对照连接估计再连接的载体少于0.7%。从平板上刮下转化的细菌,并在-80度下储存在含有30%甘油的lb肉汤中。
[0059]
获得文库后,本发明人应用本发明方法,使用ficoll基于简单的密度梯度进行vhh选择。(图1e)。
[0060]
将表位与珠粒偶联
[0061]
使用前立即用2ml的冷的1mm hci洗涤1ml nhs活化的琼脂糖4快速流动(fast flow)珠粒(ge医疗),然后用冷的无菌pbs洗涤5次。将在pbs 1x中的200μg的纯化蛋白加入到珠粒中,并旋转温育过夜。添加乙醇胺至0.5m终浓度,封闭培养基上的非反应基团。用pbs 1x洗涤珠粒5次,并在4℃下储存。
[0062]
密度梯度分离
[0063]
将文库中的1ml甘油原液接种在含有20ml lb培养基(含有25μgml-1氯霉素和2%葡萄糖)的烧瓶中。将烧瓶在37℃下以200rpm搅拌温育(预接种)过夜。用卡那霉素抗性质粒(对照)转化的对照细菌重复相同的程序。将预接种物沉淀并重悬于具有25μgml-1氯霉素的lb培养基中,然后在具有25μgml-1氯霉素且不具有葡萄糖的100ml新鲜lb培养基中稀释至0.02od
600nm
,在37℃下以200rpm搅拌温育直至达到0.45-0.6od
600nm
。加入iptg至50μm的终浓度,以在30℃和200rpm下诱导蛋白质表达3小时。测量文库和对照细菌培养物的od600nm吸光度。用10ml的过滤的pbs洗涤50ml的两种培养物三次。始终在3000xg下离心5min。将两种培养物重悬于10ml pbsx的最终体积中。将2ml文库培养物和2ml对照培养物混合(如果最终od600nm相同,如果不同则基于od调整对照细菌的体积以确保等量的细菌),并与在摇摆平台上的15ml锥形管中偶联至表位蛋白的300μl nhs珠粒在室温下温育30min。将混合物加入在15ml锥形管中的6ml ficoll(ficoll-paquetm plus ge healthcare)上,以200xg离心1min。丢弃未结合的部分(上层部分),留下可见的珠粒沉淀,将其重悬于4ml pbs中并在室温下旋转5min。重复这一步骤六次。最后,加入1ml的lb培养基并在室温下温育5min,然后将50μl铺板在具有25μgml-1氯霉素和2%葡萄糖的lb琼脂平板上,在37℃下温育过夜(推荐》20hr)。
[0064]
细菌展示系统表达融合至内含肽蛋白和myc标签的细菌表面上的vhh。优化缓冲液
条件以从细菌膜中提取vhh-内含肽融合物,并且应用以下两种不同的方法直接使用细菌提取物进行与刺突的结合确认:斑点印迹分析和高内涵显微术。使用我们基于ficoll的简单密度梯度方案进行vhh选择后,我们从琼脂糖-抗原包被的部分中获得在lb-琼脂平板上的~1000个菌落。使用100个菌落接种液体lb培养基并进一步诱导内含肽-vhh的表达。在优化条件下裂解细胞,并且将提取物用作vhh的来源,作为一抗用于进行第二结合筛选。对于斑点印迹分析,将不相关蛋白质的阴性对照以相同量的刺突全长施用到硝酸纤维素条上。此外,将单点印迹条测试与含有vhh的细菌提取物在12个孔板中温育。结合刺突的vhh是通过与小鼠抗myc抗体和抗小鼠hrp缀合物的顺序温育而揭示的。在前100个克隆中,有三个克隆在斑点印迹分析中显示出对全长刺突的强结合能力w25、w23和w5(w25 seq id no.1和seq id no.2和w23 seq id no.3和seq id no.4、w5 seq id no.5和seq id no.6)。
[0065]
实施例2结合测定
[0066]
斑点印迹
[0067]
将来自表达vhh的细菌的个体菌落、从实施例1获得的w25、w23和w5、(dh10b菌株)接种到2ml lb培养基中,并在37℃下以200rpm搅拌温育过夜。将100μl预接种物加入至1.9ml的具有25μg ml-1氯霉素的新鲜lb培养基中,在37℃下以200rpm搅拌温育直至达到0.45-0.6od600nm。加入iptg至50μm的终浓度,以在30℃和200rpm下诱导蛋白质表达3小时。将培养物沉淀并且重悬于1ml pbs 1x 0.2%tritonx100中,在冰上以40%超声处理10秒,然后在4℃下以14,000xg离心30min,并且回收上清液以获得来自每个克隆的总蛋白提取物。将1μl的蛋白质sars-cov-2刺突蛋白(200ng/μl),以及大肠杆菌总蛋白提取物作为阴性对照,在0.2μm孔径的硝酸纤维素膜(merk millipore)的预先标记网格内点样,同时使用抗histag商业抗体作为阳性对照,使用的刺突蛋白具有6x组氨酸标签。然后将膜干燥以在室温下将蛋白质在其上固定30min。在室温下用封闭溶液(具有5%牛血清白蛋白的pbs-t)对非特异性部位以搅拌进行30min封闭。弃去封闭溶液,以及将每个膜在室温下用1:10稀释的每个克隆总蛋白提取物(在5ml的含有5%bsa的pbs-t中)搅拌温育1hr,然后用pbs-t洗涤3x5min。二抗温育用在含有5%bsa的tbs-t中1:3000的小鼠抗myc抗体(9b11,细胞信号传导)在室温下进行1hr,然后用tbs-t洗涤3x5min。在这之后,将膜与在含有5%bsa的pbs-t中1:5000的偶联hrp的山羊抗小鼠igg抗体(invitrogen)在室温下温育1hr,然后用pbs-t洗涤3x5min并且使用ecl试剂显影。结果在图2中示出,其中包括斑点印迹的照片。值得赞赏的是,对3个测试的vhh具有强的应答。
[0068]
此外,我们使用高内涵显微术作为第二种确认方法。因此,用刺突gfp转染单个10cm板24h,并将细胞接种到3x96孔板上。24小时后,将细胞固定、透化,并将我们的100个选定的细菌展示克隆的个体提取物作为vhh的来源(用作一抗)进行温育。将vhh进行myc标记,与小鼠抗myc抗体和抗小鼠alexa647二抗细胞进行温育后,通过免疫荧光测定进行分析。hela细胞显示~20%的转染效率。在这种情况下,期待较低的转染率,因为它表示在相同图像中非特异性结合未转染的细胞。与斑点印迹分析一致,结合刺突gfp的vhh w23和w25s在病毒自然条件下在人类细胞中表达(图3a)。我们观察到w23和w25共定位到刺突gfp,而阴性对照提取物未观察到共定位(图3b)。对选定的克隆进行测序,氨基酸序列的比对表明两种vhh是不同的,并且很可能识别不同的刺突表位。因此,我们表明了,使用直接来自细菌展示文库的细菌提取物对vhh进行快速二次筛选选择,使用常规生化方法诸如斑点印迹分析或
高内涵显微术免疫荧光基测定选择克隆。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1