用于治疗动脉粥样硬化性心血管疾病的药物化合物的制作方法
1.本发明涉及一种包含两个gp130-fc融合肽作为其组分的多肽二聚体,该多肽二聚体用于治疗人类患者的动脉粥样硬化性心血管疾病(ascvd),该ascvd如2019esc/eas指南(尤其是表4):mach等人,eur.heart j.[欧洲心脏杂志]41:111(2020)所定义。ascvd包括低密度脂蛋白(ldl)驱动的ascvd、甘油三酸酯驱动的ascvd、脂蛋白a驱动的ascvd、慢性炎症性疾病驱动的ascvd、或炎症性ascvd,可伴有以下一种或多种病症:家族性高胆固醇血症、慢性肾脏病、糖尿病、血压高于180/110mmhg、或人类免疫缺陷病毒感染。
[0002]
通常来说,人类患者可能对以下的一种或多种治疗无响应或不耐受以下的一种或多种治疗:他汀类药物;依折麦布(ezetimibe);前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(pcsk9)抑制剂,优选地是例如阿利苏单抗(alirocumab)或依伏库单抗(evolocumab)等抗体、或例如英立西兰(inclisiran)等短干扰rna;或脂质单采疗法(lipid apheresis therapy)。
背景技术:
[0003]
炎症是动脉粥样硬化性心血管疾病(ascvd)的强驱动因素(ross1999,n.engl.j.med.[新英格兰医学杂志]340:115)。虽然目前存在先进的医学治疗方法,但是患有很高危ascvd(如2019esc/eas指南的表4:mach等人2020,eur.heart j.[欧洲心脏杂志]41:111所定义)且炎症负荷高的患者对有效疗法的需求仍然很大,远未得到满足。此类治疗方法应防止或减少不当发生的炎症,同时避免出现全身免疫抑制(ridker 2017,circ.res.[循环研究]120:617),因为全身免疫抑制会增加感染的风险,并且不会降低心血管事件(ridker等人2019,n.engl.j.med.[新英格兰医学杂志]380:752)。对于生活方式改变、血浆脂质水平优化后,ascvd仍然进展的情况,抗细胞因子疗法是一种有前景的治疗选择(schuett&schieffer2012,curr.atheroscler.rep.[当代动脉硬化报道]14:187;ait-oufella等人2019,arterioscler.thromb.vasc.biol.[动脉硬化、血栓形成和血管生物学]39:1510)。
[0004]
最近的cantos试验研究了抗白细胞介素-1β(il-1β)抗体康纳单抗(canakinumab)对已建立的人类炎症性ascvd的作用,结果证实了以下挑战:通过降低心血管事件复发率获得的显著益处是以致命性感染的发生率升高为代价的(ridker等人2017,n.engl.j.med.[新英格兰医学杂志]377:1119)。位于il-1β下游的白细胞介素-6(il-6)信号转导参与动脉粥样硬化(scheller&rose-john 2012,lancet[柳叶刀]380:338)。il-6是一种多效性细胞因子,由造血细胞和非造血细胞响应于感染和组织损伤而产生。ascvd患者的循环il-6水平高,这与临床活动相关(ridker等人2016,circ.res.[循环研究]118:145)。高il-6血浆水平与未来心血管事件风险的升高相关联(kaptoge等人2014,eur.heart j.[欧洲心脏杂志]35:578)。
[0005]
il-6通过两条主要的信号转导通路发挥多种功能,这两条通路都需要由跨膜共受体gp130预先形成的二聚体进行信号转导(scheller等人2014,semin.immunol.[免疫学研
讨会]26:2)。在经典信号转导中,il-6利用主要是由肝细胞和白细胞表达的膜结合il-6受体(il-6r)。在跨信号转导通路中,通过蛋白水解切割或可变剪接产生的循环可溶性il-6r(sil-6r)募集il-6,形成il-6/sil-6r复合物,该复合物可激活几乎所有体细胞上普遍表达的gp130(garbers等人2018,nat.rev.drug discov.[自然评论药物发现]17:395)。在生理情况下,这种普遍存在的跨信号转导被血液中存在的充当缓冲剂的过量可溶性gp130亚型(sgp130)所阻止(jostock等人2001,eur.j.biochem.[欧洲生物化学杂志]268:160)。经典的il-6信号转导具有许多生理和抗感染功能,而过度的跨信号转导则存在于许多慢性炎症性病症中。因此,有人提出利用特异性的跨信号转导抑制而非阻断il-6或其受体来治疗慢性炎症,避免全身免疫抑制的负面作用(rose-john等人2017,nat.rev.rheumatol.[自然评论风湿病学]13:399;garbers等人2018,nat.rev.drug discov.[自然评论药物发现]17:395)。如上所述,通过康纳单抗来抑制il-1β导致了心血管事件复发率显著降低以及人体il-6水平降低。但是,康纳单抗全身免疫抑制的副作用为该ascvd疗法带来不利的风险/收益比(ridker等人2017,n.engl.j.med.[新英格兰医学杂志]377:1119;palmer等人.2019,front.cardiovasc.med.[心血管医学前沿]6:90)。_enref_23这些结果与使用抗il-6r抗体托珠单抗所观察到的机会性感染和严重感染发生率上升的结果一致(rose-john等人2017,nat.rev.rheumatol.[自然评论风湿病学]13:399)。完全il-6抑制的另一个潜在缺陷是甘油三酸酯和ldl胆固醇的潜在升高(garbers等人2018,nat.rev.drug discov.[自然评论药物发现]17:395)。
[0006]
ep 1148065b1和jostock等人2001(eur.j.biochem.[欧洲生物化学杂志]268:160)描述了由2个sgp130结构域融合至人类免疫球蛋白g1的可结晶片段所构成的融合蛋白sgp130fc。_enref_7wo 2008/000516 a2描述了sgp130fc的优化变体,该变体采用国际非专有名称奥兰吉西普(olamkicept),目前由辉凌制药公司(ferring pharmaceuticals)(saint-prex,ch)和天境生物公司(shanghai,cn)进行临床开发。
[0007]
schuett等人2012(arterioscler.thromb.vasc.biol.[动脉硬化、血栓形成和血管生物学]32:281)证明了冠状动脉疾病患者具有较低的血浆内源性sgp130水平,并描述了sgp130fc在标准的鼠动脉粥样硬化模型中使动脉粥样硬化减少,该模型经遗传操作而缺失ldl受体,并经高脂高胆固醇饮食喂养以使动脉粥样硬化疾病程度最大化。然而,要将这种来自人造遗传模型的发现转化应用于人类疾病,仍会受到大量的风险因素和行为变化的影响,往往不能取得成功(seok等人2013,pnas 110:3507;tsukamoto 2016,drug discov.today[今日药物发现]21:529),即使选择了正确的疾病模型也是如此(oppi等人2019,front.cardiovasc.med.[心血管医学前沿]6:46)。例如,在两种最广泛使用的动脉粥样硬化遗传小鼠模型(ldlr-/-和apoe-/-)中,删除il-6可以抗动脉粥样硬化(madan等人2008,atherosclerosis[动脉粥样硬化]197:504)、抑制il-6r可以减少动脉粥样硬化病变(akita等人2017,front.cardiovasc.med.[心血管医学前沿]4:84)。然而,就是在这些模型中,消除il-6也可能增强而不是减少动脉粥样硬化(ramji&davies 2015,cytokine growth factor rev.[细胞因子与生长因子综述]26:673),这突出了il-6信号转导复杂的生理和病理功能、以及复杂慢性疾病的鼠模型内在的不确定性。
技术实现要素:
[0008]
ascvd患者即使接受最大限度的医学治疗,仍然会频繁地经历疾病恶化和心血管事件。要解决的问题是提供一种靶向抗炎疗法,该疗法减轻动脉粥样硬化斑块中局部ldl胆固醇驱动的自我延续的代谢性炎症,而不会产生显著的全身免疫抑制。
[0009]
这个问题的解决方案通过权利要求的特征提供,特别是通过一种多肽二聚体提供,该多肽二聚体包含两个gp130-fc融合肽(例如奥兰吉西普),用于治疗人类患者的ascvd,优选地用于治疗人类患者的高危ascvd,更优选地用于治疗人类患者的很高危ascvd。
[0010]
目前发现,奥兰吉西普可以给予确诊ascvd的人类患者,这种治疗不会引起明显的副作用。令人惊讶的是,在已建立的动脉粥样硬化中,奥兰吉西普对il-6跨信号转导产生的特异性治疗抑制被发现能够高效减轻很高危ascvd人类患者的动脉粥样硬化负担并降低局部炎症活动,程度出人意料地大(虽然进行了最大限度的医学治疗)。虽然患者的疗法和生活方式经过了优化,奥兰吉西普可以在临床上显著消退这些患者体内已建立的动脉粥样硬化斑块和动脉壁炎症,这一发现令人惊讶,因为前面描述的奥兰吉西普在动脉粥样硬化的鼠模型中的效果(schuett等人2012,arterioscler.thromb.vasc.biol.[动脉硬化、血栓形成和血管生物学]32:281)是在以下设定下获得的:小鼠经过人工删除ldl受体后,在遗传上容易发生严重动脉粥样硬化;喂养小鼠大量诱发动脉粥样硬化的高脂高胆固醇饮食;小鼠仅给予奥兰吉西普一种药物。然而,在没有人工删除ldl受体的人类患者中,奥兰吉西普作为一种额外的疗法,在优化的治疗设定下表现出临床有意义的作用,并且令人惊讶地能够有利地影响ascvd的关键参数,而这些关键参数显然无法被最好的可用抗ascvd药物(例如pcsk9抑制剂或他汀类药物)恰当地靶向。优选地,这些关键参数由2019esc/eas指南(mach等人2020,eur.heart j.[欧洲心脏杂志]41:111)所定义。
[0011]
本发明的多肽二聚体包含两个gp130-fc单体,每个单体与seq id no:1具有至少90%的序列同一性,优选地其中,两个单体包含gp130 d6结构域、fc结构域铰链区,该gp130 d6结构域包含seq id no:1第585-595位的氨基酸,该fc结构域铰链区包含seq id no:1第609-612位的氨基酸;更优选地,两个单体不包含位于gp130部分与fc部分之间的连接子,而是该gp130部分与该fc部分直接连接,奥兰吉西普这个实例就是这种情况。进一步,本发明提供了多肽二聚体(尤其是奥兰吉西普),该多肽二聚体用于治疗确诊ascvd、高危ascvd或很高危ascvd的人类患者的方法中。
[0012]
优选地,该人类患者对以下的一种或多种治疗无响应或不耐受以下的一种或多种治疗:他汀类药物、依折麦布、前蛋白转化酶枯草杆菌蛋白酶/kexin 9型(pcsk9)抑制剂、或脂质单采疗法。可选地,该人类患者可患有例如以下病症:ldl胆固醇驱动的ascvd、甘油三酸酯驱动的ascvd、脂蛋白a驱动的ascvd、慢性炎症性疾病驱动的ascvd、炎症性ascvd、家族性高胆固醇血症、慢性肾脏病、糖尿病、血压高于180/110mm hg、或人类免疫缺陷病毒感染。
具体实施方式
[0013]
本发明提供了一种多肽二聚体(例如奥兰吉西普),该多肽二聚体用于治疗人类患者的ascvd,优选地用于治疗人类患者的高危ascvd,更优选地用于治疗人类患者的很高危ascvd。本文中,该多肽二聚体包含两个gp130-fc单体、或由两个gp130-fc单体组成,每个单
体与seq id no:1具有至少90%的序列同一性,优选地其中,两个单体包含gp130 d6结构域、fc结构域铰链区,该gp130 d6结构域包含seq id no:1第585-595位的氨基酸,该fc结构域铰链区包含seq id no:1第609-612位的氨基酸;更优选地,两个单体不包含位于gp130部分与fc部分之间的连接子。
[0014]
本文描述的多肽二聚体通过选择性靶向并中和il-6/sil-6r复合物来抑制过量的il-6跨信号转导,因此,该多肽二聚体被认为在理想的浓度下仅抑制il-6跨信号转导,而保留完整的经典信号转导及其多种生理功能和急性炎症防御机制。目前已发现,该多肽二聚体的功效类似于例如抗il-6r抗体托珠单抗或抗il-6抗体西鲁库单抗(sirukumab)所产生的全局il-6阻断,但副作用显著减少,尤其是不会出现普遍的免疫抑制。
[0015]
本文描述的多肽二聚体优选地包含gp130-fc单体,该单体具有与seq id no:1对应的序列。在某些实施例中,本文描述的多肽二聚体包含多肽,该多肽与seq id no:1具有至少90%、95%、97%、98%、99%或99.5%的序列同一性。优选地,本文描述的多肽二聚体包含多肽,该多肽与seq id no:1第1-595位的氨基酸(对应于gp130序列)具有至少90%、95%、97%、98%、99%或99.5%的序列同一性。优选地,该fc结构域是igg1或igg4的fc结构域。优选地,该多肽包含gp130 d6结构域(尤其是氨基酸残基tfttpkfaqge:seq id no:1第585-595位)、fc结构域铰链区内的氨基酸残基aega(seq id no:1第609-612位),并且不包含位于gp130部分与fc部分之间的连接子。在一个优选的实施例中,本披露内容提供了一种包含两个单体的多肽二聚体,该两个单体具有与seq id no:1存在至少90%的序列同一性的氨基酸序列,其中,该氨基酸序列包含gp130 d6结构域、fc结构域铰链区内的aega,并且在gp130部分与fc部分之间不存在连接子。在一些实施例中,本发明提供包含本文描述的多种多肽(例如,本文描述的多种多肽单体和/或多肽二聚体)的组合物。
[0016]
本发明的多肽二聚体用于肠胃外给药,例如静脉内输注或皮下注射。合适的配制品包括那些包含表面活性剂的配制品,尤其是包含例如聚山梨酸酯表面活性剂(例如,聚山梨酸酯20)等非离子表面活性剂的配制品。配制品还可包含缓冲剂和糖类。一种示例性缓冲剂是组氨酸。一种示例性糖是蔗糖。从而,合适的配制品可以包含聚山梨酯20(例如,0.01mg/ml-1mg/ml、0.02mg/ml-0.5mg/ml、0.05mg/ml-0.2mg/ml)、组氨酸(例如,0.5mm-250mm、1mm-100mm、5mm-50mm、10mm-20mm)和蔗糖(例如,10mm-1000mm、20mm-500mm、100mm-300mm、150mm-250mm)。
[0017]
本发明的多肽二聚体典型的给药剂量是60mg至1g,优选地150mg至600mg。典型的给药频率是每1-4周一次,优选地每1-2周一次。
[0018]
本发明的示例表明,奥兰吉西普可以给予ascvd患者而无任何显著的副作用。令人惊讶的是,在已建立的很高危ascvd(如2019esc/eas指南的表4:mach等人2020,eur.heart j.[欧洲心脏杂志]41:111所定义,这是目前优选的指南)中,奥兰吉西普对il-6跨信号转导的特异性治疗抑制减轻了动脉粥样硬化负担并降低局部炎症活动,程度出人意料地大,虽然进行了最大限度(耐受)的医学治疗。尤其是,奥兰吉西普可以减少内中膜厚度(imt)、动脉粥样硬化斑块和动脉壁炎症,如通过检测动脉粥样硬化斑块的细胞浸润可得。
[0019]
因此,本发明适用于治疗人类患者,该人类患者患有ascvd,优选地患有高危ascvd,更优选地患有很高危ascvd,其中,该人类患者优选地对以下的一种或多种治疗无响应或不耐受以下的一种或多种治疗:他汀类药物、依折麦布、pcsk9抑制剂(优选地是例如阿
利苏单抗和依伏库单抗等抗体、或例如英立西兰等短干扰rna)、或脂质单采疗法。
[0020]
如本文所使用,“无响应”是指按照目前的指南以合适的剂量进行合适的疗法时,无论是单独采取该疗法还是将该疗法与其他疗法组合,人类患者对该疗法仅产生部分预期响应、或完全缺乏预期响应。例如,对他汀类药物、依折麦布和/或pcsk9抑制剂无响应的一种生物标记是血液和/或血浆和/或血清中的ldl胆固醇,其水平降低不足,或者没有降低。目前用于ascvd的ldl胆固醇治疗目标,例如,由2019esc/eas指南(mach等人2020,eur.heart j.[欧洲心脏杂志]41:111)所定义。降低ldl胆固醇的药物的功效不仅在不同药物类别之间存在差别,而且在同一药物类别内也可能会不同,如使用他汀类药物所观察到的,多种他汀类药物的功效存在差异,同样是80mg的最大剂量,这些药物降低ldl胆固醇的范围为大约30%-55%(illingworth 2000,med.clin.north am.[北美临床医学]84:23)。当添加到辛伐他汀疗法时,依折麦布预期可将ldl胆固醇进一步降低,幅度高达约25%(cannon等人2015,n.engl.j.med.[新英格兰医学杂志]372:2387)。他汀类药物疗法加上抗pcsk9抗体预期可将ldl胆固醇降低约60%(sabatine等人2017,n.engl.j.med.[新英格兰医学杂志]376:1713;schwartz等人2018,n.engl.j.med.[新英格兰医学杂志]379:2097)。因此,特定患者(群)无响应的定义取决于药物的类型和剂量、以及伴随用药(如果有的话),可由负责治疗的医师等本领域技术人员基于客观的指南和可公开获得的文献资料来确定。
[0021]
因此,根据本发明的人类患者可以是接受根据本发明用于治疗的多肽二聚体之前,接受过他汀类药物、依折麦布和/或pcsk9抑制剂的患者。优选地,人类患者对他汀类药物、依折麦布和/或pcsk9抑制剂治疗无响应是,例如,该治疗采用目前的指南中相应药物的推荐剂量、和/或用相应药物进行治疗来研究ldl胆固醇水平变化的临床试验结果,而该人类患者血液ldl胆固醇水平和/或血浆ldl胆固醇水平和/或血清ldl胆固醇水平的降低没有达到按照当前的指南使用相应药物的推荐剂量时预期达到的程度,和/或没有达到用相应药物进行治疗来研究ldl胆固醇水平变化的临床试验结果所预期达到的程度。
[0022]
如本文所使用,“不耐受”是指部分或完全不耐受药物,需要减少剂量或中止治疗。同一类别不同药物的副作用可以不同。例如,他汀类药物最常见的副作用包括肌肉疼痛、压痛或无力(他汀类药物相关的肌肉症状);头痛;头晕;肠胃问题;疲劳/乏力;睡眠问题;瘙痒;肝酶水平升高;或血小板计数低。依折麦布也观察到类似的副作用。针对pcsk9的抗体(依伏库单抗)的疗法在治疗期间频繁观察到的副作用有流感样症状、呕吐、上呼吸道感染、背部和关节疼痛。上述药物中几种药物的组合还可能导致多种副作用的组合、患者的耐受性和依从性不足,使得ascvd的最大耐受治疗欠佳。
[0023]
根据本发明的奥兰吉西普在给药后显示出主要是抗炎方面的不同作用机制,并且在副作用方面非常有利,这一点很有优势,尤其是考虑到奥兰吉西普对示例中展示的很高危ascvd的治疗作用令人惊讶地强。
[0024]
待用gp130-fc融合肽(例如奥兰吉西普)治疗的ascvd患者可患有例如以下病症:ldl胆固醇驱动的ascvd、甘油三酸酯驱动的ascvd、脂蛋白a驱动的ascvd、慢性炎症性疾病驱动的ascvd、炎症性ascvd、家族性高胆固醇血症、慢性肾脏病、糖尿病、血压高于180/110mm hg、或人类免疫缺陷病毒感染。
[0025]
示例
[0026]
实例1:奥兰吉西普给药以治疗确诊很高危ascvd的人类患者
[0027]
作为包含两个gp130-fc融合肽的多肽二聚体的代表,奥兰吉西普(600mg静脉注射[i.v.],每2周一次,分别持续6周和10周)被给药至两名很高危ascvd患者(虽然接受了最佳治疗)。奥兰吉西普给药后,发现这些患者的imt、斑块尺寸和动脉壁炎症减少到出人意料的水平。
[0028]
给药:
[0029]
将奥兰吉西普(由丹麦哥本哈根的辉凌制药有限公司(ferring pharmaceuticals a/s)生产)以1小时内600mg i.v.的临床试验剂量每2周一次给药至患者1和患者2,患者1给药6周(总共4次输注),患者2给药10周(总共6次输注)。奥兰吉西普的半衰期是4.7天。监测患者的输注反应3小时(前2次输注)或1小时(后续输注)。
[0030]
患者的研究前评价和表型:
[0031]
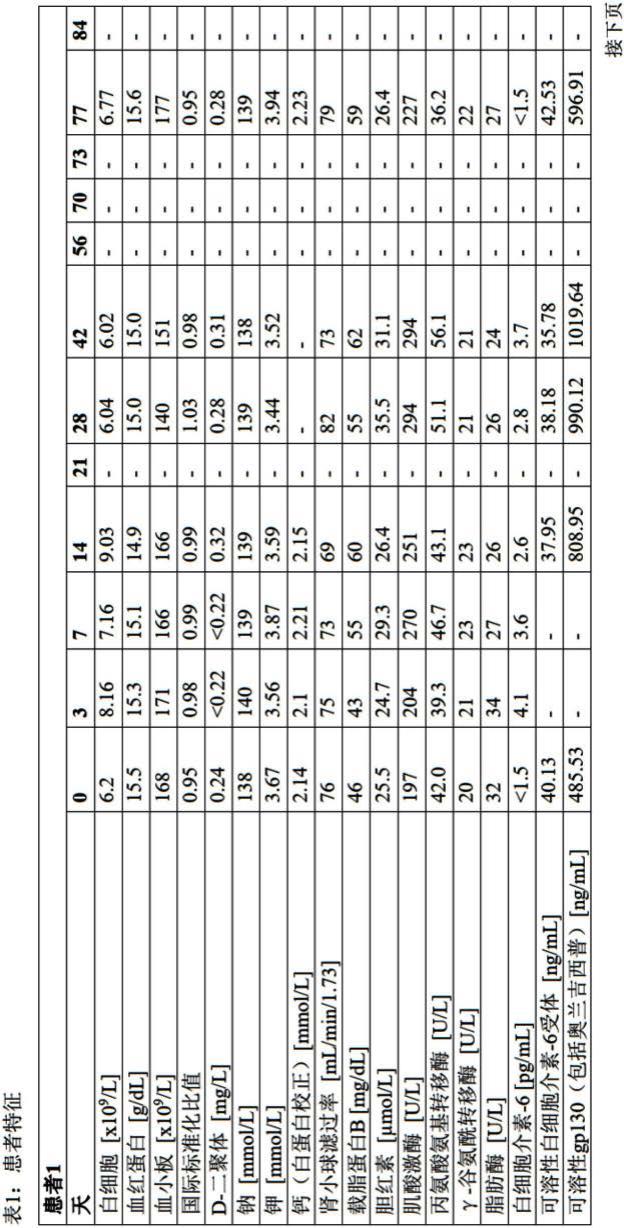
患者特征在表1中详细给出。患者1是42岁的高加索男性(体重指数[bmi]:37kg/m2,血压:140/95mmhg),患有很高危ascvd(抗核抗体[ana]和抗中性粒细胞胞浆抗体[anca]阴性)。该患者有中风复发史,正接受由以下药物组成的最大限度的医学治疗:依伏库单抗、阿托伐他汀、阿司匹林、美托洛尔、氨氯地平、氢氯噻嗪、多沙唑嗪和维生素d。患者2是64岁的高加索女性(bmi:37kg/m2,血压:135/90mmhg),同样患有很高危ascvd(ana/anca阴性)。该患者有冠状动脉疾病史,曾接受过右颈动脉内膜切除术。该患者的治疗药物由以下药物组成:依伏库单抗、阿司匹林、美托洛尔、氨氯地平、氢氯噻嗪、坎地沙坦、泮托拉唑和维生素d。虽然接受了最大限度耐受的治疗,但是两名患者出现与ascvd晚期有关的未来血管事件的风险都很高。
[0032]
动脉粥样硬化成像:
[0033]
为临床评估和非侵入性成像,使用超声和
18
氟脱氧葡萄糖正电子发射断层扫描/计算机断层扫描(
18
fdg pet/ct)。对于患者1,ascvd的筛查包括对颈动脉和腹主动脉进行超声检查。两侧颈动脉均使用7.5mhz频率探头扫描,该探头在靠近颈动脉分叉处使用b模式、在该分叉内使用脉冲多普勒模式、在颈内动脉和外颈动脉内使用彩色模式。动脉壁imt的评估在距离颈总动脉球1cm处无斑块的部位进行。腹主动脉用5mhz的频率扫描,以检测动脉粥样硬化斑块。超声测量的imt可以预测心血管结局(polak等人2011,n.engl.j.med.[新英格兰医学杂志]365:213)。对于患者2,炎症性ascvd的筛查由
18
fdg pet/ct检查完成。
18
fdg pet/ct在非侵入性地可视化、量化和表征动脉粥样硬化炎症方面显示出巨大潜力,成为抗动脉粥样硬化新治疗手段的临床测试的合适替代终点(tarkin等人2014,nat.rev.cardiol.[自然评论心脏病学]11:443)。目标背景比(tbr)按照此前van wijk等人2014,j.am.coll.cardiol.[美国心脏病学会杂志]64:1418的描述计算。
[0034]
安全性和代谢参数:
[0035]
两名ascvd患者在每2周一次600mg奥兰吉西普给药的6周(患者1)和10周(患者2)期间,是安全的。治疗期间或治疗后,未在临床和实验室观察到任何副作用(表1)。sil-6r的水平保持不变,血清il-6的浓度轻微上升,反映出奥兰吉西普对il-6/sil-6r复合物具有额外的sgp130缓冲能力(表1)。奥兰吉西普给药不改变患者1的正常高敏c反应蛋白(hscrp)血清水平;但是奥兰吉西普在患者2输注后3天暂时性地使升高的hscrp水平降低64-70%,在输注后7天,使该水平降低50%(表2)。如选择性抑制il-6跨信号转导所预期,血清总胆固醇、高密度脂蛋白(hdl)胆固醇、ldl胆固醇、甘油三酸酯和脂蛋白(a)[(lp(a)]的水平在奥
兰吉西普治疗时未显示出任何明显的倾向或改变(表2)。这与使用抗il-6或抗il-6r观察到的常见合成代谢性副作用(血清甘油三酸酯和胆固醇水平以及体重增加)形成对比,抗il-6或抗il-6r不仅抑制经典信号转导、还抑制跨信号转导(garbers等人2018,nat.rev.drug discov.[自然评论药物发现]17:395)。
[0036]
奥兰吉西普治疗功效:
[0037]
患者1有ldl胆固醇驱动的动脉粥样硬化和lp(a)驱动的动脉粥样硬化(表2),其颈动脉imt轻微升高、并且腹主动脉内检测到动脉粥样硬化斑块(图1)。每2周一次输注奥兰吉西普,输注4次后,右侧颈动脉的imt从0.93mm降至0.86mm、左侧颈动脉的imt从0.98mm降至0.89mm(3个月相对于基线)(图1a、b)。另外,腹主动脉内的动脉粥样硬化斑块在奥兰吉西普治疗下完全消退(图1c、d)。
[0038]
患者2存在ldl胆固醇驱动的动脉粥样硬化、lp(a)驱动的动脉粥样硬化和hscrp驱动的动脉粥样硬化。因此,对比了奥兰吉西普给药(每2周一次输注,输注6次,表2)前后颈动脉内动脉壁炎症的
18
fdg pet/ct图像。斑块巨噬细胞密度已证明与pet测量的
18
fdg摄取相关(tarkin等人2014,nat.rev.cardiol.[自然评论心脏病学]11:443),所得信号表示为平均目标背景比和最大目标背景比(tbr
平均
和tbr
最大
)。
18
fdg pet/ct在基线时检测到的动脉壁炎症在输注6次奥兰吉西普的3个月后大大减少(图2)。
[0039]
综上,在已建立的ascvd中,对il-6跨信号转导的特异性治疗抑制减轻了两名很高危ascvd人类患者的动脉粥样硬化负担并降低了局部炎症活动,幅度出人意料地大,虽然进行了最大限度的医学治疗。
[0040]
患者1没有显示出crp血清水平升高。但是,抗细胞因子治疗(奥兰吉西普)令人惊讶地减少了imt和动脉粥样硬化斑块负担。因此,crp水平升高虽然表明炎症活动,但是筛选使用奥兰吉西普来治疗ascvd的患者时,可能没有必要作为生物标记。
[0041]
作为跨信号转导抑制剂,奥兰吉西普的特异性和功效突出表现在,脂质(尤其是lp(a))水平不发生改变(表2)。由于奥兰吉西普不直接抑制急性期蛋白(如crp)的诱导(hoge等人2013,j.immunol.[免疫学杂志]190:703),因此,对于患者2的hscrp下降,目前的理解是,这种下降是动脉粥样硬化病变的疾病活动减少的反映。
附图说明
[0042]
图1:il-6跨信号转导的抑制减少内中膜厚度和终末期动脉粥样硬化的动脉粥样硬化斑块尺寸。该图显示了基线时和开始奥兰吉西普治疗后12周(600mg i.v.每2周一次,输注4次;表1),患者1超声评估的代表性图像;(a)治疗前的imt:右侧颈动脉0.93mm、左侧颈动脉0.98mm(未显示);(b)治疗后的imt:右侧颈动脉0.86mm、左侧颈动脉0.89mm(未显示);(c)治疗前的腹主动脉,显示有动脉粥样硬化斑块;(d)奥兰吉西普治疗消退动脉粥样硬化斑块后的腹主动脉同一位置。
[0043]
图2:il-6跨信号转导的抑制减少动脉壁炎症和终末期动脉粥样硬化的动脉粥样硬化斑块的巨噬细胞浸润。该图显示了(a)基线时、(b)开始奥兰吉西普治疗后11周(600mg i.v.每2周一次,输注6次;表1)时,患者2颈动脉内的动脉壁炎症。在代表性轴向计算机断层扫描(ct)、
18
氟脱氧葡萄糖正电子发射断层扫描(
18
fdg pet)和融合图像(
18
fdg pet/ct)中,目标区域以粗体圆圈(动脉)和细圆圈(静脉)突出显示。平均目标背景比和最大目标背景比
(tbr
平均
和tbr
最大
)在下面列出。
[0044]
[0045]
[0046]
[0047][0048]
[0049]
[0050]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1