具有集成热声温度测量的热消融系统的制作方法
具有集成热声温度测量的热消融系统
1.领域
2.本技术涉及热消融系统中的温度测量。特别地,本技术公开了用于实时组织温度测量的热声系统和方法。
3.背景
4.肿瘤切除仍然是许多原发性和转移性病变的“金标准”。然而,由于存在不可切除的疾病、患者合并症或患者对麻醉的敏感性,大多数患者是不适合手术的(surgical candidate)。微波(mw)消融是可替代的治疗方法,其在世界范围内越来越受欢迎,因为它已经被证明为各种组织恶性肿瘤提供受控的组织破坏。消融技术可以包括但不限于射频(rf)或高强度聚焦超声波或激光。mw消融结合了成本效益、优越的消融区域控制、简化的后勤(simplified logistics)、更短时间内的更大加热以及显著降低对“热沉(heat-sink)”效应的敏感性。为了本公开的目的,“热沉”效应是(例如由血液流动引起的)身体内能量的不期望的热传递。这些优点与以降低的成本提高安全性和效果的全球趋势相一致。在mw消融中,介电损耗将靶病变加热至细胞毒性水平(》60℃),并且经由温度依赖性凝固性坏死而发生细胞死亡。由于最佳分布的目标温度与改善的结果高度相关,所以精确的加热控制和监测是极其重要的。
5.mw消融系统使用介电迟滞(dielectric hysteresis)将靶组织加热到细胞毒性水平(至少60℃),并经由凝固性坏死有效地导致组织死亡。精确的温度控制对于确保治疗效果是极其重要的。不充分的加热使组织容易发生肿瘤复发,而过度消融可能导致对邻近正常组织或非靶器官的附带损伤。
6.以前用于监测组织温度的方法包括侵入性方法和非侵入性方法。侵入性方法造成出血和感染风险。非侵入性策略已经利用了由于感知深度、温度敏感性、时间分辨率或高昂成本的限制而被证明是次优的成像。
7.准确的温度监测和实时剂量调节对于改善消融是重要的。因此,对于可以确保有效消融治疗同时限制健康组织损伤程度的系统和方法的需求仍然没有得到满足。
8.概述
9.在一个实施例中,用于组织的热消融和所述组织的温度监测的系统包括:插入设备,该插入设备被配置为插入所述组织中;射频源,该射频源被配置为经由插入设备将消融射频能量传输到所述组织中,以在所述组织内生成热量;脉冲发生器,该脉冲发生器被配置为对射频源加以脉冲,以经由插入设备以预定脉冲速率提供非消融射频脉冲,并在所述组织中生成热声信号,其中消融射频能量和非消融射频脉冲从插入设备的尖端同时发射;超声波换能器,该超声波换能器被配置为接收热声信号;以及处理器,该处理器被配置为利用热声信号来计算所述组织的温度,其中处理器利用独立于消融能量的热声信号部分,并且其中处理器还被配置为确定插入设备在组织内距表面的深度,并将所计算的温度与所确定的深度相关联。
10.在单独的实施例中,插入设备是针形热消融工具。
11.在单独的实施例中,射频源具有在10mhz和100ghz之间的频率。
12.在单独的实施例中,脉冲发生器具有在0.1纳秒和10微秒之间的脉冲持续时间。
13.在单独的实施例中,处理器还被配置为(例如当在所述组织内检测到蒸汽时)启动警报。
14.在单独的实施例中,处理器还被配置为基于所计算的所述组织的温度来控制射频源。
15.在单独的实施例中,处理器还被配置为当所计算的所述组织的温度大于预定义阈值时,将射频源控制到off操作状态。
16.在单独的实施例中,处理器还被配置为将温度传输到显示器。
17.在单独的实施例中,处理器还被配置为接收与组织相关联的b模式超声波图像,并将所计算的所述组织的温度叠加到b模式超声波图像上。
18.提供本概述仅仅是为了介绍某些概念,而不是为了标识所要求保护的主题的关键或极其重要的特征。
19.附图简述
20.现在将参照附图更全面地描述实施例,其中:
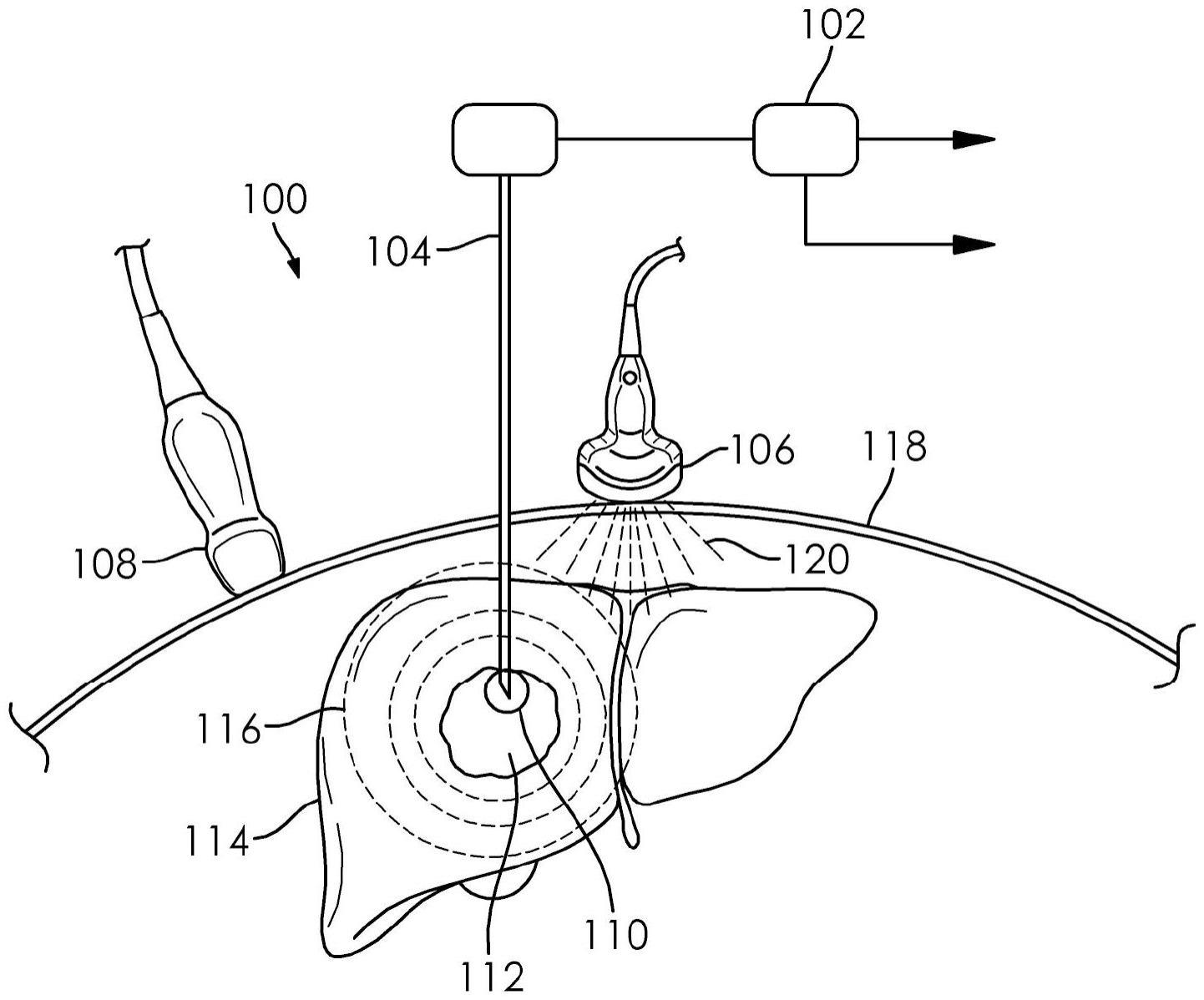
21.图1a示意性地示出了在执行超声波测量时具有集成热声温度测量的热消融系统的实施例。
22.图1b示意性地示出了在执行热声测量时具有集成热声温度测量的热消融系统的实施例。
23.图2示出了示例性热声换能器。
24.图3示出了示例性氮化镓放大器。
25.图4a将热声信号数据显示为2d重建信号。
26.图4b示出了随时间变化的信号增加的示例性2d重建图以及通过加热区域中心的相对信号增加轮廓(profile)。
27.图5示出了在离体肝组织的两探针微波消融期间的示例性红外热成像图像叠加。
28.图6示出了根据实施例的用于组织的热消融和所述组织的温度监测的方法。
具体实施方式
29.当结合附图阅读时,将更好地理解前述概述以及以下对某些示例的详细描述。如本文所使用,以单数引入且前面有单词“一(a)”或“一个(an)”的元件或特征应被理解为不一定排除元件或特征的复数。此外,对“一个示例(one example)”或“一个实施例(one embodiment)”的引用不旨在被解释为排除也结合所述元件或特征的附加示例或实施例的存在。此外,除非明确地相反说明,否则“包括(comprising)”或“具有(having)”或“包含(including)”具有特定特性的元件或特征或多个元件或特征的示例或实施例可包括不具有该特性的附加元件或特征。同样,应理解,术语“包括(comprises)”、“具有(has)”、“包含(includes)”意味着“包括但不限于”,并且术语“包括(comprising)”、“具有(having)”和“包含(including)”具有等同的含义。
30.如本文所使用,术语“和/或”可包括一个或更多个相关联的列出的元件或特征的任何和所有组合。本文中描述为“示例性”的任何实施例不一定被解释为比其他实施例或设计优选或更有利,而是旨在意味着用作示例、实例或说明。
assessments)没有用。
40.多重磁共振(mr)测温方法已经证明了具有高空间分辨率和高温度敏感性的三维体积。然而,这些优点伴随着高昂的成本、复杂的后勤、有限的可用性、不足的时间分辨率周期和运动伪影敏感性。
41.相比之下,将基于电磁波的技术的高对比度和特异性与基于声波的感测方式的高分辨率和深度穿透相结合。如本公开中所讨论的,使用同一导管来加热和生成热声脉冲,实时热剂量测定可以被添加到商业mw消融和us系统中,从而以较低的成本显著提高癌症消融治疗的质量。
42.的各种实施例包括:使用mw消融天线来降低成本和最大化热声热感测;利用消融针来传送足以诱导热声信号的治疗性组织加热微波能量和非治疗性更高功率脉冲的微波能量两者;紧凑的超高效mw源的新颖设计,其最大化便携性,同时降低尺寸和成本;和/或固态技术允许从壁式插座的能量(wall outlet energy)到rf脉冲的》80%的转换,从而消除了对大型风扇和专用插座的需求。在各种实施例中,新颖的特征使得能够容易且有成本效益地与mw消融系统集成。热声系统的实施例可以在现有的us和mw消融系统上实施,从而最小化后勤和成本,同时增加无与伦比的热监测能力。实施例可以包括用于有成本效益的便携式实时深层热成像器的空间和时间分辨率。例如,系统的实施例可以提供的温度、时间和空间分辨率为每5s在5cm的深度处《1℃。
43.因此,所提出的高度创新的系统有潜力显著提高微波消融程序的质量,为了癌症患者的利益而降低风险或复发以及降低总治疗成本。
44.在各种实施例中,同时成像和mw消融混合系统将基于氮化镓(gan)高效技术等的2.45ghz脉冲放大器模块与基于先前批准用于脂肪肝成像的系统的改进的热声成像器相结合。
45.电磁-声学技术(例如)将基于电磁波的技术的高对比度和特异性与基于声波的感测方式的高分辨率和深度穿透相结合。已经开发的电磁-声学技术包括光诱导光声学和微波,以及射频诱导热声学(ta)。在这些技术中的每一种技术中,生物组织被电磁场加热,并且局部温度升高导致组织的瞬时热弹性膨胀,从而导致超声(ultrasonic)(或超声(ultrasound))波的发射。图像对比度主要由组织电磁特性决定。然而,ta信号幅度和组织温度之间存在已建立的线性关系。通过检查消融程序期间接收的信号幅度的变化,可以以高时间分辨率和高温度敏感性监测组织温度分布。
46.本公开讨论了一种新颖的热声图像引导消融(tiga)系统100,如图1a和图1b所示。在该实施例中,tiga系统100包括功率组合器102、消融针104和热声换能器108。图1a和图1b示出了示例性消融区域110、局灶性病变112、肝脏114、热声信号116、皮肤118、超声波换能器106和超声波信号120。处理器用于处理热声数据,并且未被示出。
47.在一个实施例中,在热消融之前,超声波换能器106用于将超声波信号120发送到感兴趣的区域(例如肝脏114和位于肝脏内的所有要素)。超声波信号被反射以产生超声波换能器106接收的可测量超声波信号(未示出)。超声波系统解释来自超声波换能器106的超声波信号,以生成感兴趣的区域中的所有要素(例如肝脏114、局灶性病变112、消融区域110和消融针104)的位置数据。位置数据可以用于适当地定位热声换能器108以进行热声测量。
48.在一个实施例中,首先完成超声波测量。接下来,热声换能器108替代超声波换能器106在皮肤118上的位置。最后,如下所述完成热声测量。
49.tiga系统100利用消融针104来传送足以诱导热声信号116的治疗性组织加热微波能量和非治疗性更高功率脉冲的微波能量两者。可以使用热声换能器108(作为系统的一部分)在皮肤118处检测这些声波,以生成治疗区域的准确温度图。在各种实施例中,tiga系统100将提供对消融程序的有成本效益的、实时的热监测,其可与传统超声波互操作。tiga系统100可以利用系统:传感器、信号处理和高速数字采集电子技术。
50.热声信号可以通过tiga系统经由杆部分(shaft section)、尖端部分或其组合在消融针104处被诱导。tiga生成的脉冲可以在肝脏114、局灶性病变112和消融区域110以及身体内的其他区域处诱导热声信号。如授予cho等人的美国专利10631734b1中所讨论的,热声信号还可以从感兴趣的区域内两个对象之间的边界发出。在本情况下,边界可以包括但不限于局灶性病变112和消融区域110之间的边界或肝脏114和局灶性病变112之间的边界。美国专利10631734b1通过引用以其整体并入本文。
51.在单独的实施例中,可以用一个不同插入设备或多个不同插入设备替代消融针104。不同插入设备的示例包括但不限于在针尖处或针尖附近具有一个或更多个突起的针形设备,以及被配置为同时操作的两个或更多个插入设备。图5示出了作为示例的在离体肝组织的两探针微波消融期间的红外热成像图像叠加。
52.对于肝脏、肾脏、骨骼、甲状腺和肺部的许多局灶性病变(特别是在患有不可手术疾病、患者合并症或手术成本问题的情况下),图像引导热消融是一种公认的治疗选择。特别值得关注的是具有侵袭性肿瘤类型的患者,无论治疗策略如何,其经历很高的肿瘤复发发生率。由于残余器官功能的限制或与重复器官切除术相关联的技术难题,在根治性切除不再是一种选择后,热消融可以成为复发癌症患者的关键治疗选择。在决定经皮肿瘤治疗的消融策略时,有许多因素起作用(包括操作者经验、可用性和肿瘤特征(组织类型、大小和位置))。普遍公认的是,消融治疗的局部疗效与靶肿瘤大小直接相关,其中mw消融表示出令人满意的局部肿瘤控制和88%-97%的完全消融率,其中许多肿瘤类型的肿瘤大小《5cm,并且肺部肿瘤的肿瘤大小《3cm。精确的温度控制对于有效的消融治疗是极其重要的,因为加热不足容易复发,并有可能通过诱导血管流量改变和保护性热休克反应来增加热阻。相比之下,不受控制的热传导可能导致并发症(例如对邻近正常组织或非靶器官的附带损伤)。为了确保消融治疗的安全应用,具有高空间分辨率(~1mm)和高温度敏感性(2℃或更高)的实时温度监测是优选的。测温方法对热治疗的应用为准确的温度监测和实时剂量调节提供了可能。
53.以前通过非侵入性成像监测组织温度的方法已经证明了在感知深度、温度敏感性、时间分辨率或高昂的成本方面的局限性。尽管mr测温不太理想,但它是目前临床的金标准。已经开发了具有mr兼容部件的商业可用的mw消融系统,以使得能够使用mri作为经皮消融程序的引导方式。mr引导的潜在用途目前限于一些专门从事mr引导介入治疗的中心,并且专业设备需求、高运营成本和长程序持续时间的结合将继续限制mr引导消融介入治疗的广泛使用。为了执行这样的程序,需要mr兼容的微波天线以及电磁屏蔽的非铁磁性微波发生器或具有补偿能量应用的延长电缆,以使微波发生器能够定位于mr扫描仪室之外。目前,超声波(us)由于其广泛的可用性、成本效益和易用性,仍然是消融针放置的首选方式
(modality of choice)。因此,测温技术应表现出与传统us系统的兼容性,用于护理点临床实施。
54.热声成像已经被证明以高敏感性、深度穿透和以实时能力非侵入性地有效测量组织温度。感测准确度估计约为0.15℃,其中时间分辨率短至2s。利用由超声波线性阵列提供的空间分辨率,热绘图(thermal mapping)不仅提供关于热高度的反馈,而且提供关于热剂量分布的空间信息。tiga系统100可以通过在消融治疗期间检测组织中诱导的热声响应来允许热轮廓分析(thermal profiling)。当生物组织被电磁场(如微波)加热时,局部温度升高,导致热弹性膨胀和松弛,并产生声压波。这些热声波可以被皮肤表面处的热声换能器检测到。随着组织温度的升高,热声信号幅度线性增加,因此,基于热声成像的技术可以用作消融治疗的有效监测工具。
55.为了产生能够进行mw消融加热和mw诱导热声成像两者的混合系统,需要集成多个子系统。tiga系统需要微波放大子系统,该子系统能够为消融程序提供连续功率,并为热声成像的感应提供超短脉冲功率。在传统的mw消融中,针形mw天线连接到连续波(cw)mw放大器,该mw放大器通常具有100w-200w的峰值功率。此外,需要脉冲放大器来进行tiga热轮廓分析,其中峰值功率为2kw,持续时间非常短(脉动)。可以使用紧凑的2.45ghz高效放大模块,该模块能够在0.1%占空比获得2kw峰值脉冲功率,以用于热声成像。可以测试用于mw消融的所有连接器,以确保tiga系统的峰值功率可以被容忍。一旦确认了峰值功率兼容性,tiga系统100脉冲mw放大器信号就可以与治疗mw放大器组合,以将治疗性mw功率和成像脉冲mw功率两者传送到针导管。
56.在具有多个消融设备的潜在实施例中,功率可以被同时利用或多路复用。
57.在一个实施例中,将开发波形合成器来驱动具有脉冲设计的氮化镓(gan)放大器,该脉冲设计针对2.45ghz mw传输和利用1.3mhz声传感器阵列的热声成像进行了优化。在一个实施例中,为了最佳地匹配声传感器阵列的要求,波形将具有300纳秒(nsec)的脉冲持续时间和35纳秒的上升时间。tiga系统的声感测部分可以由32单元的传感器阵列组成,该传感器阵列能够对8cm x 8cm的视场进行成像。对于护理点使用,成像系统必须具有足够的敏感性以检测组织或组织等效模体(tissue equivalent phantoms)中2℃的温度变化。
58.如图2所示,系统100可以包括在1.3mhz中心频率和》75%带宽操作的高敏感性32单元的只接收换能器阵列50。传感器可以在修改的外壳中实施,这将使传感器模块与消融针可互操作。两个16通道das模块可以用于从32通道tiga传感器阵列50采集数据。在一个实施例中,das可以以5m次采样/秒的速度采集热声信号,并使用以太网通信将数字化通道数据传输到采集计算机。电缆和外壳设计可以容纳远离tiga传感器阵列的das,以使来自热量管理系统的噪声最小化。
59.在一个实施例中,如图3所示,脉冲源是低成本、紧凑、高效率的氮化镓(gan)脉冲放大器70。在一个实施例中,脉冲放大器提供在2.35ghz和2.55ghz之间的脉冲源。放大器70可以使用碳化硅上氮化镓(sic上gan)技术,该技术允许以最小的热损失有效地放大微波信号。生成的热量可以经由热管(heatpipe)技术快速消散。广泛用于计算机冷却的热管是填充有少量超低压水的金属管。水在蒸发/膨胀/冷凝/毛细运动之间循环,产生比固体金属高数百倍的有效热导率。从热gan芯片(chip)到环境的快速热传递(经由标准风扇)使放大器保持紧凑和最佳冷却。
60.在一个实施例中,单级功率放大器可以被设计成实现20db的标称小信号增益,其中输出功率为2kw瓦,并且功率附加效率为70%。高效率源将提供2.45ghz消融,同时保持低成本和轻量化特征。
61.图4a和图4b示出了在离体组织中随着微波消融加热的热声信号的相对变化。热声信号数据可以在图4a中显示为2d重建信号。图4b示出了对应于热声信号强度的3d热图。这些温度变化还可以叠加在传统的b模式超声波图像上,以引导介入组织消融程序的针放置。
62.如果消融加热实现得太快,则产生潜在的意外结果,从而导致蒸汽泡。》100℃的快速加热可能诱导蒸汽泡,这将阻止热声波的传输,并在临床环境中将被视为安全风险。在不太可能遇到这种问题的情况下,只有在消融期间膨胀的热轮廓的前缘才能进入。如果发生这种情况,那么消融研究将不得不在低功率下进行。因此,本公开中讨论的热消融的原位(患者体内)热声感测使得能够检测警报状态(蒸汽泡),这进一步使得能够进行温度控制以消除警报状态。
63.图5示出了在离体肝组织的两探针微波消融期间的红外热成像图像叠加。
64.图6示出了使用示例性tiga系统100对组织进行热消融和对所述组织进行温度监测的示例性过程600。如图6所示,过程600可以根据其他执行过程手动或自动初始化。在一个实施例中,通过简单地将系统100转到on操作状态来初始化过程600。在一个实施例中,通过从计算机程序或操作者接收指令来初始化过程600以开始602。
65.在步骤604,成像系统100可以从超声波成像系统获得边界信息。超声波成像系统经由超声波换能器阵列将声波发射到组织中。来自声波的回波由一个或更多个超声波换能器阵列接收,并由超声波成像系统处理以确定感兴趣的区域或边界。感兴趣的区域和/或边界可以由系统100使用来关联来自热声成像系统的数据。
66.在步骤606,可以停用超声波成像系统以消除对系统100的潜在干扰。
67.在一些实施例中,系统100可以在没有边界信息的情况下工作。
68.在步骤608,系统100然后启动射频(rf)源以将rf能量脉冲发送到组织中。如上所述,rf能量脉冲在组织中被吸收。
69.在步骤610,系统100对射频源加以脉冲,以在组织中生成热声信号。
70.在步骤612,系统100经由热声换能器阵列接收热声信号。
71.在步骤614,系统100计算组织的温度。
72.在步骤616,系统100基于所计算的组织的温度来控制rf源。在一个实施例中,如果温度超过预定阈值,则rf源转换到off操作状态。在一个实施例中,预定阈值是100摄氏度。在一个实施例中,预定阈值是99摄氏度。
73.系统100还可以被配置为显示关于接收到的信息的所计算的温度(例如与组织相关联的b模式超声波图像和/或插入设备与组织距表面的深度)。
74.在本文包括示意性流程图,以总体上阐述为逻辑流程图。因此,所描绘的顺序和标记的步骤指示了所呈现的过程的一个实施例。可以设想在功能、逻辑或效果上等同于所示方法的一个或更多个步骤或其部分的其他步骤和方法。此外,所采用的格式和符号被提供来解释该方法的逻辑步骤,并且被理解为不限制该方法的范围。尽管在流程图中可以采用各种箭头类型和线条类型,但是它们被理解为不限制相应方法的范围。实际上,一些箭头或其他连接符可以用于仅指示过程的逻辑流。例如,箭头可以指示所描绘的过程的枚举步骤
之间的未指定持续时间的等待或监测时段。还应当注意的是,在框图和/或流程图中的每个块及框图和/或流程图图示中块的组合,可以由执行指定功能或动作的专用的基于硬件的系统或专用硬件和程序代码的组合来实现。
75.附加地,特定方法发生的顺序可以严格遵守或可以不严格遵守所示的相应步骤的顺序。例如,连续地示出的两个块事实上可以基本上同时执行,或者块有时可以以相反的顺序执行,这取决于所涉及的功能。可以设想在功能、逻辑或效果上等同于图示的一个或更多个块或其部分的其他步骤和方法。例如,在一些实施例中,步骤608和612可以同时执行。
76.如本领域技术人员所理解的,本发明的各方面可以体现为系统、方法和/或计算机程序产品。因此,本发明的各方面可以采取以下形式:完全硬件实施例、完全软件实施例(包括固件、常驻软件,微代码等)或对在本文通常所有可以被称为“电路”、“模块”或“系统”的软件和硬件方面进行结合的实施例。此外,本发明的各方面可以采取在一个或更多个计算机可读介质中实施的计算机程序产品的形式,在该一个或更多个计算机可读介质上实施有程序代码。
77.许多在本说明书中描述的功能单元已被标记为模块,以便更具体地强调它们的实现独立性。例如,模块可以作为包括定制vlsi电路或门阵列、诸如逻辑芯片等现货供应的半导体、晶体管,或其他分立元件的硬件电路来实现。模块也可以在诸如现场可编程门阵列,可编程阵列逻辑,可编程逻辑器件等可编程硬件设备中实现。
78.模块也可以在软件中来实现,以用于通过各种类型的处理器来执行。例如,计算机可读程序代码的识别模块可以包括一个或更多个物理或逻辑的计算机指令块,例如,其可以被组织为对象、过程或函数。然而,识别模块的可执行代码不一定在物理上位于一起,而是可以包括存储在不同位置的完全不同的指令,当在逻辑上接合在一起时,其包括该模块以及实现该模块的所述目的。
79.事实上,计算机可读程序代码的模块可以是单个指令或许多指令,并且甚至可以分布若干不同的代码段上,分布在不同的程序中,以及分布在若干存储器设备上。类似地,操作数据可被识别并在本文中在模块内说明,并且可以以任何合适的形式进行实施以及在任何适当类型的数据结构内进行组织。操作数据可被收集为单个数据集合,或可以分布在不同的位置,包括在不同的存储设备上,并可以至少部分地,仅作为系统或网络上的电子信号而存在。在以软件实施模块或模块的一部分的情况下,计算机可读程序代码可以存储在一个或更多个计算机可读介质中和/或在一个或更多个计算机可读介质上传播。在本文档的上下文中,计算机可读存储介质可以是任何有形介质,其可以包含和/或存储计算机可读程序代码以供指令执行系统、装置或设备使用和/或与该指令执行系统、装置或设备结合使用。
80.用于执行本发明各方面的操作的计算机可读程序代码可以用一种或更多种编程语言的任意组合来编写。计算机可读程序代码可以完全在用户的计算机上执行、部分在用户的计算机上执行作为独立的软件包、部分在用户的计算机上执行且部分在远程计算机上执行或完全在远程计算机或服务器上执行。在后者的场景中,远程计算机可通过任何类型的网络连接到用户的计算机,包括局域网(lan)或广域网(wan),或者可连接到外部计算机(例如,通过使用互联网服务提供商的互联网)。
81.尽管前述公开讨论了说明性实施例,但应当注意,在不脱离如由所附权利要求限
定的所述实施例的范围的情况下,可以在本文进行各种改变和修改。因此,所描述的实施例旨在包含落入所附权利要求范围内的所有这样的改变、修改和变化。此外,尽管所描述的实施例的元件可以用单数来描述或要求保护,但是除非明确说明对单数的限制,否则复数是预期的。附加地,除非另有说明,否则任何实施例的全部或部分可以与任何其他实施例的全部或部分一起使用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1