多层基于胶原蛋白的膜的制作方法
多层基于胶原蛋白的膜
1.胶原蛋白作为一种生物材料广泛应用于外科领域,并且它在组织再生的特定学科中的应用已有很长的历史。例如,美国专利5206028和5837278均描述了用于组织再生的单层胶原蛋白装置。胶原蛋白装置可以由重构的胶原蛋白设计和形成。或者,它们可以是天然来源的,即,从在其自然状态下收获的组织制造,并加工用作生物材料,而组织的物理尺寸没有显著变化。源自天然组织的胶原蛋白装置的一个缺点是最终装置的厚度和总体尺寸由靶组织决定。因此,已经开发了修改厚度和尺寸的策略。参见美国专利5955110和5885619。
2.加固是改变胶原蛋白装置物理机械特性的另一种策略。通过将第二种生物材料与胶原蛋白相结合,可以在保持胶原蛋白的生物学益处的同时修改该装置的强度或操作特性。例如,美国专利申请公开2014/0067058描述了通过堆叠、压缩和干燥对胶原蛋白和第二生物相容性网状物进行分层。
3.在临床组织再生程序中,特别是在颌面部,在愈合阶段宿主组织有大量运动,稳定性对于可预测的愈合是必需的。任何层压装置的分层通常会在伤口内产生死角,这会导致感染和手术失败。分层还会导致增强组件失去稳定性,从而导致可能导致组织穿孔和损坏的依从性问题。因此,层的稳定性和寿命在层压装置中是最重要的。
4.在各种硬组织和软组织再生过程中使用天然来源的胶原蛋白膜具有优势。然而,来源组织的固有局限性,即厚度、处理特性和整体尺寸,可能需要修改才能实现临床使用的理想配置。如果能够将几个胶原蛋白片连接在一起,改变它们的整体厚度,或将它们与片之间的介入组件层压在一起,将是有利的。此外,当用生物流体润湿足够长的时间以获得临床成功时,层的强度应足以承受分层。
5.存在对具有多层的基于胶原蛋白的膜的需求,其不会受到上述缺点的影响。
6.概述
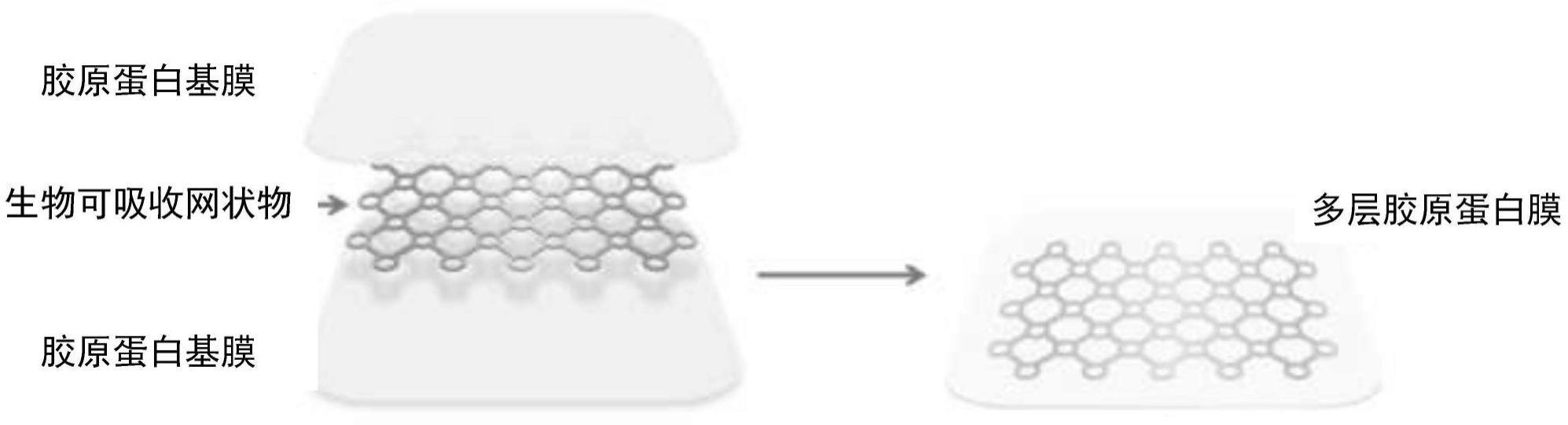
7.为满足这种需要,提供了一种多层基于胶原蛋白的膜,其包括嵌入在第一脱细胞基于天然胶原蛋白的膜和第二脱细胞基于天然胶原蛋白的膜之间的生物可吸收网状物。第一和第二脱细胞基于天然胶原蛋白的膜相互交联,并且多层基于胶原蛋白的膜在90
°
的剥离强度为5-250n/m。
8.还提供了一种多层基于胶原蛋白的膜的制备方法。该方法是通过获得第一和第二脱细胞的含有天然胶原蛋白的膜,将第二脱细胞的含有天然胶原蛋白的膜放置在第一脱细胞的含有天然胶原蛋白的膜之上以形成膜组件,在均匀分布在膜组件上的压重物(wight)下干燥膜组件,所述压重物包括用于允许湿气逸出的开口以及将所述膜组件暴露于交联剂以使得在所述膜组合件的层之间形成交联来进行的。多层基于胶原蛋白的膜的每一层在植入体内后以基本相同的速率被再吸收,并且在该过程中不使用粘合剂。
9.还公开了用于制造多层基于胶原蛋白的膜的第二种方法。该方法包括以下步骤:获得第一和第二干燥的脱细胞的含有天然胶原蛋白的膜,获得生物可吸收合成的聚合物网状物,将生物可吸收合成的聚合物网状物置于第一干燥的脱细胞的含有天然胶原蛋白的膜之上,水化第一干燥的脱细胞的含有天然胶原蛋白的膜以形成第一水合膜,将第二干燥的脱细胞的含有天然胶原蛋白的膜放置在生物可吸收的合成聚合物网状物上面,使得第二干
燥的脱细胞的含有天然胶原蛋白的膜通过从第一水合膜中吸取水分而变得水合,在均匀分布在膜网状物组件上的压重物下干燥膜网状物组件,并将干燥的膜网状物组件暴露于交联剂,使得膜网状物组件的层之间形成交联。第二种方法,与第一种方法一样,形成多层基于胶原蛋白的膜,其中每一层在体内以基本相同的速率被再吸收,生物可吸收合成的聚合物网状物为多层基于胶原蛋白的膜提供形状记忆,并且在该过程中不使用粘合剂。
10.一个或多个实施方案的细节在下面的描述和实施例中阐述。其他特征、目的和优点将从详细描述、附图以及所附权利要求中显而易见。
附图说明
11.下面的描述参考了附图,其中:
12.图1是本发明的多层基于胶原蛋白的膜的示意图;
13.图2为多层基于胶原蛋白的膜的制备工艺的流程图;
14.图3显示了本发明的多层基于胶原蛋白的膜的示例性制备方法和临床应用。1,3=基于胶原蛋白的膜;2=生物可吸收网状物;4=多层胶原蛋白膜组件;5=紫外线交联装置;6=成品多层基于胶原蛋白的膜;7=用于覆盖前臂伤口的成品多层基于胶原蛋白的膜
15.详细说明
16.如上所述,本发明的多层基于胶原蛋白的膜包括嵌入在第一脱细胞基于天然胶原蛋白的膜和第二脱细胞基于天然胶原蛋白的膜之间的生物可吸收网状物。在示例性多层基于胶原蛋白的膜中,生物可吸收网状物不延伸到多层基于胶原蛋白的膜的边缘,在没有生物可吸收网状物的边缘周围留下边界。
17.生物可吸收网状物可由已经脱矿物质的层状骨形成。层状骨可来自哺乳动物,例如人、牛、绵羊、马和猪。脱矿物质的层状骨是例如通过模切或激光切割形成的网状物的形式。
18.在备选的多层基于胶原蛋白的膜中,生物可吸收网状物是一种合成的聚合物网状物,可对多层基于胶原蛋白的膜赋予形状记忆。合成的聚合物网状物可由均聚物形成,包括但不限于聚丙交酯(“pla”)、聚乙交酯(“pga”)、聚己内酯(“pcl”)和三亚甲基碳酸酯(“ptmc”)。或者,合成的聚合物网状物可由包括在上述聚合物中的单体的共聚物形成,例如聚(乳酸-共-乙醇酸)(“plga”)和聚(丙交酯-共-ε-己内酯)(“plcl”)。在某些实施方案中,特定的对映异构体可用于均聚物或共聚物。例如,聚(l-丙交酯)(“plla”)、聚(d-丙交酯)(“pdla”)或聚(dl-丙交酯)(“pdlla”)等聚合物可用于合成的聚合物网状物。
19.合成的聚合物网状物可以通过例如激光切割、模切、压缩成型、3d打印和挤出来制造。
20.示例性的多层基于胶原蛋白的膜具有由plga形成的合成的聚合物网状物,plga具有25:75至75:25的乳酸与乙醇酸单体比例。在特定的多层基于胶原蛋白的膜中,乳酸与乙醇酸单体的比例为50:50。在另一个实施例中,多层基于胶原蛋白的膜具有由plcl以70:30的乳酸单体与己内酯单体比例形成的合成的聚合物网状物。
21.在某些多层基于胶原蛋白的膜中,合成的聚合物网状物还含有钙矿物质。钙矿物质可以是但不限于磷酸钙、β-磷酸三钙、硫酸钙、羟基磷灰石和源自天然骨矿物质的磷灰石钙。钙矿物质可包含添加剂,例如氟(例如,氟磷灰石)和镁。
22.在其他多层基于胶原蛋白的膜中,合成的聚合物网状物含有重组生长因子,例如rhpdgf-bb、rhbmp-2和fgf。可选地或一起地,诸如抗生素和抗炎剂的药物可以包括在合成的聚合物网状物中。
23.如上所述,多层基于胶原蛋白的膜包括第一脱细胞基于天然胶原蛋白的膜和第二脱细胞基于天然胶原蛋白的膜。第一脱细胞的含有天然胶原蛋白的膜、第二脱细胞的含有天然胶原蛋白的膜或两者源自天然心包膜并具有纤维侧和浆膜侧。优选地,脱细胞的含有天然胶原蛋白的膜来源于哺乳动物例如人、牛、绵羊、马和猪的心包壁层。更优选地,脱细胞的含有天然胶原蛋白的膜来源于猪心包壁层。
24.在本发明的多层基于胶原蛋白的膜中,第一脱细胞的含有天然胶原蛋白的膜的纤维侧可与(i)第二脱细胞的含有天然胶原蛋白的膜的纤维侧或(ii)第二脱细胞的含有天然胶原蛋白的膜的浆膜侧接触并交联。
25.在备选的多层基于胶原蛋白的膜中,第一脱细胞的含有天然胶原蛋白的膜的浆膜侧可与(i)第二脱细胞的含有天然胶原蛋白的膜的纤维侧或(ii)第二脱细胞的含有天然胶原蛋白的膜的浆膜侧接触并交联。
26.本发明的多层基于胶原蛋白的膜可具有在90
°
下的5-250n/m,例如5-250、10-250、20-250、30-250、40-250、和50-250n/m的干燥剥离强度。整个多层基于胶原蛋白的膜的剥离强度不均匀。如上所述,在某些实施例中,生物可吸收网状物不延伸至多层基于胶原蛋白的膜的边缘。这些没有生物可吸收网状物的边缘具有最强的干燥剥离强度,即50-250n/m,而包括生物可吸收网状物的多层基于胶原蛋白的膜的区域具有可变的剥离强度,例如,5-250n/m,取决于网状物的几何形状,例如网状物尺寸。
27.上面还总结了两种制备多层基于胶原蛋白的膜的方法。
28.第一种方法通过(i)获得第一和第二脱细胞的含有天然胶原蛋白的膜,(ii)将第二脱细胞的含有天然胶原蛋白的膜放置在第一脱细胞的含有天然胶原蛋白的膜之上以形成膜组件,(iii)在均匀分布在膜组件上的压重物下干燥膜组件,以及(iv)将膜组件暴露于交联剂,使得膜组件的层之间形成交联。
29.第一和第二脱细胞的含有天然胶原蛋白的膜源自天然心包膜并具有纤维侧和浆膜侧。优选地,脱细胞的含有天然胶原蛋白的膜来源于哺乳动物例如人、牛、绵羊、马和猪的心包壁层。更优选地,脱细胞的含有天然胶原蛋白的膜来源于猪心包壁层。
30.在示例性方法中,将第一脱细胞的含有天然胶原蛋白的膜的纤维侧与第二脱细胞的含有天然胶原蛋白的膜的纤维侧接触以形成膜组件。或者,将第一脱细胞的含有天然胶原蛋白的膜的浆膜侧与第二脱细胞的含有天然胶原蛋白的膜的纤维侧接触以形成膜组件。在另一个实施例中,第一脱细胞的含有天然胶原蛋白的膜的浆膜侧与第二脱细胞的含有天然胶原蛋白膜的浆膜侧接触以形成膜组件。
31.在特别的方法中,将胶原蛋白凝胶施加到两个脱细胞的含有天然胶原蛋白的膜中的一个或两个,然后将它们彼此接触。在这种方法中,脱细胞的含有天然胶原蛋白的膜在施用胶原蛋白凝胶之前首先被短暂干燥以去除多余的水分。
32.胶原蛋白凝胶可通过将组织脱细胞,然后将胶原蛋白水解和微粉化,从人、牛、绵羊、马或猪的心包中制备。凝胶中胶原蛋白的浓度可以从2.5mg/ml到10.0mg/ml。优选地,浓度为10mg/ml。
33.不受理论的束缚,据信胶原蛋白凝胶通过增加膜层之间的胶原蛋白表面积接触来帮助脱细胞的含有天然胶原蛋白的膜的组装和层压。
34.膜组件在干燥步骤之后进行暴露步骤,在暴露步骤中膜组件暴露于交联剂,使得膜组件的层之间形成交联。交联剂可以是例如化学交联剂、紫外线(“uv”)辐射、交联酶和塑压。
35.可以使用的化学交联剂包括但不限于戊二醛或戊二醛蒸气、甲醛或甲醛蒸气、还原糖如核糖和葡萄糖、京尼平、碳二亚胺,例如n-(3-二甲基氨基丙基)-n'-乙基碳二亚胺和n-羟基琥珀酰亚胺、二醛淀粉、具有uva辐射的核黄素、亚氨酸酯,例如,辛二亚氨酸二甲酯、己二亚胺酸二甲酯、庚二亚胺酸二甲酯(dimethyl primelimidate)和二硫代双丙亚胺酸二甲酯、酰基叠氮化物和4-臂聚乙二醇琥珀酰亚胺基戊二酸酯。
36.交联也可以酶法进行,例如使用转谷氨酰胺酶或赖氨酰氧化酶。
37.最后,交联可以与塑压结合进行,其中胶原蛋白纤维通过在暴露于交联剂之前在单个方向上对纤维施加物理力来对齐。
38.当紫外线辐射用作交联剂时,暴露步骤是通过用紫外线辐射以1,200至216,000mj/m2的总能级照射干燥膜组件的顶侧和底侧1至210分钟来完成的。在示例性方法中,uv辐射具有12,000至48,000mj/m2的能级并且暴露时间为10至40分钟。
39.在本发明的某些方法中,其中紫外线辐射是交联剂,在暴露步骤中不使用化学交联剂。
40.在具体的实施例中,在暴露步骤之后,包括去除由uv辐射产生的气味化合物的步骤。可去除的气味化合物是脂肪酸、氨基酸和肽的挥发性降解和氧化副产物。这些化合物可以是但不限于2-甲基丁醛、3-甲基丁醛、1-庚烯、1-辛烯、1-壬烯、硫化氢、二氧化硫、巯基甲烷、二甲基硫醚、硫代乙酸甲酯、二甲基二硫醚、和二甲基三硫醚。
41.去除步骤通过用h2o漂洗膜组件和/或在h2o浴中摇动膜组件一次或多次,例如一次、两次、三次和四次来完成。在用h2o冲洗之前,膜组件可以用缓冲液冲洗,例如磷酸盐缓冲盐水(“pbs”)。
42.该方法还可以包括最后的干燥步骤。干燥可以通过风干或真空干燥来完成。干燥可在5℃至45℃下进行,优选在室温下进行60分钟至300分钟。如果在真空下干燥,真空度应为50毫托至500毫托。
43.在某些实施方案中,该方法还包括在将第二脱细胞的含有天然胶原蛋白的膜放置在第一脱细胞的含有天然胶原蛋白的膜之上之前将生物可吸收网状物放置到第一脱细胞的含有天然胶原蛋白的膜上的步骤。
44.上面已经详细描述了生物可吸收网状物。它可以是由例如pla、pga、pcl、ptmc、plla、pdla、pdlla、plga、plcl或具有上述单体比例的这些聚合物的混合物形成的合成的聚合物网状物。
45.将钙矿物质例如磷酸钙、硫酸钙和羟基磷灰石添加到聚合物中的另外的步骤可以是该方法的一部分。可以添加钙矿物质,例如通过将聚合物浸泡在钙矿物质溶液中。
46.或者,生物可吸收网状物可由如上所述的脱矿物质的层状骨形成。
47.上面还总结了用于制备多层基于胶原蛋白的膜的第二种方法。该工艺通过(i)获得第一干燥的脱细胞的含有天然胶原蛋白的膜,(ii)获得生物可吸收合成的聚合物网状
物,(iii)将生物可吸收合成的聚合物网状物置于第一干燥的脱细胞的含有天然胶原蛋白的膜之上,(iv)水化第一干燥的脱细胞的含有天然胶原的膜以形成第一水合膜,(v)获得第二干燥的脱细胞的含有天然胶原蛋白的膜,(vi)将第二干燥的脱细胞的含有天然胶原蛋白的膜放置在生物可吸收的合成的聚合物网状物上面,使得第二干燥的脱细胞的含有天然胶原的膜通过从第一水合膜中吸取水分而变得水合,(vii)在均匀分布膜网状物组件上的压重物下干燥膜网状物组件,和(viii)将干燥的膜网状物组件暴露于交联剂,使得膜网状物组件的层之间形成交联。第二种方法,与第一种方法一样,形成多层基于胶原蛋白的膜,其中每一层在体内以基本相同的速率被再吸收,生物可吸收合成的聚合物网状物为多层基于胶原蛋白的膜提供形状记忆,并且在该过程中不使用粘合剂。
48.第一和第二脱细胞的含有天然胶原蛋白的膜如上文对于第一种方法所述,合成的生物可吸收聚合物网状物也是如此。第二种方法,也类似于第一种方法,可以采用暴露步骤,其中将干燥的膜网状物组件暴露于上述强度和时间的紫外线辐射。由第二种方法形成的膜网状物组件也可以经过第一种方法中包括的去除和干燥步骤。在其中紫外线辐射是交联剂的第二种方法的特别的实施例中,在暴露步骤中不使用化学交联剂。
49.通过将h2o施加到第一干燥的脱细胞的含有天然胶原蛋白的膜上来进行水合步骤。
50.作为备选,可通过将上述胶原蛋白凝胶施加至第一干燥的脱细胞的含有天然胶原蛋白的膜来实现水合作用。同样,由人、牛、绵羊、马或猪心包膜制备的胶原蛋白凝胶可具有2.5mg/ml至10.0mg/ml的胶原蛋白浓度。
51.本发明包括上述两种制备多层基于胶原蛋白的膜的方法的变型,其中交联是通过除了暴露于化学交联剂、暴露于紫外线辐射或暴露于交联酶来实现的。例如,可以进行第一和第二方法中的干燥步骤,使得在膜网状物组件中的含胶原蛋白膜之间发生脱水热(dehydrothermal)交联。在某些方法中,在不暴露于紫外线辐射的情况下采用脱水热交联。
52.在没有进一步阐述的情况下,相信本领域的技术人员可以基于本文的公开,最大限度地利用本公开。因此,以下具体实施例应被解释为仅仅是描述性的,而不以任何方式限制本公开的其余部分。本文引用的所有出版物和专利文献均通过引用整体并入。
实施例
53.实施例1:制备多层基于胶原蛋白的膜的工艺
54.层组装
55.将由共聚物plga(乳酸与乙醇酸的单体比例为50:50或70:30)形成的厚度为0.22毫米(0.0085英寸)的可吸收的聚合物网状物放置在一个冻干的猪心包膜之上。将足量的反渗透去离子h2o施加到膜上,直到它变得透明。将第二冻干猪心包膜的纤维侧放置在第一水合猪心包膜的纤维侧之上,使得第二膜从第一膜吸出h2o以变得水合。将另外的h2o添加到任何未充分水合的剩余白色区域。
56.从膜的中间开始,施加压力以从两个膜中去除过量的h2o。随着过量的h2o被移除,膜牢固地吸在一起。
57.注意避免将膜过度润湿到h2o在膜周围聚集的程度。膜之间界面的完整性对成品多层基于胶原蛋白的膜的清晰度和视觉均匀性有影响。随着h2o蒸发掉,膜之间具有过量h2o
的区域可能不会完全干燥。这些区域在干燥后可能会出现白色或模糊。值得注意的是,将h2o从膜中压出时施加的压力大小会对设备的干燥厚度产生影响。
58.组装的心包层在均匀的扁平压重物下干燥。压重物包含格栅形式的孔,以允许组装的心包层快速干燥。组装好的心包层在露天干燥时有卷曲或褶皱的倾向。在压重物的格栅下干燥可使膜干燥平整,并有助于保持膜片接触。
59.还发现,分层膜将保持一定程度的干燥形状记忆。此外,发现在压重物的格栅下干燥出乎意料地优于用硅胶垫材料按压膜长达24小时的干燥,这一过程不允许心包层充分干燥,从而将植入时的生物负荷降低到可接受的水平。
60.交联
61.将干燥的组装膜置于紫外光室中进行交联。一旦多层基于胶原蛋白的膜在使用过程中与h2o接触,组装膜的交联对于防止分层至关重要。
62.将膜组件放置在距离254nm光源(即uv辐射)的75瓦灯泡光源6英寸处15分钟。然后将膜组件翻转过来并在另一侧再暴露于相同水平的紫外线辐射下15分钟。此暴露持续时间在膜表面提供大约14,000-22,000mj/cm2的功能能量。
63.不受理论的束缚,据信uv辐射穿透到膜组件的内部。翻转膜组件以使交联过程尽可能均匀。
64.应该注意的是,在处理时间少于每侧15分钟时可实现充分的交联。在上述条件下,该处理时间提供了促进交联同时使降解最小化的最大量的紫外线暴露。
65.重要的是,紫外线辐射用于交联,而不是更常见的方法,如化学和脱水热交联。紫外线辐射是有利的,因为它避免了残留化学交联剂的污染,也避免了脱水热交联中出现的变性。此外,紫外线辐射是一种控制和/或延长基于胶原蛋白的膜的再吸收时间的新方法。
66.值得注意的是,电源和交联剂交联单元之间的专用稳压110v电源可能会导致uv灯泡产生更均匀的可重复输出。这是由于调节从电网供应的电力的变化。
67.不需要的气味的去除
68.交联过程中的紫外线辐射会释放心包中的化合物,这些化合物具有强烈的令人讨厌的辛酸样气味。这些化合物是极性的,可以通过连续多次用水h2o洗涤来去除。新鲜的h2o在膜组件上运行30秒,然后将其放入装有1l h2o的托盘中并在轨道振荡器上振荡15-20分钟。膜组件再次用新鲜h2o洗涤30秒。
69.将洗涤后的膜组件放置在干净的硅酮表面上,并用足够数量的干净不锈钢大头钉钉住边缘,使得膜组件被训练(taught)并平整。让膜组件完全风干。
70.真空干燥
71.将膜组件置于真空干燥器中并在18℃,在50毫托下干燥300分钟。
72.众所周知,水分会导致plga共聚物框架的降解。此干燥步骤保留了plga框架的保质期,并最大限度地减少了设备中的h2o量,以降低生物负载。
73.模切
74.多层基于胶原蛋白的膜与略大于成品所需尺寸的心包层组装在一起。通过模切,聚合物网状物可以通过选择放置模具的位置在成品中居中。模具的切削刃应安装在清晰的表面上,以便在此过程中可以看到设备中的聚合物网状物。
75.在此阶段模切产品也使多层基于胶原蛋白的膜具有干净整洁的直边,因为原始的
心包的边缘在组装过程中无法完美对齐。
76.模切多层基于胶原蛋白的膜时,应翻转方向,使模具按与膜中任何自然卷曲相反的方向受压。这样做是为了抵消卷曲并使多层基于胶原蛋白的膜尽可能平坦。
77.消毒
78.多层基于胶原蛋白的膜通过环氧乙烷(“eo”)进行消毒。
79.由于以下原因,消毒循环应以对多层基于胶原蛋白的膜进行消毒所需的最少热量和水分进行操作。首先,来自eo循环的水分可能会留在聚合物网状物中,从而缩短保质期。其次,热会降解聚合物网状物,也会缩短保质期。第三,过多的热量会熔化,并可能使聚合物网的结构完整性变形或改变。最后,过多的水分会导致多层基于胶原蛋白的膜中的胶原蛋白起皱。
80.多层基于胶原蛋白的膜不应使用电子束进行消毒。这种性质的辐射已被证明会使聚合物网状物变脆。
81.实施例2:胶原蛋白凝胶的制备
82.猪心包通过标准技术脱细胞以制备纯化的胶原蛋白。通过低温和旋风研磨将胶原蛋白微粉化,然后在ph 2.0-3.2的柠檬酸中消化。凝胶保持冷藏以尽量减少变性。
83.为了组装多层基于胶原蛋白的膜,在使用氢氧化钠对膜进行水合之前,将胶原蛋白凝胶的ph值标准化回6.8-7.2的范围。如果需要,加入磷酸二氢钠和氯化钠。
84.其他实施方案
85.本说明书中公开的所有特征可以以任何组合方式组合。本说明书中公开的每个特征可以由服务于相同、等同或相似目的的备选特征代替。因此,除非另有明确说明,否则所公开的每个特征仅是等同或相似特征的一般系列的示例。
86.从以上描述中,本领域的技术人员可以容易地确定本发明的基本特征,并且在不脱离其精神和范围的情况下,可以对本发明进行各种改变和修改以使其适应各种用途和条件。因此,其他实施方案也在所附权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1