用于深层皮肤药物递送的组合物和方法与流程
本文所述主题总体上涉及用于对毛囊皮脂腺单位进行药物局部施用的药物组合物和给药方法。如本文所述,本发明的发明人惊讶地发现,包含活性药物成分的小颗粒的药物组合物可以靶向于毛囊皮脂腺单位。在优选的实施方案中,所述药物组合物包含shr0302或螺内酯作为活性药物成分。
背景技术:
1、经皮肤局部递送药物相比其他给药途径具有多种优势。经皮肤局部递送可用于持续将药物递送到体循环,并且避开首过代谢。相反,口服药物递送具有明显的肝脏首过效应,可导致过早的代谢药物。经皮肤局部递送同样具有相比静脉给药的优势,静脉给药必须是无菌产品,并且可因疼痛导致患者的不顺从性增加。另一方面,经皮肤递送可以是非无菌的、非侵入性的和自我进行给药。
2、传统的药物递送系统专注于经表皮的药物递送途径(andrea c.lauer等人,transfollicular drug delivery,pharmaceutical research 12:2(1995))。皮肤主要由四层组成:(a)角质层(无活性表皮),(b)活性表皮,(c)真皮和(d)皮下组织。皮肤还包含终毛和毫毛形式的附属物,终毛可延伸到皮肤表面下超过3mm并进入皮下脂肪组织,毫毛是细密的难以注意到的体毛,其延伸小于1mm并进入真皮层。被称为毛囊皮脂腺单位的结构包含毛囊、毛干和皮脂腺,皮脂腺分泌润滑的油类物质到毛囊中。虽然传统上认为角质层是药物渗透的主要途径,但是它也是经皮吸收的主要屏障。在过去,研究者们怀疑毛囊皮脂腺单位在药物递送中的重要性。
3、然而,最近对毛囊皮脂腺单位的潜在作用和透皮递送药物的可选机制进行了研究(amit verma等人,transfollicular drug delivery:current perspectives,researchand reports in transdermal drug delivery(2016年4月20日))。哺乳动物的毛囊是一个复杂的、动态的结构,其中发生独特的生化和免疫反应。虽然毛囊皮脂腺单位可作为药物递送的可接受目标,但是将药物递送到毛囊皮脂腺单位仍有一些挑战。其中一个将药物递送到毛囊皮脂腺单位的相关挑战是需要绕过厚度约10-20μm深的角质层,以及绕过厚度约80μm深的上毛细血管丛。
4、目前需要能够更深的渗透到约1000μm到2000μm深的真皮层,从而到达毛囊皮脂腺单位的药物组合物。对于经由毛囊皮脂腺单位给药的新的药物组合物和方法仍有未满足的需求。
5、发明概述
6、本发明涉及用于对毛囊皮脂腺单位局部给药的药物组合物和给药方法。本发明的发明人惊讶地发现,包含活性药物成分的小颗粒的药物组合物可被递送到毛囊皮脂腺单位,导致到达真皮层的更深渗透和改善的功效。在优选的实施方案中,所述药物组合物包含shr0302或螺内酯作为活性药物成分。
7、在本发明的某些实施方案中,提供的药物组合物包含治疗有效量的活性药物成分和硅酮,所述硅酮选自二甲基硅油、环甲基硅油以及其组合。所述活性药物成分具有特征如下的初级粒径分布(primary particle size distribution):d90值小于约20μm。在某些实施方案中,活性药物成分具有特征如下的初级粒径分布:d90值小于约10μm,或更优选小于约5μm。在某些实施方案中,组合物包含约0.10%w/w到约7.5%w/w的活性药物成分。本发明的药物组合物能够将活性药物成分递送至毛囊皮脂腺单位。在某些实施方案中,活性药物成分能够在个体中实现真皮渗透至少1mm。
8、在本发明的某些实施方案中,提供的药物组合物包含治疗有效量的shr0302或其药学上可接受的盐。shr0302可具有特征如下的初级粒径分布:d90值小于约20μm,小于约10μm,或更优选小于约5μm。shr0302可进一步具有特征如下的初级粒径分布:d50值小于约5μm,小于约1μm,或更优选小于约0.7μm。shr0302可进一步具有特征如下的初级粒径分布:d10值小于约1μm,小于约0.5μm,或更优选小于约0.25μm。
9、药物组合物还包含硅酮,所述硅酮选自二甲基硅油、环甲基硅油以及其组合。在本发明的某些实施方案中,药物组合物包含shr0302,其悬浮于二甲基硅油和环甲基硅油中的至少一种。
10、在某些实施方案中,药物组合物可包含约0.10%w/w到约5%w/w的shr0302或其盐。在优选的实施方案中,药物组合物可包含约0.1%w/w到约3%w/w的shr0302或其盐。
11、在本发明的某些实施方案中,提供了一种在有需要的个体中治疗斑秃的方法。该方法包含对个体局部施用本文所述的shr0302的药物组合物。在本发明的所述方法中,shr0302或其盐可递送到毛囊皮脂腺单位。在本文所述的方法中,施用所述药物组合物可以导致shr0302在个体中真皮渗透至少约1mm,优选到达约2-3mm的个体终毛的毛球深度。
12、在本发明的某些实施方案中,提供的药物组合物包含治疗有效量的螺内酯或其药学上可接受的盐。螺内酯可具有特征如下的初级粒径分布:d90值小于约6μm,小于约1μm,或更优选小于约0.25μm。螺内酯可进一步具有特征如下的初级粒径分布:d50值小于约2.7μm,小于约0.75μm,或更优选小于约0.15μm。螺内酯可进一步具有特征如下的初级粒径分布:d10值小于约1.2μm,小于约0.50μm,或更优选小于约0.10μm。
13、所述药物组合物还包含硅酮,所述硅酮选自二甲基硅油和环甲基硅油。在本发明的某些实施方案中,螺内酯的药物组合物是一种水包油型乳剂。
14、另外,所述药物组合物可包含约0.10%w/w到约7.5%w/w的螺内酯或其盐。在某些实施方案中,所述药物组合物可包含约0.5%w/w到约5%w/w的螺内酯或其盐。
15、在本发明的某些实施方案中,提供的药物组合物包含治疗有效量的螺内酯或其药学上可接受的盐和水。螺内酯可具有特征如下的初级粒径分布:d90值小于约6μm,小于约1μm,或更优选小于约0.25μm。螺内酯可进一步具有特征如下的初级粒径分布:d50值小于约2.7μm,小于约0.75μm,或更优选小于约0.15μm。螺内酯可进一步具有特征如下的初级粒径分布:d10值小于约1.2μm,小于约0.50μm,或更优选小于约0.10μm。
16、在某些实施方案中,药物组合物包括约0.10%w/w至约7.5%w/w的螺内酯或其盐。在某些实施方案中,药物组合物可包括约0.5%w/w至约5%w/w的螺内酯或其盐。在某些实施方案中,药物组合物是含水的混悬液。在某些实施方案中,药物组合物进一步包括磺基琥珀酸二辛酯钠和/或羟丙基纤维素。在某些实施方案中,药物组合物包括约0.01%w/w至约1%w/w的磺基琥珀酸二辛酯钠和/或约0.01%至约1.5%w/w的羟丙基纤维素。
17、在本发明的某些实施方案中,提供了一种药物组合物,其基本上由治疗有效量的螺内酯或其药学上可接受的盐、磺基琥珀酸二辛酯钠、羟丙基纤维素和水组成,或者由治疗有效量的螺内酯或其药学上可接受的盐、磺基琥珀酸二辛酯钠、羟丙基纤维素和水组成。螺内酯可具有特征如下的初级粒径分布:d90值小于约6μm,小于约1μm,或更优选小于约0.25μm。螺内酯可进一步具有特征如下的初级粒径分布:d50值小于约2.7μm,小于约0.75μm,或更优选小于约0.15μm。螺内酯可进一步具有特征如下的初级粒径分布:d10值小于约1.2μm,小于约0.50μm,或更优选小于约0.10μm。
18、在某些实施方案中,药物组合物包括约0.10%w/w至约7.5%w/w的螺内酯或其盐。在某些实施方案中,药物组合物可包括约0.5%w/w至约5%w/w的螺内酯或其盐。在某些实施方案中,药物组合物是含水的混悬液。在某些实施方案中,药物组合物包括约0.01%w/w至约1%w/w的磺基琥珀酸二辛酯钠和约0.01%至约1.5%w/w的羟丙基纤维素。
19、在某些实施方案中,药物组合物能够将螺内酯递送至患者的毛囊皮脂腺单位。在某些实施方案中,该药物组合物能够实现在患者中真皮渗透至少1mm,优选在个体中约2或3mm的深度。
20、在本发明的某些实施方案中,提供了一种在有需要的个体中治疗痤疮的方法。在某些实施方案中,个体为男性人类或女性人类。在优选的实施方案中,个体为女性人类。该方法包含对个体局部施用本文所述的螺内酯的药物组合物。在本发明的方法中,螺内酯或其盐可递送到毛囊皮脂腺单位。在本文所述的方法中,施用药物组合物可以导致螺内酯在个体中真皮渗透至少1mm,优选在个体中约2或3mm的深度。
21、附图简述
22、附图并入本文并构成公开内容的一部分,它们帮助举例说明本发明的不同实施方案,并且与说明书一起进一步用于描述本发明,从而使相关领域技术人员能够制备和使用本文所公开的实施方案。
23、图1显示在示例性的药物组合物中shr0302的粒度分布图。
24、图2显示了用于第一个供体(供体a)的0.3%shr0302局部30%dmso乳膏剂的傅里叶变换离子回旋共振-高分辨-基质辅助激光解吸电离质谱(fticr-hr-maldi)的深度曲线。
25、图3显示了用于第一个供体(供体a)的3%shr0302在二甲基硅油中的局部混悬剂的fticr-hr-maldi的深度曲线。
26、图4显示了用于第二个供体(供体b)的0.3%shr0302局部30%dmso乳膏剂的fticr-hr-maldi的深度曲线。
27、图5显示了用于第二个供体(供体b)的3%shr0302在二甲基硅油中的局部混悬剂的fticr-hr-maldi的深度曲线。
28、图6显示了5.0%的纳米研磨的螺内酯在含有0.05%磺基琥珀酸二辛酯钠(doss)和1%羟丙基纤维素的水中的混悬液中的螺内酯的粒度分布。
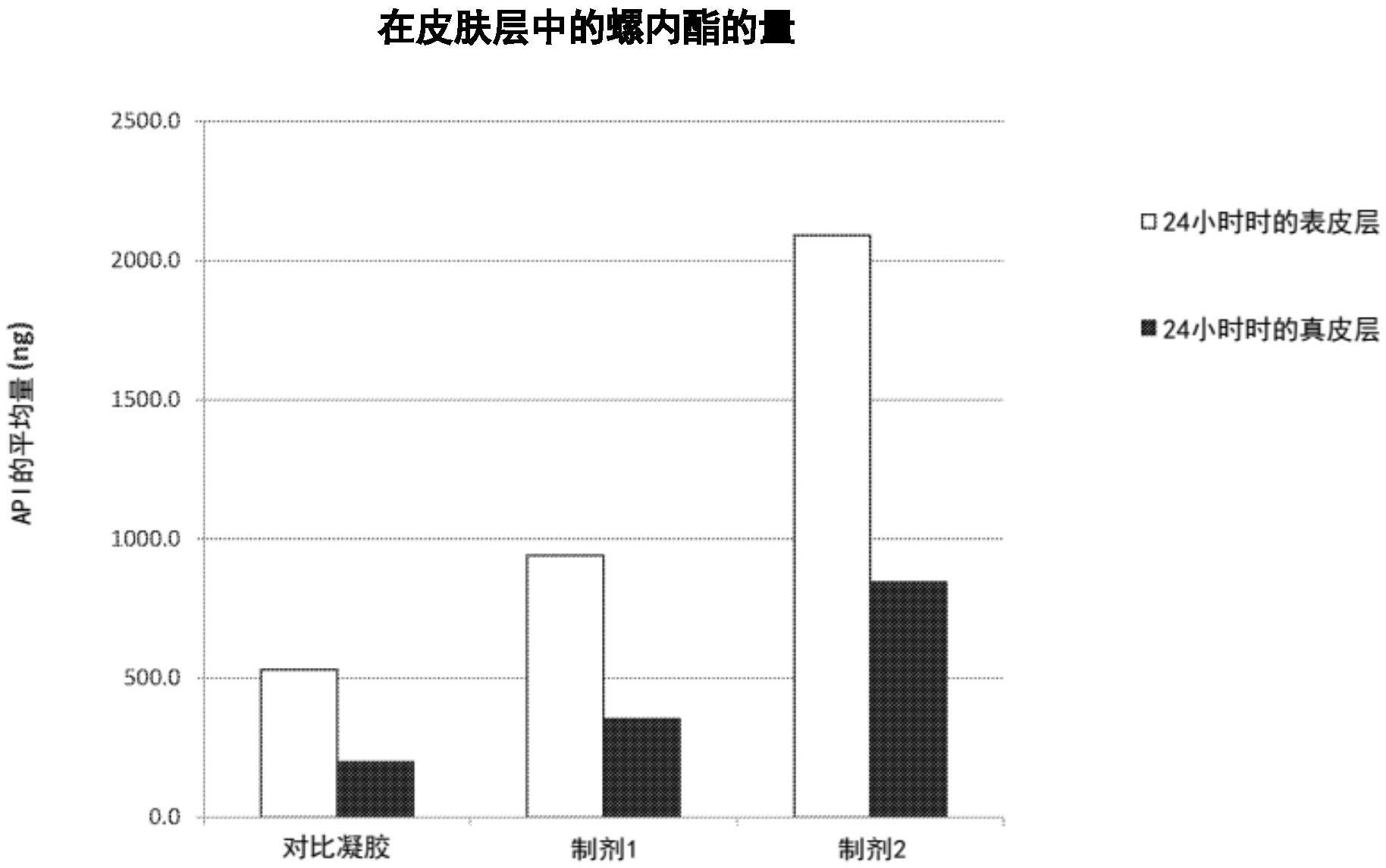
29、图7是5%的螺内酯在环甲基硅油中的混悬液在完成研磨并储存两周后拍摄的显微照片,所述螺内酯经辊磨形成d90小于约5μm的混悬液。
30、图8显示了两个示例性的制剂(实施例4所述的制剂1和制剂2)和对比的凝胶制剂(也在实施例4中描述)在单次施用5.0μl/室(10mg/cm2皮肤组织)24小时后,在接受溶液(receptor solution)中出现的螺内酯的累积量。
31、图9显示了在两个示例性的制剂(实施例4所述的制剂1和制剂2)和对比的凝胶制剂(也在实施例4中描述)施用24小时后,表皮和真皮中的螺内酯的量(ng)。
32、图10是5%的螺内酯在94.5:0.5重量比的环甲基硅油和磺基琥珀酸二辛酯钠的混合物中的混悬液在完成研磨并储存两周后拍摄的显微照片,所述螺内酯经辊磨形成d90小于约5μm的混悬液。
33、图11显示了示例性的水性混悬液制剂(制剂1)、乳剂1、乳剂2和对比的凝胶制剂(在实施例5中详细描述)在单次施用5.0μl/室(10mg/cm2皮肤组织)24小时后,在接受溶液中出现的螺内酯的累积量。
34、图12显示了示例性的水性混悬液制剂(制剂1)、乳剂1、乳剂2和对比的凝胶制剂(如实施例5所述)施用24小时后,表皮和真皮中的螺内酯的量(ng)。
35、图13显示了八个示例性制剂(s1-s7,在实施例6中描述,和制剂1,在实施例4中描述)在单次施用5.0μl/室(10mg/cm2皮肤组织)24小时后,在接受溶液中出现的螺内酯的平均量。
36、图14显示了八个示例性制剂(s1-s7,在实施例6中描述,和制剂1,在实施例4中描述)施用24小时后,表皮和真皮中的螺内酯的量(ng)。
37、发明详述
38、在进行以下对本发明的详述前,应当理解本发明不限于本文所述的特定的方法、方案和试剂,因为它们可以变化。还应当理解,本文所用术语仅用于描述具体实施方案的目的,并不意味着限定本发明的范围,本发明的范围仅由所附的权利要求书限定。除非另有定义,否则本文所用的所有技术和科学术语具有本发明所属领域的普通技术人员通常理解的相同含义。
39、除非另有说明,否则本文引用的所有出版物、专利和专利申请书以其整体通过引用并入本文。当在出版物、专利或专利申请和通过引用并入本文的本技术中定义了相同的术语时,本技术中的定义代表控制性的定义。对于为了描述特定类型的化合物、化学等而引用的出版物、专利或专利申请而言,与所述化合物、化学等相关的部分是通过引用并入本文的该文献中的部分。
40、需要注意,除非上下文另有明确规定,本文所用的单数形式“一种”、“一个”和“该”包含复数指称。因此,例如“活性成分”包括一种单一成分和两种或多种不同成分,“硫酸盐”包括一种单一硫酸盐和两种或多种不同硫酸盐。
41、术语“约”和数值连用的时候表示包含一个范围内的数值,其下限比所示数值低5%,其上限比所示数值高5%。
42、术语“有效”指化合物、试剂、物质、制剂或组合物的量,该量是足以导致疾病症状的严重程度降低、疾病无症状时期的频率和持续时间增加、或者预防因疾病折磨导致的损害或失能的量。该量可以是以单一剂量或多剂量方案,单独使用或和其他化合物、试剂或物质组合使用。本领域技术人员应该有能力根据诸如个体的体型、个体的症状严重程度和所选择的具体组合物或给药途经等因素来决定该有效量。
43、“药学上可接受的”意味着对人类或动物给药普遍安全。优选地,药学上可接受的组分是联邦或者州政府的管理机构批准的、或者记录在由位于马里兰州罗克维尔的美国药典公约公司出版的美国药典或其他公认的用于动物、更具体而言是用于人类的药典中的成分。
44、本发明的“药物组合物”可以以组合物的形式存在,其中将不同的活性成分和稀释剂和/或载体相互混合,或者可以采用组合制剂的形式,其中活性成分以部分或完全不同的形式存在。这种组合或组合制剂的一个例子是由几部分组成的药盒。
45、本文所用术语“个体”或“患者”最优选是指人类。术语“个体”或“患者”可包括任何可能受益于本文所述化合物的哺乳动物。
46、“治疗量”或“治疗有效量”指足以达成预期目的的治疗剂的量。给定治疗剂的有效量可随着活性剂的性质、给药途径、接受治疗剂的个体的体型和给药目的等因素而变化。每个个体病例的有效量可由技术人员根据本领域已确立的方法结合经验决定。
47、对于药物或组合物的给药,术语“局部”指的是在体外的上皮表面,包括皮肤或角膜施用所述药物或组合物。对于这种施用而言,在其中粘膜表皮不含毛囊皮脂腺单位的身体开口内,例如口腔、阴道或直肠处的施用,不视为局部施用。
48、如本文所用,疾病或病症的“处理”或“治疗”是指实现一个或多个以下效果:(a)减少病症的严重程度和/或持续时间;(b)限制或预防所治疗的疾病的特有症状的发展;(c)抑制所治疗疾病的特有症状的恶化;(d)限制或预防以前患有该疾病的患者的疾病复发;(e)限制或预防以前具有该疾病的症状的患者的症状复发。
49、缩略语“w/w”代表组合物中组分的相对浓度为“重量比”(即,百分比指的是占总重量的百分比),而不是基于体积或其他量。
50、本发明涉及用于对毛囊皮脂腺单位局部施用药物的药物组合物以及其给药方法。本发明的发明人惊讶地发现,包含活性药物成分小颗粒的药物组合物,可被递送至毛囊皮脂腺单位,导致更深地渗透到真皮层并提升功效。在优选的实施方案中,所述药物组合物包含shr0302或螺内酯作为活性药物成分。
51、在本发明的某些实施方案中,提供了药物组合物,其包含治疗有效量的活性药物成分和硅酮,所述硅酮选自二甲基硅油、环甲基硅油以及其组合。在某些实施方案中,活性药物成分的量的范围可以是约0.01%w/w到约10%w/w,或约0.01%w/w到约7.5%w/w,或约0.01%w/w到约5%w/w,或约0.1%w/w到约3%w/w。示例性的范围是约0.1%w/w到约10%w/w,或约0.1%w/w到约7.5%w/w,或约0.1%w/w到约5%w/w,或约0.1%w/w到约5%w/w,或约1.0%w/w到约5%w/w,或约0.3%w/w到约5.0%w/w。例如,药物组合物包含以下任何一种w/w百分比的活性药物成分:0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%等。
52、在本发明的药物组合物中,活性药物成分以小颗粒的形态存在。可以使用激光衍射方法测量药物的粒径。激光衍射得到了包括iso和astm的标准和指导机构的认可,并广泛应用于测定粒度分布。在进行测量时,使样品通过激光束,导致激光以一系列角度散射。以固定角度放置的探测器测量在该位置散射的光的强度。接下来应用数学模型获得粒度分布。本文所述粒度值是通过液体或湿法分散方法测定的。
53、在粒度测定中,中位值定义为群体的一半位于该值之上,一半位于该值之下的数值。粒度分布的中位值被称为d50。d50是将所述分布分成一半在该直径之上且一半在其下的值。分布宽度也可表征为引用x轴上一个、两个或三个值,通常是d10、d50和d90的某种组合。d50即中位值,其定义为群体的一半都低于该值的直径。类似的,分布的90%都低于d90,群体的10%低于d10。
54、在某些实施方案中,活性药物成分具有特征如下的初级粒径分布:d90值小于约20μm,小于约15μm,小于约10μm,或更优选小于约5μm。在某些实施方案中,活性药物成分具有特征如下的初级粒径分布:d90值为从约0.001μm、0.01μm或0.1μm到约5μm、10μm、15μm和20μm。活性药物成分可进一步具有特征如下的初级粒径分布:d50值小于约5μm,小于约2μm,小于约1μm,小于约0.8μm,或更优选小于约0.7μm。在某些实施方案中,活性药物成分具有特征如下的初级粒径分布:d50值为从约0.001μm、0.01μm或0.1μm到约0.7μm、0.80μm、1.0μm、2.0μm或5.0μm。活性药物成分可进一步具有特征如下的初级粒径分布:d10值小于约1μm,小于约0.5μm,小于约0.4μm,或更优选小于约0.25μm。在某些实施方案中,活性药物成分具有特征如下的初级粒径分布:d10值为从约0.0001μm、0.001μm或0.01μm到约0.25μm、0.4μm、0.5μm或1.0μm。
55、在某些实施方案中,本发明的药物组合物能够将活性药物成分递送至毛囊皮脂腺单位。在某些实施方案中,活性药物成分能够在个体中实现真皮渗透至少1mm。
56、在本发明的某些实施方案中,药物组合物包含jak1抑制剂(3ar,5s,6as)-n-(3-甲氧基-1,2,4-噻二唑-5-基)-5-(甲基(7h-吡咯并[2,3-d]嘧啶-4-基)氨基)六氢环戊二烯并[c]吡咯-2(1h)-甲酰胺,也称为shr0302或arq-250。在本文中,术语shr0302和arq-250可互相替代。shr0302的结构式为:
57、
58、shr0302是jak1的有效的小分子抑制剂,已经证明其对jak1的选择性高于jak2,因此具有在不引起与jak2抑制相关的造血系统不良反应例如贫血、血小板减少症和中性粒细胞减少症的情况下治疗炎症疾病的潜力。shr0302公开于美国专利号9,527,851,通过引用将其并入本文。
59、在本发明的某些实施方案中,药物组合物包含醛固酮激动剂17-羟基-7α-巯基-3-氧代-17α-孕甾-4-烯-21-甲酸γ-内酯乙酸酯,也称为螺内酯。螺内酯的结构为:
60、
61、螺内酯是通过竞争性地抑制醛固酮结合而作用于盐皮质激素受体水平的药物。该甾体化合物用于阻断肾远曲小管中的醛固酮依赖性的钠转运,以此减少水肿并治疗原发性高血压和原发性醛固酮过多症。口服施用螺内酯在治疗女性痤疮上同样有效。e.m.attwa等人,efficacy and safety of topical spironolactone 5%gel versus placebo in thetreatment of acne vulgaris,j.dermatol.venerol.39:89-94(2019);j.w.charny等人,spironolactone for the treatment of acne in women,a retrospective study of110patients,int.j.womens dermatol.3(2):111-115(2017)。螺内酯是市售药物,商品名为和螺内酯公开于美国专利号3,013,012,通过引用将其并入本文。
62、在本发明中,药物组合物是局部给药。药物组合物可包括以游离碱或药学上可接受的盐形式的shr0302或螺内酯。适合的药学上可接受的盐可在remington’spharmaceutical sciences,第17版,mack publishing company(1985)中找到,通过引用将其并入本文。
63、在某些实施方案中,所述药物组合物包含shr0302,其具有特征如下的初级粒径分布:d90值小于约20μm,小于约15μm,小于约10μm,或更优选小于约5μm。在某些实施方案中,shr0302具有特征如下的初级粒径分布:d90值为从约0.01μm、0.1μm或1.0μm到约5.0μm、10.0μm、15.0μm和20.0μm。
64、shr0302可进一步具有特征如下的初级粒径分布:d50值小于约5μm,小于约2μm,小于约1μm,小于约0.8μm,或更优选小于约0.7μm。在某些实施方案中,shr0302具有特征如下的初级粒径分布:d50值为从约0.001μm、0.01μm或0.1μm到约0.7μm、0.8μm、1.0μm、2.0μm或5.0μm。
65、shr0302可进一步具有特征如下的初级粒径分布:d10值小于约1μm,小于约0.5μm,小于约0.4μm,或更优选小于约0.25μm。在某些实施方案中,shr0302具有特征如下的初级粒径分布:d10值为从约0.0001μm、0.001μm或0.01μm到约0.25μm、0.4μm、0.5μm或1.0μm。
66、在某些实施方案中,包含螺内酯的药物组合物具有特征如下的初级粒径分布:d90值小于约6μm,小于约5μm,小于约2μm,小于约1μm,小于约0.5μm,小于约0.25μm,或更优选小于约0.2μm。在某些实施方案中,螺内酯具有特征如下的初级粒径分布:d90值为从约0.001μm、0.01μm或0.1μm到约0.2μm、0.25μm、0.5μm、1μm、2μm、5μm和6μm。
67、螺内酯可进一步具有特征如下的初级粒径分布:d50值小于约2.7μm,小于约2.0μm,小于约1.0μm,小于约0.75μm,小于约0.5μm,小于约0.25μm,小于约0.2μm,或更优选小于约0.15μm。在某些实施方案中,螺内酯具有特征如下的初级粒径分布:d50值为从约0.001μm、0.01μm或0.1μm到约0.15μm、0.2μm、0.25μm、0.5μm、0.75μm、1.0μm、2.0μm和2.7μm。
68、螺内酯可进一步具有特征如下的初级粒径分布:d10值小于约1.2μm,小于约1.0μm,小于约0.5μm,小于约0.25μm,小于约0.15μm,小于约0.10μm,或更优选小于约0.08μm。在某些实施方案中,螺内酯具有特征如下的初级粒径分布:d10值为从约0.0001μm、0.001μm或0.01μm到约0.10μm、0.15μm、0.25μm、0.5μm、1.0μm和1.2μm。
69、在某些实施方案中,所述药物组合物还包含硅酮,硅酮选自二甲基硅油、环甲基硅油或其组合。二甲基硅油也称为聚二甲基硅氧烷(pdms),是一种聚合的有机硅化合物。环甲基硅油是一组甲基硅氧烷,其与二甲基硅油不同,为环状的有机硅化合物。在某些实施方案中,药物组合物包含硅酮的组合,其包括二甲基硅油和环甲基硅油。例如,药物组合物包含二甲基硅油-环甲基硅油-二甲基硅油/乙烯基二甲基硅油。可以向二甲基硅油和/或环甲基硅油中添加额外的甲基硅氧烷可相容的辅料,例如环五聚二甲基硅氧烷(cyclopentasiloxane)、聚二甲基硅氧烷醇和苯基二甲基硅氧烷,以调节美观度或粘度。硅酮例如二甲基硅油和环甲基硅油具有和皮脂相似的极性,可允许药物组合物靶向毛囊递送。
70、在某些实施方案中,药物组合物是混悬液,其中活性成分(例如shr0302或螺内酯)悬浮于硅酮(例如二甲基硅油或环甲基硅油)中。在某些实施方案中,药物组合物可以配制成乳剂。例如,药物组合物可配制成如下的形式之一:
71、水包油型乳剂:该产品可以是乳剂,其包含离散相的疏水成分和连续水相,所述连续水相包括水和任选的一种或多种极性亲水赋形剂以及溶剂、共溶剂、盐、表面活性剂、乳化剂和其他成分。这些乳剂可包含帮助稳定乳剂的水溶性和水溶胀性的聚合物。
72、油包水型乳剂:该组合物可以是乳剂,其包含连续相的疏水成分和水相,所述水相包括水和任选的一种或多种极性亲水载体以及盐和其他成分。这些乳剂可包含油溶性的和油溶胀性的聚合物以及一种或多种乳化剂用于帮助稳定乳剂。
73、微乳剂:微乳剂是澄清的热力学稳定的各向同性液体体系,其包含油、水和表面活性剂,以及经常含有辅助表面活性剂。微乳剂可以是水连续的、油连续的或双连续的混合物。这些制剂中也可以任选地含有高达60%重量的水。在一些组合物中,可能适用更高的水平。
74、纳米乳:纳米乳是各向同性的分散体系,其包含水、油和乳化剂。该体系可以是分散于水体系中的油体系,或者是分散于油体系中的水体系,形成纳米尺寸的液滴或油相。纳米乳一般比微乳对亲脂性活性成分的承载能力更高。疏水性和亲水性的活性成分也可配制在纳米乳中。纳米乳可以通过任何本领域已知的合适方法制备,包括高压匀浆法、微流化法和相转变温度。
75、在某些实施方案中,药物组合物基本上由活性成分和硅酮组成,硅酮选自二甲基硅油、环甲基硅油或其组合。或者,药物组合物可使用其他成分配制,包括化妆品和药学的局部用产品中常规知晓的那些成分。
76、在某些实施方案中,所述药物组合物是混悬液,其中活性成分(例如螺内酯)悬浮在水中。在某些实施方案中,所述药物组合物包括约90%到99%w/w的水。在某些实施方案中,所述药物组合物基本上由螺内酯、磺基琥珀酸二辛酯钠、羟丙基纤维素和水组成,或由螺内酯、磺基琥珀酸二辛酯钠、羟丙基纤维素和水组成。在某些实施方案中,该药物组合物不包括额外的增稠剂或防腐剂。加入额外的药用赋形剂,如额外的增稠剂或防腐剂,可以使悬浮的螺内酯靶向毛囊皮脂腺单位的能力失活。
77、在某些实施方案中,所述药物组合物可与额外的成分一起配制,包括化妆品和药物的局部用产品中常规知晓的成分。在某些实施方案中,所述额外的成分的量不超过药物组合物的3%、2%、1%或0.5%w/w。在某些实施方案中,药物组合物进一步包括磺基琥珀酸二辛酯钠。在某些实施方案中,药物组合物进一步包括羟基丙基纤维素。在某些实施方案中,药物组合物包括约0.01%w/w到约1%w/w的磺基琥珀酸二辛酯钠和/或约0.01%到约1.5%w/w的羟丙基纤维素。
78、在某些实施方案中,药物组合物进一步包括羟丙甲基纤维素(hpmc)、聚乙烯吡咯烷酮(pvp k30)、泊洛沙姆类如泊洛沙姆407、或聚山梨酯如聚山梨酯80中的一种或多种。在某些实施方案中,药物组合物包括约0.1%到约1.5%的hpmc。在某些实施方案中,药物组合物包括约0.1%到约1.5%pvp k30。在某些实施方案中,药物组合物包括约0.1%到约1.5%的泊洛沙姆407。在某些实施方案中,药物组合物包括约0.1%至约1.5%的聚山梨酯80。在某些实施方案中,药物组合物包括药学上可接受的纤维素聚合物,例如甲基纤维素(mc)、乙基纤维素(ec)、羟乙基纤维素(hec)、羧甲基纤维素(cmc)、羧甲基纤维素钠(nacmc)或微晶纤维素。在某些实施方案中,该药物组合物包含约0.1%到约1.5%的纤维素聚合物。
79、表面活性剂
80、在某些实施方案中,药物组合物可包括一种或多种表面活性剂或辅助表面活性剂。表面活性剂包括但不限于短链醇、烷二醇和三醇、烷基磷酸酯、聚乙二醇和乙二醇醚、聚乙烯硬脂醇醚,包括那些以商品名brij s2、brij s20、brij 721、brij 38、brij 52、brij56和brij w1等销售的产品、吡咯烷衍生物、胆汁盐、失水山梨醇脂肪酸酯和聚氧乙烯失水山梨醇脂肪酸酯。在优选的实施方案中,表面活性剂是磺基琥珀酸二辛酯钠。
81、聚合物和增稠剂
82、在某些实施方案中,药物组合物可包括不溶性有机聚合物增稠剂,例如天然和合成的聚合物或无机增稠剂,如丙烯酸酯共聚物、卡波姆1382、卡波姆共聚物b型、卡波姆均聚物a型、卡波姆均聚物b型、卡波姆均聚物c型、丙烯酰胺/丙烯酰二甲基牛磺酸钠共聚物、羧基乙烯基共聚物、羧甲基纤维素、羧聚乙烯、卡拉胶、瓜尔胶、黄原胶、羟乙基纤维素、羟丙基纤维素、微晶蜡和甲基纤维素。
83、其他成分
84、在某些实施方案中,药物组合物可包括其他成分,例如通常在化妆品和药物的局部用产品中发现的载体和赋形剂。其他成分包括但不限于抗氧化剂(例如bht、bha、抗坏血酸、生育酚、柠檬酸、没食子酸丙酯、偏亚硫酸氢钠)、螯合剂、稳定剂、缓冲剂、ph调节剂(优选导致酸性ph值的试剂,包括但不限于葡糖酸内酯、柠檬酸、乳酸和α-羟基酸)、皮肤渗透促进剂、皮肤保护剂(包括但不限于矿脂、石蜡、二甲基硅油、单异硬脂酸甘油酯、异硬脂酸异丙酯、异硬脂酸异硬脂基酯、十六烷醇、鲸蜡醇磷酸酯钾、十六烷基山萮酸酯和山萮酸)、螯合剂、悬浮剂(如黄原胶)、染料、色素、稀释剂、香料和其他提高稳定性或美观的赋形剂,可被添加到组合物中。
85、给药和剂量
86、本发明包括治疗毛发损失的病症的方法,例如脱发、雄激素脱发、毛发稀少症和休止期脱发。该方法可包括通过向患者施用本文所述的shr0302或螺内酯的组合物来治疗有需要的患者中的毛发损失的病症。
87、在优选的实施方案中,本发明包括治疗斑秃(aa)的方法。aa是最普遍的自身免疫性疾病的一种,由于毛囊的免疫赦免失效和随后的自身免疫性破坏而导致毛发损失。aa是导致头皮和其它部位毛发损失的皮肤疾病。在本发明之前,局部施用jak抑制剂没有显示出可重现的临床效果。在不受理论束缚的情况下,在本发明之前jak抑制剂不能治疗aa的原因被认为是没有足够的药物递送到毛囊皮脂腺单位,更具体而言是递送到毛球。本发明的发明人惊讶地发现,本文所述药物组合物能够渗透入aa患者的毛囊中至少约1mm,至少约2mm和至少约3mm。
88、在某些实施方案中,本发明提供了治疗有需要的患者中的aa的方法,包含向患者局部施用治疗有效量的本文所述shr0302药物组合物。在某些实施方案中,活性成分shr0302可以以治疗有效量施用。在某些实施方案中,shr0302的量的范围是约0.01%w/w到约7.5%w/w,或约0.01%w/w到约5%w/w,或约0.1%w/w到约3%w/w。示例性的范围是约0.01%w/w到约5%w/w,或约0.01%w/w到约3%w/w,或约0.1%w/w到约3%w/w,或约0.3%w/w到约3.0%w/w。例如,所述局部制剂包含以下任何一种重量百分比的shr0302:0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%等。
89、本发明还提供了治疗有需要的患者中的痤疮的方法。痤疮是位于脸、胸和背部的毛囊皮脂腺单位的疾病。痤疮可以是选自以下的一种:痤疮、寻常痤疮、炎症性痤疮、非炎症性痤疮、暴发性痤疮、结节性丘疹脓疱性痤疮、聚会性痤疮、红斑痤疮、酒糟鼻、人工痤疮、成人痤疮,青春期后的持续复发性痤疮以及与其他疾病相关的痤疮。在某些实施方案中,患者是人类男性或女性患者。在优选的实施方案中,患者是人类女性。另外,患者可以是:(a)经历伴随月经周期出现的痤疮;(b)甚至在没有临床或实验室的高雄激素症体征的情况下,患有成人痤疮或青春期后的持续复发性痤疮;(c)口服避孕药并且表现出中度至重度痤疮,尤其是具有临床上的激素特征;或者(d)对常规治疗没有反应,并且不是口服异维甲酸治疗的候选者。
90、在某些实施方案中,本发明提供了治疗有需要的患者中的痤疮的方法,包含向患者局部施用治疗有效量的本文所述的螺内酯药物组合物。在某些实施方案中,活性成分螺内酯可以以治疗有效量给药。在某些实施方案中,螺内酯的量的范围是约0.01%w/w到约10%w/w,或约0.01%w/w到约7.5%w/w,或约0.01%w/w到约5%w/w,或约0.1%w/w到约3%w/w,示例性的范围是约0.1%w/w到约10%w/w,或约0.1%w/w到约7.5%w/w,或约0.1%w/w到约5%w/w,或约0.1%w/w到约3%w/w,或约1.0%w/w到约5%w/w,或约0.3%w/w到约5.0%w/w。例如,所述局部制剂包含以下任何一种重量百分比的螺内酯:0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%、1.1%、1.2%、1.3%、1.4%、1.5%、1.6%、1.7%、1.8%、1.9%、2.0%、2.1%、2.2%、2.3%、2.4%、2.5%、2.6%、2.7%、2.8%、2.9%、3.0%、3.1%、3.2%、3.3%、3.4%、3.5%、3.6%、3.7%、3.8%、3.9%、4.0%、4.1%、4.2%、4.3%、4.4%、4.5%、4.6%、4.7%、4.8%、4.9%、5.0%,5.1%、5.2%、5.3%、5.4%、5.5%、5.6%、5.7%、5.8%、5.9%、6.0%、6.1%、6.2%、6.3%、6.4%、6.5%、6.6%、6.7%、6.8%、6.9%、7.0%、7.1%、7.2%、7.3%、7.4%、7.5%等。
91、在某些实施方案中,药物组合物可以按照给药方案进行局部施用,例如以规律的间隔施用。例如,局部药物组合物可以一天一次、一天两次、一天三次、一周一次、一周两次、一周三次或一周四次施用。药物组合物可以按照规定的时间段给药。例如,局部药物组合物可以给药约两周到至少约六个月的时间,或者直到皮肤状况或疾病出现肉眼可观察的改善。示例性的治疗方案的时间段包括:两周、一个月、六周、两个月、三个月、四个月、五个月、六个月、七个月、八个月、九个月或一年。在优选的实施方案中,所述局部药物组合物每天两次或三次施用,持续至少3个月、4个月、5个月或6个月。
92、以下实施例非限制性地举例说明本发明的某些实施方案。
93、实施例
94、尽管上文已经描述了多种实施方案,但是应当理解,提供它们只是为了举例说明,并不限制本发明的范围。因此,本发明的宽度和范围不应受到任何上述的示例性实施方案限定。而且,除非本文另有说明或与上下文明显矛盾,否则本技术包含以其所有可能的变通方案形式的任何上述要素的组合。
95、对比实施例1
96、将对比实施例1制备为0.3% shr0302局部乳膏剂,其具有如表1所示的组成。
97、表1.shr0302乳膏剂的组成
98、 成分 shr0302 0.3%乳膏剂 shr0302 0.30%w/w 二甲亚砜(dmso) 30.0%w/w 丙二醇 15%w/w 聚乙二醇200 15%w/w 环甲基硅油 7.0%w/w st-弹性体10 2.0%w/w 二甲基硅油 1.0%w/w pemulen tr 1 0.8%w/w carbopol 974p 1.5%w/w edta 0.05%w/w bht 0.05%w/w 苄醇 2.0%w/w d-柠檬烯 0.1%w/w 三乙醇胺(25%溶液,以调节ph) 适量,加至ph 5.5 纯水 适量,加至100% 总计 100%
99、实施例1
100、制备包含悬浮于二甲基硅油的3% shr0302的药物组合物。组合物中所用的shr0302具有如图1所示的粒度分布。shr0302具有特征如下的初级粒径分布:d10值小于约0.25μm;d50值小于约0.7μm;d90值小于约5μm。所述药物组合物是透明溶液,因为颗粒太小而不能散射可见光。采用malvern metasizer model 3000(使用hydro mv分散单元)测定shr0302的粒度分布图。进行样品制备程序如下:称取10-20mg的scp处理的arq-250至30ml小瓶中,加入20ml乙酸乙酯,在5℃水浴中用40%功率的超声探头对混悬液进行超声处理,转移混悬液样品到malvern hydro mv分散单元中以获得5-15%的遮蔽值。仪器的参数为:(i)颗粒的折射率:1.5;(ii)分散剂折射率:1.395;(iii)吸光指数:0.01;(iv)测量持续时间:10秒;(v)测量次数:3;(vi)搅拌速度:3500rpm;(vii)超声:关闭。
101、实施例2
102、对对比实施例1和实施例1对人类尸体头皮皮肤的渗透能力进行评定。两个不同的人类尸体头皮皮肤(供体a和b)在特殊的拉伸室中进行固定。向所述头皮皮肤样品施用对比实施例1或实施例1的一个剂量(7.5μl)6小时。从皮肤上洗掉所有的制剂残留。从皮肤的真皮侧钻取8mm的活检样品,并在液氮中快速冷冻。取一系列的10μm冰冻切片,其中每隔一个切片进行苏木精和伊红染色(h&e),并保留相邻的切片用于进行傅里叶变换离子回旋共振-高分辨率-基质辅助激光解吸电离质谱(fticr-hr-maldi)。所述fticr-hr-maldi使用bruker 7t fticr-hr-maldi ms系统进行分析。
103、图2和图4分别显示了用于供体a和供体b的0.3% shr0302局部30%dmso乳膏剂的fticr-hr-maldi深度图。如图2所示,在供体a中,对比实施例1达到的最大真皮渗透少于160μm。如图4所示,在供体b中,对比实施例1达到的最大真皮渗透少于500μm。该结果与药物组合物能够跨越角质层递送药物一致,并且表明药物无法渗透到上毛细血管丛以下。
104、图3和图5分别显示了用于供体a和供体b的3% shr0302在二甲基硅油中的局部混悬液的fticr-hr-maldi的深度图。如图3和5所示,实施例1达到的最大真皮渗透大于1mm。这些结果令人惊讶地显示了该药物组合物能够将药物递送到毛球。
105、实施例3
106、将5.0%螺内酯的50mg/ml水性混悬液(其中包含0.5%磺基琥珀酸二辛酯钠和1%羟丙基纤维素)在5℃和环境光条件下存储两周后,成功地完成纳米研磨以提供药物颗粒混悬液的稳定的亚微米颗粒。螺内酯的粒度分布如图6所示。使用horiba激光散射粒度分布分析仪模型la-950来测定螺内酯基于容积的分布图。关闭循环、搅拌和超声波,设定仪器为手动重复模式。
107、制备稳定的0.3%螺内酯的水包油型乳剂,其组成如表2所示。
108、表2.螺内酯的水包油型乳剂的组成
109、 成分 螺内酯水包油型乳剂 螺内酯 0.30%w/w 环甲基硅油 10.0%w/w 对羟基苯甲酸甲酯 0.10%w/w 对羟基苯甲酸丙酯 0.01%w/w sepineo p600 4.0%w/w 纯水 适量,加至100% 总计 100%
110、实施例4
111、将5.0%-5.5%螺内酯在水中的混悬液(其包含0.05%-0.055%磺基琥珀酸二辛酯钠和1.0-1.1%羟丙基纤维素)经纳米研磨达到如图6所示的粒度分布。该成品混悬液的组成如表3的制剂1所示。将5%螺内酯在环甲基硅油中的混悬液经辊磨形成如图7所示的d90小于约5μm的混悬液(在完成研磨并储存两周后拍摄的显微照片)。该成品混悬液的组成如表3的制剂2所示。制备了文献所述的对比凝胶制剂并在表3中作为对比凝胶列出(attwaem,ibrahim am,abd el-halim mf,mahmoud hm,efficacy and safety of topicalspironolactone 5%gel versus placebo in the treatment of acne vulgaris,egyptj dermatol venerol(2019);39:89-94.)。
112、表3.两个深层真皮药物递送制剂和来自文献的对比凝胶的组成
113、
114、
115、体外皮肤渗透实验(ivpt)用于测定不同制剂穿过离体的人类皮肤的速度。从两名供体获得人类尸体皮肤(高加索女性,年龄48岁,腹部取皮,平均厚度为580μm,以及西班牙裔男性,年龄50岁,腹部取皮,平均厚度为910μm)。所取的皮肤以冷冻状态从美国组织库接收,存储于-20℃直至使用。将皮肤加载到垂直的franz室中,其具有0.503cm2(直径为8mm)扩散区域并在接受室中填充了控温在32℃的3.0ml包含0.01%硫酸庆大霉素的4%bsa水溶液。使用外置活塞式移液器,在每个franz室中施用5微升的各制剂(10mg/cm2皮肤)。使用经验证的lc-ms/ms(kinetex c18,5μm,2.1x50mm柱,shimadzu lc20adxr泵,ab sciex api4000涡轮喷雾探测器)分析接受溶液。接受溶液中测定的螺内酯的累积量是四次重复ivpt测量的平均值。
116、为了测定皮肤给药后24小时在表皮和真皮中螺内酯的水平,清除皮肤表面的任何未吸收和未渗透的螺内酯。这是通过以下方法实现:用1x pbs浸湿的q-tip擦拭组织表面3次,然后进行两次胶带剥离。将表皮(包括角质层)从真皮剥离,并浸泡于4.0ml dmso/乙腈(acn)(50/50v/v)混合液中,使用轨道摇床在室温下过夜。剩下的真皮层切成小块,在室温下使用4.0ml dmso/acn混合物用轨道摇床过夜进行提取。真皮和表皮的提取物使用经过验证的lc-ms/ms进行分析(kinetex c18,5μm,2.1x50mm柱,shimadzu lc20adxr泵,ab sciexapi 4000涡轮喷雾探测器)。
117、图8说明了在接受单次5.0μl/室(10mg/cm2皮肤组织)的制剂1、制剂2和对比凝胶后24小时在接受溶液中出现的螺内酯的累积量。在图8中,每一个标绘的点的数值是四片单独切除的人体皮肤的平均值。图9说明了在制剂1、制剂2和对比凝胶给药的24小时后,真皮和表皮中的螺内酯的量(ng)。如图8所示,与5%螺内酯的水混悬液或5%螺内酯的环甲基硅油混悬液相比,含5%溶解的螺内酯的对比凝胶递送了更多穿过离体人体皮肤的螺内酯。然而,如图9所示,两种混悬液的螺内酯在表皮(位于毛囊皮脂腺单位的漏斗位置)的沉积都显著更多。在表皮和真皮中的高水平api表明,螺内酯靶向于毛囊皮脂腺单位,并且具有来自水混悬液(d90<0.5μm,制剂1)和环甲基硅油混悬液(d90<5.0μm,制剂2)的显著更多的毛囊沉积。
118、实施例5
119、将5.0%-5.5%螺内酯在水中的混悬液(其包含0.05%-0.055%磺基琥珀酸二辛酯钠和1.0-1.1%羟丙基纤维素)经纳米研磨达到如图6所示的粒度分布。成品悬浮液的组成在表1中被列为制剂1。通过混合表1中公开的赋形剂形成乳剂,作为乳剂1。sepineotmp600是一种由seppic公司,fairfield nj分装的增稠、乳化和稳定聚合物丙烯酰胺/丙烯酰二甲基牛磺酸钠共聚物/异十六烷和聚山梨酯80。表4列出了乳剂1的最终组成,其中环甲基硅油油相是5%的螺内酯在环甲硅油中的混悬液,其经过辊磨形成d90小于约5μm的混悬液,如图7所示(在研磨完成后储存两周后拍摄的显微照片)。表4还列出了乳剂2的最终组成,其中环甲基硅油油相是5%的螺内酯在94.5:0.5重量比的环甲基硅油和磺基琥珀酸二辛酯中的混悬液,其经辊磨形成d90小于约5μm的混悬液,如图10所示(在研磨完成后储存两周后拍摄的显微照片)。制备了文献中描述的对比凝胶制剂,在表4中列为对比凝胶。(attwa em,ibrahim am,abd el-halim mf,mahmoud hm,efficacy and safety of topicalspironolactone 5%gel versus placebo in the treatment of acne vulgaris,egyptj dermatol venerol(2019);39:89-94。)
120、表4.深层真皮药物递送制剂和来自文献的对比凝胶的组成
121、
122、
123、体外皮肤渗透实验(ivpt)用于测定不同制剂穿过离体的人类皮肤的速度。从两名供体获得人类尸体皮肤(高加索女性,年龄48岁,腹部取皮,平均厚度为580μm,以及西班牙裔男性,年龄50岁,腹部取皮,平均厚度为910μm)。所取的皮肤以冷冻状态从美国组织库接收,存储于-20℃直至使用。将皮肤加载到垂直的franz室中,其具有0.503cm2(直径为8mm)扩散区域和接受室,在接受室中填充了控温在32℃的3.0ml包含0.01%硫酸庆大霉素的4%bsa水溶液。使用外置活塞式移液器,在每个franz室中施用5微升的各制剂(10mg/cm2皮肤)。使用经验证的lc-ms/ms(kinetex c18,5μm,2.1x 50mm柱,shimadzu lc20adxr泵,absciex api 4000涡轮喷雾探测器)分析接受溶液。接受溶液中测定的螺内酯的累积量是四次重复ivpt测量的平均值。
124、为了测定皮肤给药后24小时在表皮和真皮中螺内酯的水平,清除皮肤表面的任何未吸收和未渗透的螺内酯。这是通过以下方法实现:用1x pbs浸湿的q-tip擦拭组织表面3次,然后进行两次胶带剥离。将表皮(包括角质层)从真皮剥离,并浸泡于4.0ml dmso/乙腈(acn)(50/50v/v)混合液中,使用轨道摇床在室温下过夜。剩下的真皮层切成小块,在室温下使用4.0ml dmso/acn混合物用轨道摇床过夜进行提取。真皮和表皮的提取物使用经过验证的lc-ms/ms进行分析(kinetex c18,5μm,2.1x 50mm柱,shimadzu lc20adxr泵,ab sciexapi 4000涡轮喷雾探测器)。
125、图11说明了在接受单次5.0μl/室(10mg/cm2皮肤组织)的制剂1、乳剂1、乳剂2和对比凝胶后24小时在接受溶液中出现的螺内酯的累积量。在图11中,每一个标绘的点的数值是四片单独的切除的人体皮肤的平均值。图12说明了在制剂1、乳剂1、乳剂2和对比凝胶给药的24小时后,真皮和表皮中的螺内酯的量(ng)。如图12所示,与5%螺内酯的水混悬液或另外两种乳剂制剂相比,含5%的溶解的螺内酯的对比凝胶递送了更多穿过离体人体皮肤的螺内酯。然而,由图12可见,与具有溶解的螺内酯的对比凝胶或具有悬浮的螺内酯的亚微米颗粒的硅油乳剂相比,水混悬液的螺内酯在表皮(位于毛囊皮脂腺单位的漏斗位置)中的沉积显著更多。在表皮和真皮中的高水平api表明,螺内酯靶向于毛囊皮脂腺单位,并且具有来自水混悬液(d90<0.5μm,制剂1)的显著更多的毛囊沉积。
126、实施例6
127、将5.0%-5.5%螺内酯在水中的混悬液(其包含0.05%-0.055%磺基琥珀酸二辛酯钠和1.0-1.1%羟丙基纤维素)经纳米研磨达到如图6所示的粒度分布。向该水混悬液中加入不同的防腐剂、增稠剂和乙醇,如表5所示。制备了如表5所述的七种不同的制剂(s1-s7)。
128、表5.对比的螺内酯(s)水混悬液制剂的组成
129、
130、
131、体外皮肤渗透实验(ivpt)用于测定不同制剂穿过离体的人类皮肤的速度。从两名供体获得人类尸体皮肤(高加索女性,年龄44岁,腹部取皮,平均厚度为710μm,以及高加索女性,年龄48岁,腹部取皮,平均厚度为578μm)。所取的皮肤以冷冻状态从美国组织库接收,存储于-20℃直至使用。将皮肤加载到垂直的franz室中,其具有0.503cm2(直径为8mm)扩散区域和接受室,该接受室中填充了控温在32℃的3.0ml包含0.01%硫酸庆大霉素的4%bsa水溶液。使用外置活塞式移液器,在每个franz室中施用5微升的各制剂(10mg/cm2皮肤)。使用经验证的lc-ms/ms(kinetex c18,5μm,2.1x 50mm柱,shimadzu lc20adxr泵,ab sciexapi 4000涡轮喷雾探测器)分析接受溶液。接受溶液中测定的螺内酯的累积量是四次重复ivpt测量的平均值。
132、为了测定皮肤给药后24小时在表皮和真皮中保留的螺内酯的水平,清除皮肤表面的任何未吸收和未渗透的螺内酯。这是通过以下方法实现:用1x pbs浸湿的q-tip擦拭组织表面3次,然后进行两次胶带剥离。将表皮(包括角质层)从真皮剥离,并浸泡于4.0ml dmso/乙腈(acn)(50/50v/v)混合液中,使用轨道摇床在室温下过夜。剩下的真皮层切成小块,在室温下使用4.0ml dmso/acn混合物用轨道摇床过夜进行提取。真皮和表皮的提取物使用经过验证的lc-ms/ms进行分析(kinetex c18,5μm,2.1x 50mm柱,shimadzu lc20adxr泵,absciex api 4000涡轮喷雾探测器)。
133、图13说明了在接受单次5.0μl/室(10mg/cm2皮肤组织)的s1-s7和制剂1(如实施例4所述)后24小时在接受溶液中出现的螺内酯的平均量。在图13中,每一个标绘的点的数值是四片单独的切除的人体皮肤的平均值。图14说明了在s1-s7和制剂1(如实施例4所述)给药的24小时后,真皮和表皮中的螺内酯的量(ng)。图14显示,与具有如图6中所示的相同粒度分布的其他7种制剂(s1-s7)相比,在局部施用水混悬液(制剂1)后,螺内酯在表皮和真皮中的沉积都显著更多。该数据表明,即使是添加防腐剂或胶凝剂的微小修改,也使得悬浮的螺内酯靶向毛囊皮脂腺单位的能力失活。
134、提供以上说明书是用于举例说明和描述的目的。本说明书并不意图将本发明限制到所公开的精确形式。本领域普通技术人员应当理解,可以对基本的发明描述进行修改和替代。
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!