基于酪氨酸的抗体缀合物的制作方法
本发明涉及抗体-药物缀合物领域,特别是通过酪氨酸酶介导的生物缀合制备的抗体-药物缀合物,其适用于治疗癌症。
背景技术:
1、抗体-药物缀合物(adc),被认为是治疗中的灵丹妙药,由其中连接有药物试剂的抗体组成。抗体(也称为配体)通常是单克隆抗体(mab),基于它们对给定抗原的高选择性和亲和力、它们的长循环半衰期以及很少或没有免疫原性来选择这些单克隆抗体。因此,mab作为精心选择的生物受体的蛋白质配体,为医疗药物的选择性靶向提供了理想的递送平台。例如,已知与特定癌症相关抗原选择性结合的单克隆抗体可用于通过结合、内化、细胞内加工和最终释放活性分解代谢物将化学缀合的有效负载递送至肿瘤。有效负载可以是小分子毒素、蛋白质毒素或其他形式,如寡核苷酸。因此,可以选择性地根除肿瘤细胞,同时保留未被抗体靶向的正常细胞。类似地,抗菌药物(抗生素)与抗体的化学缀合可用于治疗细菌感染,而抗炎药物的缀合物正在研究用于治疗自身免疫性疾病。最后,寡核苷酸与被肌肉细胞选择性吸收的抗体的连接是治疗神经肌肉疾病的潜在的有前途的方法。因此,将活性医疗药物靶向递送至所选的特定细胞位置的概念是治疗多种疾病的有力方法,与相同药物的全身递送相比,具有许多有益方面。
2、在adc领域,通常使用化学连接体将医疗药物连接到抗体上。这种连接体需要具有许多关键属性,包括在给药后长时间在血浆中保持稳定的要求。稳定的连接体能够使adc定位于体内的预计部位或细胞,并防止循环中有效负载的过早释放,这将不加选择地诱导各种不希望的生物反应,从而降低adc的治疗指数。在内化时,应该处理adc,使得有效负载被有效地释放,从而它可以结合到其靶点。
3、有两类连接体,不可裂解的和可裂解的。不可裂解的连接体由抗体和有效负载之间的原子链组成,不管抗体-药物缀合物位于哪个器官或生物区室中,其在生理条件下完全稳定。因此,从具有不可裂解的连接体的adc中释放有效负载依赖于adc内化进入细胞后抗体的完全(溶酶体)降解。由于这种降解,将释放有效负载,其仍然带有连接体,以及来自连接体最初连接的抗体的肽片段和/或氨基酸。可裂解的连接体利用细胞或细胞区室的固有特性从adc中选择性释放有效负载,这通常在代谢处理后不会留下连接体的痕迹。对于可裂解的连接体,有三种常用的机制:1)对特定酶的敏感性,2)ph敏感性,和3)对细胞氧化还原状态(或其微环境)的敏感性。可裂解的连接体也可以含有自牺牲(self-immolative)单元,例如基于对氨基苯甲醇基团及其衍生物。连接体还可以含有额外的非功能性元件,通常称为间隔基或延伸子单元,以将连接体与反应性基团连接,从而与抗体反应。
4、目前,细胞毒性有效负载包括例如微管破坏剂[例如澳瑞他汀(auristatin)如单甲基澳瑞他汀e(mmae)和单甲基澳瑞他汀f(mmaf),美登木素生物碱(maytansinoid),如dm1和dm4,微管溶素(tubulysin)],dna损伤剂[例如卡奇霉素(calicheamicin)、吡咯并苯并二氮杂卓(pbd)二聚体、吲哚并苯并二氮杂卓二聚体、倍癌霉素(duocarmycin)、蒽环霉素(anthracyclin)],拓扑异构酶抑制剂[例如dxd、sn-38]或rna聚合酶ii抑制剂[例如鹅膏蕈碱]。已经获得市场批准的adc包括例如有效负载mmae、mmaf、dm1、卡奇霉素、sn-38和dxd,而基于倍癌霉素、dm4和pbd二聚体的adc正在进行各种关键试验。更多种类的有效负载仍在临床评估中,或在过去已处于临床试验中,例如艾瑞布林(eribulin)、吲哚并苯并二氮杂卓二聚体、pnu-159,682、hemi-asterlin、阿霉素、长春花生物碱等。最后,各种处于后期临床前阶段的adc与新的有效负载例如鹅膏蕈碱、ksp抑制剂、mmad等缀合。
5、除了sacituzumab govetican之外,所有临床和上市的adc都含有不适合作为独立药物的细胞毒性药物。是一个例外,因为它以sn-38为细胞毒性有效负载,它也是依立替康(sn-38前药)的活性分解代谢物。目前临床adc中使用的其他几种有效负载已作为游离药物进行了初步化疗评估,例如卡奇霉素、pbd二聚体和艾瑞布林。但是因为细胞毒素的极高效力(皮摩尔-低纳摩尔ic50值)相比于标准化疗药物如紫杉醇和阿霉素的典型低微摩尔效力,所以失败了。
6、尽管adc已经显示了临床和临床前活性,但是除了靶向肿瘤细胞上的抗原表达之外,还不清楚是什么因素决定了这种潜能。例如,药物:抗体比(dar)、adc结合亲和力、有效负载的效力、受体表达水平、内化率、运输、多种药物抗性(mdr)状态和其他因素都会影响体外adc治疗的结果。除了直接杀死抗原阳性肿瘤细胞之外,adc还具有杀死邻近的抗原阴性肿瘤细胞的能力:所谓的“旁观者效应(bystander killing)”效应,最初由sahin et al,cancer res.1990,50,6944–6948报告,其通过引用纳入,并且例如由li et al,cancerres.2016,76,2710–2719所研究的,其通过引用纳入。一般来说,中性的细胞毒性有效负载将显示旁观者效应,而离子(带电)有效负载则不会,这是因为离子形式不容易通过被动扩散穿过细胞膜。具有确定的旁观者效应的有效负载例如是mmae和dxd。不显示旁观者效应的有效负载的实例是mmaf或kadcyla的活性分解代谢物(赖氨酸-mcc-dm1)。
7、adc通过反应性连接体-药物与蛋白质的化学连接来制备,这一过程称为生物缀合。许多生物缀合技术是已知的,如g.t.hermanson,“bioconjugate techniques”,elsevier,3rd ed.2013中所概述的,其通过引用纳入。对于抗体的随机缀合,有两种公认的主要技术,一种基于赖氨酸侧链的酰化,一种基于半胱氨酸侧链的烷基化。赖氨酸侧链中ε-氨基的酰化通常通过将蛋白质置于基于活化的酯或活化的碳酸酯衍生物的试剂中来实现,例如smcc用于的制备。半胱氨酸侧链中巯基的烷基化的主要化学反应基于使用马来酰亚胺试剂,例如在中应用的。除了标准的马来酰亚胺衍生物,一系列马来酰亚胺变体也用于更稳定的半胱氨酸缀合,例如由james christie et al.,j.contr.rel.2015,220,660–670和lyon et al.,nat.biotechnol.2014,32,1059–1062所证明的,两者都通过引用纳入。半胱氨酸烷基化的其他方法包括例如卤代乙酰胺(通常是溴代乙酰胺或碘代乙酰胺)的亲核取代,参见例如alley et al.,bioconj.chem.2008,19,759–765,其通过引用纳入,或者基于不饱和键上的亲核加成的各种方法,例如与丙烯酸酯试剂的反应,参见例如bernardim et al.,nat.commun.2016,7,doi:10.1038/ncomms13128和ariyasu et al.,bioconj.chem.2017,28,897–902,两者均通过引用纳入;与烷基磷酰胺的反应,参见例如kasper et al.,angew.chem.int.ed.2019,58,11625–11630,其通过引用纳入;与联烯酰胺的反应,参见例如abbas et al.,angew.chem.int.ed.2014,53,7491–7494,其通过引用纳入;与氰基乙炔基试剂的反应,参见例如kolodych et al.,bioconj.chem.2015,26,197–200,其通过引用纳入;与乙烯基砜的反应,参见例如gil demontes et al.,chem.sci.2019,10,4515–4522,其通过引用纳入;或与乙烯基吡啶的反应,参见例如https://iksuda.com/science/permalink/(2020年1月7日获取)。通过半胱氨酸的抗体缀合的另一种方法包括加入与半胱氨酸交联剂如双砜试剂连接的有效负载,参见例如balan et al.,bioconj.chem.2007,18,61–76和bryant et al.,mol.pharmaceutics2015,12,1872–1879,两者均通过引用纳入;单-或双-溴马来酰亚胺,参见例如smith etal.,j.am.chem.soc.2010,132,1960–1965和schumacher et al.,org.biomol.chem.2014,37,7261–7269,两者均通过引用纳入;双马来酰亚胺试剂,参见例如wo2014114207;双(苯硫基)马来酰亚胺,参见例如schumacher et al.,org.biomol.chem.2014,37,7261–7269和aubrey et al.,bioconj.chem.2018,29,3516–3521,两者均通过引用纳入;双溴哒嗪二酮,参见例如robinson et al.,rsc advances 2017,7,9073–9077,其通过引用纳入;双(卤甲基)苯,参见例如ramos-tomillero et al.,bioconj.chem.2018,29,1199–1208,其通过引用纳入;或其他双(卤甲基)芳族烃,参见例如wo2013173391。通常,通过半胱氨酸交联制备的adc的药物与抗体负载量为约4(dar4)。与半胱氨酸侧链缀合的另一种有用的技术是通过二硫键,已被用于可逆地将蛋白毒素、化疗药物和探针连接到载体分子上的生物活性连接(参见例如pillow et al.,chem.sci.2017,8,366–370,其通过引用纳入)。
8、将连接体药物与叠氮基修饰的蛋白质连接的一种常用方法是应变促进的炔烃-叠氮化物环加成(spaac)。在spaac反应中,连接体-药物用环炔烃官能化,并且与叠氮基修饰的抗体的环加成由环间张力的释放驱动。相反,连接体-药物用叠氮化物官能化,抗体用环炔烃官能化。适用于无金属点击化学的各种应变炔烃如图1所示。除了环辛炔之外,某些环庚炔也适用于无金属点击化学,如weterings et al.,chem.sci.2020,doi:10.1039/d0sc03477k中所报告的,其通过引用纳入。也可以使用较小的应变炔烃,但是在大多数情况下,由于固有的不稳定性,需要原位产生应变炔烃。
9、应变炔烃与四嗪的反应也是无金属点击反应。此外,四嗪也与应变烯烃反应(四嗪连接)。应变炔烃和应变烯烃均通过反电子需求diels-alder(iedda)反应与四嗪发生反应,表现出非常快的反应动力学。例如,反式环辛烯(tco)与四嗪的反应在其反应速度上是无与伦比的,并且这种快速反应已经能够应用于啮齿动物模型和其他大型生物,在这些环境中仅容许最小的反应时间和试剂浓度。三嗪和其他杂芳族部分也可以与应变炔烃或烯烃反应。值得注意的是,应变烯烃通常不与叠氮化物反应。适用于无金属点击化学的各种应变烯烃如图2所示。
10、除了叠氮化物之外,应变炔烃还可以与一系列其他官能团反应,例如腈氧化物、硝酮、邻醌、二氧噻吩和悉尼酮。图3提供了无金属点击化学的官能团对f和q(=应变炔烃或应变烯烃)对的列表。nguyen and prescher,nature rev.2020,doi:10.1038/s41570-020-0205-0提供了用于生物缀合的无金属点击化学的综合概述,也延伸到蛋白质(例如,聚糖、核酸)之外,其通过引用纳入。
11、基于以上所述,制备蛋白质缀合物,例如图4中的单克隆抗体的一般方法,需要使含有x个反应性部分f的蛋白与含有单个分子q的连接体-药物构建体反应。
12、将叠氮化物或四嗪部分引入蛋白质可以通过基因编码、酶安装或化学酰化来实现。一种方法是基于非天然氨基酸的遗传编码,例如适用于肟连接的对乙酰苯丙氨酸,或适用于点击化学缀合的对叠氮基甲基苯丙氨酸或对叠氮基苯丙氨酸,如axup etal.proc.nat.acad.sci.2012,109,16101–16106所证明的,其通过引用纳入。类似地,zimmerman et al.,bioconj.chem.2014,25,351–361,其通过引用纳入,已采用无细胞蛋白质合成方法将叠氮基甲基苯丙氨酸(azphe)引入单克隆抗体中,通过无金属点击化学转化为adc。此外,nairn et al.,bioconj.chem.2012,23,2087–2097,其通过引用纳入,也显示了甲硫氨酸类似物如叠氮基高丙氨酸(aha)可通过营养缺陷型细菌引入蛋白质中,并通过(铜催化的)点击化学进一步转化为蛋白质缀合物。最后,nguyen et al.,j.am.chem.soc.2009,131,8720–8721,其通过引用纳入,显示了使用吡咯赖氨酰-trna合成酶/trnacua对遗传编码重组蛋白中的脂肪族叠氮化物,标签由点击化学固定。
13、另一种方法是基于非天然功能的酶促安装。例如dennler at al.,bioconj.chem.2014,25,569–578和lhospice et al.,mol.pharmaceut.2015,12,1863–1871,两者均通过引用纳入,使用细菌酶转谷氨酰胺酶(btg或tgase)将叠氮化物部分安装到抗体上。为此,tgase介导的安装的关键谷氨酰胺残基首先通过pngase f介导的天然n-聚糖的去除而被释放,如jeger et al.,angew.chem.int.ed.2010,49,9995–9997中首次证明的,其通过引用纳入。cheng et al.,mol.cancer therap.2018,17,2665–2675报告了一种基于c-末端tgase介导的叠氮化物引入,然后在adc中用无金属点击化学进行转化的遗传方法,其通过引用纳入。
14、van geel et al.,bioconj.chem.2015,26,2233–2242和verkade et al.,antibodies 2018,7,12,其均通过引用纳入,已证明天然抗体聚糖在n297的酶促改造也能够通过叠氮糖将叠氮化物引入抗体,适合于使用点击化学连接细胞毒性有效负载。还开发了化学方法用于抗体的位点特异性修饰,而无需预先的遗传修饰,例如yamada and ito,chembiochem.2019,20,2729–2737中所强调的。
15、在图3中的官能部分f中,叠氮化物和硝酮也可以通过化学修饰安装到天然蛋白质上。然后,所得含叠氮化物或硝酮的蛋白质可以与合适的探针q进行无金属点击缀合,在简单的两步法中提供所得蛋白质缀合物。例如,用重氮转移试剂处理天然蛋白质导致游离氨基向叠氮基团的化学转化,如schoffelen et al.,chem.sci.2011,2,701–705所报告的,其通过引用纳入。此外,在某些情况下小心滴定ph会导致具有最低pka的胺(通常是模型蛋白质n-末端的胺)的选择性转化。基于应变促进的官能化的环烷烃的环加成,对所得叠氮化物进行修饰。此外,ning et al.,angew.chem.int.ed.2010,49,3065–3068,其通过引用纳入,证明了通过高碘酸盐介导的n-末端丝氨酸或苏氨酸的氧化,接着用过量的n-烷基羟胺处理,可以在天然多肽上产生n-末端硝酮。得到的硝酮显示出与应变炔烃进行快速原位环加成。
16、在表3中的官能部分f中,邻醌可以通过酪氨酸侧链的氧化从天然蛋白质中直接产生,如bruins et al.,chem.eur.j.2017,24,4749–4756中所述的,其通过引用纳入。与叠氮化物或硝酮相比,产生邻醌的一个主要优点是,邻醌能够进行原位后续化学反应,在一步法中产生蛋白质缀合物,而无需分离醌中间体。例如,wilchek and miron,bioconj.chem.2015,26,502,其通过引用纳入,报告了酪氨酸中的酚基团直接化学转化为邻醌可以通过用亚硝基二磺酸钾(ptn,也称为fremy盐)处理并将其用于蛋白质聚合来实现。类似地,george et al.,chemistryselect 2017,2,7117–7112,其通过引用纳入,表明通过用fremy盐生成邻醌,然后与双环壬炔(bcn)原位反应,应变促进的氧化控制的环辛炔-1,2-醌环加成(spocq)可用于蛋白质修饰,如图5中突出显示的。然而,使用强氧化剂如fremy盐可导致半胱氨酸和甲硫氨酸侧链的间接氧化,在反应后需要从蛋白质溶液中除去氧化剂。此外,多个酪氨酸部分可以氧化成邻醌,从而导致蛋白质缀合物的异质混合物。
17、避开化学氧化剂的一个很好的解决方案是使用酶来产生邻醌。几十年来,已知酪氨酸酶和酚氧化酶介导的邻醌的产生通过非选择性酪氨酸-酪氨酸、酪氨酸-半胱氨酸和酪氨酸-赖氨酸键介导肉、乳清和面粉中蛋白质之间的交联。通过在合适的外部亲核试剂的存在下进行酶介导的邻醌的产生,氧化的蛋白质将容易进行化学缀合,例如struck et al.,j.am.chem.soc.2016,138,3038–3045所证明的。蛋白质的酶促氧化的缺点是大多数或所有的酪氨酸部分通常被包埋在蛋白质的疏水内部,因此对于像酪氨酸酶这样的大体积酶来说是不可接近的。另一方面,缺乏用于氧化的天然酪氨酸为通过引入具有暴露酪氨酸的n-末端或c-末端融合标签的选择性外周蛋白氧化铺平了道路。例如,bruins et al.,bioconj.chem.2017,28,1189–1193,其通过引用纳入,表明了通过将c-末端g4y-标签融合到葡聚糖酶上,可以在spocq上选择性地荧光团修饰laminarase a,一种超稳定的内-β-1,3-葡聚糖酶,而融合到曲妥珠单抗轻链上的相同c-末端g4y-标签能够在与bcn-连接体-mmae反应时产生位点特异性抗体-药物缀合物。bruins et al.,chem.commun.2018,54,7338–7341,其通过引用纳入,证明了抗体-药物缀合物可以通过c-末端邻醌与基于构象应变的反式环辛烯(stco)的连接体-澳瑞他汀构建体的反应产生。marmelstein et al.,j.am.chem.soc.2020,142,5078–5086,其通过引用纳入,最近报告了一种类似的方法,表明曲妥珠单抗单链上的c-末端ggy标签能够实现各种标签的选择性酪氨酸酶介导的偶联。
18、在上述所有情况下,官能团f的引入需要蛋白质的遗传修饰(非天然氨基酸的遗传编码,特异性融合标签的引入)或两步法,其中官能团f首先通过化学或酶法引入。然而,目前不存在基于通过无金属点击化学修饰天然氨基酸侧链的天然蛋白质一步修饰的通用方法。
技术实现思路
1、本发明人惊奇地发现,天然n-糖蛋白对氧化酶如酪氨酸酶或(多)酚氧化酶不敏感,然而,如果天然n-聚糖被修饰,例如(a)被去除,例如通过pngase f水解,或(b)被修饰,例如通过内切糖苷酶,或(c)突变为另一种氨基酸,糖蛋白附近的酪氨酸残基变得暴露,并对氧化酶敏感,导致邻醌的形成(图6)。通过在(官能化的)应变炔烃或烯烃(图7中的示例性结构)的存在下进行酶促氧化,所得邻醌可以与应变炔烃或应变烯烃进行原位[4+2]环加成,从而在一锅法中形成糖蛋白缀合物。
2、本发明首先涉及具有结构(1a)或(1b)的缀合物:
3、
4、其中:
5、-pr是n-糖蛋白;
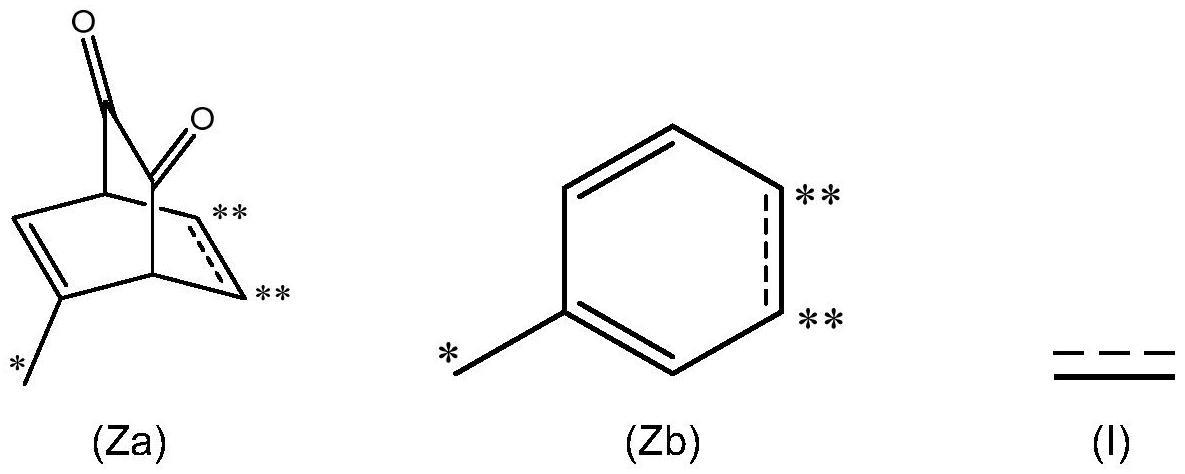
6、-z1包含结构(za)或(zb):
7、
8、其中用*标记的碳在位于n-糖基化位点的10个氨基酸内的氨基酸处直接连接到抗体的肽链,所述n-糖基化位点已经被修饰,使得糖蛋白在氨基酸残基的10个氨基酸内不含长于两个单糖残基的聚糖,并且用**标记的两个碳原子都连接到l,并且描绘为的键是单键或双键;
9、-l是连接体;
10、-x是1-4范围内的整数;
11、-y是1-4范围内的整数;
12、-q2是对适当官能化的有效负载具有反应性的化学柄;
13、-d是有效负载。
14、本发明还涉及用于合成根据本发明的缀合物的方法、根据本发明的缀合物的医疗用途以及包含根据本发明的缀合物的药物组合物。
- 还没有人留言评论。精彩留言会获得点赞!